龚卫华1,2,马 玥1,吕 霞1,叶发银1,赵国华1,3,*
(1.西南大学食品学院,重庆 400715;2.吉首大学师范学院,湖南 吉首 416000;3.重庆市特色食品工程技术研究中心,重庆 400715)
摘 要:以葵花籽壳为原料,采用醋酸法提取木质素,并利用凝胶渗透色谱、紫外光谱、傅里叶变换红外光谱、核磁共振氢谱和热重分析对提取的木质素进行结构表征,并对提取木质素的抗氧化活性进行评价。结果表明:醋酸法木质素提取率为70.12%(相对于Klason木质素),纯度达到88.54%,结合少量的碳水化合物(2.92%)。葵花籽壳木质素为GS型木质素,含有较高的愈创木基结构单元(G),结构单元之间的连接键以β-O-4结构为主,重均分子质量(Mw)、数均分子质量(Mn)和多分散度(Mw/Mn)分别为2 977 、1 931 D和1.54。葵花籽壳醋酸提取的木质素主要降解温度在200~400 ℃之间,最大失质量速率为0.32%/℃。抗氧化活性研究表明,木质素清除1,1-二苯基-2-三硝基苯肼自由基指数值为1.54,显著高于商业合成抗氧化剂二丁基羟基甲苯(0.94),具有很好地应用于食品及其他工业做抗氧化剂的前景。
关键词:葵花籽壳;醋酸法;木质素;结构分析;抗氧化活性
木质素由苯丙烷类结构单元组成,分子结构中存在酚羟基、醇羟基、羰基、甲氧基、羧基和共轭双键等活性基团[1-3]。近年来,木质素的生物活性受到越来越多的关注,Li Mingfei等[2]研究了从竹材中提取木质素的抗氧化活性,发现木质素的抗氧化活性要强于人工合成的抗氧化剂二丁基羟基甲苯(butylated hydroxytoluene,BHT),且还有研究表明木质素对皮肤和眼睛无害[4],具有应用于化妆品和食品行业做抗氧化剂的潜力。Rodríguez-Gutiérrez等[5]研究发现木质素对胆汁酸具有很强的吸附能力;Mitjans等[6]还研究发现木质素具有抗癌变、抗菌、抗诱变等生物活性,尤其是抗氧化活性方面。木质素的提取主要有无机溶剂提取法和有机溶剂提取法,无机溶剂提取法主要包括:硫酸法、硫酸盐法、烧碱法等[7],这些方法条件比较激烈,如采用高温、强酸强碱,因此提取的木质素结构改变比较大,不利于进一步应用。有机溶剂溶解提取木质素,如:甲醇、乙醇、甲酸、醋酸等溶剂[8-11]提取。有机溶剂提取的木质素结构改变较少,其中醋酸法提取木质素具有可在常压下进行,对设备要求低,醋酸溶液易挥发可回收利用等特点,可有效降低提取成本,且提取的木质素有较低分子质量和较高反应活性[12-13],被广泛应用于木质素提取研究。目前对葵花籽壳木质素的研究国内外鲜见报道。
葵花籽壳是许多粮油厂、食品厂加工副产品,年产量大约70万 t。目前对其综合利用主要是制备纳米纤维素,提取天然色素、花色苷及黄酮类等生物活性物质[14-16],但利用率较低,大多数丢弃于环境中。前期的研究表明,葵花籽壳中的木质素含量很高,因此以葵花籽壳为原料提取木质素,对木质素的结构进行解析,为葵花籽壳木质素的进一步的应用提供结构基础,并评价其抗氧化活性,对提高葵花籽壳高附加值的应用具有实际意义。
1.1 材料与试剂
葵花子壳 重庆市北碚区农贸市场。
1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl radical,DPPH)、二丁基羟基甲苯(分析纯)上海阿拉丁试剂有限公司;单糖标准品 美国Sigma公司。
1.2 仪器与设备
IP-500B高速多功能粉碎机 永康市久品工贸有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;LGJ-10冷冻干燥机 北京松源华兴科技发展有限公司;722可见光分光光度计 北京金科利达电子科技有限公司;L535-1低速离心机 长沙湘仪离心机仪器有限公司;K-360全自动凯氏定氮仪 瑞士Büchi公司;Perkin-Elmer 2000傅里叶红外光谱仪 美国铂金埃尔默股份公司;LC-20A高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司;400M超导核磁共振(nuclear magnetic resonance,NMR)仪德国布鲁克公司;TGA/DSC 1 SF/1382同步热分析仪瑞士梅特勒公司。
1.3 方法
1.3.1 原料的预处理
将葵花籽壳用蒸馏水洗干净,烘箱中以60 ℃烘干,粉碎,过筛,得40~60 目样品。然后经甲苯/乙醇(2∶1,V/V)溶液置于索式抽提器中抽提6 h,60 ℃烘干12 h,得实验样品,备用。
1.3.2 木质素的提取[12]
称取一定量经预处理样品,加入质量分数为90%的醋酸,固液比为1∶15(m/V),添加4% HCl作为催化剂,在114 ℃条件下(磁力搅拌),油浴120 min,冷却后过滤,滤渣用同质量分数的醋酸冲洗两次,并用纯水冲至中性,60 ℃条件下减压浓缩,加入10 倍体积的纯水沉淀,离心分离,用pH 2(HCl 调节)的酸水冲洗3 次,冷冻干燥,所得产品为葵花籽壳木质素。式(1)为提取率计算公式。
1.3.3 葵花籽壳及木质素基本成分的测定
纤维素、半纤维、木质素的含量:按美国国家可再生能源实验室方法测定[17];首先,准确称取300 mg样品,加入3.0 mL浓硫酸(72%)在30 ℃条件下水解1 h。然后,用超纯水稀释硫酸至4%,高压反应釜中121 ℃条件下继续水解1 h。水解结束后,自然冷却水解液,用事先恒质量的砂芯漏斗过滤,通过称取滤渣的质量计算出酸不溶性(Klason)木质素的含量。滤液稀释2 倍,用HPLC分析滤液中糖含量,换算出纤维素和半纤维含量。测定条件为:色谱分离柱:Aminex HPX-87H(300 mm×7.8 mm,9 µm);RI示差检测器;流动相:0.005 mol/L H2SO4(pH 2);进样体积:20 μL;流动相流速:0.6 mL/min;柱温:65 ℃。采用纤维二糖、L-阿拉伯糖、D-葡萄糖、D-木糖、D-半乳糖、D-甘露糖、L-鼠李糖、D-葡萄糖醛酸和D-半乳糖醛酸的标准溶液进行校准。
水分含量:参照GB 5009.3—2010《食品中水分的测定》;灰分测定:参照GB 5009.4—2010《食品中灰分的测定》;蛋白质含量:参照GB 5009.5—2010《食品中蛋白质的测定》;脂肪含量:参照GB/T 5009.6—2003《食品中脂肪的测定》。
1.3.4 木质素的结构分析
1.3.4.1 木质素的乙酰化
参考文献:[18-19],取200 mg木质素溶于8 mL的吡啶/醋酸酐(1∶1,V/V)混合溶液中。在避光常温条件下搅拌24 h,停止反应,往反应液中加少量乙醇进行旋蒸(反复几次),以蒸掉多余的吡啶和醋酸酐。将浓缩液滴入到10 倍体积的酸水(pH 2,HCl调节)中,析出木质素沉淀,冷冻干燥后保存,以备分析。
1.3.4.2 木质素平均分子质量的测定
参照文献[20],采用凝胶渗透色谱(gel permeation chromatography,GPC)分析测定木质素的分子质量。准确称取4 mg乙酰化的木质素样品溶于2 mL的四氢呋喃中,待其全部溶解后,溶液过滤,进色谱柱进行分析,进样量50 μL。流动相为色谱级四氢呋喃,流速1 mL/min。采用分子质量范围为800~90 000 D的聚苯乙烯标样进行标定。
1.3.4.3 木质素紫外光谱分析
称取5 mg木质素样品溶于10 mL体积分数95%的二氧六环溶液中,再取1 mL的木质素溶液用50%的二氧六环溶液定容至10 mL,然后再进行测定。其中以50%的二氧六环作为参比液。
1.3.4.4 木质素傅里叶红外光谱分析
采用KBr压片法,样品均匀分散于KBr中,质量分数为1%。扫描波数范围4 000~400 cm-1,扫描次数设为32 次,分辨率4 cm-1。
1.3.4.5 木质素核磁共振氢谱分析
将20 mg乙酰化的木质素样品,溶在0.5 mL氘代氯仿(CDCl3)中,用四甲基硅烷(tetramethylsilane,TMS)做内标进行测定。
1.3.4.6 木质素的热重分析
测试前对木质素样品105 ℃干燥,取10 mg样品置于坩埚中(Al2O3),氮气流速(50 mL/min),加热速率(10 K/min),测试温度范围为30~650 ℃。
1.3.5 木质素抗氧化活性分析
参照Tao Bingbing等[21]的方法,采用DPPH自由基清除能力来评价木质素抗氧化能力。取0.1 mL不同质量浓度(0.10~5.00 mg/mL)木质素(溶解于90%二氧六环)溶液,加入3.9 mL DPPH溶液(0.06 mmol/L溶于甲醇溶液),混合均匀后在室温条件下避光反应30 min。然后于517 nm波长处测定吸光度As。同时,测定空白样吸光度Ab。按式(2)计算样品对DPPH自由基清除率(S/%)。
半抑制浓度(half maximal inhibitory concentration,IC50)是自由基清除率达到50%时所需样品的浓度。(free radical scavenging index,RSI)值为自由基清除指数,是IC50的倒数,常用来评价抗氧化活性大小,其值越大,抗氧化活性越强。以商业合成的抗氧化剂二丁基羟基甲苯做阳性对照。
2.1 葵花籽壳及木质素成分分析
表1 葵花籽壳及木质素的成分分析
Table 1 Composition analysis of sunf l ower seed shell and lignin
由表1可知,葵花籽壳的主要成分为纤维素、半纤维素和木质素,其含量分别为25.50%、29.95%、29.00%,一共占总成分含量的84.45%,且木质素的含量很高,是提取木质素的良好原料。提取的木质素纯度高达为88.54%,得率为70.12%(相对于原料中的Klason木质素的含量),醋酸法提取的木质素结合的碳水化合物的总量为2.92%。且提取木质素中的灰分、脂肪、蛋白质含量远远低于葵花籽壳中相应成分的含量。以上结果说明醋酸法提取葵花籽壳木质素过程中,有效断裂了木质素与多糖之间的化学连接,保证了提取木质素的得率及纯度,对木质素进一步应用提供了结构基础。
2.2 木质素的平均分子质量

图1 木质素GPC图谱
Fig. 1 GPC chromatogram of lignin extracted from sunf l ower seed shell
木质素的化学结构、官能团的含量都随着木质素平均分子质量变化而变化[22],所以木质素分子质量大小对木质素的结构和活性特征都有重要影响。根据木质素GPC图谱(图1),计算出葵花籽壳醋酸法提取木质素的重均分子质量(Mw)、数均分子质量(Mn)和多分散度(Mw/Mn)分别为2 977、1 931 D和1.54,较Li Mingfei等[12]从竹子中提取的醋酸法木质素的平均分子质量和多分散性要低,这可能和原料来源不同有关。
2.3 木质素紫外和傅里叶红外光谱分析
在200~400 nm波长内扫描,测得葵花籽壳醋酸法提取木质素的紫外吸收光谱(图2),在280 nm波长附近有最大强度的吸收峰,这是苯环的特征峰,由木质素中非共轭羟基引起,说明所提取的木质素为芳香族化合物。同时最大吸收峰位置从波长280 nm转移到285 nm,其原因是提取的木质素中含有较高比率的愈创木基(G)单元,通常其在280~285 nm波长处有极大吸收峰[23]。
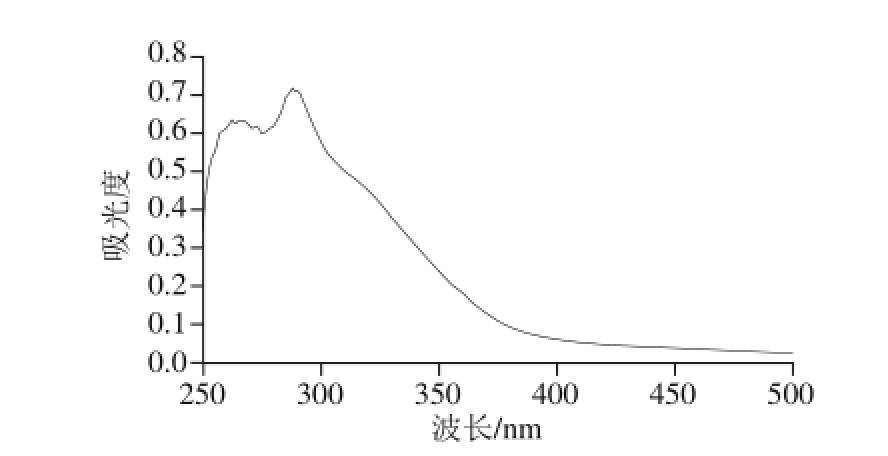
图2 葵花籽壳木质素紫外光谱图
Fig. 2 UV spectrum of lignin extracted from sunf l ower seed shell

图3 葵花籽壳木质素傅里叶红外光谱图
Fig. 3 FT-IR spectrum of lignin extracted from sunf l ower seed shell
参考相关文献[24-25],确定葵花籽壳木质素的红外光谱特征峰(图3)及峰的归属,与文献[12]中毛竹醋酸法木质素谱图比较相似。在3 436 cm-1处吸收峰为酚羟基和醇羟基的伸缩振动峰。2 928 cm-1和2 851 cm-1峰则分别来源于甲基和亚甲基中的C—H伸缩振动。木质素中各官能团的特征吸收峰主要集中在1 800~900 cm-1指纹区,其中1 735 cm-1峰表示非共轭的酮、羰基和酯中的C=O伸缩振动;木质素苯环振动出现在1 596、1 511、1 423 cm-1;而1 463 cm-1处的吸收峰为与苯环相连的C—H变形振动,呈现出典型的木质素红外吸收峰。1 370 cm-1处吸收峰为脂肪族甲基中C—H和酚羟基中O—H伸缩振动;1 236 cm-1和1 328 cm-1分别为紫丁香基结构单元和愈创木基结构单元中芳环呼吸振动及C—O伸缩振动;且1 236 cm-1吸收峰强度比1 328 cm-1的强度大,说明提取的木质素中含有较多的愈创木基单元,与紫外谱图结果一致。1 037 cm-1处吸收峰为伯醇中C—O伸缩振动和愈创木基结构单元上的C—H振动;在1 125 cm-1(紫丁香基结构的特征峰)伸缩振动处的强吸收峰及1 166 cm-1处无明显吸收峰,表明提取的木质素样品为GS型木质素,830 cm-1处吸收峰来自S型结构单元的2、6位的C—H特征吸收。
2.4 木质素核磁共振氢谱分析
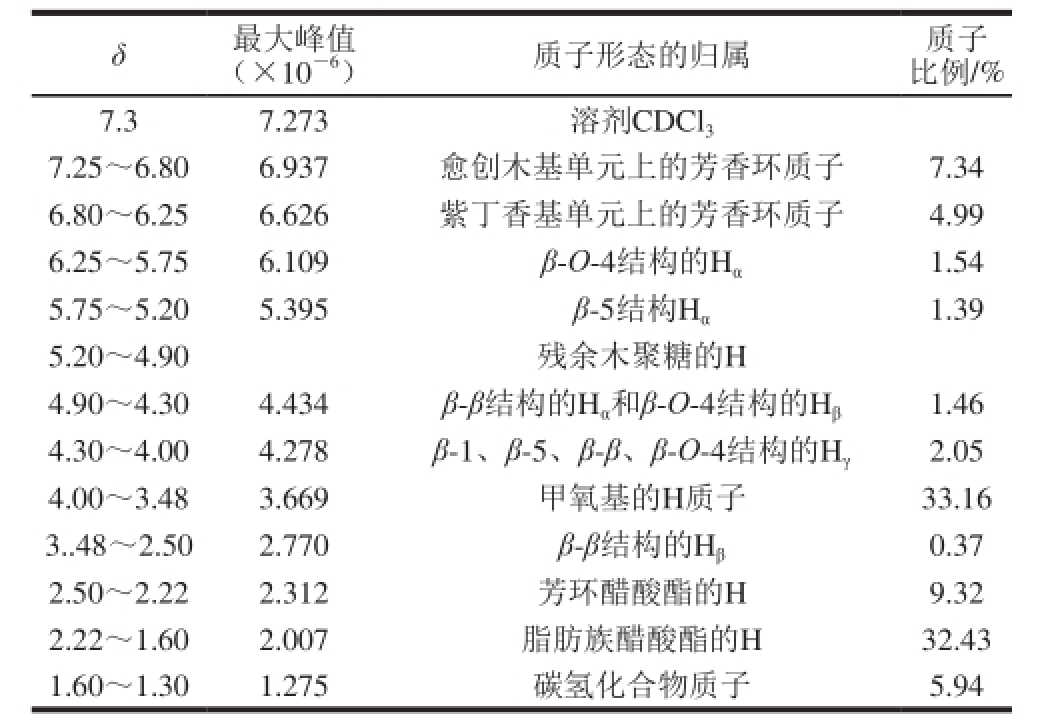
经乙酰化处理的木质素的核磁共振氢谱见图4。参考相关文献[26-29]对测定的木质素谱图进行范围区分,确定了1H谱特征峰归属,然后求出各区段信号积分强度与总积分强度的比例,得到各种质子的相对比例(表2)。δ 8.0~7.28、7.25~6.80、6.80~6.5分别属于对羟苯基(H)、愈创木基(G)和紫丁香基(S)的结构单元。葵花籽壳木质素1H核磁共振谱图在δ 8.0~7.28区域无明显吸收峰,说明该木质素为GS型木质素,与紫外和红外结果一致。由表2可知,结构单元间相互连接的方式有如下几种:β-O-4结构、β-1结构、β-5结构、β-β结构,其中以β-O-4结构比例较大。木质素中各种官能团包括羟基和甲氧基峰形都十分明显,表现出丰富的官能团特征,有利于提取木质素的进一步利用。且愈创木基单元上的芳香环质子数比例要大于紫丁香基芳香环质子,进一步证明醋酸法提取的葵花籽壳木质素是以占较多愈创木基结构单元的GS型木质素。

图4 乙酰化葵花籽壳木质素核磁共振氢谱图
Fig. 41H-NMR spectrum of acetylated lignin extracted from sunf l ower seed shell
表2 乙酰化木质素核磁共振氢谱波谱解析
Table 21H-NMR analysis of acetylated lignin extracted from sunf l ower seed shell
2.5 木质素的热稳定性分析
热重(TG)曲线显示的是木质素的质量变化与温度关系的曲线。由图5可知,在20~120 ℃是一个脱水的过程,包括游离水、物理吸附水和分子中的结晶水。热降解的第二阶段(200~360 ℃)降解的速率较快,此阶段主要涉及β-O-4键的降解,说明该木质素中β-O-4含量较多。在后续的热降解阶段(360~400 ℃),主要取决于木质素侧链的氧化。同时,甲氧基的裂解主要发生在400~600 ℃[30]。此外,木质素在650 ℃的残炭率可能与木质素的C—C键含量相关。DTG为不同温度条件下相应质量的降解速率。样品的热稳定性可以通过最大失质量率(DTGmax)来表示。如图5所示,葵花籽壳木质DTGmax对应的分解温度为361.17 ℃,最大失质量速率为0.32%/℃,由以上数据可知,葵花籽壳木质素的热稳定性最好,这将有利于扩大其的应用范围。
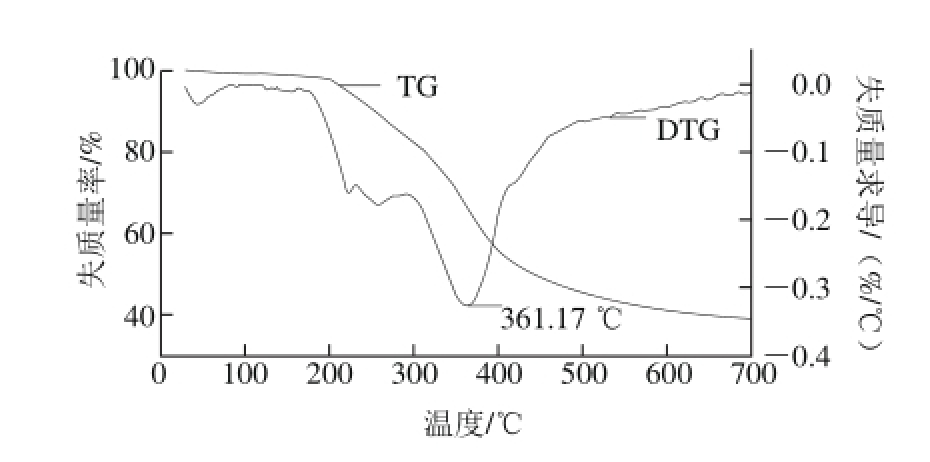
图5 葵花籽壳木质素热分析
Fig. 5 TG and DTG curves of lignin extracted from sunf l ower seed shell
2.6 木质素的抗氧化活性
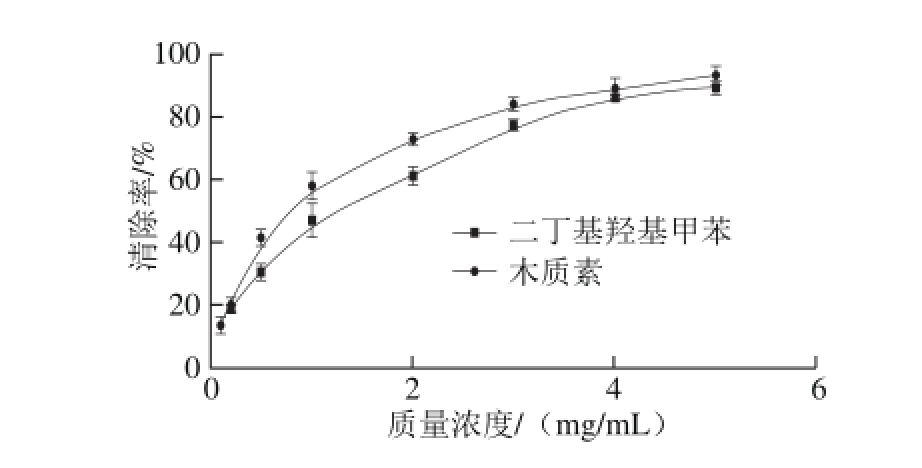
图6 葵花籽壳木质素质量浓度对DPPH自由基的清除效果
Fig. 6 DPPH radical scavenging activity of lignin extracted from sunf l ower seed shell
醋酸法提取的木质素对DPPH自由基清除效果如图6所示,以商业合成抗氧化剂二丁基羟基甲苯作阳性对照。木质素抗氧化活性IC50值为0.65 mg/mL,RSI值为1.54,显著高于商业合成的抗氧化剂二丁基羟基甲苯(RSI值为0.94),这与木质素中含有的活性基团有关,研究表明木质素对皮肤和眼睛无伤害[4],因此醋酸法提取的葵花籽壳木质素可用做天然的抗氧化剂,用来延长食用油及食品货架期,阻止食品的风味、颜色、活性维生素的丧失等[29],为葵花籽壳高附加值应用提供一个新的方向。
醋酸法提取葵花籽壳木质素得率达到70.12%(相对于原料中Klason木质素的含量),纯度为88.54%,提取的木质素中结合有少量碳水化合物,总量为2.92%。利用凝胶渗透色谱、紫外光谱、红外光谱、核磁共振氢谱和热重分析对提取的木质素进行结构表征,结果表明葵花籽壳木质素的平均分子质量较低,分散系数低,均一性较好,含有较多的活性官能团:酚羟基、甲氧基等。提取的木质素是以愈创木基为主的GS型木质素,结构单元之间的连接键以β-O-4结构为主,木质素样品主要降解温度在200~400 ℃之间,最大失质量速率为0.32%/℃。葵花籽壳木质素在DPPH自由基清除指数RSI值为1.54,显著高于商业合成的抗氧化剂二丁基羟基甲苯(RSI值为0.94)。
参考文献:
[1] 蒋挺大. 木质素[M]. 北京: 化学工业出版社, 2001: 20-26.
[2] LI M F, SUN S N, XU F, et al. Microwave-assisted organic acid extraction of lignin from bamboo: structure and antioxidant activity investigation[J]. Food Chemistry, 2012, 134(3): 1392-1398. DOI:10.1016/j.foodchem.2012.03.037.
[3] GONG W H, XIANG Z Y, YE F Y, et al. Composition and structure of an antioxidant acetic acid lignin isolated from shoot shell of bamboo (Dendrocalamus Latiforus)[J]. Industry Crops and Products, 2016, 91(30): 340-349. DOI:10.1016/j.indcrop.2016.07.023.
[4] VANESSA U, MONTSERRAT M, MARIA P V. Comparative antioxidant and cytotoxic effects of lignins from different sources[J]. Bioresource Technology, 1999, 99(14): 6683-6687. DOI:10.1016/ j.biortech.2007.11.038.
[5] RODRÍGUEZ-GUTIÉRREZ G, RUÍBO-SENENT F, LAMAMUNOZ A, et al. Properties of lignin, cellulose, and hemicelluloses isolated from olive cake and olive stones: binding of water, oil, bile acids, and glucose[J]. Journal of Agricultural and Food Chemistry, 2014, 62(36): 8973-8981. DOI:10.1021/jf502062b.
[6] MITJANS M, VINARDELLM P. Biological activity and health benef i ts of lignans and lignins[J]. Trends Comparative of Biochemistry and Physiology, 2005, 11(3): 55-62.
[7] LAPIERRE C, JOUIN D, MONTIES B. On the molecular origin of the alkali solubility of Gramineae lignins[J]. Phytochemistry, 1989, 28(5): 1401-1403. DOI:10.1016/S0031-9422(00)97755-0.
[8] WORMEYER K, INGRAM T, SAAKE B, et al. Comparison of different pretreament methods for lignocellulosic materials. Part Ⅱ: influence of pretreatment on the properties of rye straw lignin[J]. Bioresource Technology, 2011, 102(5): 4157-4164. DOI:10.1016/ j.biortech.2010.11.063.
[9] WEN J L, XUE B L, XU F, et al. Unmasking the structural features and property of lignin from bamboo[J]. Industrial Crops and Products, 2013, 42(1): 332-343. DOI:10.1016/j.indcrop.2012.05.041.
[10] ROSSBERG C, BREMER M, MACHILL S, et al. Separation and characterisation of sulphur-free lignin from different agricultural residues[J]. Industrial Crops and Products, 2015, 73(30): 81-89. DOI:10.1016/j.indcrop.2015.04.001.
[11] SUN S N, CAO X F, SUN, R C, et al. Structural features and antioxidant activities of lignin from steam-exploded bamboo (Phyllostachys pubescens)[J]. Journal of Agricultural and Food Chemistry, 2014, 62(25): 5939-5947. DOI:10.1021/jf5023093.
[12] LI M F, SUN S N, XU F, et al. Mild acetosolv process to fractionate bamboo for the bioref i nery: structural and antioxidant properties of the dissolved lignin[J]. Journal of Agricultural and Food Chemistry, 2012, 60(7): 1703-1712. DOI:10.1021/jf2050608.
[13] VILLAVERDE J J, LI J B, EK M, et al. Native lignin structure of Miscanthus×giganteus and its change during acetic and formic acid fractionation[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 6262-6270. DOI:10.1021/jf900483t.
[14] 臧延青, 葛德鹏. 葵花籽壳水溶性膳食纤维的提取工艺优化及抗氧化活性[J]. 食品工业科技, 2015, 36(10): 307-312. DOI:10.13386/ j.issn1002-0306.2015.10.056.
[15] 陈珊珊, 陶宏江, 王亚静, 等. 葵花籽壳纳米纤维素制备工艺优化及其表征[J]. 农业工程学报, 2015, 31(15): 302-309. DOI:10.11975/ j.issn.1002-6819.2015.15.041.
[16] 张海悦, 张守媛, 韩升廷. 黑葵花籽壳中占有花色苷类物质的结构分析[J]. 食品科学, 2012, 33(17): 118-122. DOI:1002-6630(2012)17-0118-04.
[17] 张红漫, 郑荣平, 陈敬文, 等. NREL法测定木质纤维原料组分的含量[J]. 分析试验室, 2010, 29(11): 15-18. DOI:10.1007/BF02358196.
[18] PAN X J, KADLA J F, EHARA K, et al. Organosolv ethanol lignin from hybrid poplar as a radical scavenger: relationship between lignin structure, extraction conditions, and antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2006, 54(16): 5806-5813. DOI:10.1021/jf0605392.
[19] WEN J L, XUE B L, SUN S L, et al. Quantitative structural characterization and thermal properties of birch lignins after autocatalyzed organosolv pretreatment and enzymatic hydrolysis[J]. Journal of Chemical Technology and Biotechnology, 2013, 88(9): 1663-1671. DOI:10.1002/jctb.4017.
[20] ZHU M Q, WEN J L, SU Y Q, et al. Effect of structural changes of lignin during the autohydrolysis and organosolv pretreatment on Eucommia ulmoides Oliver for an effective enzymatic hydrolysis[J]. Bioresource Technology, 2015, 185(2): 378-385. DOI:10.1016/ j.biortech.2015.02.061.
[21] TAO B B, YE F Y, LI H, et al. Phenolic profile and in vitro antioxidant capacity of insoluble dietary fi ber powders from citrus (Citrus junos Sieb.ex Tanaka) pomace as affected ultraf i ne grinding[J]. Journal of Agricultural and Food Chemistry, 2014, 62(29): 7166-7173. DOI:10.1021/jf501646b.
[22] WEN J L, SUN S L, XUE B L, et al. Structural elucidation of inhomogeneous lignins from bamboo[J]. International Journal of Biological Macromolecules, 2015, 77(3): 250-259. DOI:10.1016/ j.ijbiomac.2015.03.044.
[23] SUN R C, LU Q, SUN X F. Physico-chemical and thermal characterization of lignins from Caligonum monogoliacum and Tamarix spp.[J]. Polymer Degradation and Stability, 2001, 72(2): 229-238. DOI:10.1016/S0141-3910(01)00023-4.
[24] 李坚. 木材波谱学[M]. 北京: 科学出版社, 2003: 104-105.
[25] FAIX O. Classif i cation of lignins from different botanical origins by FT-IR spectroscopy[J]. Holzforschung, 1991, 45(Suppl 1): 21-27. DOI:10.1515/hfsg.1991.45.s1.21.
[26] 周厚德, 刘玉环, 阮榕生, 等. 常压醋酸法分离毛竹木质素[J]. 林业科学, 2011, 47(10): 153-160. DOI:1001-7488(2011)10-0153-07.
[27] SALUD E C, FAIX O. The isolation and characterization of lignins of Shorea species[J]. Holzforschung, 1980, 34(4): 113-121. DOI:10.1515/ hfsg.1980.34.4.113.
[28] 秦特夫, 黄洛华, 李改云. 慈竹、毛竹木质素的化学官能团和化学键特征研究[J]. 北京林业大学学报, 2010, 32(3): 161-165. DOI:10.13332/j.1000-1522.2010.03.018.
[29] ZHOU S, LIU L, WANG B, et al. Microwave-enhanced extraction of lignin from birch in formic acid: structural characterization and antioxidant activity study[J]. Process Biochemistry, 2012, 47(12): 1799-1806. DOI:10.1016/j.procbio.2012.06.006.
[30] 文甲龙. 生物质木质素结构解析及其预处理解离机制研究[D]. 北京: 北京林业大学, 2014: 111-113.
Structural Features and Antioxidant Activities of Lignin Extracted from Sunf l ower Seed Shell
GONG Weihua1,2, MA Yue1, LÜ Xia1, YE Fayin1, ZHAO Guohua1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. College of Normal, Jishou University, Jishou 416000, China; 3. Chongqing Engineering Research Centre of Regional Foods, Chongqing 400715, China)
Abstract:Lignin was extracted from sunf l ower seed shell using acetic acid. The structural features of the isolated lignin were characterized by gel permeation chromatography (GPC), ultraviolet spectroscopy (UV), infrared spectroscopy (FT-IR), hydrogen-1 nuclear magnetic resonance spectrocopy (1H-NMR) and thermogravimetry (TG). In addition, the antioxidant activity of the lignin was evaluated by 1,1 diphenyl-2-trinitrobenzene hydrazine (DPPH) radical scavenging activity assay. The results showed that the yield and purity of lignin extracted from sunf l ower seed shell were 70.12% (based on Klason lignin) and 88.54%, respectively, and the content of lignin-associated carbohydrates was 2.92%. The lignin was GS-type lignin with β-O-4 ether bond as the major inter-unit linkage, having a high proportion of guaiacyl (G) units. The weightaverage molecular (Mw), number-average molecular (Mn) and polydispersity (Mw/Mn) of the lignin were 2 977, 1 931 D and 1.54, respectively. It major decomposition temperature was 200–400 ℃ and the maximum weight loss rate was 0.32%/℃. We found that the lignin showed stronger antioxidant activity than butylated hydroxytoluene (BHT) with free radical scavenging index (RSI) of 1.54 versus 0.94. The results suggested that acetic acid extraction provides a promising way to prepare lignin from sunf l ower seed shell with a good potential as an antioxidant in food and other industries.
Key words:sunf l ower seed shell; acetic acid extraction; lignin; structural feature; antioxidant activity
DOI:10.7506/spkx1002-6630-201707005
中图分类号:TS229
文献标志码:A
文章编号:1002-6630(2017)07-0023-06
引文格式:
龚卫华, 马玥, 吕霞, 等. 葵花籽壳木质素的结构分析及抗氧化活性[J]. 食品科学, 2017, 38(7): 23-28. DOI:10.7506/ spkx1002-6630-201707005. http://www.spkx.net.cn
GONG Weihua, MA Yue, LÜ Xia, et al. Structural features and antioxidant activities of lignin extracted from sunf l ower seed shell[J]. Food Science, 2017, 38(7): 23-28. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201707005 http://www.spkx.net.cn
收稿日期:2016-05-11
基金项目:国家自然科学基金面上项目(31371737);重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
作者简介:龚卫华(1980—),女,讲师,博士,研究方向为非消化性碳水化合物。E-mail:19010043@qq.com
*通信作者:赵国华(1971—),男,教授,博士,研究方向为食品化学与营养学。E-mail:zhaoguohua1971@163.com