王 博,伊 东,谢梦颖,潘 男,张莉丽*,夏秀芳*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:选择70 ℃条件下反应4 h所得到的糖基化大豆分离蛋白样品(蛋白与葡萄糖质量比1∶1)与肌原纤维蛋白以不同比例(9∶1、8∶2、7∶3、6∶4、5∶5)进行复配,测定不同复合蛋白的乳化性能、浊度、表面疏水性、凝胶特性(质构特性、白度值、微观结构分析),探讨糖基化大豆分离蛋白对肌原纤维蛋白功能性质的影响及其机理。结果表明:复合蛋白的乳化性和表面疏水性均较肌原纤维蛋白显著提升(P<0.05);复合蛋白的浊度随着加热温度的升高(30~80 ℃)而不断增加,随着糖基化大豆分离蛋白比例的加大,浊度不断变小;肌原纤维蛋白与糖基化大豆分离蛋白混合凝胶的硬度和弹性均显著优于其与天然大豆分离蛋白混合凝胶(P<0.05),微观结构比其与天然大豆分离蛋白混合凝胶更加致密均匀;与纯肌原纤维蛋白凝胶相比,混合凝胶的白度值下降,但混合比例为9∶1时白度值下降不显著(P>0.05)。
关键词:大豆分离蛋白;糖基化;肌原纤维蛋白;乳化性;凝胶特性
大豆分离蛋白(soybean protein isolate,SPI)是一种含有高蛋白、低胆固醇的功能性食品添加剂[1]。由于其资源丰富,具有较高的营养价值,近年来许多研究者致力于SPI功能性和新用途开发的研究[2]。近年来,合理利用SPI功能性并将其应用到肉品中以提高其品质被广泛应用,同时满足了消费者对肉制品品质的追求[3]。
尽管SPI具有良好的凝胶性、乳化性等功能性质,但当SPI应用于肉制品时,由于普通肉制品加热的最终温度远低于SPI的变性温度,从而使得SPI不能发生有效的结构改变,这样不利于其与肌原纤维蛋白(myofibrillar protein,MP)的相互作用[4-5]。因此许多学者开始研究改性后SPI对MP功能性质的影响,并发现适当改性后的SPI可以显著提高MP的功能性质。梁婧等[6]的研究中将不同改性方式的SPI和MP混合,其乳化性和凝胶性显著提高。张明成[7]用酶水解结合酶交联改善大豆分离并将其添加到火腿肠中,结果显示改性后的MP和SPI复配后的乳化性明显上升。孔杭如等[8]在探讨优化牦牛MP和热改性SPI共凝胶条件的过程中发现,MP-SPI溶液体积比9∶1、SPI热改性温度100 ℃时能形成很好的共凝胶。欧阳艳华等[9]探究了经酶改性的SPI与鸡肉MP复配后的凝胶性和乳化性,结果表明混合蛋白的凝胶性和乳化性明显改善。
糖基化改性由于其不需要外加任何化学试剂,是一个自然、自发的反应[10],蛋白质的糖基化改性可以提高蛋白质的功能性质、增加酶的热稳定性,是一种很有前景的改性方法。因此本实验研究糖基化改性后的SPI对MP功能性质的影响,以期为SPI的综合利用和生产出具有较高质量的肉制品提供理论指导。
1.1 材料与试剂
SPI 哈尔滨高科大豆食品公司;猪背部最长肌哈尔滨家乐福超市。
葡萄糖 上海国药集团;氯化钠、氯化镁、磷酸二氢钠、磷酸氢二钠、乙二醇二乙醚二胺四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、溴酚蓝 天津市津东天正精细化学试剂厂。
1.2 仪器与设备
AL-104型精密电子天平 常州万泰天平仪器有限公司;DK-8B型电热恒温水浴锅 西化仪科技有限公司;STARTER 3100型pH计 成都启运通仪器有限公司;冷冻干燥机 常州中云干燥工程有限公司;QT-1旋涡混合器 西安华辰乐天实验室设备有限公司;TG16-WS型高速离心机 常州市万合仪器制造有限公司;TU-1800紫外-可见光分光光度计 济南博鑫生物技术有限公司;T18高速匀浆机 德国IKA公司;TA-XT Plus型质构分析仪 英国Stable Micro System公司;色差仪CS-10杭州彩谱科技有限公司;S-3400N扫描电子显微镜日本日立公司;EMS 150R离子喷膜仪 海德创业生物科技有限公司。
1.3 方法
1.3.1 糖基化SPI的制备
参照王松等[11]的方法并略加修改,SPI和葡萄糖质量比1∶1放于烧杯中用蒸馏水溶解,使蛋白质量分数为8%,保鲜膜密封,将混合液置于70 ℃恒温水浴锅中反应4 h后,取样冷冻干燥,测定样品蛋白含量,备用。
1.3.2 MP的提取
参照Liu Gang等[12]的方法并略加修改。选取猪背部最长肌,去除可见脂肪和结蹄组织后,将肉切成小块绞碎称质量备用。提取,加入4 倍体积的提取液(10 mmol/L磷酸盐、 0.1 mol/L NaCl、2 mmol/L MgCl2和1 mmol/L EGTA,pH 7.0)匀浆60 s,4 ℃、3 500 r/min冷冻离心15 min,取沉淀,以同样方法再提取两次,将沉淀中加入4 倍体积洗液(0.1 mol/L NaCl)匀浆60 s,在4 ℃、3 500 r/min条件下冷冻离心15 min,去上清液,重复洗一次,去上清液后再加4 倍体积洗液,匀浆60 s,4 层纱布过滤,用0.1 mol/L HCl调pH值至6.0,3 500 r/min、4 ℃冷冻离心15 min,得到沉淀即为MP,在4 ℃保存备用,存储时间不得超过48 h。用双缩脲法测定其蛋白含量。整个提取过程需在4 ℃条件下完成。
1.3.3 糖基化SPI与MP的复合
提取的MP与糖基化SPI分别按蛋白质量比9∶1、8∶2、7∶3、6∶4和5∶5进行复合,对复合蛋白进行各指标测定。
1.3.4 复合蛋白性质的测定
1.3.4.1 复合蛋白乳化活性及乳化稳定性的测定
参照Agyare等[13]的方法,并稍作修改。复合蛋白溶解在pH 6.5、0.1 mol/L磷酸盐缓冲溶液中,使蛋白质量浓度为1 mg/mL,将2.0 mL大豆油和8.0 mL蛋白溶液放入直径为中2.5 cm的塑料离心中用匀浆机高速匀浆1 min,立即从距离心管底部0.5 cm的地方取匀浆液50 μL加入到5 mL 0.1%的SDS溶液中,振荡混匀后用TU-1800紫外分光光度计在500 nm波长处测定吸光度记作A0,匀浆后10 min再次在相同位置取匀浆液50 μL加入到5 mL 0.1%的SDS溶液中,振荡混匀后测定吸光度记做A10,用0.1% SDS溶液作空白对照。复合蛋白溶液的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI),分别用公式(1)、(2)来表示。
式中:A500nm为500 nm波长处的吸光度;φ为油相体积分数(φ = 0.2%);ρ为蛋白质质量浓度/(mg/mL);A0、A10为乳状液在0、10 min的吸光度。
1.3.4.2 复合蛋白浊度的测定
复合蛋白的浊度根据Benjakul等[14]的方法并稍作修改进行测定。复合蛋白配制成蛋白质量浓度1 mg/mL的溶液后吸取5 mL放入试管中,将试管分别放在30、40、50、60、70、80 ℃的水浴锅中加热30 min后取出,冷却至室温,以不加蛋白的溶液为空白,在600 nm波长处测定吸光度。
1.3.4.3 复合蛋白表面疏水性的测定
依据Chelh等[15]的方法测定复合蛋白的表面疏水性。1 mL的3 mg/mL蛋白溶液加入200 μL 1 mg/mL的溴酚蓝,室温条件下搅拌10 min后,7 000 r/min离心15 min,取上清液稀释10 倍后在595 nm波长处测定吸光度(A样品)。溴酚蓝空白样是用1 mL的pH 6.0 20 mmol/L的磷酸盐缓冲液加200 μL溴酚蓝,磷酸盐缓冲液作空白样(A空白)。表面疏水性以溴酚蓝结合量表示,如公式(3)所示。
1.3.4.4 复合蛋白凝胶的制备
将复合蛋白按比例溶解在0.6 mol/L的NaCl溶液中配制成蛋白质量浓度为40 mg/mL的溶液,将溶液放入25 mm×40 mm密封的玻璃瓶中后,将其放入80 ℃的水溶锅中加热30 min,取出凝胶放在冰浴中冷却后贮存在2~4 ℃的冰箱中过夜备用。制备好的凝胶在每次分析前要放在室温条件下(25~27 ℃)平衡30 min。
1.3.4.5 复合蛋白凝胶质构的测定
复合蛋白凝胶室温条件下平衡30 min,将待测样品置于测定平台上,利用物性分析仪在室温条件下进行测量。以质构剖面分析方法测定凝胶的硬度和弹性等。物性仪的参数设定如下:测试前速率为5 mm/s,测试速率为2 mm/s,测试后速率为5 mm/s,下压距离为凝胶高度的50%,引发力为5 g,探头型号选择P/0.5。每个样品进行3 次平行实验,取平均值。
1.3.4.6 复合蛋白凝胶白度值的测定
复合凝胶的白度值用色差仪来测定,色差仪可以测定出凝胶的L值、a值、b值,白度值按Park[16]的方法来计算,见公式(4)。
式中:L代表亮度(0代表黑色,100代表白色);a代表红度(a为正时表示红色,a为负时表示绿色);b代表黄度(b为正时表示黄色,b为负时表示蓝色)。
1.3.4.7 复合蛋白凝胶微观结构的观察
取待测凝胶样品,切成约2 mm×5 mm的小条,用体积分数为2.5% pH 6.8的戊二醛浸泡过夜固定,再用0.1 mol/L pH 6.8磷酸盐缓冲液洗涤3 次,每次10 min。然后分别用体积分数为50%、70%、80%、90%的乙醇进行脱水,每次10 min;再用100%乙醇脱水3 次,每次10 min。之后用氯仿脱脂1 h,再分别用100%乙醇与叔丁醇体积比1∶1和叔丁醇进行置换各一次,每次15 min。用冷冻干燥仪对样品进行干燥。扫描时将凝胶样品观察面向上黏贴在扫描电子显微镜样品台上,用EMS 150R型离子溅射镀膜仪进行离子溅射喷金,将处理好的样品放入样品盒中待检。加速电压为5 kV,在1 000 倍的放大条件下进行扫描观察。
1.4 数据分析
每个实验重复3 次。数据统计分析采用Statistica 8.1软件进行,使用Tukey HSD程序进行差异显著性(P<0.05)分析,采用Sigmaplot 10.0软件作图。
2.1 糖基化SPI对MP乳化性能的影响
乳化能力通常是衡量一定量的蛋白质溶液在一定条件下所能乳化油的量[17]。肉的乳化体系是一种由斩拌或绞碎的脂肪颗粒、溶出的蛋白、各种水溶及水不溶物质组成的多相复合体系[18]。评价蛋白质乳化能力主要有EAI和ESI两个指标。
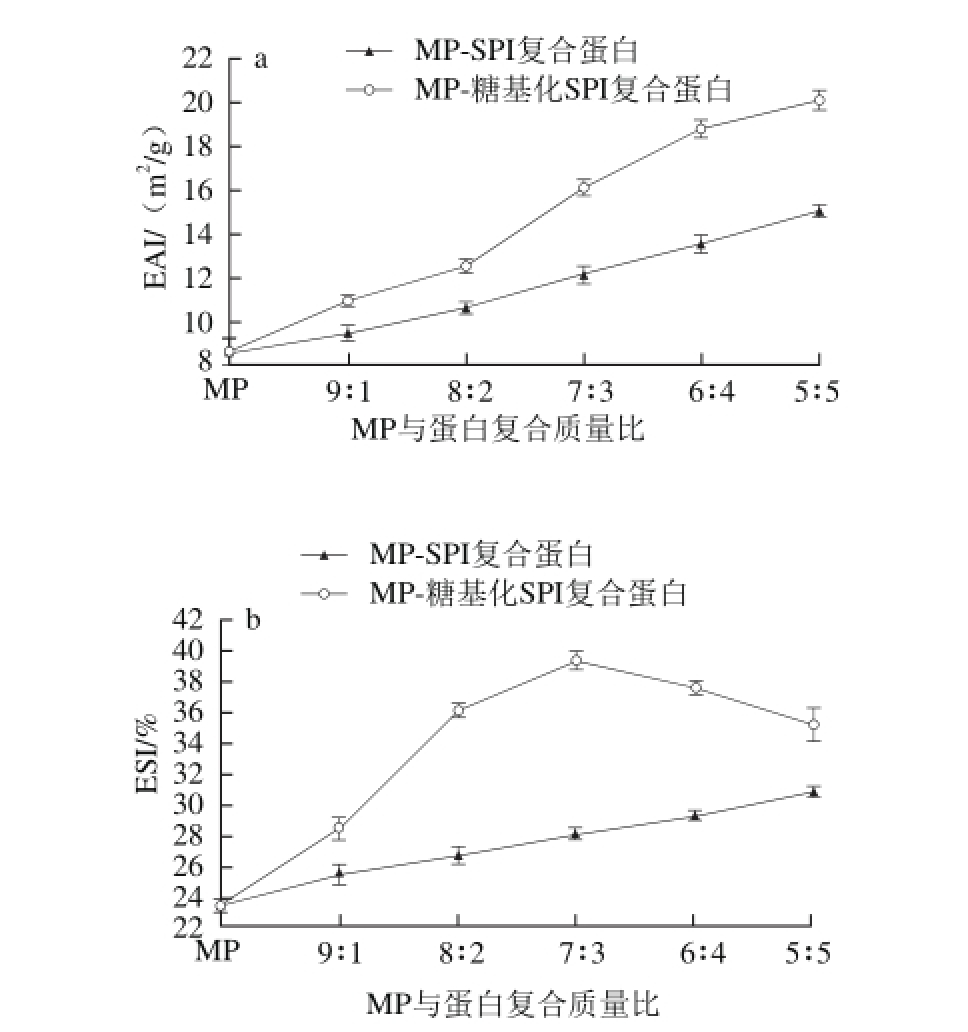
图1 糖基化SPI对MP乳化活性(a)和乳化稳定性(b)的影响
Fig. 1 Effect of glycosylated SPI on the emulsifying activity (a) and emulsifying stability (b) of myof i brillar protein
图1a展示的是不同比例的MP与SPI、糖基化SPI复合蛋白乳化活性的变化。乳化活性指的是蛋白乳化液的浊度与乳化微粒界面面积之间的线性关系,主要反映蛋白质在油水界面的扩散、吸附和定向排列[19]。从图1a可以看出,复合蛋白的乳化活性均高于MP,并随着SPI、糖基化SPI所占比例的增加呈现上升的趋势。在同一复配比例条件下,MP-糖基化SPI复合蛋白的乳化活性显著高于MP与SPI复合蛋白(P<0.05)。复配比例为5∶5时,MP与SPI、糖基化SPI复合蛋白的乳化活性分别达到了15.03、20.06 m2/g,后者比前者提高了33.42%。这是因为SPI是一种优良的天然乳化剂,但由于其较差的溶解性限制了其乳化性能的发挥。而经过糖基化改性后的SPI由于引入了亲水羟基,溶解性增加,同时暴露出疏水性氨基酸残基,使其能够较好地吸附在油水界面,从而与MP复合后可显著提高其乳化活性。
图1b展示的是不同比例的MP与SPI、糖基化SPI复合蛋白乳化稳定性的变化。乳化稳定性与乳化微粒直径或颗粒度有一定的关系,通常乳化微粒越小乳化稳定性越好,但也受其他的因素影响[20]。由图1b可知,在同一复配比例条件下,MP与糖基化SPI复合蛋白的乳化稳定性显著高于MP与SPI复合蛋白(P<0.05),并且其随着糖基化SPI所占比例的增加呈现先上升后下降的趋势,在复配比例7∶3时达到最大值39.12%,比MP的乳化稳定性提高了68.18%。得到这一结果可能是因为糖基化SPI增加了混合体系的黏度,从而使油水界面上蛋白质的吸附层厚度增加,继而阻止油滴聚集,最终使得体系乳化稳定性提高。但当糖基化SPI比例过大时,复合蛋白的亲水性增强,会优先吸附体系中的水使得蛋白的疏水基团不能有效地暴露在油水界面上,因此导致乳化稳定性下降[21]。
2.2 糖基化SPI对MP浊度的影响
浊度是反映蛋白聚集程度的指标,形成具有优良质构特性的凝胶的前提条件是形成大的聚集物[22]。它可以反映溶液中悬浮粒子的数量和大小,当浊度小时说明蛋白质分散并且悬浮颗粒的直径小,当浊度升高时说明蛋白聚集、悬浮颗粒直径变大。蛋白质的浊度能够用来粗略地评价蛋白聚集程度[23]。图2所示是不同比例MP与SPI、糖基化SPI复合溶液浊度的变化。随着加热温度的升高(30~80℃),各溶液的浊度不断增加,这是因为蛋白溶液在加热过程中蛋白质单体可通过疏水建、氢键、二硫键、静电作用以及范德华力等形成蛋白聚集体[24]。当加热温度相同时,MP与SPI、糖基化SPI复合溶液的浊度均小于MP溶液,并且随着SPI和糖基化SPI比例的加大浊度不断变小。这说明MP间的结合能力大于MP与SPI间的结合。还可以发现,MP-糖基化SPI复合液的浊度比在相同温度、混合比例的MP-SPI复合液显著增加。在加热温度为80 ℃时,比例为9∶1、8∶2、 7∶3、6∶4、5∶5的MP-糖基化SPI复合液的浊度比MP-SPI复合液分别提高了18.41%、14.76%、22.79%、11.94%、10.81%。这是由于SPI经过糖基化改性后结构发生改变,暴露出许多内部基团,同时引入糖链,增加了蛋白间聚合的机会,形成较多的蛋白聚集体。
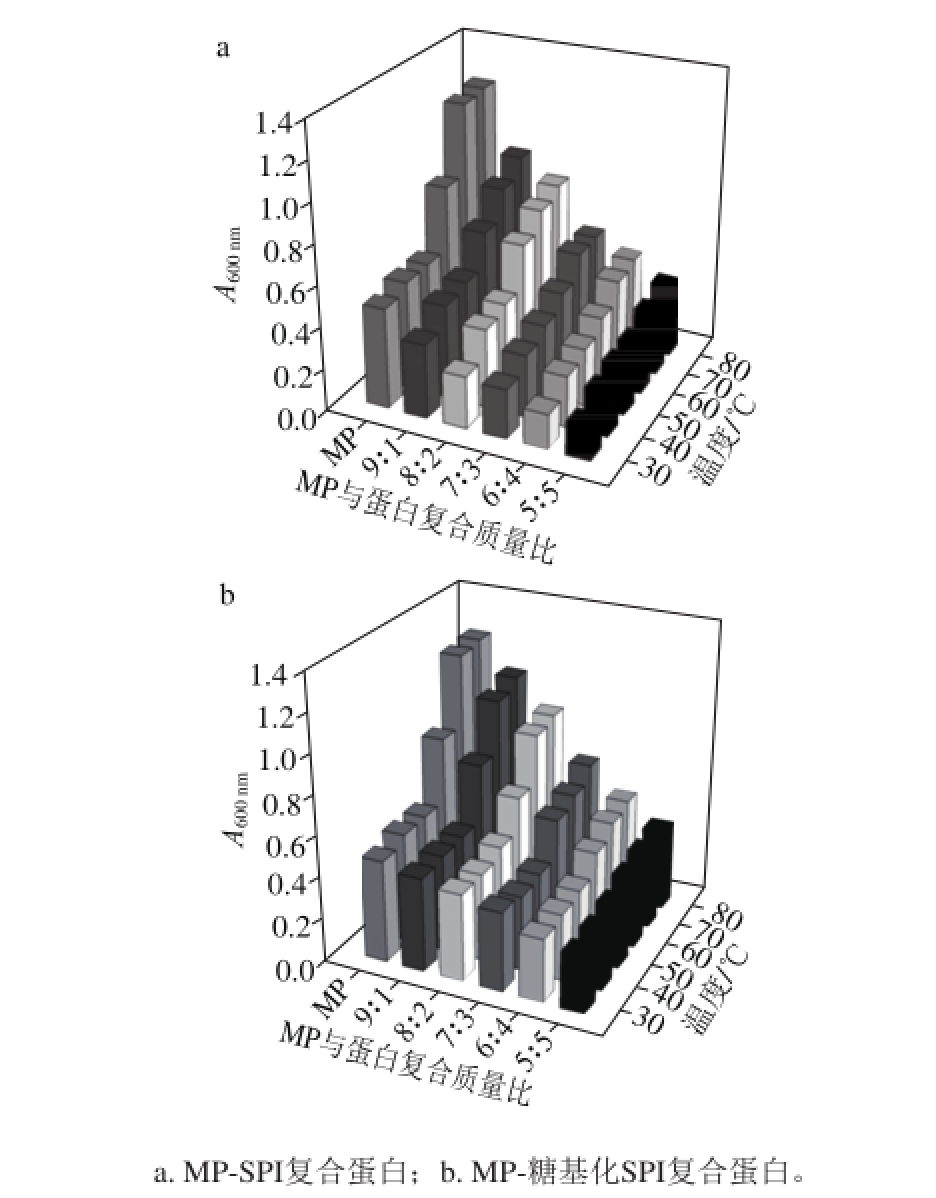
图2 糖基化SPI对MP浊度的影响
Fig. 2 Effect of glycosylated SPI on the turbidity of myof i brillar protein
2.3 糖基化SPI对MP表面疏水性的影响
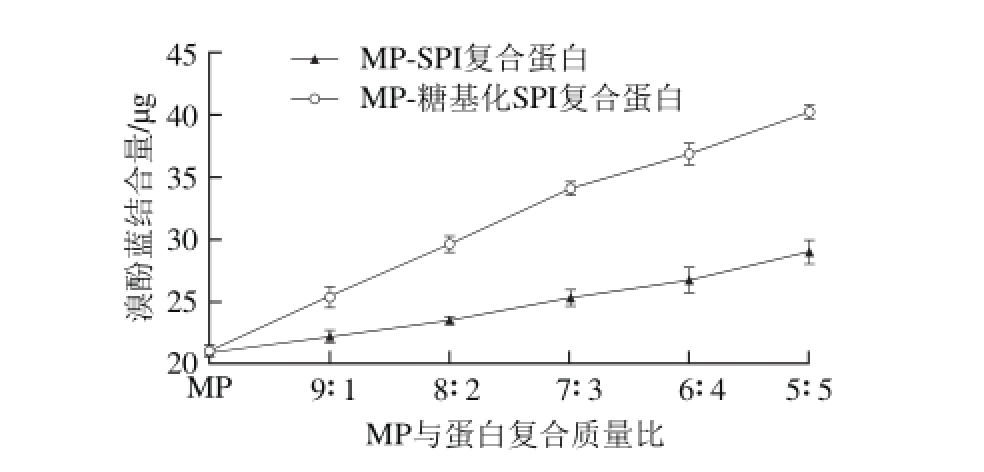
图3 糖基化SPI对肌原纤维蛋白表面疏水性的影响
Fig. 3 Effect of glycosylated SPI on the surface hydrophobicity of myof ibrillar protein
表面疏水性是蛋白质重要的结构性质,可用来评价蛋白质的空间构像,与蛋白质的功能性质息息相关。在分析蛋白分子三维结构时会发现有一些疏水基团暴露在分子表面,这些疏水性基团片段对分子之间相互作用方面起了关键作用,此即为蛋白质的表面疏水性[25]。因此,表面疏水性对理解蛋白质的功能性质起着至关重要的作用。蛋白质的表面疏水性不仅可以反映分子表面疏水性基团的相对含量,还可以用以衡量蛋白质的变性程度[15]。不同比例的MP与SPI、糖基化SPI复合蛋白表面疏水性的变化如图3所示,复合蛋白的表面疏水性均高于MP,并随着SPI、糖基化SPI所占比例的增加呈现上升的趋势。在同一复配比例条件下,MP-糖基化SPI复合蛋白的表面疏水性显著高于MP-SPI复合蛋白(P<0.05)。MP的表面疏水性(溴酚蓝结合量)为20.99 μg,而复配比例为5∶5时,MP与SPI、糖基化SPI复合蛋白的表面疏水性分别达到了28.92、40.17 μg,比MP的表面疏水性分别提高了37.78%、91.38%,并且后者比前者提高了38.90%。这是由于未改性SPI中多数的疏水性基团通过疏水作用而聚集,并埋藏在分子内部[26]。而SPI经过糖基化改性后,蛋白分子结构展开使埋藏在内部的更多疏水基团暴露出来,并且蛋白参与反应后会有更多的疏水性氨基酸残基存在,从而可以显著提高混合蛋白的表面疏水性。
2.4 糖基化SPI对MP凝胶特性的影响
2.4.1 糖基化SPI对MP凝胶质构的影响
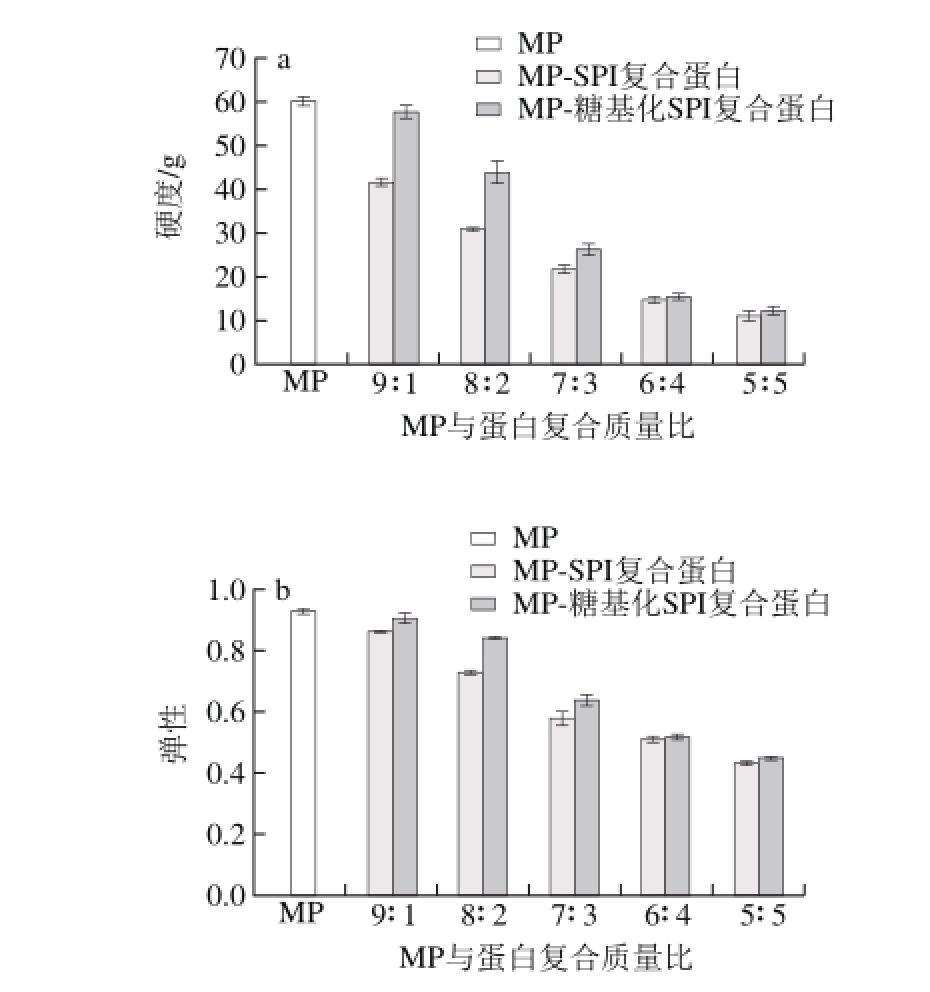
图4 糖基化SPI对MP凝胶质构的影响
Fig. 4 Effect of glycosylated SPI on the texture prof i le analysis of myof i brillar protein gels
MP与SPI、糖基化SPI按蛋白质量比9∶1、8∶2、7∶3、6∶4、5∶5混合制备复合凝胶,凝胶质构的变化如图4所示。蛋白质凝胶的质构特性能够很好地体现蛋白质形成凝胶的能力,其中硬度和弹性是蛋白质凝胶质构最主要的两个参数。从图4可以看出,与MP凝胶相比,添加SPI和糖基化SPI制备的复合凝胶的硬度和弹性均显著降低(P<0.05),并且随着SPI和糖基化SPI添加量的增加,凝胶的硬度和弹性均呈现下降的趋势。这与马宇翔等[27]的研究结果一致,他们研究了SPI对盐溶猪肉蛋白热诱导凝胶强度的影响,结果表明,SPI添加量越高混合蛋白凝胶的强度越低。这是因为无论是天然还是改性后的SPI在蛋白质量浓度为4 g/100 mL时都无法独立形成凝胶[28],而再将其添加到MP中,会使得MP的浓度下降,MP的凝胶强度在一定范围内与蛋白质量浓度成正比,因此,添加SPI的量越大,MP分子在形成凝胶网络结构时受到的阻碍越大,无法形成强度较好的凝胶。从图4还可以发现,MP-糖基化SPI复合凝胶的硬度和弹性均显著高于同一比例条件下天然MP-SPI复合凝胶,在复合比例为9∶1、8∶2、7∶3、6∶4、5∶5时,凝胶硬度分别提高了38.51%、42.46%、22.01%、7.38%、12.15%,凝胶弹性分别提高了5.27%、15.72%、10.02%、1.65%、4.20%。这与Feng等[29]的观点一致,其发现加入改性后的SPI可以有效改善混合凝胶的强度。这是由于SPI经糖基化改性后引入了糖链,分子运动阻力增大,黏度增加,同时反应后蛋白质的疏水性侧链残基会暴露出来,从而有利于与MP的相互作用[30]。
2.4.2 糖基化SPI对MP凝胶白度值的影响
表1 糖基化SPI对MP凝胶白度值的影响
Table 1 Effect of glycosylated SPI on the whiteness of myof i brillar protein gels
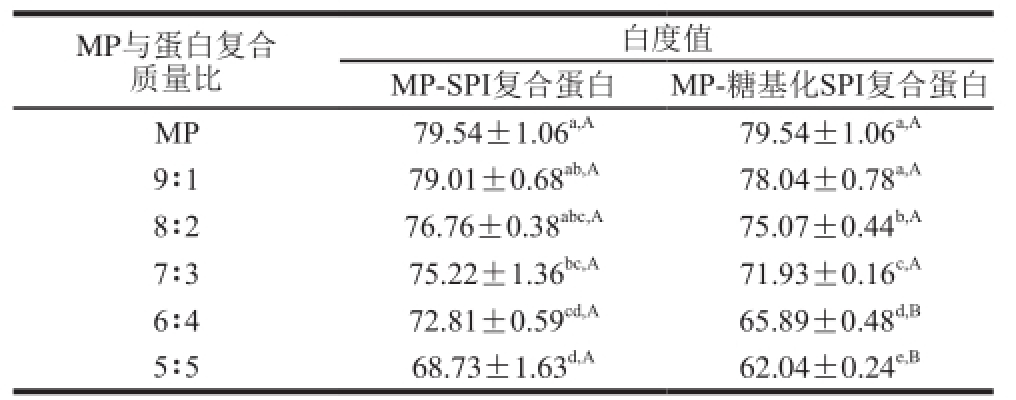
注:肩标小写字母表示同一列的显著性分析,肩标大写字母表示同一行的显著性分析;字母不相同表示两者间存在显著差异(P<0.05),字母相同表示两者间差异不显著(P>0.05)。
不同比例的MP与天然SPI、糖基化SPI混合凝胶的白度值变化如表1所示,MP与天然SPI、糖基化SPI混合凝胶的白度值均低于纯MP凝胶,并且随着天然SPI和糖基化SPI添加比例的增大,混合凝胶的白度值呈逐渐变小的趋势。这与杨振[21]的研究结果一致,向MP凝胶中添加SPI会使得其白度值降低。得到这一结果是因为天然SPI本身呈现淡黄色,并且SPI在糖基化改性过程中会形成褐色色素类物质。但通过差异显著性分析可以发现,MP-糖基化SPI以9∶1混合形成凝胶的白度值与纯MP凝胶白度值差异不显著(P>0.05);在复合比例为9∶1、8∶2、7∶3时,MP-糖基化SPI混合凝胶的白度值略低于MP-SPI复合凝胶,但差异不显著(P>0.05),随着SPI比例的进一步增加,两者间的差异显著(P<0.05)。因此,在将糖基化SPI应用于肉制品时,为了避免影响肉制品的感官颜色,应选择适当的复配比例。
2.4.3 糖基化SPI对MP凝胶微观结构的影响

图5 糖基化SPI对MP凝胶微观结构的影响
Fig. 5 Effect of glycosylated SPI on the microstructure of myof i brillar protein gels
扫描电子显微镜是观察凝胶微观结构的主要方法,通过扫描电子显微镜观察蛋白质凝胶的微观结构可以直观地反映凝胶的结构与强度的关系。图5展现的是MP凝胶、MP与SPI和糖基化SPI按不同比例制备的混合凝胶的微观结构。由于实验条件有限,MP-糖基化SPI以6∶4、5∶5形成的凝胶较弱,取样未成功,因此没有得到其微观结构图。可以看出,MP凝胶有较好的空间网络结构,其结构均匀致密,线条纤细,形成的网格细小,蛋白质间相互交联,没有明显的空洞。而随着SPI添加量的增大,混合凝胶所形成的网络结构越来越松散不规则,线条粗细不均匀,形成大小不同的空洞和断层。这都是由于SPI的不规则碎片和小分子无序混乱地与MP混合,阻碍了MP形成较好的网络结构[31]。当MP-SPI混合比例为6∶4和5∶5时几乎不能观察到网络结构,只能观察到SPI的不规则碎片。这与马宇翔等[27]的研究结果也是一致的,其发现添加SPI的混合凝胶的结构变得粗糙。从图5还可以发现,在相同比例条件下,MP-糖基化SPI形成的凝胶的网络结构要好于MP-SPI所形成的。尤其是以9∶1混合的MP-糖基化SPI凝胶的网络结构能与纯MP凝胶相媲美,网络结构也很致密均匀,但略有空洞形成。由此可以看出,蛋白凝胶微观结构决定了凝胶的质构特性,网络结构越致密均匀,其硬度和弹性越好。这与图4所展现的凝胶硬度和弹性是一致的。
通过对复合蛋白乳化性质、浊度、表面疏水性及凝胶质构特性和白度值的测定,并对凝胶微观结构进行观察可知:MP-糖基化SPI的乳化活性和乳化稳定性均较MP-SPI显著提升(P<0.05),并且随着糖基化SPI所占比例的增大乳化活性呈上升趋势;MP-糖基化SPI的浊度与表面疏水性高于MP-SPI,表面疏水性随着糖基化SPI所占比例的增加呈现上升的趋势,并且在同一复合比例条件下,MP-糖基化SPI的表面疏水性显著高于MP-SPI(P<0.05);MP-糖基化SPI复合凝胶的硬度和弹性均显著优于MP-SPI复合凝胶(P<0.05);在一定比例条件下,MP-糖基化SPI复合凝胶的微观结构比MP-SPI复合凝胶更加致密均匀。通过本实验的研究得出,糖基化SPI与天然SPI相比对混合蛋白的功能性质起到了积极的作用,从而拓宽了SPI在食品工业(尤其是肉制品)中的应用。
参考文献:
[1] 于莉萍, 迟玉杰, 刘红玉. 糖基化提高大豆分离蛋白凝胶性的工艺条件[J]. 食品与发酵工业, 2012, 38(3): 100-104. DOI:10.13995/ j.cnki.11-1802/ts.2012.03.032.
[2] 徐真真, 黄国清, 肖军霞. 干热条件下大豆分离蛋白-木糖美拉德反应研究[J]. 粮油食品科技, 2015, 23(2): 26-30. DOI:10.16210/ j.cnki.1007-7561.2015.02.015.
[3] 李杨, 梁婧, 江连洲, 等. 与大豆分离蛋白复合体系乳化性的研究[J]. 食品工业科技, 2014, 35(23): 140-144. DOI:10.13386/ j.issn1002-0306.2014.23.020.
[4] GAN C Y, CHENG L H, EASA A M. Physicochemical properties and microstructures of soy protein isolate gels produced using combined cross-linking treatments of microbial transglutaminase and Maillard cross-linking[J]. Food Research International, 2013, 41(6): 600-605. DOI:10.1016/j.foodres.2008.03.015.
[5] RAY M, ROUSSEAU D. Stabilization of oil-in-water emulsions using mixtures of denatured soy whey proteins and soluble soybean polysaccharides[J]. Food Research International, 2013, 52(1): 298-307. DOI:10.1016/j.foodres.2013.03.008.
[6] 梁婧, 王中江, 李丹, 等. 改性大豆分离蛋白与肌原纤维蛋白共混体系乳化性及凝胶性研究[J]. 中国粮油学报, 2015, 30(8): 37-41. DOI:1003-0174(2015)08-0037-05.
[7] 张明成. 酶水解结合酶交联处理改善大豆分离蛋白功能特性及其在肉制品中的应用[D]. 哈尔滨: 东北农业大学, 2015: 17-79.
[8] 孔杭如, 孙莎, 唐善虎, 等. 牦牛肌原纤维蛋白与热改性大豆分离蛋白共凝胶条件的优化[J]. 食品科学, 2015, 36(14): 44-49. DOI:10.7506/spkx1002-6630-201514009.
[9] 欧阳艳华, 汪少芸, 周红, 等. 鸡肉蛋白和大豆蛋白的相互作用和机理研究[J]. 中国食品学报, 2011, 11(4): 90-95. DOI:10.16429/j.1009-7848.2011.04.030.
[10] AKHTAR M, DICKINSON E. Whey protein-maltodextrin conjugates as emulsifying agents: an alternative to gum arabic[J]. Food Hydrocolloids, 2014, 21(4): 607-616. DOI:10.1016/ j.foodhyd.2005.07.014.
[11] 王松, 夏秀芳, 黄莉, 等. 湿法糖基化改性对大豆分离蛋白功能性质的影响[J]. 食品科学, 2014, 35(9): 38-42. DOI:10.7506/spkx1002-6630-201409009.
[12] LIU G, XIONG Youling L.. Contribution of liqid and protein oxidation to rheological differences between chicken white and red muscle myof i brillar proteins[J]. Journal of Agricultural and Food Chemistry, 1996, 44(3): 779-784.
[13] AGYARE K K, ADDO K, XIONG Youling L.. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81. DOI:10.1016/ j.foodhyd.2007.11.012.
[14] BENJAKUL S, BAUER F. Biochemical and physicochemical changes in catfish (Silurus glanis Linne) muscle as influenced by different freeze-thaw cycles[J]. Food Chemistry, 2001, 72(2): 207-217. DOI:10.1016/S0308-8146(00)00222-3.
[15] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/ j.foodhyd.2007.11.012.
[16] PARK J W. Functional protein additives in surimi gels[J]. Journal of Food Science, 1994, 59(3): 525-527.
[17] 曹雪妍, 李新华. 大豆分离蛋白的酶改性与水解处理对猪肉火腿肠品质的影响[J]. 食品科技, 2015, 40(2): 139-144. DOI:10.13684/ j.cnki.spkj.2015.02.030.
[18] 刘建华, 丁玉庭. 糖基化反应改善鱼肉肌原纤维蛋白功能特性及其机制研究进展[J]. 食品与发酵工业, 2012, 38(8): 132-136. DOI:10.13995/j.cnki.11-1802/ts.2012.08.020.
[19] VENTUREIRA J, MARTINEZ E N, ANON M C. Stability of oil: water emulsions of amaranth proteins. Effect of hydrolysis and pH[J]. Food Hydrocolloids, 2010, 24(6/7): 551-559.
[20] 熊拯. 大豆分离蛋白溶解性的影响因素研究[J].农产品加工(学刊), 2012(3): 67-70. DOI:10.3969/jissn.1671-9646(X).2012.03.016.
[21] 杨振. 魔芋粉、转谷氨酰胺酶和大豆分离蛋白对鲤鱼肌原纤维蛋白凝胶特性的影响[D]. 哈尔滨: 东北农业大学, 2012: 37.
[22] CHAN J K, GILL T A, PAULSON A T. Cross-linking of myosin heavy chain from cod, herring and silver hake during thermal setting[J]. Journal of Food Science, 1992, 57(4): 906-912.
[23] SANKAR T V, RAMACHANDRAN A. Thermal stability of myof i brillar protein from Indian major carps[J]. Journal of the Science of Food and Agriculture, 2005, 85(4): 563-568.
[24] TOTOSAUS A, MONTEJANO J G, SALAZAR J A, et al. A review of physical and chemical protein-gel induction[J]. International Journal of Food Science and Technology, 2002, 37(6): 589-601.
[25] 曹雪妍, 李新华. 大豆分离蛋白的酶改性与水解处理对猪肉火腿肠品质的影响[J]. 食品科技, 2015, 40(2): 139-144. DOI:10.13684/ j.cnki.spkj.2015.02.030.
[26] 陈怡岑, 彭宏刚, 曹艳婷, 等. TG和大豆分离蛋白对猪PSE肉丸保水性和硬度的影响[J]. 食品工业, 2015, 36(10): 218-222.
[27] 马宇翔, 杨国龙, 周瑞宝, 等. 大豆分离蛋白对盐溶肌肉蛋白受热形成凝胶的影响[J]. 河南工业大学学报(自然科学版), 2008, 29(6): 22-25. DOI:10.16433/j.cnki.issn1673-2383.2008.06.0070.
[28] DAMODARAN S. Refolding of thermally unfolded soy proteins during the cooling regime of the gelation process: effect on gelation[J]. Journal of Agricultural and Food Chemistry, 1988, 36(2): 262-269.
[29] FENG H, XIONG Youling L.. Interaction of myofibrillar and preheated soy proteins[J]. Food Science, 2002, 67(8): 2851-2856.
[30] 逯昕, 华欲飞. 酶改性制备低黏度弱凝胶性大豆分离蛋白[J]. 中国油脂, 2008, 33(2): 18-21. DOI:1003-7969(2008)02-0018-04.
[31] 张秋会, 李苗云, 高晓平. 11S大豆球蛋白对鸡肌球蛋白凝胶品质特性的影响[J]. 现代食品科技, 2015, 31(3): 103-107. DOI:10.13982/ j.mfst.1673-9078.2015.3.018.
Effect of Glycosylated Soybean Protein Isolate on Functional Properties of Myof i brillar Protein
WANG Bo, YI Dong, XIE Mengying, PAN Nan, ZHANG Lili*, XIA Xiufang*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:Glycosylated soybean protein isolate (SPI) was prepared by reaction between SPI and glucose at a ratio of 1:1 (m/m) at 70 ℃ for 4 h, and its blends with myof i brillar protein (MP) at different ratios of 9:1, 8:2, 7:3, 6:4 and 5:5 (m/m) were determined for emulsifying properties, turbidity, surface hydrophobicity and gel properties (texture properties, whiteness and microstructure) in order to elucidate the effect and mechanism of glycosylated SPI on the functional properties of MP. The results showed that the emulsifying properties and surface hydrophobicity of glycosylated SPI and MP blends were significantly improved compared with MP (P < 0.05). The turbidity of the blended proteins rose with increasing temperature (30-80 ℃), but it decreased with higher proportion of glycosylated SPI. The gel hardness and springiness of MP and glycosylated SPI blends were signif i cantly better than those of MP and native SPI blends (P < 0.05), and the gel microstructure was more compact and uniform than that of MP and native SPI blends. Compared with MP, the gel whiteness of the mixed proteins signif i cantly decreased, except for no signif i cant difference at a mixing ratio of 9:1 (P > 0.05).
Key words:soybean protein isolate; glycosylation; myof i brillar protein; emulsifying properties; gel properties
DOI:10.7506/spkx1002-6630-201707011
中图分类号:TQ936.2
文献标志码:A
文章编号:1002-6630(2017)07-0063-07
引文格式:
王博, 伊东, 谢梦颖, 等. 糖基化大豆分离蛋白对肌原纤维蛋白功能特性的影响[J]. 食品科学, 2017, 38(7): 63-69. DOI:10.7506/spkx1002-6630-201707011. http://www.spkx.net.cn
WANG Bo, YI Dong, XIE Mengying, et al. Effect of glycosylated soybean protein isolate on functional properties of myof i brillar protein[J]. Food Science, 2017, 38(7): 63-69. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201707011. http://www.spkx.net.cn
收稿日期:2016-04-28
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102208);黑龙江省博士后资助项目(LBH-15013);黑龙江应用技术研究与开发计划重大项目(GA15B302)
作者简介:王博(1992—),女,硕士研究生,研究方向为畜产品加工。E-mail:wangbo9214@163.com
*通信作者:张莉丽(1981—),女,副教授,博士,研究方向为发酵和蛋白质工程。E-mail:Lilizhang2011@163.com夏秀芳(1973—),女,教授,博士,研究方向为畜产品加工。E-mail:Xxfang524@163.com