童 微1,余 强1,李 虎1,崔武卫1,2,聂少平1,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.加拿大农业与农业食品部圭尔夫食品研究中心,加拿大 安大略 圭尔夫 NIG 5C9)
摘 要:采用水提醇沉法结合冻融制备高纯度铁皮石斛多糖,并利用硫酸化、脱乙酰化及羧甲基化修饰方法对铁皮石斛多糖进行化学修饰,探讨不同方法修饰的铁皮石斛多糖对RAW264.7巨噬细胞免疫活性影响。结果表明,铁皮石斛纯多糖(purif i ed polysaccharides of Dendrobium off i cinale,DOP)的中性糖含量较高,而糖醛酸及蛋白质含量则较低,分别为87.37%、3.19%和0.51%,羧甲基化及硫酸化显著降低了铁皮石斛多糖的中性糖含量。红外分析结果显示硫酸化、脱乙酰化及羧甲基化修饰衍生物均已成功制备。高性能凝胶渗透色谱法测定铁皮石斛多糖分子质量为960 kD,硫酸化及羧甲基化修饰显著增加了其分子质量。体外实验研究发现,硫酸化和脱乙酰化修饰的铁皮石斛多糖能够增强RAW264.7巨噬细胞的免疫活性,而羧甲基化修饰则表现为显著的抑制作用,表明不是所有的官能团接枝改性都可以改善铁皮石斛多糖对免疫活性的影响。
关键词:铁皮石斛;多糖;化学修饰;RAW264.7巨噬细胞;免疫活性
铁皮石斛为兰科石斛属多年生附生草本植物,被列为石斛上品,是一种药食两用植物,其茎可直接食用,亦可将其作为原料进行泡茶、煮粥、煲汤及浸酒,具有益胃生津、滋阴清热等功效[1-3]。此外,食用铁皮石斛还可以提高机体的健康水平、预防慢性疾病的发生[4]。随着铁皮石斛功效研究的不断深入,其在食品工业中的应用也得到了迅速的发展。目前,市场上的铁皮石斛产品主要包括铁皮枫斗、铁皮石斛颗粒冲剂、铁皮石斛花茶、铁皮石斛茶叶及铁皮石斛功能性饮料等产品。
分子修饰是指利用化学、物理和生物学等手段对其结构进行修饰,从而得到具有多样生物活性衍生物的方法,包括化学、物理及生物3 种修饰方法。其中,化学修饰是常用方法,主要包括硫酸化、乙酰化、羧甲基化、磷酸化、烷基化、硒化等。在构效关系研究中发现,一些天然多糖本身不具有或具有较弱的生物活性[5],由于活性的发挥与其结构密切相关,因此可以利用化学修饰的方法对多糖进行衍生以改善其生物活性。例如,硫酸化迷果芹多糖能够有效清除1,1-二苯基-2-三硝基苯肼自由基、羟自由基和超氧阴离子自由基,提高其抗氧化活性[6]。硒化的百合多糖能够显著促进淋巴细胞的增殖,提高鸡外周血淋巴细胞白细胞介素(interleukin,IL)-2、IL-6和干扰素(interferon,IFN) -γ mRNA的表达,从而提高其免疫活性[7]。乌龙茶多糖经硫酸化和乙酰化修饰后其抗氧化活性均有所提高[8]。
铁皮石斛多糖是一种天然乙酰化多糖,含有β-1,4-D-葡甘露聚糖的主链结构,在β-1,4-D-甘露糖残基的C2位的O上连有乙酰基,是一种天然的乙酰化多糖[4,9-10],具有抗肿瘤、增强免疫力、抗氧化等多种功效[11-13],其中免疫调节活性备受关注[4,14-16]。近年来研究还发现,铁皮石斛多糖对机体的肠道免疫和结肠的健康也具有一定的促进作用[4,9]。然而,对铁皮石斛多糖目前的研究主要集中在其自身结构以及生理活性方面,对其的化学修饰衍生方面的研究报道还较少。本实验对铁皮石斛多糖进行硫酸化、脱乙酰化及羧甲基化修饰,并对衍生化多糖的结构特征及对体外免疫活性的影响进行研究,旨在比较不同官能团的引入或去除对多糖结构及其免疫活性的影响,从而为铁皮石斛多糖构效关系的研究提供一定的理论依据,同时也为开发新型多糖及促进铁皮石斛产业的发展奠定基础。
1.1 材料与试剂
铁皮石斛干茎由云南金九地生物科技有限公司提供;小鼠巨噬细胞株RAW264.7购自中国科学院上海生科院细胞资源中心。
DMEM(Dulbecco’s modif i ed Eagle medium)培养基美国Thermo公司;胎牛血清 以色列Biological Industries公司;耐高温α-淀粉酶 杰能科(中国)生物工程有限公司;脂多糖(lipopolysaccharide,LPS)、异硫氰酸荧光素标记葡聚糖(fluorescein isothiocyanatedextran,FITC-dextran)、葡萄糖、阿拉伯糖、甘露糖、半乳糖、鼠李糖、木糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸、核糖标准品 美国Sigma公司;咔唑 上海国药集团;牛血清白蛋白 美国Amresco公司;氯磺酸、一氯乙酸 萨恩化学技术(上海)有限公司;浓硫酸、无水碳酸钠、浓盐酸、氢氧化钠、吡啶、苯酚、正己烷、95%乙醇、无水乙醇等均为国产分析纯。
1.2 仪器与设备
NICOLET-5700傅里叶红外光谱仪 美国尼高力仪器公司;FACS Calibur流式细胞仪 美国BD公司;高效分子排阻色谱系统 美国Brookhaven公司;TGL-16GA CO2培养箱、Varioskan Flash全波长多功能酶标仪 美国Thermo公司;超净工作台 吴江市净化设备总厂;倒置显微镜 日本Olympus公司;TU-1900双光束紫外-可见分光光度计 北京普析通用有限责任公司。
1.3 方法
1.3.1 铁皮石斛多糖的纯化
参考文献:方法[17],将50 g铁皮石斛干茎粉碎至80 目以下,分别依次加入正己烷、95%乙醇溶液,依次各搅拌48 h。过滤除去浸泡液,收集残渣,然后加入4 倍质量的去离子水,于70 ℃搅拌提取3 h,离心收集上清液,剩余残渣再次进行提取。收集、混合提取所得上清液,真空浓缩后加入乙醇进行沉淀,静置过夜,离心(25 ℃,4 800 r/min,10 min)收集沉淀。所得沉淀再加入去离子水进行复溶,冷冻干燥后得到铁皮石斛粗多糖样品(crude polysaccharides of Dendrobium off i cinale,DOC)。取10 g DOC溶于1 000 mL去离子水中,70 ℃加热溶解,加入0.3 mL α-淀粉酶(酶活力为20 000 U/mL),酶解2 h后冷却至室温,“冻融-离心”4 次(4 ℃,10 000×g,20 min),最后一次离心所得上清液透析3 d,然后加入乙醇沉淀,静置过夜,离心收集沉淀,所得样品经冷冻干燥后得到铁皮石斛纯多糖(purified polysaccharides of Dendrobium off i cinale,DOP)样品。
1.3.2 DOP的化学修饰
1.3.2.1 DOP的硫酸化改性
参照文献[18-19],冰浴条件下,将氯磺酸逐滴加入到吡啶中进行反应以制备硫酸酯化试剂,其中氯磺酸和吡啶的体积比为1∶4。将15 mL硫酸酯化试剂逐滴加入铁皮石斛多糖质量浓度为10 mg/mL的甲酰胺溶液中,60 ℃反应2 h,然后用4 mol/L NaOH中和,离心收集上清液并进行透析72 h,真空浓缩后加入无水乙醇沉淀,静置过夜,离心(25℃,4 800 r/min,10 min)收集沉淀。所得沉淀用去离子水复溶,冷冻干燥得到硫酸化铁皮石斛多糖样品(sulfated DOP,SDOP)。取代度(DS)测定采用氯化钡-明胶法[20],以硫酸钾为换算当量,取代度按公式(1)计算[21]。
式中:DS为取代度;S为硫酸基含量/%。
1.3.2.2 DOP的脱乙酰化改性
参考文献[22],将50 mg DOP样品溶解于20 mL去离子水中,冷却至4 ℃,缓慢加入等体积的冷Na2CO3溶液(0.2 mol/L),4 ℃条件下反应1 h。反应结束后,1 mol/L HCl溶液调节pH值至4.5,然后进行透析48 h,经真空浓缩及冷冻干燥后得到脱乙酰化铁皮石斛多糖样品(deacetylated DOP,DADOP)。采用酸碱滴定法测定取代度[23],乙酰基含量及脱乙酰度通过公式(2)、(3)计算[24]。

式中:A为乙酰基含量/%;V0为加入NaOH溶液的体积/mL;c0为NaOH浓度/(mol/L);V1为消耗的HCl体积/mL;c1为HCl浓度/(mol/L);m为样品质量/g;A1为DOP样品中乙酰基含量/%;A0为脱乙酰化后样品中乙酰基含量/%。
1.3.2.3 DOP的羧甲基化改性
参考文献[25],将100 mg D O P样品溶解于40 mL 2.5mol/L NaOH溶液中,室温搅拌30 min,加入2.2 g一氯乙酸,50 ℃反应3 h,反应结束后加入冰醋酸中和,然后进行透析72 h,经真空浓缩及冷冻干燥得到羧甲基化铁皮石斛多糖样品(caboxymethylated DOP,CMDOP)。采用经典酸洗法[26]测定取代度(DS),按式(4)、(5)计算[26]。
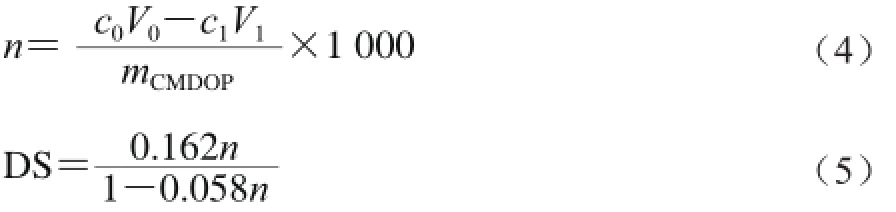
式中:n为每克样品消耗NaOH的物质的量/(mmol/g);V0为加入NaOH溶液的体积/mL;c0为NaOH溶液浓度/(mol/L);V1为消耗HCl溶液的体积/mL;c1为HCl溶液浓度/(mol/L);mCMDOP为羧甲基化铁皮石斛多糖的质量/mg。
1.3.3 铁皮石斛多糖化学修饰衍生物结构分析
1.3.3.1 傅里叶红外光谱分析
分别取一定量DOP、SDOP、DADOP以及CMDOP样品,采用溴化钾压片法制样,然后采用傅里叶红外光谱仪在400~4 000 cm-1范围内进行扫描。
1.3.3.2 理化性质分析
以甘露糖为标准品,采用苯酚-硫酸法[27]测定中性糖含量,测定波长为490 nm;以半乳糖醛酸为标准品,采用硫酸-咔唑法[28]测定糖醛酸含量,测定波长为530 nm;以牛血清白蛋白为标准品,采用考马斯亮蓝法[29]测定蛋白质含量,测定波长为595 nm。
1.3.3.3 分子质量测定
采用高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)法[30]进行测定。利用Agilent 1260高效液相色谱仪进行分析,选用UltrahydrogelTM线性色谱柱(300 mm×7.8 mm)以及RI2410示差和DAD2996紫外检测器。样品测定的色谱条件为:流动相为0.02% NaN3溶液;流速为0.6 mL/min;检测器温度和柱温均为35 ℃;进样量20 μL。
1.3.4 DOP化学修饰前后免疫活性测定
1.3.4.1 RAW264.7巨噬细胞增殖效应测定
采用细胞计数试剂盒(cell counting kit-8,CCK-8)法测定细胞增殖作用。将RAW264.7巨噬细胞按4×105个/mL接种于96 孔细胞培养板中,分别加入DOP、SDOP、DADOP以及CMDOP样品(本实验室前期研究表明(论文未公开),DOP在质量浓度为40 µg/mL时活性最佳,故本研究所用多糖样品均采用终质量浓度为40 µg/mL),同时设置1 µg/mL的LPS阳性对照孔、正常对照孔(含有巨噬细胞、CCK-8溶液而没有药物溶液)及阴性对照孔(含有培养基和CCK-8溶液而没有巨噬细胞),每组均设6个复孔。在含5% CO2的37 ℃培养箱中培养24 h,然后加入10 μL的CCK-8试剂,1.5 h后终止培养,450 nm波长处检测光密度(OD)值。细胞增殖率按公式(6)计算。
式中:A1为含有巨噬细胞、CCK-8溶液和药物溶液孔的吸光度;A0为阴性对照孔的吸光度;A2为正常对照孔的吸光度。
1.3.4.2 RAW264.7 巨噬细胞吞噬效应测定
采用FITC-dextran法测定巨噬细胞的吞噬作用。将RAW264.7巨噬细胞按每孔2×106个/孔接种于6 孔细胞培养板中,给药方式同1.3.4.1节。24 h后去上清液,磷酸盐缓冲溶液(phosphate buffer saline,PBS)清洗2 次,收集细胞于1.5 mL EP管中,离心(1 500 r/min,5 min)去上清液,分别加入100 μL PBS,然后分别加入10 μL 1 mg/mL FITC-dextran,37 ℃孵育1 h,用含2%胎牛血清的冷PBS中止反应,巨噬细胞清洗2次,0.5 mL PBS重悬,流式细胞仪检测分析。
1.4 数据统计分析
实验数据采用 ±s表示。应用SPSS 19.0统计软件进行单因素方差分析和t检验。P<0.05表示差异显著,P<0.01表示差异极显著。
±s表示。应用SPSS 19.0统计软件进行单因素方差分析和t检验。P<0.05表示差异显著,P<0.01表示差异极显著。
2.1 DOP化学修饰前后的理化性质分析
表1 DOP化学修饰衍生物取代度、得率及化学成分分析
Table 1 Degree of substitution, yield and chemical composition of chemically modified poly saccharides from Dendrobium of ficinale
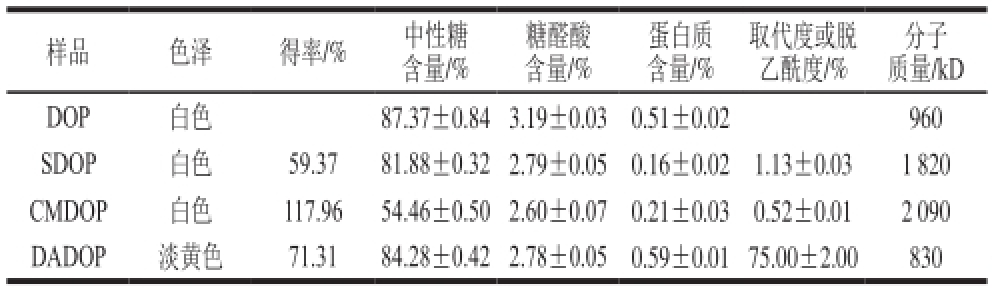
注:得率为所得提取物质量占原料干质量的百分比。
由表1可知,DOP中性糖含量较高,为87.37%,而糖醛酸及蛋白质含量则较低,分别为3.19%和0.51%。脱乙酰化修饰对其理化性质无显著改变,而羧甲基化及硫酸化显著降低了铁皮石斛多糖的中性糖含量,这与Chen Yi等[31-32]的研究结果一致,表明该现象可能与硫酸化及羧甲基化反应时的酸性环境而引起的多糖降解及官能团的引入有关。
由表1可知,SDOP取代度较高,为1.13,但得率较低,仅为59.37%。羧甲基化得率虽高,但其取代度较低,测定结果为0.52。DADOP脱乙酰度为75.00%,其得率为71.31%。
2.2 傅里叶红外光谱分析
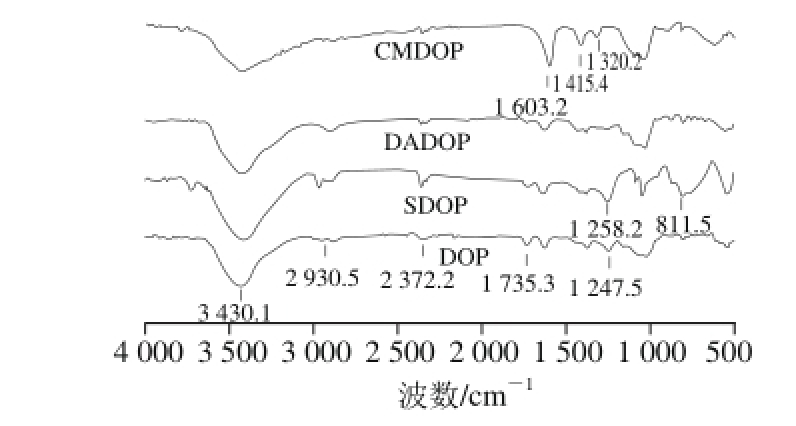
图1 DOP及其化学修饰衍生物的红外光谱分析
Fig. 1 Infrared spectral analysis of native polysaccharides and chemically modif i ed polysaccharides from Dendrobium off i cinale
由图1可知,DOP、SDOP、DADOP和CMDOP在3 430、2 930cm-1和2 372cm-1附近均有吸收峰,其中,3 430 cm-1附近的宽吸收峰是糖类的O—H伸缩振动,2 930 cm-1和2 372 cm-1处附近的吸收峰分别为糖类C—H的伸缩振动及变角振动,表明DOP及其衍生产物均具有多糖的特征吸收峰。与DOP相比,SDOP在1 258 cm-1和811 cm-1处产生了明显的吸收峰,其中1 258 cm-1处为S=O伸缩振动的特征吸收峰,811 cm-1处为S—O—C伸缩振动的特征吸收峰[31],表明SDOP为DOP硫酸化衍生产物。与DOP相比,DADOP在1 735、1 245 cm-1处吸收峰均发生显著变化,其中1 735、1 247 cm-1处附近的吸收峰分别为乙酰基的羰基的C=O和C—O伸缩振动[32],表明DADOP为DOP脱乙酰化衍生物。与DOP相比,CMDOP在1 603 、1 415 cm-1和1 320 cm-1处均产生了明显的吸收峰,其中1 603 、1 320cm-1处附近分别为羧基(COO—)的C=O非对称伸缩振动和对称伸缩振动的特征吸收峰,1 415 cm-1处附近为甲基的C—H的变角振动吸收峰[33],表明CMDOP为DOP羧甲基化衍生物。
2.3 分子质量
分子质量分布由表1可知。根据各标准葡聚糖得到标准曲线,计算得出DOP、SDOP、DADOP、CMDOP分子质量分别为0.96×106、1.82×106、0.83×106、2.09×106D。此外,观察SDOP、DADOP和CMDOP的检测信号发现,SDOP和DADOP均主要为单一峰,CMDOP则具有3 个峰,表明羧甲基化修饰过程中DOP发生了较强烈的降解。
2.4 DOP化学修饰前后免疫活性测定
2.4.1 DOP化学修饰衍生物对RAW264.7巨噬细胞增殖的影响
表2 化学修饰衍生物对RAW264.7细胞增殖率的影响
Table 2 Effects of chemically modif i ed polysaccharides from Dendrobium off i cinale on the proliferation of RAW264.7 cells

注:NC.正常对照组;**.与NC相比差异极显著(P<0.01);Δ.与DOP相比差异显著(P<0.05);ΔΔ.与DOP相比差异极显著(P<0.01)。
CCK-8实验结果(表2)显示,与正常对照组相比,DOP、SDOP和DADOP均能显著促进RAW264.7巨噬细胞的增殖,且差异极显著(P<0.01),而CMDOP则无显著差异,表明DOP、SDOP、DADOP及CMDOP均无明显的细胞毒性作用。与DOP相比,SDOP能够显著促进RAW264.7巨噬细胞的增殖(P<0.05),这可能与SDOP具有较高的硫酸取代度有关[34]。DADOP无明显的促进作用,而CMDOP极显著抑制了巨噬细胞的增殖作用(P<0.01),推测这可能与DOP在羧甲基化修饰过程中发生的强烈降解及分子质量显著增加有关。
2.4.2 化学修饰衍生物对RAW264.7巨噬细胞吞噬效应的影响
FITC-dextran 实验结果由图2可知,SDOP和CMDOP对RAW264.7巨噬细胞吞噬作用结果与增殖作用相一致,分别能够显著地促进及抑制(P<0.01)RAW264.7巨噬细胞吞噬作用,表明硫酸化修饰能够增强铁皮石斛多糖的免疫活性,而羧甲基化则抑制其活性的发挥。DADOP细胞吞噬实验结果显示其能显著的增强RAW264.7巨噬细胞的吞噬作用(P<0.05),表明脱乙酰化修饰能够在一定程度上增强铁皮石斛多糖免疫活性。
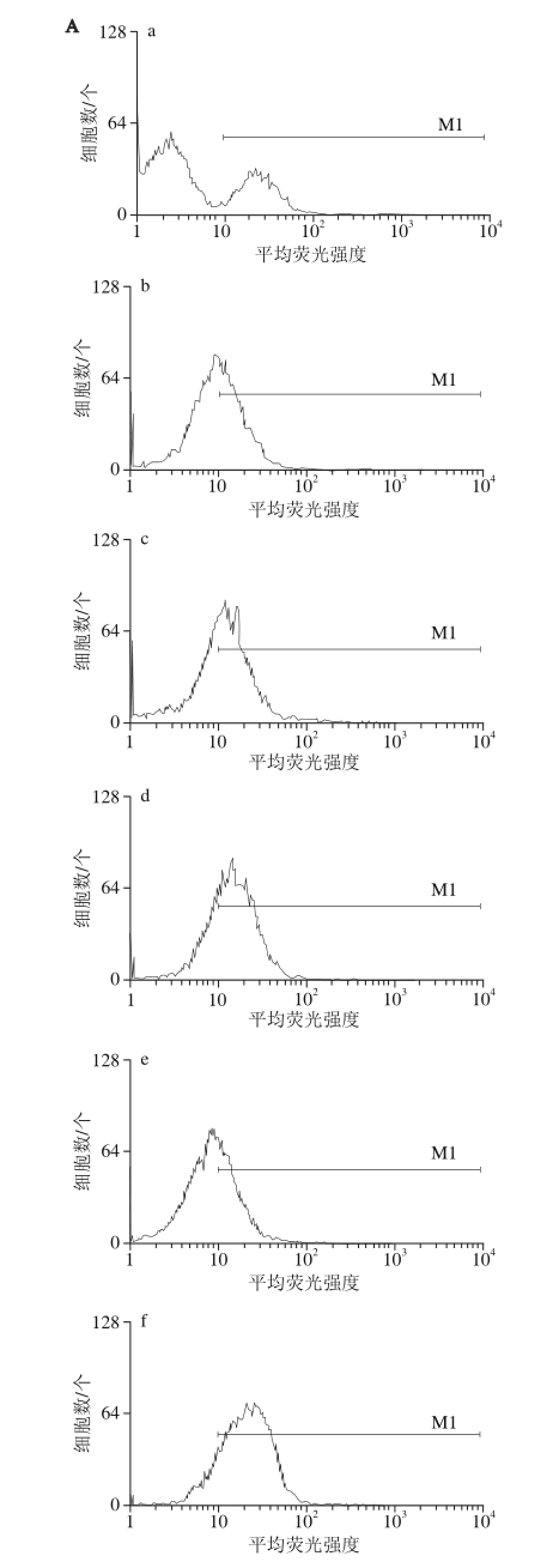

图2 化学修饰衍生物对RAW264.7巨噬细胞吞噬的影响
Fig. 2 Effects of chemically modif i ed polysaccharides from Dendrobium off i cinale on the phagocytosis of FITC-dextran in RAW264.7 cells
理化性质分析表明DOP中性糖含量较高,为87.37%,而糖醛酸及蛋白质含量则较低,分别为3.19%和0.51%。脱乙酰化修饰对其理化性质无显著改变,而羧甲基化及硫酸化则显著降低铁皮石斛多糖的中性糖含量。红外光谱分析表明成功制备出3 种不同修饰方法的铁皮石斛多糖衍生物,其硫酸化取代度、脱乙酰度及羧甲基化取代度分别为1.13±0.03、(75±2)%和0.52±0.01,得率分别为59.37%、71.31%和117.96%。HPGPC分析表明DOP、SDOP、DADOP和CMDOP分子质量分别为0.96×106、1.82×106、0.83×106、2.09×106D,其中SDOP和CMDOP分子质量发生显著变化。体外细胞实验表明,硫酸化和脱乙酰化修饰能够增强铁皮石斛多糖的免疫活性,而羧甲基化修饰降低了铁皮石斛多糖的免疫活性,与王雪松[35]的研究结果一致,表明不是所有的官能团接枝改性都会增强其免疫活性的发挥。
本研究为铁皮石斛多糖今后的衍生化修饰以及提高免疫力方面研究提供了一定理论基础,但如何获得高活性多糖衍生物以及修饰后铁皮石斛多糖的免疫调节机制还尚未明确,有待于进一步的深入研究。
参考文献:
[1] 国家药典委员会. 中国药典(2010年版一部)[M]. 北京: 中国医药科技出版社, 2010: 265-266.
[2] 曲卫玲, 刘焕兰, 尚子乂. 从历代文献探究石斛的发展脉络[J]. 亚太传统医药, 2011, 7(5): 133-134.
[3] 李青, 陈彦斌, 陈涛林, 等. 铁皮石斛茶的研制[J]. 湖南农业科学, 2014(22): 54-56. DOI:10.16498/j.cnki.hnnykx.2014.22.002.
[4] XIE S Z, LIU B, ZHANG D D, et al. Intestinal immunomodulating activity and structural characterization of a new polysaccharide from stems of Dendrobium off i cinale[J]. Food & Function, 2016, 7: 2789-2799. DOI:10.1016/j.foodres.2015.01.035.
[5] GAO G Z, JIAO Q C, LI X L, et al. Structural modification of pachymaran and the mechanism interaction between Azur A[J]. Acta Laser Biology Sinica, 2005, 14(3): 228-232.
[6] XU Y, SONG S, WEI Y, et al. Sulfated modification of the polysaccharide from Sphallerocarpus gracilis and its antioxidant activities[J]. International Journal of Biological Macromolecules, 2016, 87: 180-190. DOI:10.1016/j.ijbiomac.2016.02.037.
[7] HOU R, CHEN J, YUE C, et al. Modif i cation of lily polysaccharide by selenylation and the immune-enhancing activity[J]. Carbohydrate Polymers, 2016, 142: 73-81. DOI:10.1016/j.carbpol.2016.01.032.
[8] 李淑琴, 陈海霞, 曲志爽, 等. 乌龙茶多糖的化学修饰及其理化性质和活性研究[J]. 食品安全质量检测学报, 2015(5): 1764-1769.
[9] ZHANG G, NIE S, HUANG X, et al. Study on Dendrobium off i cinale O-acetyl-glucomannan (Dendronan): part VII. Improving effects on colonic health of mice[J]. Journal of Agricultural and Food Chemistry, 2015, 64(12). DOI:10.1021/acs.jafc.5b03117.
[10] HUA Y F, ZHANG M, FU C X, et al. Structural characterization of a 2-O-acetylglucomannan from Dendrobium officinale stem[J] Carbohydrate Research, 2004, 339(13): 2219-2224. DOI:10.1016/ j.carres.2004.05.034.
[11] 刘亚娟, 王诗豪, 张铭, 等. 铁皮石斛多糖抗癌及免疫活性研究[J]. 广州化工, 2014, 42(10): 58-60. DOI:10.3969/ j.issn.1001-9677.2014.10.021.
[12] HUANG X, NIE S, CAI H, et al. Study on Dendrobium officinale O-acetyl-glucomannan (Dendronan): part IV. immunomodulatory activity in vivo[J]. Journal of Functional Foods, 2015, 15: 525-532. DOI:10.1016/j.foodres.2015.01.035.
[13] HUANG X, NIE S, CAI H, et al. Study on Dendrobium officinale O-acetyl-glucomannan (Dendronan): part VI. protective effects against oxidative stress in immunosuppressed mice[J]. Food Research International, 2015, 72: 168-173. DOI:10.1016/j.foodres.2015.01.035.
[14] 蔡海兰, 黄晓君, 聂少平, 等. 铁皮石斛多糖对RAW264.7细胞分泌TNF-α的影响[J]. 中国药理学通报, 2012, 28(11): 1553-1556.
[15] MENG L Z, LÜ G P, HU D J, et al. Effects of polysaccharides from different species of Dendrobium (Shihu) on macrophage function[J]. Molecules, 2013, 18(5): 5779-5791. DOI:10.3390/molecules18055779.
[16] XIA L, LIU X, GUO H, et al. Partial characterization and immunomodulatory activity of polysaccharides from the stem of Dendrobium off i cinale (Tiepishihu) in vitro[J]. Journal of Functional Foods, 2012, 4(1): 294-301. DOI:10.1016/j.jff.2011.12.006.
[17] XING X, CUI S W, NIE S, et al. Study on Dendrobium officinale O-acetyl-glucomannan (Dendronan): part I. extraction, purification, and partial structural characterization[J]. Bioactive Carbohydrates and Dietary Fibre, 2014, 4(1): 74-83. DOI:10.1016/j.bcdf.2014.06.004.
[18] YOSHIDA T, YASUDA Y, MIMURA T, et al. Synthesis of curdlan sulfates having inhibitory effects in vitro against AIDS viruses HIV-1 and HIV-2[J]. Carbohydrate Research, 1995, 276(2): 425-436. DOI:10.1016/0008-6215(95)00186-W.
[19] WANG Z J, XIE J H, KAN L J, et al. Sulfated polysaccharides from Cyclocarya paliurus reduce H2O2-induced oxidative stress in RAW264.7 cells[J]. International Journal of Biological Macromolecules, 2015, 80: 410-417. DOI:10.1016/j.ijbiomac.2015.06.031.
[20] KAWAI Y, SENO N, ANNO K. A modif i ed method for chondrosulfatase assay[J]. Analytical Biochemistry, 1969, 32(2): 314-321. DOI:10.1016/0003-2697(69)90091-8.
[21] WANG L, LI X, CHEN Z. Sulfated modif i cation of the polysaccharides obtained from defatted rice bran and their antitumor activities[J]. International Journal of Biological Macromolecules, 2009, 44(2): 211-214. DOI:10.1016/j.ijbiomac.2008.12.006.
[22] TAMAKI Y, KONISHI T, FUKUTA M, et al. Isolation and structural characterisation of pectin from endocarp of Citrus depressa[J]. Food Chemistry, 2008, 107(1): 352-361. DOI:10.1016/ j.foodchem.2007.08.027.
[23] 黄丹菲, 聂少平, 江乐明, 等. 乙酰化大粒车前子多糖的制备及其活性研究[J]. 食品科学, 2013, 34(22): 1-4. DOI:10.7506/spkx1002-6630-201322001.
[24] ELOMAA M, ASPLUND T, SOININEN P, et al. Determination of the degree of substitution of acetylated starch by hydrolysis,1H NMR and TGA/IR[J]. Carbohydrate Polymers, 2004, 57(3): 261-267. DOI:10.1016/j.foodchem.2007.08.027.
[25] 江乐明, 樊灿梅, 聂少平, 等. 羧甲基化大粒车前子多糖的制备及其生物活性研究[J]. 食品科学, 2013, 34(22): 10-14. DOI:10.1016/ j.carbpol.2016.01.032.
[26] EYLER R, KLUG E, DIEPHUIS F. Determination of degree of substitution of sodium carboxymethylcellulose[J]. Analytical Chemistry, 1947, 19(1): 24-27. DOI:10.1021/ac60001a007.
[27] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ ac60111a017.
[28] BLUMENKRANTZ N, ASBOE-HANSEN G. New method for quantitative determination of uronic acids[J]. Analytical Biochemistry, 1973, 54(2): 484-489. DOI:10.1016/0003-2697(73)90377-1.
[29] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. DOI:10.1016/0003-2697(76)90527-3.
[30] XIE J H, WANG Z J, SHEN M Y, et al. Sulfated modification, characterization and antioxidant activities of polysaccharide from Cyclocarya paliurus[J]. Food Hydrocolloids, 2016, 53: 7-15. DOI:10.1016/j.carbpol.2013.07.011.
[31] CHEN Y, ZHANG H, WANG Y, et al. Sulfated modification of the polysaccharides from Ganoderma atrum and their antioxidant and immunomodulating activities[J]. Food Chemistry, 2015, 186: 231-238. DOI:10.1016/j.foodchem.2014.10.032.
[32] CHEN Y, ZHANG H, WANG Y, et al. Acetylation and carboxymethylation of the polysaccharide from Ganoderma atrum and their antioxidant and immunomodulating activities[J]. Food Chemistry, 2014, 156: 279-288. DOI:10.1016/j.foodchem.2014.01.111.
[33] 张小平, 孙润广, 王小梅, 等. 化学修饰水提麦冬多糖WPOJ的抗肿瘤活性研究[J]. 食品与生物技术学报, 2014, 33(4): 368-373.
[34] WITVROUW M, CLERCQ E D. Sulfated polysaccharides extracted from sea algae as potential antiviral drugs[J]. General Pharmacology, 1997, 29(4): 497-511. DOI:10.1016/j.carbpol.2012.03.016.
[35] 王雪松. 积雪草多糖的分离纯化, 化学结构, 生物活性构效关系及葡聚糖和半乳聚糖的化学修饰研究[D]. 上海: 中国科学院上海生命科学院上海药物研究所, 2004: 151-154.
Chemical Modif i cation and Immunoregulatory Activity of Polysaccharides from Dendrobium off i cinale
TONG Wei1, YU Qiang1, LI Hu1, CUI Wuwei1,2, NIE Shaoping1,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. Agriculture and Agri-Food Canada, Guelph Food Research Centre, Guelph N1G 5C9, Canada)
Abstract:Highly pure polysaccharides from the dried stems of Dendrobium off i cinale were obtained by water extraction and alcohol precipitation combined with freeze-thawing, and they were further subjected to chemical modification by sulfation, deacetylation and carboxymethylation, respectively, with the aim of investigating the effects of these different modif i cations on the immunomodulatory activity of Dendrobium off i cinale polysaccharides in RAW264.7 macrophages. The results showed that Dendrobium off i cinale polysaccharides had high neutral sugar contents along with low contents of uronic acids and proteins, which were 87.37%, 3.19% and 0.51%, respectively. The neutral sugar content of Dendrobium off i cinale polysaccharides was signif i cantly reduced by sulfation and carboxymethylation. The Fourier transform infrared spectroscopic (FTIR) analysis indicated that sulfation, deacetylation and carboxymethylation derivatives were successfully prepared. The molecular weight of Dendrobium off i cinale polysaccharides measured by high-performance gel permeation chromatography (GPGPC) was 960 kD, while it was signif i cantly increased by sulfation and carboxymethylation. It was found that sulfation and deacetylation could enhance the immunomodulatory activity of Dendrobium off i cinale polysaccharides in vitro, while carboxymethylation had a signif i cant opposite effect, indicating that grafted modif i cation cannot necessarily improve the immunomodulatory activity of Dendrobium off i cinale polysaccharides.
Key words:Dendrobium off i cinale; polysaccharide; chemical modif i cation; RAW264.7 macrophages; immunomodulatory activity
DOI:10.7506/spkx1002-6630-201707025
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)07-0155-06
引文格式:
童微, 余强, 李虎, 等. 铁皮石斛多糖化学修饰及其对免疫活性的影响[J]. 食品科学, 2017, 38(7): 155-160. DOI:10.7506/ spkx1002-6630-201707025. http://www.spkx.net.cn
TONG Wei, YU Qiang, LI Hu, et al. Chemical modification and immunoregulatory activity of polysaccharides from Dendrobium off i cinale[J]. Food Science, 2017, 38(7): 155-160. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201707025. http://www.spkx.net.cn
收稿日期:2016-06-28
基金项目:江西省主要学科学术和技术带头人培养计划项目(20162BCB22008)
作者简介:童微(1991—),女,硕士研究生,研究方向为食品化学与分析。E-mail:tongwei19911123@163.com
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学与分析、食品安全与营养、保健食品和多糖生物化学。
E-mail:spnie@ncu.edu.cn