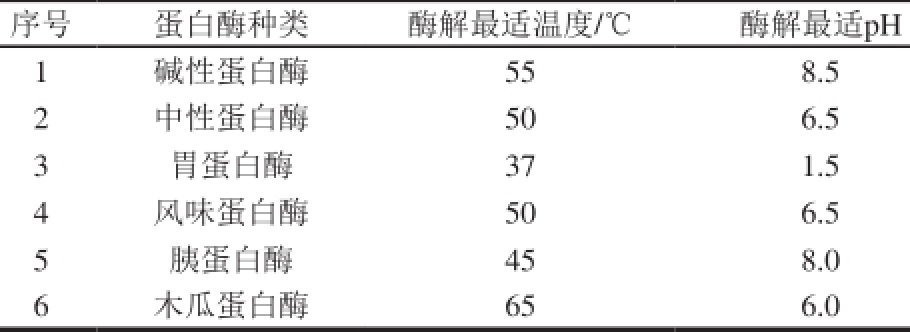
表1 不同蛋白酶酶解最适温度和最适pH值
Table 1 Optimal reaction temperature and pH for different proteases
郑志强1,2,李宝林3,郝利民2,郭顺堂1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中央军委后勤保障部军需装备研究所,北京 100010;3.江苏智荟生物科技有限公司,江苏 徐州 221222)
摘 要:小麦蛋白是小麦淀粉加工的副产物,酶解是提高小麦蛋白溶解性和功能性的有效方式,而酶解用酶种类可能对酶解产物的功能性如抗氧化活性有一定影响。采用碱性蛋白酶、中性蛋白酶、胃蛋白酶、风味蛋白酶、胰蛋白酶、木瓜蛋白酶6 种常用的蛋白酶分别对小麦蛋白进行酶解,并对酶解4 h后酶解物的多肽得率、分子质量分布、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、超氧阴离子自由基(O2-·)清除率、羟自由基(·OH)清除率等反映水解程度和抗氧化能力的主要指标进行评价。结果表明,风味蛋白酶酶解物中多肽得率最高,达91.44%,且分子质量小于3 000 D的多肽含量达76.9%;酶解物质量浓度为3 mg/mL时,木瓜蛋白酶酶解物对DPPH自由基清除作用最好,清除率为65.12%(P<0.01),其次是风味蛋白酶(58.43%)和碱性蛋白酶(55.29%);碱性蛋白酶酶解物对O2-·清除率效果最好,清除率为58.68%(P<0.01),其次是风味蛋白酶(49.25%);碱性蛋白酶和木瓜蛋白酶酶解物对·OH清除效果最佳,清除率分别为59.23%和58.16%。结果说明,蛋白酶种类对小麦蛋白酶解物抗氧化活性影响显著,风味蛋白酶对提高蛋白水解程度和生成小分子质量多肽的作用明显,而碱性蛋白酶、木瓜蛋白酶和风味蛋白酶对提高酶解产物抗氧化活性效果较好。
关键词:蛋白酶;小麦蛋白;抗氧化活性;自由基清除活性
我国是小麦生产大国,据国家统计局数据显示,2015年我国小麦产量达到1.3亿吨。但是,我国对小麦的深加工研究及应用较少,尤其是对小麦淀粉生产的副产物小麦蛋白的开发研究还处于起步阶段。小麦蛋白,俗称谷朊粉,其蛋白质含量高达75%~85%,主要由麦醇溶蛋白和麦谷蛋白组成[1]。小麦蛋白中的氨基酸组成比较齐全,是营养丰富、物美价廉的植物性蛋白源。近年来,随着对植源性蛋白质研究的深入,越来越多的研究者将具有良好的生物活性功能的植源蛋白水解物作为研究的重点。小麦肽作为小麦蛋白水解的主要产物,其中分子质量更小功能更强的小麦低聚肽成为了国内外研究的热点。2012年9月5日,卫生部发布《关于批准中长链脂肪酸食用油和小麦低聚肽作为新资源食品等的公告》(卫生部公告2012年第16号)批准小麦低聚肽作为新资源食品。因此,研究应用小麦肽不仅可实现小麦的高附加值,而且也可为开发功能性产品提供可靠的食源性基料。
国内外众多学者聚焦在小麦蛋白酶解物的抗氧化活性如清除机体自由基能力方面的研究。Žilić等[2]研究表明小麦蛋白酶解物的清除自由基能力强于豆类蛋白质酶解物的清除能力。Zhu Kexue等[3]同样研究表明小麦蛋白酶解物具有抗氧化性和游离自由基清除能力。曾瑜等[4]提出小麦肽在体内和体外均有良好的抗氧化效果。Wang Jinshui等[5]利用木瓜蛋白酶水解小麦蛋白得到具有抗氧化特性的水解产物。酶解是获得高抗氧化小麦肽的主要方式和关键环节,通过酶解改性,提高了小麦蛋白的溶解性,同时也提高了其抗氧化功能特性。因此,在酶解过程中,用酶的选择对于小麦蛋白酶解物抗氧化活性的高低至关重要,但关于小麦蛋白酶解用酶的文献报道多是采用指定的酶制剂进行酶解实验,而针对不同酶制剂对抗氧化活性的影响差异研究较少,为此,本研究将采用碱性蛋白酶、中性蛋白酶、胃蛋白酶、风味蛋白酶、胰蛋白酶、木瓜蛋白酶6 种常用的蛋白酶对小麦蛋白进行酶解,对酶解4 h后酶解物的多肽得率、分子质量分布、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、超氧阴离子自由基(O2-·)清除率、羟自由基(·OH)清除率等反映水解程度和抗氧化能力的主要指标进行评价,分析不同蛋白酶种类对小麦蛋白酶解物抗氧化活性的影响,确定产生高抗氧化活性的最佳用酶,进而对功能性小麦肽的制备与产业开发提供可靠的理论依据和参考借鉴。
1.1 材料与试剂
小麦蛋白(蛋白质含量81.91%) 商丘华阳生态农业发展有限公司。
碱性蛋白酶(217 434 U/mL)、中性蛋白酶(102 786 U/mL)、胃蛋白酶(67 800 U/g)、风味蛋白酶(30 916 U/mL)、胰蛋白酶(361 335 U/g)、木瓜蛋白酶(71 461 U/g) 诺维信(中国)生物技术有限公司;其他所用试剂均为国产分析纯。
1.2 仪器与设备
LC-20A高效液相色谱仪 日本岛津公司;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;CR22G高速冷冻离心机 日本日立公司;SHZ-B水浴恒温振荡器 上海五相仪器仪表有限公司。
1.3 方法
1.3.1 酶解工艺流程
小麦蛋白100 g→加900 mL去离子水混合→在设定温度(酶对应最适温度)的水浴锅中保温→用1.0 mol/L NaOH或HCl调节溶液的pH值于设定条件下(酶对应最适pH值)→加入2 000 U/g酶开始酶解→酶解过程中每20 min用1.0 mol/L NaOH或HCl调节溶液pH值保持不变→搅拌酶解4 h→酶解结束后沸水灭酶10 min →冷却后3 000 r/min离心20 min→取上清液冷冻干燥→-20 ℃保存待用。不同蛋白酶酶解最适温度和最适pH值见表1。
表1 不同蛋白酶酶解最适温度和最适pH值
Table 1 Optimal reaction temperature and pH for different proteases

1.3.2 多肽得率的测定
三氯乙酸(trichloroacetic acid,TCA)是一种蛋白质沉淀剂,可以沉淀蛋白质和较长的肽段。蛋白质在酶解过程中肽链逐渐被切成长短不一的片段,由于TCA可沉淀肽段导致其氮溶指数(soluble nitrogen index,NSI)随着酶解时间的延长逐步提高。因此,TCA-NSI可准确反映蛋白质的酶解情况,也是蛋白质水解度的主要检测指标,TCA-NSI越高,表明多肽得率越高。对不同蛋白酶分别酶解1、2、3、4 h酶解物的TCA-NSI进行测定,测定方法采用TCA-NSI法[6]。
式中:TCA-NSI得率为TCA可溶性氮得率/%;m0为原料中总氮质量/mg;m1为在10% TCA中可溶性氮质量/mg。
1.3.3 酶解物分子质量分布测定
小麦蛋白经蛋白酶酶解后可产生分子质量大小不同的多肽和氨基酸,酶解物分子质量大小是反映蛋白酶解程度的重要指标,不同蛋白酶作用于同一底物,由于各蛋白酶酶解特性的差异可导致酶解物分子质量分布的不同。本实验将对不同蛋白酶酶解小麦蛋白4 h后的酶解物进行分子质量分布测定,测定方法参照GB/T 22729—2008《海洋鱼低聚肽粉》中的附录A[7],采用高效凝胶过滤色谱法测定。
色谱条件如下:色谱柱:TSKgel G2000 SWXL(300 mm×7.8 mm);流动相:乙腈-水-三氟乙酸体积比为45∶55∶0.1;检测波长:220 nm;流速:0.5 mL/min;柱温:30 ℃;进样体积:10 µL。
以杆菌肽(Mw=1 450 D)、细胞色素C(Mw=12 500 D)、抑肽酶(Mw=6 500 D)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mw=451 D)和乙氨酸-乙氨酸-乙氨酸(Mw=189 D)为标准品作分子质量校正曲线,得到分子质量的对数与保留时间之间的回归方程y=-0.209 5 x+ 6.608 1(R2=0.997 5)。将样品的色谱数据代入校正曲线方程计算,即可得出样品的分子质量以及分布范围。
1.3.4 DPPH自由基清除率的测定
DPPH自由基是一种在醇溶液中稳定的自由基,在517 nm波长处有最大吸光度,当遇到氢供体如抗氧化剂时,自由基单电子与氢结合,在517 nm波长处吸光度变小,而吸光度变小的程度与自由基被清除的程度呈定量关系,从而反映抗氧化活性的强弱[8]。
对不同蛋白酶酶解小麦蛋白4 h后酶解物的DPPH自由基清除率进行测定[9]。取DPPH溶液2 mL,加95%乙醇(或无水乙醇)1 mL,充分混合,测517 nm波长处吸光度(A0);取DPPH溶液2 mL,加样品液,再加95%乙醇(或无水乙醇),混合,静置30 min后,测517 nm波长处吸光度(A)。DPPH自由基清除率的计算见公式(2)。
1.3.5 O2-·清除率的测定
O2-·通过歧化作用可产生过氧化氢和·OH,这些自由基及产物可抑制生物体中各类酶的活性,杀死正常细胞,破坏细胞膜和DNA的结构,从而导致机体正常细胞的功能受到损伤[10]。因此,O2-·对人体健康有很大影响,对该自由基的清除活性可作为评价小麦蛋白酶解物抗氧化能力大小的重要指标。
对不同蛋白酶酶解小麦蛋白4 h后酶解物的O2-·清除率进行测定[11]。取2 950 μL Tris-HCl缓冲液,再加50 μL联苯三酚溶液,迅速混合,开始计时,每隔30 s读数325 nm波长处吸光度(A1),至300 s时为止(A2),计算ΔA0=A1-A2;取样品溶液,加Tris-HCl缓冲液,再加联苯三酚溶液,迅速混合,开始计时,每隔30 s读数325 nm波长处吸光度(A样1),至300 s时为止(A样2),计算ΔA样=A样1-A样2。O2-·清除率的计算见公式(3)。
1.3.6 ·OH清除率的测定
·OH是非常活跃并易发生化学反应的自由基,在铜或铁离子的存在下可由O2-·和过氧化氢反应形成。·OH非常容易与氨基酸、蛋白质、DNA等生物分子发生反应,也可引起脂质过氧化反应[12-13]。因此,清除·OH可能是机体抗氧化或抗某些疾病的最有效方式之一,·OH清除率大小可作为评价抗氧化活性的重要指标。
对不同蛋白酶酶解小麦蛋白4 h后酶解物的·OH清除率进行测定[14]。取1.0 mL浓度为1.865 mmol/L邻二氮菲的无水乙醇溶液,分别加入浓度为0.2 mol/L的pH 7.4磷酸盐缓冲液2 mL和1 mL不同质量浓度的样品,充分混匀后加入1.0 mL浓度为1.865 mmol/L的FeSO4·7H2O溶液,再次混匀后加入1.0 mL体积分数0.03%的H2O2,于37 ℃恒温水浴,60 min后,在532 nm波长处分别测量各组混合溶液的吸光度得AS,以蒸馏水代替样品作为空白组测吸光度得Ab,以蒸馏水替代H2O2作为损伤组,测其吸光度An。·OH清除率的计算见公式(4)。
2.1 小麦蛋白酶解物多肽得率的变化

图1 不同蛋白酶酶解小麦蛋白多肽得率变化
Fig. 1 Polypeptide yields from wheat gluten hydrolysis by different proteases
由图1可知,不同蛋白酶酶解小麦蛋白过程中TCANSI得率随着酶解时间的延长均呈增长趋势,其中酶解1 h时的多肽含量均已达到酶解4 h时的一半以上,表明各蛋白酶酶解初期的酶解速度均较快。酶解4 h后,风味蛋白酶酶解所得酶解物中多肽得率最高,达91.44%,与其余各组均有统计学差异(P<0.05),其次是碱性蛋白酶,多肽得率为76.89%,胰蛋白酶最低。多肽得率高意味着蛋白的水解程度高,这对赋予酶解物抗氧化活性具有重要作用。风味蛋白酶是一种微生物来源的内切酶和外切酶的复合物,可从肽链的任意一端切下一个单位氨基酸残基,也可在多肽链的内部破坏肽键,进而提高蛋白水解度,并产生一系列分子质量不同的多肽,同时由于外切酶的作用可产生大量的氨基酸态氮,从而抑制酶解物苦味,赋予良好风味[15]。碱性蛋白酶是一种非特异性内切蛋白酶,主要裂解疏水性氨基酸如缬氨酸、亮氨酸、异亮氨酸等,这导致酶解物中含有大量的疏水性氨基酸和终端为疏水性氨基酸的多肽,而疏水性氨基酸在终端比在肽链间呈苦味小,有利于消除蛋白酶解液的苦味[16]。因此,从提高小麦蛋白水解程度以及抑制或消除苦味的角度分析,风味蛋白酶和碱性蛋白酶是制备高抗氧化活性小麦肽的最佳用酶。
2.2 小麦蛋白酶解物分子质量分布
表2 不同蛋白酶酶解小麦蛋白酶解物的分子质量分布
Table 2 Molecular weight distribution of wheat gluten hydrolysates produced by different proteases

由表2可知,不同蛋白酶酶解小麦蛋白后酶解物中含有大量的小分子质量多肽(180~3 000 D)、部分氨基酸(小于180 D),其中风味蛋白酶酶解物中小分子质量的多肽含量最高,其次是碱性蛋白酶,胰蛋白酶最少。风味蛋白酶酶解物中分子质量小于3 000 D的多肽含量达76.9%,分子质量小于1 000 D的低聚肽含量达70.91%;而胰蛋白酶酶解物中分子质量小于3 000 D的多肽含量为43.17%,分子质量小于1 000 D的低聚肽含量只有22.26%。酶解物中小分子质量肽所占比例越大,代表其水解程度越高,此外,大量研究表明低分子质量的小麦肽尤其是低聚肽具有良好的抗氧化、调节免疫、降血压等生物活性功能。Mendis等[17]研究发现分子质量小于3 000 D的多肽具有良好的抗氧化功能。Gauthier等[18]从小麦蛋白中经过酶解获得了具有免疫调节功能的肽。Thewissen等[19]研究表明小麦肽可明显抑制ACE活性,具有良好的降血压效果。因此,从提高小麦蛋白酶解物抗氧化等生物活性功能角度出发,风味蛋白酶是小麦蛋白酶解的最佳用酶,碱性蛋白酶其次,胰蛋白酶的作用效果最差。
2.3 小麦蛋白酶解物DPPH自由基清除活性
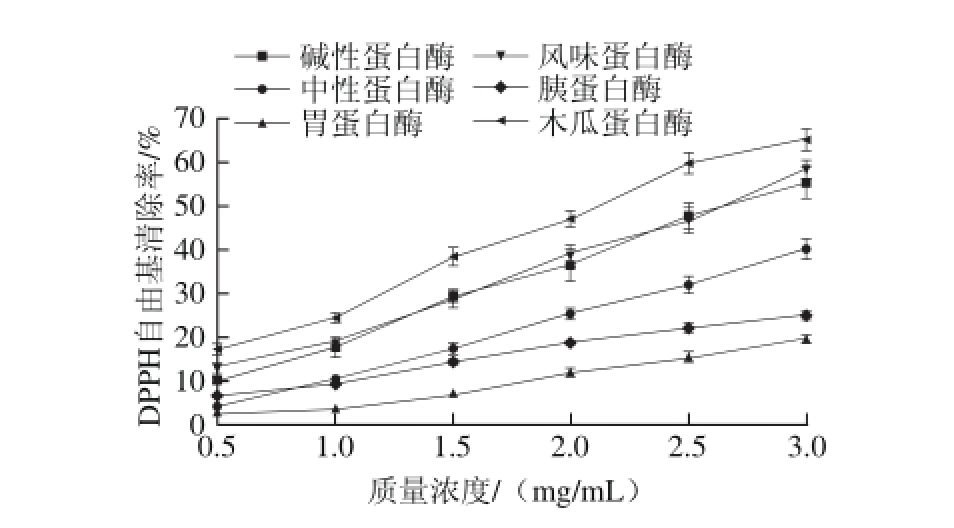
图2 不同蛋白酶酶解小麦蛋白酶解物在不同质量浓度条件下对DPPH自由基清除率的影响
Fig. 2 DPPH radical scavenging activity of different concentrations of wheat gluten hydrolysates produced by different proteases
由图2可知,不同蛋白酶酶解小麦蛋白酶解物清除DPPH自由基能力与酶解物质量浓度呈正相关,当质量浓度值小于1 mg/mL时,DPPH自由基清除率增长较缓,所有蛋白酶酶解物肽质量浓度为1 mg/mL时对应的清除率均不到30%;当质量浓度值大于1 mg/mL时,各蛋白酶酶解物的DPPH自由基清除率均呈明显的增加趋势,因此,1 mg/mL可在一定程度上被视为清除DPPH自由基最低的有效肽质量浓度。针对不同蛋白酶的作用效果可以看出,3 mg/mL质量浓度条件下,木瓜蛋白酶对DPPH自由基清除作用最好,清除率达65.12%,与其余各组均有统计学差异(P<0.01);其次是风味蛋白酶和碱性蛋白酶,清除率分别为58.43%和55.29%,二者无统计学差异,但与其余各组均有统计学差异(P<0.01);而两种动物蛋白酶胃蛋白酶和胰蛋白酶作用效果较差。木瓜蛋白酶是一种底物特异性内切酶,属巯基蛋白酶,作用位点广泛,可从蛋白质分子内部切开肽链而生成小分子质量的具有生物活性功能的多肽。木瓜蛋白酶是酶解小麦蛋白并产生高抗氧化活性组分的优质酶制剂,Wang Jinshui等[5]采用木瓜蛋白酶对小麦蛋白进行酶解,酶解物以及对酶解物进行进一步超滤分离所得的分子质量更小的组分均展示了很强的DPPH自由基清除能力。碱性蛋白酶主要裂解疏水性氨基酸,而风味蛋白酶的外切酶特性可将含有疏水性氨基酸的短肽链末端切断释放氨基酸并进一步彻底降解为氨基酸,这可增加酶解物中疏水性氨基酸含量。DPPH自由基清除能力可能与疏水性氨基酸含量有关,据报道,蛋白酶解物含有较高DPPH自由基清除活性与高含量的疏水性氨基酸或肽有关联[20]。因此,本实验利用6 种蛋白酶分别酶解小麦蛋白的酶解物均呈现良好的DPPH自由基清除活性,其中木瓜蛋白酶、风味蛋白酶和碱性蛋白酶的清除作用最好,从清除DPPH自由基角度出发,以上3 种蛋白酶是酶解小麦蛋白产生高抗氧化活性物质的最佳用酶。
2.4 小麦蛋白酶解物O2-·清除活性
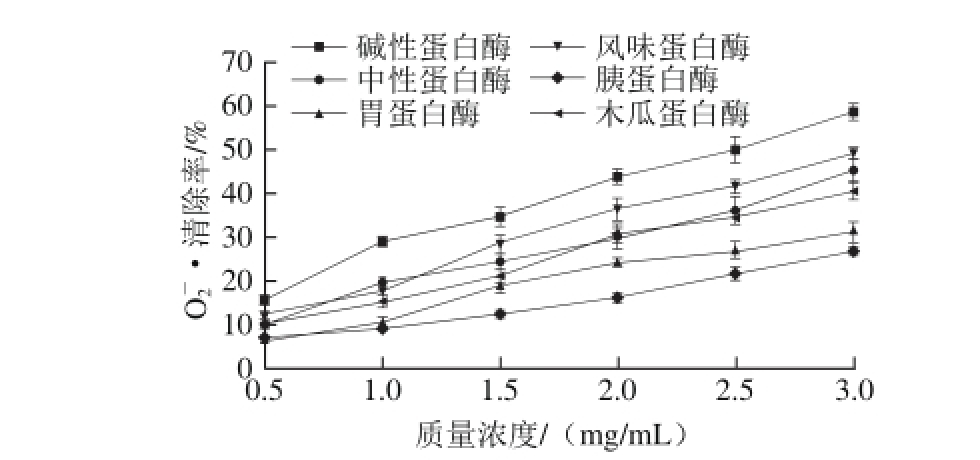
图3 不同蛋白酶酶解小麦蛋白酶解物在不同质量浓度条件下对 清除率的影响
清除率的影响
Fig. 3 Superoxide anion radical activity of different concentrations of wheat gluten hydrolysates produced by different proteases
由图3可知,不同蛋白酶酶解小麦蛋白酶解物清除O2-·能力均随酶解物质量浓度的增加而呈逐渐增强的趋势,其中碱性蛋白酶清除效果最好,其次是风味蛋白酶,胰蛋白酶最差。当酶解物质量浓度为3 mg/mL时,碱性蛋白酶酶解物的O2-·清除率为58.68%,与其余各组均有统计学差异(P<0.01);风味蛋白酶O2-·清除率为49.25%,与其余各组均有统计学差异(P<0.01,P<0.05)。程云辉等[21]采用碱性蛋白酶制备麦胚抗氧化肽的O2-·清除率可达56.38%。碱性蛋白酶酶解物清除O2-·效果好和碱性蛋白酶酶解蛋白可产生大量的疏水性氨基酸有关,Suetsuna等[22]对小麦蛋白中的抗氧化肽进行提取和结构鉴定,结果鉴定出两条具有抗氧化活性的肽链,两条肽链的终端均含有疏水性氨基酸丙氨酸或亮氨酸,这说明了疏水性氨基酸易于与自由基结合从而产生良好的抗氧化效果。此外,Saito等[23]研究表明His、Pro和Tyr残基在抗氧化肽清除自由基能力方面起着非常重要的作用,而小麦蛋白酶解物中总氨基酸含量为939 mg/g,Pro含量达100 mg/g,His含量为75 mg/g,Tyr含量为48 mg/g,上述3 种氨基酸含量占比为23.7%[5],这也解释了小麦蛋白酶解物具有清除O2-·能力的原因。因此,本实验利用6 种蛋白酶分别酶解小麦蛋白的酶解物对O2-·均有一定的清除效果,其中碱性蛋白酶和风味蛋白酶的清除作用最好,从清除O2-·角度出发,以上两种蛋白酶是酶解小麦蛋白产生高抗氧化活性物质的最佳用酶。
2.5 小麦蛋白酶解物·OH清除活性

图4 不同蛋白酶酶解小麦蛋白酶解物在不同质量浓度条件下对·OH清除率的影响
Fig. 4 Hydroxyl radical scavenging activity of different concentrations of wheat gluten hydrolysates produced by different proteases
由图4可知,不同蛋白酶酶解小麦蛋白酶解物清除·OH能力均随酶解物质量浓度的增加而呈逐渐增强的趋势,质量浓度与清除效果存在明显的量效关系,清除效果最好的是碱性蛋白酶和木瓜蛋白酶,在酶解物质量浓度为3 mg/mL时二者清除率分别为59.23%和58.16%,二者无统计学差异,但与其余各组均有统计学差异(P<0.01)。碱性蛋白酶酶解物良好的·OH清除效果和清除DPPH自由基和O2-·类似,主要原因均是由于碱性蛋白酶切割位点为疏水性氨基酸而导致产生良好的自由基清除能力。Zhu Kexue等[3]利用碱性蛋白酶对麦芽蛋白进行酶解,经测定,酶解物具有显著的DPPH自由基、O2-·和·OH清除能力。陈美珍等[24]研究证实木瓜蛋白酶酶解大豆分离蛋白所得酶解物具有良好的清除·OH作用。邱春江等[25]对采用木瓜蛋白酶酶解文蛤蛋白制备的酶解物进行了抗氧化活性测定,研究结果表明木瓜蛋白酶酶解产物对·OH的清除率可达到95.8%。因此,本实验采用的6 种蛋白酶分别酶解小麦蛋白所得酶解物均有清除·OH的效果,其中碱性蛋白酶和木瓜蛋白酶作用效果最好,从清除·OH角度出发,以上两种蛋白酶是酶解小麦蛋白产生高抗氧化活性物质的最佳用酶。
本研究采用6 种不同蛋白酶分别对小麦蛋白进行酶解,分析了不同蛋白酶对蛋白水解程度和酶解产物抗氧化活性的影响,结果显示风味蛋白酶对提高蛋白水解程度和生成小分子质量多肽的作用明显,而碱性蛋白酶、木瓜蛋白酶和风味蛋白酶对提高酶解产物抗氧化活性效果较好。随着小麦肽抗氧化活性功能研究的深入,下一步应重点对高抗氧化小麦肽段的分离鉴定,动物体内抗氧化效果评价以及人体临床评价等方面开展研究。小麦肽不仅具有良好的抗氧化活性,而且还具有抗疲劳[26]、增强免疫力[18]、阿片活性[27-28]、抑制血压升高[19,29-30]等多种生理活性,这些多样化活性也将是小麦肽研究的重点方向。
参考文献:
[1] WIESER H. Chemistry of gluten proteins[J]. Food Microbiology, 2007, 24(2): 115-119. DOI:10.1016/j.fm.2006.07.004.
[2] ŽILIĆ S, AKILLIOĞLU G, SERPEN A, et al. Effects of isolation, enzymatic hydrolysis, heating, hydratation and Maillard reaction on the antioxidant capacity of cereal and legume proteins[J]. Food Research International, 2012, 49(1): 1-6. DOI:10.1016/j.foodres.2012.06.031.
[3] ZHU K X, ZHOU H M, QIAN H F. Antioxidant and free radicalscavenging activities of wheat germ protein hydrolysates (WGPH) prepared with alcalase[J]. Process Biochemistry, 2006, 41(6): 1296-1302. DOI:10.1016/j.procbio.2005.12.029.
[4] 曾瑜, 袁亚潘, 兴昌, 等. 小麦低聚肽对老龄小鼠抗氧化功能的影响[J].卫生研究, 2013, 42(3): 470-473.
[5] WANG J S, ZHAO M M, ZHAO Q Z, et al. Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J]. Food Chemistry, 2007, 101(4): 1658-1663. DOI:10.1016/ j.foodchem.2006.04.024.
[6] JANG A, LEE M. Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J]. Meat Science, 2005, 69(4): 653-661. DOI:10.1016/j.meatsci.2004.10.014.
[7] 国家质量监督检验检疫总局. 海洋鱼低聚肽粉: GB/T 22729—2008[S].北京: 中国标准出版社, 2008.
[8] GHRIBI A M, SILA A, PRZYBYLSKI R, et al. Purification and identif i cation of novel antioxidant peptides from enzymatic hydrolysate of chickpea (Cicer arietinum L.) protein concentrate[J]. Journal of Functional Foods, 2015, 12: 516-525. DOI:10.1016/j.jff.2014.12.011.
[9] LI X C, LIN J, GAO Y X, et al. Antioxidant activity and mechanism of Rhizoma Cimicifugae[J]. Chemistry Central Journal, 2012, 6: 140. DOI:10.1186/1752-153X-6-140.
[10] UDENIGWE C C, LU Y L, HAN C H, et al. Flaxseed proteinderived peptide fractions: antioxidant properties and inhibition of lipopolysaccharide-induced nitric oxide production in murine macrophages[J]. Food Chemistry, 2009, 116(1): 277-284. DOI:10.1016/j.foodchem.2009.02.046.
[11] LI X C. Improved pyrogallol autoxidation method: a reliable and cheap superoxide-scavenging assay suitable for all antioxidants[J]. Journal of Agricultural and Food Chemistry, 2012, 60(25): 6418-6424. DOI:10.1021/jf204970r.
[12] XIE Z J, HUANG J R, XU X M, et al. Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J]. Food Chemistry, 2008, 111(2): 370-376. DOI:10.1016/j.foodchem.2008.03.078.
[13] YOU L J, ZHAO M, REGENSTEIN J M, et al. Purification and identification of antioxidative peptides from loach (Misgurnus anguillicaudatus) protein hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Research International, 2010, 43(4): 1167-1173. DOI:10.1016/ j.foodres.2010.02.009.
[14] HALLIWELL B, GUTTERIDGE J M C, ARUOMA O I. The deoxyribose method: a simple “test tube” assay for determination of rate constants for reactions of hydroxyl radicals[J]. Analytical Biochemistry, 1987, 165(1): 215-219. DOI:10.1016/0003-2697(87)90222-3.
[15] 张聪, 苏扬. 风味酶与风味生物技术[J]. 中国调味品, 2014, 39(12): 120-123. DOI:10.3969/j.issn.1000-9973.2014.12.031.
[16] KIM C H, KIM M R, LEE C H. The bitterness of the enzymatic hydrolysate of soybean protein and the amino acid composition of the UF fi ltrate[J]. Foods and Biotechnology, 1997, 6(4): 244-249.
[17] MENDIS E, RAJAPAKSE N, KIM S K. Antioxidant properties of a radical-scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2005, 53(3): 581-587. DOI:10.1021/jf048877v.
[18] GAUTHIER S F, POULIOT Y, SAINT-SAUVEUR D. Immunomodulatory peptides obtained by the enzymatic hydrolysis of wheat proteins[J]. Intemational Dairy Journal, 2006, 16 (11): 1315-1323. DOI:10.1016/j.idairyj.2006.06.014.
[19] THEWISSEN B G, PAULY A, CELUS I, et al. Inhibition of angiotensin I converting enzyme by wheat gliadin hydrolysates[J]. Food Chemistry, 2011, 127(4): 1653-1658. DOI:10.1016/ j.foodchem.2010.11.171.
[20] RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38(2): 175-182. DOI:10.1016/j.foodres.2004.10.002.
[21] 程云辉, 王璋, 许时婴. 酶解麦胚蛋白制备抗氧化肽的研究[J]. 食品科学, 2006, 27(6): 147-151.
[22] SUETSUNA K, CHEN J R. Isolation and characterization of peptides with antioxidant activity derived from wheat gluten[J]. Food Science and Technology Research, 2002, 8(3): 227-230.
[23] SAITO K, JIN D H, OGAWA T, et al. Antioxidative properties of tripeptide libraries prepared by the combinatorial chemistry[J]. Journal of Agricultural and Food Chemistry, 2003, 51(12): 3668-3674.
[24] 陈美珍, 余杰, 郭慧敏. 大豆分离蛋白酶解物清除羟自由基作用的研究[J]. 食品科学, 2002, 23(1): 43-47.
[25] 邱春江, 陈慧. 木瓜蛋白酶水解文蛤蛋白制备小分子肽及其抗氧化研究[J]. 食品科技, 2008, 33(3): 180-182.
[26] 唐波. 小麦肽对模拟高原训练大鼠红细胞的影响及其调节机制[D].扬州: 扬州大学, 2012: 29-33.
[27] FUKUDOME S, MATSUKAWA T, SASAKI R, et al. Release of opioid peptides, gluten exorphins by the action of pancreatic elastase[J]. FEBS Letters, 1997, 412(3): 475-479.
[28] 孔祥珍, 周惠明, 钱海峰. 小麦面筋蛋白功能短肽的阿片活性及其相对分子质量分布的研究[J]. 中国粮油学报, 2007, 22(4): 24-27.
[29] QU W J, MA H L, ZHAO W R, et al. ACE-inhibitory peptides production from defatted wheat germ protein by continuous coupling of enzymatic hydrolysis and membrane separation: modeling and experimental studies[J]. Chemical Engineering Journal, 2013, 226: 139-145. DOI:10.1016/j.cej.2013.04.030.
[30] ASOODEH A, HAGHIGHI L, CHAMANI J, et al. Potential angiotensin I converting enzyme inhibitory peptides from gluten hydrolysate: biochemical characterization and molecular docking study[J]. Journal of Cereal Science, 2014, 60(1): 92-98. DOI:10.1016/ j.jcs.2014.01.019.
Effects of Different Proteases on Antioxidant Activities of Wheat Gluten Hydrolysates
ZHENG Zhiqiang1,2, LI Baolin3, HAO Limin2, GUO Shuntang1,*
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2. The Quartermaster Equipment Institute of Logistic Support Department, Central Military Commission, Beijing 100010, China; 3. Jiangsu Zhihui Biotechnology Co. Ltd., Xuzhou 221222, China)
Abstract:Wheat gluten is a main by-product of wheat starch processing. Enzymatic hydrolysis is an effective way of improving the solubility and functionality of wheat gluten; however, protease type may influence the functionalities of wheat gluten hydrolysates such as antioxidant activities. Six frequently used proteases including Alcalase, Neutrase, Pepsin, Flavourzyme, Pancreatin and Papain were used for the hydrolysis of wheat gluten, and the degree of hydrolysis and antioxidant capacity of four-hour hydrolysates were evaluated in terms of polypeptide yield, molecular weight distribution, 1,1-diphenyl-2- picrylhydrazyl (DPPH) radical scavenging activity, superoxide radical anion (O2-·) scavenging activity,and hydroxyl radical (·OH) scavenging activity. The results showed that Flavourzyme hydrolysate exhibited the highest polypeptide yield (91.44%), containing up to 76.9% polypeptide with a molecular weight of less than 3 000 D. Papain hydrolysate at a concentration of 3 mg/mL exhibited the best DPPH radical scavenging activity (65.12% scavenging percentage, P < 0.01), followed by Flavourzyme hydrolysate (58.43%) and Alcalase hydrolysate (55.29%). Alcalase hydrolysate exhibited the best superoxide anion radical scavenging activity (58.68% scavenging percentage, P < 0.01), followed by Flavourzyme hydrolysis (49.25%). Alcalase and Papain hydrolysates exhibited the best hydroxyl radical scavenging activity (scavenging percentages of 59.23% and 58.16%, respectively). Therefore, protease type had a notable effect on antioxidant activities of wheat gluten hydrolysates. In addition, Flavourzyme hydrolysis gave a significant improvement in the degree of hydrolysis and the formation of small polypeptides; moreover, Alcalase, Papain and Flavourzyme resulted in improved antioxidant activities of hydrolysates.
Key words:protease; wheat gluten; antioxidant activity; free radical scavenging activity
DOI:=162,ebook=168
DOI:10.7506/spkx1002-6630-201707026
中图分类号:TS210.9
文献标志码:A
文章编号:1002-6630(2017)07-0161-06
收稿日期:2016-06-16
基金项目:全军后勤科研重点项目(AX110C002)
作者简介:郑志强(1984—),男,工程师,博士研究生,研究方向为蛋白质加工与利用。E-mail:zzq198408@126.com
*通信作者:郭顺堂(1962—),男,教授,博士,研究方向为蛋白质加工与利用。E-mail:shuntang@cau.edu.cn
引文格式:
郑志强, 李宝林, 郝利民, 等. 不同蛋白酶对小麦蛋白酶解物抗氧化活性的影响[J]. 食品科学, 2017, 38(7): 161-166. DOI:10.7506/spkx1002-6630-201707026. http://www.spkx.net.cn
ZHENG Zhiqiang, LI Baolin, HAO Limin, et al. Effects of different proteases on antioxidant activities of wheat gluten hydrolysates[J]. Food Science, 2017, 38(7): 161-166. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201707026. http://www.spkx.net.cn