
图1 不同温度下粗多糖的提取量及其特征黏度
Fig. 1 Effect of extraction temperature on the yield and viscosity of crude polysaccharides
江贤敏,王正明,潘利华,查学强,罗建平*
(合肥工业大学食品科学与工程学院,安徽 合肥 230009)
摘 要:目的:研究提取温度对霍山石斛多糖提取量、理化性质以及肠道黏膜免疫活性的影响。方法:在不同提取温度(40、60、80、100 ℃)条件下水提醇沉法提取霍山石斛多糖(Dendrobium huoshanense polysaccharides,DHP),并测定多糖提取量和特性黏度;采用高效液相色谱(high performance liquid chromatography,HPLC)、气相色谱(gas chromatography,GC)、傅里叶变换红外光谱(Fourier transform infrared spectrometry,FTIR)技术分析霍山石斛多糖及其阴离子交换色谱水洗组分和盐洗组分的分子质量分布、单糖组成和特征基团;以体外培养的小鼠小肠Peyer结细胞的培养液对小鼠骨髓细胞增殖作用为指标,测定多糖及其分级组分的肠道黏膜免疫调节活性。结果:DHP的提取量随提取温度的升高而增加,但其特性黏度呈现下降趋势。HPLC分析表明不同温度条件下提取的多糖均由高分子质量(higher molecular weight,HMW)和低分子质量(lower molecular weight,LMW)两种组分所构成,LMW热稳定性好、主要存在于阴离子交换色谱的水洗脱组分(water-eluted fraction,DHPW),HMW热稳定性弱、主要存在于阴离子交换色谱的盐洗脱组分(salt-eluted fraction,DHPS);GC和FTIR分析显示,DHPW主要由呈α-构型的葡萄糖所组成、不含糖醛酸,DHPS主要由呈β-构型的葡萄糖、半乳糖、阿拉伯糖和甘露糖所组成,且含糖醛酸;不同温度提取的DHP及其阴离子交换色谱DHPW和DHPS均表现出肠道黏膜免疫调节活性,且DHPS比DHPW具有更强的肠道黏膜免疫调节活性,但它们的活性均随提取温度的升高而下降。结论:不同提取温度不仅影响DHP的提取量,而且可明显改变DHP的特性黏度、分子质量分布、单糖组成和肠道黏膜免疫调节活性,较高的提取温度在提高DHP提取量的同时显著降低DHP中HMW比例,进而导致多糖肠道黏膜免疫调节活性的下降。
关键词:霍山石斛;提取温度;多糖;理化性质;肠道黏膜;免疫活性
热水浸提法是最常用的多糖提取方法,其提取多糖的效率受提取温度、提取时间、料液比和提取次数等因素的影响。一些研究表明,提取温度的改变不仅影响多糖的提取量,也会影响多糖的组成和结构,从而影响多糖的活性[1-4]。
霍山石斛(Dendrobium huoshanense C. Z. Tang et S. J. Cheng)是一种名贵药食兼用植物,多糖是其主要的活性成分[5],具有保肝、明目、益胃的功能[6]。霍山石斛多糖(Dendrobium huoshanense polysaccharides,DHP)的提取主要有水提醇沉、酶辅助提取和超声波辅助等方式[7-10],但提取温度的改变是否会影响霍山石斛多糖的理化性质与生物活性,目前鲜见报道。肠道黏膜免疫系统是机体最大和最复杂的免疫系统,也是口服吸收的重要作用靶点[11]。一些研究表明,中草药多糖口服后可通过刺激小肠内Peyer结细胞产生相应的生长因子,进而促进骨髓细胞的增殖[12-13],进而发挥其生物学活性。本实验将在固定的料液比、提取时间和提取次数的条件下,通过分析不同提取温度条件下DHP的提取量、特性黏度、分子质量分布、单糖组成、特征性红外吸收光谱及肠黏膜免疫调节活性的变化,研究提取温度对DHP理化性质和免疫活性的影响,以期为DHP的提取制备和产品开发提供参考。
1.1 材料与试剂
霍山石斛种子由安徽省霍山县长冲中药材开发有限公司提供,霍山石斛材料为种子诱导的原球茎芽。SPF级雄性昆明小鼠(6~8 周、(20±2)g)购自安徽医科大学实验动物中心。
DEAE-纤维素离子交换树脂、青链霉素双抗、二甲基亚砜 美国Sigma公司;改良型RPMI-1640培养基美国Thermo Fisher公司;胎牛血清 浙江天杭生物科技有限公司;Alamar Blue试剂盒 上海贝博试剂公司;标准葡聚糖 日本Fluka公司;其他化学试剂均为国药分析纯。
1.2 仪器与设备
CT15RT高速冷冻离心机 上海天美科学仪器有限公司;MCO -17AIC CO2培养箱 日本Sanyo公司;Varioskan Flash酶标仪 美国Thermo Fisher公司;1260 Infinity高效液相色谱仪、QP2010气相色谱-质谱联用分析仪 安捷伦科技有限公司;Paragon-1000红外波谱分析仪 美国PE公司。
1.3 方法
1.3.1 DHP的提取
取霍山石斛原球茎芽100 g,匀浆后,按料液比1∶3(m/V),在40 ℃条件下搅拌浸提2 h,重复1次,合并提取液,60 ℃减压浓缩至100 mL,10 000 r/min离心10 min,取上清液,经终体积分数为80%的乙醇醇沉24 h,离心取醇沉物经Sevag法脱蛋白、透析(截留分子质量为3 500 D)、冷冻干燥后,得霍山石斛多糖DHP-40。同法在提取温度为60、80 ℃及100 ℃时提取霍山石斛原球茎芽,分别得霍山石斛多糖DHP-60、DHP-80及DHP-100。
多糖的提取量以冷冻干燥后的多糖质量占提取材料质量的比计算;多糖的特性黏度[η]按文献[14]测定,测定温度为30 ℃,样品质量浓度为1.0 mg/mL。
1.3.2 DHP的分级
采用DEAE-纤维素离子交换树脂柱对霍山石斛多糖DHP-40、DHP-60、DHP-80及DHP-100进行分级。在5 mL/min流速下,经双蒸水和1 mol/L NaCl溶液的洗脱,分别收获水洗多糖DHPW-40、DHPW-60、DHPW-80、DHPW-100和盐洗多糖DHPS-40、DHPS-60、DHPS-80、DHPS-100。
1.3.3 DHP及其组分的分子质量分布测定
采用高效液相色谱(high performance liquid chromatography,HPLC)测定样品分子质量分布。色谱条件:Agilent 1260Infinity系统;TSKG4000PWxl(7.8 m m×3 0 0 m m)和T S K G 5 0 0 0 P W x l(7.8 mm×300 mm)串联色谱柱;柱温30 ℃;双蒸水流动相;流速0.5 mL/min;进样量20 μL;进样质量浓度5 mg/mL;示差折光检测器。标准品Dextran:T-670000、T-420000、T-150000、T-80000、T-25000和T-5000。
1.3.4 DHP及其组分的单糖组成分析
取多糖5 mg,加入2 mol/L的三氟乙酸4 mL,于120 ℃条件下水解4 h。水解完毕后,水解液于50 ℃条件下用甲醇减压蒸干,3 mL超纯水溶解,再加入30 mg硼氢化钠于室温条件下还原3 h。经25%乙酸中和及甲醇减压蒸干,反应产物于110 ℃条件下充分除去水分后,加入4 mL乙酸酐和3 mL吡啶,100 ℃条件下反应1 h,经甲苯反复减压蒸干,得单糖残基的乙酰化产物。乙酰化产物经氯仿萃取、无水硫酸钠干燥后,取上清液进行气相色谱(gas chromatography,GC)分析。标准品葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)、阿拉伯糖(arabinose,Ara)、甘露糖(mannose,Man)、鼠李糖(rhamnose,Rha)和木糖(xylose,Xyl)按上法直接还原和乙酰化处理后进行GC分析。GC分析条件同文献[15]。
1.3.5 DHP及其组分的红外光谱扫描
傅里叶变换红外光谱(Fourier transform infrared spectrometry,FTIR)分析,多糖样品与干燥的KBr粉末混合,研磨后压成1 mm薄片,于红外光谱仪上在500~4 000 cm-1之间进行扫描[11]。
1.3.6 DHP及其组分的肠道黏膜免疫活性评价
按照文献[12,16]方法取小鼠小肠Peyer结细胞,台盼蓝染色活细胞计数,调整Peyer结细胞悬液浓度为2×106个/mL。取96 孔培养板,每孔加入180 μL细胞悬液和20 μL不同质量浓度的DHP及其两种组分(终质量浓度分别为0、25、50、100、200 μg/mL),每组设5 个复孔,于5% CO2、37 ℃的CO2培养箱中培养5 d后,离心取上清液,即为Peyer结细胞条件培养基。
小鼠骨髓细胞悬液的制备方法同文献[12],台盼蓝染色活细胞计数,调整骨髓细胞悬液浓度为2.5× 105个/mL。取96 孔培养板,每孔加入100 μL骨髓细胞悬液和100 μL含有50% Peyer结细胞条件培养基的完全培养基,置于5% CO2、37 ℃的培养箱中培养6 d。培养结束前5 h,每孔加入20 μL Alamar Blue试剂,继续培养至结束,在激发波长544 nm、发射波长590 nm条件下测定荧光强度。
2.1 提取温度对DHP提取量及特性黏度的影响

图1 不同温度下粗多糖的提取量及其特征黏度
Fig. 1 Effect of extraction temperature on the yield and viscosity of crude polysaccharides
图1 显示提取温度显著影响DHP的提取量和特性黏度。当提取温度从40 ℃上升到100 ℃时,DHP的提取量从0.57 mg/g上升到1.32 mg/g,说明较高的提取温度有利于多糖的提取,但随着提取温度的升高,多糖的特性黏度表现出明显的下降。多糖的特性黏度与多糖的分子质量和结构有关,温度的升高,可能会破坏多糖的结构,导致多糖的特性黏度发生改变[17-18]。
2.2 提取温度对DHP分子质量分布的影响
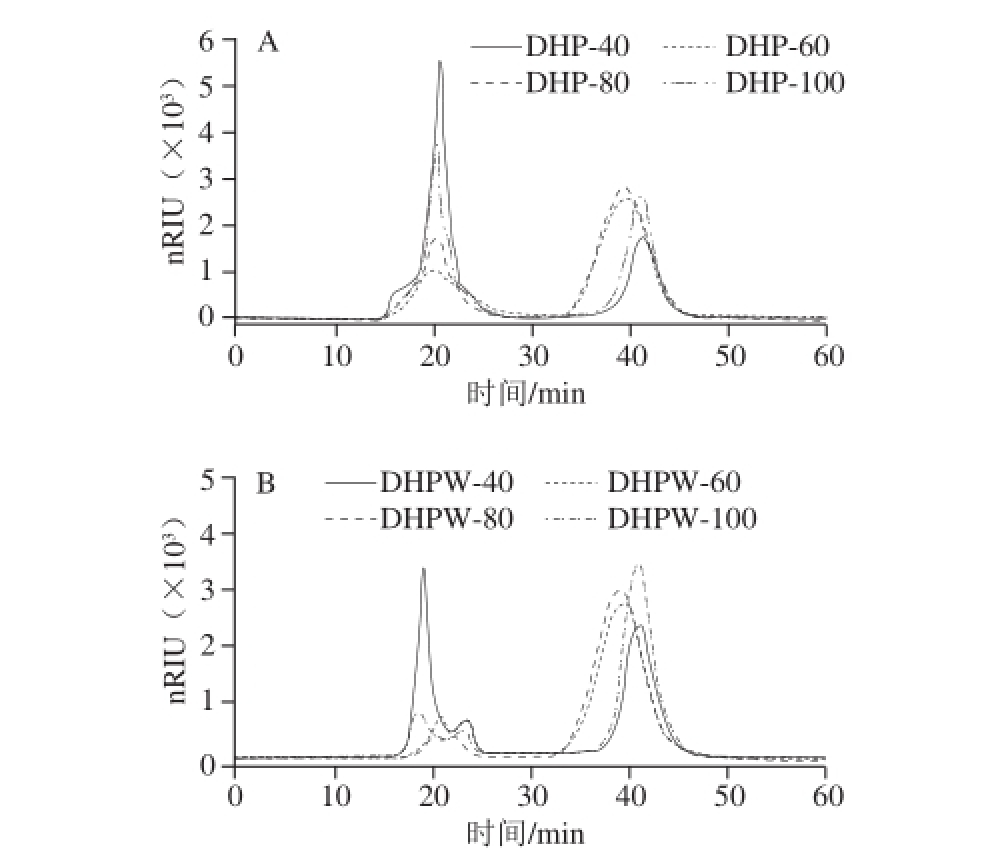

图2 DHP(A)及其阴离子交换树脂DHPW(B)和DHPS(C)的HPLC图
Fig. 2 HPLC prof i les of Dendrobium huoshanense polysaccharides (A) and their fractions eluted with water (B) and salt solution (C) from DEAE-cellulose anion exchange column
HPLC分析显示,提取的霍山石斛多糖DHP主要由两组分子质量不同的组分构成,高分子质量组分(higher molecular weight,HMW)的平均分子质量为(9.25±0.13)×106D,低分子质量组分(lower molecular weight,LMW)的平均分子质量为(6.57±3.60)×103D(图2A)。随提取温度的升高,DHP中的HMW所占比例呈下降趋势,而LMW所占比例呈上升趋势。根据结果可以推测HMW热稳定性差,LMW热稳定好,当升高提取温度,HMW发生降解,可生成LMW,因此导致DHP中HMW比例下降、LMW比例上升。DHP的DEAE-纤维素阴离子交换色谱分析表明,DHP的水洗组分(water-eluted fraction,DHPW)由HMW和LMW两个组分构成,其中主要成分为LMW,且其比例随提取温度而升高(图2B),而DHP的盐洗组分(salt-eluted fraction,DHPS)均由HMW组成,其分子质量随提取温度升高呈现一定的下降趋势(图2C)。刘玲等[19]研究表明在50~80 ℃加热条件下,碳水化合物、蛋白质可通过美拉德反应产生自由基,且产生的自由基强度随温度提高而增加,而利用自由基的活泼作用降解多糖已成为多糖改性的一种有效方法,许多多糖经自由基降解后获得的低分子质量多糖片段表现出明显改变的生物活性[20]。可以推测,图2显示的随温度升高DHP分子质量呈现下降的趋势,可能与提取体系中多糖和蛋白质之间因美拉德反应产生的自由基对多糖的降解作用相关。
2.3 提取温度对DHP及其组分单糖组成的影响
由图3可知,不同温度下提取的DHP及其阴离子交换树脂DHPW和DHPS具有不同的单糖组成,但均由Glc、Gal、Ara、Man以及少量的Rha和Xyl组成。其中,随着提取温度升高,DHP中Glc的含量逐渐增加,可能是由于低温不易抽提的高Glc含量的多糖组分,高温条件下加速它们的溶解与抽提[21],或者高温条件下多糖发生部分降解,降解时可能由于其他单糖的丢失,从而导致Glc的含量上升,而其他单糖的含量相对减少;DHPW单糖组成的变化与DHP相似,当提取温度由40 ℃增加到100 ℃时,Glc的含量显著升高,高达97.23%;DHPS中各单糖比例随提取温度的升高变化不大。结合上述DHP及其DHPW和DHPS的分子质量分布变化,可以推测,HMW主要由Glc、Gal、Ara和Man组成,同时含有少量的Rha和Xyl;而LMW则主要由Glc组成,Gal、Ara和Man含量较少。
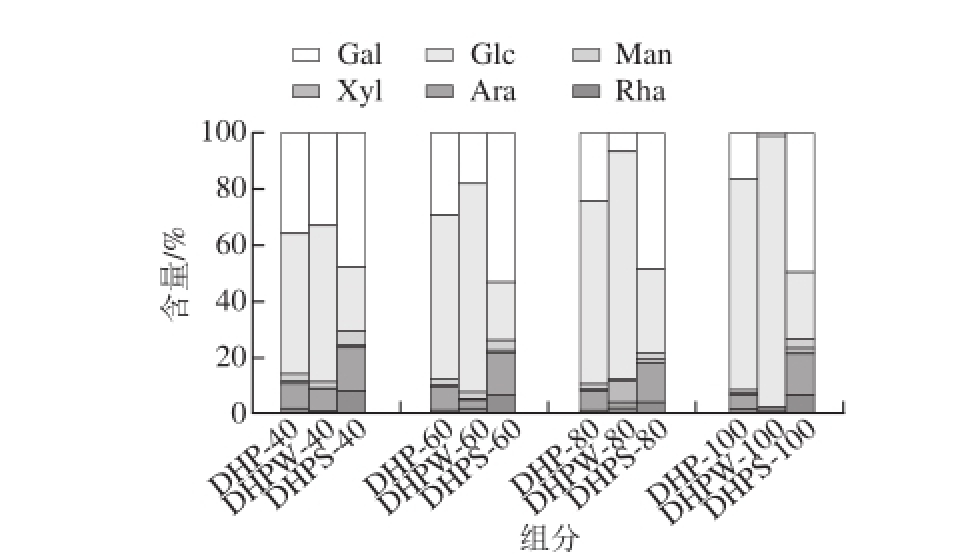
图3 霍山石斛粗多糖及其阴离子交换树脂DHPW和DHPS的单糖组成
Fig. 3 Molecular weight distribution of Dendrobium huoshanense polysaccharides and their fractions eluted with water and salt solution from DEAE-cellulose anion exchange column
2.4 不同温度提取的DHP及其组分的FTIR比较
红外光谱分析显示(图4),不同温度提取的DHP及其DHPW和DHPS组分均在3 400、2 930、1 650、1 150、1 080 cm-1处具有典型的多糖特征峰,且1 080 cm-1吸收峰说明DHP及其组分的单糖残基均以吡喃糖形式存在[22],但也存在特征吸收峰的差异。其中,DHP和DHPS在1 730 cm-1附近有糖醛酸的吸收峰[23]、在897 cm-1附近有β-构型的吸收峰[24],且DHP在852 cm-1附近有α-构型的吸收峰[25](图4A、C);而DHPW在897 cm-1附近无吸收峰,但在852 cm-1附近有吸收峰,1 730 cm-1附近有较弱的吸收峰,表明DHPW的糖残基主要是以α-构型存在,也含有少量的糖醛酸(图4B)。

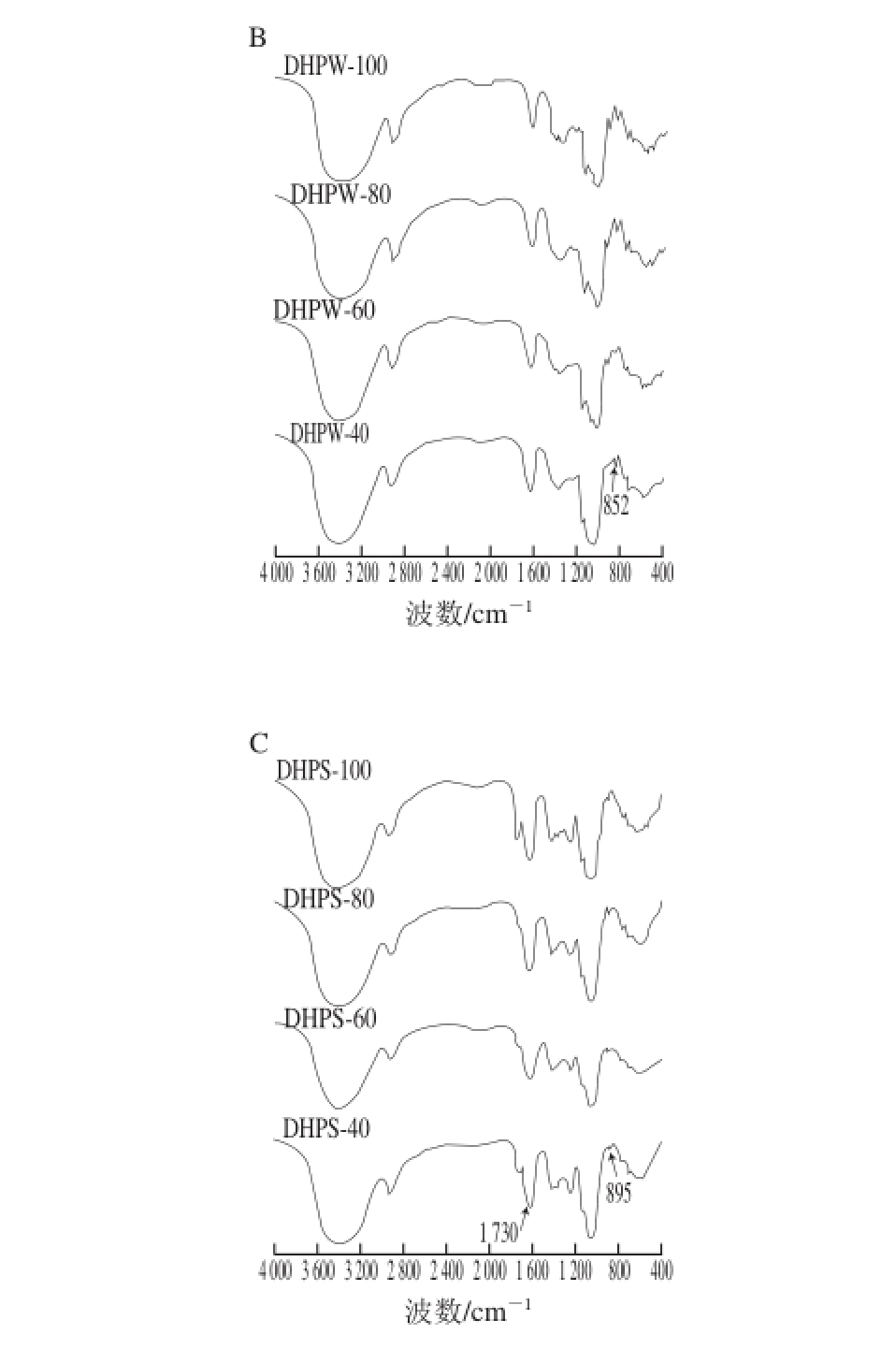
图4 DHP(A)及其阴离子交换树脂DHPW(B)和DHPS(C)的红外光谱
Fig. 4 FTIR spectra of Dendrobium huoshanense polysaccharides (A) and their fractions eluted with water (B) and salt solution (C) from DEAE-cellulose anion exchange column
2.5 不同温度提取的DHP及其组分肠道黏膜免疫活性的比较

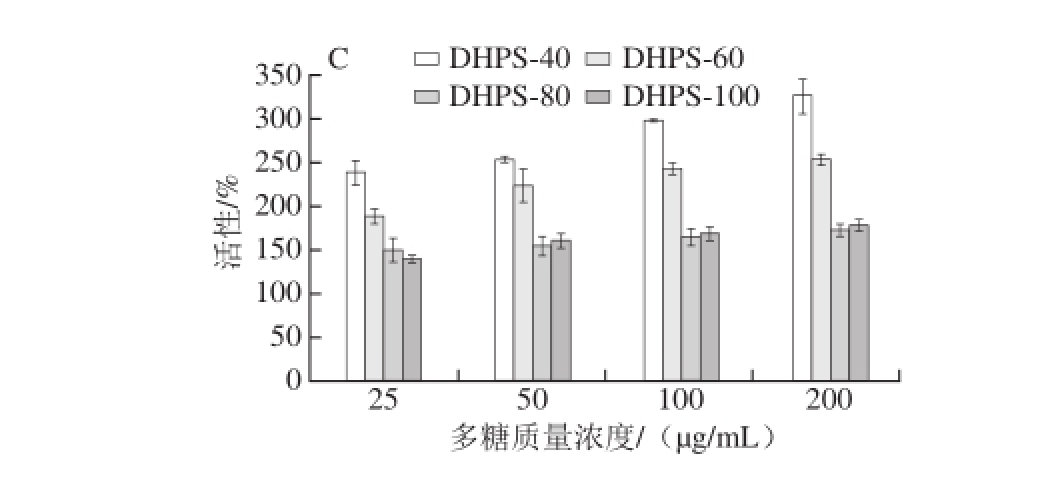
图5 DHP(A)及其阴离子交换树脂DHPW(B)和DHPS(C)的肠道黏膜免疫调节活性
Fig. 5 In vitro intestinal mucosal immunomodulating activities of Dendrobium huoshanense polysaccharides (A) and their fractions eluted with water (B) and salt solution (C) from DEAE-cellulose anion exchange column
中药及其多糖口服后能够通过小肠进行吸收[26-28],调节肠黏膜免疫活性,进而通过细胞因子及淋巴细胞归巢影响系统免疫[29-31]。多糖的肠道黏膜免疫活性可用多糖刺激的小鼠小肠Peyer结细胞培养液对骨髓细胞的增殖作用表示。如图5所示,不同温度提取的DHP及其组分均可以刺激骨髓细胞增殖,并且具有剂量依赖效应。与对照组相比,当多糖质量浓度为200 μg/mL时,DHP-40、DHP-60、DHP-80和DHP-100对骨髓细胞的增殖作用分别提高86.4%、68.6%、71.9%和48.9%(图5A),DHPW-40、DHPW-60、DHPW-80和DHPW-100对骨髓细胞的增殖作用分别提高100.4%、53.6%、47.7%和44.1%(图5B),DHPS-40、DHPS-60、DHPS-80和DHPS-100对骨髓细胞的增殖作用分别提高226.8%、154.0%、72.8%和78.3%(图5C)。由此可知,DHP、DHPW和DHPS的肠道黏膜活性均随着温度的升高而降低,且DHPS比DHP和DHPW具有更强的肠道黏膜免疫活性,结合DHP、DHPW和DHPS的分子质量分布,可以推测DHP中具有较高分子质量和复杂单糖组成的HMW组分具有较强的肠道黏膜免疫活性,而LMW组分活性相对较弱,由于HMW热稳定性差,所以随提取温度的升高,DHP的肠道黏膜免疫活性下降。
本实验考察了提取温度对DHP提取量和特性黏度的影响,并比较了不同温度提取的多糖在分子质量分布、单糖组成、红外特征吸收光谱和肠道黏膜免疫活性方面的异同。结果表明,霍山石斛的多糖提取量随提取温度升高而增加,但其特性黏度呈现下降趋势;不同温度条件下提取的多糖均由HMW和LMW两种组分所构成,LMW主要存在于阴离子交换色谱的DHPW,由呈α-构型Glc为主的单糖所组成,不含糖醛酸、热稳定性好,HMW主要存在于阴离子交换色谱的DHPS,由呈β-构型的Glc、Gal、Ara和Man为主的单糖所组成,且含糖醛酸、热稳定性弱;肠道黏膜免疫活性分析显示,DHP中DHPS比DHPW具有更强的肠道黏膜免疫调节活性,随提取温度的升高、HMW的降解,DHP的肠道黏膜免疫调节活性显著下降。
参考文献:
[1] 孙世利. 提取温度对金萱绿茶多糖体外抗氧化活性的影响[J].广东农业科学, 2011, 38(1): 123-125. DOI:10.3969/j.issn.1004-874X.2011.01.045.
[2] 于斐. 低温提取南瓜多糖的理化性质及清除DPPH自由基作用[J]. 食品研究与开发, 2011, 32(4): 28-31. DOI:10.3969/ j.issn.1005-6521.2011.04.008.
[3] 朱婷, 尹溽纹, 张贵强, 等. 板蓝根多糖提取工艺及对活性成分影响的研究[J]. 中国新药杂志, 2013(12): 1390-1395.
[4] 陈丹丹, 郭源鑫, 陈建平, 等. 不同提取温度对蛤蒌叶粗多糖抗氧化作用的影响研究[J]. 农产品加工, 2016(2): 1-4. DOI:10.16693/ j.cnki.1671-9646(X).2016.02.001.
[5] 李胜立, 陈程, 杨思林, 等. 霍山石斛类原球茎免疫调节活性的有效部位及其毒理安全性评价[J]. 药物评价研究, 2012, 35(5): 321-327.
[6] 吴胡琦, 罗建平. 霍山石斛的研究进展[J]. 时珍国医国药, 2010, 21(1): 208-211. DOI:10.3969/j.issn.1008-0805.2010.01.104.
[7] 黄森, 查学强, 罗建平, 等. Box-Behnken法优化提取霍山石斛活性多糖的研究[J]. 中药材, 2007, 30(5): 591-594. DOI:10.3321/ j.issn:1001-4454.2007.05.033.
[8] 魏明, 邵平, 姚红, 等. 超声波协同纤维素酶法提取霍山石斛多糖的研究[J]. 食品工业科技, 2009, 30(3): 199-201. DOI:10.13386/ j.issn1002-0306.2009.03.011.
[9] 秦霞, 董海丽, 刘红. 响应面法优化霍山石斛多糖超声提取工艺[J]. 安徽农业科学, 2012(12): 7065-7066. DOI:10.3969/ j.issn.0517-6611.2012.12.029.
[10] 先桂花. 微波辅助提取霍山石斛多糖的研究[J]. 农业科学与技术: 英文版, 2014(8): 1304-1307. DOI:10.3969/j.issn.1009-4229.2014.08.014.
[11] 江益平, 周联, 王青. 香菇多糖对免疫抑制小鼠肠道粘膜免疫系统功能的影响[EB/OL]. 2011-12-16. http://www.paper.edu.cn/ releasepaper/content/201112-441.
[12] HONG T, MATSUMOTO T, KIYOHARA H, et al. Enhanced production of hematopoietic growth factors through T cell activation in Peyer’s patches by oral administration of Kampo (Japanese herbal) medicine, “Juzen-Taiho-To”[J]. Phytomedicine, 1998, 5(5): 353-360. DOI:10.1016/S0944-7113(98)80017-2.
[13] 刘惠, 李丽立, 张彬, 等. 中草药多糖对断奶仔猪肠道组织形态的影响[J]. 家畜生态学报, 2008, 29(1): 63-66. DOI:10.3969/ j.issn.1673-1182.2008.01.014.
[14] ZHA Xueqiang, XIAO Jingjing, ZHANG Haining, et al. Polysaccharides in Laminaria japonica (LP): extraction, physicochemical properties and their hypolipidemic activities in dietinduced mouse model of atherosclerosis[J]. Food Chemistry, 2012, 134(1): 244-252. DOI:10.1016/j.foodchem.2012.02.129.
[15] ZHA Xueqiang, LUO Jianping, LUO Shuizhong, et al. Structure identification of a new immunostimulating polysaccharide from the stems of Dendrobium huoshanense[J]. Carbohydrate Polymers, 2007, 69(1): 86-93. DOI:10.1016/j.carbpol.2006.09.005.
[16] 郝冉, 王正明, 查学强, 等. 霍山石斛多糖的肠黏膜免疫调节活性及在小肠中的吸收分布[J]. 食品科学, 2014, 35(9): 256-259. DOI:10.7506/spkx1002-6630-201409050.
[17] 周林. 黏度法测定水溶液中裂褶多糖分子质量[J]. 功能高分子学报, 2005, 18(4): 692-695. DOI:10.3969/j.issn.1008-9357.2005.04.029.
[18] ZHOU Cunshan, MA Haile. Ultrasonic degradation of polysaccharide from a red algae (Porphyra yezoensis)[J]. Journal of Agricultural and Food Chemistry, 2006, 54(6): 2223-2228. DOI:10.1021/jf052763h.
[19] 刘玲, 纪淑娟, 檀德宏, 等. 利用电子自旋共振技术研究美拉德反应自由基变化[J]. 农业工程学报, 2013, 29(6): 280-286. DOI:10.3969/ j.issn.1002-6819.2013.06.035.
[20] ZHANG Zhongshan, WANG Xiaomei, ZHAO Mingxing, et al. Freeradical degradation by Fe2+/VC/H2O2, and antioxidant activity of polysaccharide from Tremella fuciformis[J]. Carbohydrate Polymers, 2014, 112(21): 578-582. DOI:10.1016/j.carbpol.2014.06.030.
[21] 刘益东. 提高豆渣中可溶性大豆多糖得率的方法及其机理初探[D].南昌: 南昌大学, 2012: 49-66.
[22] ZHANG Anqiang, XIAO Nannan, DENG Yinglin, et al. Purification and structural investigation of a water-soluble polysaccharide from Flammulina velutipes[J]. Carbohydrate Polymers, 2012, 87(3): 2279-2283. DOI:10.1016/j.carbpol.2011.10.061.
[23] BOULET J C, WILLIAMS P, DOCO T. A Fourier transform infrared spectroscopy study of wine polysaccharides[J]. Carbohydrate Polymers, 2007, 69(1): 79-85. DOI:10.1016/j.carbpol.2006.09.003.
[24] DENG C, HU Z, FU H, et al. Chemical analysis and antioxidant activity in vitro of a β-D-glucan isolated from Dictyophora indusiata[J]. International Journal of Biological Macromolecules, 2012, 51(1/2): 70-75. DOI:10.1016/j.ijbiomac.2012.05.001.
[25] PENG Y, ZHANG L, ZENG F, et al. Structure and antitumor activity of extracellular polysaccharides from mycelium[J]. Carbohydrate Polymers, 2003, 54(3): 297-303. DOI:10.1016/S0144-8617(03)00190-5.
[26] 郑年新, 阮金秀, 张永祥, 等. 六味地黄多糖在小鼠体内的吸收[J]. 中国药理学通报, 2000, 16(4): 403-405. DOI:10.3321/ j.issn:1001-1978.2000.04.013.
[27] 高其品, 陈慧群, 王坤, 等. 银耳多糖在大鼠体内的吸收、分布和排除[J]. 中国药学杂志, 2002, 37(3): 205-208. DOI:10.3321/ j.issn:1001-2494.2002.03.016.
[28] 朱怡卿, 刘玮, 王虹, 等. 多糖对肠道功能调节作用的研究进展[J].药学进展, 2015(4): 293-299.
[29] GRØNHAUG T E, KIYOHARA H, SVEAASS A, et al. Beta-D-(1→4)-galactan-containing side chains in RG-I regions of pectic polysaccharides from Biophytum petersianum Klotzsch. contribute to expression of immunomodulating activity against intestinal Peyer’s patch cells and macrophages[J]. Phytochemistry, 2011, 72(17): 2139-2147. DOI:10.1016/j.phytochem.2011.08.011.
[30] KIYOHARA H, MATSUMOTO T, YAMADA H. Intestinal immune system modulating polysaccharides in a Japanese herbal (Kampo) medicine, Juzen-Taiho-To[J]. Phytomedicine, 2002, 9(7): 614-624. DOI:10.1078/094471102321616427.
[31] 单春兰, 孙播东, 胡庆花, 等. 口服黄芪多糖对雏鸡十二指肠IgA+细胞分布的影响[J]. 中国兽医科学, 2016(2): 253-257. DOI:10.16656/ j.issn.1673-4696.2016.02.021.
Effect of Extraction Temperature on Physicochemical Properties and Intestinal Mucosal Immunomodulating Activity of Polysaccharides from Dendrobium huoshanense
JIANG Xianmin, WANG Zhengming, PAN Lihua, ZHA Xueqiang, LUO Jianping*
(School of Food Science and Engineering, Hefei University of Technology, Hefei 230009, China)
Abstract:Objective: To investigate the effect of extraction temperature on the yield, physicochemical properties and intestinal mucosal immunomodulating activity of polysaccharides extracted from Dendrobium huoshanense. Methods: Four different extraction temperatures including 40, 60, 80 and 100 ℃ were used to investigate the changes in the yield and intrinsic viscosity of Dendrobium huoshanense polysaccharides (DHP) extracted by the water extraction-ethanol precipitation method. High performance liquid chromatography (HPLC), gas chromatography (GC) and Fourier transform infrared spectrometry (FTIR) were used to analyze the molecular weight distribution, monosaccharide compositions and characteristic groups of DHP and its fractions eluted with water and salt solution from DEAE-cellulose anion exchange column. The conditioned medium from Peyer’s patch cells from the small intestine of mice was used to determine the intestinal mucosal immunomodulating activity of DHP and its fractions by observing the proliferation of bone marrow cells of mice. Results: With increasing extraction temperature, the yield of DHP rose and its intrinsic viscosity dropped. HPLC analysis showed that DHP extracted at different temperatures were mainly composed of higher molecular weight fraction (HMW) and lower molecular weight fraction (LMW). LMW, which had better thermal stability, mainly existed in the water-eluted fraction (DHPW) from DEAE-cellulose anion exchange column and HMW, which had weaker thermalstability, mainly existed in the salt-eluted fraction (DHPS). GC and FTIR analysis displayed that DHPW mainly consisted of Glc in α-conf i guration and DHPS mainly consisted of Glc, Gal, Ara and Man in β-conf i guration with some uronic acids. All DHPs from different extraction temperatures and the corresponding DHPW and DHPS fractions possessed intestinal mucosal immunomodulating activity and the activity of DHPS was higher than that of DHPW, but their activities decreased signif i cantly with increasing extraction temperature. Conclusion: Extraction temperatures not only inf l uenced the yield of DHP, but also markedly changed its intrinsic viscosity, molecular weight distribution, monosaccharide compositions and immunomodulating activity. Although higher temperature increased the extraction yield of DHP, it signif i cantly decreased the intestinal mucosal immunomodulating activity of DHP because of the reduction in the proportion of HMW in DHP.
Key words:Dendrobium huoshanense; extraction temperature; polysaccharides; physicochemical properties; intestinal mucosa; immunomodulating activities
DOI:10.7506/spkx1002-6630-201707028
中图分类号:Q539
文献标志码:A
文章编号:1002-6630(2017)07-0176-06
收稿日期:2016-04-27
基金项目:安徽省科技重大专项(15czz04087)
作者简介:江贤敏(1993—),女,硕士研究生,研究方向为多糖化学及生物学。E-mail:jiangxianmin1128@163.com
*通信作者:罗建平(1966—),男,教授,博士,研究方向为中草药与功能食品。E-mail:jianpingluo@hfut.edu.cn
引文格式:
江贤敏, 王正明, 潘利华, 等. 提取温度对霍山石斛多糖理化性质及肠道黏膜免疫活性的影响[J]. 食品科学, 2017, 38(7): 176-181. DOI:10.7506/spkx1002-6630-201707028. http://www.spkx.net.cn
JIANG Xianmin, WANG Zhengming, PAN Lihua, et al. Effect of extraction temperature on physicochemical properties and intestinal mucosal immunomodulating activity of polysaccharides from Dendrobium huoshanense[J]. Food Science, 2017, 38(7): 176-181. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201707028. http://www.spkx.net.cn