
李海珊,刘丽乔,聂少平*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:本实验以从江西婺源绿茶中提取的茶多糖(tea polysaccharides,TPS)为研究材料,研究不同剂量TPS对正常小鼠肠道健康及免疫调节功能的影响。实验小鼠随机分为正常组和低、中、高剂量TPS干预组。TPS干预21 d后,收集小鼠腹腔巨噬细胞,进行中性红吞噬实验检测腹腔巨噬细胞的吞噬能力,解剖获取小鼠脾脏、胸腺后称其质量并计算脾指数和胸腺指数。气相色谱法检测小鼠结肠内容物中短链脂肪酸(short chain fatty acids,SCFAs)的含量;靛酚蓝比色法测定结肠内容物中氨含量;pH计检测结肠内容物pH值;恒质量法检测结肠内容物含水量。结果显示:高、中、低剂量TPS干预组的小鼠免疫器官指数均显著增大,腹腔巨噬细胞吞噬能力呈剂量依赖性增强,结肠内容物的乙酸,丙酸和正丁酸的含量升高,而异丁酸、正戊酸、异戊酸的含量无明显变化;结肠内容物中氨含量下降,结肠内容物pH值下降,含水量升高。实验结果提示TPS具免疫调节功能及促进小鼠肠道健康的作用。
关键词:茶多糖;免疫调节;肠道健康
茶作为当今世界的一种日常饮料,主要分为绿茶、乌龙茶、红茶、黑茶等[1],每年约有30亿 kg茶叶被生产和消费[2]。近年来,绿茶因其抗氧化、抗肿瘤、降血糖等生物学活性被发现而备受关注[3]。绿茶的功效与其有效成分(茶多酚、茶多糖、茶氨酸、瞟呤碱等)有直接联系,而茶多糖(tea polysaccharides,TPS)作为其中含量最丰富的功能成分,有较大的研究和应用前景。TPS是一类与蛋白质结合在一起的多糖或糖蛋白[4]。随着对TPS生物学活性的深入发掘,它被证实具有多种生物学功效,例如降血糖[5-6]、抗疲劳[7]、抗氧化[8-9]、保肝作用[10]、抗凝血[11]、免疫调节[12]等,具有广泛的应用前景。
近年来,大量研究已证实多糖对机体免疫系统具有重要调节作用,植物多糖可通过与免疫细胞表面的多种受体结合来激活不同的信号通路进而调控动物机体的免疫系统,包括:刺激巨噬细胞、T/B淋巴细胞、自然杀伤细胞的分泌或增殖;调节细胞因子的释放;促进抗体的分泌;激活补体系统等[13]。越来越多的研究证明多糖不能被人体胃肠道消化,但其在结肠内可被肠道菌群选择性分解及发酵,产生短链脂肪酸(short chain fatty acids,SCFAs)[14]。SCFAs主要包括乙酸、丙酸及丁酸等。乙酸是肠道细菌在结肠中发酵多糖的主要产物,被吸收后可促进机体胆固醇的合成;丙酸可进入糖异生途径;丁酸是结肠、盲肠的首选能源物质[15]。然而,肠道菌群的代谢也可能会产生一些对机体健康有害的物质,如氨和硫化氢[16]。SCFAs和氨类物质作为肠道菌群代谢产物的代表,其含量变化在一定程度上反映了肠道环境的健康状态。胃肠道作为人体主要的消化吸收器官,其pH值的变化影响食物的消化吸收,与人体健康相关。
本实验以江西婺源绿茶为原料,通过水提醇沉法提取茶叶粗多糖,并通过Sevag法脱蛋白纯化后获得精多糖,研究不同质量浓度TPS对正常小鼠肠道健康及免疫调节作用的影响,实验小鼠随机分为正常组和低、中、高剂量TPS干预组,干预21 d后,检测小鼠免疫器官指数和腹腔巨噬细胞的吞噬能力,探究TPS对正常C57/BL6小鼠的免疫调节功能的影响。实验测定结肠内容物中SCFAs、氨类物质含量、pH值及含水量的变化,观察TPS对正常小鼠肠道健康的影响。
1.1 动物、材料与试剂
S P F级C 5 7/B L 6小鼠,4~6 周龄,体质量(20.0±0.2)g,资格证号:SCXK(湘)2012—0003,购自湖南斯莱克实验动物有限公司。实验中所有动物严格遵守南昌大学动物管理条例,伦理委员会鉴定许可。饲料、垫料均购买于湖南斯莱克实验动物有限公司,经过辐照杀菌用于动物的饲养。纯净水、生理盐水均经过高压灭菌处理。
茶多糖由南昌大学食品科学与技术国家重点实验室制备。粗老绿茶购自江西婺源,水提醇沉法提取粗多糖,Sevag法脱蛋白纯化获得精制茶多糖,通过高效渗透凝胶色谱(high performance gel permeation chromatography,HPGPC)法的分析,表明所制备茶叶多糖为均一多糖。测得组分中糖含量为55.1%,蛋白质含量为1.8%,离子色谱分析得出茶叶多糖中含有半乳糖醛酸,含量为33.5%。样品中糖、糖醛酸、蛋白质三者相加含量超过90%,表明所制得精制茶叶多糖纯度较高,杂质较少。分子质量约为289 734 D。气相色谱(gas chromatography,GC)分析确定茶叶多糖主要由鼠李糖、核糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,其物质的量比为1.26∶3.18∶4.08∶1.00∶1.52∶3.92[4]。
高纯度SCFAs标准品:乙酸(纯度100%)、正戊酸(纯度99.9%) 德国Merck公司;丙酸(纯度100%)比利时Janssen Chimica公司;异丁酸(纯度99.9%)、正丁酸(纯度100%)、异戊酸(纯度100%)、4-甲基戊酸(内标物) 美国Sigma公司。所有有机溶剂均为国产分析纯。
1.2 仪器与设备
AL04电子天平 梅特勒-托利多仪器(上海)有限公司;TDL-SA离心沉淀机 上海安亭分析仪器有限责任公司;Milli-Q超纯水仪 美国Millipore公司;超低温冰箱、MULTISKAN MK3酶标仪、Series II细胞培养箱3110 美国Thermo Scientif i c公司;TU-1900双光束紫外分光光度计 北京通用仪器有限责任公司;QL-861涡旋仪 海门市其林贝尔仪器制造有限公司;3k15离心机 德国Sigma公司;连续可调微量移液器(1 mL、200、10 μL) 德国Eppendorf公司;DGG-9140B电热恒温鼓风干燥箱 上海森倍实验仪器有限公司;PHS-3B精密pH计 上海雷磁有限公司;Agilent 6890 N气相色谱系统(190901N-213火焰离子化检测仪(flame ionization detector,FID)及HP-INNOWAX柱) 美国Agilent公司;超净工作台 吴江市净化设备总厂;ZDX-35B高压灭菌锅 上海申安医疗器械厂;CKX41倒置显微镜日本Olympus公司。
1.3 方法
1.3.1 动物实验
48只C57/BL6小鼠置于SPF级动物房恒温恒湿饲养,保证12 h/12 h灯光/黑暗循环,并给予基本膳食、足够饮用水,定时更换垫料并清洗笼子。适应性饲养1 周后随机分为生理盐水处理组(空白组,C)、TPS低剂量干预组(25 mg/kg TPS,TL)、TPS中剂量干预组(5 0 m g/k g T P S,T M)、T P S高剂量干预组(100 mg/kg TPS,TH)。
每日定时进行灌胃处理,对照组灌胃生理盐水,其余3 组行不同剂量TPS干预,连续灌胃21 d。在整个实验周期内,每天观察小鼠基本状况并记录体质量。
小鼠在实验结束前12 h禁食,颈椎脱臼法处死小鼠,无菌收集小鼠腹腔巨噬细胞并置于细胞培养箱内培养。摘除小鼠脾脏和胸腺并称质量。获取小鼠肠道并收集肠道内容物,将盲肠内容物与结肠内容物分别收集并保存;小鼠肠道内容物与肠道组织标本置于-80 ℃冰箱保存备用。
1.3.2 免疫器官指数测定
据小鼠解剖前体、脾脏和胸腺的质量,按式(1)、(2)计算其胸腺指数和脾指数,用于推断TPS对小鼠免疫调节作用的影响[17]。

式中:m1为动物脾脏质量/g;m2为动物解剖前体质量/g;m3为动物胸腺质量/g。
1.3.3 小鼠腹腔巨噬细胞吞噬能力测定
1.3.3.1 小鼠腹腔巨噬细胞培养
颈椎脱臼法处死小鼠后,无菌收集小鼠腹腔巨噬细胞[18],腹腔注射无菌磷酸盐缓冲液(phosphate buffered saline,PBS),轻揉小鼠腹部,微量移液器收集细胞悬液,离心后弃上清液,重悬于RPMI1640完全培养基中,置于37 ℃孵箱进行细胞培养。
1.3.3.2 中性红吞噬实验
腹腔巨噬细胞接种于96 孔板,以腹腔巨噬细胞作对照组,用1µg/mL的LPS刺激腹腔巨噬细胞为实验组,空白组未接种腹腔巨噬细胞,培养24 h后,弃细胞培养液,加入0.1%中性红溶液100 µL/孔,培养3 h后以温PBS洗3 次后,加入细胞裂解液200 µL/孔,静置30 min,酶标仪测定每孔吸光度,以A540nm记录并按式(3)计算吞噬指数[19]。每组样品重复测试3 次。
式中:A1为实验组吸光度;A3为对照组吸光度;A2为空白组吸光度。
1.3.4 结肠内容物中总SCFAs浓度测定
GC法测定总SCFAs浓度[20],结肠内容物与超纯水按质量-体积比1∶9经涡旋超声混匀,上清液经0.22 μm滤膜过滤,进行总SCFAs浓度测定。各标准分析物按不同浓度范围设定浓度梯度,并以其色谱峰面积制作标准曲线,计算结肠内容物中总SCFAs浓度。
色谱分析采用Agilent 6890 N气相色谱和HP-INNOWAX色谱柱进行。GC分析条件:FID;载气:N2;分流比:1∶1;N2流速:19.0 mL/min,空气流速:300 mL/min, H2流速:30 mL/min;检测器温度:240 ℃,进样口温度:240 ℃;升温程序:0.5 min升到100 ℃后,4 ℃/min升到180 ℃。样品进样量:0.2 μL。每次测定时间为20.5 min。每组样品重复测试3次。
1.3.5 结肠内容物氨类物质含量、结肠pH值、含水量测定
采用靛酚蓝比色法[21]测定结肠内容物氨含量,以A630nm为横坐标,氨浓度为纵坐标绘制标准曲线后,测定结肠内容物样液吸光度,根据结肠内容物质量、稀释倍数等换算关系计算粪便样品中的氨含量,以µmol/g粪便表示。每组样品重复实验3 次。
结肠内容物用蒸馏水以1∶9(m/V)的比例稀释,取上清液测定pH值。结肠内容物称质量后,置于(105±2) ℃的烘箱内干燥至恒质量并称质量记录[22],质量差值是结肠内容物含水量(恒质量法)。每组样品重复测试3 次。
1.4 数据统计分析
各组数据以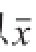 ±s表示。应用SPSS 20软件单因素方差分析,LSD检验。P<0.05表示差异显著,P<0.01表示差异极显著。
±s表示。应用SPSS 20软件单因素方差分析,LSD检验。P<0.05表示差异显著,P<0.01表示差异极显著。
2.1 实验周期内小鼠状态

图1 不同剂量TPS干预后小鼠体质量(n=12)
Fig. 1 Body weights in mice administered with different concentrations of TPS (n = 12)
在整个实验周期内,小鼠健康状态良好,没有出现死亡或疾病情况,也未观测到活动和行为的改变。同时TL、TM、TH组小鼠与C组小鼠在外观上没有明显差异。由图1可知,实验周期内C、TL、TM、TH组小鼠体质量无明显差异,且没有出现个别小鼠体质量骤减的情况。
2.2 免疫器官指数
表1 不同剂量TPS干预后小鼠免疫器官指数(n=12)
Table 1 Immune organ indices of mice administered with different concentrations of TPS (n= 12)
注:*.与C组相比差异显著(P<0.05),下同。
由表1可知,TL、TM、TH组小鼠免疫器官指数均较C组小鼠免疫器官指数明显增大,并呈剂量依赖关系,具有统计学意义(P<0.05),表明灌胃TPS对小鼠免疫器官指数有积极影响。
2.3 小鼠腹腔巨噬细胞吞噬能力
表2 不同剂量TPS干预后小鼠腹腔巨噬细胞吞噬能力(n=12)
Table 2 Phagocytosis of peritoneal macrophages in mice administered with different concentrations of TPS (n= 12)
由表2可知,TL、TM、TH组的小鼠腹腔巨噬细胞吞噬能力均较C组小鼠腹腔巨噬细胞吞噬能力明显增强,并呈剂量依赖性,具有统计学意义(P<0.05),表明灌胃高、中、低剂量TPS对小鼠腹腔巨噬细胞的吞噬能力有积极影响。
2.4 结肠内容物中总SCFAs浓度

图2 不同浓度TPS干预后小鼠结肠内容物中总SCFAs浓度(n =12)
Fig. 2 Total SCFA concentrations in colonic contents of mice administered with different concentrations of TPS (n = 12)
由图2可知,TL、TM、TH组小鼠均较C组总SCFAs浓度明显增大,并呈剂量依赖关系,具有统计学意义(P<0.05),表明灌胃茶多糖对小鼠总SCFAs的生成有积极影响。
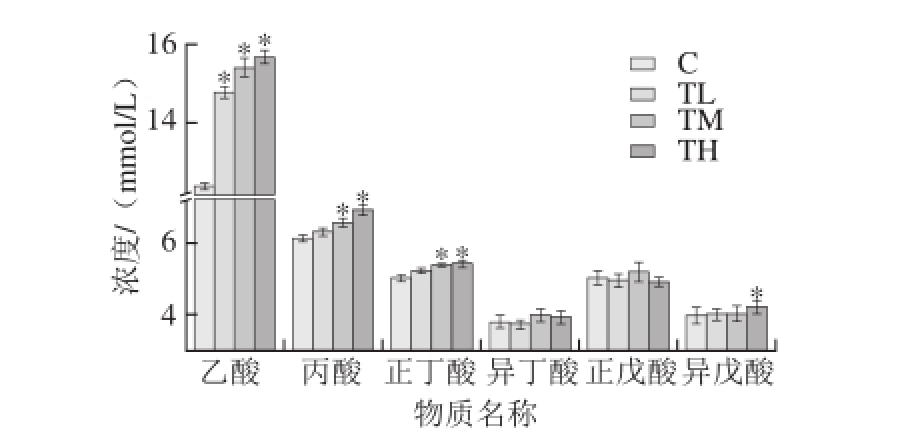
=12)
Fig. 3 The concentrations of acetic acid, propionic acid, butyric acid, isobutyric acid, valeric acid, isovaleric acid in colonic contents of mice in TPS treatment groups and control group (n = 12)
图3 TPS干预组与空白组结肠内容物中SCFA成分含量(n
TPS干预组与空白组结肠内容物中SCFA成分含量由图3可知,TL、TM、TH组的乙酸含量明显高于C组,并呈剂量依赖关系,具有统计学意义(P<0.05),表明灌胃茶多糖对小鼠乙酸的生成有积极影响。
TM、TH组结肠内容物中丙酸、正丁酸含量均明显高于C组(P<0.05),并呈剂量依赖关系。TL组小鼠结肠内容物中丙酸、正丁酸含量高于C组小鼠结肠内容物中丙酸、正丁酸含量但无显著性差别(P>0.05)。
TL、TM、TH组结肠内容物中异丁酸、正戊酸含量与C组的含量没有明显差异(P>0.05)。不同剂量TPS干预组的异戊酸含量均较C组的高,TH组小鼠结肠内容物中异戊酸含量明显高于C组(P<0.05),TM、TL组小鼠结肠内容物中异戊酸含量高于C组但无显著性差异(P>0.05)。结肠内容物中主要的SCFA是乙酸、丙酸和丁酸,约占总SCFAs含量的90%~95%[23],而结果发现这3 种SCFA的含量均升高,总SCFAs含量明显上升,提示TPS可促进SCFAs的产生。
2.5 结肠内容物中氨类物质含量、结肠pH值、含水量
紫外分光光度仪测量系列浓度梯度氨标准溶液浓度,以A630nm为横坐标,各吸光度对应的氨浓度为纵坐标,求得回归方程y=75.991x,相关系数为0.998。此结果说明靛酚蓝比色法测得的氨含量标准曲线在标准溶液质量浓度范围内(0.5~4.0 µg/mL,换算为氨浓度则为22.8~222.2 µmol/L),氨含量(y)和A630nm(x)相关性良好,该标准曲线可用于待测氨含量计算。
表3 不同剂量TPS干预后小鼠结肠内容物中氨含量、pH值、含水量(n=12)
Table 3 Ammonia content, pH and water content in colonic contents of mice administered with different concentrations of TPS (n= 12)

注:**.与C组相比差异极显著(P<0.01)。
由表3可知,TL、TM组结肠内容物氨含量均显著低于C组(P<0.05),表明低剂量TPS与中剂量TPS干预可明显降低氨类物质含量。TH组与C组相比,小鼠结肠内容物氨含量极显著降低(P<0.01),表明高剂量TPS干预能显著降低肠道内氨类物质的含量。肠道内氨含量的降低有助于人体肠道健康,因此TPS对维持肠道健康具有一定的作用。
TL、TM、TH组小鼠结肠内容物的pH值较C组均显著降低(P<0.05),并呈剂量依赖关系。表明不同剂量TPS干预均能显著地降低肠道pH值。pH值的降低能降低结肠癌等结肠类疾病发生的几率,因此TPS对小鼠肠道健康有积极影响。
TL、TM、TH组小鼠结肠内容物的含水量较C组均显著增加(P<0.05),并呈剂量依赖关系,表明高剂量TPS与中剂量TPS能显著地影响结肠内容物含水量。该结果提示TPS的摄入可使结肠内容物具有更强的持水力,形成松弛的粪便,有利于肠道健康。
哺乳类动物的脾脏和胸腺是重要的免疫器官[24],其脏器指数在一定程度上可反映机体免疫功能的强弱。巨噬细胞作为人体免疫系统的第一道屏障,对侵入人体的外来病原微生物具有极强的吞噬能力还能够清除自身衰老和凋亡细胞[25-26]。本实验研究结果显示,经TPS干预后,正常C57/BL6小鼠器官指数显著升高,巨噬细胞吞噬能力明显增强,提示TPS可增强小鼠非特异性免疫调节功能。
SCFAs与氨类物质均为碳水化合物在结肠内被肠道菌群发酵的主要产物。近期研究发现,SCFAs在肠道方面不仅可氧化以供能,还可维持电解质平衡、肠道菌群平衡、调节肠道功能、提高机体免疫等[27-28]。膳食纤维在肠道内发酵的主要代谢产物是乙酸,生物体内大部分乙酸会被吸收入血液,参与肝脏代谢,为组织器官生命活动提供能量。丙酸、丁酸可减少体内胰岛素的合成,间接减少胆固醇的合成[14]。结肠内容物中主要的SCFA是乙酸、丙酸和丁酸,约占 SCFAs 总量的90%~95%[23],而结果发现这3 种SCFA的含量均升高,总SCFAs含量明显上升,提示TPS可促进SCFAs的产生。而氨是某些菌群成员发酵内源性蛋白和尿素的产物,也是大部分肠道菌群的氮源物质。Wutzke等[29]认为肠道菌群对SCFAs和氨的调节可以营造更利于其生长繁殖的环境条件,这三者之间必然存在着相互联系。Sakata等[30]认为,肠道内SCFAs浓度增加引起酸度上升,可以促进以氨为氮源的肠道菌群对氨的利用,从而引起氨浓度降低。结肠内容物含水量的升高使其具有更强的持水力,形成松弛的粪便,有利于肠道健康。本研究显示,给予正常小鼠高中低剂量TPS干预后,正常小鼠肠道中SCFAs含量增加的同时,pH值降低,氨含量下降,内容物含水量升高。提示TPS干预有利于小鼠肠道健康。
综上所述,经TPS干预的小鼠器官指数明显升高,巨噬细胞吞噬能力明显增强,结肠内氨类物质含量、pH值均明显降低,结肠内容物含水量升高,结肠内的部分SCFAs(乙酸、丙酸、正丁酸)含量明显升高。提示TPS可增强机体的免疫调节能力且对维护肠道健康具有明显作用。
参考文献:
[1] TANAKA T, UMWKI H, NAGAI S, et al. Transformation of tea catechins and flavonoid glycosides by treatment with Japanese postfermented tea acetone powder[J]. Food Chemistry, 2012, 134(1): 276-281. DOI:10.1016/j.foodchem.2012.02.136.
[2] WANG Y F, HUANG S R, SHAO S H, et al. Studies on bioactivities of tea (Camellia sinensis L.) fruit peel extracts: antioxidant activity and inhibitory potential against α-glucosidase and α-amylase in vitro[J]. Industrial Crops and Products, 2012, 37(1): 520-526. DOI:10.1016/ j.indcrop.2011.07.031.
[3] XU P, WU J, ZHANG Y, et al. Physicochemical characterization of Puerh tea polysaccharides and their antioxidant and α-glycosidase inhibition[J]. Journal of Functional Foods, 2014, 6(1): 545-554. DOI:10.1016/j.jff.2013.11.021.
[4] 丁婧思, 聂少平, 冯燕玲, 等. 茶叶酸性多糖的分离、纯化及其理化性质研究[J]. 食品科学, 2014, 35(23): 57-60. DOI:10.7506/spkx1002-6630-201423012.
[5] LI S Q, CHEN H X, WANG J, et al. Involvement of the PI3K/Akt signal pathway in the hypoglycemic effects of tea polysaccharides on diabetic mice[J]. International Journal of Biological Macromolecules, 2015, 81: 967-974. DOI:10.1016/j.ijbiomac.2015.09.037.
[6] WANG Y F, PENG Y H, WEI X L, et al. Sulfation of tea polysaccharides: synthesis, characterization and hypoglycemic activity[J]. International Journal of Biological Macromolecules, 2010, 46(2): 270-274. DOI:10.1016/j.ijbiomac.2009.12.007.
[7] CHI A P, LI H, KANG C Z, et al. Anti-fatigue activity of a novel polyscharide conjugates from Ziyang green tea[J]. International Journal of Biological Macromolecules, 2015, 80: 566-572. DOI:10.1016/ j.ijbiomac.2015.06.055.
[8] ZHAO Z Y, HUANGFU L T, DONG L L, et al. Functional groups and antioxidant activities of polysaccharides from fi ve categories of tea[J]. Industrial Crops and Products, 2014, 58(1): 31-35. DOI:10.1016/ j.indcrop.2014.04.004.
[9] LU X S, ZHAO Y, SUN Y F, et al. Characterisation of polysaccharides from green tea of Huangshan Maofeng with antioxidant and hepatoprotective effects[J]. Food Chemistry, 2013, 141(4): 3415-3423. DOI:10.1016/j.foodchem.2013.06.058.
[10] WANG D Y, ZHAO Y, SUNY F, et al. Protective effects of Ziyang tea polysaccharides on CCl4-induced oxidative liver damage in mice[J]. Food Chemistry, 2014, 143(1): 371-378. DOI:10.1016/ j.foodchem.2013.08.005.
[11] CAI W R, XIE L L, CHEN Y, et al. Purification, characterization and anticoagulant activity of the polysaccharides from green tea[J]. Carbohydrate Polymers, 2013, 92(2): 1086-1090. DOI:10.1016/ j.carbpol.2012.10.057.
[12] 夏道宗, 张元君, 倪达美, 等. 安吉白茶多糖抗肿瘤及免疫调节研究[J].茶叶科学, 2013(1): 40-44. DOI:10.13305/j.cnki.jts.2013.01.008.
[13] 张桂国, 尚庆辉, 解玉怀, 等. 植物多糖的免疫调节作用及其机制研究进展[J]. 动物营养学报, 2015(1): 49-58. DOI:10.3969/j.issn.1006-267x.2015.01.008.
[14] LAYDEN B T, ANGUEIRA A R, BRODSKY M, et al. Short chain fatty acids and their receptors: new metabolic targets[J]. Translational Research, 2013, 161(3): 131-140. DOI:10.1016/j.trsl.2012.10.007.
[15] 刘松珍, 张雁, 张名位, 等. 肠道短链脂肪酸产生机制及生理功能的研究进展[J]. 广东农业科学, 2013(11): 99-103. DOI:10.3969/ j.issn.1004-874X.2013.11.029.
[16] 蔡访勤. 肠道正常菌群与人体健康和疾病密切相关[J]. 河南医学研究, 2001(2): 171-174. DOI:10.3969/j.issn.1004-437X.2001.02.027.
[17] YU Z M, HUANG X H, YAN C Q, et al. Effect of Fuzheng Jiedu granule on immunological function and level of immunerelated cytokines in immune-suppressed mice[J]. Journal of Integrative Agriculture, 2016, 15(3): 650-657. DOI:10.1016/S2095-3119(14)60971-0.
[18] YU Q, NIE S P, WANG J Q, et al. Toll-like receptor 4-mediated ROS signaling pathway involved in Ganoderma atrum polysaccharideinduced tumor necrosis factor-α secretion during macrophage activation[J]. Food and Chemical Toxicology, 2014, 66: 14-22. DOI:10.1016/j.fct.2014.01.018.
[19] 田维毅, 王文佳, 李海峰, 等. 中性红法检测巨噬细胞吞噬功能的实验条件的优化[J]. 贵阳中医学院学报, 2009, 31(2): 23-26.
[20] HU J L, NIE S P, MIN F F, et al. Polysaccharide from seeds of Plantago asiatica L. increases short-chain fatty acid production and fecal moisture along with lowering pH in mouse colon[J]. Journal of Agricultural and Food Chemistry, 2012, 60(46): 11525-11532. DOI:10.1021/jf302169u.
[21] XIE J H, FAN S T, NIE S P, et al. Lactobacillus plantarum NCU116 attenuates cyclophosphamide-induced intestinal mucosal injury, metabolism and intestinal microbiota disorders in mice[J]. Food & Function, 2016, 7(3): 1584-1592. DOI:10.1039/c5fo01516b.
[22] MIN F F, WAN Y J, NIE S P, et al. Study on colon health benef i t of polysaccharide from Cyclocarya paliurus leaves in vivo[J]. Journal of Functional Foods, 2014, 11: 203-209. DOI:10.1016/j.jff.2014.10.005.
[23] 王玉蕾, 郑跃杰. 肠道中短链脂肪酸与过敏性疾病关系的研究进展[J].中国微生态学杂志, 2013, 25(1): 104-108.
[24] 王君巧, 聂少平, 余强, 等. 黑灵芝多糖对免疫抑制小鼠的免疫调节和抗氧化作用[J]. 食品科学, 2012, 30(23): 274-277.
[25] 李蕾, 李海山, 宋乃宁. 邻苯二甲酸二丁酯对巨噬细胞吞噬能力的影响研究[J]. 中国免疫学杂志, 2011, 27(9): 771-778. DOI:10.3969/ j.issn.1000-484X.2011.09.001.
[26] 黄凌凌, 谢婷, 梁宁生. 胸腺五肽对大鼠腹腔巨噬细胞吞噬功能的影响研究[J]. 内科, 2016, 11(3): 347-349. DOI:10.16121/j.cnki.cn45-1347/r.2016.03.05.
[27] KUMAR A P, SHETTY A K, SALIMATH P V. Effect of dietary fi ber and butyric acid on lysosomal enzyme activities in streptozotocininduced diabetic rats[J]. European Food Research and Technology, 2006, 222(5): 692-696. DOI:10.1007/s00217-005-0199-3.
[28] 陈燕, 曹郁生, 刘晓华. 短链脂肪酸与肠道菌群[J]. 江西科学, 2006, 24(1): 38-40. DOI:10.3969/j.issn.1001-3679.2006.01.010.
[29] WUTZKE K D, LOTZ M, ZIPPRICH C. The effect of pre- and probiotics on the colonic ammonia metabolism in humans as measured by lactose-[15N2]ureide[J]. European Journal of Clinical Nutrition, 2010, 64(10): 1215-1221. DOI:10.1038/ejcn.2010.120.
[30] SAKATA T, KOJIMA T, FUJIEDA M, et al. Probiotic preparations dose-dependently increase net production rates of organic acids and decrease that of ammonia by pig cecal bacteria in batch culture[J]. Digestive Diseases and Science, 1999, 44(7): 1485-1493. DOI:10.1023/A:1026624423767.
Effects of Green Tea Polysaccharides on Intestinal Health and Immune Regulation in Mice
LI Haishan, LIU Liqiao, NIE Shaoping*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Abstract:The objective of this work was to evaluate the effect of tea polysaccharides (TPS, from Wuyuan green tea) on intestinal health and immune regulation in mice. Healthy C57/BL6 mice were randomly divided into four groups, and they were administrated by gavage with different concentrations of tea polysaccharides. After adaptive feeding for one week, the animals in these groups were given high, mediumand low doses of TPS and normal saline as blank control for 21 days, respectively. At the end of the experimental period, the mice were sacrif i ced, and spleen and thymus were harvested and weighted to calculate immune organ indexes. Peritoneal macrophages were used to examine phagocytosis activity by using neutral red phagocytosis assay. Short chain fatty acids (SCFAs) in colonic contents were analyzed by gas chromatography (GC) and ammonia by the indophenol blue colorimetric method. Meanwhile, the pH and water content of colonic contents were also measured. Results showed that immune organ indexes were increased signif i cantly after TPS administration. The phagocytosis of peritoneal macrophages was improved in a dose-dependent manner. Some SCFAs (acetic acid, propionic acid and butyric acid) were increased while no difference in isobutyrate, pentanoic acid and delphinic acid was detected. A signif i cant decline in the ammonia content and pH of colonic contents of mice was observed, while water content increased. Therefore, TPS can regulate immune function and promote intestinal health in mice.
Key words:tea polysaccharides; immune regulation; intestinal health
DOI:10.7506/spkx1002-6630-201707030
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)07-0187-06
引文格式:
李海珊, 刘丽乔, 聂少平. 茶多糖对小鼠肠道健康及免疫调节功能的影响[J]. 食品科学, 2017, 38(7): 187-192.
DOI:10.7506/spkx1002-6630-201707030. http://www.spkx.net.cn
LI Haishan, LIU Liqiao, NIE Shaoping. Effects of green tea polysaccharides on intestinal health and immune regulation in mice[J]. Food Science, 2017, 38(7): 187-192. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201707030. http://www.spkx.net.cn
收稿日期:2016-06-28
基金项目:国家自然科学基金优秀青年科学基金项目(31422042)
作者简介:李海珊(1994—),女,硕士研究生,研究方向为食品科学与工程。E-mail:lihaishan1112@163.com
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学、食品营养与安全。E-mail:spnie@ncu.edu.cn