赵一洁1,唐 毅1,王威浩1,姚世响1,邓丽莉1,2,曾凯芳1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
摘 要:为确定蜜橘果实酸腐病的致病菌及膜醭毕赤酵母、水杨酸和壳寡糖对蜜橘果实采后酸腐病的控制效果,从自然发病的蜜橘果实上分离出一株致病真菌,通过形态学特征、rDNA-ITS分析以及致病性检测,发现该真菌为蜜橘白地霉(Geotrichum candidum)。离体实验发现2.5 mmol/L水杨酸、质量分数1.5%壳寡糖处理能够抑制白地霉孢子萌发和菌丝的生长,膜醭毕赤酵母产生的挥发性物质能够抑制白地霉菌丝的生长。果实上的实验结果表明,
关键词:蜜橘;酸腐病;膜醭毕赤酵母;水杨酸;壳寡糖
蜜橘(Citrus unshiu Marc.)是中国、韩国和日本等亚洲地区最重要的柑橘品种之一。因其成熟期较集中,易造成市场供大于求,因此对其进行采后贮藏十分必要[1]。但是蜜橘在贮藏期间容易受到病原菌的侵染而造成大量的腐烂,从而造成严重的经济损失。在贮藏前期的病害主要是青霉病(Penicillium italicum)、绿霉病(Penicillium digitatum),贮藏后期主要的病害是酸腐病(Geotrichum citriaurentii)和炭疽病(Colletotrichum gloeosporioides)[2]。近年来,蜜橘酸腐病已经成为采后果实较难防治的病害之一,且不能被咪鲜胺、苯并咪唑类等传统杀菌剂所抑制[3],因此寻找有效控制蜜橘采后酸腐病的方法已经迫在眉睫。
随着社会的发展,人们越来越重视食品安全问题,寻找安全的抑菌剂十分必要,其中拮抗酵母和环境友好型的天然诱抗剂已经被广泛被用于果实采后病害的控制。膜醭毕赤酵母(Pichia membranaefaciens)属于毕赤酵母属(Pichia),可以与病原菌竞争生存空间,可以寄生在病原菌的菌丝上以抑制病原菌的生长,还可以诱导果实的抗病性以防治果实的采后病害[4]。研究表明,膜醭毕赤酵母能有效控制由Alternaria alternate、Penicillium expansum、Botrytis cinerea、Rhizopus stolonifer、Penicillium digitatum和Penilliun italicum引起的甜樱桃、桃、油桃、枇杷、苹果、蜜橘等果实的采后病害[5-8]。张璐等[9]研究结果表明,膜醭毕赤酵母能够抑制草莓的灰霉病,延长草莓的贮藏期。水杨酸(salicylic acid)作为一种天然抗菌物质,具有对多种细菌和真菌的直接抑制作用。Neto等[10]研究结果表明,2.5 mmol/L水杨酸能够100%抑制苹果扩展青霉孢子的萌发。壳寡糖(chitosan oligosaccharide)是经虾、蟹、贝类的外壳降解而成的脱乙酰几丁寡糖[11]。研究表明壳寡糖对多种植物真菌、细菌、病毒都有良好的抑制效果。Xu Junguang等[12]的研究表明,壳寡糖不仅能够抑制辣椒疫霉菌的菌丝生长,而且还能抑制其孢子的萌发;王丽等[13]研究结果表明,使用0.5 mg/mL的壳寡糖能够抑制蜜橘酸腐病孢子的萌发和芽管的生长;Ma Zengxin等[14]发现0.5 g/L的壳寡糖能够防治采后桃果实的褐腐病,延长桃果实的贮藏期。
膜醭毕赤酵母、水杨酸和壳寡糖均是天然的抗菌物质,无毒无害,不会危害环境和人类健康。研究发现这3 种抑菌物质对柑橘青霉病、绿霉病、炭疽病等均有很好的抑菌效果,但其对酸腐病鲜见系统的研究。根据文献[9-11]和本实验室前期研究发现1×108CFU/mL酵母、2.5 mmol/L水杨酸和质量分数1.5%壳寡糖抗菌效果最好。本研究利用组织块分离法在蜜橘病果上筛选出酸腐病的病原真菌,采用形态学特征、rDNA-ITS(internal transcribed spaer,内部转录间隔区)分析以及致病性检测对所分离的菌株进行鉴定,并利用膜醭毕赤酵母、水杨酸、壳寡糖对白地霉进行离体实验和果实实验,探讨膜醭毕赤酵母、水杨酸、壳寡糖对白地霉的抑制作用和对蜜橘酸腐病的控制效果,以期为蜜橘果实采后酸腐病的防治提供一定的理论参考。
1.1 材料与试剂
蜜橘可溶性固形物含量为(8.77±0.15)%,可滴定酸含量为(1.01±0.05)%,产地为重庆鸡公山,大小均一、成熟度一致、无机械伤。采摘后于实验室冷库7~10 ℃贮藏备用。实验时用2%次氯酸钠溶液浸泡2 min,后用自来水清洗并晾干。
膜醭毕赤酵母 中国工业微生物菌种保藏管理中心;水杨酸 成都市科龙化工试剂厂;壳寡糖 济南海得贝海洋生物工程有限公司;白地霉分离自蜜橘果实病健交界处。
1.2 仪器与设备
SW-CJ-1F超净工作台 苏净集团安泰有限公司;B203生物显微镜 重庆奥特光学仪器有限公司;PowerPac电泳仪 美国Bio-Rad公司;G:BOX EF凝胶成像仪 英国Syngene公司。
1.3 方法
1.3.1 膜醭毕赤酵母菌的制备
膜醭毕赤酵母悬浮液制作:1)活化菌种:在NYDA酵母培养基上扩大培养, 28 ℃条件下培养48 h;2)液体培养:挑取一环NYDA培养基上的酵母于NYDB液体培养基中,在200 r/min、28 ℃摇床中培养24 h;3)离心浓缩:5 000 r/min、4 ℃离心10 min,用无菌水洗涤2次,去培养基;4)血球计数板计数后用无菌水稀释至1×108CFU/mL备用。
1.3.2 水杨酸和壳寡糖溶液的制备
水杨酸为分析纯试剂,使用时用无菌水配制,浓度为2.5 mmol/L。壳寡糖为分析纯试剂,相对分子质量为1 500~2 000,使用时用无菌水配制,质量分数为1.5%。
1.3.3 蜜橘白地霉的分离与鉴定
1.3.3.1 组织块分离法分离纯化病原菌
参照刘霞[15]的方法,略有修改,选取已发病的蜜橘果实,利用75%乙醇进行消毒灭菌30 s,取病健交界处组织小方块(5 mm×5 mm),无菌水冲洗组织小方块3 次,放置于灭菌冷却的PDA平板上,置于恒温培养箱(相对湿度95%、28 ℃)内培养3~5 d,待菌落形成后进行单孢培养,获取纯化的病原菌。
1.3.3.2 蜜橘白地霉形态学鉴定
将浓度为的1×106CFU/mL孢子悬浮液加在含有PDA培养基载玻片上,进行载玻片培养,培养24 h在光学显微镜观察分生孢子形态、菌丝形态并拍照;将浓度为的1×106CFU/mL孢子悬浮液加在平板中央,28 ℃条件下倒置培养。观察并记录菌落形态并拍照。
1.3.3.3 蜜橘白地霉DNA的提取
参照易润华等[16]的方法,略做修改,对病原菌的DNA进行提取。称取0.5 g的病原菌菌丝,加入液氮快速充分研磨,研磨后移入1.5 mL的离心管中,加入600 μL 2×十六烷基三甲基溴化铵提取缓冲液(0.7 mol/L NaCl、100 mmol/L Tris-HCl pH 8.0,20 mmol/L乙二胺四乙酸、10 g/L聚乙烯吡咯烷酮、20 g/L十六烷基三甲基溴化铵,体积分数0.1% β-巯基乙醇),在恒温水浴锅于65 ℃条件下保温30 min,加等体积氯仿与异戊醇混合液(V(氯仿)∶V(异戊醇)= 24∶1)充分摇匀,4 ℃条件下8 000 r/min离心5 min。移取上清液至新的离心管中,加10%体积的3 mol/L醋酸钠溶液(pH 6.0)和2.5 倍体积的冰冻乙醇,沉淀,4 ℃条件下8 000 r/min离心5 min,弃上清液,用75%乙醇洗2~3 次,晾干,加Tris-乙二胺四乙酸缓冲液(10 mmol/L Tris-HCl、1 mmol/L乙二胺四乙酸pH 8.0)充分溶解后在-20 ℃条件下保存备用。
1.3.3.4 蜜橘白地霉DNA的鉴定
将提取的DNA低温保存,送至生工生物工程(上海)股份有限公司,进行聚合酶链式反应(polymerase chain reaction,PCR)扩增和测序,然后进行BLAST序列比对,根据序列同源性大小,确定该病原菌种类。
1.3.3.5 致病性实验
将分离纯化的病原菌,置于恒温培养箱(相对湿度95%、28 ℃)内进行培养7 d,获取浓度为1×104CFU/mL病原菌孢子悬浮液。选取健康无机械损伤、大小均匀的蜜橘果实,赤道部位损伤接种20 μL孢子悬浮液,用聚乙烯袋包装保湿,放置28 ℃贮藏室,观察果实的发病症状。
1.3.4 水杨酸、壳寡糖对蜜橘白地霉孢子萌发抑制效果的测定
将水杨酸和壳寡糖添加至55 ℃ PDA培养基中摇匀,使其分别为2.5 mmol/L和质量分数1.5%,以不添加介质的培养基为对照。取灭菌的载玻片,放于含有介质的PDA培养基中蘸一下,冷却形成薄层后,去掉一面琼脂培养基。用微量移液器移取10 μL蜜橘白地霉孢子悬浮液,滴在琼脂平面中间部位,平放于培养皿内的“U”形玻棒上,平皿底用无菌水吸水滤纸保湿,28 ℃保温保湿培养。分别于4 h和24 h显微镜观察孢子萌发情况,观察多个视野,使计数孢子个数不少于150 个,重复3 次[17]。按式(1)计算孢子萌发率。
1.3.5 水杨酸、壳寡糖对蜜橘白地霉菌丝生长抑制效果的测定
测定使用含毒介质法[18]并改进。将水杨酸和壳寡糖添加至55 ℃ PDA培养基中,摇匀,使其分别为2.5 mmol/L和质量分数1.5%,以不添加介质的培养基为对照。倒平板,每平板为15 mL,每处理3 个重复。培养基冷却凝固后,用灭菌的打孔器在已培养形成蜜橘白地霉菌落PDA平板上,取直径为1 cm菌斑,接种于PDA上,将平皿倒置放于28 ℃恒温培养箱中。每隔24 h观察菌丝生长情况,并用十字交叉法测定菌落直径,记录平均值。实验重复3 次。
1.3.6 膜醭毕赤酵母挥发性物质对蜜橘白地霉菌丝生长抑制效果的测定
采用双皿对扣法[19],测定膜醭毕赤酵母生长过程中产生的挥发性物质对蜜橘白地霉菌丝生长的影响。将100 μL 108CFU/mL膜醭毕赤酵母均匀涂抹在平板上。24 h后,在另一个PDA平板中央接种直径为1 cm的蜜橘白地霉菌块。将培养皿盖去掉,皿底口对口扣在一起,涂抹酵母平板在下,接种菌块的PDA平板在上,用封口膜封口。在对照实验中,一个PDA平板上不涂抹膜醭毕赤酵母,而另一个PDA平板上接种蜜橘白地霉菌块。于28 ℃条件下培养,每间隔24 h用十字交叉法测量蜜橘白地霉菌落直径。实验重复3 次。
1.3.7 同孔接种处理实验
蜜橘果实随机分为4 组,每组5 个果实,重复3 次。果实表面赤道部位用75%酒精擦拭消毒后,用消毒后的打孔器在果实赤道部位等距离打2 个孔(直径4 mm、深3 mm)。每个孔用微量移液枪接种20 μL处理液,4 组处理液分别如下:1)无菌水作为对照处理;2)2.5 mmol/L水杨酸溶液;3)1.5%壳寡糖溶液;4)1×108CFU/mL的膜醭毕赤酵母悬浮液。待处理液被果实充分吸收后用聚乙烯薄膜袋单果包装蜜橘果实,放置于20 ℃、相对湿度90%的环境中4 h,然后在果实的同一个孔中分别接种20 μL、1×104CFU/mL的白地霉孢子悬浮液。待菌液吸收干净后,再用聚乙烯薄膜袋单果包装,于20 ℃、相对湿度90%的环境中贮藏。每间隔24 h统计果实的发病率和病斑直径。发病率计算见式(2)。
1.3.8 异孔接种处理实验
接种4 组处理液方法同1.3.7节。果实在接种处理液24 h后,在果实原来的孔径周围1 cm左右,再打一个新孔(直径4 mm、深3 mm),在这个新孔中分别接种20 μL 1×104CFU/mL的白地霉孢子悬浮液。待菌液吸收干净后,再用聚乙烯薄膜袋单果包装,于20 ℃、相对湿度90%的环境中贮藏。每24 h统计果实的发病率和病斑直径。每组5 个果实,重复3 次。按式(2)计算发病率。
1.4 数据分析
采用Excel 2003软件统计分析所有数据,计算标准误差并制图;应用SPSS 11.5软件进行方差分析(ANOVA),利用邓肯式多重比较对差异显著性进行分析(P<0.05)。
2.1 病原菌的形态学鉴定
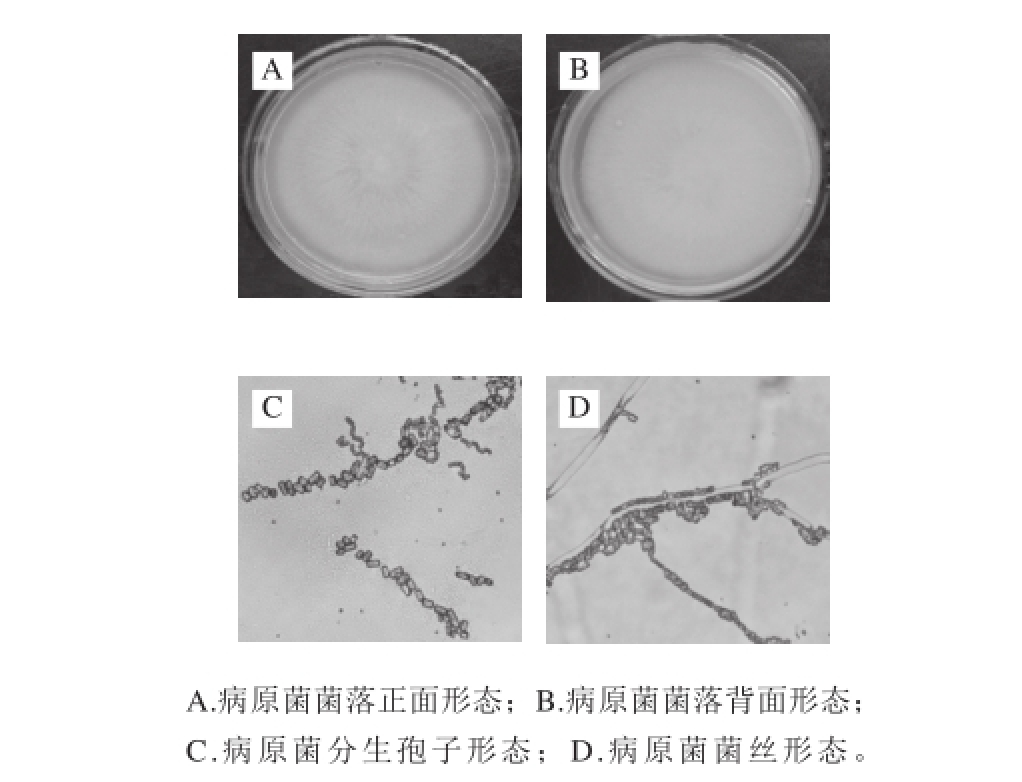
图1 病原菌的形态特征
Fig. 1 Phenotype characteristics of the pathogen
病原菌的菌落形态和显微形态如图1所示。在PDA培养基培养5 d,菌落呈圆形,较薄,正面颜色为白色平坦,中心为脐状突起,背面基质无色,平均直径达到70 mm以上,菌丝质地为绒毛状兼粉状,放射线状,边缘色浅,清晰(图1A、B)。孢子呈圆柱或长筒形、椭圆形、两端多圆形、少数平切;无色透明,单胞,有时成链状连接(图1C)。菌丝在生长过程中,呈二叉分枝,有横隔,菌丝无色(图1D)。参考真菌鉴定手册[20],病原菌的形态鉴定为典型的地霉属真菌的形态。
2.2 病原菌分子生物学鉴定

图2 菌株ITS的PCR产物电泳结果
Fig. 2 PCR products of the ITS region of the pathogen
如图2所示,以病原菌DNA作为模版,扩增出约1 318 bp左右的DNA片段。病原菌株rDNA-ITS测定结果如图3所示,测序结果表明该片段长1 318 bp。该核苷酸序列提交到GenBank核酸数据库(http://www.ncbi. nlm.nih.gov/blast)通过BLAST程序对比分析得知结果:该病原菌与已知的白地霉(Geotrichum candidum,AB000652.1)rDNA-ITS区域同源性为98%,根据该病原菌的形态学特征和分子鉴定结果,可以说明此病原菌就是白地霉。

图3 病原菌核苷酸序列
Fig. 3 Nucleotide sequences of the pathogen
2.3 病原菌致病性实验结果
将蜜橘果实表面分离的病原菌回接到健康的蜜橘果实上,能够引起蜜橘果实腐烂,果实3 d后发病,果实变软,发病处呈水渍状并果皮软化,病斑呈规则圆形,病斑扩展2 cm时,发病处凹陷,然后长出白色霉层,最后整果腐烂,并流出酸臭的液体,此症状与田间酸腐病果实一致(图4),到第8天时果实全部腐烂。从而进一步证明此病原菌就是白地霉。

图4 回接病原菌发病(A)和自然发病(B)症状
Fig. 4 Incidence of sour rot caused by the pathogen inoculated on satsuma mandarin (A) and natural incidence of satsuma mandarin (B)
2.4 水杨酸、壳寡糖对蜜橘白地霉孢子萌发以及菌丝生长的影响
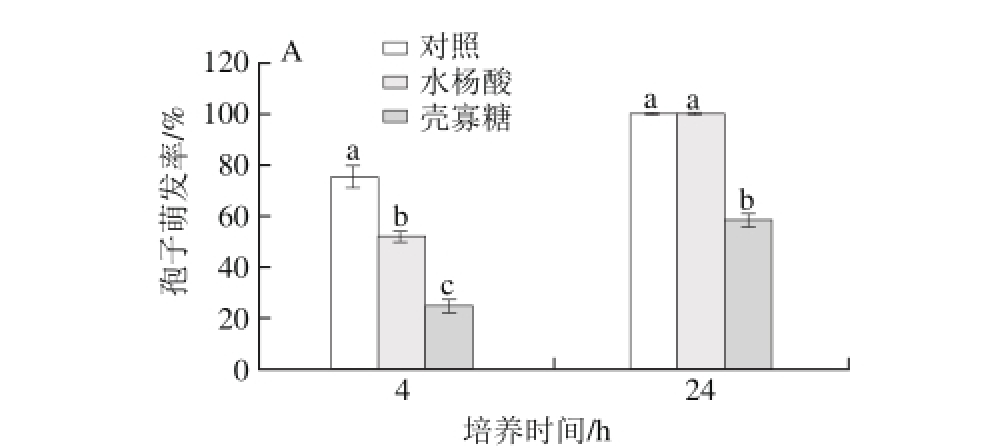

图5 水杨酸、壳寡糖对白地霉孢子萌发率(A)和菌丝生长(B)的影响
Fig. 5 Effect of salicylic acid and chitosan oligosaccharide treatment on the spore germination rate (A) and mycelium growth (B) of G. candidum
如图5所示,白地霉孢子萌发率和菌落直径均随着时间的增加呈上升的趋势。对孢子萌发率,在4 h时,3 个处理组间均有显著性差异(P<0.05),其中对照组的孢子萌发率分别为水杨酸处理组和壳寡糖处理组的1.5、3.1 倍。对菌落直径,水杨酸处理和壳寡糖处理与对照有显著性差异,且壳寡糖处理组的菌落直径一直显著低于水杨酸处理组,在第6天时,对照组的菌落直径为水杨酸处理组和壳寡糖处理组的1.24、6.33 倍。综上,水杨酸处理和壳寡糖处理能显著抑制孢子萌发率和菌落直径的上升(P<0.05),其中壳寡糖处理组效果显著优于水杨酸处理组(P<0.05)。
2.5 膜醭毕赤酵母挥发性物质对蜜橘白地霉菌丝生长的影响
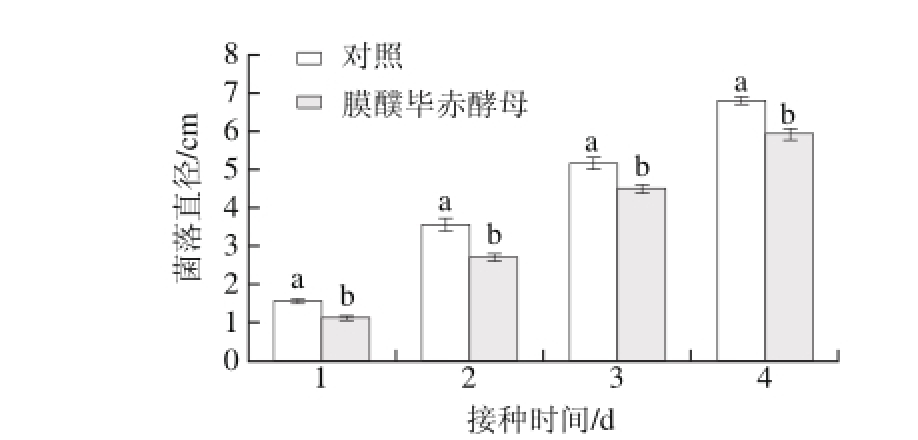
图6 膜醭毕赤酵母产挥发性物质对白地霉菌丝生长的抑制效果
Fig. 6 Effect of volatile organic compounds produced by P. membranaefaciens on the mycelial growth of G. candidum
如图6所示,白地霉菌落直径随着时间的延长菌落直径呈上升趋势,其中酵母挥发性物质能显著降低白地霉菌落直径的生长(P<0.05)。在接种膜醭毕赤酵母和蜜橘白地霉的对扣皿处理中,2 d后PDA平板上的蜜橘白地霉菌落直径为(2.7±0.1) cm,而在仅接种蜜橘白地霉对扣皿处理中,白地霉菌落直径达到(3.60±0.15) cm,2 种处理之间白地霉菌落直径差异性达到显著水平(P<0.05)(图7)。在接种膜醭毕赤酵母和白地霉的对扣皿处理中,2 种真菌在空间上是分离的,白地霉菌丝生长受到抑制,说明膜醭毕赤酵母在生长时利用PDA中的养分产生了挥发性抗真菌物质,从而抑制白地霉菌丝的生长。
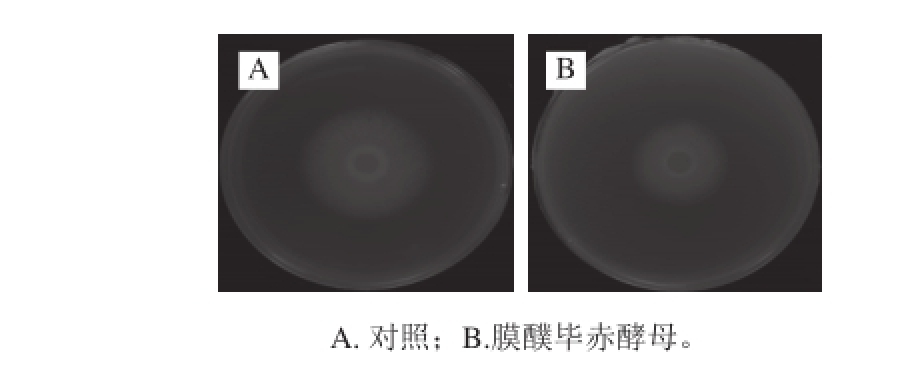
图7 2 d膜醭毕赤酵母产挥发性物质对蜜橘白地霉菌丝生长的影响
Fig. 7 Effect of volatile organic compounds produced by P. membranaefaciens on the mycelial growth of G. candidum after 2 days of storage
2.6 膜醭毕赤酵母、水杨酸、壳寡糖同孔接种处理对蜜橘果实酸腐病的防治效果
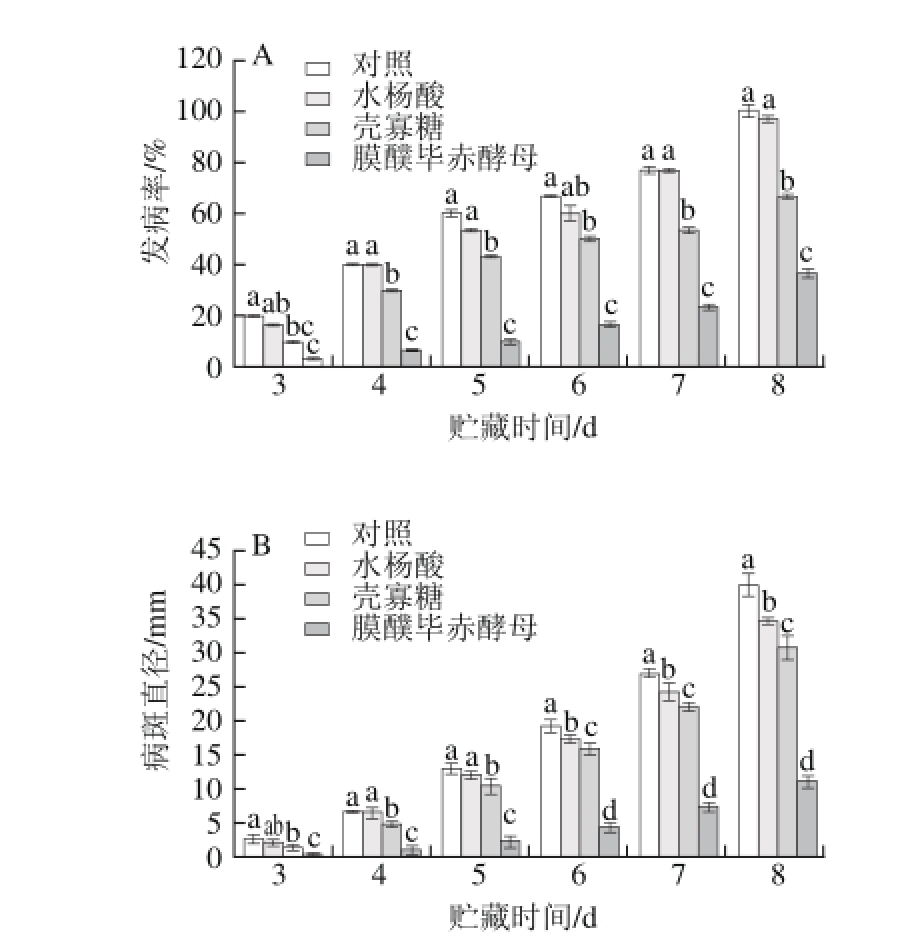
图8 膜醭毕赤酵母、水杨酸、壳寡糖与白地霉同孔接种处理对蜜橘果实酸腐病发病率(A)和病斑直径(B)的影响
Fig. 8 Effect of P. membranaefaciens, salicylic acid and chitosan oligosaccharide on disease incidence (A) and lesion diameter (B) of satsuma mandarin with G. candidum inoculation on the same wounds
如图8所示,膜醭毕赤酵母、水杨酸、壳寡糖同孔接种处理的蜜橘果实在贮藏期间,果实发病率和病斑直径随着时间的延长而增加。和对照相比,水杨酸处理组发病率和对照无显著性差异,但能够显著抑制病斑直径的扩增。壳寡糖和膜醭毕赤酵母处理组均能显著抑制蜜橘发病率和病斑直径的增长(P<0.05),且膜醭毕赤酵母处理组效果最好,并与壳寡糖处理组有显著性差异(P<0.05)。在贮藏第8天,对照组果实发病率分别是壳寡糖处理组、膜醭毕赤酵母处理组的1.49、2.70 倍,对照果实病斑直径分别是壳寡糖处理组、膜醭毕赤酵母处理组的1.29、3.64 倍。图9直观地表明在贮藏4、6、8 d同孔接种不同处理组之间病斑直径的扩展情况。可以看出,3 组处理均可以抑制酸腐病病斑直径的扩展,其中膜醭毕赤酵母处理效果最好。

图9 水杨酸、壳寡糖和膜醭毕赤酵母与白地霉同孔接种处理后柑橘果实酸腐病的发病情况
Fig. 9 Effect of salicylic acid, chitosan and P. membranaefaciens of satsuma mandarin with G. candidum inoculation on the same wounds after 4, 6 and 8 days of storage
2.7 膜醭毕赤酵母、水杨酸、壳寡糖异孔接种处理对蜜橘果实酸腐病的防治效果
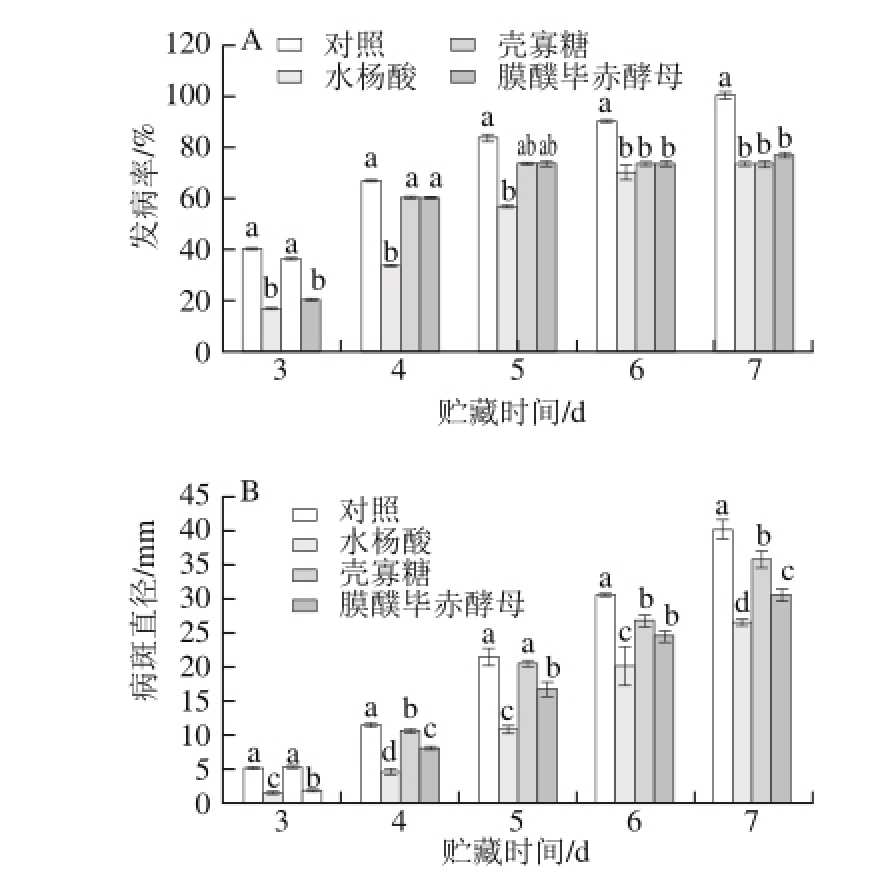
图10 膜醭毕赤酵母、水杨酸、壳寡糖与白地霉异孔接种处理对蜜橘果实酸腐病发病率(A)和病斑直径(B)的影响
Fig. 10 Effect of P. membranaefaciens, salicylic acid and chitosan oligosaccharide on disease incidence (A) and lesion diameter (B) of satsuma mandarin with G. candidum inoculation on different wounds
如图10所示,膜醭毕赤酵母、水杨酸、壳寡糖异孔接种处理的蜜橘果实在贮藏期间,果实发病率和病斑直径随着时间的延长而增加,和对照相比,3 种处理均能控制果实酸腐病的发病率和病斑直径的增长,且水杨酸处理组效果最好。水杨酸处理组能显著降低果实酸腐病的发病率和病斑直径(P<0.05)。在贮藏第7天,对照组的发病率和病斑直径分别是水杨酸处理组的1.37 倍和1.51倍。壳寡糖和酵母处理组发病率在前期均与对照组无显著性差异,到贮藏后期(第7天)其发病率与对照组有显著性差异,且在整个贮藏过程中均能显著抑制病斑直径的生长(P<0.05)。在贮藏第7天,对照组果实发病率分别是壳寡糖处理组、膜醭毕赤酵母处理组的1.37、1.30倍,对照果实病斑直径分别是壳寡糖处理组、膜醭毕赤酵母处理组的1.12、1.31倍。图11直观表明贮藏5、6、7 d异孔接种不同处理组之间病斑直径的扩展情况。可以看出,和对照相比3 组处理均可以抑制酸腐病病斑直径的扩展,其中水杨酸处理效果最好。
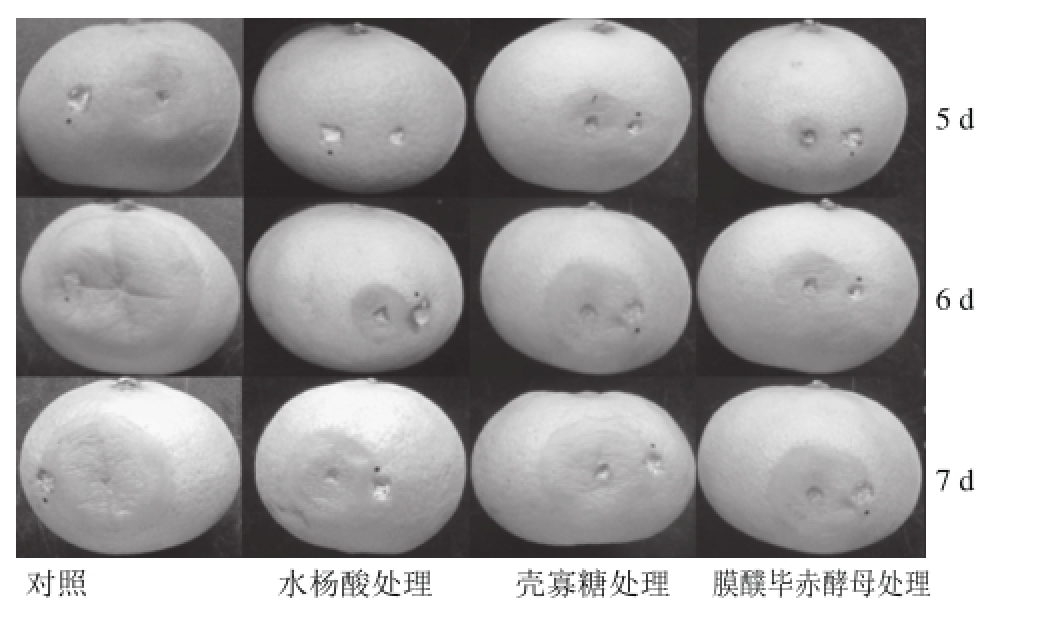
图11 水杨酸、壳寡糖和膜醭毕赤酵母与白地霉异孔接种处理后柑橘果实酸腐病的发病情况
Fig. 11 Effect of salicylic acid, chitosan and P. membranaefaciens of satsuma mandarin with G. candidum inoculation on the different wounds after 5, 6 and 7 days of storage
采用组织分离法从发病蜜橘果实上分离酸腐病菌,并进行致病性检测。根据致病性测定结果、病原菌菌落形态、孢子和菌丝形态以及分子生物学鉴定结果等鉴定蜜橘酸腐病菌为白地霉(Geotrichum candidum),与刘霞[15]、周海恩[21]和王哲[22]等的研究结果一致。同时,研究表明番茄、葡萄、桃子以及荔枝的酸腐病的病原菌也为白地霉[23-27],本实验结果与其一致。
本实验研究发现膜醭毕赤酵母在生长过程中产生的挥发性物质能够抑制蜜橘白地霉菌丝的生长,程雷[28]研究发现毕赤类酵母,季也蒙毕赤酵母(Pichia guilliermondii)能够抑制苹果灰霉菌和青霉菌菌落的扩展,与实验结果相一致。目前报道的膜醭毕赤酵母抗病机制主要包括竞争营养和空间、诱导植物产生抗性[29-30],本实验证实了膜醭毕赤酵母产生的挥发性物质同样对蜜橘酸腐病有较好的抑制作用,也是其主要的控病机理。水杨酸对枯草芽孢杆菌、金黄色葡萄球菌和黑曲霉菌、白色假丝酵母有直接抑制作用[31],本实验研究发现2.5 mmol/L水杨酸能够抑制蜜橘白地霉孢子的萌发和菌丝的生长,说明水杨酸对白地霉菌有直接抑制作用。王永博[32]发现水杨酸浓度在2~10 mmol/L时对黑斑病菌的抑制较为显著,杨超[33]研究表明水杨酸处理对灰葡萄孢菌的菌落直径和孢子萌发率均有抑制作用。本实验结果与其相一致。但王博宇等[34]发现0.025%~0.010%水杨酸对采后青椒黑斑病的孢子萌发和菌落扩展均无明显抑制作用,因水杨酸浓度与抑菌效果成正比[35-36],所以可能与其浓度过低有关。
壳寡糖对果蔬采后病害控制机制最先表现为直接的抑菌作用。壳寡糖的抑菌活性与其能改变菌丝体生长形态有关[37-40]。本实验发现质量分数1.5%壳寡糖能够抑制蜜橘白地霉孢子的萌发和菌丝的生长。祖庆勇等[41]研究发现高浓度的壳寡糖可以抑制交链孢菌菌丝的生长;Yan Jiaqi等[42]研究发现0.5~20.0 g/L的壳寡糖能够抑制枣黑霉病菌菌丝体的生长,本实验结果与其一致。但Molloy等[43]发现2 g/L壳寡糖对胡萝卜核盘菌无生长抑制作用。可能与壳寡糖的抑菌活性一般具有浓度效应有关,贾盼盼等[44]研究发现随着浓度的增加,壳寡糖对病原菌的抑制作用增强;同时也有可能用为壳寡糖对不同的病原菌有不同的半致死浓度[45],壳寡糖抑制梨黑斑病菌和轮纹病菌菌丝体生长的半抑制浓度分别为1.46 g/L和0.35 g/L[46]。
本实验中,同孔损伤接种实验中膜醭毕赤酵母处理、水杨酸处理、壳寡糖处理均对蜜橘酸腐病有控制效果。其中膜醭毕赤酵母的效果最好,与Zhou Yahan等[47]研究结果一致,壳寡糖处理要优于水杨酸处理,与阿衣木古丽·艾赛提[48]的研究一致。可能因为膜醭毕赤酵母对蜜橘酸病的控制是多方面的有关,不仅能够直接抑制病原菌生长,也能通过营养和空间的竞争,以及挥发性物质直接抑制病原菌生长。同时水杨酸和壳寡糖同孔处理效果与离体实验结果一致,可以得出同孔处理时水杨酸和壳寡糖可能主要通过直接抑制病原菌的生长和孢子萌发,从而抑制酸腐病的发病。而异孔损伤接种实验中水杨酸的效果最好。因为水杨酸能显著提高果实体内苯丙烷代谢相关酶的活性及果实总酚、类黄酮和木质素含量的积累[49-50],从而提高果实诱导抗病性。而邓雨艳等[51]研究壳寡糖处理果实后需要先激活水杨酸信号,从而产生诱导抗病性。所以水杨酸处理相对于壳寡糖处理更加直接,效果最好。
综上所述,蜜橘酸腐病的病原菌为白地霉菌株,膜醭毕赤酵母、水杨酸、壳寡糖均对蜜橘酸腐病有显著控制效果,直接抑菌病原菌及诱导寄主抗病性是其主要作用机制,其中膜醭毕赤酵母直接抑菌效果最好,而水杨酸可以显著提高蜜橘的诱导抗病性,壳寡糖的直接抑制作用优于提高蜜橘诱导抗病性,但其抗病效果并不明显。本实验初步研究了膜醭毕赤酵母、水杨酸、壳寡糖的控病效果,下一步可对水杨酸和酵母进行复合作用,或对其机理进行系统和深一步的研究;同时也可以研究其与不同拮抗剂复合,从而期待得到更好的效果,为蜜橘酸腐病的防治提供新的方法和思路。
参考文献:
[1] ZHU Feng, YUN Ze, MA Qiaoli, et al. Effects of exogenous 24-epibrassinolide treatment on postharvest quality and resistance of Satsuma mandarin (Citrus unshiu)[J]. Postharvest Biology and Technology, 2014, 100: 8-15. DOI:10.1016/j.postharvbio.2014.09.014.
[2] 陈仕俏, 赵文红, 白卫东. 我国柑橘的发展现状与展望[J]. 农产品加工学刊, 2008(3): 21-24. DOI:10.3969/j.issn.1671-9646-B.2008.03.006.
[3] 刘霞, 刘莉, 王鹏, 等. 罗伦隐球酵母对柑橘采后酸腐病的抑制效果[J].江师范大学学报(自然科学版), 2010, 33(1): 13-17. DOI:10.3969/ j.issn.1001-5051.2010.01.003.
[4] CAO Shifeng, ZHENG Yonghua, TANG Shuangshuang, et al. Improved control of anthracnose rot in loquat fruit by a combination treatment of Pichia membranifaciens with CaCl2[J]. International Journal of Food Microbiology, 2008, 126(1/2): 216-220. DOI:10.1016/ j.ijfoodmicro.2008.05.026.
[5] LUO Yang, ZENG Kaifang, MING Jian. Control of blue and green mold decay of citrus fruit by Pichia membranaefaciens and induction of defense responses[J]. Scientia Horticulturae, 2012, 135(2): 120-127. DOI:10.1016/j.scienta.2011.11.031.
[6] NANTAWANIT N, CHANCHAICHAOVIVAT A, PANIJPAN B, et al. Induction of defense response against Colletotrichum capsici in chili fruit by the yeast Pichia guilliermondii strain R13[J]. Biological Control, 2010, 52(2): 145-152. DOI:10.1016/j.biocontrol.2009.10.011.
[7] FAN Qing, TIAN Shiping. Postharvest biological control of Rhizopus rot of nectarine fruits by Pichia membranaefaciens[J]. Plant Disease, 2000, 84(11): 1212-1216. DOI:10.1094/PDIS.2000.84.11.1212.
[8] WANG Jia, WANG Hongyan, XIA Xiaoming, et al. Synergistic effect of Lentinula edodes and Pichia membranaefaciens on inhibition of Penicillium expansum infections[J]. Postharvest Biology and Technology, 2013, 81(7): 7-12. DOI:10.1016/j.postharvbio.2013.02.002.
[9] 张璐, 张瑶, 刘丽丹, 等. 膜醭毕赤酵母对草莓采后灰霉病抗病性的诱导[J]. 食品科学, 2013, 34(22): 286-291. DOI:10.7506/spkx1002-6630-201322058.
[10] NETO A C, LUIZ C, MARASCHIN M, et al. Eff i cacy of salicylic acid to reduce Penicillium expansum inoculum and preserve apple fruits[J]. International Journal of Food Microbiology, 2016, 35(1): 57-66. DOI:10.1016/j.ijfoodmicro.2016.01.007.
[11] 邓丽莉, 黄艳, 周玉翔, 等. 壳寡糖处理对柑桔果实贮藏品质的影响[J].食品工业科技, 2009, 30(7): 287-290.
[12] XU Junguang, ZHAO Xiaoming, HAN Xiuwen, et al. Antifungal activity of oligochitosan against Phytophthora capsici and other plant pathogenic fungi in vitro[J]. Pesticide Biochemistry and Physiology, 2007, 87(3): 220-228. DOI:10.1016/j.pestbp.2006.07.013.
[13] 王丽, 赵盼, 孟祥红. 壳聚(寡)糖对柑橘酸腐, 黑腐病菌的抑制作用及对采后病害的防治[J]. 食品工业科技, 2011, 32(12): 424-428.
[14] MA Zengxin, YANG Lingyu, YAN Haixia, et al. Chitosan and oligochitosan enhance the resistance of peach fruit to brown rot[J]. Carbohydrate Polymers, 2013, 94(1): 272-277. DOI:10.1016/ j.carbpol.2013.01.012.
[15] 刘霞. 柑橘果实采后酸腐病侵染规律及防治技术的研究[D]. 杭州:浙江大学, 2009: 16.
[16] 易润华, 朱西儒, 周而勋. 简化CTAB法快速微量提取丝状真菌DNA[J]. 湛江海洋大学学报, 2003, 23(6): 72-73.
[17] 胡健, 姜涌明. 壳寡糖抑制植物酸腐病菌生长的研究[J]. 扬州大学学报(自然科学版), 2000, 3(2): 42-44.
[18] 刘晓宇, 刘志恒, 吕淑霞. 壳寡糖对植物病原真菌的抑制作用[J]. 安徽农业科学, 2005, 33(2): 225. DOI:10.3969/j.issn.0517-6611.2005.02.021.
[19] HUANG R, LI G Q, ZHANG J, et al. Control of postharvest Botrytis fruit rot of strawberry by volatile organic compounds of Candida intermedia[J]. Phytopathology, 2011, 101(7): 859-869. DOI:10.1094/ PHYTO-09-10-0255.
[20] 魏景超. 真菌鉴定手册[M]. 上海: 上海科技出版社, 1979: 501-502.
[21] 周海恩, 陶能国, 贾雷. 一株柑橘采后酸腐病菌的分离与鉴定[J].湘潭大学自然科学学报, 2013, 35(1): 92-96. DOI:10.3969/ j.issn.1000-5900.2013.01.019.
[22] 王哲. 柑橘酸腐病菌的致病机理及其拮抗酵母研究[D]. 武汉: 华中农业大学, 2012: 36-37.
[23] 杨蕊, 杨峰, 赵瑞丽, 等. 番茄酸腐病菌的生物学特性研究[J]. 河南农业科学, 2013, 42(8): 71-74. DOI:10.3969/ j.issn.1004-3268.2013.08.017.
[24] MOLINE H E. Comparative studies with 2 geotrichum species inciting postharvest decays of tomato fruit[J]. Plant Disease, 1984, 68(1): 46-48. DOI:10.1094/pd-69-46.
[25] 宋来庆, 赵玲玲, 赵华渊. 葡萄酸腐病发病原因及防治对策分析[J]. 烟台果树, 2008, 103(3): 38-39. DOI:10.3969/ j.issn.1005-9938.2008.03.022.
[26] YAGHMOUR M A. Biology and sources of inoculum of Geotrichum candidum causing sour rot of peach and nectarine fruit in California[J]. Plant Disease, 2012, 96(2): 204-210. DOI:10.1094/pdis-05-11-0391.
[27] 蔡学清, 林通, 谢玲平, 等. 福建荔枝酸腐菌的生物学特性研究[J]. 热带作物学报, 2009, 30(12): 1858-1864. DOI:10.3969/ j.issn.1000-2561.2009.12.027.
[28] 程雷. 两种酵母对“红富士”苹果采后病害的生物防治研究[D]. 南京: 南京农业大学, 2010: 41-43.
[29] WANG Kaituo, JIN Peng, CAO Shifeng, et al. Biological ontrol of Green mould decay in postharvest chinese bayberries by Pichia membranaefaciens[J]. Journal of Phytopathology, 2011, 159(6): 417-423. DOI:10.1111/j.1439-0434.2010.01782.x.
[30] GUO Honglian, CUI Yang, ZHU Enlong, et al. Effect of antagonistic yeast Pichia membranaefaciens on black spot decay of postharvest broccoli[J]. European Journal of Plant Pathology, 2015, 143(2): 373-383. DOI:10.1007/s10658-015-0689-5.
[31] 郑国兴, 张春乐, 黄浩, 等. 水杨酸的抑酶与抑菌作用[J]. 厦门大学学报(自然科学版), 2006(增刊1): 19-22. DOI:10.3321/ j.issn:0438-0479.2006.z1.005.
[32] 王永博. 水杨酸诱导梨抗黑斑病作用机制研究[D]. 保定: 河北农业大学, 2010: 25-26.
[33] 杨超. 水杨酸及钙盐对采后果蔬贮藏影响的研究[D]. 郑州: 河南工业大学, 2013: 26-27.
[34] 王博宇, 郭红莲, 李喜宏, 等. 采后青椒黑斑病的抗病性诱导初步研究[J]. 食品科技, 2009, 34(1): 57-59.
[35] 孟雪娇, 邸昆, 丁国华. 水杨酸在植物体内的生理作用研究进展[J].中国农学通报, 2010, 26(15): 207-214.
[36] 王芳芳. 外源水杨酸诱导苹果抗轮纹病效应的研究[D]. 保定: 河北农业大学, 2008: 38-39.
[37] XU Junguang, ZHAO Xiaoming, HAN Xiuwen, et al. Antifungal activity of oligothitosan against Phytophthora capsici and other plant pathogenic fungi in vitro[J]. Pesticide Biothemistry and Physiology, 2007, 87(3): 220-228. DOI:10.1016/j.pestbp.2006.07.013.
[38] ROBLES-MARTÍNEZ L, GUERRA-SÁNCHEZ M G, HERNÁNDEZ-LAUZARDO A N, et al. Effects of chitosan and oligothitosan on development and mitothondrial function of Rhizopus stolonifer[J]. Journal of Basic Microbiology, 2014, 54(Suppl 1): 42-49. DOI:10.1002/jobm.201300790.
[39] MENG Xiangchun, TANG Yanxia, ZHANG Aiyu, et al. Effect of oligothitosan on development of Colletotrichum musae in vitro and in situ and its role in protection of banana fruits[J]. Fruits, 2012, 67(3): 147-155. DOI:10.1051/fruits/2012008.
[40] YANG Lingyu, ZHANG Jianlei, BASSETT C L. et al. Difference between chitosan and oligothitosan in growth of Monilinia fructicola and control of brown rot in peach fruit[J]. LWT-Food Science and Technology, 2012, 46(1): 254-259. DOI:10.1016/j.lwt.2011.09.023.
[41] 祖庆勇. 壳寡糖诱导番茄抗交链孢菌及菌毒素提取研究[D]. 天津:天津科技大学, 2014: 57-58.
[42] YAN Jiaqi, CAO Jiankang, JIANG Weibo, et al. Effects of oligochitosan on postharvest Alternaria rot, storage quality, and defense responses in Chinese jujube (Zizyphus jujuba Mill. cv. Dongzao) fruit[J]. Journal of Food Protection, 2011, 74(5): 783-788. DOI:10.4315/0362-028X.JFP-10-480.
[43] MOLLOY C, CHEAH L H, KOOLAARD J P. Induced resistance against Sclerotinia sclerotiorum in carrots treated with enzymatically hydrolysed chitosan[J]. Postharvest Biology and Technology, 2004, 33(1): 61-65. DOI:10.1016/j.postharvbio.2004.01.009.
[44] 贾盼盼, 刘晓丹, 吝晨晨, 等. 壳寡糖对杏果实采后主要病原菌抑菌作用的研究[J]. 新疆农业科学, 2012, 49(2): 290-295.
[45] 闫佳琪, 张忆楠, 赵玉梅, 等. 壳寡糖控制果蔬采后病害及诱导抗病性研究进展[J]. 食品科学, 2015, 36(21): 268-272. DOI:10.7506/ spkx1002-6630-201521050.
[46] MENG Xianghong, YANG Lingyu, KENNEDY J F. Effects of chitosan and oligochitosan on growth of two fungal pathogens and physiological properties in pear fruit[J]. Carbohydrate Polymers, 2010, 81(1): 70-75. DOI:10.1016/j.carbpol.2010.01.057.
[47] ZHOU Yahan, ZHANG Lu, ZENG Kaifang. Efficacy of Pichia membranaefaciens combined with chitosan against Colletotrichum gloeosporioides in citrus fruits and possible modes of action[J]. Biological Control, 2016, 96(2): 39-47. DOI:10.1016/ j.biocontrol.2016.02.001.
[48] 阿衣木古丽·艾赛提. 杏采后病原菌鉴定及采前壳寡糖和水杨酸处理对杏品质和病害的影响[D]. 乌鲁木齐: 新疆农业大学, 2014: 37-44.
[49] 赵妍, 王晨. 水杨酸处理对苹果采后品质及炭疽病害的影响[J]. 食品工业, 2015, 36(9): 195-198.
[50] 范存斐, 毕阳, 王云飞, 等. 水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响[J]. 中国农业科学, 2012, 45(3): 584-589. DOI:10.3864/ j.issn.0578-1752.2012.03.022.
[51] 邓雨艳, 明建, 张昭其, 等. 壳聚糖诱导脐橙果实抗病性、水杨酸及活性氧代谢变化[J]. 中国农业科学, 2010, 43(4): 812-820. DOI:10.3864/j.issn.0578-1752.2010.04.019.
Isolation and Identif i cation of Sour Rot Pathogen of Satsuma Mandarin and Inhibitory Effects of Three Antifungal Substances on It
ZHAO Yijie1, TANG Yi1, WANG Weihao1, YAO Shixiang1, DENG Lili1,2, ZENG Kaifang1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Chongqing Engineering Research Center of Regional Food, Chongqing 400715, China)
Abstract:This investigation aimed to identify the sour rot pathogen of satsuma mandarin and to test the effect of Pichia membranaefaciens, salicylic acid and chitosan oligosaccharide in controlling this pathogen. We isolated a fungal pathogen from naturally infected citrus fruits and identif i ed it as Geotrichum candidum on the basis of morphological characteristics, rDNA-ITS sequence analysis and pathogenicity. In addition, 2.5 mmol/L salicylic acid and 1.5% chitosan oligosaccharide could signif i cantly inhibit the germination and mycelial growth of G. candidum under detached conditions. The volatile substances of P. membranaefaciens could inhibit the mycelial growth of G. candidum. Similarly, 1 × 108CFU/mL P. membranaefaciens, 2.5 mmol/L salicylic acid and 1.5% chitosan oligosaccharide treatment of the same and different wounds could control sour rot incidence and lesion diameter, especially P. membranaefaciens and salicylic acid through inoculation on the same wounds and different wounds, respectively.
Key words:satsuma mandarin; sour rot; Pichia membranaefaciens; salicylic acid; chitosan oligosaccharide
DOI:10.7506/spkx1002-6630-201707037
中图分类号:S666.2
文献标志码:A
文章编号:1002-6630(2017)07-0230-08
引文格式:
赵一洁, 唐毅, 王威浩, 等. 蜜橘酸腐病病原菌的分离鉴定以及不同抑菌剂处理对其控制效果[J]. 食品科学, 2017, 38(7): 230-237. DOI:10.7506/spkx1002-6630-201707037. http://www.spkx.net.cn
ZHAO Yijie, TANG Yi, WANG Weihao, et al. Isolation and identif i cation of sour rot pathogen of satsuma mandarin and inhibitory effects of three antifungal substances on it[J]. Food Science, 2017, 38(7): 230-237. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201707037. http://www.spkx.net.cn
收稿日期:2016-07-26
基金项目:“十二五”国家科技支撑计划项目(2015BAD16B07);中央高校基本科研业务费专项(XDJK2016E111);国家自然科学基金面上项目(31271958)
作者简介:赵一洁(1993—),女,硕士研究生,研究方向为农产品贮藏工程。E-mail:zhaoyijie1993@163.com
*通信作者:曾凯芳(1972—),女,教授,博士,研究方向为农产品贮藏工程。E-mail:zengkaifang@163.com
1×108CFU/mL膜醭毕赤酵母、2.5 mmol/L水杨酸、1.5%壳寡糖同孔接种和异孔接种处理均能够有效抑制蜜橘果实酸腐病的发病率和病斑直径的上升,其中同孔处理膜醭毕赤酵母效果最好,异孔处理水杨酸效果最好。