糖尿病作为一类慢性疾病已严重危害人们健康和生活质量,患者通常以注射胰岛素并长期使用降血糖药物维持正常血糖水平[1]。α-葡萄糖苷酶抑制剂是目前应用较广泛的降血糖药物[2]。α-葡萄糖苷酶抑制剂参与竞争性抑制小肠黏膜刷状缘上的α-葡萄糖苷酶,减缓碳水化合物快速分解成葡萄糖,从而达到调节糖尿病患者餐后血糖的作用[3-4]。开发自然来源的α-葡萄糖苷酶抑制剂已成为糖尿病治疗的热点。研究表明,一些天然产物如多糖类[5]、多酚类[6]、黄酮类[7]等在抑制α-葡萄糖苷酶活性方面表现突出。膳食纤维的一些生理作用已得到科学实验证实,如促进胃肠道健康、预防肥胖、降低心血管疾病和糖尿病的病发率等[8]。为了防护慢性疾病的发生,应适当增加膳食纤维的摄入。
小米糠为谷子加工过程中产生的副产物,其中含有50%~60%的膳食纤维。美国谷物化学家协会将膳食纤维定义为“膳食纤维是一种在人体小肠耐消化、吸收,在大肠完全或部分发酵的植物可食部分或类似碳水化合物”[9]。根据其溶解性不同可分为不溶性膳食纤维(insoluble dietary fiber,IDF)和水溶性膳食纤维(soluble dietary fiber,SDF)[10]。SDF在调节血糖、血脂,防止心血管疾病等方面具有良好的生理活性[11-14]。如何采用简便有效的改性方法使IDF向SDF转化,成为膳食纤维改性研究的热点[15-16]。利用先进的技术手段分析改性方法对膳食纤维结构的影响,已成为膳食纤维研究领域的重点。
本实验以小米糠为实验材料,采用超声-微波协同法对气爆预处理小米糠膳食纤维进行改性处理,同时借助扫描电子显微镜、凝胶色谱-示差-多角度激光光散射[17]和离子色谱法[18]等技术对改性前后小米糠膳食纤维的结构进行分析。目前有关小米糠SDF的研究多集中在提取工艺、改性方法和理化特性方面[19-20],关于小米糠SDF能否通过抑制α-葡萄糖苷酶活性这一重要途径来调节血糖的研究鲜见报道。通过建立α-葡萄糖苷酶抑制剂体外模型,研究改性前后小米糠SDF对α-葡萄糖苷酶的抑制作用,为膳食纤维功能性产品的开发和动物实验提供理论依据。
1 材料与方法
1.1 材料与试剂
红谷小米糠 黑龙江省大庆肇州托古小米厂;耐高温α-淀粉酶、中性蛋白酶、淀粉葡萄糖苷酶、α-葡萄糖苷酶、对硝基苯酚吡喃葡萄糖苷(p-nitrophenol glucopyranoside,PNPG) 美国Sigma公司;牛血清白蛋白 上海Aladdin公司;其他试剂均为分析纯。
1.2 仪器与设备
GDE-CSF6膳食纤维测定仪 意大利VELP公司;QBS-200B型气爆工艺试验台 鹤壁正道生物能源公司;K-360全自动凯氏定氮仪 瑞士BÜCHI公司;S-570扫描电子显微镜 日本日立公司;DAWNHELEOSⅡ多角度激光光散射、OPTILAB T-rEX示差检测器美国Wyatt公司;Nicolet 6700傅里叶变换红外光谱仪、ICS5000离子色谱仪 美国Thermo Fisher公司;MR-96A酶标仪 深圳迈瑞生物医疗电子股份有限公司。
1.3 方法
1.3.1 小米糠的预处理
脱脂小米糠:取适量小米糠粉碎,40 ℃烘干,水分质量分数控制在6%~8%范围内,过40 目筛,进行脱脂处理[21],备用。
气爆小米糠:称取500 g小米糠加入气爆反应器中进行处理。设置不同的气爆压力和时间,小米糠经气爆预处理后烘干、粉碎、过筛、脱脂。1.3.2 小米糠SDF、IDF的制备
改性前小米糠膳食纤维:称取5.0 g脱脂小米糠,分别经耐高温α-淀粉酶、中性蛋白酶、淀粉葡萄糖苷酶的酶解,灭酶,滤液浓缩后,用4 倍体积的95%(体积分数)乙醇溶液醇沉、离心、干燥得SDF,滤渣用热水洗涤、干燥得IDF。同时去除空白、未消化蛋白质、灰分的影响。
改性后小米糠膳食纤维:称取5.0 g气爆小米糠,分别经耐高温α-淀粉酶、中性蛋白酶、淀粉葡萄糖苷酶的酶解,灭酶,将全部反应液转移至超声-微波协同萃取仪中进行改性处理,设置微波功率535 W、料液比1∶50(m/V)、超声-微波协同处理时间53 min,滤液浓缩后,用4 倍体积的95%(体积分数)乙醇溶液醇沉、离心、干燥得SDF,滤渣用热水洗涤、干燥得IDF。
1.3.3 小米糠SDF的超微结构观察
取适量样品固定于观察台上,采用离子溅射方法镀金,置于扫描电子显微镜下观察、分析[22]。
1.3.4 小米糠SDF相对分子质量分布测定
样品处理方法:取10 mg SDF样品,加1.0 mL 0.1 mol/L NaNO3溶液,45 ℃孵育4 h,再稀释4 倍,过0.22 μm滤膜,取100 μL上样[23]。
检测条件:流动相为0.1 mol/L NaNO3,流速为0.8 mL/min,柱温为45 ℃,分析柱型号为Ohpak SB-804 HQ、Ohpak SB-803 HQ,上样量100 μL。
1.3.5 小米糠IDF的X射线衍射测试
将小米糠IDF进行干燥、粉碎,研磨至无颗粒感,随后将样品均匀洒入框内,略高于框板面,并用不锈钢片压实样品,确保样品紧密平整且表面光滑,与框紧密结合,将样品框插在测角仪中心的底座上,进行测试[24]。
1.3.6 小米糠SDF、IDF的傅里叶变换红外光谱测定
称取小米糠SDF和IDF,在红外灯下将样品与KBr粉末混匀并充分研磨,利用真空压片机进行压片,置于傅里叶变换红外光谱仪中扫描,扫描范围为4 000~400 cm-1,绘制傅里叶变换红外光谱图[25]。
1.3.7 小米糠SDF的单糖组成成分分析
1.3.7.1 小米糠SDF的水解
分别称取5 mg小米糠SDF,各加入2.5 mol/L三氟乙酸(trifluoroacetic acid,TFA),在121 ℃烘箱内水解2 h,冷却至室温用氮气吹干,加少量甲醇并用氮气反复吹干,加入1 mL水溶解,定容至100 mL,最后取25 µL上样[26]。
1.3.7.2 离子色谱分析
Dionex ICS 5000离子色谱仪,检测器:PAD(脉冲安培检测器);分析柱型号:CarboPac-PA10,柱温:30 ℃,流速:1.0 mL/ min;流动相条件:0~40 min:5 mmol/L NaOH,40~45 min:100 mmol/L NaOH+100 mmol/L NaOAc,45~50 min:200 mmol/L NaOH,50.2~55.0 min:5 mmol/L NaOH。
1.3.7.3 单糖含量的计算
单糖含量的计算按照式(1)进行。
1.3.8 体外抑制α-葡萄糖苷酶活性的测定
1.3.8.1 样品处理方法
称取100 mg脱脂小米糠SDF,溶于蒸馏水中,过0.45 μm滤膜,配制成20 mg/mL的样品溶液。依次取0.2、0.3、0.4、0.6、0.8、1.0 mL样品溶液,并依次添加蒸馏水至2 mL,配制成不同质量浓度梯度的待测样品溶液。
改性小米糠SDF样品溶液增加一个质量浓度梯度(1.2 mL样品溶液添加蒸馏水至2 mL),其他处理同脱脂小米糠SDF样品溶液。
1.3.8.2 测定方法
采用96 孔酶标仪测定α-葡萄糖苷酶抑制活力[27-28]。在96 孔酶标板中先后加入100 µL浓度为0.5 mol/L的磷酸盐缓冲溶液、20 µL质量浓度为0.913 3 mg/mL的底物PNPG溶液、20 µL酶溶液、15 µL不同质量浓度梯度的待测样品溶液。然后水平振荡酶标板使溶液混匀,密封,置于37 ℃培养箱中反应1 h。反应完成后,取出酶标板,依次加入50 µL浓度为0.57 mo1/L Na2CO3溶液来终止反应。该反应过程中会释放一定量的对硝基苯酚(p-nitrophenol,PNP),该物质在405 nm波长处有最大吸收峰,在一定浓度范围内,此物质的吸光度与α-葡萄糖苷酶抑制率正相关。空白对照组中由与样品体积相等的蒸馏水代替。α-葡萄糖苷酶抑制率(AGA)的计算公式如式(2)所示。
式中:A1为样品组的吸光度;A2为空白组的吸光度。
2 结果与分析
2.1 改性前后小米糠SDF含量比较
结果表明,经超声-微波协同改性后的小米糠SDF含量(10.841%)明显增加,远高于未经改性的小米糠SDF含量(2.157%),说明超声-微波协同改性适用小米糠膳食纤维改性工艺的研究。
2.2 改性前后小米糠SDF的超微结构

图1 改性前后小米糠SDF的扫描电子显微镜图
Fig. 1 SEM images of millet bran SDF before and after modification
a.脱脂小米糠SDF(×25 000);b.脱脂小米糠SDF(×500);
c.改性小米糠SDF(×25 000);d.改性小米糠SDF(×500)。
从扫描电子显微镜图(图1)可看出,在相同放大倍数下,改性前后小米糠SDF具有不同的形态结构。脱脂小米糠SDF颗粒较大且颗粒大小不一,形状为不规则碎片,表面较光滑,结构较致密。改性小米糠SDF的颗粒表面变得粗糙,疏松多孔,呈蜂窝状,是由小颗粒聚集在一起的。改性前后小米糠SDF微观结构的不同导致了性质差异。由于气爆预处理和超声-微波协同改性作用,改性小米糠SDF分子质量较小,聚合度较低,这可能是改性小米糠SDF比脱脂小米糠SDF具有更好的溶解性和较小黏度的内在原因。
2.3 改性前后小米糠SDF的相对分子质量分布
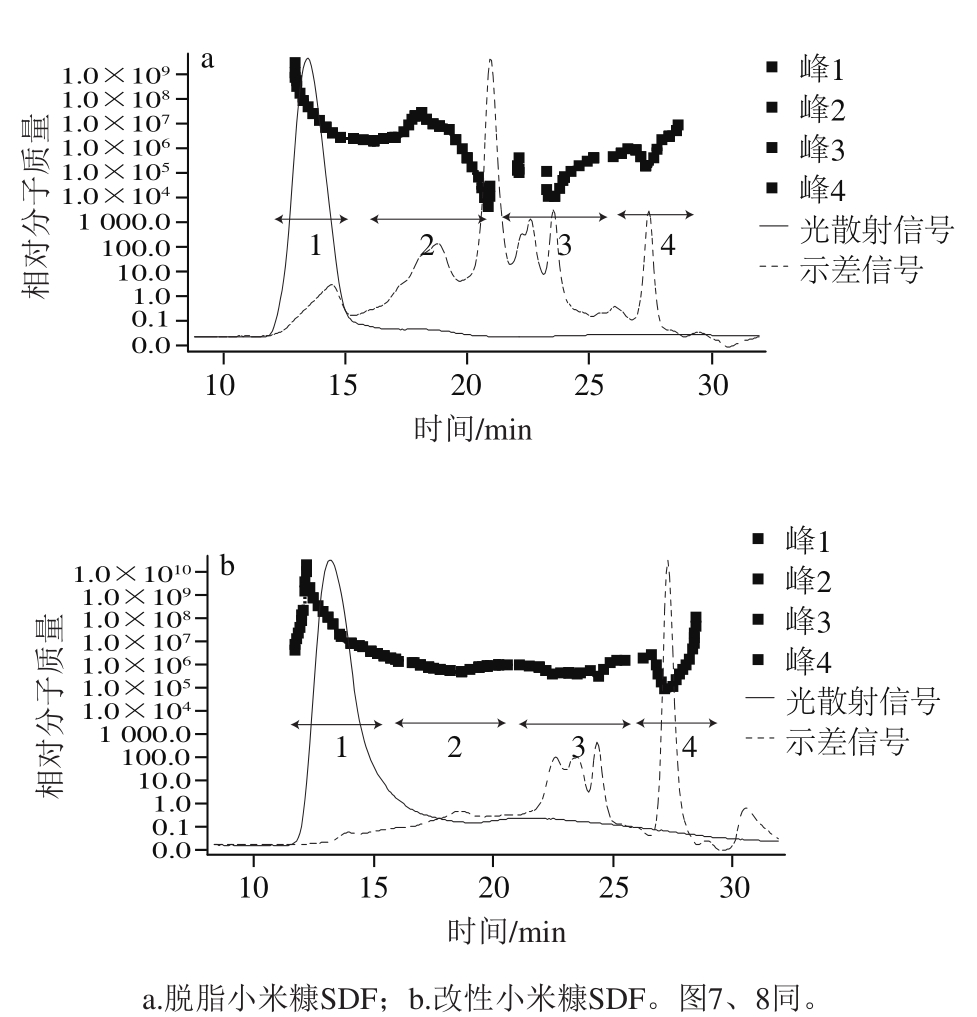
图2 改性前、后小米糠SDF的相对分子质量分析图
Fig. 2 Molecular mass analysis of millet bran SDF before and after modification
表1 改性前后小米糠SDF相对分子质量
Table 1 Molecular mass determination of millet bran SDF before and after modification
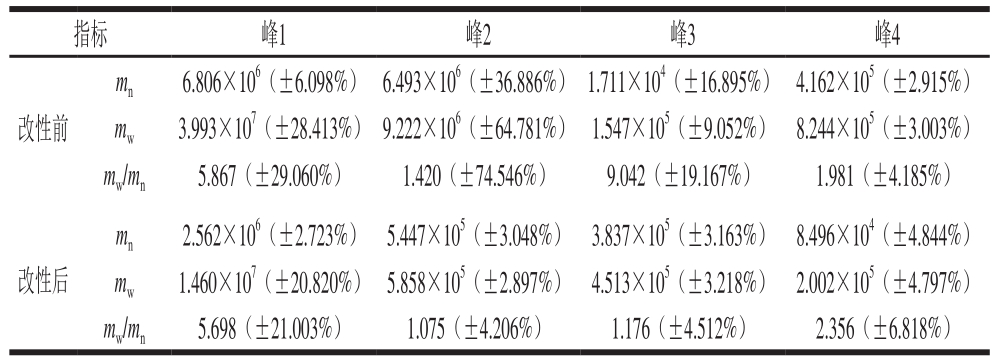
注:括号中数据为信号噪音、小分子质量产生的信号波动所造成的误差范围。
SDF的功能活性和理化性质与其相对分子质量大小有关。图2a、b分别为改性前后小米糠SDF的相对分子质量分析图,表1为改性前后小米糠SDF的相对分子质量测定结果,结果表明:从重均相对分子质量角度分析,改性小米糠SDF小于未经改性小米糠SDF的相对分子质量,说明改性小米糠SDF分子链变短和聚合度变低,与扫描电子显微镜结果一致。一般情况下,相对分子质量越小,分子聚合度越低,物质的溶解性越好,相同条件下黏度越小。重均相对分子质量与数均相对分子质量的比值为相对分子质量分散系数,其大小可以作为判断样品相对分子质量分布是否均一的指标,分散系数越大,说明相对分子质量越分散。总体来看,改性后小米糠SDF相对分子质量的分散系数小于未经改性小米糠SDF相对分子质量的分散系数,说明改性后小米糠SDF分子链分布较均匀。此外低相对分子质量的多糖类物质一般都具有良好的生理活性,酶法制备条件比较温和,活性物质未受到破坏。
2.4 改性前后小米糠IDF的X射线衍射结果

图3 改性前后小米糠IDF的X射线衍射谱图
Fig. 3 X-ray diffraction spectra of millet bran IDF before and after modification
如图3所示,脱脂小米糠IDF在扫描角度2θ为21.97°处有明显的结晶衍射峰,同时在16.38°、34.55°两处有较弱的衍射峰;这些峰均表明脱脂小米糠IDF具有纤维素I型的X射线衍射曲线特征,说明小米糠膳食纤维的晶型与其他植物源膳食纤维相同。经气爆预处理和超声-微波协同改性,改性小米糠IDF在扫描角度2θ为22.13°处有明显的结晶衍射峰,同时在16.33°、34.51°两处有较弱的衍射峰;说明改性小米糠IDF的晶体类型也是纤维素I型,为结晶区与非结晶区两相共存的状态。改性小米糠IDF与脱脂小米糠IDF比较,结晶峰的2θ值相近,表明这种改性方法并没有使小米糠IDF的晶型发生改变。改性小米糠IDF衍射峰强度明显增大,结晶度由原来的22.89%增大为25.55%;说明改性小米糠IDF表面结构被破坏,致使纤维素结晶区暴露[29]。气爆预处理和超声-微波协同改性使小米糠IDF中半纤维素部分降解,并且转化为SDF,也说明超声-微波协同改性方法能够有效提高小米糠SDF的含量。
2.5 改性前后小米糠SDF、IDF的傅里叶变换红外光谱分析

图4 改性前后小米糠SDF的傅里叶变换红外光谱图
Fig. 4 Fourier transform infrared spectra of millet bran SDF before and after modification
如图4所示,在3 300~3 500 cm-1内出现较强的宽展圆滑的吸收峰是O—H的伸缩振动,脱脂小米糠SDF和超声微波协同改性气爆预处理小米糠SDF分别在3 415cm-1和3 411 cm-1处出现吸收峰。改性前后小米糠SDF分别在2 963 cm-1和2 960 cm-1处出现弱吸收峰,这是糖类甲基C—H的反对称伸缩振动所致,1 200~1 400 cm-1范围内是C—H的变角振动吸收峰,这些区域的吸收峰为糖类的特征吸收峰。改性前后小米糠SDF分别在1 103 cm-1和1 079 cm-1处出现较强吸收峰,这是由C—O—C中C—O伸缩振动和C—O—H的O—H变角振动所致,也是多糖类的另一特征吸收峰。1 650cm-1附近为羧基—COOH的特征峰,峰强度较大,表明样品中含有糖醛酸。改性前后小米糠SDF在1 405 cm-1处出现弱小尖峰,为C—H(—CH2)弯曲振动峰。两者在804 cm-1处均出现吸收峰,而改性小米糠SDF在880 cm-1处出现弱小吸收峰,推测小米糠经改性处理后,SDF的单糖组成与含量发生变化。改性小米糠SDF在3 442 cm-1附近出现的吸收峰更强,说明在制备改性小米糠SDF时,部分糖苷键断裂,形成氢键增多。综合分析得出改性前后小米糠SDF结构很相似,由于含量或结合程度不同,导致它们在吸收强度上存在差异。

图5 改性前后小米糠IDF的傅里叶变换红外光谱图
Fig. 5 Fourier transform infrared spectra of millet bran SDF before and after modification
如图5所示,与脱脂小米糠IDF相比,超声-微波协同改性气爆预处理小米糠IDF的特征吸收峰的峰形、位置未发生明显变化,说明小米糠膳食纤维的化学结构没有发生明显变化。改性前后小米糠IDF都在3 430 cm-1左右出现宽展圆滑的吸收峰,这是由O—H的伸缩振动所致,在2 920 cm-1左右的吸收峰为糖类亚甲基C—H的反对称伸缩振动,1 200~1 400 cm-1范围内吸收峰是C—H的变角振动所致,这些区域的吸收峰都为糖类的特征吸收峰。说明改性小米糠IDF的结构并未完全破坏,气爆预处理和超声-微波协同改性使其部分降解。
2.6 改性前后小米糠SDF的单糖组成成分分析

图6 单糖标准品的离子色离谱图
Fig. 6 Ion chromatogram of monosaccharide standards
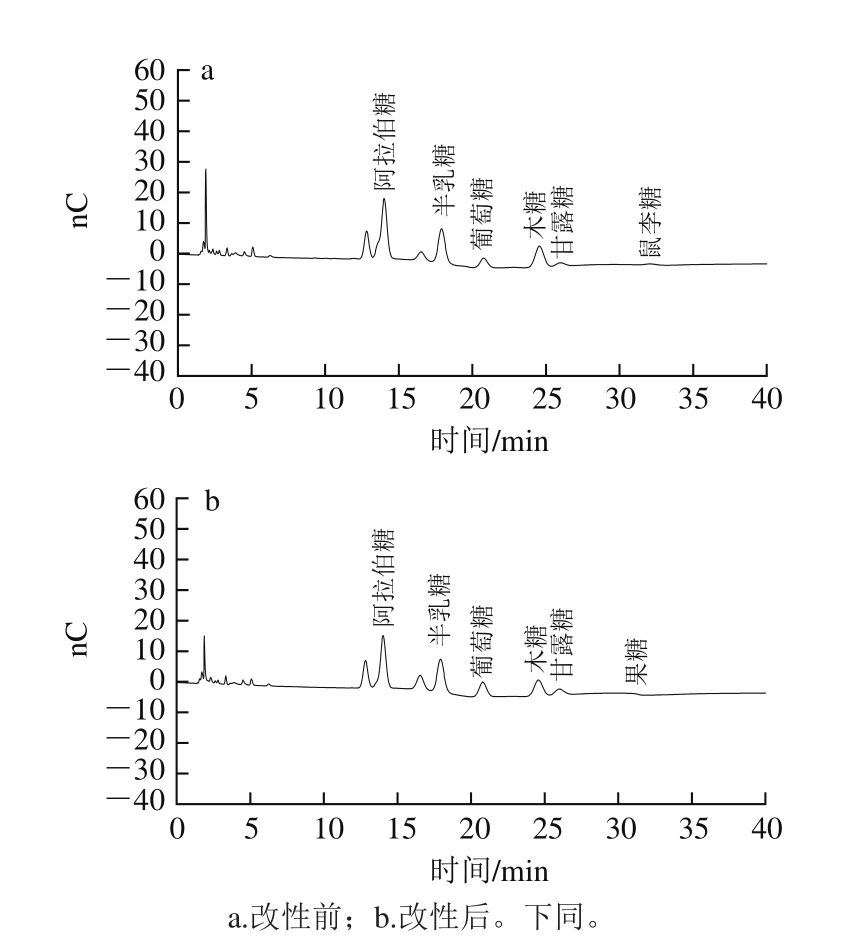
图7 改性前后小米糠SDF中单糖的离子色谱图
Fig. 7 Ion chromatogram of monosaccharides in millet bran SDF before and after modification
由图6、7可知,改性前后小米糠SDF中单糖种类变化不大,但改性前后小米糠SDF中各单糖的峰面积不同,说明两者在单糖含量上存在差异。如表2所示,脱脂小米糠SDF和改性小米糠SDF都含有阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖,另外脱脂小米糠SDF含有少量的鼠李糖。经改性处理后,改性小米糠SDF中的单糖总量略有增加,其中葡萄糖、甘露糖、果糖含量增加,阿拉伯糖、木糖含量减少,半乳糖含量几乎不变。
表2 改性前后小米糠SDF中单糖的含量
Table 2 Contents of monosaccharides in millet bran SDF before and after modification

注:Ara.阿拉伯糖;Gal.半乳糖;Glu.葡萄糖;Xyl.木糖;Man.甘露糖;Fru.果糖;Rib.鼠李糖。
2.7 改性前后小米糠SDF对α-葡萄糖苷酶活性的影响

图8 改性前后小米糠SDF对α-葡萄糖苷酶活性的抑制作用
Fig. 8 Inhibitory effects of defatted millet bran and modified millet bran SDF on the activity of α-glucosidase
如图8a所示,改性前后小米糠SDF对α-葡萄糖苷酶均有抑制作用,且随着SDF质量浓度的增大,SDF对α-葡萄糖苷酶的抑制率呈现上升趋势,抑制作用与其质量浓度之间存在显著的量效关系。α-葡萄糖苷酶可以催化非还原α-(1→4)糖苷键,释放出葡萄糖,同时能被小肠内壁吸收[30]。以PNPG为反应底物,经α-葡萄糖苷酶水解α-1,4-葡萄糖苷键后释放出PNP,在pH>7的条件下PNP呈现黄色,并在405 nm波长处释放PNP。向该反应中加入SDF,以此来抑制α-葡萄糖苷酶与底物PNPG的反应,减少PNP的生成量[31]。另外,膳食纤维的生物活性与分子质量大小和单糖组成也有关系。
如图8b所示,在相同质量浓度下,改性小米糠SDF对α-葡萄糖苷酶的抑制率更大,说明改性小米糠SDF是一种抑制能力强于脱脂小米糠SDF的α-葡萄糖苷酶抑制剂。改性小米糠SDF表现出较强的α-葡萄糖苷酶抑制能力,推测原因为改性小米糠SDF中单糖组成比例发生改变,尤其是甘露糖含量的增加。研究显示,由鼠李糖、甘露糖、半乳糖、半乳糖醛酸、果胶糖组成的多糖片段表现出很强的α-葡萄糖苷酶抑制能力[32]。另外可能与改性小米糠SDF的相对分子质量较小有关,低相对分子质量糖类不能形成聚合结构从而表现出良好的生物活性。
以抑制率AGA为纵坐标y,以SDF质量浓度为横坐标x,得到脱脂小米糠SDF对α-葡萄糖苷酶活性的抑制曲线方程为:y=26.364 99×ln(x+15.627 73),R2=0.902 82,半抑制浓度(half maximal inhibitory concentration,IC50)为2.934 mg/mL;改性小米糠SDF对α-葡萄糖苷酶活性的抑制曲线方程为:y=29.777 59×ln(x+13.890 89),R2=0.930 47,IC50为0.415 mg/mL。
3 结 论
对于脱脂小米糠SDF颗粒,改性小米糠SDF的颗粒较小且表面粗糙,疏松多孔,呈蜂窝状。
从重均相对分子质量角度分析,改性小米糠SDF小于脱脂小米糠SDF的相对分子质量,说明改性小米糠SDF分子链变短和聚合度变低。
改性小米糠IDF的结晶度上升,小米糠IDF表面结构破坏,使纤维素结晶区暴露。说明气爆预处理和超声-微波协同改性使小米糠IDF中半纤维素部分降解。
改性前后小米糠SDF均具有明显的糖类特征吸收峰,其化学官能团基本不变。与脱脂小米糠IDF相比,改性小米糠IDF的特征吸收峰的峰形、位置无明显变化,说明小米糠IDF的结构并未完全破坏。
改性前后小米糠SDF均含有阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖,但两者在含量上存在差异,说明气爆预处理和超声-微波协同改性改变了小米糠SDF中单糖组成比例。
脱脂小米糠SDF和改性小米糠SDF对α-葡萄糖苷酶均有抑制作用。改性小米糠SDF是一种抑制作用强于脱脂小米糠SDF的α-葡萄糖苷酶抑制剂。
参考文献:
[1] SIM L, JAYAKANTHAN K, MOHAN S, et al. New glucosidase inhibitors from an ayurvedic herbal treatment for type 2 diabetes:structures and inhibition of human intestinal maltase-glucoamylase with compounds from Salacia reticulata[J]. Biochemistry, 2009,49(3): 443-451. DOI:10.1021/bi9016457.
[2] HIROYUKI F, TOMOHIDE Y, KAZUNORI O. Efficacy and safety of Touchi extract, an α-glucosidase inhibitor derived from fermented soybeans, in non-insulin-dependent diabetic mellitus[J]. The Journal of Nutritional Biochemistry, 2001, 12(6): 351-356. DOI:10.1016/S0955-2863(01)00149-8.
[3] WATANABE J, KAWABATA J, KURAHARA H, et al. Isolation and identification of α-glucosidase inhibitors from tochu-cha (Eucommia ulmoides)[J]. Bioscience, Biotechnology, and Biochemistry, 1997,61(1): 177-178. DOI:10.1271/bbb.61.177.
[4] 朱振元, 刘晓翠, 郭蓉, 等. 蛹虫草多糖对α-葡萄糖苷酶活性的抑制研究[J]. 现代食品科技, 2014, 30(12): 55-60.
[5] GUO R H, ZHAI L. LIU Z M, et al. Study on inhibition on alphaglucosidase and analysis of the hypoglycemic composition of lobster sauce[J]. Journal of Chinese Medicinal Materials, 2005, 28(1): 38-40.
[6] MCOUGALL G J, SHPIRO F, DOBSON P, et al. Different polyphenolic components of soft fruits inhibit α-amylase and α-glucosidase[J]. Journal of Agricultural and Food Chemistry, 2005,53(7): 2760-2766. DOI:10.1021/jf0489926.
[7] KIM J S, KWON C S, SON K H. Inhibition of alpha-glucosidase and amylase by luteolin, a flavonoid[J]. Bioscience, Biotechnology, and Biochemistry, 2000, 64(11): 2458-2461.
[8] LUNN J, BUTTRISS J L. Carbohydrates and dietary fibre[J]. Nutrition Bulletin, 2007, 32(1): 21-64.
[9] CHO S, CRAIG S, DEVRIE J, et al. The definition of dietary fiber[J].Cereal Foods World, 2001, 46(3): 112-126.
[10] 郑建仙. 功能性食品[M]. 北京: 中国轻工业出版社, 1999: 45-126.
[11] THEUWISSEN E, MENSINK R P. Water-soluble dietary fibers and cardiovascular disease[J]. Physiology & Behavior, 2008, 94(2):285-292.
[12] 钟艳萍. 水溶性膳食纤维的制备及功能性研究[D]. 广州: 华南理工大学, 2011: 6-8.
[13] ZHANG N, HUANG C H, OU S Y. In vitro binding capacities of three dietary fibers and their mixture for four toxic elements, cholesterol,and bile acid[J]. Journal of Hazardous Materials, 2011, 186(1): 236-239. DOI:10.1016/j.jhazmat.2010.10.120.
[14] OU S Y, KWOK K, LI Y, et al. In-vitro study of possible role of dietary fiber in lowering postprandial serum glucose[J]. Journal of Agriculture and Food Chemistry, 2001, 49: 1026-1029. DOI:10.1021/jf000574n.
[15] 王俊丽, 臧明夏. 膳食纤维改性研究进展[J]. 食品研究与开发, 2012,33(5): 225-228.
[16] 王强, 赵欣. 不同膳食纤维改性技术研究进展[J]. 食品工业科技,2013, 34(9): 392-395. DOI:10.13386/j.issn1002-0306.2013.09.081.
[17] CHEONG K L, WU D T, ZHAO J, et al. A rapid and accurate method for the quantitative estimation of natural polysaccharides and their fractions using high performance size exclusion chromatography coupled with multi angle laser light scattering and refractive index detector[J]. Journal of Chromatography A, 2015, 1400: 98-106.DOI:10.1016/j.chroma.2015.04.054.
[18] GUDLAVALLETI S K, CRAWFORD E N, HARDER J, et al.Quantification of each serogroup polysaccharide of Neisseria meningitidis in A/C/Y/W-135-DT conjugate vaccine by highperformance anion-exchange chromatography-pulsed amperometric detection analysis[J]. Analytical Chemistry, 2014, 86(11): 5383-5390.
[19] TEJADA-ORTIGOZA V, GARCIA-AMEZQUITA L E, SERNASALDÍVAR S O, et al. Advances in the functional characterization and extraction processes of dietary fiber[J]. Food Engineering Reviews,2015, 8(3): 251-271.
[20] 王岸娜, 朱海兰, 吴立根, 等. 膳食纤维的功能、改性及应用[J].河南工业大学学报(自然科学版), 2009, 30(2): 89-94.
[21] 蒋勇, 王友国, 梁叶星, 等. 重庆糯小米米糠的稳定化及脱脂工艺优化[J].食品科学, 2015, 36(8): 54-60. DOI:10.7506/spkx1002-6630-201508010.
[22] 涂宗财, 段邓乐, 王辉, 等. 豆渣膳食纤维的结构表征及其抗氧化性研究[J]. 中国粮油学报, 2015, 30(6): 22-26.
[23] 李方方, 李先国, 法芸, 等. 凝胶色谱-十八角激光光散射联用测定聚丙烯酰胺的相对分子质量及其分布[J]. 化学世界, 2016, 57(8):481-486.
[24] 陈雪峰, 吴丽萍, 刘爱香. 挤压改性对苹果膳食纤维物理化学性质的影响[J]. 食品与发酵工业, 2005, 31(12): 57-60.
[25] 赵倩, 熊善柏, 邵小龙, 等. 米糠多糖的提取及其性质和结构[J]. 中国粮油学报, 2008, 23(3): 4-7.
[26] YU Q, SHANG S, FENG Y L, et al. Determination of monosaccharide composition of polysaccharide in Ganoderma lucidum spore by ion chromatography[J]. Chinese Pharmaceutical Journal, 2014, 49(4): 344-347. DOI:10.11669/cpj.2014.04.020.
[27] KIM J S, HYUN T K, KIM M J. The inhibitory effects of ethanol extracts from sorghum, foxtail millet and proso millet on α-glucosidase and α-amylase activities[J]. Food Chemistry, 2011, 124(4): 1647-1651.
[28] CREMONESI F, TORTI E, PECILE A, et al. Evaluation of α-glucosidase activity in dog semen and its use in fertility diagnosis[J].Veterinary Research Communications, 2003, 27: 587-589.
[29] 郭娜. 小麦麸皮纤维降解糖化与分层利用[D]. 合肥: 合肥工业大学,2013: 56-58.
[30] DENG Y, LIN-SHIAU S, SHVUR L, et al. Pu-erh tea polysaccharides decrease blood sugar by inhibition of α-glucosidase activity in vitro and in mice[J]. Food Function, 2015, 6: 1539-1546.
[31] YU Z P, YIN Y G, ZHAO W Z, et al. Novel peptides derived from egg white protein inhibiting alpha-glucosidase[J]. Food Chemistry, 2011,129: 1376-1382.
[32] CUI L, GU X, WANG F J, et al. Purification and structural characterization of an α-glucosidase inhibitory polysaccharide from apricot (Armeniaca sibirica L. Lam.) pulp[J]. Carbohydrate Polymers,2015, 121: 309-314.