细胞在新陈代谢过程中会产生自由基,这些自由基影响着体内调控系统,自由基过多便会氧化细胞膜、酶、DNA及蛋白质等物质,对机体造成损伤[1]。此外,研究表明,自由基与癌症、衰老、炎症,心脑血管等多种疾病的发生与发展密切相关[2]。因此,具有清除自由基作用的食品及药品的研究日趋受到人们的重视。近年来,中药被认为是“天然自由基清除剂”,并对其开展了各种清除自由基的实验研究[3]。
金银花(Lonicera japonica Thunb.)为药食同源性植物,具有清热解毒、抗炎、抗病原微生物、免疫调节等功效[4-5],其叶具有产量大,生物活性成分丰富,抗氧化、抑菌功效较好等优点,但长期被作为金银花的副产物而被丢弃,造成了资源浪费[6-8]。有研究显示,金银花叶中黄酮含量是花中的2.78 倍,且金银花叶的抑菌能力与花相同甚至高于花[9]。翟凤艳等[10]研究显示,金银花叶提取物对植物真菌的抑菌效果较强。文献[11-13]报道金银花叶粗黄酮具有良好的抗氧化活性。但以上研究都是采用单一的方法对金银花叶粗提物进行功效方面的评价,而对金银花叶黄酮纯化物的功效作用研究较少。此外,由于不同评价方式及其适用范围的不同使实验结果也存在差异。
为系统准确地评价金银花叶黄酮的抗氧化活性,深入了解其功效机理,本实验以VC为对照,既采用了较为广泛的体外抗氧化评价方法,又建立了H2O2诱导RAW264.7巨噬细胞损伤模型,以评价金银花叶黄酮的体外及细胞抗氧化抗炎能力,探索其作用机理,为金银花叶功能性食品开发及抗氧化抗炎药物的研发提供理论依据。
1 材料与方法
1.1 材料与试剂
金银花叶黄酮由本实验室以金银花叶为原料,采用超声辅助乙醇提取,经NKA-Ⅱ大孔吸附树脂纯化所得。
小鼠单核巨噬细胞RAW264.7 南京科佰生物科技有限公司;RPMI-1640培养基 美国Hyclone公司;胎牛血清、胰酶、双抗(青霉素-链霉素) 美国Gibco公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT)美国Sigma公司;丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)、乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒 南京建成生物工程研究所;其余试剂均为分析纯。
1.2 仪器与设备
680全自动酶标仪 美国Bio-Rad公司;CKX41倒置显微镜 日本Olympus公司;E191IR型CO2细胞培养箱 美国金西盟公司;LDZX-50KB立式压力蒸汽灭菌器 上海申安医疗器械厂;微型旋涡混合仪 上海沪西分析仪器厂有限公司;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;TGL-20M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;UV2400紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;HL-2D型恒流泵 上海圣科仪器设备有限公司。
1.3 方法
1.3.1 金银花叶黄酮的制备
1.3.1.1 金银花叶黄酮的提取
准确称取金银花叶粉末100 g,石油醚脱脂处理1 h,用体积分数60%的乙醇按料液比1∶65(m/V)的比例混合均匀,于超声功率250 W,提取温度46 ℃的条件下超声提取30 min,抽滤,45 ℃下减压浓缩至无醇味,真空冷冻干燥成粉,备用。
1.3.1.2 金银花叶黄酮的纯化
预处理NKA-Ⅱ树脂,将1.3.1.1节中所得金银花叶黄酮配制成2.17 mg/mL的上样液,调节其pH 2.82左右,以1.96 BV/h左右的流速上NKA-Ⅱ树脂柱进行纯化,先用2.0 BV蒸馏水以2.0 BV/h左右的流速洗脱以除杂,再用体积分数75.36%的乙醇溶液以1.47 BV/h左右的流速洗脱,收集乙醇洗脱液,旋蒸,冻干后置于4 ℃保存,备用。本实验中,金银花叶黄酮经纯化后纯度为(79.820±0.474)%。
1.3.2 金银花叶黄酮总还原能力的测定
采用铁氰化钾法[14]进行总还原力的测定。量取0.4 mL不同质量浓度(0.015 6~8.000 0 mg/mL)的样品溶液,加入2.5 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(0.2 mol/L,pH 6.6)和2.5 mL质量分数1%的K3Fe(CN)6溶液,混匀后在50℃水浴中暗处反应20 min,快速置于冰水中冷却。再加入2.5 mL质量分数10%的三氯乙酸溶液,混匀,3 000 r/min离心10 min。取2.5 mL上清液,加入2.5 mL蒸馏水和质量分数1%的FeCl3溶液0.5 mL,混匀后静置10 min,于700 nm波长处测定其吸光度,吸光度越大表明还原力越大。用蒸馏水代替样品作为空白,VC作为阳性对照,平行做3 次。
1.3.3 金银花叶黄酮对·OH的清除作用
参考Lai Furao等[15]的方法,并稍作修改。配制不同质量浓度(0.015 6~4.000 0 mg/mL)的金银花叶黄酮样品液,分别吸取2 mL上述样品液,依次添加6 mmol/L的FeSO4溶液0.6 mL、6 mmol/L的H2O2溶液0.6 mL,混匀静置10 min后加入0.6 mL 6 mmol/L水杨酸,摇匀静置10 min,于510 nm波长处测定其吸光度A1;同时测定用无水乙醇代替水杨酸时的吸光度A2及用蒸馏水代替样品液时的吸光度A0,以VC为阳性对照,平行做3 组取平均值。羟自由基(·OH)清除率根据公式(1)计算。
1.3.4 金银花叶黄酮对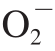 ·的清除作用
·的清除作用
采用邻苯三酚自氧化法[16]进行测定,分别取pH 8.2 Tris-HCl缓冲液4.0 mL于25 ℃水浴20 min,加入不同质量浓度(0.015 6~8.000 0 mg/mL)的金银花叶黄酮样品液0.5 mL及25 ℃预热的3 mmol/L邻苯三酚(10 mmol/L HCl配制)1.0 mL,混匀后25 ℃水浴4 min,随即加入0.5 mL HCl(8 mol/L)终止反应,于320 nm波长处测定吸光度A1;同时测定用10 mmol/L HCl溶液代替邻苯三酚时的吸光度A2及用蒸馏水代替样品液时的吸光度A0,以VC作阳性对照,平行做3 组取平均值。超氧阴离子自由基(O2-·)清除率根据公式(1)计算。
1.3.5 金银花叶黄酮对DPPH自由基的清除作用
参照Goupy等[17]的方法并稍作修改,分别吸取不同质量浓度(0.015 6~8.000 0 mg/mL)金银花叶黄酮的无水乙醇溶液2.0 mL,加入2.0 mL 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazy,DPPH)(2×10-4 mol/L)的无水乙醇溶液,摇匀,避光反应40 min后,以无水乙醇调零,于517 nm波长处测定吸光度A1;同时,测定2.0 mL不同质量浓度的样品溶液与2.0 mL无水乙醇的混合液在517 nm波长处吸光度A2;再测2.0 mL空白样品(蒸馏水)与2.0 mL DPPH的混合液在517 nm波长处的吸光度A0。以VC作为阳性对照,重复3 组取平均值。清除率计算见式(1)。
1.3.6 RAW264.7细胞培养
将RAW264.7细胞接种于含10%胎牛血清和1%双抗的RPMI-1640培养基中,置于37 ℃、5% CO2的培养箱中培养[18]。每隔2~3 d传代一次,取对数生长期细胞进行后续实验。1.3.7 H2O2诱导RAW264.7细胞氧化损伤模型的建立
取对数生长期的RAW264.7细胞接种于96 孔板中,每孔200 mL,细胞浓度为2.0×105 个/mL。在37 ℃、5% CO2条件下培养24 h至细胞贴壁,弃上清液,加入用RPMI-1640培养基配制的不同浓度的H2O2溶液,每个浓度设6 个复孔。继续培养24 h后,弃上清液,用PBS洗涤2 次后,每孔分别加入200 mL的培养基及10 mL 5 mg/mL MTT,放入培养箱4 h后停止培养,弃上清液,每孔加入150 mL DMSO,轻微振荡10 min使紫色结晶溶解,放入酶标仪于490 nm波长处测定吸光度,根据公式(2)计算细胞存活率。
式中:A0为空白组的平均吸光度;A1为特定浓度样品液组的平均吸光度。
1.3.8 金银花叶黄酮剂量的筛选
细胞培养过程同1.3.7节,仅将1.3.7节中所加入的RPMI-1640培养基配制的H2O2溶液换为同种培养基配制的不同质量浓度的金银花叶黄酮溶液,并通过公式(2)计算细胞存活率。
1.3.9 细胞及细胞培养液中MDA、GSH含量、SOD、LDH活力的测定
将细胞浓度为2.0×105 个/mL的RAW264.7细胞接种于6 孔板中,每孔2.0 mL,在37 ℃、5% CO2培养箱中培养24 h至细胞贴壁,吸弃上清液。空白组和模型组加入2.0 mL培养基;实验组分别加入2.0 mL不同质量浓度的金银花叶黄酮培养液;对照组加入2.0 mL 250 mg/mL VC培养液,置于培养箱中培养24 h,吸弃上清液,每孔加入750 mmol/L的H2O2溶液2.0 mL,置于培养箱中孵育4 h后将细胞和细胞培养液分离。细胞培养液于4 ℃、1 500 r/min离心5 min后取上清液待测;细胞用PBS清洗2 次后于4 ℃、1 000 r/min离心10 min留细胞团块,加入0.5 mL的PBS,冰水浴条件下超声破碎(300 W,3~5 s/次,间隔30 s,重复3 次),待测。所需测定的MDA、GSH含量及SOD、LDH活力参照相应试剂盒方法。
1.4 数据统计分析
使用DPS 7.5统计软件对实验数据进行统计分析,测定结果以 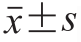 表示,采用单因素方差分析并用LSD法进行多重比较,P<0.05表示差异具有统计学意义。
表示,采用单因素方差分析并用LSD法进行多重比较,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 金银花叶黄酮体外抗氧化活力
2.1.1 总还原力

图1 金银花叶黄酮的总还原力
Fig. 1 Reducing power of flavonoids from honeysuckle leaves
样品中的黄酮会使反应体系中的Fe3+还原成Fe2+,在700 nm波长处吸光度变化反应出还原能力的高低,吸光度越高说明还原能力越强[19]。由图1可知,随样品质量浓度的增加,VC和金银花叶黄酮的还原力逐渐加强,并成剂量依赖关系。VC的吸光度在质量浓度为1.0 mg/mL时达到最大值5.21,之后保持不变;金银花叶黄酮的还原力在0.015 6~4.000 0 mg/mL范围内显著小于VC(P<0.05)。当质量浓度为4.000 0 mg/mL时,VC和金银花叶黄酮吸光度均达到最大,差异不显著(P>0.05)。以上结果表明,金银花叶黄酮在低质量浓度时还原能力不强,而质量浓度大于4.000 0 mg/mL时,其还原能力较强,等同于VC。
2.1.2 ·OH清除能力

图2 金银花叶黄酮对·OH的清除作用
Fig. 2 Scavenging effect of flavonoids from honeysuckle leaves on hydroxyl free radicals
如图2所示,在0.015 6~4.000 0 mg/mL的质量浓度范围内,VC和金银花叶黄酮对·OH的清除率与质量浓度存在明显的量效关系。随着样品质量浓度的增大,·OH的清除能力也随之增大,且金银花叶黄酮和VC对DPPH自由基的清除能力相近,差异不显著(P>0.05)。VC抗氧化能力的IC50值为0.116 0 mg/mL,金银花叶黄酮的IC50值为0.203 0 mg/mL,VC的·OH清除能力是金银花叶黄酮的1.75 倍。结果表明,金银花叶黄酮对·OH的清除效果与VC相近,说明金银花叶黄酮清除·OH的能力较强。
2.1.3  ·清除能力
·清除能力
O2-·虽然是相对较弱的自由基,但它能够与生物大分子相互作用产生活性更强的自由基如·OH、单线态氧等进一步引起组织氧化损伤和多种疾病[20]。因此,采用邻苯三酚自氧化法测定金银花叶黄酮清除O2-·的能力。由图3可知,在0.015 6~8.000 0 mg/mL的范围内,VC和金银花叶黄酮对O2-·的清除能力与样品质量浓度呈正相关,且金银花叶黄酮和VC对O2-·的清除能力差异不显著(P>0.05)。VC的IC50值为0.336 0 mg/mL,金银花叶黄酮的IC50值为0.417 0 mg/mL,VC的O2-·清除能力是金银花叶黄酮的1.24 倍。但当样品质量浓度达到2.000 0 mg/mL以上时,金银花叶黄酮和VC对O2-·的清除率均达到100%。以上结果表明,金银花叶黄酮对O2-·的清除能力较强,并在实验的浓度范围内表现出剂量依赖性。
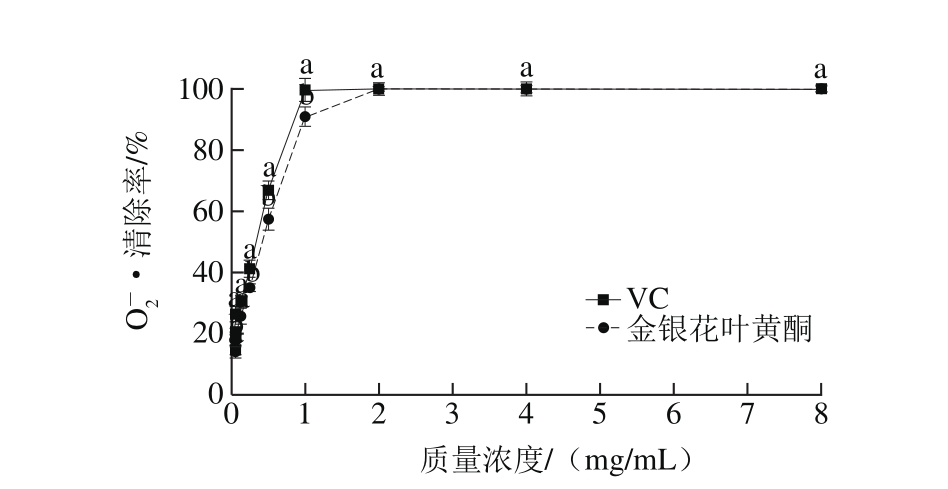
图3 金银花叶黄酮对O-2·的清除作用
Fig. 3 Scavenging effect of flavonoids from honeysuckle leaves on superoxide anion free radicals
2.1.4 DPPH自由基清除能力
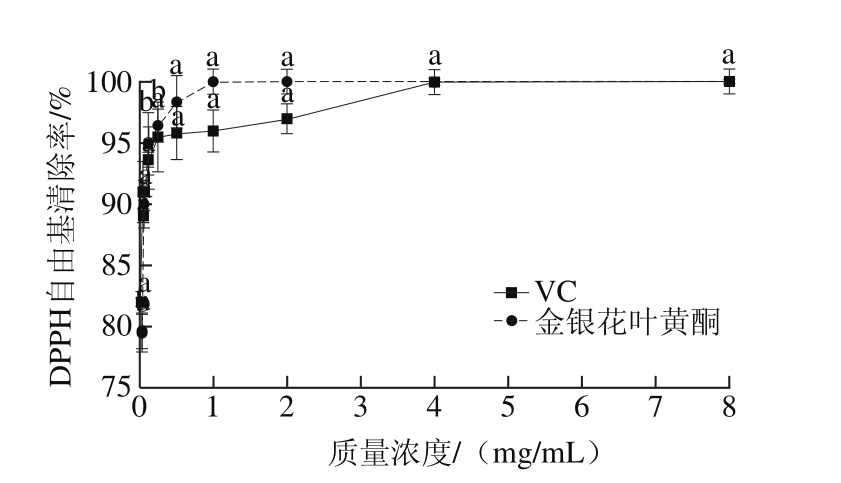
图4 金银花叶黄酮对DPPH自由基的清除作用
Fig. 4 Scavenging effect of flavonoids from honeysuckle leaves on DPPH free radicals
由图4可知,金银花叶黄酮对DPPH自由基的清除作用存在剂量依赖效应,在0.015 6~8.000 0 mg/mL的质量浓度范围内,随着样品质量浓度的增加,DPPH自由基清除率相应增大。在质量浓度较低时,金银花叶黄酮和VC对DPPH自由基的清除能力差异不显著(P>0.05),随着质量浓度增加,金银花叶黄酮的DPPH自由基清除率高于同一质量浓度的VC,DPPH自由基清除率达到100%时对应的金银花叶黄酮和VC的质量浓度分别为1.000 0、4.000 0 mg/mL。由此表明,金银花叶黄酮对DPPH自由基的清除能力比VC好。金银花叶黄酮清除DPPH自由基的机理可能是因为黄酮样品中具有供氢体,可以提供质子还原具有氧化性的自由基,终止自由基的连锁反应,起到抑制或清除自由基的作用[21]。
2.2 金银花叶黄酮对H2O2诱导RAW264.7细胞损伤的保护作用
2.2.1 H2O2浓度筛选结果

图5 H2O2对RAW264.7细胞增殖的影响
Fig. 5 Dose-dependent effect of hydrogen peroxide on the viability of RAW264.7 cells
由图5可知,不同浓度的H2O2对RAW264.7细胞的生长均有一定抑制作用,且细胞存活率随H2O2浓度的升高而降低。与空白组相比,不同浓度的H2O2均显著抑制RAW264.7细胞的存活(P<0.05),当用750 mmol/L H2O2处理时,RAW264.7细胞的存活率达到53.73%。H2O2浓度太低时对细胞造成的损伤不明显,而H2O2浓度过高则会造成细胞死亡过量,因此建模时H2O2的浓度选取750 mmol/L。
2.2.2 金银花叶黄酮质量浓度筛选结果

图6 不同质量浓度金银花叶黄酮对RAW264.7细胞增殖的影响
Fig. 6 Dose-dependent effect of flavonoids from honeysuckle leaves on the viability of RAW264.7 cells
由图6可知,与空白组相比,一定质量浓度范围内的金银花叶黄酮对RAW264.7细胞有促进增殖的作用,但当金银花叶黄酮质量浓度大于500 mg/mL时会显著抑制细胞增殖(P<0.05),因此,金银花叶黄酮质量浓度选择125、250、500 mg/mL,将此质量浓度作为推荐剂量进行后续实验。
2.2.3 RAW264.7细胞及细胞培养液中MDA含量
MDA含量的高低间接反应了细胞受自由基攻击的严重程度[22]。如图7所示,与空白组相比,模型损伤组细胞和细胞培养液中的MDA含量均有所上升,且有显著差异(P<0.05)。金银花叶黄酮低中高剂量组显著抑制了H2O2引起的细胞和细胞培养液中MDA含量的增加,并呈剂量依赖性(P<0.05)。空白组与VC对照组无显著差异(P>0.05)。
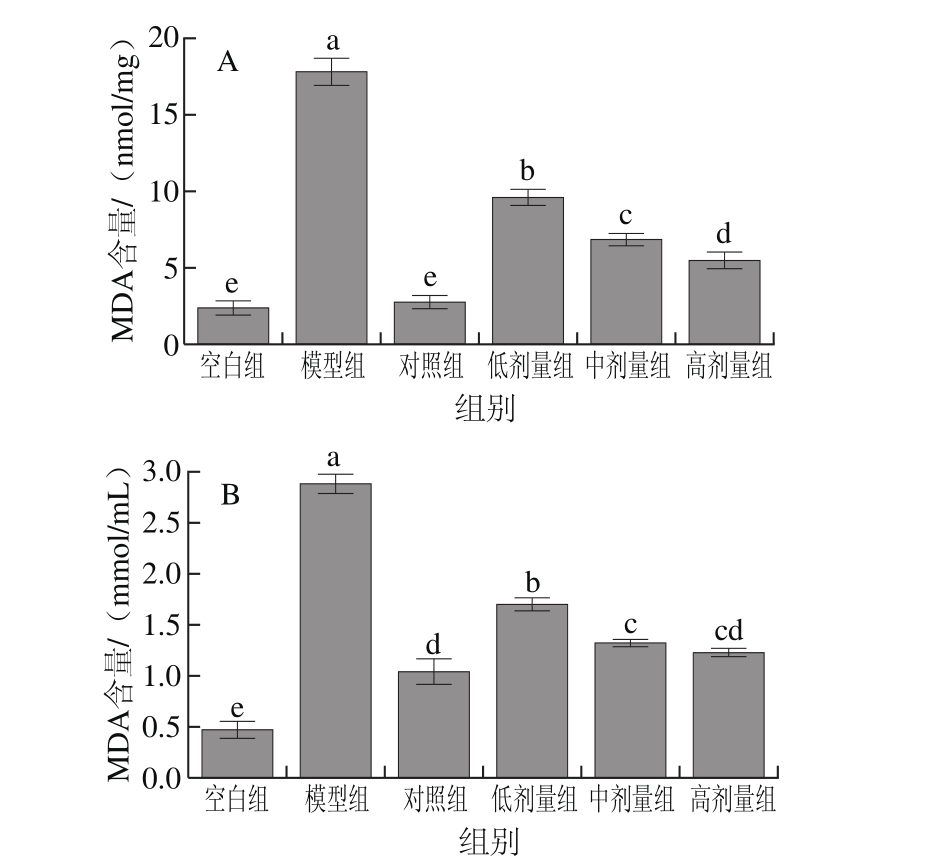
图7 RAW264.7细胞(A)及细胞培养液(B)中MDA含量
Fig. 7 MDA contents in RAW264.7 cells (A) and culture supernatant (B)
MDA是生物体内自由基作用于脂质发生过氧化反应得到的氧化终产物[23]。机体内的自由基极易侵害细胞脂中的不饱和脂肪酸,形成脂质自由基,引起脂质过氧化反应。细胞膜中由磷脂酰基链和胆固醇组成的区域在细胞中极性最小,溶解有高浓度的氧,更有利于脂质过氧化反应的进行[24]。因此,细胞膜内的MDA含量显著高于细胞培养液中的MDA含量(P<0.05)。
2.2.4 RAW264.7细胞及细胞培养液中GSH含量
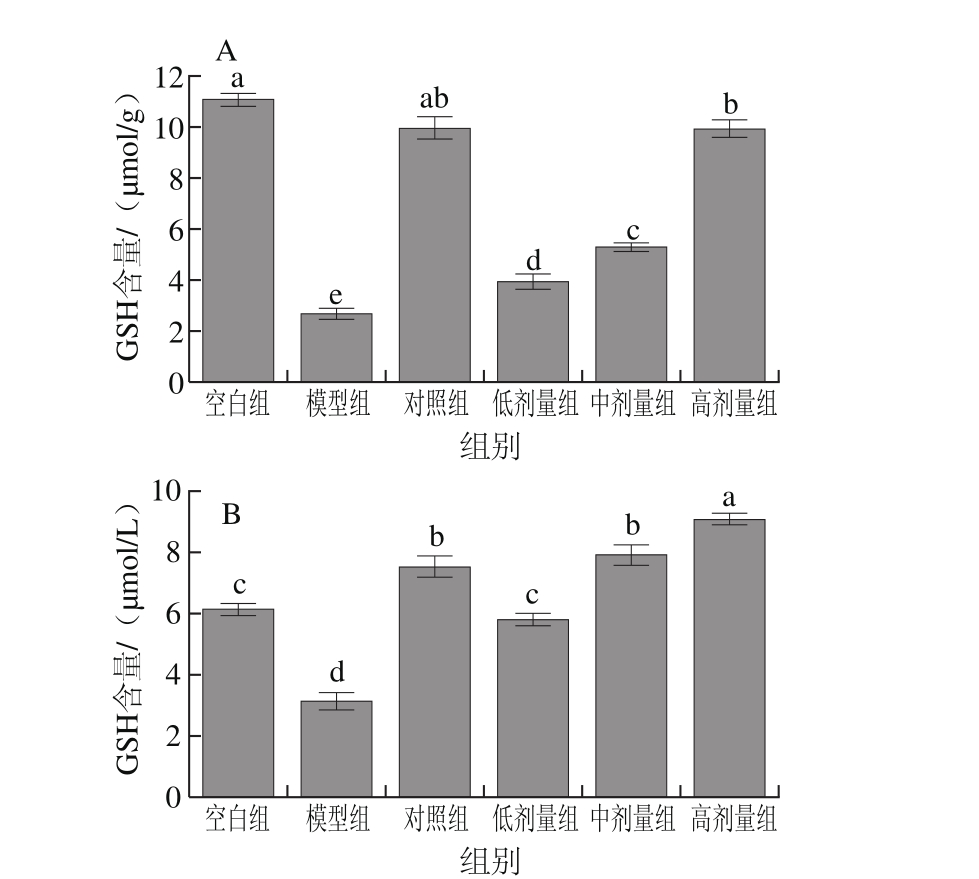
图8 RAW264.7细胞(A)及细胞培养液(B)中GSH含量
Fig. 8 GSH contents in RAW264.7 cells (A) and culture supernatant (B)
GSH是一种低分子清除剂,可清除O2-•、H2O2、过氧化脂质,其含量多少是衡量机体抗氧化能力的重要因素
[25]。如图8所示,与空白组相比,模型损伤组细胞和细胞培养液中的GSH含量明显降低(P<0.05),而金银花叶黄酮低、中、高剂量组显著抑制了H2O2引起的细胞及细胞培养液中GSH含量的下降(P<0.05),并呈现剂量依赖性。金银花叶黄酮高剂量组在细胞中的GSH含量接近
VC对照组,无显著差异(P>0.05);金银花叶黄酮中剂量组在细胞培养液中的GSH含量接近VC对照组,无显著差异(P>0.05)。
2.2.5 RAW264.7细胞及细胞培养液中SOD活力
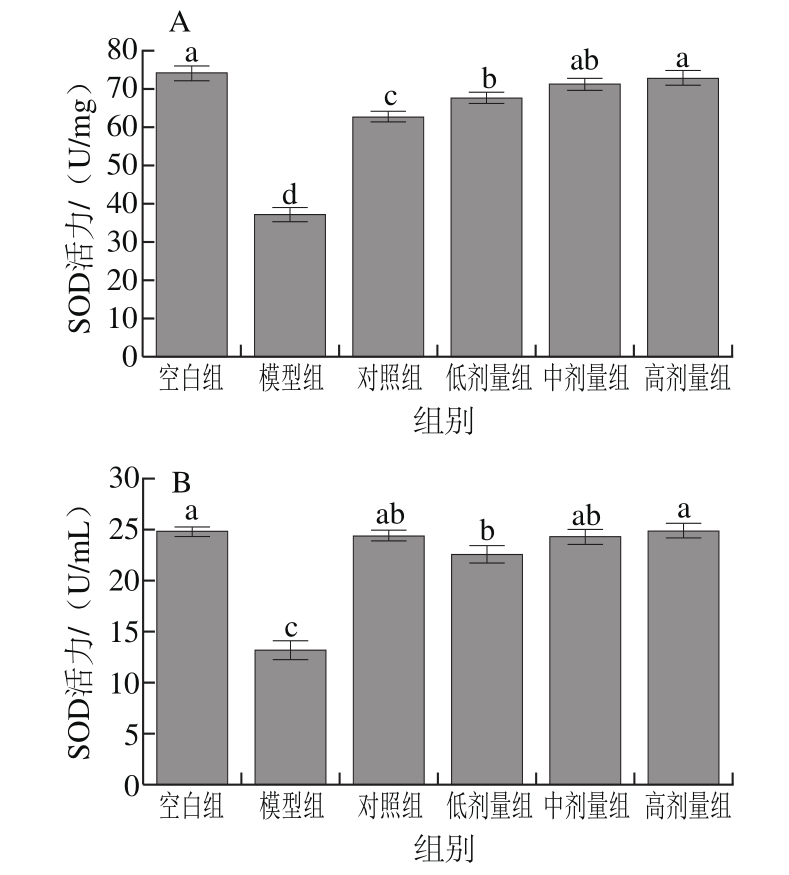
图9 RAW264.7细胞(A)及细胞培养液(B)中SOD活力
Fig. 9 SOD activity in RAW264.7 cells (A) and culture supernatant (B)
SOD通过催化超氧阴离子歧化为H2O2和O2,从而达到清除自由基的目的,其活力对细胞的氧化与抗氧化平衡起着至关重要的作用[26-27]。由于SOD主要存在于机体的各个组织细胞内[28],因此细胞中的SOD活力显著高于其所对应的细胞液(P<0.05)。如图9所示,与空白组相比,模型损伤组细胞和细胞培养液中的SOD活力均显著下降(P<0.05),而添加金银花叶黄酮中、高剂量组能有效升高细胞及细胞培养液中SOD活力使其与正常组SOD活力无显著差异(P>0.05)。金银花叶黄酮各剂量组在细胞中的SOD活力均显著强于VC对照组(P<0.05);金银花叶黄酮中剂量组在细胞液中的SOD活力接近VC对照组,无显著差异(P>0.05)。2.2.6 RAW264.7细胞及细胞培养液中LDH活力
LDH存在于细胞内,细胞受损时细胞膜通透性增加,会引起LDH外漏,因此LDH活力可以反映细胞膜结构的完整性和受氧化损伤程度[29]。如图10所示,与空白组相比,模型损伤组细胞中的LDH活力显著降低(P<0.05),细胞培养液中的LDH活力显著升高(P<0.05),表明H2O2使细胞受损引起了LDH外漏。与模型损伤组相比,金银花叶黄酮各剂量组显著升高了细胞中LDH活力,降低了细胞培养液中LDH活力(P<0.05),并呈剂量依赖性,表明金银花叶黄酮可以预防或减缓细胞膜受损程度,阻止细胞内LDH外漏。金银花叶黄酮高剂量组在细胞中的SOD活力接近VC对照组,无显著差异(P>0.05)。

图10 RAW264.7细胞(A)及细胞培养液(B)中LDH活力
Fig. 10 LDH activity in RAW264.7 cells (A) and culture supernatant (B)
3 讨 论
本研究结果表明,在一定质量浓度范围内,金银花叶黄酮抗氧化能力随质量浓度的增大而增强,并呈剂量依赖性。金银花叶黄酮的总还原力及对·OH、O2-·和DPPH自由基的清除能力接近甚至高于VC,金银花叶黄酮具有较好的体外抗氧化性。
本实验发现经过H2O2损伤后,RAW264.7细胞与细胞培养液中MDA含量均显著升高,GSH含量以及SOD活力显著下降,这表明H2O2对RAW264.7巨噬细胞具有明显的毒性作用;RAW264.7细胞中LDH活力显著下降,而细胞培养液中LDH活力显著上升,这可能是由于H2O2使细胞膜结构受到损伤,细胞膜通透性增加,从而使LDH漏到细胞外[30]。用不同剂量金银花叶黄酮作用于损伤细胞时,上述指标较模型损伤组均获得了不同程度的改善。金银花叶黄酮一方面通过提高细胞和细胞培养液中GSH含量及SOD活力,清除机体中有毒有害物质和自由基,从而保护细胞不受过氧化氢的损伤;另一方面通过减少机体中MDA含量,降低脂质过氧化作用形成脂质过氧化物含量,减缓细胞膜系统受氧自由基攻击后的损伤,从而间接增强了机体抵抗自由基攻击的能力[31],保持生物膜的结构完整和膜表面蛋白质的功能,有效减轻了LDH向细胞外扩散的程度。
综上所述,金银花叶黄酮对H2O2诱导RAW264.7巨噬细胞损伤的保护作用可能与其调节细胞氧化还原系统,清除氧自由基及有害物质,维持细胞膜系统稳定性有关,但其具体机制还需进一步研究。
参考文献:
[1] 张昊, 任发政. 羟基和超氧自由基的检测研究进展[J]. 光谱学与光谱分析, 2009, 29(4): 1093-1099. DOI:10.3964/j.is sn.1000-0593(2009)04-1093-07.
[2] CHAUDHARY A, SHARMA U, VIG A P, et al. Free radical scavenging, antiproliferative activities and profiling of variations in the level of phytochemicals in different parts of broccoli (Brassica oleracea Italica)[J]. Food Chemistry, 2014, 148(4): 373-380.DOI:10.1016/j.foodchem.2013.10.042.
[3] ZHANG H L, LI J, XIA J M, et al. Antioxidant activity and physicochemical properties of an acidic polysaccharide from Morinda officinalis[J]. International Journal of Biological Macromolecules,2013, 58: 7-12. DOI:10.1016/j.ijbiomac.2013.03.031.
[4] JIN X H, OHGAMI K, SHIRATORI K, et al. Effects of blue honeysuckle (Lonicera caerulea L.) extract on lipopolysaccharideinduced inflammation in vitro and in vivo[J]. Experimental Eye Research, 2005, 82(5): 860-867. DOI:10.1016/j.exer.2005.10.024.
[5] WU S S, HE X, WU X S, et al. Inhibitory effects of blue honeysuckle(Lonicera caerulea L.) on adjuvant-induced arthritis in rats: crosstalk of anti-inflammatory and antioxidant effects[J]. Journal of Functional Foods, 2015, 17: 514-523. DOI:10.1016/j.jff.2015.06.007.
[6] 李世传, 熊建华, 罗秋水, 等. 不同干燥方法对金银花叶成分和抑菌效果的影响[J]. 中国食品学报, 2012, 12(12): 78-83.
[7] 李世传, 杜华英, 熊建华, 等. 金银花叶抑菌成分的提取及效果研究[J]. 食品研究与开发, 2015, 36(6): 6-10. DOI:10.3969/j.issn.1005-6521.2015.06.002.
[8] 王丽婷, 王丽娟. 大孔树脂分离纯化金银花叶中的总黄酮[J]. 华西药学杂志, 2010, 25(5): 575-576.
[9] 刘婵娟, 毛晓霞, 苏占辉, 等. 金银花叶的研究进展[J]. 中国医药导刊, 2010, 12(1): 98-100. DOI:10.3969/j.issn.1009-0959.2010.01.055.
[10] 翟凤艳, 刘快, 杜丽娟, 等. 金银花叶乙醇提取物对几种病原真菌的抑制作用[J]. 河南科技学院学报(自然科学版), 2016, 44(2): 40-44.DOI:10.3969/j.issn.1008-7516.2016.02.010.
[11] 郑必胜, 李会娜. 金银花叶有效成分的抗氧化活性研究[J]. 现代食品科技, 2013, 29(12): 2870-2876.
[12] 张宁, 曹光群, 林贵坤, 等. 金银花叶的抑菌活性和抗氧化性研究[J]. 香料香精化妆品, 2008(3): 9-12; 16. DOI:10.3969/j.issn.1000-4475.2008.03.003.
[13] 武雪芬, 郑超萍, 李桂兰. 金银花叶提取物的抗氧化作用研究[J]. 河南化工, 1999(10): 10-11.
[14] 李莉梅, 李恒, 朱苗, 等. 野生仙人掌多糖对DPPH·、NO2-的清除能力及其还原力研究[J]. 广东农业科学, 2013, 40(15): 121-123.DOI:10.3969/j.issn.1004-874X.2013.15.039.
[15] LAI Furao, WEN Qibiao, LI Lin, et al. Antioxidant activities of watersoluble polysaccharide extracted from mung bean (Vigna radiata L.)hull with ultrasonic assisted treatment[J]. Carbohydrate Polymers,2010, 81(2): 323-329. DOI:10.1016/j.carbpol.2010.02.011.
[16] 侯学敏, 李林霞, 张直峰, 等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(6): 124-128. DOI:10.7506/spkx1002-6630-201306027.
[17] GOUPY P, DUFOUR C, LOONIS M, et al. Quantitative kinetic analysis of hydrogen transfer reactions from dietary polyphenols to the DPPH radical[J]. Journal of Agricultural and Food Chemistry, 2003,51(3): 615-622. DOI:10.1021/jf025938l.
[18] 卞梦瑶, 方勇, 裴斐, 等. 生姜油树脂对过氧化氢引起RAW264.7巨噬细胞损伤的保护作用[J]. 食品科学, 2014, 35(1): 244-249.DOI:10.7506/spkx1002-6630-201323048.
[19] 陈红梅, 谢翎. 响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J]. 食品科学, 2016, 37(2): 45-50. DOI:10.7506/spkx1002-6630-201602008.
[20] YUAN Q X, XIE Y F, WANG W, et al. Extraction optimization,characterization and antioxidant activity in vitro of polysaccharides from mulberry (Morus alba L.) leaves[J]. Carbohydrate Polymers,2015, 128: 52-62. DOI:10.1016/j.carbpol.2015.04.028.
[21] 甘芝霖, 倪元颖, 郭悦, 等. 大孔树脂分离纯化玫瑰果多酚及其抗氧化性[J]. 农业工程学报, 2015, 31(24): 298-306. DOI:10.11975/j.issn.1002-6819.2015.24.045.
[22] BEDOYA-RAMIREZ D, CILLA A, CONTRERAS-CALDERON J, et al. Evaluation of the antioxidant capacity, furan compounds and cytoprotective/cytotoxic effects upon Caco-2 cells of commercial Colombian coffee[J]. Food Chemistry, 2017, 219: 364-372.DOI:10.1016/j.foodchem.2016.09.159.
[23] 马静静, 郑彬, 张伟, 等. 土壤B[a]P叠加污染对蚯蚓体腔细胞SOD、POD和MDA的毒性效应[J]. 生态与农村环境学报, 2013, 29(6): 743-748. DOI:10.3969/j.issn.1673-4831.2013.06.011.
[24] KHAKI K F, YAGHOUBI A R, ZARGHAMI N, et al. Evaluation of hs-CRP, antioxidant markers and MDA in patients of coronary artery disease (CAD) containing non-smokers and non-diabetics[J].Clinical Biochemistry, 2011, 44(13): 154-155. DOI:10.1016/j.clinbiochem.2011.08.384.
[25] WANG L Y, DING L, YU Z P, et al. Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten mealderived antioxidant peptides in HepG2 cells[J]. Food Research International, 2016, 90: 33-41. DOI:10.1016/j.foodres.2016.10.023.
[26] 王建华, 刘鸿先, 徐同. 超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯, 1989(1): 1-7.
[27] 刘焕兰, 武夏林, 曲卫玲, 等. 琼玉口服液对衰老小鼠脑组织SOD活性及血清中SOD和MDA含量的影响[J]. 吉林中医药, 2013, 33(3):278-280. DOI:10.3969/j.issn.1003-5699.2013.03.029.
[28] HEMACHANDRA L P M P, DIER U, HEMPEL N. Abstract 1440:mitochondrial superoxide dismutase (Sod2) modulates ovarian clear cell carcinoma transcoelomic metastatic pathway[J]. Cancer Research,2015, 75(Suppl 15): 1440. DOI:10.1158/1538-7445.AM2015-1440.
[29] 刘竹青, 尹登科, 韩岚, 等. 桃红四物汤含药血清对过氧化氢损伤的人脐静脉内皮细胞的保护作用[J]. 中国中药杂志, 2013, 38(3): 402-406. DOI:10.4268/cjcmm20130322.
[30] 陈泱杰, 刘晓珍, 黄丹菲, 等. 壬基酚致NCTC1469细胞的损伤作用及活性氧水平、谷胱甘肽含量变化[J]. 食品科学, 2014, 35(3):198-202. DOI:10.7506/spkx1002-6630-201403040.
[31] 宋家乐, 李贵节, 赵欣. 竹盐酿造酱油对H2O2诱发LLC-PK1细胞氧化损伤的保护作用[J]. 食品科学, 2015, 36(9): 176-180.DOI:10.7506/spkx1002-6630-201509032.
 ·) and DPPH free radicals were determined by using ascorbic acid as a positive control. RAW264.7 cells were cultured in vitro, and the experiment was divided into blank, model, control, and low-,medium- and high-dose flavonoid groups. RAW264.7 cells were injured by H
·) and DPPH free radicals were determined by using ascorbic acid as a positive control. RAW264.7 cells were cultured in vitro, and the experiment was divided into blank, model, control, and low-,medium- and high-dose flavonoid groups. RAW264.7 cells were injured by H