卵泡的发育及成熟是一个非常复杂的过程,在此过程中,生物活性物质对雄激素生成关键酶的影响是一个重要的方面。类固醇合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)是在胆固醇转化类固醇代谢中起到运输作用的一种重要蛋白,胆固醇在胆固醇侧链裂解酶(side-chain cleavage enzyme,P450scc)的作用下合成孕烯醇酮,此步骤是类固醇合成的限速步骤,而类固醇激素在细胞色素P450芳香化酶(cytochrome P450 aromatase,CYP19)、细胞色素P450 17等相关酶的作用下合成雌二醇;因此,在合成途径中任何酶的异常都可导致相应激素合成障碍和合成激素的前体物质积聚,造成性激素分泌紊乱[1-5]。
金雀异黄素(genistein,GEN)是大豆异黄酮的主要活性成分[6],存在于富含豆肽的多种天然植物中,其分子结构与人体自身雌激素相同。进入人体后,GEN可完全与雌激素受体结合,发挥雌激素的作用,被认为是雌激素的天然替代品[7-8]。GEN像其他的植物雌激素一样,显示出同雌激素受体更大的信号亲和力,因此,GEN被认为是人类饮食中一种重要的环境雌激素[9-10]。本课题组已通过动物实验证实GEN能调节青年雌性大鼠卵巢中激素水平,对卵巢颗粒细胞中的相关蛋白和基因如bcl-2、bax、P450 mRNA等具有调节作用[11-13]。在此基础上,为了进一步研究GEN对青年雌性大鼠卵巢功能的调节作用和机制,选择了影响卵泡发育过程的雄激素生成关键酶作为研究目标,采用Western blot和实时荧光聚合酶链式反应(polymerase chain reaction,PCR)检测GEN对青年雌性大鼠卵巢组织中雄激素生成关键酶StAR、P450scc、CYP19蛋白及mRNA表达的影响,以期进一步探讨GEN调节卵巢功能的作用和机制。
1 材料与方法
1.1 材料与试剂
GEN(纯度99.82%) 上海融禾医药科技发展有限公司;己烯雌酚(纯度99.4%) 西安天正药用辅料有限公司;花生油 山东鲁花集团有限公司;基础饲料配方:每100 g中含玉米面30.56 g、小麦粉27.27 g、鱼粉(60%蛋白)10 g、粗小麦10 g、酪蛋白7 g、脱脂奶5 g、玉米蛋白(6%)3 g、维生素预混物0.05 g、氯化胆碱(60%活性)、玉米油2 g、酵母2 g(富含GEN和紫花苜蓿的成分由玉米、小麦和酪蛋白代替,以突出处理因素GEN对实验结果的影响)。
蛋白裂解液、蛋白酶抑制剂(苯甲基 磺酰氟)上海碧云天生物技术有限公司;羊抗小鼠抗体、羊抗兔抗体 美国Cell Signaling公司;鼠抗β-肌动蛋白抗体美国Sigma公司;电化学发光(electrochemiluminescence,ECL)化学显色液、SYBR Green PCR试剂盒、蛋白用BCA蛋白定量试剂盒、TRIzol试剂盒 美国赛默飞世尔公司;6×loading buffer 天根生化科技(北京)有限公司;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)美国Millipore公司;Ezna FFPE RNA 试剂盒 广州飞扬生物工程有限公司;PCR逆转录试剂盒 加拿大Fermentas公司;聚丙烯酰胺凝胶电泳试剂盒 上海熠晨生物科技有限公司;苏木精、伊红 上海多烯生物科技有限公司;其他试剂均为国产分析纯。
10×TBS缓冲液:Tris 24.2 g、NaCl 80.0 g,加蒸馏水至1 000 mL,调节pH值至7.6,室温保存;1×TBST缓冲液:10×TBS缓冲液100 mL、蒸馏水900 mL、吐温20 1 mL。封闭液/抗体稀释液(5%脱脂牛奶):1×TBST缓冲液95~100 mL、脱脂奶粉5 g,溶解后4 ℃保存。
1.2 仪器与设备
TG-16M低温冷冻离心机 上海卢湘仪离心机仪器有限公司;K30漩涡振荡器 青浦沪西仪器厂;PRO200电动匀浆机 德国弗鲁克公司公司;Nanodrop 2000超微量分光光度计 美国赛默飞世尔公司;ABI-7300实时荧光PCR检测仪 美国ABI公司;5082酶标仪 瑞士TECAN公司;垂直电泳仪 伯乐生命医学产品(上海)有限公司;TBST脱色摇床 其林贝尔仪器制造有限公司;ImageQuant LAS 4 000 mini超灵敏化学发光成像分析仪 美国通用电气公司。
1.3 方法
1.3.1 动物与分组
2~3 月龄的雌性SD青年大鼠[14]40 只,体质量为(200±20)g,许可证号:SCXK(黑)203-001。按照体质量分为5 组,每组各8 只,分别为(灌胃体积1 mL):阴性对照组(NC):花生油灌胃;GEN低剂量组(L):GEN 15 mg/kg灌胃;GEN中剂量组(M):GEN 30 mg/kg灌胃;GEN高剂量组(H):GEN 60 mg/kg灌胃;阳性对照组(PC):己烯雌酚0.5 mg/kg灌胃。每天给予14 h的周期性光照,动物室温度(20±2)℃,相对湿度(45±10)%。剂量组给予GEN连续灌胃30 d。
1.3.2 观察指标及检测方法
给药30 d后,对所有大鼠进行阴道涂片观察,挑选出处于动情间期的大鼠,禁食不禁水12 h后,采用乙醚麻醉并腹主动脉取血,采集卵巢液氮速冻后放入-80 ℃冰箱保存。
1.3.3 实时荧光PCR检测卵巢组织中StAR、P450scc、CYP19 mRNA的相对表达量
按Trizol试剂盒说明书提取总RNA。反转录合成cDNA,反应体系(25 μL):RNA-Primer Mix 12 μL、5×RT Reaction Buffer 5 μL、25 mmol/L dNTPs 1 μL、25 U/μL RNase Inhibitor 1 μL、200 U/μL M-MLV RTase 1 μL、Oligo(dT)18 1 μL、ddH2O(DNase-free)4 μL。反应程序:37 ℃ 60 min,85 ℃ 5 min,4 ℃ 5 min;置于-20 ℃保存。使用NCBI 引物设计工具设计实时荧光PCR扩增引物,由上海生工生物技术有限公司合成,具体见表1。实时荧光PCR体系(25 μL):cDNA模板 2 μL、SYBR Green Mix 12.5 μL、上游引物F 0.5 μL、下游引物R 0.5 μL、ddH2O:9.5 μL。反应程序:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 45 s,循环40 次;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s;60 ℃ 15 s。
分析各基因的Ct值,计算标化后的-△△Ct值。采用2-△△Ct法对目的基因的表达量进行评估[6-7]。每个基因重复3 次,最后取平均值。数据经Excel整理后,用GraphPad Prism 5.0软件进行分析。
表1 实时荧光PCR引物
Table 1 Primers used for real-time PCR

1.3.4 Western blot检测卵巢组织内StAR、P450scc蛋白相对表达量
称取30 mg卵巢组织,每个样本加入500 μL蛋白裂解液和5 μL蛋白酶抑制剂(苯甲基 磺酰氟),60 Hz匀浆90 s,置于冰上15 min,最后将裂解液转移至新离心管中,14 000×g离心10 min,取上清液。
蛋白变性:用BCA蛋白定量试剂盒进行蛋白定量,酶标仪测定光密度,取等量蛋白加入6×loading buffer,100 ℃孵育10 min。
电泳:利用垂直电泳仪进行聚丙烯酰胺凝胶电泳,蛋白处于浓缩胶时电压设置为80 V,蛋白进入分离胶之后电压120 V,电泳1 h。
转膜:将凝胶玻璃板置于盛有电泳转移缓冲液的容器中,浸泡15~20 min,裁剪好滤纸(Whatman 3 mm CHR)和PVDF膜,滤纸和膜规格为83 mm×75 mm,尽量避免污染滤纸和膜,将裁剪好的滤纸和膜浸泡于电泳转移缓冲液中,驱除留于膜上的气泡。打开转移盒并放置于浅盘中,用转移缓冲液将海绵垫完全浸透后将其放在转移盒壁上,海绵上再放置一张浸湿的Whatman 3 mm滤纸。小心将凝胶放置于滤纸上,避免气泡。用去离子水清洗缓冲液槽,在缓冲液槽中放入搅拌子,将另一块海绵用转移缓冲液浸透后放在凝胶-膜“三明治”上,关上转移盒并插入转移槽。将冰盒装入缓冲液槽,注满4 ℃预冷的转移缓冲液。350 mA恒流转膜75 min。电转完毕后,将PVDF膜置于5%(质量分数,下同)的脱脂奶粉(TBST配制)中37 ℃封闭2 h。
一抗孵育:封闭结束之后,TBST清洗PVDF膜3 遍,分别加入以下一抗4 ℃孵育过夜:P450scc(1∶1 000,羊抗小鼠抗体);StAR(1∶1 000,羊抗兔抗体);β-actin(1∶5 000,羊抗小鼠抗体)。
二抗孵育:一抗孵育结束后,用TBST洗3 遍,抗鼠/抗兔(1∶2 000)二抗室温孵育2 h,TBST脱色摇床清洗3 遍。
免疫检测:PVDF膜上均匀滴加ECL化学显色液,发光强度用化学发光成像检测仪检测拍照。
1.4 数据分析
数据分析采用SPSS 19.0、GraphPad Prism 5.0、Quantity One处理分析,结果以 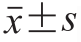 表示,以P<0.05表示差异显著。
表示,以P<0.05表示差异显著。
2 结果与分析
2.1 实验期间雌鼠体质量变化
表2 雌鼠体质量变化(n=8)
Table 2 Body mass changes of female rats (n= 8)
g

表2结果显示,实验期间雌鼠的体质量与NC组比较没有明显变化(P>0.05),实验结果与本课题组前期研究中GEN作用于雌鼠体质量结果一致。
2.2 卵巢组织中StAR、P450scc、CYP19 mRNA的相对表达量

图1β-actin(a)、StAR(b)、P450scc(c)与CYP19(d)基因实时荧光PCR产物的溶解曲线
Fig. 1 Melting curves of real-time PCR products of β-actin (a), StAR (b),P450scc (c) and CYP19 (d) genes
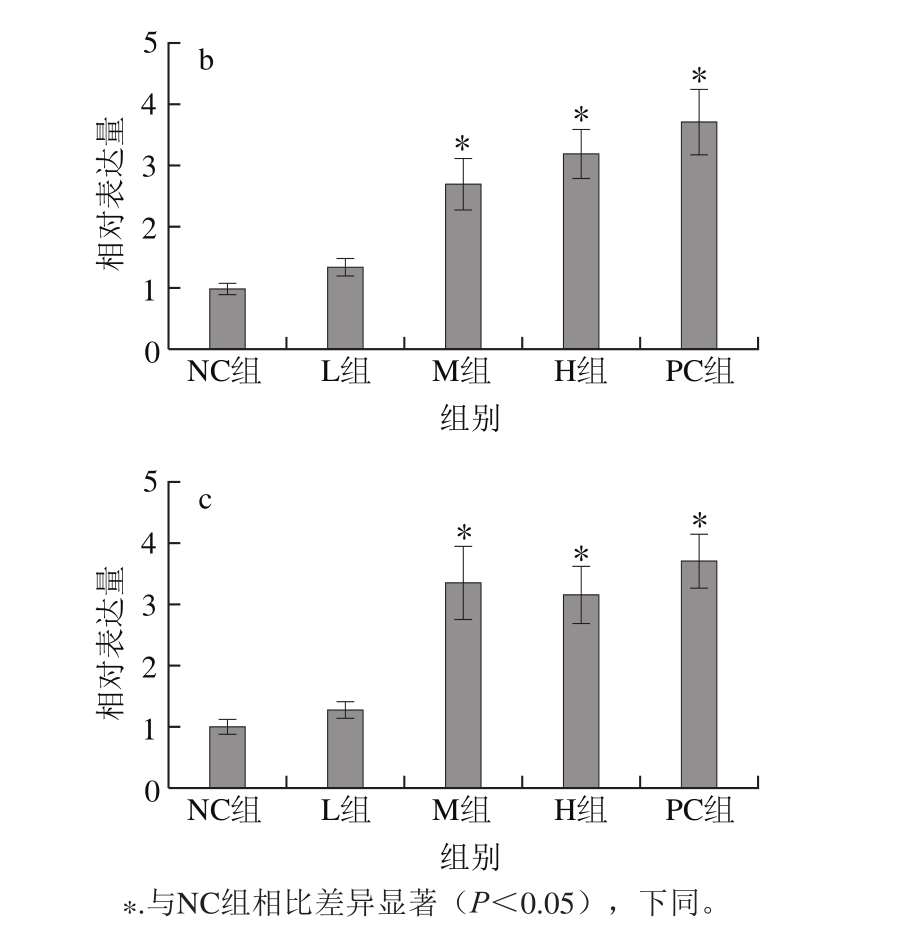
图2 各组大鼠卵巢组织中StAR(a)、P450scc(b)、CYP19(c)mRNA的相对表达量(n= 8)
Fig. 2 Relative expression levels of StAR (a), P450scc (b) and CYP19 (c) mRNA in rat ovaries(n = 8)
图2结果显示,与NC组比较,各剂量组StAR、P450scc、CYP19 mRNA表达水平均升高,尤其以GEN的M组(mRNA相对表达量分别为2.731±1.348、2.691±1.229、3.348±1.715)、GEN H组(mRNA相对表达量分别为2.410±0.864、3.198±0.859、3.153±1.284)升高明显,均有显著性差异(P<0.05),与PC组效果相似。在GEN的作用下,卵巢内起到运转作用的StAR mRNA相对表达量增加,同时P450scc mRNA相对表达量也显著提高,作用于下游产物的酶基因CYP19 mRNA相对表达量也得到了提高,此过程没有雌雄激素生成相关基因的异常表达,推测GEN可能通过影响mRNA的表达来影响激素合成。
2.3 大鼠卵巢StAR与P450scc蛋白表达情况
图1a~d溶解曲线中显示均仅有一个特异性峰,引物特异性较好,溶解温度分别为90、86、86、86 ℃。
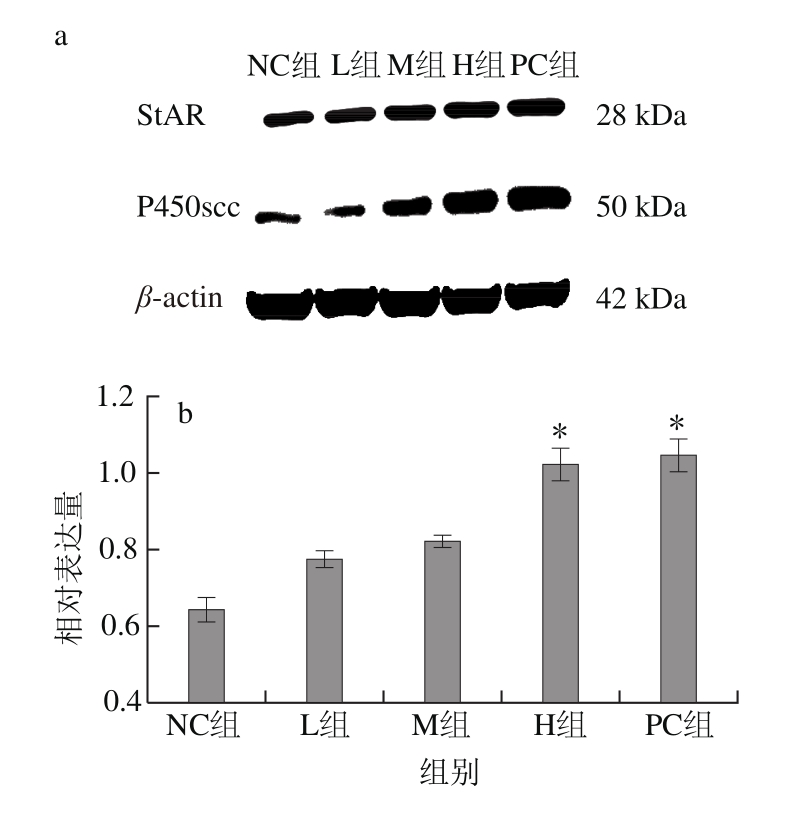

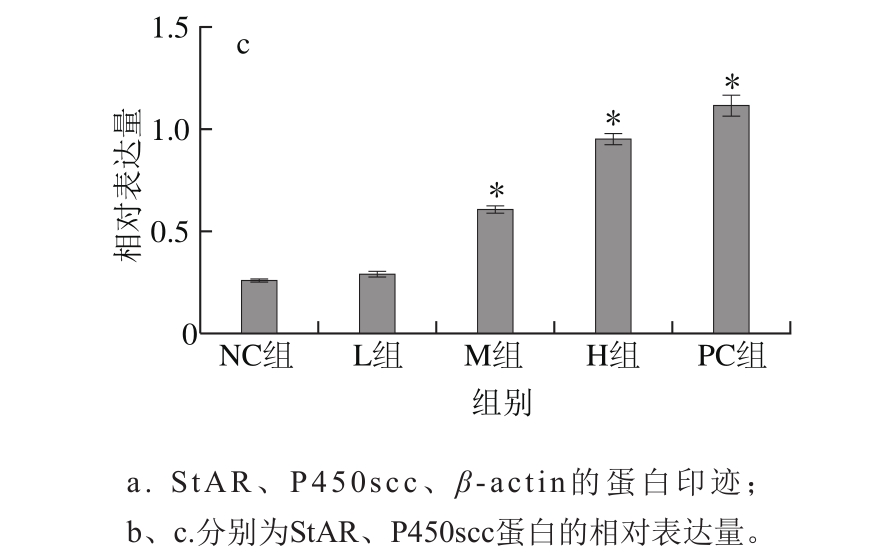
图3 各组雌鼠卵巢StAR、P450scc蛋白灰度检测结果(n=8)
Fig. 3 Relative expression levels of StAR and P450scc proteins in rat ovaries (n = 8)
由图3可见,各组大鼠卵巢中StAR、P450scc蛋白的相对表达量均高于NC组,GEN H组StAR蛋白相对表达量(1.024±0.070)增加明显(P<0.05);GEN M组(0.608±0.033)和H组(0.953±0.053)的P450scc蛋白相对表达量增加,与NC组相比差异显著(P<0.05)。Western blot蛋白检测结果与mRNA表达相一致,表明GEN可以通过影响雄激素生成的关键酶基因及蛋白的表达来影响其生成。
3 讨 论
类固醇激素是在肾上腺、卵巢、睾丸、胎盘、脑和皮肤的类固醇生成细胞中合成的一类重要的调节分子,并影响一系列发育和生理过程。StAR主要介导类固醇生物合成中的限速步骤,即将所有类固醇激素、胆固醇的底物从外部线粒体膜转运到内部线粒体膜[15]。在内膜,细胞色素P450scc切割胆固醇侧链以形成第一类固醇——孕烯醇酮,其通过一系列酶转化成特定组织中的各种类固醇激素。维持正常的生殖发育、功能以及身体内稳态取决于类固醇激素。睾酮P450scc在哺乳动物的卵巢、睾丸等组织中的线粒体内有合成,是唯一将胆固醇转化为孕烯醇酮的酶。孕烯醇酮是合成黄体酮的重要中间体,在细胞色素P450 17α羟化酶、CYP19作用下转变为雌二醇[16-21]。研究表明,在兔、羊、牛的体内黄体中的StAR mRNA的表达水平与孕酮的变化在短时间内是一致的[22-24]。由先天缺陷或实验诱导方法敲除线粒体内类固醇激素合成急性调控蛋白(即StAR和P450c17)导致的雌性胎仔雄激素合成不足,会明显的导致卵巢功能障碍,且雄激素不足会持续到出生以后。雄激素基因的过多表达在人卵巢颗粒细胞中的影响尚未明确,在睾酮刺激后的卵巢颗粒细胞中的StAR的表达是不稳定的,呈现波动状态[25]。
GEN可以抑制新生鼠卵母细胞巢的破裂、抑制卵母细胞凋亡,但对成年和早期老年大鼠卵巢的作用尚不清楚。相关实验显示[26-28],GEN对处于生育期大、小鼠的干预可能会导致生育能力降低,甚至造成不育或不孕。综上所述,有关GEN对于青年雌鼠卵巢的作用机制尚不明确,研究结果也不尽相同。本研究显示,15 mg/(kg·d)低剂量的GEN对青年雌性大鼠卵巢组织中StAR、P450scc、CYP19 mRNA表达无明显影响;给予30~60 mg/kg的GEN干预后,各组大鼠卵巢StAR、P450scc、CYP19 mRNA的表达水平增高,StAR、P450scc蛋白水平也显著增加,说明GEN可增加雄激素生成关键酶的水平,促进胆固醇转化为雄激素,进而间接提升青年雌性大鼠体内的雌二醇含量,其意义在于补充体内雌激素缺少的作用:雌二醇可直接作用于卵巢,刺激卵泡发育;也可促进或抑制促性腺激素的释放,从而间接影响卵巢功能。而StAR、P450scc的转录还受邻苯二甲酸二乙基己基酯、生长因子、前列腺素、甲状腺素、类固醇等[29-30]多种因素的调节,后面的研究中可以考虑对处于国内外热门研究、对生长分化及发育中起重要作用的基质细胞衍生因子-1及早期生长反应因子-1进行研究[31-36]。对于更加深入的医学及分子生物学的研究可基于组学的方法,例如转录组学、蛋白质组学和代谢组学等方法进行研究,有助于更好地理解芳香化和非芳香化雄激素如何调节卵巢功能,进一步明确GEN对卵巢功能作用的机制。
参考文献:
[1] 王静, 糜漫天, 韦娜, 等. n-6/n-3多不饱和脂肪酸对乳腺癌大鼠乳腺癌组织CYP17和CYP19表达的影响[J]. 第三军医大学学报, 2007,29(8): 674-677. DOI:10.3321/j.issn:1000-5404.2007.08.006.
[2] 周文, 余争平. 类固醇合成急性调节蛋白基因表达的调控元件[J].环境卫生学杂志, 2004, 31(4): 224-226.
[3] 王启荣, 杨则宜. 类固醇激素合成急性调控蛋白(StAR)与睾酮的生物合成[J]. 中国运动医学杂志, 2004, 23(5): 591-595. DOI:10.3969/j.issn.1000-6710.2004.05.031.
[4] 周文, 杨进清, 王虚步, 等. 微波辐射对大鼠睾丸P450scc mRNA表达水平的影响[J]. 中华物理医学与康复杂志, 2005, 27(2): 72-74.DOI:10.3760/j:issn:0254-1424.2005.02.003.
[5] LIEBERMAN S, MA S, HE Y. New assumptions about oxidative processes involved in steroid hormone biosynthesis: is the role of cytochrome P-450-activated dioxygen limited to hydroxylation reactions or are dioxygen insertion reactions also possible?[J]. Journal of Steroid Biochemistry & Molecular Biology, 2005, 94(5): 405-420.DOI:10.1016/j.jsbmb.2004.12.040.
[6] KOGISO M, SAKAI T, MITSUYA K, et al. Genistein suppresses antigen-specific competition with 17beta-estradiol receptors for estrogen in ovalbumin-immunized BALB/c mice[J]. Nutrition, 2006,22(7/8): 802-809. DOI:10.1016/j.nut.2006.04.003.
[7] GELLER S E, STUDEE L. Botanical and dietary supplements for menopausal symptoms: what works, what does not[J].Journal of Women’s Health, 2005, 14(7): 634-649. DOI:10.1089/jwh.2005.14.634.
[8] GHESHLAGHI S A, JAFARI R M, ALGAZO M, et al. Genistein modulation of seizure: involvement of estrogen and serotonin receptors[J]. Journal of Natural Medicines, 2017, 71(3): 537-544.DOI:10.1007/s11418-017-1088-3.
[9] MAGIERA S, ADAMEK J. Evaluation of new natural deep eutectic solvents for the extraction of isoflavones from soy products[J]. Talanta,2017, 168: 329-335. DOI:10.1016/j.talanta.2017.02.065.
[10] DA SILVA FERNANDES M, LIMA F S, RODRIGUES D, et al.Evaluation of the isoflavone and total phenolic contents of kefirfermented soymilk storage and after the in vitro digestive system simulation[J]. Food Chemistry, 2017, 229: 373-380. DOI:10.1016/j.foodchem.2017.02.095.
[11] 迟晓星, 张涛, 钱丽丽, 等. 大豆异黄酮对青年雌性大鼠卵巢、子宫组织中Bcl-2 mRNA和Bax mRNA表达的影响[J]. 食品科学, 2010,31(11): 231-233.
[12] 迟晓星, 张涛, 郑丽娜, 等. 大豆异黄酮对青年雌性大鼠的抗氧化作用研究[J]. 中国食品学报, 2010, 10(5): 78-82. DOI:10.3969/j.issn.1009-7848.2010.05.012.
[13] 张涛, 迟晓星, 郭艳萍, 等. 大豆异黄酮对青年雌性大鼠卵巢组织Bcl-2和Bax蛋白表达的影响[J]. 中国公共卫生, 2011, 27(3): 337-338.
[14] 石如玲, 许建功, 杨磊, 等. 老年和青年大鼠大脑皮质脂肪酸组成及含量的对比分析[J]. 中国生物化学与分子生物学报, 2010, 26(12):1165-1169.
[15] 汤昆, 梁慧子, 张漓. 线粒体胆固醇转运蛋白研究进展[J].中国运动医学杂志, 2017, 36(3): 255-259. DOI:10.3969/j.issn.1000-6710.2017.03.013.
[16] HIORT O, HOLTERHUS P M, WERNER R, et al. Homozygous disruption of P450 side-chain cleavage (CYP 11A1) is associated with prematurity, complete 46, XY sex reversal, and severe adrenal failure[J]. Clinical Endocrinology and Metabolism, 2005, 90(1): 538-541. DOI:10.1210/jc.2004-1059.
[17] QIU Y Y, SUI X X, CAO S X, et al. Steroidogenic acute regulatory protein (StAR) overexpression reduces inflammation and insulin resistance in obese mice[J]. Journal of Cellular Biochemistry, 2017,118(11): 3932-3942. DOI:10.1002/jcb.26046.
[18] 王建明, 孙静, 齐峰, 等. 何首乌饮对大鼠睾丸间质细胞类固醇激素合成急性调节蛋白和细胞色素P450胆固醇侧链裂解酶蛋白表达的影响[J]. 解剖学报, 2017, 48(1): 30-36.
[19] STOCCO D M, SELVARAJ V. Yet another scenario in the regulation of the steroidogenic acute regulatory (StAR) protein gene[J].Endocrinology, 2017, 158(2): 235-238. DOI:10.1210/en.2016-1874.
[20] CARRAT G R, HU M, NGUYEN-TU M S, et al. Decreased StARD10 expression is associated with defective insulin secretion in humans and mice[J]. American Journal of Human Genetics, 2017, 100(2): 238-256.DOI:10.1016/j.ajhg.2017.01.011.
[21] PUTHUMANA J, LEE M C, PARK J C, et al. Ultraviolet B radiation induces impaired lifecycle traits and modulates expression of cytochrome P450 (CYP) genes in the copepod Tigriopus japonicas[J]. Aquatic Toxicology, 2017, 184: 116-122. DOI:10.1016/j.aquatox.2017.01.011.
[22] TOWNSON D H, WANG X J, KEYES P L, et al. Expression of the steroidogenic acute regulatory protein (StAR) in the corpus luteum of the rabbit: dependence upon the luteotrophic hormone, estradiol-17β[J]. Biology of Reproduction, 1996, 55(4): 868-874. DOI:10.1095/biolreprod55.4.868.
[23] BOSMANN H B, HALES K H, LI X, et al. Acute in vivo inhibition of testosterone by endotoxin parallels loss of steroidogenic acute regulatory (StAR) protein in Leydig cells[J]. Endocrinology, 1996,137(10): 4522-4525. DOI:10.1210/en.137.10.4522.
[24] PESCADOR N, SOUMANO K, STOCCO D M, et al. Steroidogenic acute regulatory protein in bovine corpora lutea[J]. Biology of Reproduction, 1996, 55(2): 485-491. DOI:10.1095/biolreprod55.2.485.
[25] CHEN M, XU Y, MIAO B, et al. Expression pattern of circadian genes and steroidogenesis-related genes after testosterone stimulation in the human ovary[J]. Journal of Ovarian Research, 2016, 9(1): 56.DOI:10.1186/s13048-016-0264-5.
[26] NADERI G A, ASGARY S, SARRAF-ZADEGAN G N, et al. Antioxidant eあect of flavonoids on the susceptibility of LDL oxidation[J].Molecular and Cellular Biochemistry, 2003, 246(1/2): 193-196.
[27] 孙晓溪, 张云波, 郭纪鹏, 等. 生育期金雀异黄素干预对亲代大鼠生育能力的影响[J]. 中国医药导报, 2016, 13(3): 4-7.
[28] 林松, 沈维干. 金雀异黄素对雌性小鼠卵母细胞成熟及其受精能力的影响[J]. 南京医科大学学报(自然科学版), 2008, 28(7): 845-849.
[29] 刘淑敏, 万力, 常薇. 邻苯二甲酸二乙基己基酯暴露对青春期大鼠卵巢StAR、P450scc基因表达的影响[J]. 卫生研究, 2014, 43(1):143-145.
[30] 吴莉. 家族性糖皮质激素缺乏伴生长激素缺乏的基因突变分析及治疗观察[D]. 济南: 山东大学, 2015: 15-18.
[31] 肖程, 罗庆, 康权, 等. 高表达CXCR4/CXCR7对小鼠胚胎肝干细胞增殖、迁移和抗氧化应激损伤的影响[J]. 中国细胞生物学学报,2017, 39(2): 165-171. DOI:10.11844/cjcb.2017.02.0305.
[32] 刘宗超, 韦章超, 刘勇, 等. 基质细胞衍生因子1对于血管内皮细胞增殖影响及其相关机制研究[J]. 中国修复重建外科杂志, 2017,31(1): 91-97.
[33] CIVES M, QUARESMINI D, RIZZO F M, et al. Osteotropism of neuroendocrine tumors: role of the CXCL12/CXCR4 pathway in promoting EMT in vitro[J]. Oncotarget, 2017, 8(14): 22534-22549.DOI:10.18632/oncotarget.15122.
[34] 王丹, 关美萍, 薛耀明, 等. 早期生长反应因子-1与糖尿病肾病[J].国际内分泌代谢杂志, 2014, 34(6): 397-400. DOI:10.3760/cma.j.issn.1673-4157.2014.06.0010.
[35] 黄舒颖, 卿城, 朱元方. 早期生长反应因子1在正常卵巢及卵巢良、恶性肿瘤组织中的表达及意义[J]. 广东医学, 2015, 36(7):1045-1048.
[36] DUCLOT F, KABBAJ M. The role of early growth response 1(EGR1) in brain plasticity and neuropsychiatric disorders[J].Frontiers in Behavioral Neuroscience, 2017, 11: 35. DOI:10.3389/fnbeh.2017.00035.