随着现代社会交往需求增加,酒精消费量快速增加,酒精性肝损伤的发病率也呈逐年上升趋势,在我国已成为继病毒性肝炎后的第二大肝病,严重危害着大众身体健康。由于酒精性肝损伤是进行性疾病,发展到晚期为肝硬化难以治愈。因此,研究预防和早期遏制酒精性肝损伤的有效方法显得尤为重要[1-2]。目前,现代医学治疗酒精性肝损伤除了戒酒、对症治疗外,临床多采用激素类药物进行治疗,但疗效有限,而且药物也存在潜在的毒副作用。因此,从食物中寻找具有保肝作用的活性成分,已成为国内外学者的研究热点之一[3-5]。
猪血是一种价格低廉,又可大量获取的食品工业副产品,含有蛋白质、矿物质、酶和一些生理活性物质;其蛋白质含量达到18%左右,蛋白质中含有人体所需的8 种必需氨基酸,是极具开发利用价值的优质蛋白资源。如今优质蛋白资源短缺,而我国作为世界养猪大国,有丰富的血资源,并且生猪定点屠宰的贯彻实施和屠宰加工企业向大型化的发展,使血液的大规模收集成为可能。因此,开发利用猪血蛋白资源受到了广泛重视[6-7]。近年来,由于生物酶解技术的发展,利用蛋白酶水解猪血以提高其利用率已逐渐成为热点。目前对猪血蛋白酶解产物的功能研究多集中在抗氧化[8]、降血脂[9]、辅助调节血压[10]等方面,而有关其对酒精性肝损伤的保护作用研究鲜见报道。为此,本实验以雄性昆明种小鼠为实验动物,通过建立急性酒精性肝损伤动物模型,研究猪血蛋白酶解物对酒精性肝损伤的保护作用,为更广泛利用猪血蛋白资源和开发抗酒精性肝损伤的功能食品提供参考。
1 材料与方法
1.1 实验动物、材料与试剂
实验专用雄性昆明种小鼠60 只,体质量(20±2)g,小鼠专用生长维持饲料,均由四川大学华西实验动物中心提供,动物合格证号为SCXK(川)-2013-026。
猪血蛋白酶解物(porcine blood hydrolysate,PBH)的制备:将新鲜猪血于40 ℃水浴条件下,加胰酶进行搅拌酶解。酶解5 h后,将酶解液置沸水浴灭酶,冷却后将酶解液离心,取上清液于试管中,经过滤、浓缩、干燥后得到粉末状产品。
超氧化物歧化酶(superoxide dismutase,SOD)测试盒、谷胱甘肽-过氧化物酶(glutathione peroxidase,GSH-Px)测试盒、甘油三酯(triglyceride,TG)测试盒、还原型谷胱甘肽(glutathione,GSH)、丙二醛(malonic dialdehyde,MDA)、肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素-6(nterleukin-6,IL-6)测试盒 南京建成生物工程研究所;GSH原料药(纯度98%) 北京澳康生物科技有限公司。
1.2 仪器与设备
TE412-L电子天平 德国Sartorius公司;MicrOTOF-QⅡ型高分辨质谱仪 德国Bruker公司;S-433D型全自动氨基酸分析仪 德国赛卡姆公司;XHF-D型高速分散器 宁波新芝生物科技有限公司;UV-3200型紫外-可见分光光度计 上海美谱达仪器有限公司;St16r型冷冻离心机和Multiskan MK3型全自动酶标仪 赛默飞世尔科技(中国)有限公司;7020型全自动生化分析仪 日本Hitachi株式会社;RM2135型半自动切片机 德国Leica公司;NIS-Elements BR显微摄像仪 日本Nikon株式会社。
1.3 方法
1.3.1 PBH分子质量的测定
将一定质量的PBH溶于甲醇后,采用电喷雾质谱法方式自动进样,以3 µL/min的流速检测分子质量。
1.3.2 小分子肽得率的测定
蛋白质含量测定:按照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,采用凯氏定氮法测定。游离氨基酸含量和氨基酸组成的测定:按照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》,采用全自动氨基酸分析仪测定,色氨酸的测定采用碱水解法进行。三氯乙酸(trichloroacetic acid,TCA)可溶性蛋白含量测定:按照GB/T 22492—2008《大豆肽粉》和GB/T 22729—2008《海洋鱼低聚肽粉》进行,取PBH 2 g,加入10 mL质量分数15%的TCA溶液,混合均匀,静置10 min,将样品溶液4 000 r/min离心10 min,取全部上清液,采用凯氏定氮法测定上清液蛋白质含量。小分子肽含量测定:按照GB/T 22492—2008和GB/T 22729—2008进行,PBH经过TCA溶液溶解处理后,离心分离出沉淀物,收集离心上清液;按照GB 5009.5—2016方法测定离心清液中TCA可溶性蛋白含量,离心清液中TCA可溶性蛋白含量减去游离氨基酸含量可得到样品中小分子肽的含量,即小分子肽含量/(g/100 g)=TCA可溶性蛋白质含量/(g/100 g)-游离氨基酸含量/(g/100 g)。
1.3.3 动物分组和给药方法
按照《保健食品检验与评价技术规范(2003年版)》中“对化学性肝损伤有辅助保护作用”检验方法要求,采用造酒精性肝损伤模型进行实验。将60 只小鼠适应性喂养3 d后随机分为6 组,每组10 只,分别为空白对照组、模型对照组、药物对照组和PBH低、中、高剂量组。通常蛋白质类补充剂的人体推荐剂量为10 g/d,按成人体质量平均为60 kg设计灌胃剂量。以人体推荐剂量5、10、20 倍作为受试剂量,即3 个实验组以0.83(Ⅰ组)、1.70(Ⅱ组)、3.33 g/kg mb(Ⅲ组)剂量每日灌胃PBH,药物对照组用GSH以20 mg/kg mb灌胃,空白对照组、模型对照组给予等体积蒸馏水,实验期30 d。实验至第31天,模型对照组、药物对照组及PBH各剂量组一次灌胃给予50%的无水乙醇12 mL/kg mb,空白对照组给予蒸馏水,禁食16 h后各组小鼠摘除眼球取血,再采用颈椎脱臼法处死,取出肝脏,测定各项指标。
1.3.4 血清和肝脏生化指标的检测
血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)活力采用全自动生化分析仪进行检测。肝脏MDA、GSH-Px、GSH、TG、TNF-α、IL-6水平按试剂盒说明书进行测定。
1.3.5 肝组织病理组织学观察
取部分肝组织,用体积分数10%甲醛溶液固定,常规石蜡包埋,切片,苏木精-伊红(hematoxylin-eosin,HE)染色,光学显微镜下观察肝组织形态学变化。
1.4 数据统计
实验数据采用SPSS 19.0软件进行统计分析,采用Duncan’s法进行单因素多重比较分析,数据以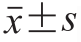 表示。
表示。
2 结果与分析
2.1 PBH中氨基酸组成、游离氨基酸含量和分子质量
表1 PBH中氨基酸组成和游离氨基酸含量
Table 1 Compositions of amino acid and free amino acid in PBH g/100 g
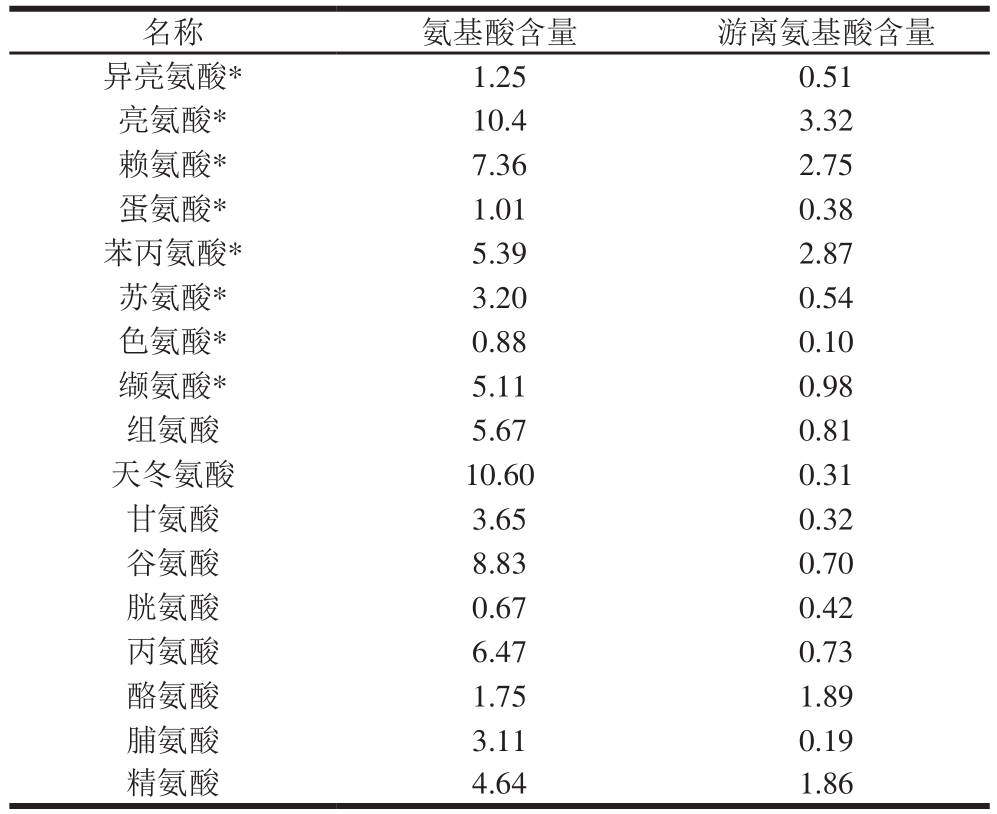
注:*.必需氨基酸。
由表1可知,PBH中必需氨基酸含量丰富,总量为34.6 g/100 g,而且还含有11.45 g/100 g的游离氨基酸。
由图1可知,PBH是分子质量集中在1 000 Da以下的多种小肽和氨基酸的混合物。由凯氏定氮法测得PBH中蛋白质含量为91.25 g/100 g,TCA可溶性蛋白质含量为89.85 g/100 g。由于高分子质量蛋白质在酸性条件容易被沉淀,低分子质量蛋白质水解物(包含小分子肽和游离氨基酸)可溶于TCA溶液。样品经过TCA溶液溶解处理后,离心分离出沉淀物,上清液中TCA可溶性蛋白含量减去游离氨基酸含量即可得到样品中小分子肽的含量。因此,PBH中小肽含量占70%以上,各组分含量所占比例如图2所示。
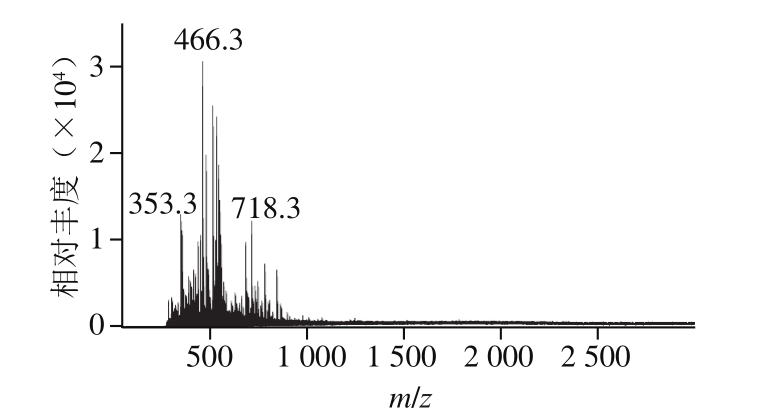
图1 PBH分子质量范围
Fig. 1 Molecular mass distribution of PBH

图2 PBH中小分子肽、游离氨基酸、高分子质量蛋白质等含量比例
Fig. 2 Proportions of small peptide, free amino acid and high-molecular-mass protein in PBH
2.2 PBH对小鼠体质量的影响
整个实验期间,各组小鼠精力充沛,活泼好动,食欲旺盛;皮肤富有弹性,被毛光滑明亮,个体增质量迅速,体质量测定结果见表2。实验至第31天灌胃酒精后,模型对照组首先表现出兴奋状态,然后出现反应迟缓、嗜睡、四肢瘫软,此状态持续1 h左右。PBH各剂量组与模型对照组相比较,精神状态明显优于模型对照组,中、高剂量组尤为明显。
表2 各组小鼠平均体质量的测定结果(n= 10)
Table 2 Average body weight of mice (n= 10)
g
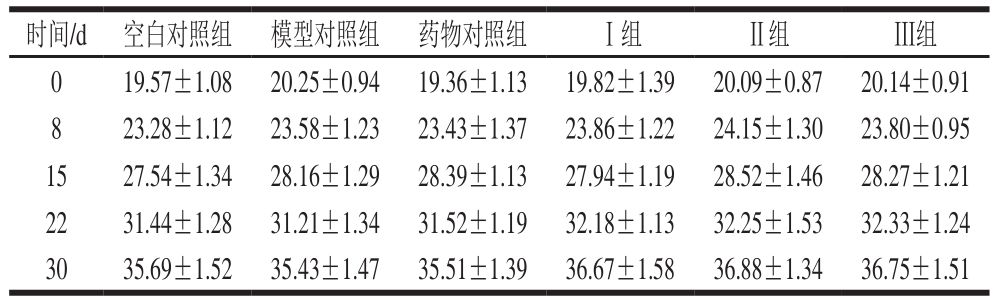
由表2可知,在整个实验期间,各组小鼠的体质量差异不显著(P>0.05),表明在本实验条件下PBH对小鼠的生长发育和健康状况无不良影响。
2.3 PBH对小鼠血清ALT、AST活力的影响
表3 PBH对小鼠血清 ALT和AST活力的影响(n=8)
Table 3 Effect of PBH on ALT and AST activity in serum from mice (n= 8)

注:同行肩标相同大写或小写字母表示差异不显著(P>0.05),如A和A,a和a;肩标相同大小写字母或不同小写字母表示差异显著(P<0.05),如A和a,a和b;肩标不同大写字母,或不同大小写字母表示差异极显著(P<0.01),如A和B,A和b;下同。
ALT和AST是主要存在于肝脏的转氨酶,当肝细胞发生损伤如变性或坏死时,ALT和AST会逸出肝细胞使血中ALT、AST活力升高。因此,在临床医学上常用血中ALT、AST活力作为判断肝脏是否受到损伤的重要指标。由表3可知,模型对照组血清AST和ALT活力与药物对照组、Ⅰ组、Ⅱ组、Ⅲ组、空白对照组差异极显著(P<0.01),表明模型组肝细胞受到损伤,肝功能出现异常。Ⅰ组、Ⅱ组、Ⅲ组AST和ALT活力与药物对照组、空白对照组差异显著(P<0.05,P<0.01),Ⅰ组与Ⅱ组、Ⅲ组差异显著(P<0.05),Ⅱ组与Ⅲ组差异不显著(P>0.05);这表明PHB各剂量组ALT和AST活力虽然高于药物对照组,但显著低于模型对照组,说明猪血经过酶解后产生的PHB对维持肝细胞的完整性起到重要作用。而且随着PHB灌胃剂量增加,小鼠血中ALT和AST活力逐渐下降,呈现一定的剂量-效应关系。刘睿等[11]在研究人参低聚肽对急性酒精性肝损伤的作用时证实,通过人参低聚肽干预可以显著降低大鼠血清ALT、AST活力;何慧等[12]研究灵芝肽对乙醇诱导肝损伤小鼠的保护作用时,也得出了类似结论。因此,本实验结果与同类研究结果类似。
2.4 PBH对小鼠肝脏SOD、GSH-Px活力,MDA、GSH
和TG水平的影响
表4 PBH对小鼠肝脏SOD、GSH-Px活力,MDA、GSH和TG水平的影响(n=8)
Table 4 Effect of PBH on SOD and GSH-Px activities, MDA, GSH and TG level in liver from mice (n= 8)
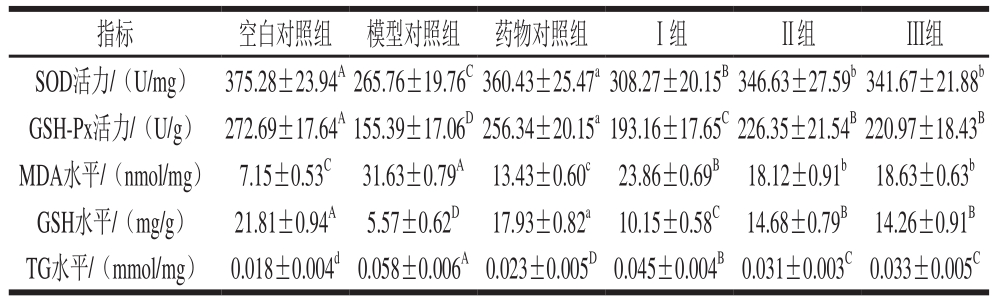
肝脏是酒精代谢的重要器官,饮酒过量可使肝脏受到损伤,尤其对肝脏的抗氧化能力和脂肪代谢影响较大。SOD和GSH-Px是体内重要是抗氧化酶,GSH能够清除体内自由基,MDA是体内脂质过氧化产物,它们的变化均可反映组织细胞过氧化损伤的程度。由表4可知,模型对照组肝脏SOD、GSH-Px活力,MDA、GSH和TG水平与药物对照组、Ⅰ组、Ⅱ组、Ⅲ组、空白对照组差异显著(P<0.05,P<0.01),这进一步表明模型对照组小鼠肝脏受到损伤,导致SOD、GSH-Px活力,GSH水平下降,MDA和TG水平上升,提示本实验造模成功;Ⅰ组、Ⅱ组、Ⅲ组SOD、GSH-Px活力,MDA、GSH和TG水平与药物对照组、空白对照组差异显著(P<0.05,P<0.01),Ⅰ组与Ⅱ组、Ⅲ组差异显著(P<0.05,P<0.01),表明在本实验条件下,灌胃不同剂量PHB能够提高肝脏的抗氧化能力,改善肝脏的脂肪代谢。王双玉等[13]在研究玉米肽对小鼠急性酒精性肝损伤的保护作用时发现,灌胃不同剂量玉米肽均能显著提高肝脏GSH-Px活力,降低MDA、TG水平。本实验中Ⅱ组与Ⅲ组差异不显著(P>0.05),表明蛋白质类补充剂过量摄入不会增加机体的抗氧化能力。徐士勋等[14]在研究鳖甲寡肽抗小鼠急性酒精性肝损伤时也证实,鳖甲寡肽能够使得肝组织SOD活力升高、MDA含量下降,但是高剂量组和低剂量组差异不显著。因此,本实验结果与同类研究类似。
2.5 PBH对小鼠肝脏TNF-α、IL-6水平的影响
表5 PBH对小鼠肝脏TNF-α和IL-6水平的影响(n=8)
Table 5 Effect of PBH on TNF-αand IL-6 level in liver from mice (n= 8)

TNF-α和IL-6作为重要的炎症反应调节因子,在酒精性肝病的发生过程中被认为是反映炎症严重程度的重要指标。由表5可知,模型对照组肝脏TNF-α和IL-6水平极显著(P<0.01)高于药物对照组、Ⅰ组、Ⅱ组、Ⅲ组、空白对照组,表明模型组肝细胞发生严重的炎症反应。Ⅰ组、Ⅱ组、Ⅲ组TNF-α和IL-6水平与药物对照组、空白对照组差异显著(P<0.05,P<0.01),Ⅰ组与Ⅱ组、Ⅲ组差异显著(P<0.05,P<0.01),Ⅱ组与Ⅲ组差异不显著(P>0.05);这表明PHB对改善肝脏的炎症反应有明显效果。孙梦雯等[15]在研究脑肠肽对酒精性肝损伤的保护作用时证实,脑肠肽通过降低肝脏中TNF-α和IL-6水平,发挥抗炎抗氧化作用对酒精性肝损伤起保护作用。刘晨晨等[16]也认为,鳕鱼皮胶原蛋白肽通过降低肝脏中TNF-α水平对小鼠急性肝损伤起保护作用。因此,本实验结果与同类研究类似。
2.6 PBH对小鼠肝脏的组织病理学影响
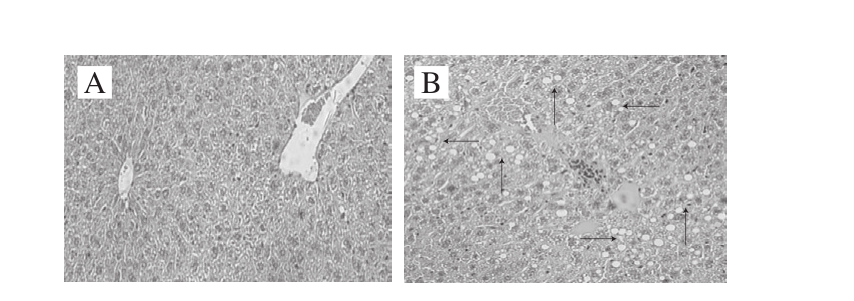
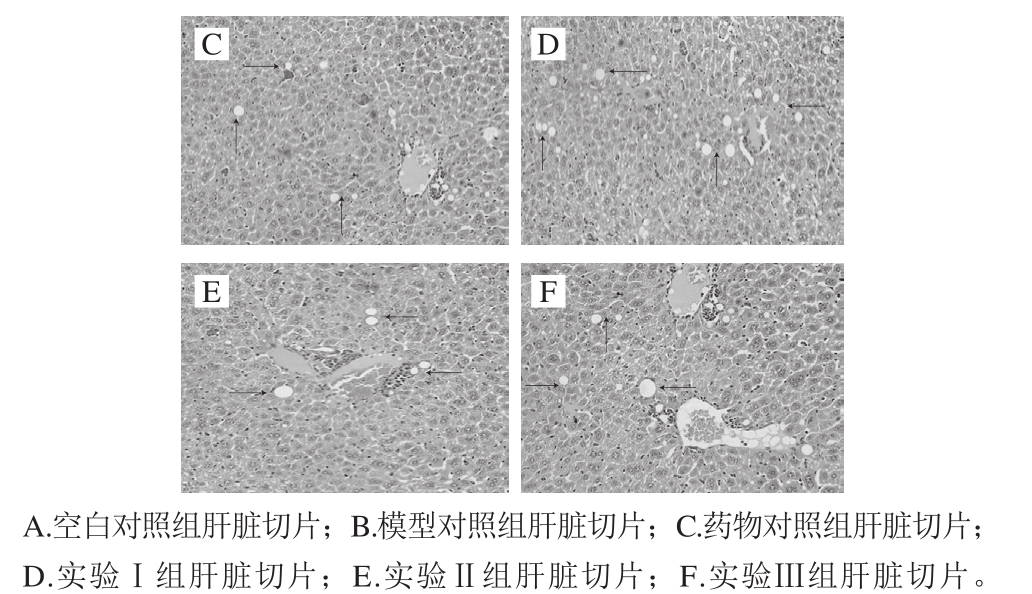
图3 小鼠肝脏切片HE染色
Fig. 3 HE staining of liver sections from mice
由图3A可知,空白对照组肝小叶清晰,肝细胞索排列整齐,在中央静脉周围呈放射状分布;中央静脉无扩张,胞浆内无脂滴,无异常改变。由图3B可知,模型对照组肝小叶界限不清,肝细胞结构紊乱,胞浆内有大量脂滴出现,严重者脂滴互相融合,将细胞核挤向细胞一侧,出现明显的脂肪变性。
由图3C可知,药物对照组肝细胞结构和肝索排列基本接近正常,肝细胞内脂滴基本消失,偶见散在脂滴。由图3D可知,实验Ⅰ组肝细胞结构基本完整,胞浆内有部分脂滴出现,但脂滴排列稀疏,脂肪变性程度明显轻于模型对照组。
由图3E可知,实验Ⅱ组肝细胞结构较完整,胞浆内有散在脂滴出现,但脂肪变性程度明显轻于实验Ⅰ组。由图3F可知,实验Ⅲ组肝细胞结构较完整,胞浆内有少量脂滴出现,脂肪变性程度轻于实验Ⅰ组。因此,PBH对小鼠急性酒精性肝损伤有显著的改善作用。蔡琦等[17]在研究蛹虫草多肽对大鼠急性酒精性肝损伤的作用时发现,灌胃虫草多肽可以明显减轻肝细胞脂肪变性及坏死。李林格等[18]通过研究大鲵皮胶原蛋白肽对乙醇肝损伤时证实,小鼠灌胃大鲵皮胶原蛋白肽后肝细胞损伤得到改善。因此,本实验结果与同类研究类似。
3 讨 论
酒精性肝病已成为全球面临的重要公共卫生问题之一,多个国家都在致力于降低酒精的过量使用,以减少酒精性肝病的发病率。目前认为酒精性肝病的发病机制与酒精及其代谢产物对肝脏的损伤密切相关,包括氧化应激与脂质过氧化反应、内毒素作用、免疫学、营养和遗传等因素,而氧化应激与脂质过氧化反应在酒精性肝损伤中的作用日益受到重视[19-20]。大量研究表明,急性酒精中毒会导致肝细胞中的酶和细胞器受到损伤,使脂肪酸在线粒体内的β-氧化产生障碍,产生脂质过氧化反应。而脂质过氧化会不仅会使肝细胞膜产生损伤,使血中AST、ALT活力升高,还会使甘油三酯在肝细胞中的代谢发生障碍,导致甘油三酯在肝脏聚集。肝脏在发生脂质过氧化反应时,TNF-α可通过直接细胞毒作用,引起肝细胞变性或坏死,也可与IL-6相互激发,引起级联放大反应而加重肝损伤[21-22]。本实验结果显示模型组小鼠肝组织SOD、GSH-Px活力和GSH水平显著下降,MDA、TNF-α、IL-6水平显著升高,表明小鼠在灌胃酒精后机体氧化应激水平发生改变,引起了肝细胞损伤。而灌胃PBH剂量组显著升高肝组织SOD、GSH-Px活力和GSH水平,降低MDA、TNF-α、IL-6水平,表明PBH能够对抗灌胃酒精后引起的肝细胞脂质过氧化反应,保护肝细胞免受损伤。此外,模型组小鼠肝脏TG水平显著上升,病理组织切片也显示肝细胞胞浆有大量脂滴出现,发生明显脂肪变性;且肝细胞形态结构发生破坏,使得血中ALT、AST活力显著上升。而PBH剂量组肝细胞结构相对完整,脂肪变性程度减轻,而且肝脏TG水平、血中ALT、AST活力明显下降,表明PBH能够调节肝脂代谢,降低肝脏的脂质过氧化损伤,通过修复和维持肝细胞膜的完整性以降低血中ALT、AST活力。Wu Yuhong等[23]在研究玉米肽对酒精性肝损伤的保护作用时证实,玉米肽通过提高肝内SOD、GSH-Px活力和GSH水平,降低TNF-α浓度,减轻肝脏过氧化损伤,以促进肝细胞修复而降低血中ALT、AST活力。Lin Bing等[24]在研究海洋胶原蛋白肽对酒精性肝损伤的作用时也认为,海洋胶原蛋白肽能够通过抗炎抗氧化途径缓解酒精性肝损伤。
猪血蛋白具有一定空间结构,当酶对其水解时,肽键发生断裂,蛋白质结构发生变化。一些被包埋的氨基酸残基和氨基酸的侧链基团暴露出来,其中具有提供氢原子和金属鳌合能力的基团能直接参与自由基的淬灭,抑制脂质过氧化发生,保护肝细胞[25]。因此PBH的氨基酸组成可能决定其对肝细胞损伤有保护作用。Wei等[26]认为所有氨基酸都含有—NH2基团,可以在不同体系中表现出抗氧化活性,对肝细胞损伤有辅助保护作用;Ramos等[25]研究发现组氨酸、苯丙氨酸、色氨酸等抗氧化活性较强,这些氨基酸能够作为潜在的护肝补充剂使用。但还有研究认为,蛋白质酶解产物的功能是由其含有的小肽和氨基酸共同体现。Zhang Feng等[27]在研究玉米肽的功能时发现,玉米蛋白水解物中的多种小肽能够直接发挥保肝作用,而且在水解物中其他氨基酸的协同作用下,其保肝活性得到增强。通常对酒精性肝损伤具有保护作用的肽都具有抗氧化活性,而且其中富含亮氨酸、赖氨酸、组氨酸、苯丙氨酸等氨基酸[28-29]。PBH的氨基酸组成中含有一定量的组氨酸、赖氨酸、蛋氨酸、苯丙氨酸等氨基酸,这些氨基酸不仅在游离状态就具有抗氧化保肝作用,而且由其所组成的肽还能发挥保肝作用,这样使得PBH的保肝效果还可能进一步提高。此外,PBH作为蛋白质类补充剂,在参与肝组织的更新与修复方面也起了重要作用。
因此,可以认为PBH对急性酒精性肝损伤的保护作用是由组成它的许多小肽和游离氨基酸共同形成。其机制可能是PBH能够有效拮抗急性酒精性肝损伤所导致的抗氧化酶活性下降、GSH耗竭以及炎症因子的产生,抑制自由基介导的脂质过氧化反应,增强机体自由基清除防御体系及脂肪酸在细胞内的代谢能力,促进肝细胞的修复和再生。
4 结 论
本实验以小鼠为实验动物,研究PBH对急性酒精性肝损伤的保护作用,实验按照我国卫生部颁布的《保健食品检验与评价技术规范(2003版)》中“对化学性肝损伤有辅助保护作用检验方法”评定标准,结果显示PBH能够减轻小鼠急性酒精性肝损伤程度,降低血清中ALT、AST活力,提高小鼠肝脏SOD、GSH-Px水平及GSH水平,增强肝脏脂质代谢能力,降低受损肝组织中MDA、TNF-α、IL-6水平,减轻肝组织病变程度,说明PBH作为对酒精性肝损伤有保护作用的保健食品的开发具有很大前景。
参考文献:
[1] 邢佳, 陆文娟, 赵云霞, 等. 石榴叶多酚对小鼠急性酒精性肝损伤的保护作用[J]. 食品科学, 2015, 36(21): 253-257. DOI:10.7506/spkx1002-6630-201521047.
[2] 王丽娟, 仇菊, 李再贵. 芦荟白酒毒性评价及对酒精性肝损伤小鼠的保护作用研究[J]. 现代食品科技, 2016, 32(6): 281-287.
[3] SONTHALIA N, PAWAR S V, MOHITE A R, et al. metronidazoleinduced encephalopathy in alcoholic liver disease: a diagnostic and therapeutic challenge[J]. The Journal of Emergency Medicine, 2016,51(4): 79-83. DOI:10.1016/j.jemermed.2016.05.038.
[4] ADDOLORATO G, MIRIJELLO A, BARRIO P, et al. Treatment of alcohol use disorders in patients with alcoholic liver disease[J].Journal of Hepatology, 2016, 65(3): 618-630. DOI:10.1016/j.jhep.2016.04.029.
[5] GONÇALVES J L, LACERDA-QUEIROZ N, SABINO J F L, et al.Evaluating the effects of refined carbohydrate and fat diets with acute ethanol consumption using a mouse model of alcoholic liver injury[J]. The Journal of Nutritional Biochemistry, 2017, 39: 93-100.DOI:10.1016/j.jnutbio.2016.08.011.
[6] 周毅, 杨萍, 肖前程. 降解猪血蛋白的优良菌株筛选鉴定及产酶条件研究[J]. 食品与发酵工业, 2015, 41(3): 58-63. DOI:10.13995/j.cnki.11-1802/ts.201503010.
[7] 张敏, 闫晓明, 王敏, 等. 高铁含量猪血红蛋白的提取纯化及特性研究[J]. 食品工业科技, 2016, 37(8): 268-271. DOI:10.13386/j.issn1002-0306.2016.08.047.
[8] 孙骞, 胡鑫, 罗永康, 等. 猪血红蛋白抗氧化肽的酶法制备及其体外抗氧化活力观察[J]. 中国农业大学学报, 2008, 13(4): 77-81.DOI:10.3321/j.issn:1007-4333.2008.04.014.
[9] 方俊, 田云, 卢向阳, 等. 猪血多肽辅助降血脂功能研究[J]. 中国食品学报, 2010, 10(4): 147-151. DOI:10.3969/j.issn.1009-7848.2010.04.023.
[10] 郑炯, 邓惠玲, 阚建全. 响应面法优化猪血红蛋白制备ACE抑制肽的酶解工艺条件[J]. 食品科学, 2012, 33(23): 209-214.
[11] 刘睿, 任金威, 陈启贺, 等. 人参低聚肽对急性酒精性肝损伤大鼠的保护作用[J]. 现代预防医学, 2016, 43(15): 2820-2824.
[12] 何慧, 石燕玲, 徐淑芬, 等. 灵芝肽对乙醇诱导肝损伤小鼠的保护作用[J]. 食品科学, 2010, 31(3): 213-216.
[13] 王双玉, 李坤, 阚国仕, 等. 玉米抗氧化肽的制备及其对小鼠急性酒精性肝损伤的保护作用[J]. 食品研究与开发, 2007, 28(3): 29-33.DOI:10.3969/j.issn.1005-6521.2007.03.009.
[14] 徐士勋, 王咪娜, 林锦旋, 等. 鳖甲寡肽I-C-F-6抗酒精诱导小鼠急性肝损伤活性研究[J]. 环球中医药, 2013, 6(10): 721-724.DOI:10.3969/j.issn.1674-1749.2013.10.001.
[15] 孙梦雯, 胡世莲, 殷实, 等. 脑肠肽通过抗炎抗氧化作用发挥酒精性肝损伤的保护作用[J]. 中国药理学通报, 2014, 30(10): 1452-1456.DOI:10.3969/j.issn.1001-1978.2014.10.025.
[16] 刘晨晨, 赵玉勤, 杨最素, 等. 鳕鱼皮胶原蛋白肽对小鼠急性肝损伤的保护作用研究[J]. 现代食品科技, 2015, 31(7): 18-24.
[17] 蔡琦, 闫魏魏, 王少坤, 等. 蛹虫草多肽对大鼠急性酒精性肝损伤的保护作用[J]. 临床肝胆病杂志, 2016, 32(4): 669-672. DOI:10.3969/j.issn.1001-5256.2016.04.011.
[18] 李林格, 曲敏. 大鲵皮胶原蛋白肽的结构特性及其对乙醇诱导肝损伤小鼠的保护作用[J]. 食品工业科技, 2014, 35(8): 340-343.DOI:10.13386/j.issn1002-0306.2014.08.069.
[19] WANG M, ZHANG X J, LIU F, et al. Saponins isolated from the leaves of Panax notoginseng protect against alcoholic liver injury via inhibiting ethanol-induced oxidative stress and gut-derived endotoxinmediated inflammation[J]. Journal of Functional Foods, 2015, 19:214-224. DOI:10.1016/j.jff.2015.09.029.
[20] LÍVERO F A, MARTINS G G, TELLES J E Q, et al. Hydroethanolic extract of Baccharis trimera ameliorates alcoholic fatty liver disease in mice[J]. Chemico-Biological Interactions, 2016, 260: 22-32.DOI:10.1016/j.cbi.2016.10.003.
[21] CUI Y, YE Q, WANG H Y A, et al. Aloin protects against chronic alcoholic liver injury via attenuating lipid accumulation, oxidative stress and inflammation in mice[J]. Archives of Pharmacal Research,2014, 37: 1624-1633. DOI:10.1007/s12272-014-0370-0.
[22] ALBANO E. Oxidative mechanisms in the pathogenesis of alcoholic liver disease[J]. Molecular Aspects of Medicine, 2008, 29: 9-16.DOI:10.1016/j.mam.2007.09.004.
[23] WU Yuhong, PAN Xingchang C, ZHANG Shixiu, et al. Protective effect of corn peptides against alcoholic liver injury in men with chronic alcohol consumption: a randomized double-blind placebocontrolled study[J]. Lipids in Health and Disease, 2014, 13: 192-200.DOI:10.1186/1476-511X-13-192.
[24] LIN Bing, ZHANG Feng, YU Yongchao, et al. Marine collagen peptides protect against early alcoholic liver injury in rats[J]. British Journal of Nutrition, 2012, 107(6): 1160-1166. DOI:10.1017/S0007114511004211.
[25] RAMOS G, FERNÁNDEZ S, CARRILLO L, et al. Functional properties of protein fractions isolated from porcine blood[J]. Journal of Food Science, 2003, 68(4): 1196-1200. DOI:10.1111/j.1365-2621.2003.tb09624.x.
[26] WEI J T, CHIANG B H. Bioactive peptide production by hydrolysis of porcin blood proteins in a continuous enzymatic membrane reactor[J].Journal of the Science of Food and Agricultural, 2009, 89(3): 372-378.DOI:10.1002/jsfa.3451.
[27] ZHANG Feng, ZHANG Jiali, LI Yong. Corn oligopeptides protect against early alcoholic liver injury in rats[J]. Food and Chemical Toxicology, 2012, 50(6): 2149-2154. DOI:10.1016/j.fct.2012.03.083.
[28] LU Y K, WU D F. Role of oxidative stress in alcohol-induced liver injury[J]. Archives of Toxicology, 2009, 83(6): 519-548. DOI:10.1007/s00204-009-0432-0.
[29] GUO H, KOUZUMA Y, YONEKURA M. Structures and properties of antioxidative peptides derived from royal jelly protein[J]. Food Chemistry, 2009, 113(1): 238-245. DOI:10.1016/j.foodchem.2008.06.081.