扑热息痛(acetaminophen,APAP)是应用最广泛的解热镇痛药,采用治疗剂量时是安全的,但是急性或蓄积性地过量使用则会导致严重的肝损伤,并有可能进一步发展成肝衰竭[1]。药物代谢动力学研究表明,在正常情况下,APAP进入体内后大部分在肝脏中经尿苷二磷酸-葡萄糖醛酸转移酶(uridine diphosphatedependent glycosyltransferase,UGT)和磺基转移酶(sulfotransferase,SULT)的作用,分别与葡萄糖醛酸和硫酸结合后,代谢为无毒化合物——APAP-葡萄糖醛酸酯和APAP-硫酸盐,继而由胆汁和肾脏排出;另有少量在细胞色素P450酶系的参与下,代谢为毒性物质N-乙酰-对-苯醌亚胺(N-acetyl-p-benzoquinone imine,NAPQI)[2]。在治疗剂量下,NAPQI与谷胱甘肽(glutathione,GSH)结合,形成半胱氨酸衍生物和硫醇尿酸而解毒。若给予过量的APAP,生成的NAPQI超过体内GSH能处理的量时,可造成机体内NAPQI堆积,NAPQI具有亲电性和很强的氧化作用,可与肝细胞内核酸、蛋白质共价结合,使生物膜系统发生脂质过氧化[3-4],引起肝细胞坏死[5-7]。此外,APAP致肝损伤的机制还与氧化应激及炎症反应有关。因此,可抑制细胞色素P450酶活性,减少APAP通过细胞色素P450酶的代谢[8-9],增加机体GSH含量和抗氧化能力,均有缓解或预防APAP引起的肝损伤的作用[10-12]。水飞蓟素是一种有效的抗氧化剂,可通过保护肝细胞膜,促进肝细胞的自我修复及再生等作用发挥保肝功效,是目前世界上发现的最具肝脏疾病疗效的类黄酮物质。
本实验室先前的研究发现,富硒玉米肽(seleniumenriched corn peptides,SeCPs)可以提高机体GSH的供应量,且具有抗氧化活性及保护肝脏的作用[13],至于SeCPs是否具有拮抗APAP致肝损伤的作用目前鲜有报道,故本研究采用APAP致小鼠肝损伤模型,通过考察SeCPs对代谢APAP各相关酶指标的影响及观察小鼠肝脏病理学变化,以期阐明SeCPs对APAP致肝损伤模型鼠的保护作用,并分析其可能的作用机制。
1 材料与方法
1.1 实验动物、材料及试剂
昆明种雄性小鼠,体质量(20±2)g,SPF级,购于湖北省疾病预防控制中心实验动物中心。许可证号:SCXK(鄂)2011-0012。
富硒玉米通过在玉米植株叶面喷施硒肥得到,硒含量为2.192 mg/kg;SeCPs实验室自制(分子质量小于5 kDa,肽含量为95.05%,有机硒含量32.37 mg/kg);碱性蛋白酶(Alcalase 3.0 T,24万 U/g) 丹麦诺维信公司;亚硒酸钠(Na2SeO3,纯度≥98%) 德国Sigma-Aldrich公司;水飞蓟素胶囊 德国马博士大药厂;对乙酰氨基酚片 北京曙光药业有限责任公司;谷草转氨酶(aspartate aminotransferase,AST)、还原型谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒南京建成生物工程研究所;细胞色素P4502E1(cytochrome P4502E1,CYP2E1)、细胞色素P4501A2(cytochrome P4501A2,CYP1A2)、谷胱甘肽巯基转移酶(glutathione S-transferase,GST)、UGT、SULT试剂盒 上海源叶生物技术有限公司。
1.2 仪器与设备
ML20型电子天平、FE20实验室pH计 梅特勒-托利多(上海)仪器有限公司;TDZ5-W台式低速离心机湖南湘仪实验室仪器开发有限公司;Microfuge 20R高速冷冻离心机 贝克曼库尔特商贸(中国)有限公司;LGJ-12冷冻干燥机 北京松源华兴科技发展有限公司;Laborota 4000 eきcient旋转蒸发器 德国Heidolph公司;DF-101S集热式恒温加热磁力搅拌器 武汉亨泰达仪器设备有限公司;全波长酶标仪 美国Thermo Fisher Scientific公司;MWCO 5 kDa再生纤维素卷式膜包(有效膜面积0.09 m2) 美国Millipore公司;HH-4数显恒温水浴锅 国华电器有限公司;AFS-822型原子荧光光度计北京吉天仪器有限公司;DM3000荧光显微镜 徕卡仪器(德国)有限公司。
1.3 方法
1.3.1 玉米肽的制备
玉米籽粒磨碎得玉米粉,以1∶13(m/V)的比例加入碱醇液(0.1 mol/L NaOH与体积分数95%乙醇的比例1∶1,V/V),于45 ℃下水浴搅拌提取2 h,离心得上清液,调pH值至6.3左右,静置并离心,所得沉淀冻干即为玉米蛋白粉。取适量玉米蛋白粉,按1∶35(m/V)的比例加入蒸馏水,在60 ℃,pH 8.0的条件下用碱性蛋白酶(酶与底物比值为0.6%,m/m)在恒温加热磁力搅拌器中酶解4 h。将所得酶解液进行超滤,取分子质量小于5 kDa的产物,浓缩,冷冻干燥,得SeCPs,硒含量为32.37 mg/kg,保存于干燥器中备用。
1.3.2 动物分组及模型的建立
将70 只体质量为(20±2)g的昆明种雄性小鼠随机分成7 组,每组10 只,分别为正常对照组、APAP模型组、水飞蓟素阳性对照组(50 mg/kg mb)、玉米肽组(corn peptides,CPs。400 mg/kg mb)、亚硒酸钠组(Na2SeO3,28.36 µg/kg mb)、亚硒酸钠+玉米肽组(Na2SeO3+CPs,28.36 µg/kg mb+400 mg/kg mb)、SeCPs组(SeCPs,400 mg/kg mb),其中玉米肽组、亚硒酸钠+玉米肽组及富硒玉米肽组的肽含量相同,亚硒酸钠组、亚硒酸钠+玉米肽组及SeCPs组的硒含量相同。各组均以小鼠标准饲料喂养,自由饮水。室温25 ℃下适应7 d后,开始灌胃,每天灌胃1 次,正常对照组和模型组每日灌胃等剂量生理盐水,小鼠每两天称1 次体质量,连续灌胃14 d。于第15天,小鼠禁食12 h,按上述剂量灌胃1次,2 h后,除正常组外其余组均腹腔注射280 mg/kg mb APAP的水溶液(于40 ℃水浴加热),正常组小鼠腹腔注射等剂量的生理盐水。小鼠再禁食12 h后,眼眶取血,脱臼处死后取肝脏做相关检测。
1.3.3 小鼠肝脏指数的计算
小鼠肝脏指数的计算按照下式进行。
1.3.4 小鼠各项生化指标的测定
小鼠血液离心后取上清液,按试剂盒说明书操作步骤进行AST活力的测定。小鼠肝脏用生理盐水制备成质量分数10%的肝匀浆,离心取上清液,按试剂盒说明书操作步骤进行CYP2E1、CYP1A2、GST、UGT质量浓度,SULT、GSH-Px活力及GSH含量的测定。
1.3.5 组织病理学HE染色观察
切取小鼠肝脏1 cm3左右,立即用体积分数4%的多聚甲醛溶液固定,进行常规石蜡包埋切片,厚度5 μm,苏木精-伊红(hematoxylin-eosin,HE)染色,于荧光显微镜下观察肝组织的变化,并进行图像采集。
1.4 数据处理
实验数据使用SPSS 17.0统计软件,采用Duncan法进行显著性分析处理,实验结果以 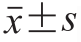 表示,P<0.05表示差异显著。
表示,P<0.05表示差异显著。
2 结果与分析
2.1 SeCPs对小鼠肝脏指数的影响
肝损伤小鼠因其肝脏肿大,导致肝脏指数增大,故模型组小鼠的肝脏指数显著高于正常对照组(表1),CPs组、SeCPs组及CPs+Na2SeO3组均可以显著降低小鼠肝脏指数;水飞蓟素阳性对照组及Na2SeO3组小鼠的肝脏指数虽有所降低,但与模型组相比尚未达统计学差异(P>0.05)。
表1 SeCPs对小鼠肝脏指数的影响(n=10)
Table 1 Effects of SeCPs on liver index of mice (n= 10)

注:同列肩标大写字母不同表示差异显著(P<0.05)。
2.2 SeCPs对小鼠血清中AST活力及肝匀浆中CYP2E1、CYP1A2质量浓度的影响
AST是指示肝损伤的灵敏指标,在肝细胞受损时,会从细胞内溢出进入血液,使血液中AST活力大幅度上升,CYP2E1及CYP1A2参与APAP的代谢并生成肝毒性物质,当大量APAP摄入时,机体的自我保护作用会使得肝脏中CYP2E1和CYP1A2的质量浓度下降。

图1 SeCPs对小鼠血清中AST活力的影响(n=10)
Fig. 1 Effects of SeCPs on serum AST activity in mice (n = 10)

图2 SeCPs对小鼠肝匀浆中CYP2E1、CYP1A2质量浓度的影响(n=10)
Fig. 2 Effects of SeCPs on CYP2E1 and CYP1A2 levels in liver homogenate of mice (n = 10)
如图1、2所示,与正常对照组相比,模型组小鼠血清中AST活力显著上升(P<0.05),肝匀浆中CYP2E1质量浓度显著下降(P<0.05),CYP1A2质量浓度有所降低,但尚未达到显著性水平(P>0.05);相比于模型组,阳性对照物水飞蓟素可显著性降低血清中AST活力及肝匀浆中CYP2E1和CYP1A2的质量浓度;CPs组小鼠血清AST活力及肝匀浆中CYP1A2质量浓度明显降低,效果与水飞蓟素相当,但CPs对CYP2E1的质量浓度没有显著影响;Na2SeO3显著降低了血清中AST活力,使肝匀浆中CYP1A2质量浓度虽然有所降低,但未达显著水平,而对CYP2E1的质量浓度无显著影响;CPs+Na2SeO3组可明显降低小鼠血清AST及肝匀浆中CYP2E1和CYP1A2的质量浓度,且效果优于CPs组及Na2SeO3组,差异显著(P<0.05);SeCPs可大幅度降低AST活力以及CYP2E1、CYP1A2质量浓度,且对血清AST活力和肝匀浆中CYP1A2质量浓度的降低作用显著优于CPs+Na2SeO3,与其他给药组相比,SeCPs表现出了最佳的抑制肝毒性物质产生的作用。
2.3 SeCPs对小鼠肝匀浆中GST质量浓度、GSH-Px活力及GSH含量的影响
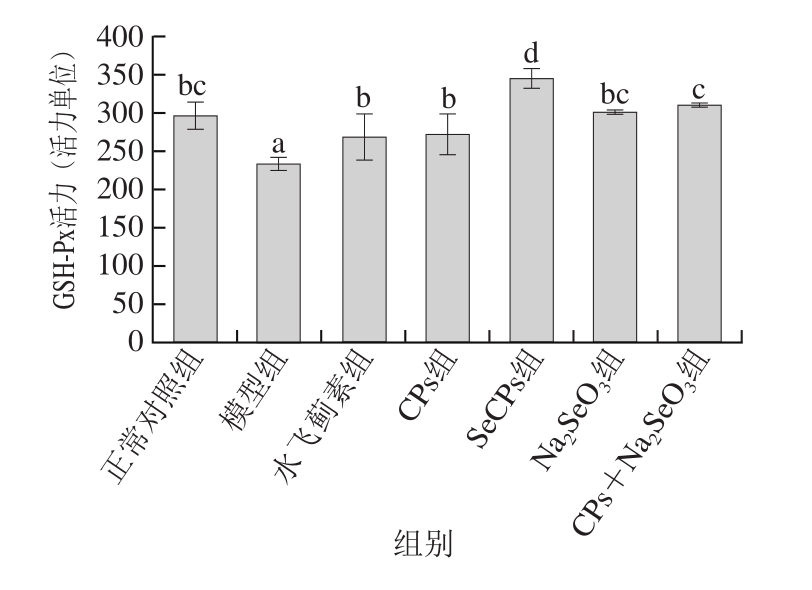
图3 SeCPs对小鼠肝匀浆中GSH-Px活力的影响(n=10)
Fig. 3 Effects of SeCPs on GSH-Px activity in liver homogenate of mice (n = 10)

图4 SeCPs对小鼠肝匀浆中GST质量浓度及GSH含量的影响(n=10)
Fig. 4 Effects of SeCPs on GST and GSH levels in liver homogenate of mice (n = 10)
有毒代谢产物NAPQI与GSH的结合解毒过程需要GST的催化,而GSH-Px是有效的抗氧化酶,硒是其活性中心。如图3、4所示,模型组小鼠肝脏中GSH-Px活力及GSH含量较正常对照组显著性降低,GST质量浓度有所降低,但未达到显著水平;与模型组相比,CPs显著提高了GSH含量及GSH-Px活力,部分提高GST质量浓度;Na2SeO3仅显著性提高了GSH-Px活力,效果优于CPs,但没有达到显著性水平,这源于硒是GSH-Px的重要组成部分;CPs+Na2SeO3对这3 种物质均起到了正向调节作用,且对GSH含量的增加显著性高于Na2SeO3组,对GSH-Px活力的提升作用显著性优于CPs;SeCPs相比于CPs+Na2SeO3对这3 种物质的正向调节作用进一步大幅增加(P<0.05)。由此可见,单纯补充无机硒或CPs,无法有效提高或只能部分提高机体排出有毒物质NAPQI能力,同时补充CPs和无机硒,可进一步提升机体的解毒能力,而补充SeCPs,其对机体解毒能力的提升作用在CPs+Na2SeO3的基础上又有大幅提升(P<0.05),提示SeCPs中CPs与有机硒具有协同保肝作用。
2.4 SeCPs对小鼠肝匀浆中UGT质量浓度及SULT活力的影响
APAP进入体内后大部分经UGT及SULT催化,与葡萄糖醛酸及硫酸结合,最终以无毒的酯或盐的形式排出体外,这两种酶质量浓度或活力的变化将会影响APAP在体内不同代谢途径处理量。

图5 SeCPs对小鼠肝匀浆中UGT质量浓度及SULT活力的影响(n= 10)
Fig. 5 Effects of SeCPs on UGT content and SULT activity in liver homogenate of mice (n = 10)
由图5可以看出,模型组小鼠肝脏中UGT质量浓度及SULT活力较正常对照组均显著下降;而相比于模型组,CPs可显著性降低小鼠肝脏中UGT质量浓度,Na2SeO3对UGT的质量浓度及SULT的活力均无显著影响,CPs+Na2SeO3可显著性降低UGT质量浓度及SULT活力,但SeCPs对这两种酶的抑制作用较CPs+Na2SeO3又明显增大,提示SeCPs等可通过降低UGT质量浓度及SULT活力,从而降低APAP在体内的代谢。
2.5 SeCPs对小鼠肝组织的病理学影响
由图6可知,正常对照组小鼠肝脏结构完整,小叶轮廓清晰,肝细胞索呈明显的放射状排列,无肝细胞坏死现象,细胞形状规则,核结构清晰可见;模型组小鼠肝脏结构破坏严重,有明显的灶状坏死现象,肝细胞索排列呈紊乱状,且细胞坏死严重;相比于模型组,水飞蓟素组小鼠肝组织病理变化得到显著改善,表现为肝细胞坏死现象明显减少,大部分肝细胞索仍存在,但仍有部分点状坏死;Na2SeO3组小鼠肝脏病变仍比较严重,但灶状坏死面积有所减小;CPs组小鼠肝脏灶状坏死面积进一步减小,肝细胞坏死现象也得到缓解;CPs+Na2SeO3组小鼠肝脏病变明显改善,肝细胞再生明显,细胞索紊乱现象减轻,灶状坏死范围明显减小;SeCPs组小鼠肝脏的病理变化仅表现为有轻微的点状坏死及部分肝细胞坏死,相比于模型组及其他给药组,其肝脏情况良好。

图6 小鼠肝组织HE染色(×200)
Fig. 6 HE staining of liver slices of mice (× 200)
3 讨 论
近年来,随着药物品种的不断增加,药物性肝损害的发生率亦相应增加。常见的能引起肝损伤的药物主要有APAP[14-17]、咪唑硫嘌呤、阿霉素、环保霉素及抗结核药物等[18],而在美国和英国,APAP过量是肝损伤最常见的原因[19]。APAP致肝损伤模型被广泛用于药物性肝损伤的机制研究及药物保肝作用的评价[20]。很多研究已经表明,一些天然活性产物具有防治药物性肝损伤的功能作用。本实验采用APAP致小鼠肝损伤的模型研究SeCPs对其的防护作用。研究结果显示,小鼠腹腔注射280 mg/kg mb的APAP后,引起严重的肝损伤,而SeCPs可以通过多种方式拮抗APAP的肝毒性。首先,SeCPs可显著性降低小鼠肝脏中CYP1A2及CYP2E1的质量浓度,而CYP1A2和CYP2E1是代谢APAP产生毒性产物的主要酶系[21]。在啮齿动物实验中发现,CYP2E1和CYP1A2基因敲除小鼠对于APAP肝毒性的耐受明显高于野生小鼠[22],提示降低CYP2E1和CYP1A2的表达水平,可减少有毒代谢产物NAPQI的产生,对于抗APAP的肝毒是有利的。其次,在本研究中,各给药组相对于模型组其SULT活力显著降低,SeCPs组更为显著,各组UGT质量浓度测定结果也与此相似,即APAP经UGT、SULT催化代谢这一途径被抑制。Yao等[23]研究发现,在大鼠的饲料中掺入表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),可以降低其肝脏中APAP-葡萄糖醛酸酯的含量,降低幅度达到42%,即EGCG抑制了APAP致肝损伤大鼠肝微粒体内UGT的活性。另外,大鼠进食茶多酚后,其盲肠中由微生物产生的能分解APAP-葡萄糖醛酸酯的β-葡萄糖醛酸酶的活性降低[24]。由此推断,SeCPs可能也发挥了类似作用,即通过降低肠中分解APAP-葡萄糖醛酸酯相关酶的活性,减少APAP在肝肠循环通路中的重吸收,降低了肝脏中APAP的浓度,从而减小其肝脏毒性。早在20世纪90年代已有研究表明,阿魏酸通过增加APAP致肝损伤小鼠体内GST活性及GSH含量,起到保肝作用[25],表明此为有效防护APAP致肝损伤的途径。乙酰紫堇灵能显著减少小鼠由APAP引起的肝脏GSH耗竭,降低血中APAP的浓度,其对肝脏CYP450总量及GST活力有明显诱导作用,而对代谢APAP的CYP450同工酶——CYP2E1活力却有抑制作用,说明乙酰紫堇灵对小鼠APAP肝损伤的防护作用与其选择性地调节CYP450同工酶,诱导GST,加快机体对APAP的解毒代谢作用密切相关[26]。此外,在APAP引起肝损伤的过程中,活性氧产生于线粒体,它会损伤线粒体功能,影响细胞信号传导,并促使细胞死亡,有研究表明,线粒体的靶向抗氧化剂是治疗过量APAP引起肝损伤的有效药物,将现有的药物针对性地用于抵抗氧化应激及缓解由活性氧引起的其他并发症状,使其有可能用于过量服用APAP病人的治疗中[27]。而有毒代谢物NAPQI的形成会使机体内的GSH处于很低的水平,这样会大幅度抑制GSH-Px的抗氧化解毒作用[28],因此,增加机体GST活力及GSH的含量格外重要。本研究中,SeCPs不仅能够大幅度逆转由过量APAP引起的GST质量浓度及GSH含量下降的现象,还可以显著性提高GSH-Px的活力,且相比于模型组,其提高幅度高达48.4%,虽然Na2SeO3也可显著提高小鼠肝脏中GSH-Px的活力,但效果不及SeCPs,其中有机硒的贡献功不可没,说明有机硒更利于机体吸收,有更好的生理活性。此外,小鼠肝脏HE染色观察结果也显示,SeCPs可以有效地逆转由APAP引起的肝脏病理变化,佐证了其优异的保肝作用。
综上所述,其一,SeCPs可以降低肝脏中UGT质量浓度及SULT的活力,抑制APAP的代谢;其二,SeCPs能有效地降低小鼠肝脏中CYP2E1及CYP1A2的质量浓度,减少有毒物质的产生;其三,SeCPs可提高GST质量浓度及GSH的含量,提高机体排出有毒代谢物的能力,且其对GSH-Px活力的提升作用又加强了机体的抗氧化应激能力。故SeCPs是通过上述3 个方面的共同作用,有效地保护肝脏,减弱APAP的肝毒对机体的侵害。
参考文献:
[1] RUMACK B H. Acetaminophen misconceptions[J]. Hepatology,2004, 40(1): 10-15. DOI:10.1002/hep.20300.
[2] 任林, 邝江莹, 蒲诗云, 等. 核受体在对乙酰氨基酚引起的肝毒性中的作用[J]. 生理科学进展, 2016, 47(1): 53-56.
[3] 唐云安, 刘玉清, 王国钦. 肝损伤动物模型研究进展[J].卫生毒理学杂志, 2002, 16(4): 236-238. DOI:10.16421/j.cnki.1002-3127.2002.04.016.
[4] MACRIDES T A, NAYLOR L M, KALAFATIS N, et al.Hepatoprotective effects of the shark bile salt 5β-scymnol on acetaminophen-induced liver damage in mice[J]. Fundamental and Applied Toxicology, 1996, 33(1): 31-37. DOI:10.1006/faat.1996.0140.
[5] RUMACK B H. Acetaminophen hepatotoxicity: the first 35 years[J].Journal of Toxicology: Clinical Toxicology, 2002, 40(1): 3-20.DOI:10.1081/CLT-120002882.
[6] JOLLOW D J, MITCHELL J R, POTTER W Z, et al. Acetaminopheninduced hepatic necrosis. II. role of covalent binding in vivo[J]. The Journal of Pharmacology and Experimental Therapeutics, 1973,187(1): 195-202.
[7] MOHAR I, STAMPER B D, RADEMACHER P M, et al.Acetaminophen-induced liver damage in mice is associated with gender-specific adduction of peroxiredoxin-6[J]. Redox Biology, 2014,2: 377-387. DOI:10.1016/j.redox.2014.01.008.
[8] YAO H T, LUO M N, LI C C. Chitosan oligosaccharides reduce acetaminophen-induced hepatotoxicity by suppressing CYP-mediated bioactivation[J]. Journal of Functional Foods, 2015, 12: 262-270.DOI:10.1016/j.jあ.2014.11.014.
[9] GENG T, SI H H, KANG D, et al. Influences of Re Du Ning Injection,a traditional Chinese medicine injection, on the CYP450 activities in rats using a cocktail method[J]. Journal of Ethnopharmacology, 2015,174: 426-436. DOI:10.1016/j.jep.2015.08.035.
[10] MURRAY T V A, DONG X B, SAWYER G J, et al. NADPH oxidase 4 regulates homocysteine metabolism and protects against acetaminophen-induced liver damage in mice[J]. Free Radical Biology and Medicine, 2015, 89: 918-930. DOI:10.1016/j.freeradbiomed.2015.09.015.
[11] 贺敏, 黄仁彬, 蒋伟哲, 等. 利福平抑制对乙酰氨基酚代谢物耗竭谷胱甘肽的作用[J]. 中国医院药学杂志, 2008, 28(6): 449-452.
[12] FAN Y J, RONG Y, LI P F, et al. Genistein protection against acetaminophen-induced liver injury via its potential impact on the activation of UDP-glucuronosyltransferase and antioxidant enzymes[J].Food and Chemical Toxicology, 2013, 55: 172-181. DOI:10.1016/j.fct.2013.01.003.
[13] 张岩, 何慧, 张久亮, 等. 富硒玉米肽对四氯化碳致小鼠急性肝损伤的保护作用[J]. 中国粮油学报, 2015, 30(3): 6-11.
[14] LIU Z X, HAN D, GUNAWAN B, et al. Neutrophil depletion protects against murine acetaminophen hepatotoxicity[J]. Hepatology, 2006,43(6): 1220-1230. DOI:10.1002/hep.21175.
[15] LAWSON J A, FARHOOD A, HOPPER R D, et al. The hepatic inflammatory response after acetaminophen overdose: role of neutrophils[J]. Toxicological Sciences, 2000, 54(2): 509-516.DOI:10.1093/toxsci/54.2.509.
[16] ISHIDA Y, KONDO T, KIMURA A, et al. Opposite roles of neutrophils and macrophages in the pathogenesis of acetaminopheninduced acute liver injury[J]. European Journal of Immunology, 2006,36(4): 1028-1038. DOI:10.1002/eji.200535261.
[17] HOLT M P, CHENG L L, JU C. Identification and characterization of infiltrating macrophages in acetaminophen-induced liver injury[J].Journal of Leukocyte Biology, 2008, 84(6): 1410-1421. DOI:10.1189/jlb.0308173.
[18] INGAWALE D K, MANDLIKB S K, NAIK E R. Models of hepatotoxicity and the underlying cellular, biochemical and immunelogical mechanism(s): a critical discussion[J]. Environmental Toxicology and Pharmacology, 2014, 37(1): 118-133. DOI:10.1016/j.etap.2013.08.015.
[19] OSTAPOWICZ G, FONTANA R G, SCHIODT F V, et al. Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States[J]. Annals of Internal Medicine, 2002, 137(12): 947-954.
[20] 潘家琪, 宋丹军, 李鹏旭, 等. 对乙酰氨基酚肝毒性机制与防治研究新进展[J]. 中国药理学与毒理学杂志, 2014, 28(4): 618-624.DOI:10.3867/j.issn.1000-3002.2014.04.023.
[21] SAINI S P S, ZHANG B, NIU Y D, et al. Activation of liver X receptor increases acetaminophen clearance and prevents its toxicity in mice[J].Hepatology, 2011, 54(6): 2208-2217. DOI:10.1002/hep.24646.
[22] ZAHER H, BUTERS J T, WARD J M, et al. Protection against acetaminophen toxicity in CYP1A2 and CYP2E1 double-null mice[J].Toxicology and Applied Pharmacolog, 1998, 152(1): 193-199.DOI:10.1006/taap.1998.8501.
[23] YAO H T, YANG Y C, CHANG C H, et al. Protective effects of(-)-epigallocatechin-3-gallate against acetaminophen-induced liver injury in rats[J]. BioMedicine, 2015, 5(3): 16-21. DOI:10.7603/s40681-015-0015-8.
[24] FREJNAGEL S, JUSKIEWICZ J. Dose-dependent effects of polyphenolic extracts from green tea, blue-berried honeysuckle, and chokeberry on rat caecal fermentation processes[J]. Planta Medica,2011, 77(9): 888-893. DOI:10.1055/s-0030-1250664.
[25] 汪晖, 彭仁琇, 黎七雄, 等. 阿魏酸钠对小鼠谷胱甘肽及相关酶活性的影响[J]. 湖北医科大学学报, 1996, 17(1): 23-26. DOI:10.14188/j.1671-8852.1996.01.006.
[26] 陆宏, 李燕, 刘耕陶. 乙酰紫堇灵对小鼠对乙酰氨基酚肝中毒的保护作用[J]. 中国药理学与毒理学杂志, 1994, 8(3): 171-174.
[27] DU K, RAMACHANDRAN A, JAESCHKE H. Oxidative stress during acetaminophen hepatotoxicity: sources, pathophysiological role and therapeutic potential[J]. Redox Biology, 2016, 10: 148-156.DOI:10.1016/j.redox.2016.10.001.
[28] SCHNELLMANN J G, PUMFORD N R, KUSEWITT D F, et al.Deferoxamine delays the development of the hepatotoxicity of acetaminophen in mice[J]. Toxicology Letters, 1999, 106(1): 79-88.DOI:10.1016/S0378-4274(99)00021-1.