双孢蘑菇(Agaricus bisporus)又名双孢菇,是世界上产量、销量最高且食用最广泛的食用菌之一[1];因其具有丰富的营养价值而被赋予“植物肉”之美称[2]。新鲜的双孢蘑菇质地脆嫩且具有一定弹性,由于其代谢旺盛、表面无保护结构,因而极易失水、变软而失去商品价值。质地是衡量双孢蘑菇商品价值的一个关键性指标,而众多研究表明双孢蘑菇及其他食用菌在贮藏过程中硬度呈直线下降趋势,质地劣变严重[2-4]。有研究表明食用菌硬度下降与细胞壁的加速代谢有关[4]。细胞壁是细胞的支撑物,可使细胞保持一定形状,为细胞抵御外界渗透压、机械力提供了保护,是保证细胞内各种代谢活动正常进行的重要结构,同时也与果实的软化和衰老密切相关[4]。Paudel等[5]认为真菌细胞壁中几丁质和蛋白质的降解破坏了聚合物网状结构,从而导致细胞持水力下降,加速了蘑菇组织软化及衰老。另外,细胞壁在水解酶类的作用下逐渐被降解,使大分子物质降解为各种小分子物质并溢出细胞,这些物质又会诱导水解酶类的合成,进一步破坏细胞壁结构,促使细胞产生自溶,加速组织软化与衰老[6-8]。众多研究均证明果蔬的软化与细胞壁降解呈正相关。
动态气调是指在贮藏过程中通过分阶段改变环境中的气体成分与比例,最大限度降低果蔬呼吸作用、减少营养物质的消耗,从而延长其保鲜期的一种技术[9]。根据课题组前期的研究结果,高氧动态气调可保持双孢蘑菇良好的品质,其保鲜期延长至28 d[10];然而关于质地与细胞壁代谢以及木质化方面鲜有报道。鉴于此,本实验对双孢蘑菇进行高氧动态气调(high-oxygen dynamic controlled atmosphere,HO-DCA)贮藏,探讨双孢蘑菇细胞壁代谢对质地劣变的影响以及木质化进程,为深入研究双孢蘑菇贮藏过程中衰老机制提供参考。
1 材料与方法
1.1 材料与试剂
双孢蘑菇采自山东省淄博市高青县常家镇,采后1 h内运回实验室并于(5±1)℃下预冷7 h,挑选大小一致、颜色洁白、未开伞、无损伤的蘑菇为实验材料。
D-氨基葡萄糖盐酸盐、N-乙酰氨基葡萄糖 上海源叶生物公司;对二甲氨基苯甲醛 上海麦克林生物公司。以上试剂均为分析纯。
1.2 仪器与设备
Dansensor O2/CO2测定仪 丹麦PBI公司;GY-1果实硬度计 牡丹江市机械研究所;UV-1700紫外-可见分光光度计 日本岛津有限公司。
1.3 方法
1.3.1 实验设计
将每组50 个双孢蘑菇放入干燥器中,通过配气仪分别通入一定比例的O2/CO2气体(以体积分数计)。气体流速为100 mL/min,用O2/CO2测定仪检测气体浓度,置于(2±1)℃下贮藏。HO-DCA:第一阶段气体组分100% O2,换气时间为第3天,第二阶段气体组分80%O2+20% CO2。静态气调(static controlled atmospheres,SCA):贮藏过程中始终通入100% O2。对照组:干燥器敞口置于(2±1)℃下贮藏。(每个处理均做3 个平行)。图1为动态气调操作示意图。

图1 动态气调操作示意图
Fig. 1 Schematic diagram of the dynamic controlled atmosphere
1.3.2 指标测定
1.3.2.1 硬度的测定
硬度的测定参考刘战丽等[7]的方法,采用GY-1型果实硬度计进行测定。
1.3.2.2 几丁质含量的测定
细胞壁物质的提取:参照Zivanovic等[11]的方法并作适当修改。取混匀后的双孢蘑菇菇肉或菇柄50 g于75 mL、体积分数95%乙醇中浸提10 min,之后煮沸5 min,置于室温下沉淀过夜,过滤后残渣用体积分数78%的乙醇洗涤,于60 ℃真空干燥过夜,干样经粉碎后过筛,即得细胞壁粗提物。
几丁质含量的测定参照张璇[12]的方法。1.3.2.3 纤维素含量的测定
纤维素含量的测定采用蒽酮比色法[13]。子实体烘干至恒质量后,取干样0.5 g,加入冷的体积分数60% H2SO4溶液60 mL,消化处理0.5 h,摇匀后玻璃棉过滤。取滤液2.0 mL,加入0.5 mL 2 g/L蒽酮试剂,再沿管壁加5.0 mL浓H2SO4溶液,盖上塞子,于室温下放置20 min,测定样品在620 nm波长处的吸光度。纤维素含量计算如式(1)所示。
式中:m0为标准曲线上查得的纤维素质量/μg;m为样品质量/g;N为样品稀释倍数。
1.3.2.4 木质素含量的测定
木质素含量参照姜天甲[14]的方法进行测定。
1.3.2.5 几丁质酶活力的测定
几丁质酶活力参照Kawase等[15]的方法进行测定。
1.3.2.6 纤维素酶活力的测定
采用羧甲基纤维素法测定,参照陈素芹[16]的方法。称取1 g子实体,加入4 mL 0.2 mol/L醋酸盐缓冲液(pH 5.0)研磨成匀浆,4℃ 下10 000×g离心20 min,上清液即为粗酶液。取0.5 mL上清液,与2 mL 50 ℃的10 g/L羧甲基纤维素钠混匀后50 ℃下保温30 min,冷却至室温,加入2.5 mL 3,5-二硝基水杨酸试剂显色10 min,于540 nm波长处测光密度值。以1 min催化生成1 μg C6H12O6为一个酶活力单位(U)。纤维素酶活力按式(2)计算,计算结果以鲜质量计。
式中:m0为查得的葡萄糖质量/mg;V为样液总体积/mL;m为样品鲜质量/g;V0为测定时样品的取样体积/mL;0.5为反应时间/h。
1.3.2.7 木质素合成相关酶活力的测定
苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)活力参照Ren Shuncheng等[17]的方法进行测定。4-香豆酸-辅酶A连接酶(4-coumarate: coenzyme A ligase,4CL)活力参照毕咏梅等[18]的方法进行测定。肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)活力的测定参照张美姿等[19]的方法。
1.4 数据统计分析
实验数据采用SPSS 19.0软件进行方差分析(ANOVA),采用Duncan多重比较法进行差异显著性分析,当P<0.05时认为差异达到显著性水平。
2 结果与分析
2.1 气调方式对双孢蘑菇硬度的影响
如图2A所示,双孢蘑菇菌盖的硬度在贮藏前期缓慢升高,后期迅速下降,HO-DCA、SCA处理组和对照组分别在第12、8、4天达到到最大值后下降。在第8天后,各组的硬度为HO-DCA处理组>SCA处理组>对照组。与菌盖不同的是,菌柄的硬度并未出现升高现象。贮藏结束后,对照组的菌柄硬度由最初的8.64×105 Pa降到2.21×105 Pa,而HO-DCA处理组在贮藏结束时的硬度为6.56×105 Pa(图2B)。因此,HO-DCA处理显著抑制了双孢蘑菇菌盖与菌柄硬度的下降(P<0.05),保持了其良好的质地。

图2 HO-DCA对双孢蘑菇硬度的影响
Fig. 2 Effect of HO-DCA on firmness of Agaricus bisporus
2.2 气调方式对双孢蘑菇几丁质代谢的影响
2.2.1 气调方式对双孢蘑菇几丁质含量的影响

图3 HO-DCA对双孢蘑菇几丁质含量的影响
Fig. 3 Effect of HO-DCA on chitin content of Agaricus bisporus
双孢蘑菇几丁质含量的变化趋势因部位不同而产生差异。菌盖中几丁质含量均在前期出现升高现象(图3A),这可能是由几丁质酶活力在前期下降引起的。本结果的前期变化与李志啸等[20]的研究结果一致,他认为几丁质含量的升高是双孢蘑菇在采后逆境下的应激反应。对于菌盖,在第12天后,SCA处理组的几丁质含量急剧下降,而HO-DCA处理组下降较为平缓,并显著高于SCA处理组与对照组(P<0.05)。在贮藏的第20天,HO-DCA处理组的几丁质含量仍高达对照组的2.5 倍。菌柄中的几丁质含量始终呈下降趋势,其中HO-DCA处理组与SCA处理组几丁质含量总体高于对照组,且HO-DCA处理组最高。几丁质含量一定程度上反映了细胞壁的完整度,Zivanovic等[11]曾报道几丁质含量的增加与双孢蘑菇的韧性呈正相关(r=0.95)。在菌盖与菌柄中,HO-DCA处理组的双孢蘑菇都保持了最高的几丁质含量,SCA处理组次之,对照组最低(图3A、B);说明HO-DCA处理能够减缓几丁质的降解,维持细胞壁一定的完整性。
2.2.2 气调方式对双孢蘑菇几丁质酶活力的影响
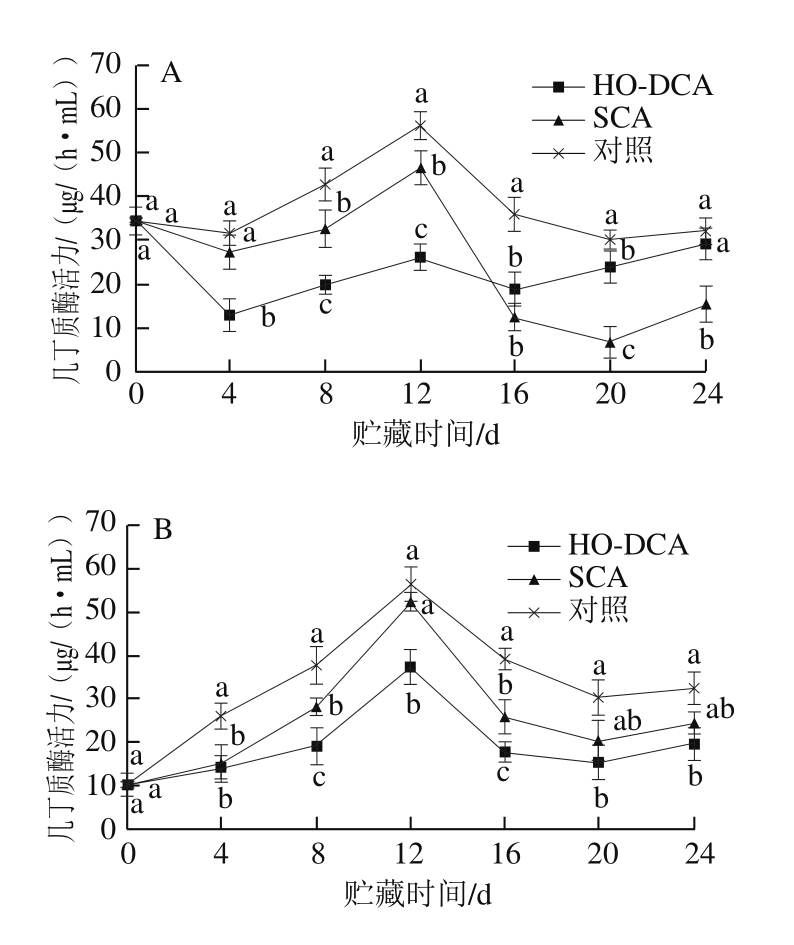
图4 HO-DCA对双孢蘑菇几丁质酶活力的影响
Fig. 4 Effect of HO-DCA on chitinase activity of Agaricus bisporus
由图4可知,菌盖中几丁质酶活力与菌柄中变化趋势大致相似。由图4A可知,菌盖中,SCA处理组与对照组几丁质酶活力均在前4 d出现略微下降,之后上升,又分别在第12天达到峰值后急剧下降。HO-DCA处理组几丁质酶活力相对最低,且变化趋势平稳。在0~12 d,菌柄中所有处理组的几丁质酶活力均急剧上升,在第12天达到峰值后又急剧下降(图4B)。
2.3 气调方式对双孢蘑菇纤维素代谢的影响
2.3.1 气调方式对双孢蘑菇纤维素含量的影响
图5A表明,菌盖中HO-DCA处理组纤维素含量最高,所有处理组的纤维素含量在贮藏初期短暂下降,随后上升。HO-DCA、SCA处理组与对照组分别在第20、16、8天达到峰值,之后又开始缓慢下降。第8天以后,HO-DCA处理组与SCA处理组的纤维素含量显著高于对照组(P<0.05);说明SCA、HO-DCA处理能有效抑制纤维素含量的下降。菌柄中双孢蘑菇纤维素含量变化类似双峰趋势,与菌盖变化规律相差较大(图5B)。贮藏12 d之后,3 个处理组之间差异显著(P<0.05),说明纤维素在贮藏后期才发生较大变化。

图5 HO-DCA对双孢蘑菇纤维素含量的影响
Fig. 5 Effect of HO-DCA on cellulose content of Agaricus bisporus
2.3.2 气调方式对双孢蘑菇纤维素酶活力的影响
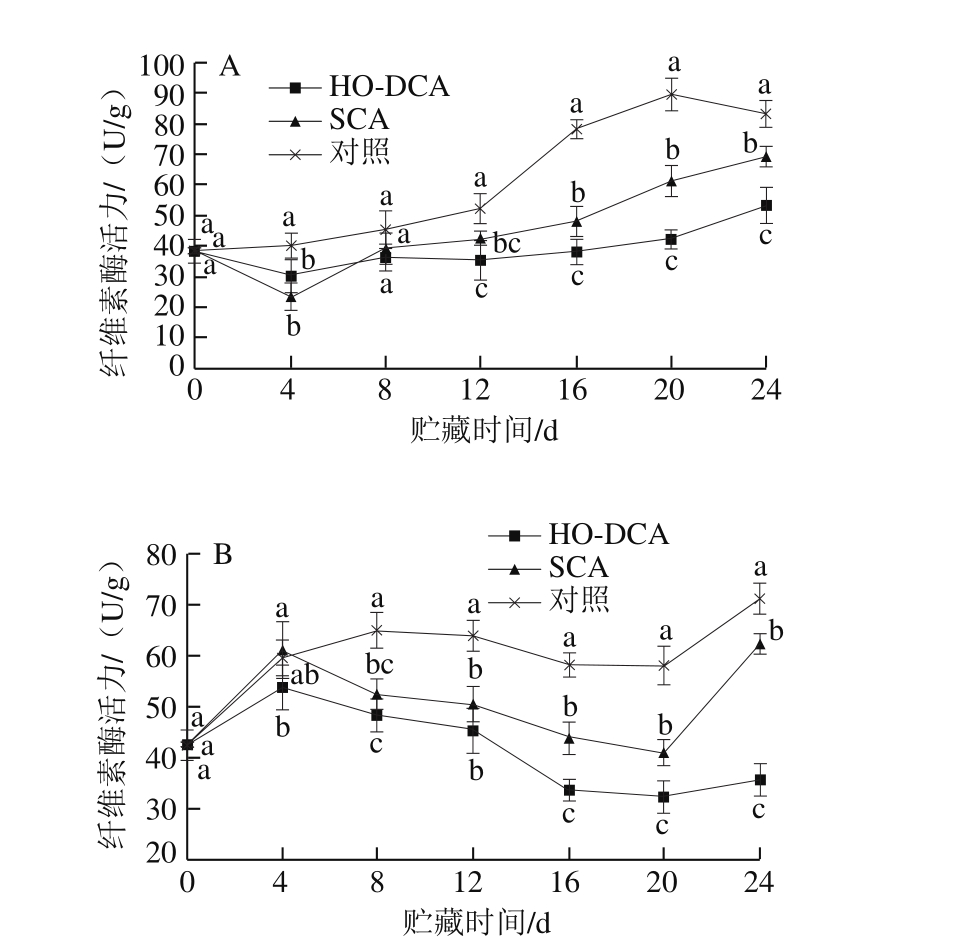
图6 HO-DCA对双孢蘑菇纤维素酶活力的影响
Fig. 6 Effect of HO-DCA on cellulase activity of Agaricus bisporus
由图6A可知,菌盖中纤维素酶活力总体呈升高趋势。而HO-DCA与SCA处理组的纤维素酶活力在前4 d出现下降现象,说明前期的高氧气调处理对纤维素酶的活力起到了显著抑制作用。整个贮藏期间,HO-DCA处理组菌盖中纤维素酶活力显著低于对照组(P<0.05)。菌盖中纤维素酶活力总体呈上升趋势,对照组的纤维素酶活力在第12天迅速上升;而菌柄则呈先上升后下降再上升的趋势,且波动更大,但在第4天后,HO-DCA与SCA处理组的纤维素酶活力都显著低于对照组(P<0.05)(图6B)。
2.4 气调方式对双孢蘑菇木质素代谢的影响
2.4.1 气调方式对双孢蘑菇木质素含量的影响
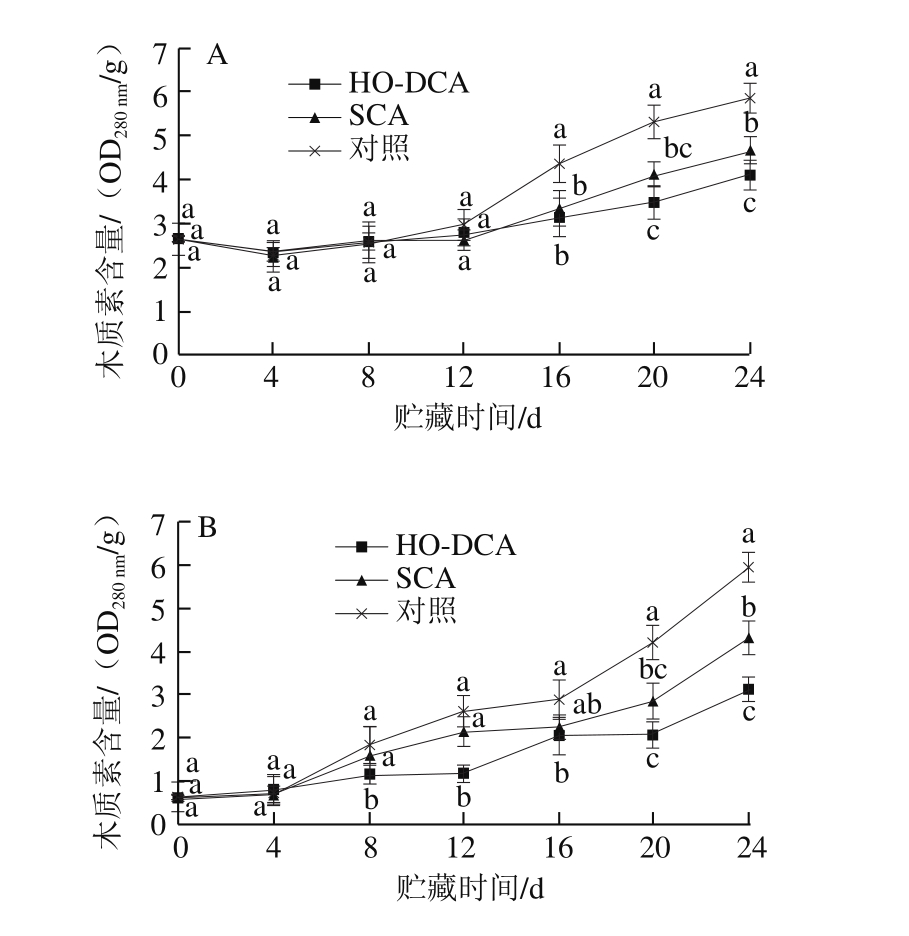
图7 HO-DCA对双孢蘑菇木质素含量的影响
Fig. 7 Effect of HO-DCA on lignin content of Agaricus bisporus
贮藏过程中,双孢蘑菇菌盖和菌柄的木质素含量均呈上升趋势(图7)。贮藏初期菌盖的木质素含量变化很小,第12天后,对照组木质素含量迅速升高,显著高于SCA与HO-DCA处理组(P<0.05)。菌柄中,木质素含量增长趋势明显,对照组与SCA处理组木质素含量增长较快,而HO-DCA处理组增长缓慢,贮藏过程中显著低于SCA处理组与对照组(P<0.05)。
2.4.2 气调方式对双孢蘑菇PAL活力的影响
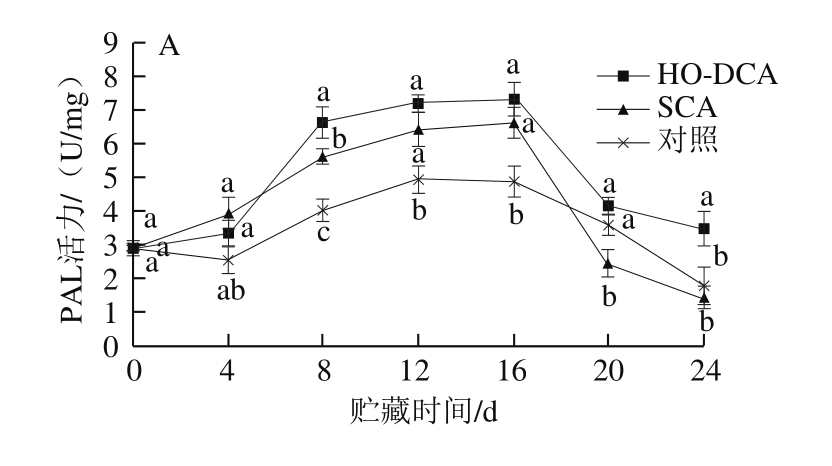

图8 HO-DCA对双孢蘑菇PAL活力的影响
Fig. 8 Effect of HO-DCA on PAL activity of Agaricus bisporus
贮藏过程中,双孢蘑菇菌盖和菌柄的PAL活力均先上升后下降(图8)。在贮藏前期,HO-DCA处理组与SCA处理组之间的差异并不显著。同时HO-DCA处理组的PAL活力显著高于对照组(P<0.05)。而结合图7可知,HO-DCA处理组的双孢蘑菇木质素含量却为最低,说明PAL的活力对双孢蘑菇体内木质素的积累可能影响不大。
2.4.3 气调方式对双孢蘑菇4CL活力的影响

图9 HO-DCA对双孢蘑菇4CL活力的影响
Fig. 9 Effect of HO-DCA on 4CL activity of Agaricus bisporus
贮藏过程中双孢蘑菇的4CL活力呈总体上升趋势(图9)。HO-DCA与SCA处理组的4CL活力变化趋势与木质素含量的变化趋势(图7)基本吻合。与菌盖不同的是,菌柄中4CL活力要明显高于菌盖,且变化幅度大,说明菌柄中4CL的合成与转化较活跃。
有研究指出,‘锈酥’果皮木质素增量与4CL活力呈显著正相关[21]。Hu Wenjing等[22]在转基因黑杨中使4CL的活力下降90%,结果表明转基因植株木质素含量下降45%,进一步说明4CL是木质素合成途径的关键酶。这可能也是本实验中4CL活力与木质素含量变化高度吻合的原因。该结果表明HO-DCA处理能显著抑制4CL活力,减缓双孢蘑菇木质素积累,减轻质地劣变。
2.4.4 气调方式对双孢蘑菇CAD活力的影响

图10 HO-DCA对双孢蘑菇CAD活力的影响
Fig. 10 Effect of HO-DCA on CAD activity of Agaricus bisporus
双孢蘑菇CAD活力呈缓慢上升趋势,菌柄更为明显(图10)。菌盖中,HO-DCA与SCA处理组的CAD活力差异不显著,对照组在0~8 d变化缓慢,第12天以后上升明显,显著高于HO-DCA与SCA处理组(P<0.05)。姜天甲[14]也发现贮藏中后期对照组的双孢蘑菇CAD活力要高于主动气调与被动气调包装处理组(P<0.05)。如图10B所示,菌柄中,CAD活力上升明显,HO-DCA处理组的CAD活力显著低于SCA处理组与对照组(P<0.05)。HO-DCA处理组菌盖与菌柄的CAD活力存在明显差异,说明HO-DCA处理对菌柄和菌盖中木质素代谢过程的影响不同步。
2.4.5 木质素合成相关酶活力与木质素含量相关性分析
表1 菌盖、菌柄中PAL、4CL及CAD活力与木质素含量相关性分析
Table 1 Correlation coefficients among PAL, 4CL and CAD activity of pileus
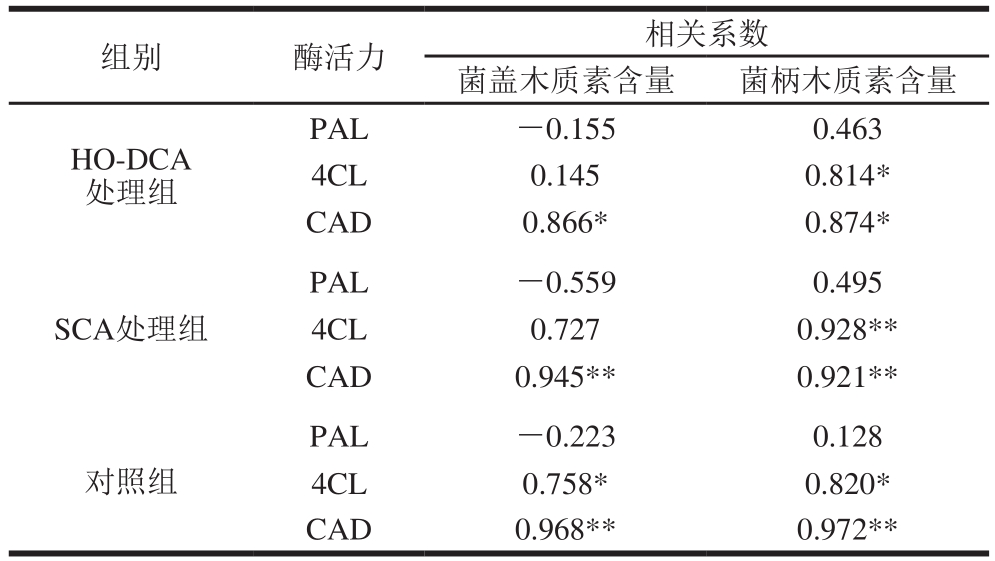
注:*.在P<0.05水平显著相关;**.在P<0.01水平极显著相关。
如表1所示,菌盖中,HO-DCA处理组的双孢蘑菇CAD活力与木质素含量呈显著正相关(P<0.05);SCA处理组、对照组的CAD活力与木质素含量呈极显著正相关(P<0.01);对照组的4CL活力与与木质素含量呈显著正相关。菌柄中,HO-DCA、SCA处理组与对照组的4CL活力与木质素含量之间分别呈显著、极显著和显著正相关;CAD活力与木质素含量之间分别呈显著、极显著和极显著正相关。
由此可看出,PAL活力与木质素的积累相关不大,而4CL和CAD活力与木质素含量显著相关,说明4CL和CAD是双孢蘑菇中木质素积累的酶学基础。
3 讨 论
几丁质是构成真菌细胞壁的主要成分,由β-1,4-N-乙酰氨基葡萄糖单体聚合成直链多聚物,与纤维素黏连成微纤丝构成细胞壁骨架[23]。 几丁质作为构成细胞壁骨架的主要成分,其代谢对双孢蘑菇的质地及品质有重要影响。有研究表明,气调处理能延缓杏鲍菇几丁质的降解,保持其较好的咀嚼度与硬度[24]。而李志啸等[20]对双孢蘑菇的研究发现其贮藏期间的几丁质含量呈上升趋势,纳米包装材料显著抑制了几丁质含量的上升,延缓了双孢蘑菇的老化;说明不同处理对不同种类的果蔬会产生不同影响。几丁质酶是催化几丁质水解生成N-乙酰葡糖胺反应的酶,其主要作用在于干预微生物形态、抗真菌感染以及对几丁质的分解等[25]。过高的几丁质酶活力可能会导致细胞壁结构受损严重[26]。本实验中对照组的几丁质酶活力都处于较高水平,特别是贮藏后期菌柄中几丁质酶活力显著高于HO-DCA与SCA处理组;说明对照组的蘑菇细胞壁受损较严重,进一步导致了质地劣变。菌盖在贮藏前期几丁质含量的升高可能是由于前期几丁质酶活力的下降,由于几丁质酶有分解真菌类细胞壁的作用,HO-DCA处理组末期几丁质酶活力升高可能是为了防御菇体表面病菌侵染[15]。
细胞壁中纤维素与木质素结合在一起,共同起到抗压的作用。同时纤维素还具有调节肠胃道、促进消化等保健功效。果蔬中过高的纤维素含量会造成组织韧性增强,影响食品口感,但食用菌中纤维素含量较低,其对质地的影响占主要地位。在SCA处理组与对照组的贮藏末期,其纤维素酶活力均出现急速上升趋势,此现象与本实验贮藏后期菌柄中纤维素含量急速下降的结果一致;说明纤维素酶在双孢蘑菇贮藏后期的升高加速了纤维素的分解,此现象可能是菌体自溶的表现。陈素芹[16]对双孢蘑菇自溶机制的研究表明,菇体自溶阶段加速纤维素酶活力迅速上升,纤维素含量也迅速下降;自溶后期其活力下降,纤维素含量下降。综合菌盖与菌柄纤维素酶的变化分析,对照组先于HO-DCA与SCA处理组发生菌体自溶,并且自溶程度严重,加速了质地劣变。而HO-DCA处理组则保持了较低的纤维素酶活力,从而保持了良好的质地。
木质素是构成细胞壁次生结构的主要成分,存在于纤维素纤维之间,有硬化细胞壁的作用,但果蔬中过高的木质素含量会影响食用品质[27]。双孢蘑菇在贮藏过程中也易发生木质化,进而影响其品质。有研究显示气调处理能显著抑制双孢蘑菇木质素的积累,维持细胞壁的结构,且与硬度存在相关性[14]。本研究发现双孢蘑菇在贮藏后期特别是菌柄硬度下降,但韧性增加,可能是由于后期细胞失水导致细胞膨压下降,同时木质素含量增加,故而提高了组织剪切力。木质素生物合成途径的主要相关酶包括PAL、4CL和CAD等。PAL作为苯丙烷类代谢途径中的第一步,是苯丙烷类代谢反应中的关键酶。但有研究表明木质素的生物合成对PAL活力的变化并不敏感[28]。Assis等[29]发现,经高浓度CO2处理过的番荔枝果实木质素含量并没有因为PAL活力的增加而升高。姜天甲[14]对双孢蘑菇进行气调包装,也发现了类似现象。这说明PAL虽然是木质素合成的第一步关键酶,但其活力的升高并不会直接引起木质素含量的升高,该结果与本研究结果一致。4CL处在主路径分支的转折点,它决定着苯丙烷类化合物的代谢方向[30]。CAD参与了木质素合成的最后一步还原反应,是木质素合成途径中的重要酶类[31]。Halpin等[32]通过转基因技术使烟草中CAD活力降低,然而其木质素含量未发生变化。不少研究者认为,CAD不是木质素合成过程中的限速酶,木质素合成只需低CAD活力即可[33]。但有研究发现,荞麦茎秆CAD活力与木质素含量显著正相关[34]。本研究相关性分析表明双孢蘑菇中CAD活力也与木质素含量呈显著正相关,说明木质素合成途径以及CAD对木质素合成的影响可能因植物种类的不同而表现出较大差异。
双孢蘑菇贮藏过程中随着水分的大量流失[10],细胞膨压下降,同时由于组织异常代谢导致细胞壁结构破坏,从而引起组织软化,发生质地劣变。而HO-DCA处理可以通过抑制几丁质与纤维素的降解,延缓其软化,保持一定的细胞膨压,从而维持其一定的质地和良好品质。同时,HO-DCA处理能够抑制双孢蘑菇木质素的积累,保持较好的鲜食品质。
4 结 论
在菌盖与菌柄中,HO-DCA处理的双孢蘑菇都保持了较高的几丁质含量和较低的几丁质酶活力,这说明高氧动态气调抑制了细胞壁中几丁质的降解,保持了较好的细胞壁完整性,减缓了菌体自溶进程,抑制了双孢蘑菇质地劣变。
双孢蘑菇在贮藏过程中纤维素的变化趋势较不稳定,但HO-DCA处理显著抑制了纤维素酶活力(P<0.05),从而维持了较高的纤维素含量,保持了较高的组织抗压力。
双孢蘑菇在其贮藏后期,菌柄木质素含量急剧升高,木质化程度不断加深,菌柄木质化程度大于菌盖。对木质素合成相关酶PAL、4CL、CAD活力的分析表明,PAL活力与木质素的积累相关不大,4CL和CAD活力与木质素含量显著相关(P<0.05),而HO-DCA处理能通过抑制双孢蘑菇4CL和CAD的活力来抑制木质素的积累,延缓其木质化进程,保持其良好的食用品质。
参考文献:
[1] SINGH P, LANGOWSKI H C, WANI A A, et al. Recent advances in extending the shelf life of fresh Agaricus mushrooms: a review[J].Journal of the Science of Food and Agriculture, 2010, 90(9): 1393-1402. DOI:10.1002/jsfa.3971.
[2] 刘战丽. 双孢蘑菇高氧气调保鲜技术研究[D]. 北京: 中国农业大学,2010: 1-2.
[3] 王相友, 闫聪聪, 刘战丽, 等. 可食性涂膜对双孢蘑菇生理和品质的影响[J]. 农业机械学报, 2012, 43(1): 141-145. DOI:10.6041/j.issn.1000?1298.2012.01.025.
[4] 巩晋龙. 杏鲍菇(Pleurotus eryngii)冷藏保鲜技术及自溶机理研究[D].福州: 福建农林大学, 2013: 54-57.
[5] PAUDEL E, BOOM R M, VAN HAAREN E, et al. Effects of cellular structure and cell wall components on water holding capacity of mushrooms[J]. Journal of Food Engineering, 2016, 187: 106-113.DOI:10.1016/j.jfoodeng.2016.04.009.
[6] 解越, 张敏, 朱赛赛. 贮藏温度对茄子果实活性氧代谢及细胞壁降解的影响[J]. 现代食品科技, 2016, 32(2): 142-151. DOI:10.13982/j.mfst.1673-9078.2016.2.022.
[7] 刘战丽, 王相友, 朱继英, 等. 高氧气调贮藏下双孢蘑菇品质和抗性物质变化[J]. 农业工程学报, 2010, 26(5): 362-366. DOI:10.3969/j.issn.1002-6819.2010.05.062.
[8] 宋晓雪, 胡文忠, 毕阳, 等. 鲜切果蔬软化机理及其调控的研究进展[J]. 食品工业科技, 2013, 34(4): 397-400. DOI:10.13386/j.issn1002-0306.2013.04.084.
[9] 侯智龙, 江泽林, 李万祥, 等. 苹果常温下组合动态气调贮藏技术的研究[J]. 农业工程学报, 1986, 2(2): 49-57.
[10] 孙涵, 李玲, 王相友. 双孢菇高氧动态气调保鲜参数优化[J].农业工程学报, 2016, 32(24): 282-290. DOI:10.11975/j.issn.1002-6819.2016.24.038.
[11] ZIVANOVIC S, BUESCHER R W, KIM K S. Textural changes in mushrooms (Agaricus bisporus) associated with tissue ultrastructure and composition[J]. Journal of Food Science, 2000, 65(8): 1404-1408.DOI:10.1111/j.1365-2621.2000.tb10621.x.
[12] 张璇. 高浓度二氧化碳结合低浓度氧处理对杏鲍菇货架期品质的影响[D]. 南京: 南京农业大学, 2014: 48.
[13] 商贺阳, 张聘, 黄梅燕, 等. 不同脱叶性甘蔗品种的叶鞘纤维素含量研究[J]. 热带农业科技, 2016, 39(3): 32-36. DOI:10.16005/j.cnki.tast.20160405.002.
[14] 姜天甲. 主要食用菌采后品质劣变机理及调控技术研究[D]. 杭州:浙江大学, 2010: 29; 35-38.
[15] KAWASE T, SAITO A, SATO T, et al. Distribution and phylogenetic analysis of family 19 chitinases in Actinobacteria[J]. Applied and Environmental Microbiology, 2004, 70(2): 1135-1144. DOI:10.1128/AEM.70.2.1135-1144.2004.
[16] 陈素芹. 白色双孢蘑菇自溶机制及诱因研究[D]. 福州: 福建农林大学, 2010: 24; 30.
[17] REN Shuncheng, SUN Juntao. Changes in phenolic content,phenylalanine ammonia-lyase (PAL) activity, and antioxidant capacity of two buckwheat sprouts in relation to germination[J]. Journal of Functional Foods, 2014, 7(2): 298-304. DOI:10.1016/j.jff.2014.01.031.
[18] 毕咏梅, 欧阳光察. 水稻4-香豆酸CoA连接酶的基本性质[J]. 植物生理学通讯, 1990(6): 18-20. DOI:10.13592/j.cnki.ppj.1990.06.007.
[19] 张美姿, 吴光斌, 陈发河. NO熏蒸处理对冷藏枇杷果实木质化劣变的影响[J]. 食品科学, 2014, 35(16): 232-237. DOI:10.7506/spkx1002-6630-201416045.
[20] 李志啸, 杨文建, 方东路, 等. 纳米包装材料对双孢菇细胞壁代谢及品质的影响[J]. 食品科学, 2016, 37(6): 248-253. DOI:10.7506/spkx1002-6630-201606045.
[21] 李晓峰, 李雪, 贾兵, 等. ‘砀山酥梨’褐皮芽变木质素含量及相关酶活性与CCoAOMT表达量分析[J]. 园艺学报, 2012, 39(5): 828-836.DOI:10.16420/j.issn.0513-353x.2012.05.003.
[22] HU WenJing, HARDING S A, LUNG J, et al. Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees[J]. Nature Biotechnology, 1999, 17(8): 808-812.DOI:10.1038/11758.
[23] 林振亚, 吴琼, 余传金, 等. 链霉菌株A01-chit33产纳他霉素和几丁质酶协同发酵研究[C]// 中国植物病理学会2012年学术年会论文集.青岛: 中国农业科学技术出版社, 2012: 405.
[24] 张璇, 古荣鑫, 胡花丽, 等. 高二氧化碳结合低氧处理对杏鲍菇细胞壁的影响[J]. 华北农学报, 2014, 29(5): 193-199. DOI:10.7668/hbnxb.2014.05.033.
[25] 刘红锦, 徐为民, 王静, 等. 果蔬的褐变及其控制方法[J]. 食品研究与开发, 2008, 29(4): 159-162.
[26] 刘巧林. 百里香乙醇提取物对黄瓜枯萎病菌的生物活性及作用机理研究[D]. 太原: 山西农业大学, 2014: 31-32.
[27] BATE N, ORR J, NI W. Quantitative relationship between phenylalanine ammonia-lyase levels and phenylpropanoid accumulation in transgenic tobacco identifies a rate-determining step in natural product synthesis[J]. Proceedings of the National Academy of Sciences, 1994, 91(16): 7608-7612. DOI:10.1073/pnas.91.16.7608.
[28] 丁霄, 曹彩荣, 李朋波, 等. 植物木质素的合成与调控研究进展[J]. 山西农业科学, 2016, 44(9): 1406-1411. DOI:10.3969/j.issn.1002-2481.2016.09.43.
[29] ASSIS J S, MALDONADO R, MUNOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biology and Technology,2001, 23(1): 33-39. DOI:10.1016/S0925-5214(01)00100-4.
[30] BOUDET A M, KAJITA S, GRIMA-PETTENATI J, et al. Lignins and lignocellulosics: a better control of synthesis for new and improved uses[J]. Trends in Plant Science, 2003, 8(12): 576-581.
[31] 唐映红, 陈建荣, 刘芳, 等. 苎麻肉桂酰辅酶A还原酶基因cDNA序列的克隆与分析[J]. 作物学报, 2015, 41(9): 1324-1332. DOI:10.3724/SP.J.1006.2015.01324.
[32] HALPIN C, KNIGHT M E, FOXON G A, et al. Manipulation of lignin quality by downregulation of cinnamyl alcohol dehydrogenase[J].Plant Journal, 1994, 6(3): 339-350. DOI:10.1046/j.1365-313X.1994.06030339.x.
[33] 魏建华, 宋艳茹. 木质素生物合成途径及调控的研究进展[J]. 植物学报, 2001, 43(8): 771-779.
[34] 汪灿, 阮仁武, 袁晓辉, 等. 荞麦茎秆解剖结构和木质素代谢及其与抗倒性的关系[J]. 作物学报, 2014, 40(10): 1846-1856. DOI:10.3724/SP.J.1006.2014.01846.