根据现代物质科学的基本理论,一种物质的性能与其组成、结构之间存在紧密的内在联系,充分掌握和分析其微观组分以及排列结构是深入了解物质性能及其应用机理的关键。淀粉是人类摄取能量的主要来源[1],作为地球上第二大天然高分子物质,其产量仅次于纤维素,且来源广泛、成本低廉、可降解、无污染[2]。淀粉宏观层次上复杂的变形力学响应是其细观、乃至微观组成与结构的体现。因此,只有深入分析淀粉颗粒在不同层次的组成和排列结构的作用与内在联系,从整体到局部,从宏观到微观,才能更清楚地把握淀粉颗粒的宏观性能[3]。因此对淀粉颗粒微观结构的研究成为当前研究的发展趋势。本文综述了天然高分子淀粉的微观结构的最新研究进展,尤其对淀粉的组成、结构及常见淀粉模型进行详细综述。研究淀粉分子的微观结构[4]与改性过程中结构之间的关系,可促进天然高分子改性和加工技术的发展、改性方法和理论体系的创新。
1 淀粉组成
淀粉的分子式为(C6H10O5)n,n为不定数,称为聚合度(degree of polymerization,DP),一般为690~6 340[5];大麦的链淀粉DP为1 570;玉米淀粉的DP为930~990;小麦淀粉的DP在830~1 570之间[6]。

图1 直链淀粉及支链淀粉分子结构[2]
Fig. 1 Molecular structures of amylose and amylopectin[2]
C6H10O5为脱水葡萄糖单位,以α-D-1,4-葡萄糖苷键或α-D-1,6-糖苷键形成葡萄糖链,由此形成两种不同的淀粉分子,即直链淀粉和支链淀粉(图1),二者约占淀粉干质量的98%~99%,其比例随不同的淀粉种类有较大的差异。淀粉的性质会因直链淀粉和支链淀粉的DP及比例差异而有较大不同[7]。同种淀粉中,链淀粉含量的不同使淀粉的分子结构和组成有很大变化,产生个体差异。差异主要表现在颗粒的大小、表观形态及性质方面。除了直链淀粉及支链淀粉,淀粉颗粒中还存在少量的其他物质,如中间级分、脂类、蛋白质、矿物质等[8]。
1.1 直链淀粉
直链淀粉是一种线形多聚物,都是由α-D-葡萄糖通过α-D-1,4-糖苷键连接而成的链状分子(图1),有一个还原性末端和一个非还原性末端,呈右手螺旋结构,每6 个葡萄糖单位组成螺旋的一个节距,在螺旋内部只含亲油的氢原子,羟基位于螺旋外侧。直链淀粉的DP为1 000~10 000,分子质量约为1×105~2×105 Da[8]。除了直链淀粉(线形)分子外,还存在一种有分支的直链淀粉,摩尔分数为0.1~0.7,其含量一般大于线性直链淀粉[9]。分支的直链淀粉分支程度一般随直链淀粉分子DP的增加而增大,单个直链平均分支数为5~21。平均每200~700 个葡萄糖单位有3~11 个支链,分支点是α-D-1,6-糖苷键连接,少于总糖苷键数的0.5%[8]。分支相隔距离通常很远,因此其物理性质基本和直链淀粉相同。
目前直链淀粉在颗粒中的位置及状态有3 种假说。第1种认为直链淀粉位于支链淀粉径向位置,此时直链支淀粉的相互作用力最小[10],但该假说没有实验依据。其他两种假说认为链淀粉在主链径向方向,以束状或单独形式随机分布在支链淀粉簇的半晶区或无定形区。已经通过玉米淀粉的交联反应证实直链淀粉彼此不发生交联[11]。从而证明第3种假说正确,即直链淀粉单独存在,在支链淀粉链的径向方向上自由分布,径向排列,如图2所示。
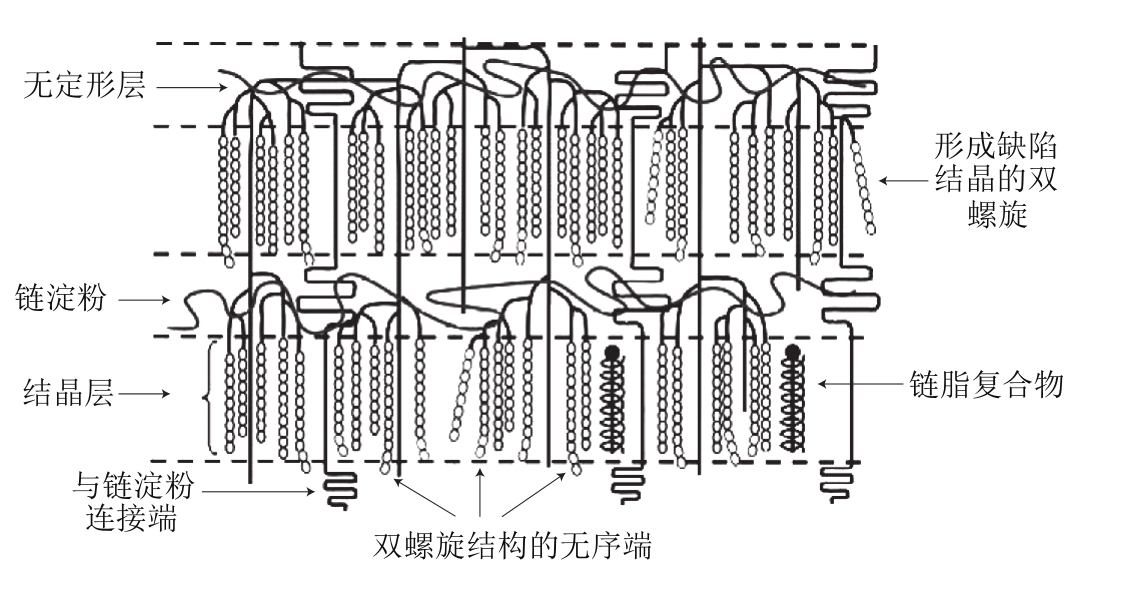
图2 颗粒中直链淀粉与支链淀粉的相互作用方式及存在位置[12]
Fig. 2 Schematic presentation of amylose localization in amylopectin clusters[12]
直链淀粉都是朝向颗粒表面[13-14]。颗粒表面找到的直链淀粉都比中心找到的链长(chain length,CL)短。Boyer[15]、Ring[16]等证明大多数的直链淀粉能够在低于糊化温度时渗出颗粒表面,渗出的直链淀粉都是单螺旋状态,因此认为直链淀粉主要是以单螺旋结构存在。90 ℃时能够从颗粒中提取出大多数的直链淀粉[17],仍然没有渗出的一些较长的链淀粉可能参与形成支链淀粉双螺旋结构,或是被缠绕在淀粉颗粒内部错综复杂的结构中[18]。
1.2 支链淀粉
支链淀粉是一种高度分支的大分子,从主链上再分出各级支链,各葡萄糖单位之间以α-D-1,4-糖苷键连接构成它的主链,支链通过α-D-1,6-糖苷键与主链相连(图1)。分支点的α-D-1,6-糖苷键数占总糖苷键数的5%~6%[19],支链淀粉的分子质量大于2×107 Da。

图3 支链淀粉中各种链的命名
Fig. 3 Basic labeling of chains in amylopectin
为了描述支链淀粉链,1952年Peat等[20]建立最基本的归类方法,如图3所示。A链通过α-D-1,6-糖苷键与其他部分相连,属于外链,没有侧链;B链与一个或几个其他链相连;C链连接非还原性末端,因此一个大分子只包含一个C链。不同来源的淀粉其支链淀粉的DP、平均CL、内链及外链的平均长度也不同。Hanashiro[21]、Parker[22]等通过对还原性末端进行荧光染色,计算DP在10~130范围内,高效排阻色谱(high performance size exclusion chromatography,HPSEC)中的峰值DP为40。
Hizukuri等[5]采用HPSEC法发现支链淀粉的链结构具有特征长度片段(CL大约在25~30)并再次把长B链细分为B2链(CL约45)、B3链(CL为70)。许多淀粉的HPAEC结果都显示有较短的长度片段(CL约为12),最短的一组命名为fa,CL为6~12,代表A链。但是,目前发现fa只是代表A链的一部分[23]。CL在13~24之间的是fb1,由B1链组成。CL在25~36之间的是fb2,CL大于37为fb3。另一种分类方法是由Hanashiro等[21]建立的,与淀粉糊化有关。fa在晶体融化时不发生变化,fb1则发生变化。说明短链不容易形成双螺旋结构,反而干扰结晶结构的组织使颗粒的结晶层存在缺陷。Bertoft等[23]从玉米支链淀粉中分离出中间长度的链,认为是原来定义B1组的亚组,因此命名为B1b和B1c(对应的fb2),而其中较短的为B1a。支链淀粉中CL最短的是6,CL在6~17间的短链分布是不同来源支链淀粉特征区域,因此称为支链淀粉“指纹结构”[24]。CL为6~8组成为A链亚组,称之为A链指纹结构,记作A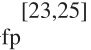 。
。
除了CL到100的分支以外,和直链淀粉那样的长支链也有报道[26],这一类结构在玉米、小麦、大麦、大米、马铃薯及木薯淀粉中可见,用物质的量单位衡量,但是含量非常少,甚至一个高分子仅含有一个或几个。采用质量基准衡量在1%~10%之间。有报道称大米淀粉样品,尤其是indica品种中超长链的含量多达14%~20%,其中结合态淀粉合成酶(granule-bound starch synthase,GBSS)(通常含有淀粉酶合成体)是合成超长链的主要原因[27]。
支链淀粉的簇状结构建立于酸处理淀粉的研究基础上。酸处理后骤然出现大量短链,从而推断支链淀粉的分支结构以簇状结构存在,此后簇模型被广泛接受。簇状结构大小差别很大,4~34 个链不等[5,28],一个DP为10×103~16×103的支链淀粉由60~120 个簇状结构组成[10];因此目前仍然无法对簇状结构精确定义。
将簇状结构分离的研究很少。一般认为可以用淀粉内切酶切断簇状结构内部的片段(inner chain snippet,IC-S)。Bender等[29]用环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,CGT)分离糯玉米和马铃薯支链淀粉中簇状结构,得到3 种簇状组:其中β-LD的DP为40~140(因此,最初包含外链的簇状结构粗略的估算为β-LD DP的两倍,即80~280)。Finch等[30]用一种麦芽四糖合成酶发现马铃薯及小麦支链淀粉中含有相同数量的簇状结构,但是马铃薯的簇状结构比小麦的大3 倍左右。Bertoft[31]用α-淀粉酶(也称为液化酶)及凝胶渗透色谱(gel permeation chromatography,GPC)法研究支链淀粉中的簇状结构尺寸。他们将支链淀粉水解率急剧降低作为簇状结构的标准,分析中间糊精的结构,并定义簇状结构为一组支链结构。对玉米、大米、苋菜、树薯及马铃薯淀粉支链淀粉的研究都反映出长B链被α-淀粉酶切除,表明它们参与连接形成簇状结构[32-35]。
簇状结构中的分支并非均匀分布,而是分成小群体的分支群,可以通过α-淀粉酶彻底水解分离得到分支群[33-34]。组成簇状结构的分支群数量根据分支群与簇状结构的尺寸可分为2~7 类,且DP差异很大,从5到40不等。例如苋菜及马铃薯中分支群的平均DP为10.7~12.7[34-35],大米及糯玉米淀粉的DP为12.7~17.1[36-37]。分支群中分支密度一般很高,苋菜14%、马铃薯16%~17%,因此内链长度(in chain length,ICL)很短,苋菜2.8、马铃薯2.0。相比而言,簇状结构的ICL分别为4.4和4.3~6.4,也就是说组间链长(in between chain length,IBCL)确实较长。事实上,IBCL在苋菜中为6.8,而在马铃薯淀粉中是7.1~8.5之间。糯玉米支链淀粉簇在结构上可划分为两种截然不同的组[37]。一类是拥有DP 10.9的分支群,群密度是7.2,IBCL是7.1,另一类型DP、群密度、IBCL则分别是12.7、5.8和8.5。也发现马铃薯淀粉存在结构上稍有不同的簇状区域。
支链淀粉不仅参与结晶结构,也参与无定形结构。支链淀粉最主要的分支及分支间的IC-S也存在于无定形区。支链淀粉中ICL的平均是4~9,因此存在3 种ICS,即簇状结构之间、簇状结构内分支群之间、分支群内。分支群的平均ICL仅有2~3,因此分支群是分支结构高度密集的区域。对马铃薯分支群的分析发现有两种尺寸的分支,一种是DP为2的分支,另一种是DP为3~8的分支。前者代表短A链,可能源于支链淀粉,也可能是α-淀粉酶水解组间淀粉片段得到。一些DP为3的链也属于A链,源于短B链或通过α-淀粉酶水解形成。其他DP大于3的分支为氨基酸基本单位Bfp,因此氨基酸基本单位Bfp及3 个或更多的链也代表性地参与了分支群的形成,其中氨基酸基本单位Bfp与另一个链相连,并且携带一个或两个链于其还原性末端。
图4是苋菜支淀粉簇f-LD及β-LD的分支群结构模型[34],该簇状结构DP为82,组成6 个分支群,一个较长的B1b或B2链,其余的为B1a或A链。苋菜支链淀粉簇发现3 种链,组间片段为7,证明这个链参与连接两个分支群。B1链是18~22,说明其跨越了3 个分支群。由于一些簇拥有很长的链,如DP达到45(如同B2链),它们可能参与到5 个分支群的连接。因此该图的结构暗示链中DP为10~12的残基参与连接分支,这与Hanashiro等[38]的研究结果相吻合。

图4 淀粉苋菜支链淀粉簇中的A、f-LD、β-LD分支群结构模型[34]
Fig. 4 A model of the building block structure of a cluster in amaranth amylopectin as A, f-LD, β-LD[34]
支链淀粉溶于水中更稳定,形成黏度较低的溶液,形成的薄膜强度也较低。颗粒中的支链淀粉有助于提高淀粉的溶胀能力[31]。淀粉糊化过程中,支链淀粉主要存在于溶胀的淀粉颗粒中,部分直链淀粉游离到颗粒外形成连续的胶体相[19]。支链淀粉需要较长的时间堆积形成晶体[39-40]。
1.3 中间级分
不同淀粉种类其中间级分物质的特点也有很大不同,因此很难明确给出其定义。对中间级分的分离提取方法不同,所得结论也不尽不同,因此在中间级分相关领域的研究还有很多工作值得进一步开展。目前对中间级分只能较笼统的定义为:在淀粉粒中存在一类结构和性质介于直链淀粉和支链淀粉的大分子多糖类物质,用GPC分离过程中不会与1-丁醇(支淀粉片段)发生络合反应,或者说,可以通过麝香香酚沉淀或用1-丁醇和异戊醇沉淀得到的独立组分被称为中间级分。
中间级分主要存在于经过生物合成改性的淀粉中,但在原淀粉中也有少量存在。也可按照上述普通支链淀粉的分支方法进行分类。但是中间级分长链更多,长链与短链的比例更高。中间级分的分子质量越低,长链的比例越高[41]。如Lansky等[42]分离的中间级分与碘的结合能力较差,这类分子在高直链玉米淀粉(玉米突变体)和具有sugary-2基因的普通玉米淀粉中也有被发现,其分支的DP最高为52,最低为21,比其支链淀粉分支长(DP最高45,最低为19)。另外,在高直链玉米淀粉中还发现一类DP仅有95的线性分子。研究表明,这类中间物质的出现是因为缺少分支酶IIb[43]。豌豆淀粉中间级分的特点是,所有很短的链淀粉有很长的分支,与同等大小的相应的簇状结构中的分支结构相比,分子质量更低,长支链比例更高。
1.4 脂类和磷脂
脂类是许多谷物淀粉中普遍存在的微量成分,玉米淀粉含有少量的自由脂肪酸和磷脂,普通大米淀粉含有大量的磷脂和微量的自由脂肪酸,而小麦、大麦、燕麦、黑麦含有大量的磷脂和少量的磷酸单酯,磷脂分别占普通小麦和玉米淀粉干质量的0.8%~1.2%和0.6%~0.8%[20]。马铃薯及豆科的脂质含量极低甚至没有脂质[12]。脂类和磷脂可以与淀粉中的直链淀粉或支链淀粉较长的侧链形成稳定的复合物,在形成复合物时,磷脂的非极性部分通常位于直链淀粉双螺旋结构的内部,而极性部分位于外部,以便使更多的磷脂包裹在双螺旋结构内部,脂质在颗粒中呈放射状分布[19](图5)。链脂复合物存在于无定形结构中,也可以通过“韧化”处理成为有序的结晶结构而形成层纹状的V-型淀粉。通过X射线微量分析及光电子能谱证明淀粉-脂类复合物的结晶度和热稳定性也随着直链淀粉CL的增加而增加,并随着脂类饱和度的减小而减小[44]。所有普通淀粉的链脂含量都有很好的相关性,已经通过魔角旋转核磁共振法证明并可以量化其中的链脂复合物[12]。例如:在普通大米淀粉中链脂复合物占直链结构的43%,在燕麦淀粉中占直链结构的33%,含链脂复合物的直链淀粉占整个直链淀粉的13%~43%。据报道,在低直链淀粉含量(糯)大麦及玉米淀粉中,含链脂复合物的直链淀粉达到整个链淀粉的19%~62%[45]。因此只有很少量的直链淀粉是和脂质形成复合物。以此类推,并不是所有的脂质都和直链淀粉形成复合物,也有的是以游离脂质的形式存在。另一种检验链脂复合物存在的方法是差示扫描量热(differential scanning calorimetry,DSC)分析,玉米淀粉和小麦淀粉的DSC分析显示在较高的温度下另外又多出一个吸热峰,当淀粉经脱脂处理后,该峰即消失,当又重新加入脂质,该峰又出现[46],说明该峰的出现归因于链脂复合物的融化。
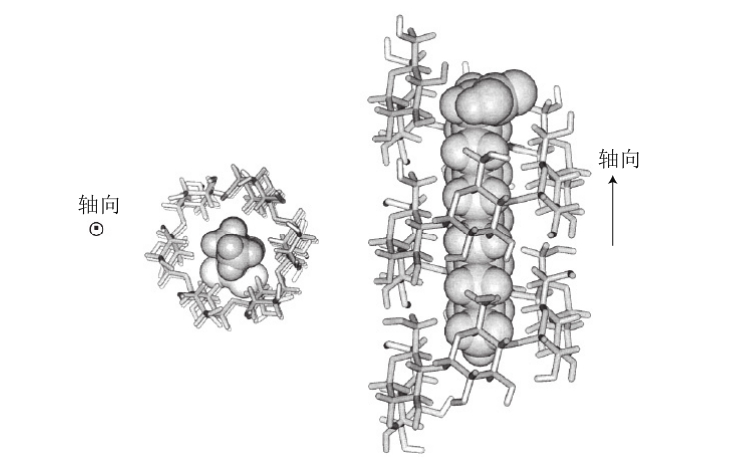
图5 直链淀粉-脂类复合物结合模型示意图
Fig. 5 Molecular modeling representation of amylose-fatty acid complexes
1.5 蛋白质
淀粉颗粒中还存在少量蛋白质(0.1%~0.7%)[47],主要分布于淀粉颗粒表面,将淀粉颗粒包覆,一定程度上能够限制淀粉颗粒的膨胀[48]。由于蛋白质具有较高的水分子结合能力,因此对淀粉的理化特性如膨胀度、溶解度等产生显著的影响,这已在大米淀粉[49]、普通玉米淀粉[50]、小麦淀粉[51]等诸多淀粉中得到了证实。蛋白的存在还会影响淀粉的结晶度,如小麦淀粉脱去蛋白后,其结晶度会显著降低。
一些淀粉颗粒(例如玉米、高粱和小麦)具有小孔道结构,从颗粒表面延伸到颗粒内部。高粱淀粉中,外部小孔的开口直径为0.1~0.3 µm,内部为0.07~0.10 µm。在发芽过程中,这些小孔道是水解酶类的作用点,从而可以消化淀粉颗粒[52]。淀粉颗粒小孔的密度分布及酶的消化性之间存在直接相关性,Han等[53]发现孔道中充满蛋白质,其中最主要的蛋白质是brittle-1(一种和玉米淀粉中brittle-1基因突变体相关的蛋白质)。
2 淀粉颗粒不同结构水平的组织形式
淀粉颗粒结构较为复杂,其内部的精细结构至今尚不明确。为了准确地研究复杂的淀粉结构,通常将淀粉颗粒结构从双螺旋结构(Å)、层状结构(9~10 nm)、超螺旋结构(10~100 nm)、止水塞结构(0.1~1.0 µm)、轮纹结构(1~10 µm)、颗粒(约10 µm)等层次来进行描述[54-59],如图6所示,以下将从淀粉的不同水平层次来介绍淀粉结构。

图6 淀粉颗粒由低到高6 个数量级不同结构水平的组织形式
Fig. 6 Different levels of structural organization spanning six orders of magnitude of starch granules
2.1 双螺旋结构
双螺旋结构主要由支链淀粉位于最外端的A链和B链组成的,一个支链淀粉分子可同时参与到多个双螺旋结构中,且支链淀粉和直链淀粉也可相互作用形成双螺旋结构。双螺旋结构平行排列,螺旋每上升10.4~10.5 Å有3 个D-吡喃葡萄糖单元,沿着单股螺旋轴重复距离相当于6 个D-吡喃葡萄糖单元(21 Å)[60-61]。
淀粉颗粒中并非全部的短链都能形成双螺旋结构。Gidley[62]的研究认为淀粉链要形成双螺旋单体结构,其CL至少要在10 个单元以上,其中谷类淀粉DP为14~20,块茎类淀粉的DP为16~22。DP更低的低聚糖如麦芽六糖在长链存在的情况下可以联合起来。迄今发现淀粉中最短的支链DP为6,6~9 个单元的支链阻滞糊化后淀粉发生重结晶。两条分子链通过氢键作用以及分子链间的范德华力形成双螺旋结构[13]。螺旋结构的有序程度大于结晶结构的。多数的支链淀粉以双螺旋结构形式更多地存在于无定形结构中。计算机模型也证实支链淀粉中的双螺旋结构按照能量最低原则存在于无定形结构中,甚至是1~6分支点(图7)。利用固态13C核磁共振法可以测定淀粉颗粒的单双链比例[40]。

图7 淀粉双螺旋结构
Fig. 7 Double helix structures of starch[62]
单螺旋-单螺旋、双螺旋-单螺旋、双螺旋-双螺旋模型充实了分支群概念[63]。连接两个分支点的单螺旋片段长度具有0~10的规律性差异。一定的ICL构成平行的双螺旋结构,因此,认为ICL决定其结晶度。按照能量最低原则,双螺旋结构可以叠加在颗粒结晶区或双螺旋结构上[64]。
直链淀粉形成一个每圈有6 个葡萄糖单元的单螺旋结构,内部疏水、外部亲水。一个螺旋结构有6~8 个葡萄糖单元,其中7 个葡萄糖单元的螺旋结构厚度为10 nm[65-67],内含特定络合物[41]。淀粉分子中只有环状葡萄糖单元中的3 个羟基是自由的,可以旋转到分子环的一侧,使这一侧亲水性更强。相反的一侧则因暴露的—CH而显示微弱的疏水性能。螺旋链内侧的羟基团可与一些乙醇类及芳香复合物形成左螺旋化合物,如碘、乙醇或脂肪酸等。低浓度的链淀粉在二甲基亚砜溶液中呈现刚性、有缺陷的蠕虫状,在新鲜分离出来的水溶液中,链淀粉的链是不稳定的无规卷曲状态[54]。
V-型淀粉中的直链淀粉的典型结构是6 个葡萄糖残基组成一个左螺旋结构。螺旋高度7.92~8.04 Å之间;目前被广泛接受的V-型淀粉的链脂复合物模型是:脂质结构中的脂肪族部分在链螺旋结构内部,而体积庞大难以进入的极性基团在螺旋外部。普通玉米和小麦淀粉中链结构的22%与脂质形成单螺旋结构。
2.2 超螺旋结构
超级双螺旋结构可以通过透射电子显微镜(transmission electron microscope,TEM)进行观测。选择分子质量小的,未着色的淀粉颗粒片段作为观测对象,可发现“虫状”波纹结构。Oostergetel等[68]通过结合电子断层摄影术及低温电子衍射技术,在TEM观察过程中放置一系列斜置的底片,用低通傅里叶滤波器处理,建立了马铃薯淀粉的残余微晶的3D结构。如图8所示,螺旋结构组成连续规则的结晶网状结构,像一个骨架结构。螺旋之间大约18 nm,节距大约为10 nm[69]。结晶区包含支淀粉大分子双螺旋结构的线性片段,形成包含四角排列的左手螺旋结构的连续网状结构[70]。由于附近的螺旋结构彼此渗透,结晶层形成一种接近连续的超螺旋结构。在超螺旋结构中含有一个直径为8 nm的中心凹腔。其螺旋节距是由支链淀粉分支聚集形成的,是不同淀粉来源的特征标志,因此可以直接通过支链淀粉合成体中分支酶的大小及组织形态确定[69]。

图8 马铃薯淀粉的超螺旋结构[70]
Fig. 8 Super helix structures of potato starch[70]
2.3 止水塞结构
Baldwin等[71]用高分辨率原子力显微镜发现淀粉颗粒表面细节:在结晶区之间有轮纹结构;支淀粉层存在于颗粒内部;颗粒表面具有孔道结构。Bahnassey等[72]首先证明化学降解的淀粉中存在自然抗性单元止水塞。淀粉颗粒纤维质概念与止水塞概念截然不同,当时显微镜分辨率还不足以解决这个争论。因此,当支链淀粉簇模型建立后,这两个概念也被遗忘了;而现在越来越多的研究发现这两个概念有一定的根据。纤维质概念强调直链淀粉与支链淀粉聚合物的径向组织形式,而止水塞概念强调颗粒内部结晶结构的高度有序化。
扫描电子显微镜(scanning electron microscope,SEM)和原子力显微镜(atomic force microscope,AFM)图提供了清晰可见的淀粉的止水塞结构,如图9所示,电子显微镜和酶降解研究也提供了一些止水塞结构的证据。止水塞具有显著的非对称性结构,轴比为2∶1或3∶1,在豌豆淀粉粒中最大长度在130~250 nm,马铃薯淀粉粒中是20~50 nm[73],玉米淀粉粒中是10~30 nm[74]。Helbert等[75]用TEM观察以亲水的三聚氰胺甲醛树脂准备的超薄淀粉颗粒切片,得到的结果中止水塞轮廓大约是几百纳米。在玉米淀粉颗粒切片中采用过碘酸-氨基硫脲-银(PATAg)也可以看到。PATAg这种标记物具有渗透性,只突出颗粒结构的无定形区域,揭示大约椭圆体区域20~500 nm范围内的止水塞结构。而TEM法不容易渗透,可以揭示整个颗粒的止水塞结构。而且,由于TEM法分辨率较高,也能观察到止水塞结构交替出现的结晶层及无定形层。
图9 淀粉颗粒的止水塞模型
Fig. 9 Spherical blocklet-like structures of starch granules
一般而言,B-型淀粉(如马铃薯淀粉)止水塞结构比A-型(如小麦淀粉)大,B-型的止水塞结构的直径为400~500 nm,而A-型的直径是25~100 nm。马铃薯淀粉大的止水塞结构出现在颗粒表面附近,大约是远离中心10 µm左右,小的止水塞结构在颗粒中心附近。在小麦淀粉中,100 nm的止水塞结构是硬的结晶环,而不是软的。因此,当颗粒阻抗力与一些相互作用因素有关时,止水塞结构的尺寸(结晶度)将对颗粒的阻抗性起作用,止水塞结构尺寸因而对马铃薯淀粉外层相对阻抗力有作用,也对相对半晶体和无定形结构的轮纹阻抗性有作用。
Atkin等[78]的研究结果支持中间止水塞结构,他们发现如果粒子表面破裂,小的、椭圆体粒子在淀粉颗粒糊化时形成并释放于周围介质中。说明单一粒子(直径400 nm,可比作止水塞结构)彼此并非共价相连。止水塞结构群集了单一支链淀粉分子,如果是这样,其也将群集超螺旋结构,而后者,代表单个支链淀粉大分子。此结构的形成通过将两个方向的簇模型主链结合成一个螺旋结构。然而,超螺旋结构的直径是18 nm,只相当于最小的止水塞结构几分之一大小,即几个螺旋结构组成一个最小止水塞结构[77]。显然,这些结构(止水塞、超级螺旋和支淀粉大分子)水平之间的关系还不清楚,需要进一步研究。为了更好地结晶,止水塞中的支链淀粉应进行同向排列。既然上述短链的长度(即晶层厚度)、长链/短链、平均DP、每分子含有链数以及结晶尺寸等均为客观的可重复的数据,因此可以基于这些数据提出正常止水塞结构的构架。止水塞结构将是半结晶超级结构,至少在大的止水塞中,一般由一些支链淀粉链组成。普通止水塞有结晶层和无定形层组成,它们也是形成支链淀粉簇状结构和支链淀粉分子的成分。止水塞中支链淀粉的还原性末端朝向颗粒脐点。有两类构型止水塞,即普通和缺陷型,由于有低分支和无分支分子的影响,它们将分别参与多相及同质外层的组成[77]。
综上,不同来源的淀粉止水塞结构形状相似,但大小不同;同种植物淀粉中止水塞的尺寸尽管不尽相同但基本类似;止水塞在淀粉粒中以连续状态存在;止水塞大小不受颗粒大小、轮纹厚度的影响;在无定形结构中止水塞的排列形成缺陷,排列不紧密;有止水塞复合体存在;生长纹及无定形纹并不总是连续的。
2.4 颗粒结构
淀粉颗粒最基本的结构特点是由厚度在100~400 nm的无定形层与结晶层交替组成的天然多晶体系[78],这样的结构被称为轮纹结构(图10)。通常结晶区约为颗粒体积的15%~30%,而无定形区的构造至今还没有较好的确定方法[79]。结晶区和无定形区间无明确的分界线,变化是渐进的。由于可见光偏振取决于可见光的波长顺序(100~1 000 nm),因此支链淀粉的径向组织方式被认为是造成光偏振的原因。从更高层次的分子排列来看,X射线衍射法研究表明颗粒内部存在9~10 nm的片段。该片段可以归因于颗粒内部交替出现的结晶层与无定形层,并通过侧链的簇状结构形成,从支链放射状的地方分叉。这也是淀粉颗粒共有的特点,与淀粉来源无关[70,80-81]。不同来源的淀粉颗粒具有相应的特征颗粒形貌,如图11所示,有球形、椭球形、多角形、片状及不规则管状。在偏光显微镜下观察,会呈现偏光十字或马耳他十字,这是淀粉粒具有晶体结构的重要标志。双折射性是由于淀粉粒的高度有序性(方向性)所引起的,高度有序的物质都有双折射性。淀粉偏光十字的存在证明了淀粉的球晶结构的存在,表明微晶的主轴是径向的。而瘦长形颗粒的两极及中线区域的偏光十字没有变化,说明微晶极其微小并呈现多向性[82-83]。十字的交叉点位于粒心,因此可以进行粒心的定位。不同种类淀粉粒的偏光十字的位置、形状和明显程度不同,可依此鉴别淀粉种类。例如,马铃薯和绿豆淀粉的偏光十字比较明显,而大米淀粉明显程度稍差(图12)。链淀粉含量与颗粒形态特征方面存在直接相关性。链淀粉含量越高,玉米淀粉中能找到的长条状颗粒越多。不同来源的淀粉粒径不同,一般分布在0.1~200.0 µm之间。

图10 淀粉轮纹结构中支淀粉的排列方式[81]
Fig. 10 Schematic representation of the several levels of ultrastructure of starch[81]

图11 不同植物来源淀粉颗粒的SEM及偏光显微镜图
Fig. 11 SEM and polarized light optical microscopy (insets) images of native starch granules from various cultivars
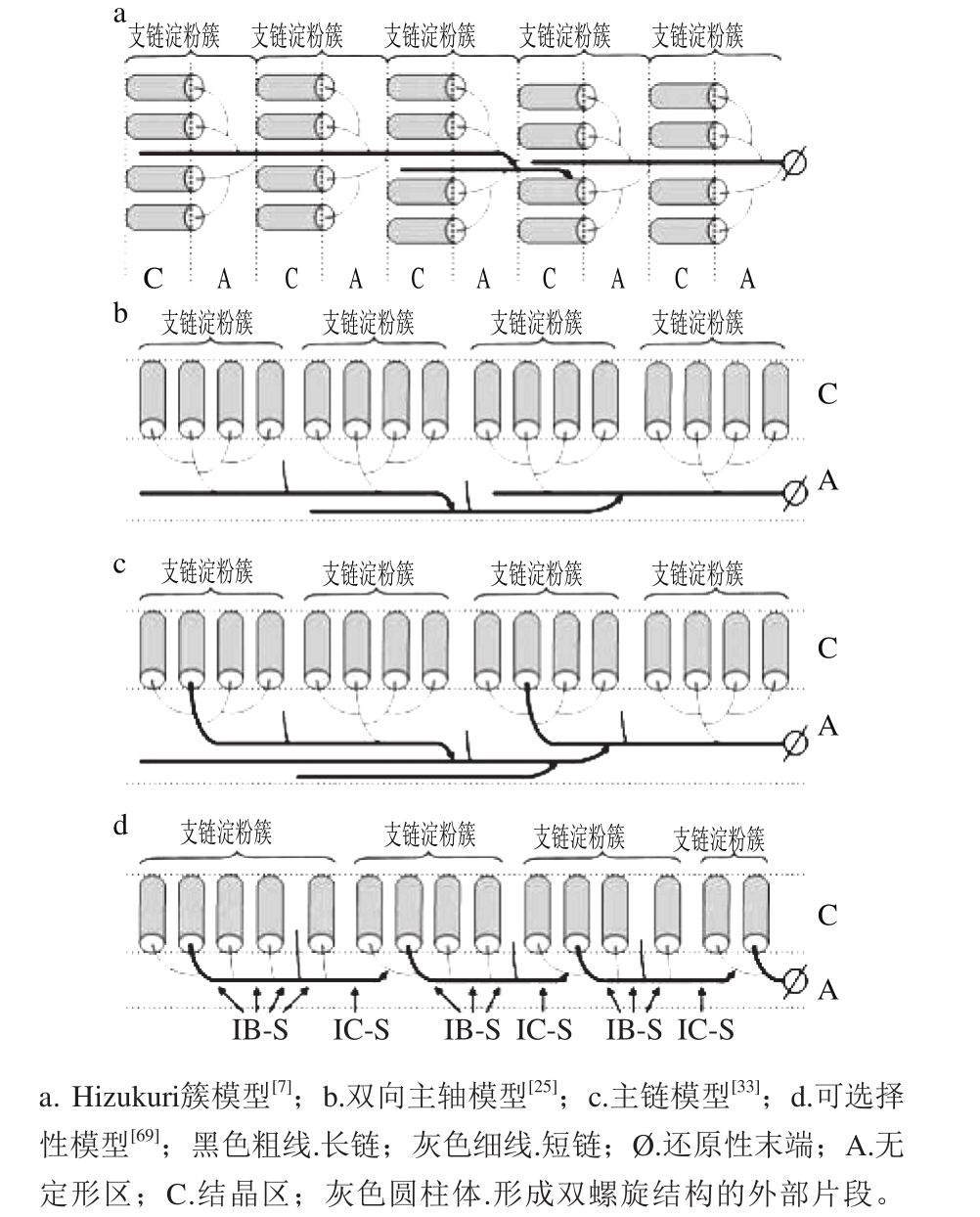
图12 几种支淀粉簇的组织模型
Fig. 12 Alternative models of the organization of clusters in amylopectin
3 淀粉晶体结构
淀粉晶体具有假六边正交晶系的晶格结构,直径大约为15 nm,其a=11.9 Å、b=17.7 Å、c=10.52 Å,α=β=γ=90o,为右旋。每个晶胞中双螺旋结构反向堆积。利用螺旋结构每一全匝包含的单糖单元数n,及每个单元沿螺旋轴上升的距离h,研究淀粉晶体的结构,也可得出h=3.5 Å、n=6[55],如图13所示。
A-型淀粉的单斜晶格a=2.124 nm、b=1.172 nm、c=1.069 nm、g=123.58o,相当于密度为1.48。B-型淀粉的晶格为a=b=1.85 nm、c=1.04 nm、g=120o,密度为1.41。中心孔道中有36 个水分子。从这些数据看,A-型、B-型淀粉双螺旋结构的十字区横截面面积可以估算为2.1 nm2和3.0 nm2。双螺旋结构的体积为分别为15 nm3和26 nm3。
由于晶格结构与水分子数目不同等方面的原因,X射线衍射图谱显示3 种不同的特征性X射线衍射,即A-型、B-型、C-型,另外在特定条件下还会呈现V-型。大多数谷物淀粉都呈现A-型图谱,块茎类淀粉或直链淀粉含量较高的淀粉呈现B-型图谱;C-型图谱表现出A-型与B-型混合图谱的特征,存在于大多数豆类植物淀粉中;V-型图谱主要存在于直链淀粉和脂肪酸的复合物、磷酸单酯以及糊化后的淀粉。烹饪后,面团的X射线衍射图谱不同于A、B、C-型[84],于是以德语“Verkleisterter starke”(糊化)命名为V-型。
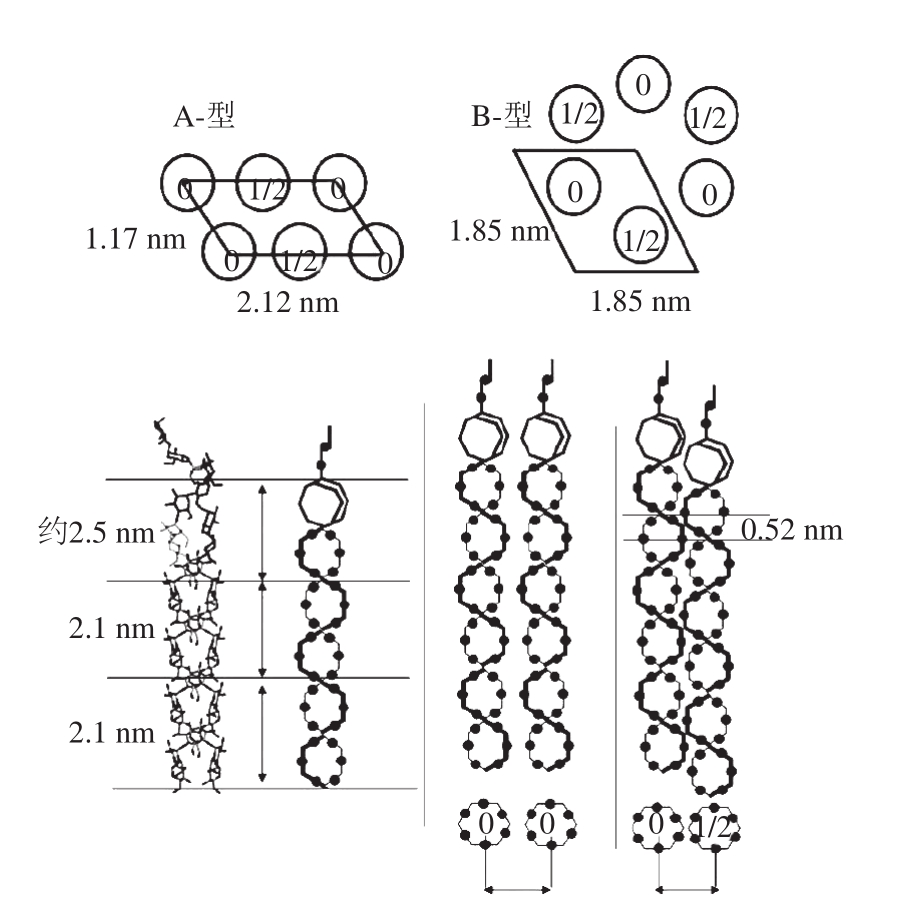
图13 A-型、B-型淀粉单位晶格结晶结构排列的3D结构
Fig. 13 Unit cell contents of A- and B-type 3D structures in their crystalline arrangements
A-型和B-型淀粉都是由平行排列的左手双螺旋构成,主要区别在于双螺旋的聚集方式上。A-型结构中链淀粉与支链淀粉相对独立的存在于淀粉中,B-型结构中链淀粉与支淀粉缠绕在一起,这种天然的相互缠绕,给分子间相互作用提供了更多的机会[84-85]。B-型结构中,左手双螺旋平行聚集,构成六方体形,中心部位充满36 个结构水;A-型结构比较紧凑,双螺旋占据中心部位,中心仅有8 个结构水,如图14所示。固态13C核磁共振结果显示,为A-型C-1峰为三重峰,而B-型则是双峰,说明A-型结构的重复单元是麦芽三糖单元,而B-型重复单元则是麦芽二糖[86]。

图14 A-型淀粉和B-型淀粉直链淀粉分子连接方式示意图[19,85]
Fig. 14 A- and B-type polymorphs of amylose[19,85]
伴随着X射线衍射,电子衍射及分子模型[76-77]的应用及小分子低聚糖的结晶研究[87-88],A-型及B-型结晶结构的3D结构已经很清楚。A-型淀粉的结晶结构又通过对单个微米级单晶同步加速辐射法进行微衍射,确定了水分子的位置在A-型结晶密度为1.622处[89]。
B-型淀粉(如马铃薯淀粉)容易在湿冷的条件下形成,A-型淀粉(如谷物类淀粉)则容易在温暖干燥的条件下形成。DP在10~12之间易形成A-型淀粉,而DP>12容易形成B-型淀粉,这可能主要由于不同长度的链在经历结晶过程中损失的熵不同造成。原淀粉同质异晶的转变及球晶的形成可以通过现场同步加速X射线衍射的方法检测。C-型淀粉可认为是A-型和B-型两种淀粉类型成分混合形成[19,56]。
4 结 语
近年来,在不断进步的现代分析仪器和技术的帮助下,对淀粉的宏观及微观结构已经有很大进展。淀粉颗粒不同结构水平已大致被掌握,但对于颗粒3D细观结构的了解仍然有限,模型还远达不到仅从结构就可以推测出功能的水平,对淀粉颗粒结构在计算机辅助下进行结构优化设计是将淀粉的宏观定量方法与颗粒细观结构设计相结合的必要手段;因此,细观结构进行计算机模拟设计的基本方法将会成为今后的重点发展趋势。
参考文献:
[1] CAI J W, YANG Y, MAN J M, et a1. Structural and functional properties of alkali-treated high-amylose rice starch[J]. Food Chemistry, 2014, 14(5): 245-253.
[2] VEELAERT S, POLLING M, DE WIT D. Structural and physicochemical changes of potato starch along periodate oxidation[J].Starch-Stärke, 1995, 47: 263-268.
[3] 张楚汉, 唐欣薇, 周元德, 等. 混凝土细观力学研究进展综述[J]. 水力发电学报, 2015, 34(12): 1-18.
[4] 廖丽莎, 刘宏生, 刘兴训, 等. 淀粉的微观结构与加工过程中相变研究进展[J]. 高分子学报, 2014(6): 761-773.
[5] HIZUKURI S, TAKEDA Y, YASUDA M, et al. Multi-branched nature of amylose and the action of debranching enzymes[J].Carbohydrate Research, 1981, 94: 205-213.
[6] SINGH N, SINGH S, ISONO N, et al. Diversity in amylopectin structure, thermal and pasting properties of starches from wheat varieties/lines[J]. International Journal of Biological Macromolecules,2009, 45: 298-304.
[7] HIZUKURI S. Polymodal distribution of the chain lengths of amylopectins, and its significance[J]. Carbohydrate Resarch, 1986,147: 342-347.
[8] HOOVER R. Composition, molecular structure, and physicochemical properties of tuber and root starches: a review[J]. Carbohydrate Polymers, 2001, 45: 253-267.
[9] TAKEDA Y, HIZUKURI S, JULIANO B O. Structures of rice amylopectins with low and high affinities for iodine[J]. Carbohydrate Research, 1987, 168: 79-88.
[10] TAKEDA Y, SHIBAHARA S, HANASHIRO I. Examination of the structure of amylopectin molecules by fluorescent labeling[J].Carbohydrate Research, 2003, 338: 471-475.
[11] KOZLOV S, KRIVANDIN A, SHATALOVA O V, et al. Structure of starches extracted from near-isogenic wheat lines[J]. Journal of Thermal Analysis and Calorimetry, 2007, 87: 575-584.
[12] KOZLOV S S, BLENNOW A, KRIVANDIN A V, et al. Structural and thermodynamic properties of starches extracted from GBSS and GWD suppressed potato lines[J]. International Journal of Biological Macromolecules, 2007, 40: 449-460.
[13] MORRISON W R, LAIGNELET B. An improved colorimetric procedure for determining apparent and total amylose in cereal and other starches[J]. Journal of Cereal Science, 1983, 1: 9-20.
[14] MORRISON W R, GADAN H. The amylose and lipid contents of starch granules in developing wheat endosperm[J]. Journal of Cereal Science, 1987, 5: 263-275.
[15] BOYER C D, LIU K C. The interaction of endosperm genotype and genetic background. part I. differences in chromatographic profiles of starches from nonmutant and mutant endosperms[J]. Starch-Stärke,1985, 37: 73-79.
[16] RING S G, L’ANSON K, MORRIS V J. Static and dynamic light scattering studies of amylose solutions[J]. Macromolecules, 1985, 18:182-188.
[17] BANKS W, GREENWOOD C, MUIR D. Studies on starches of high amylose content. part 17. a review of current concepts[J]. Starch-Stärke, 1974, 26: 289-300.
[18] TAKEDA Y, MARUTA N, HIZUKURI S. Structures of amylose subfractions with different molecular sizes[J]. Carbohydrate Research,1992, 226: 279-285.
[19] BULÉON A, COLONNA P, PLANCHOT V, et al. Starch granules:structure and biosynthesis[J]. International Journal of Biological Macromolecules, 1998, 23: 85-112.
[20] PEAT S, WHELAN W, THOMAS G J. Evidence of multiple branching in waxy maize starch[J]. Journal of the Chemical Society,1952: 4546-4548.
[21] HANASHIRO I, TAGAWA M, SHIBAHARA S, et al. Examination of molar-based distribution of A, B and C chains of amylopectin by fluorescent labeling with 2-aminopyridine[J]. Carbohydrate Research,2002, 337: 1211-1215.
[22] PARKER R, RING S G. Aspects of the physical chemistry of starch[J].Journal of Cereal Science, 2001, 34: 1-17.
[23] BERTOFT E, PIYACHOMKWAN K, CHATAKANONDA P, et al.Internal unit chain composition in amylopectins[J]. Carbohydrate Polymers, 2008, 74: 527-543.
[24] KOIZUMI K, FUKUDA M, HIZUKURI S. Estimation of the distributions of chain length of amylopectins by high-performance liquid chromatography with pulsed amperometric detection[J]. Journal of Chromatography A, 1991, 585: 233-238.
[25] BERTOFT E. On the nature of categories of chains in amylopectin and their connection to the super helix model[J]. Carbohydrate Polymers,2004, 57: 211-224.
[26] HANASHIRO I, MATSUGASAKO J, EGASHIRA T, et al. Structural characterization of long unit-chains of amylopectin[J]. Journal of Applied Glycoscience, 2005, 52: 233-237.
[27] HANASHIRO I, ITOH K, KURATOMI Y, et al. Granule-bound starch synthase I is responsible for biosynthesis of extra-long unit chains of amylopectin in rice[J]. Plant and Cell Physiology, 2008, 49: 925-933.
[28] THURN A, BURCHARD W. Heterogeneity in branching of amylopectin[J]. Carbohydrate Polymers, 1985, 5: 441-460.
[29] BENDER H, SIEBERT R, STADLER-SZÖKE A. Can cyclodextrin glycosyltransferase be useful for the investigation of the fine structure of amylopectins? characterisation of highly branched clusters isolated from digests with potato and maize starches[J]. Carbohydrate Research, 1982, 110: 245-259.
[30] FINCH P, SEBESTA D W. The amylase of Pseudomonas stutzeri as a probe of the structure of amylopectin[J]. Carbohydrate Research, 1992,227: C1-C4.
[31] BERTOFT E. Composition of building blocks in clusters from potato amylopectin[J]. Carbohydrate Polymers, 2007, 70: 123-136.
[32] BERTOFT E, KOCH K, ÅMAN P. Building block organisation of clusters in amylopectin from different structural types[J]. International Journal of Biological Macromolecules, 2012, 50: 1212-1223.
[33] BERTOFT E. Composition of clusters and their arrangement in potato amylopectin[J]. Carbohydrate Polymers, 2007, 68, 433-446.
[34] KONG X, CORKE H, BERTOFT E. Fine structure characterization of amylopectins from grain amaranth starch[J]. Carbohydrate Research,2009, 344: 1701-1708.
[35] LAOHAPHATANALEART K, PIYACHOMKWAN K, SRIROTH K, et al. The fine structure of cassava starch amylopectin. part 1:organization of clusters[J]. Inter-National Journal of Biological Macromolecules, 2010, 47: 317-324.
[36] GÉRARD C, PLANCHOT V, COLONNA P, et al. Relationship between branching density and crystalline structure of A- and B-type maize mutant starches[J]. Carbohydrate Research, 2000, 326: 130-144.
[37] BERTOFT E, ZHU Q, ANDTFOLK H, et al. Structural heterogeneity in waxy-rice starch[J]. Carbohydrate Polymers, 1999, 38: 349-359.
[38] HANASHIRO I, ABE J, HIZUKURI S. A periodic distribution of the chain length of amylopectin as revealed by high-performance anion-exchange chromatography[J]. Carbohydrate Research, 1996,283: 151-159.
[39] GIDLEY M J, BOCIEK S M. Molecular organization in starches: a carbon 13 CP/MAS NMR study[J]. Journal of the American Chemical Society, 1985, 107: 7040-7044.
[40] HOOVER R, VASANTHAN T. The effect of annealing on the physicochemical properties of wheat, oat, potato and lentil starches[J].Journal of Food Biochemistry, 1994, 17: 303-325.
[41] PÉREZ S, BERTOFT E. The molecular structures of starch components and their contribution to the architecture of starch granules: a comprehensiv review[J]. Starch-Stärke, 2010, 62: 389-420.
[42] LANSKY S, KOOI M, SCHOCH T J. Properties of the fractions and linear subfractions from various starches[J]. Journal of the American Chemical Society, 1949, 71: 4066-4075.
[43] ZAVAREZE E R, DIAS A R G. Impact of heat-moisture treatment and annealing in starches: a review[J]. Carbohydrate Polymers, 2011,83: 317-328.
[44] GELDERS G G, DUYCK J P, GOESAERT H, et al. Enzyme and acid resistance of amylose-lipid complexes differing in amylose chain length, lipid and complexation temperature[J]. Carbohydrate Polymers,2005, 60: 379-389.
[45] VASANTHAN T, BHATTY R. Physicochemical properties of small-and large-granule starches of waxy, regular, and high-amylose barleys[J]. Cereal Chemistry, 1996, 73: 199-207.
[46] DE PILLI T, DEROSSI A, TALJA R, et al. Study of starch-lipid complexes in model system and real food produced using extrusioncooking technology[J]. Innovative Food Science & Emerging Technologies, 2011, 12: 610-616.
[47] YUSUPH M, TESTER R F, ANSELL R, et al. Composition and properties of starches extracted from tubers of different potato varieties grown under the same environmental conditions[J]. Food Chemistry,2003, 82: 283-289.
[48] DEBET M R, GIDLEY M J. Three classes of starch granule swelling:influence of surface proteins and lipids[J]. Carbohydrate Polymers,2006, 64: 452-465.
[49] XIE L, CHEN N, DUAN B, et al. Impact of proteins on pasting and cooking properties of waxy and non-waxy rice[J]. Journal of Cereal Science, 2008, 47: 372-379.
[50] SANDHU K S, SINGH N. Some properties of corn starches II:physicochemical, gelatinization, retrogradation, pasting and gel textural properties[J]. Food Chemistry, 2007, 101: 1499-1507.
[51] BLASZCZAK W, BIDZINSKA E, DYREK K, et al. Effect of high hydrostatic pressure on the formation of radicals in maize starches with different amylose content[J]. Carbohydrate Polymers, 2008, 74: 914-921.
[52] MACGREGOR A W, BALLANCE D L. Hydrolysis of large and small starch granules from normal and waxy barley cultivars by alphaamylases from barley malt[J]. Cereal Chemistry, 1980, 57: 397-402.
[53] HAN X Z, HAMAKER B R. Location of starch granule-associated proteins revealed by confocal laser scanning microscopy[J]. Journal of Cereal Science, 2002, 35: 109-116.
[54] IMBERTY A, CHANZY H, PÉREZ S, et al. New three-dimensional structure for A-type starch[J]. Macromolecules, 1987, 20: 2634-2636.
[55] IMBERTY A, CHANZY H, PÉREZ S, et al. The double-helical nature of the crystalline part of A-starch[J]. Journal of Molecular Biology, 1988, 201: 365-378.
[56] WHISTLER R L, BEMILLER J, PASCHALL E F. Starch: chemistry and technology[M]. New York: Academic Press, 2009: 1-25.
[57] ANGELLIER-COUSSY H, PUTAUX J L, MOLINA-BOISSEAU S,et al. The molecular structure of waxy maize starch nanocrystals[J].Carbohydrate Research, 2009, 344: 1558-1566.
[58] WAIGH T A, HOPKINSON I, DONALD A M, et al. Analysis of the native structure of starch granules with X-ray microfocus diffraction[J]. Macromolecules, 1997, 30: 3813-3820.
[59] GALLANT D J, BOUCHET B, BULÉON A, et al. Physical characteristics of starch granules and susceptibility to enzymatic degradation[J]. Europea Journal of Clinical Nutrition, 1992, 46: 3-16.
[60] BERTOFT E. Lintnerization of two amylose-free starches of A- and B-crystalline types, respectively[J]. Starch-Stärke, 2004, 56: 167-180.
[61] HOOVER R, HUGHES T, CHUNG H J, et al. Composition, molecular structure, properties, and modification of pulse starches: a review[J].Food Research International, 2010, 43: 399-413.
[62] GIDLEY M J. Factors affecting the crystalline type (A-C) of native starches and model compounds: a rationalisation of observed effects in terms of polymorphic structures[J]. Carbohydrate Research, 1987, 161: 301-304.
[63] O’SULLIVAN A C, PÉREZ S. The relationship between internal chain length of amylopectin and crystallinity in starch[J].Biopolymers, 1999, 50: 381-390.
[64] THOMPSON D B. On the non-random nature of amylopectin branching[J]. Carbohydrate Polymers, 2000, 43: 223-239.
[65] MANLEY R S J. Chain folding in amylose crystals[J]. Journal of Polymer Science Part A: General Papers, 1964, 2: 4503-4515.
[66] YAMASHITA Y. Single crystals of amylose V complexes[J]. Journal of Polymer Science Part A: General Papers, 1965, 3: 3251-3260.
[67] YAMASHITA Y, MONOBE K. Single crystals of amylose V complexes. III. crystals with 81 helical configuration[J]. Journal of Polymer Science Part A-2: Polymer Physics, 1971, 9: 1471-1481.
[68] OOSTERGETEL G T, VAN BRUGGEN E F J. Crystalline domains in potato starch granules are arranged in a helical fashion[J].Carbohydrate Polymers, 1993, 21: 7-12.
[69] WAIGH T A, GIDLEY M J, KOMANSHEK B U, et al. The phase transformations in starch during gelatinisation: a liquid crystalline approach[J]. Carbohydrate Research, 2000, 328: 165-176.
[70] OOSTERGETEL G T, VAN BRUGGEN E F J. On the origin of a low angle spacing in starch[J]. Starch-Stärke, 1989, 41: 331-335.
[71] BALDWIN P M, ADLER J, DAVIES M C, et al. High resolution imaging of starch granule surfaces by atomic force microscopy[J].Journal of Cereal Science, 1998, 27: 255-265.
[72] BAHNASSEY Y A, BREENE W M. Rapid visco-analyzer (RVA)pasting profiles of wheat, corn, waxy corn, tapioca and amaranth starches (A. hypochondriacus and A. cruentus) in the presence of konjac flour, gellan, guar, xanthan and locust bean gums[J]. Starch-Stärke, 1994, 46: 134-141.
[73] RIDOUT M J, PARKER M L, HEDLEY C L, et al. Atomic force microscopy of pea starch granules: granule architecture of wildtype parent, r and rb single mutants, and the rrb double mutant[J].Carbohydrate Research, 2003, 338: 2135-2147.
[74] BAKER A A, MILES M J, HELBERT W. Internal structure of the starch granule revealed by AFM[J]. Carbohydrate Research, 2001,330: 249-256.
[75] HELBERT W, CHANZY H. The ultrastructure of starch from ultrathin sectioning in melamine resin[J]. Starch-Stärke, 1996, 48: 185-188.
[76] PÉREZ S, BALDWIN P M, GALLANT D J. Starch chemistry and technology[M]. Amsterdam: Elsevier, 2009: 101-107.
[77] GALLANT D J, BOUCHET B, BALDWIN P M. Microscopy of starch: evidence of a new level of granule organization[J].Carbohydrate Polymers, 1997, 32: 177-191.
[78] ATKIN N J, ABEYSEKERA R M, CHENG S L, et al. An experimentally-based predictive model for the separation of amylopectin subunits during starch gelatinization[J]. Carbohydrate Polymers, 1998, 36: 173-192.
[79] TAKEDA Y, SHITAOZONO T, HIZUKURI S. Structures of subfractions of corn amylose[J]. Carbohydrate Research, 1990, 199: 207-214.
[80] BLANSHARD J M V, BATES D R, MUHR A H, et al. Small-angle neutron scattering studies of starch granule structure[J]. Carbohydrate Polymers, 1984, 4: 427-442.
[81] BULÉON A, VÉRONÈSE G, PUTAUX J L. Self-association and crystallization of amylose[J]. Australian Journal of Chemistry, 2007,60: 706-718.
[82] FRENCH D. Organization of starch granules[M]// WHISTLER R L,BEMILLER J, PASCHALL E F. Starch: chemistry and technology.New York: Academic Press, 1984: 183-247.
[83] MIAO M, ZHANG T, JIANG B. Characterisations of kabuli and desi chickpea starches cultivated in China[J]. Food Chemistry, 2009, 113:1025-1032.
[84] ZOBEL H F. Molecules to granules: a comprehensive starch review[J].Starch-Stärke, 1988, 40: 44-50.
[85] KNUTSON C A. Annealing of maize starches at elevated temperatures[J]. Cereal Chemistry, 1990, 67: 376-384.
[86] IMBERTY A, BULEON A, TRAN V, et al. Recent advances in knowledge of starch structure[J]. Starch-Stärke, 1991, 43: 375-384.
[87] IMBERTY A, PÉREZ S. A revisit to the three-dimensional structure of B-type starch[J]. Biopolymers, 1988, 27: 1205-1221.
[88] PANGBORN W, LANGS D, PÉREZ S. Regular left-handed fragment of amylose: crystal and molecular structure of methyl-[alpha]-maltotrioside, 4H2O[J]. International Journal of Biological Macromolecules, 1985, 7: 363-369.
[89] POPOV D, BULÉON A, BURGHAMMER M, et al. Crystal structure of A-amylose: a revisit from synchrotron microdiffraction analysis of single crystals[J]. Macromolecules, 2009, 42: 1167-1174.