儿茶素类化合物是茶叶中的主要功能成分,占茶叶干质量的12%~24%。茶树中儿茶素类化合物主要包括儿茶素(catechin,C)、表儿茶素(epicatechin,EC)、没食子儿茶素(gallocatechin,GC)、表没食子儿茶素(epigallocatechin,EGC)、儿茶素没食子酸酯(catechin gallate,CG)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)及表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)8 种单体[1]。为众所知,儿茶素具有抗炎症、抗菌、抗病毒及抗氧化等效用[2-3],其中,EGCG抗氧化性最为突出,可通过清除活性氧簇(reactive oxygen species,ROS)、NO或与ROS反应生成稳定化合物的方式有效平衡人体内自由基[4]。随着对儿茶素研究愈加深入,更多药理功能被发现,儿茶素可通过调节相关酶活性或与相关酶蛋白特异性结合抑制癌细胞增殖,诱导癌细胞凋亡,但不同儿茶素单体间存在明显差异[5-8];儿茶素还可预防心脑血管疾病[9]以及保护肾脏、肝脏和神经系统等[10]。由于儿茶素存在脂溶性低、稳定性差、在人体内利用率低等缺点,大大限制了其开发应用。因此,研究人员希望通过酶法、化学法、微生物法等对儿茶素进行结构修饰以提高其药效及生物利用率[11-12]。
表1 儿茶素的结构
Table 1 Structures of catechins
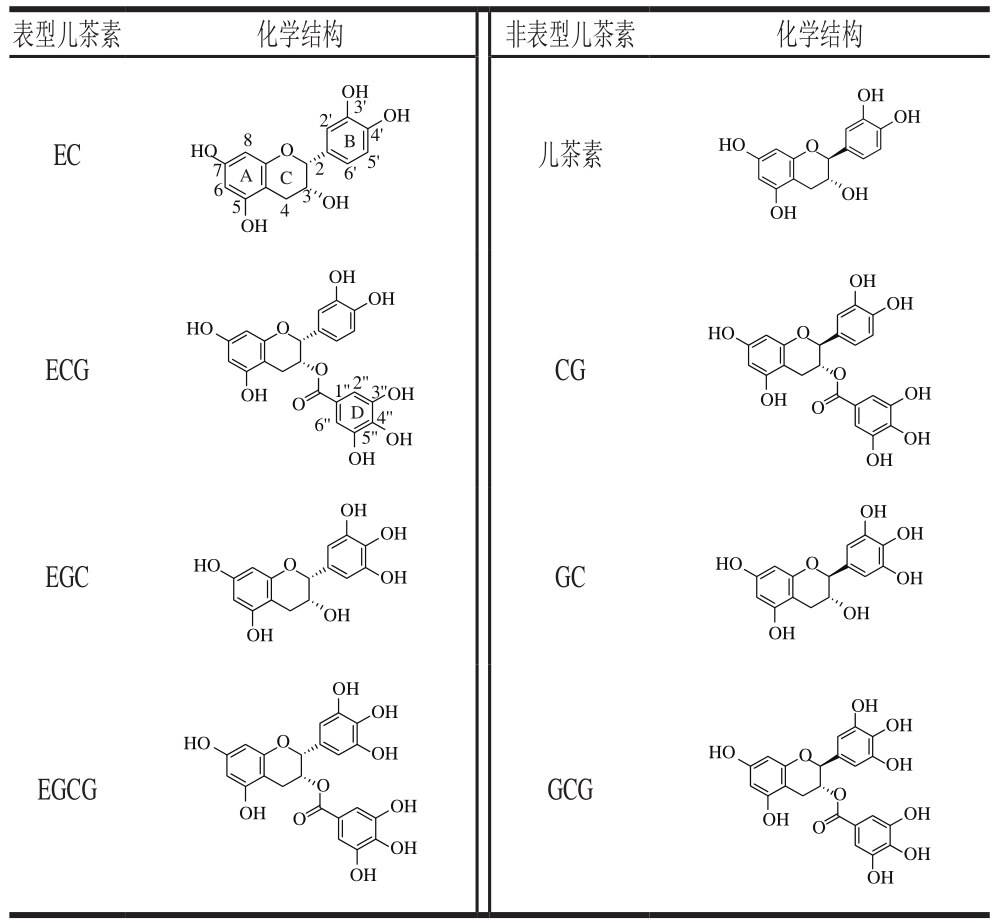
注:结构中数字表示碳键位置;A、B、C、D表示不同碳环。
1 儿茶素生物合成
儿茶素类化合物具有2-苯基苯并二氢吡喃结构,属于黄烷醇类化合物。根据夏涛[13-14]、宛晓春[15]等的总结,儿茶素在茶树中生物合成主要由莽草酸途径、苯丙烷途径、非酯型儿茶素合成、酯型儿茶素合成这4 部分组成(图1)。在莽草酸途径中,戊糖磷酸途径产生的4-磷酸赤藓糖(erythrose 4-phosphate,E4P)和糖酵解途径产生的磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)在3-脱氧-D-7-磷酸阿拉伯庚酮糖酸合成酶(3-deoxy-D-arabino-heptulosonate 7-phosphate synthase,DAHPS)作用下合成3-脱氧-D-7-磷酸阿拉伯庚酮糖酸(3-deoxy-D-arabino-heptulosonate 7-phosphate,DHAP),接着在其他酶作用下连续反应得到芳基氨基酸、维生素、木质素、酚类物质、生物碱等产物[16];其中,苯丙氨酸在苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)作用下进入苯丙烷途径,合成得到对香豆酰CoA。1 分子对香豆酰CoA与3 分子丙二酰CoA在查耳酮合成酶(chalcone synthase,CHS)作用下合成柚皮素查耳酮,并在查耳酮异构酶(chalcone isomerase,CHI)作用下环化得到柚皮素。查耳酮是儿茶素、花青素等化合物合成的重要前体物质,是儿茶素类化合物基础分子骨架,这种O1和C2连接形成吡喃环的方式为儿茶素化学合成提供了重要信息。柚皮素在类黄酮3’-羟化酶(flavonoid 3’-hydroxylase,F3’H)、类黄酮3’,5’-羟化酶(flavonoid 3’,5’-hydroxylase,F3’,5’H)作用下分别在B环引入了一个和两个羟基得到黄烷酮,随后被黄烷酮3-羟化酶(flavonoid 3-hydroxylase,F3H)和二氢黄烷醇4-还原酶(dihydroflavonol 4-reductase,DFR)催化还原合成无色花青素。无色花青素可被还原酶(leucoanthocyanidin reductase,LAR)直接还原得到非表型儿茶素,即儿茶素和GC[17],也可被花青素合成酶(anthocyanidin synthase,ANS)和花青素还原酶(anthocyanidin reductase,ANR)连续催化得到表型儿茶素EC和EGC[18];有同位素标记实验发现,EC和EGC之间也可能存在相互转化机制。
酯型儿茶素是茶树中主要儿茶素,有研究者推测酯型儿茶素是由非酯型儿茶素没食子酯化得到,但并未被实验证实。Niemezt[19]、Gross[20]等认为1-O-没食子酰-β-葡萄糖是单宁合成的有效酰基供体和受体;Liu Yajun等[21]在此基础上证实:儿茶素没食子酰基化过程与水解单宁合成途径具有相似性,即1-O-没食子酰-β-葡萄糖是酯型儿茶素合成的酰基直接供体,EC和EGC在尿苷二磷酸葡萄糖-没食子酰基-1-O-β-D-葡萄糖转移酶(UDG-galloyl-1-O-β-D-glucose transferase,UGGT)和表儿茶素-1-O-没食子酰基-β-D-没食子酰基转移酶(EC-1-O-galloyl-β-D-gallic acyltransferase,ECGT)作用下合成酯型儿茶素;与之对应,酯型儿茶素也会在酯型儿茶素水解酶(galloylated catechin hydrolase,GCH)作用下转变成非酯型儿茶素EC和EGC[22-23]。
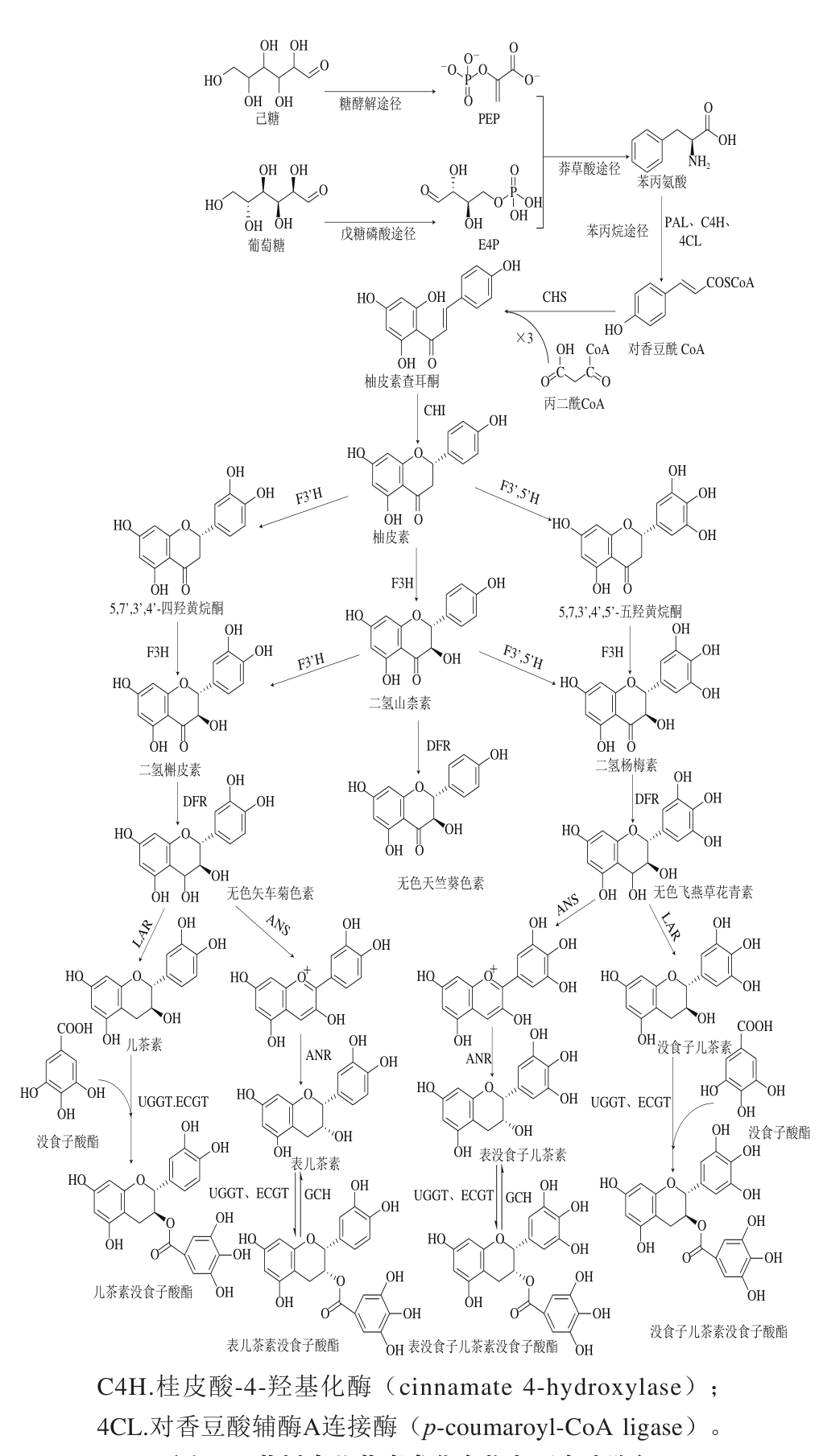
图1 茶树中儿茶素类化合物主要合成路径
Fig. 1 Major synthesis pathways of catechins in Camellia sinensis (L.) O. Ktze
2 儿茶素化学合成
迄今为止,黄烷醇化学合成路径可归纳为两种,一种源于儿茶素生物合成,即O1-C2间直接醚化成环,但所得产物结构大多为反式;另一种途径则是C4与苯环上桥碳连接环化,该方法可同时得到顺式和反式产物,与反应前体构型有很大关系[24-25]。
2.1 O1-C2环化
该方法与儿茶素生物合成途径很相似,选用不同原料进行反应可得到不同取代的查耳酮衍生物,将其环化还原后即得到不同结构儿茶素衍生物[26](图2)。Sundeep等[27]以槲皮素作为原料经羟基保护/去保护、还原后得到外消旋EC和儿茶素,并申请了专利。若用戴斯-马丁氧化剂(Dess-Martin periodinane,DMP)将C3羟基氧化成酮基,再经还原反转羟基位置即可得到其差向异构体;此外,在化学合成中,没食子酰氯和酸酐等也可与简单儿茶素酯化得到酯型儿茶素及儿茶素衍生物(图2)。
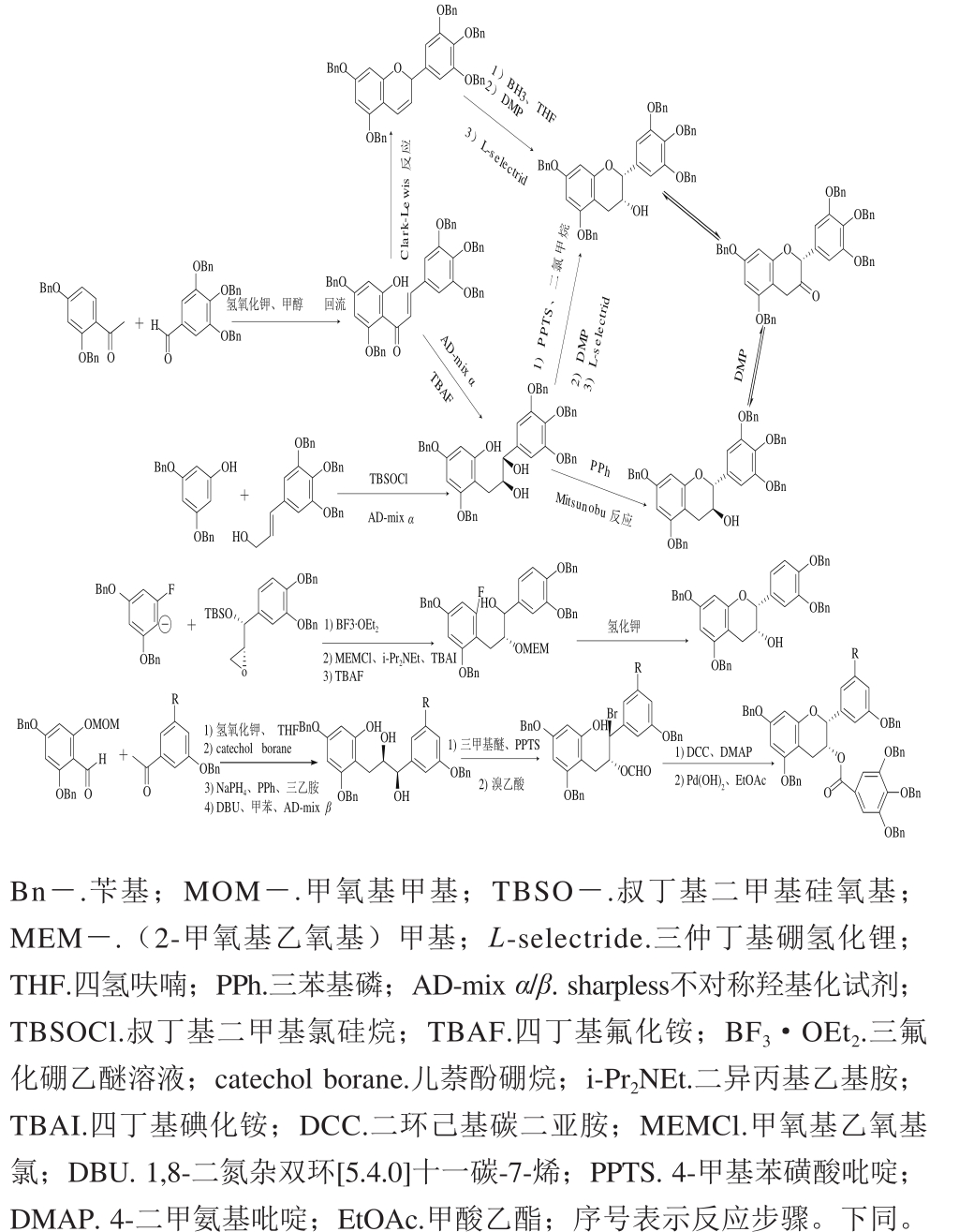
图2 O1-C2的环化
Fig. 2 Cyclization at O1-C2
2.2 C4-桥碳环化
与O1-C2环化相同,C4-桥碳环化首先形成二氢吡喃环结构,经氢化还原后得到儿茶素产物。相对O1-C2环化来说,C4-桥碳环化所需原料更少,图3列举了两种较为常见的合成途径[24-25,28-29]。
Tanaka等[24]将芳基烯丙醇用MnO2氧化后与巯基乙醇反应得到S,O-缩醛,在间氯过氧苯甲酸(3-chloroperbenzoic acid,m-CPBA)和N-溴代琥珀酰亚胺(1-bromo-2,5-pyrrolidinedione,NBS)相继作用下得到溴醇;溴醇不仅可以与2-溴-3,5-苄氧基苯酚直接反应得到顺式产物a,在碱性条件时溴醇经环氧反应后产生立体异构,与2-溴-3,5-苄氧基苯酚反应后还可得到反式产物b。顺式产物a和反式产物b分别在三氟乙酸酐(trifluoroacetic anhydride,TFAA)和三乙基硅烷(triethylsilane,Et3SiH)作用下发生亲电芳基环化得到外消旋的EGCG和GCG(图4)。
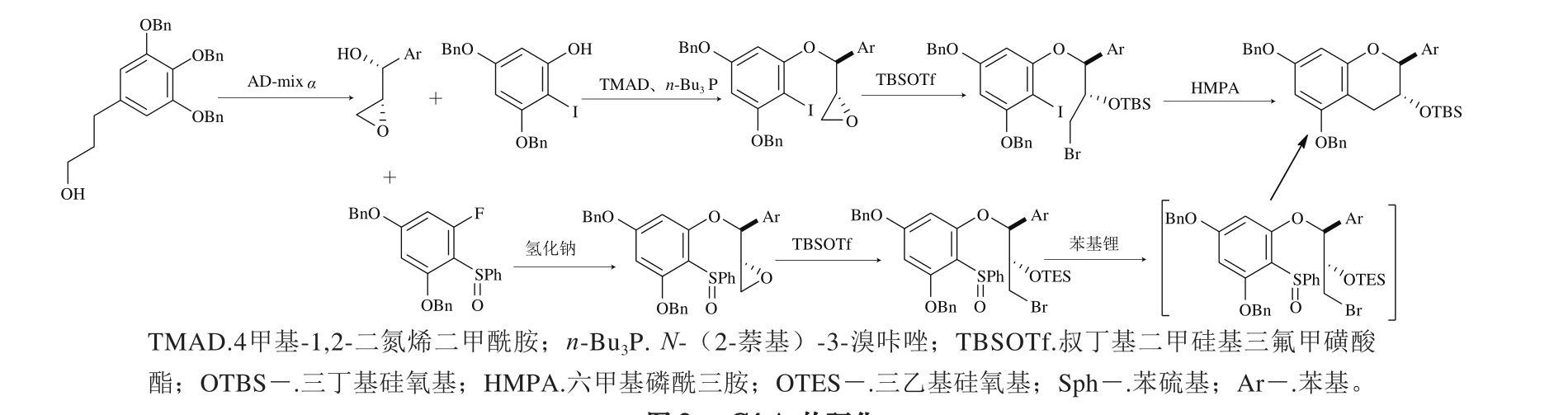
图3 C4-Ar的环化
Fig. 3 Cyclization at C4-Ar
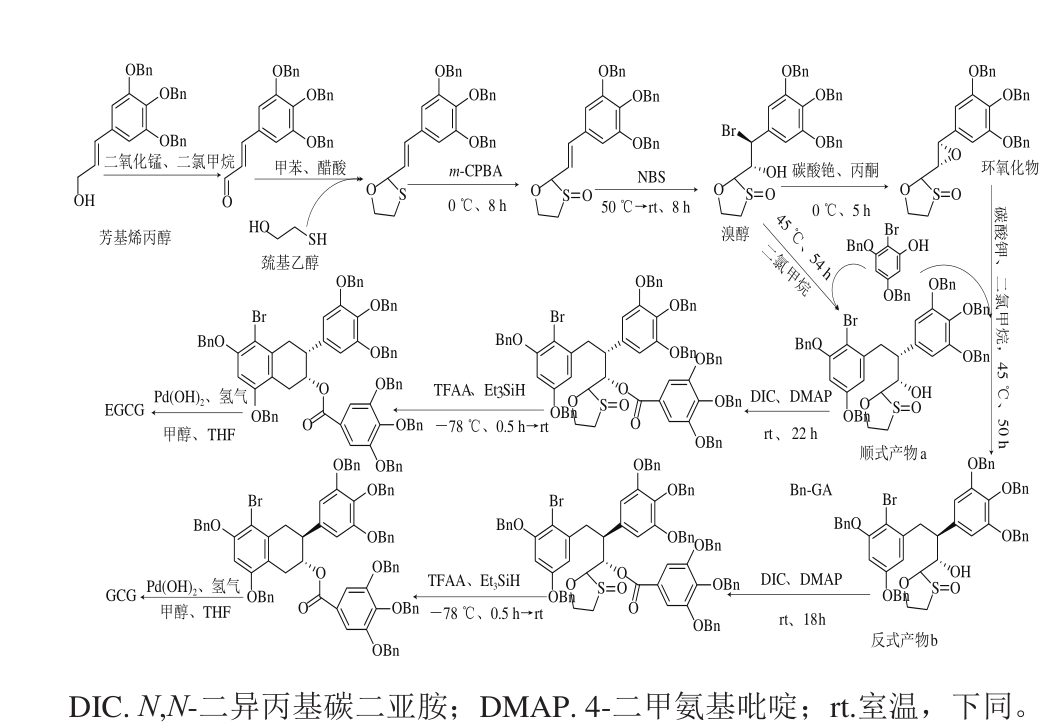
图4 儿茶素的化学合成
Fig. 4 Chemical synthesis of catechins
3 儿茶素衍生物的合成
3.1 酶法修饰
相对于化学修饰严格的反应条件和复杂多样的产物来说,酶法修饰反应条件更加温和,具有高度选择性,但产率相比较低。
3.1.1 烷基化修饰
目前,儿茶素烷基修饰主要是对羟基进行甲基化取代。研究人员在茶树鲜叶和动物血液、肝脏和尿液中发现多种甲基儿茶素,这是由于生物体本身存在儿茶素甲基转移酶(catechin-O-methyltransferase,COMT)[30-33]。在动物体中,COMT多存在于肝脏组织和小肠中,Okushio等[34]用大鼠肝脏组织匀浆和S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)对EGC、ECG分别进行体外甲基化实验,得到4’-甲基-EGC和4’’-甲基-ECG,而在(+)-C存在条件下,EGC、ECG甲基化过程被抑制。吕海鹏等[35-36]从大肠杆菌中提取得到EGCG-O-甲基转移酶(EGCG-O-methyltransferase,EOMT),用其催化EGCG反应得到10余种甲基化产物。其最佳反应条件为:温度35 ℃、pH 7.5、2 mmol/L MgCl2和2 mmol/L二硫苏糖醇(dithiothreitol,DTT)、0.4 mmol/L S-腺苷甲硫氨酸对甲苯磺酸盐(S-adenosyl methionine p-toluenesulfonate,SAM-pTS)。大量研究表明,植物源COMT大多优先甲基化C3’或C3’’,而动物源酶优先在C4’或C4’’进行甲基化。甲基儿茶素抗肿瘤活性虽然降低,但有研究发现,甲基儿茶素对肝癌细胞Bel-7402和肝癌多药耐药细胞Bel-7402/5-FU具有细胞毒性,且随着烷基化数目增多而增强[37];另外,全甲基儿茶素还对肿瘤多药耐药性具有较强的逆转作用,其中,酯型衍生物的作用相对更强[38]。儿茶素强抗氧化性源于酚羟基,当羟基被取代后,儿茶素衍生物抗氧化性随之减弱,根据不同取代位置,其改变也不尽相同,其中B环羟基被取代的影响最大。另一方面,甲基儿茶素还具有突出的抗过敏活性,可有效缓解过敏性鼻炎症状[39-40]。
3.1.2 酰基化修饰
儿茶素酰基化修饰大多由脂肪酶催化完成。李哲[41]和Zhu Song[42-43]等将儿茶素与乙酸乙烯酯以物质的量比1∶1在乙腈中用脂肪酶催化反应得到多种不同乙酰化儿茶素。赵峰等[44]利用Candida antarctica Novozym 435脂肪酶在叔戊醇中催化EGCG与丁酸乙烯酯反应,成功在EGCG分子结构中引入四碳链烷基;霍清等[45]将没食子儿茶素分别与月桂酸、硬脂肪酸按比例溶于正丁醇中,并加入Novozym 435脂肪酶催化反应,经色谱柱分离纯化得到相应酰化产物。赵峰等[44]认为酶促反应产物与溶剂有很大关联,不仅需要对酶具有很好溶解性,还要有良好疏水性。Patti[46]和Mori[47]等分别用不同来源脂肪酶催化儿茶素与不同碳链长度酸酐或酰氯反应得到了多种酰基化产物。
随着脂肪链的引入,儿茶素衍生物脂溶性明显增强,透过生物膜的能力也随之增强,其抗癌效果显著提升;但随着脂肪链长度增加,长碳链将会屏蔽周围酚羟基并增大其空间位阻,此外,长碳链的聚集也同样会抑制脂肪链的进一步引入[48]。
3.1.3 糖苷化修饰
儿茶素虽然具有很多亲水性羟基,但在水中溶解度并不高,通过引入一个或数个亲水性糖苷基团可有效提高其水溶性。在动植物体中,儿茶素和甲基儿茶素都可被糖苷化,Okushio等[49]在大鼠尿液和胆汁中检测到(-)-EC-5-β-葡糖苷酸和(-)-3’-甲基-EC-5-β-葡糖苷酸。另外,Romanov-Michailidis通过液相和质谱手段在服用50 mg(-)-EC的人体的血液、尿液、肠液和胆汁中检测到两种糖苷化产物、两种硫酸酯化产物和5 种甲基化硫酸酯化产物,但具体结构还未能被解析,其生理功能也不清楚[50]。
研究人员从肠系膜明串珠菌中提取得到蔗糖磷酸化酶(sucrose phosphorylase,SPase)和葡萄糖基转移酶(glucose transferase,GTFs)[51],用其分别催化儿茶素与蔗糖反应后得到7 种儿茶素-α-吡喃葡萄糖苷,具体为(+)-C-3’-α-D-吡喃葡萄糖苷、EGCG-7-α-D-吡喃葡萄糖苷、EGCG-4’-α-D-吡喃葡萄糖苷、EGCG-7,4’-α-D-吡喃葡萄糖苷)、EGCG-4’’-α-D-吡喃葡萄糖苷、EGCG-4’,4’’-α-D-吡喃葡萄糖苷、EGCG-7,4’’-α-D-吡喃葡萄糖苷;由于空间位阻差异,对不同儿茶素的催化效率也不相同,其由高到低排列顺序依次为:(-)-EGC=(+)-C>(-)-EC>(-)-ECCG>(-)-ECG[52]。Funayama等[53]从浸麻芽孢杆菌中提取得到环糊精葡聚糖转移酶(cyclodextrin glycosyltransferase,CGTase),催化淀粉与(+)-C反应同样得到(+)-C-3’-α-D-吡喃葡萄糖苷。
Aramsangtienchai等[54]从类芽孢杆菌中分离得到β-环糊精葡聚糖转移酶(β-cyclodextrin glycosyltransferase,β-CGTase),用其催化(-)-EC和β-环糊精反应,在不同反应时间下,分别得到(-)-EC-3’-O-α-D-吡喃葡萄糖苷、(-)-EC-3’-O-α-D-二吡喃葡萄糖苷、(-)-EC-3’-O-α-D-三吡喃葡萄糖苷和(-)-EC-4’-O-α-D-吡喃葡萄糖苷这4 种糖苷化产物,具体结构见图5。
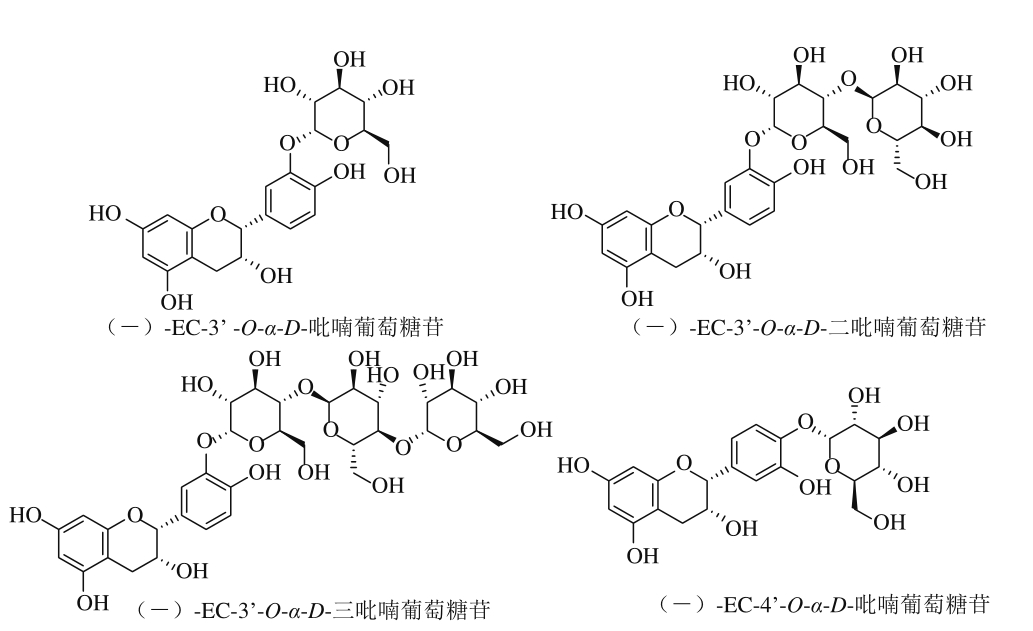
图5 4 种糖苷产物结构式
Fig. 5 Structures of 4 glycosylation products
Cho等[55]从中度嗜热菌中提取蔗糖淀粉酶基因并在大肠杆菌中成功表达,得到重组的蔗糖淀粉酶(deinococcus geothermalis,DAGS),其催化蔗糖与(+)-C反应得到(+)-C-3’-α-D-吡喃葡萄糖苷和(+)-C-3’-α-麦芽糖苷,这种转糖基反应对DAGS浓度具有正相关依赖性。另外,通过制备型高效液相色谱和麦芽糖淀粉酶消化实验还发现另一种糖苷衍生物(+)-C-3’-α-麦芽低聚糖。
Moon等[52]发现,糖苷化儿茶素抗氧化活性与糖苷基团取代位置有关,但由于羟基被取代,相对儿茶素本身并未增强甚至有所降低;随着儿茶素衍生物水溶性增强,还可以与细胞中多余的自由基结合,促进细胞新陈代谢[56];Kitao等[51]研究发现,糖苷化儿茶素对细胞内酪氨酸酶具有很强抑制性,在光照条件下可有效防止褐变。
3.2 化学修饰
一般来说,化学修饰产率较高,但其产物成分复杂,分离难度较大。
3.2.1 醚化修饰
儿茶素醚化修饰是指在酚羟基及C3醇羟基位置引入烷基链,两者以醚键连接。其中,在酚羟基位置修饰按反应路径可分为直接醚化和间接醚化,直接醚化是指儿茶素与甲基供体进行一步合成反应,其操作简便,但产物复杂,不利于分离纯化;间接醚化则是先对羟基进行保护,虽然步骤较多,但反应副产物较少,纯度较高[40]。
3.2.1.1 酚羟基直接醚化
吕海鹏等[57-59]以CH3I作为甲基供体与EGCG直接反应,实验验证,EGCG上8 个酚羟基都可被甲基化,其中,C4’’酚羟基优先被取代。除了CH3I外,常用甲基供体还有硫酸二甲酯和重氮甲烷;伍妍俊等[60]通过控制硫酸二甲酯和EGCG比例选择性合成得到4’’-甲基-EGCG(图6);Yanase等[61]用重氮甲烷作为甲基供体在乙醚中与EGCG反应得到3’-甲基-EGCG、4’-甲基-EGCG、3’’-甲基-EGCG、4’’-甲基-EGCG、3’’,5’’-二甲基-EGCG,通过光照实验发现,B环甲基化产物稳定性明显强于D环甲基化产物。
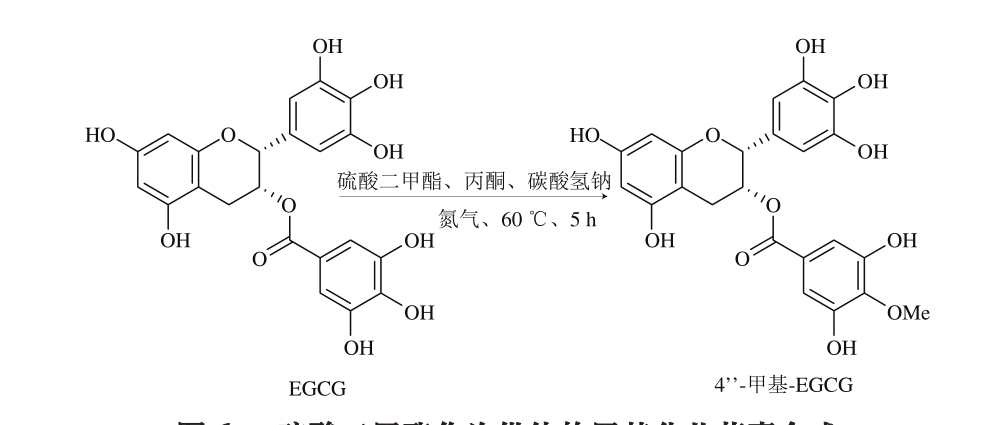
图6 硫酸二甲酯作为供体的甲基化儿茶素合成
Fig. 6 Synthesis of methylated EGCG with Me2SO4 as a donor
3.2.1.2 酚羟基间接醚化
间接醚化通常由从头合成得到羟基被保护的儿茶素,在此基础上引入烷基,常用的保护基团有苄基和硝基苯磺酰基。Zaveri[62]用3,4,5-三甲氧基苯甲酰氯对苄基保护的GC进行酰化,经还原后得到3’’,4’’,5’’-三甲基-GCG。另一方面,苄基化GC被DMP和三仲丁基硼氢化锂(L-selectride)反转C3羟基位置后得到其立体异构产物,与上述相同处理后得到3’’,4’’,5’’-三甲基-EGCG(图7)。GCG及EGCG甲基化产物对乳腺癌细胞系具有抑制作用,虽然EGCG甲基化产物抗癌活性比GCG甲基化产物稍强,但都低于EGCG本身[62]。Lai Ronghui等[63]用苄基保护的EGC与对甲基化没食子酸发生酯化反应,同样得到4’’-甲基-EGCG。
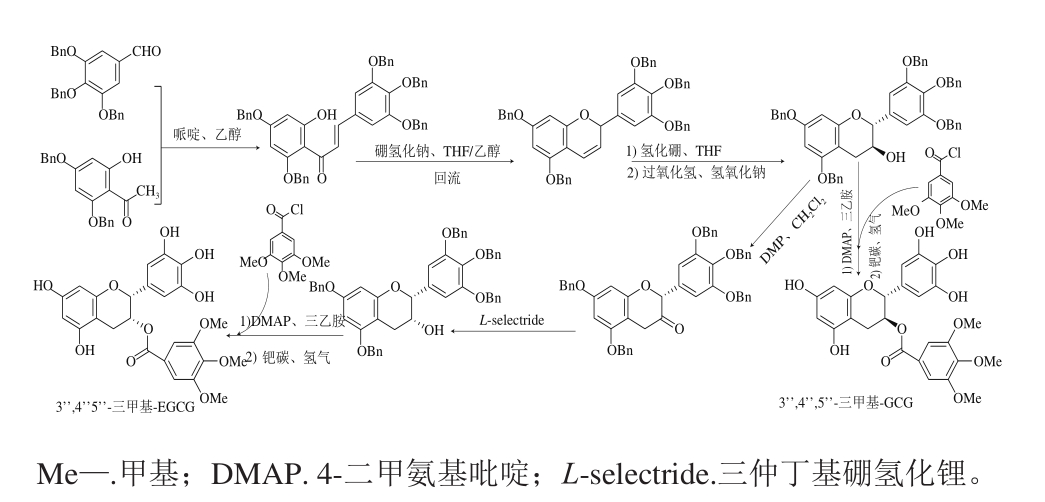
图7 甲基化儿茶素的从头合成
Fig. 7 De novo synthesis of methylated catechins
Aihara[64]和Asakawa[65]等用2-硝基苯磺酰基对儿茶素和没食子酸部分羟基进行选择性保护,在剩余羟基上引入甲基,两者在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP)作用下发生酯化得到5 种甲基化EGCG衍生物,分别是3’’-甲基-EGCG、4’-甲基-EGCG、3’’-甲基-EGCG、4’’-甲基-EGCG和3’,3’’-二甲基-EGCG。
3.2.1.3 C3-醇羟基醚化
Park等[66]用苄基对(+)-C的酚羟基进行保护,在氢氧化铯和四丁基碘化铵(tetrabutylammonium iodide,TABI)作用下与不同结构卤代烃反应,经还原得到一系列醇醚化合物(图8)。该产物对革兰氏阳性菌、阴性菌以及致病性真菌都具有较强抗性,其中(+)-3-癸基-C的效果最为明显;这可能是由于长链烷基增强了儿茶素脂溶性,从而增强对菌体磷脂化膜的干扰能力。
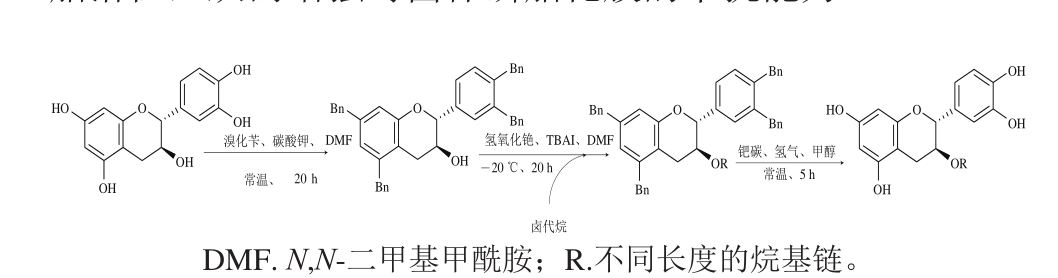
图8 苄基保护的C3醚化反应
Fig. 8 Bn-protected (+)-C acylation reaction at alcoholic hydroxyl group
3.2.2 酯化修饰
与醚化修饰相同,儿茶素酯化修饰可发生在所有酚羟基和C3醇羟基上,常以酰氯或酸酐形式作为供体;其中,乙酰基在反应中还常用作保护基团对活性羟基进行选择性保护。
在不同反应条件下,酯化位置也会发生改变。Hong Shan等[67]以(+)-C为原料,在不同酸碱条件下与月桂酰氯反应合成得到3-月桂酰基-(+)-C、5-月桂酰基-(+)-C、7-月桂酰基-(+)-C、3’-月桂酰基-(+)-C、4’-月桂酰基-(+)-C 5 种不同取代产物。在(+)-C的四氢呋喃溶液中加入吡啶和少量DMAP会促进C环上C3酰化产物的生成;加入Na2CO3和二甲基二氯化锡提供酸性反应环境会促进B环上羟基的酰化;而对B、C环上羟基进行保护后加入对甲基苯磺酸则会促进A环上酚羟基的酰化。抗氧化实验发现,B环酰基化产物清除自由基能力最弱,A环C7酰基化产物清除自由基能力则最强,说明B环酚羟基对儿茶素清除自由基能力贡献最大。
Lin Shufu等[68]用叔丁基二甲基硅基(tert-butyldimethylsilyl,TBDMS)对EGCG进行保护后,将酯键水解后得到受保护的EGC,在DMAP和二环己基碳二亚胺(N,N’-dicyclohexylcarbodiimide,DCC)作用下,EGC与不同长度和构型的羧酸反应得到一系列的C3酰化产物;Utevona等[69]在室温下用DMAP催化EGCG与乙酸酐、丙酸酐、丁酸酐反应同样得到了一系列酰化产物。陈平[70]和孙东[71]等将EGCG分别与棕榈酰氯和肉豆蔻酰氯反应,用高速逆流色谱纯化后得到EGCG-4’-棕榈酸酯和EGCG-4’-肉豆蔻酸酯。
除了酰氯和酸酐外,使用其他供体也可以得到相应的酰化产物。Osanai等[72]在常温下用对氨基苯甲酸作为供体与苄基保护的EGC在DMAP作用下反应20 h,得到酯型儿茶素衍生物EGC-3-对氨基苯甲酸酯和EGC-3-对氨基苯甲酸酯-6,8,3’’,4’’,5’’-五乙酸酐(图9)。其中,EGC-3-对氨基苯甲酸酯对蛋白酶体具有较强抑制性,而全乙酰化对氨基取代衍生物甚至可诱导癌细胞凋亡。
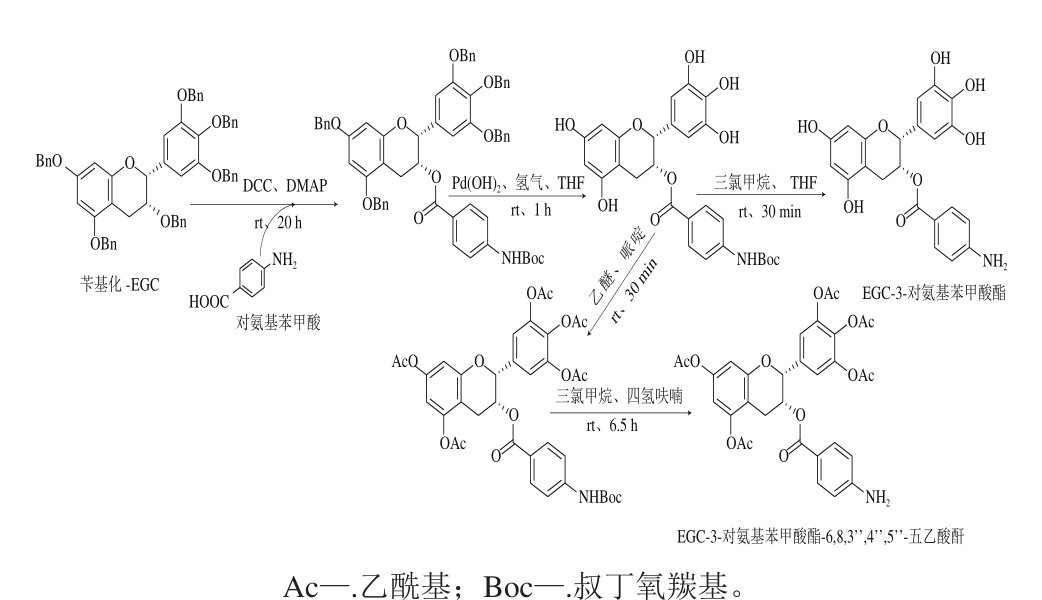
图9 EGC-3-对氨基苯甲酸酯-6,8,3’’,4’’,5’’-五乙酸酐的合成
Fig. 9 Synthesis of EGC-3-p-aminobenzoic acid ester-6,8,3’,4’,5’-acetic anhydride
Lin Shufu[68]、陈平[70]等的研究证明,在一定长度脂肪链酯化儿茶素中,随着饱和碳链碳原子数目增加,衍生物抗氧化活性和抗病毒能力随之增强,其中十六碳儿茶素棕榈酸酯效果最好。
3.2.3 碳烃化修饰
儿茶素碳烃修饰一般发生在C-4、6、8及没食子酸非羟基部分,其修饰基团可多种多样。Dutta等[73]在EC的C4位置引入间苯二酚和间苯三酚以增加酚羟基数目,结果显示,随着酚羟基数目的增加,衍生物对核糖核酸酶A抑制活性逐渐增强,说明酚羟基数目对儿茶素活性有很大影响;此外,实验还发现化合物4-(2,4,6-间苯三酚)-EC和4-(2,4-间苯二酚)-EC还可以抑制由血管生长素导致的血管生长。
Fudouji等[74]将(+)-C和(-)-EGCG分别与烯丙醇、天然醛类(如:反式-2-乙烯醛、柠檬醛、香茅醛、香叶醇和叶绿醇等)在25~100 ℃条件下加热反应,实验分离得到11 种衍生物,其中,不饱和醛类的饱和碳原子常与儿茶素A环C6或C8连接成键,不饱和碳则与C5或C7上羟基形成醚键从而环化;烯丙醇等其他醇类在A环或B环也发生同样反应,这些儿茶素衍生物在疏水条件下表现出强清除自由基能力。
Cruz等[75]对羟基用硅烷基保护后,通过控制叔丁基二甲基硅基氯(tertbutyldimethylsilyl chloride,TBDMSCl)用量,反应得到两种硅烷基化产物a和b(图10),两者区别在于4位醇羟基氢取代与否,用溴取代C8位置氢原子后,在钯和生物活性磷作用下与乙烯基硼酸频哪醇酯发生铃木交叉耦合,去保护基团后得到8-乙烯基-(+)-C(图10)。Bernini等[76]用硫酸二甲酯对儿茶素酚羟基进行甲基化保护,将A环C8碘化取代后,化合物58在钯和生物活性磷作用下与芳基化合物发生铃木交叉耦合反应得到C8芳基取代化合物8-苯基-5,7,3’,4’-四甲基-O-(+)-C和8-苯基-5,7,3’,4’-四甲基-O-(-)-EC(图11)。
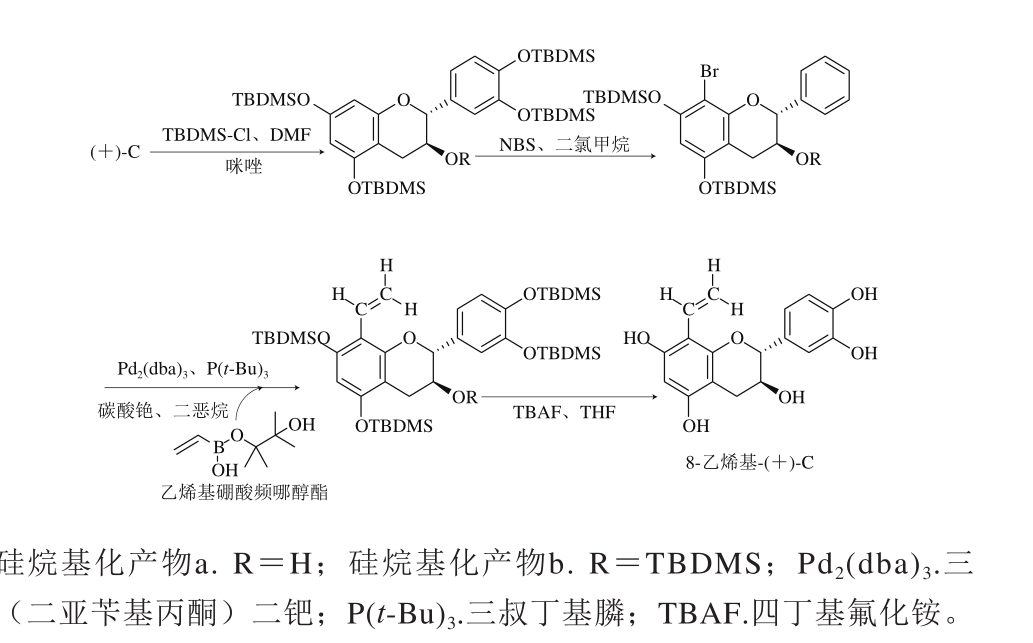
图10 C8乙烯基取代
Fig. 10 Vinyl substitution at C8-H
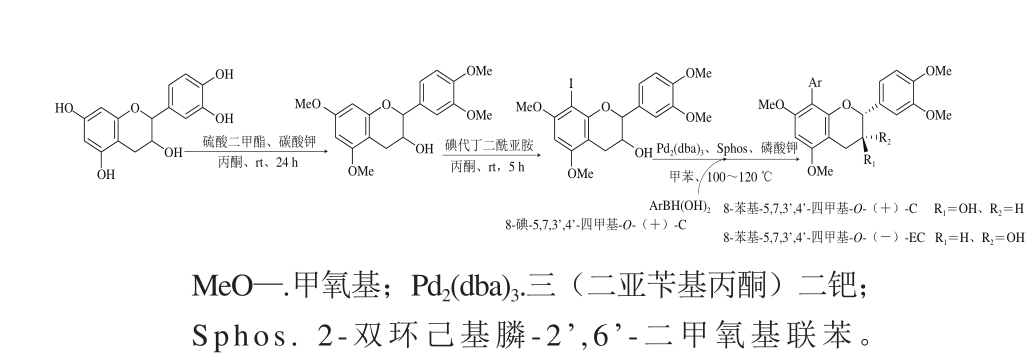
图11 C8芳基取代反应途径
Fig. 11 Aryl substitution at C8-H
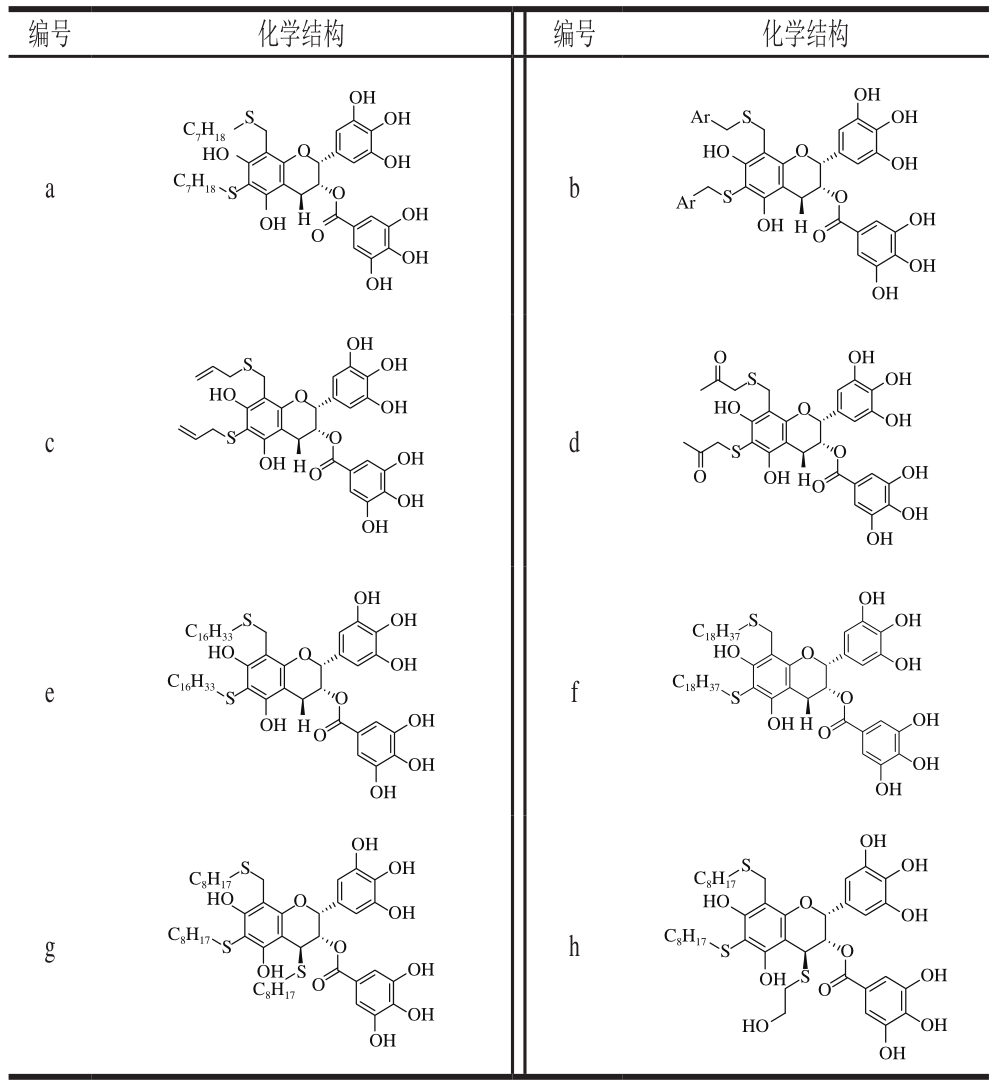
Tanaka等[77]以EGCG为底物,与硫醇化物在80 ℃下加热2~4 h,经Sephadex LH-20凝胶色谱柱分离纯化得到6 种C6、C8取代物(表2,化合物a~f)。而将多聚原花青素降解物用辛硫醇按相同方法处理后可以得到另外2 种4-硫醇-EGCG(表2,化合物g、h)。
表2 硫醇化修饰产物结构
Table 2 Structure of mercaptan modification
3.2.4 糖苷化修饰
糖苷化儿茶素化学合成步骤常常比较复杂,Mull等[78]将1-(2,4,6-三羟基苯基)-1-乙酮和3,4-二羟基苯甲醛在强碱性条件下反应得到查耳酮a(图12),接着用硼氢化钠和氯化铈还原并用叔丁基二甲基氯硅烷(tertbutyldimethylsilyl chloride,TBSCl)对羟基进行保护,在AD-mix α作用下发生Sharpless不对称双羟基化反应得到化合物b(图12),化合物b形成吡喃环后在DMP作用下生成酮,经还原后发生立体异构得到EC衍生物,最后与2,3,4-三-O-乙酰基-α-D-葡糖醛酸甲酯三氯乙酰亚氨酸酯反应,得到4’-甲基-O-(-)-EC-7-葡萄糖苷(化合物c,表3)、4’-甲基-O-(-)-EC-5-葡萄糖苷(化合物d,表3)、4’-甲基-O-(-)-EC-3’-葡萄糖苷(化合物e,表3)、3’-甲基-O-(-)-EC-7-葡萄糖苷(化合物f,表3)和(-)-EC-7-葡萄糖苷(化合物g,表3)。
传统方法得到的儿茶素糖苷化物一般由儿茶素直接衍生或直接合成,这种方法产率较低。Romanov-Michailidis等[50]选用新戊基氯硫酸盐作为磺化试剂并采用反向去保护,即先氢解再用Na3N除去新戊基,得到了(-)-EC-3’-β-葡萄糖苷、(-)-EC-4’-β-葡萄糖苷、(-)-EC-3’-亚硫酸钠酯。Zhang Xin等[79]以D-葡萄糖和EGCG为底物合成得到2,3,4,6-四氧乙酰基-5-α-D-溴吡喃葡萄糖,在与EGCG反应后得到EGCG-4’’-β-D-吡喃葡萄糖苷和EGCG-4’,4’’-β-D-吡喃葡萄糖苷。
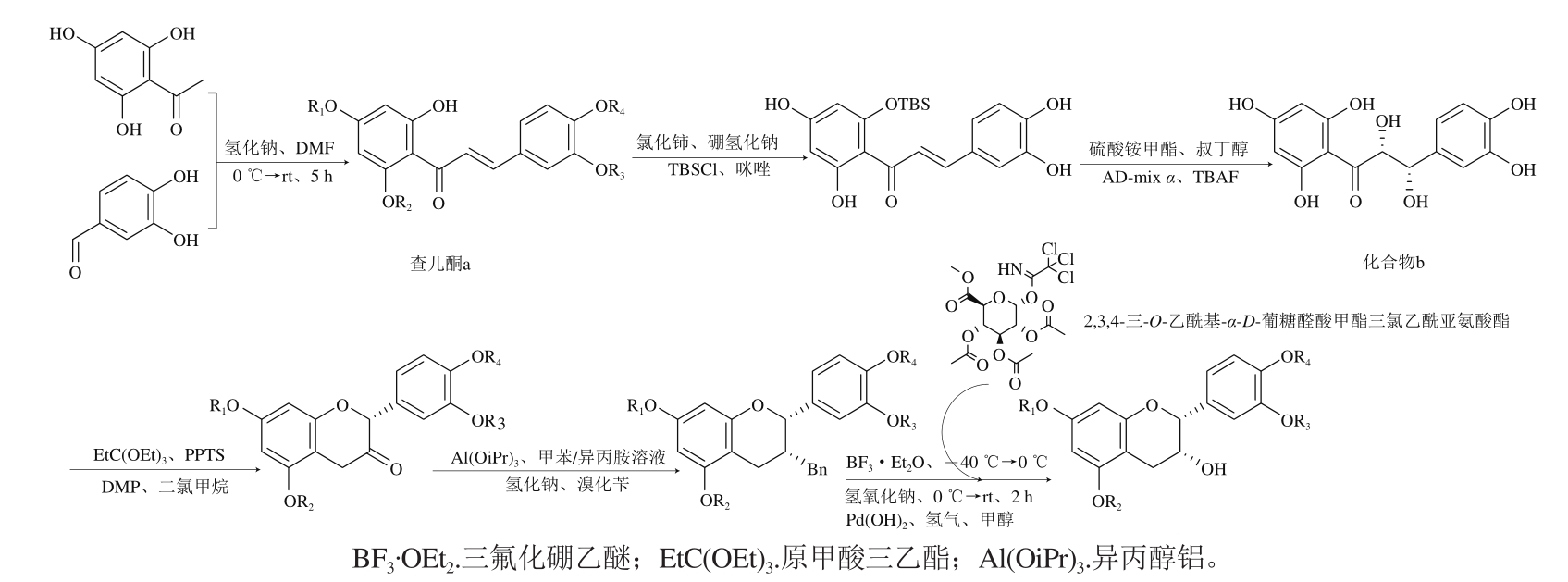
图12 糖苷化EC的合成路径
Fig. 12 Preparation of glycosylated epicatechin
表3 (-)-EC葡萄糖苷化合物结构
Table 3 Structures of (-)-EC glucoside compounds

3.2.5 其他修饰
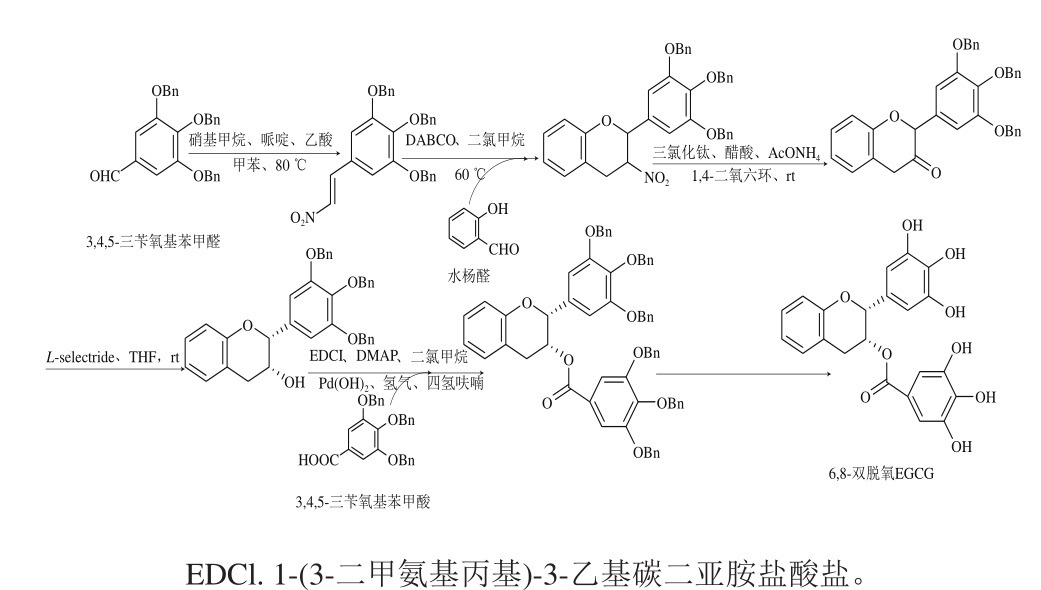
图13 双脱氧EGCG合成路径
Fig. 13 Double deoxygenation EGCG
Furuta等[80]用3,4,5-三苄氧基苯甲醛、硝基甲烷和水杨醛在1,4-二氮杂二环[2.2.2]辛烷(1,4-diazabicyclo[2.2.2]octane;triethylenediamine,DABCO)、DMAP和乙酸铵(ammonium acetate,NH4OAc)等催化作用下合成得到一种C6、C8双脱氧EGCG(图13),其与Yoshida等[29]的实验表明6,8-双脱氧EGCG比EGCG具有更强的抗流感病毒活性。Yoshida等[29]用苯基四唑-砜、苯乙醛和烷基硼酸为原料,通过Mitsunobu反应在酸性条件下闭合吡喃环并与没食子酸酯化合成前体化合物,然后在氨基端引入荧光基团TG,即得到了化合物a(图14)。化合物a在细胞中能发出强烈的荧光,可作为分子探针用来研究EGCG在生物体内的动力学特征、胞内运输以及代谢途径。
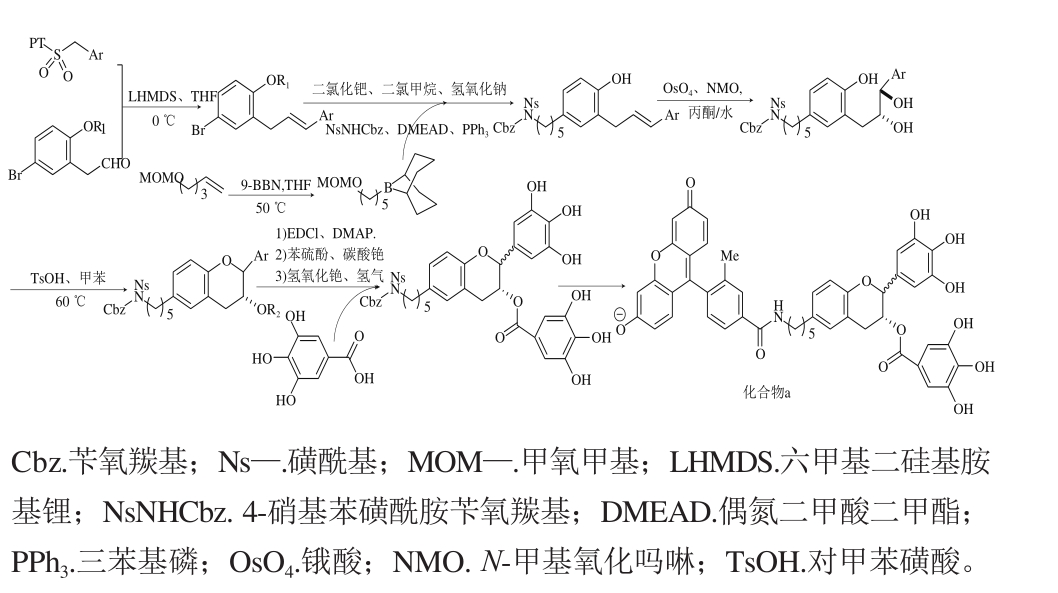
图14 Yoshida的合成路径
Fig. 14 Synthesis pathway presented by Yoshida
4 结 语
综上所述,儿茶素被甲基化修饰后,虽然抗肿瘤和抗氧化活性明显减弱,但抗过敏和逆转肿瘤细胞耐药性表现更加突出,其作用强度与甲基化位置和数目相关[81];在儿茶素结构中引入糖苷基团可显著增加其水溶性,另外,糖苷化儿茶素还可抑制酪氨酸酶活性,进而有效抵抗光照辐射引起的褐变;酰基儿茶素抗肿瘤活性和清除自由基能力显著提高,这可能是由于随着脂溶性增强,其透过细胞膜能力也随之增强,生物利用率得到明显提高[82]。
鉴于儿茶素的不稳定性,对儿茶素进行修饰是拓展儿茶素化合物应用前景的必然出路,但也还须根据不同衍生物药理特性进行有方向的研究。1)甲基化儿茶素抗过敏效用已被大量研究证实,尤其是3’-甲基-EGCG和4’-甲基-EGCG在人体内稳定性较强,具有潜在的应用价值;而酶法甲基化产率太低,因此未来可重点研究通过化学合成获得大量高纯度的3’-甲基-EGCG和4’-甲基-EGCG。2)由于小分子乙酰基取代的空间屏蔽作用很小,全乙酰化EGCG更容易穿过脂质层,其抗癌活性和生物利用率相比其他酰化产物都要强很多;此外,研究证明B环上羟基对儿茶素结构活性有很大影响[80];因此,可在全乙酰或全丁酰EGCG结构基础上对B环羟基进行取代,得到药理作用更强的衍生物。3)不同修饰带来的药效改变有相互拮抗也有相互增强,可选择性进行复合修饰,如结合多甲基儿茶素多药耐药逆转活性和酰基儿茶素强抗肿瘤活性,将大大拓展儿茶素应用空间。
参考文献:
[1] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2003: 9-15.
[2] NAKANISHI T, MUKAI K, YUMOTO H, et al. Anti-inflammatory effect of catechin on cultured human dental pulp cells affected by bacteria-derived factors[J]. Eurpean Journal of Oral Science, 2010,118(2): 145-150. DOI:10.111/j.1600-0722.2010.00714.x.
[3] NANCE C L, SIWAK E B, SHEARER W T. Preclinical development of the green tea catechin, epigallocatechin gallate, as an HIV-1 therapy[J]. Journal of Allergy and Clinical Immunology, 2009, 123(2):459-465. DOI:10.1016/j.jaci.2008.12.024.
[4] FREI B, HIGDON J V. Antioxidant activity of tea polyphenols in vivo:evidence from animal studies[J]. Journal of Nutrition, 2003, 133(10):3275-3284.
[5] KUMAR D, HARSHAVARDHAN S J, CHIRUMARRY S, et al.Design, synthesis in vitro anticancer activity and docking studies of(-)-catechin derivatives[J]. Bulletin of the Korean Chemical Society,2015, 36(2): 564-570.
[6] MANIKANDAN R, BEULAJA M, ARULVASU C, et al. Synergistic anticancer activity of curcumin and catechin: an in vitro study using human cancer cell lines[J]. Microscopy Research and Technique,2012, 75(2): 112-116. DOI:10.1002/jemt.21032.
[7] 霍远涛, 王辉. 表没食子酸儿茶素没食子酸酯的抗癌机制研究[J].实用医技杂志, 2016, 23(3): 253-255.
[8] RATHORE K, CHOUDHARY S, ODOI A, et al. Green tea catechin intervention of reactive oxygen species-mediated ERK pathway activation and chronically induced breast cell carcinogenesis[J].Carcinogenesis, 2011, 33(1): 174-183. DOI:10.1093/carcin/bgr244.
[9] 刘珊丽, 刘宗文, 卢沛琦, 等. 儿茶素对大鼠脑缺血/再灌注损伤的保护作用及机制[J]. 中国药理学通报, 2010, 26(2): 255-257.
[10] 徐先祥. 儿茶素的药理作用研究综述[J]. 郑州轻工业学院学报(自然科学版), 2012, 27(4): 60-64. DOI:10.3969/j.issn.1004-1478.2012.04.016.
[11] 于莎莎, 丁阳平, 罗赛, 等. 儿茶素衍生物合成及药理作用研究进展[J].食品科学, 2012, 33(17): 318-326.
[12] 柳敏, 饶国武, 华允芬. EGCG衍生物合成及药理活性研究进展[J].茶叶科学, 2016, 36(2): 119-130.
[13] 夏涛, 高丽萍. 类黄酮及茶儿茶素生物合成途径及其调控研究进展[J]. 中国农业科学, 2009, 42(8): 2899-2908. DOI:10.3864/j.issn.0578-1752.2009.08.031.
[14] 夏涛, 高丽萍, 刘亚军, 等. 茶树酯型儿茶素生物合成及水解途径研究进展[J]. 中国农业科学, 2013, 46(11): 2307-2320. DOI:10.3864/j.issn.0578-1752.2013.11.015.
[15] 宛晓春, 夏涛, 张正竹, 等. 茶树次生代谢[M]. 北京: 科学出版社,2015: 39-59.
[16] MAEDA H, DUDAREVA N. The Shikimate pathway and aromatic amino acid biosynthesis in plants[J]. Annual Review of Plant Biology,2012, 23(1): 73-105.
[17] STAFFORD H A, LESTER H H. Flavan-3-ol biosynthesis:the conversion of (+)-dihydromyricetin to its flavan-3,4-diol(leucodelphinidin) and to (+)-gallocatechin by reductases extracted from tissue cultures of Ginkgo biloba and Pseudotsuga menziesii[J].Plant Physiology, 1985, 78(4): 791-794. DOI:10.1104/pp.78.4.791.
[18] XIE D Y, SHARMA S B, FERREIRA D, et al. Role of anthocyanidin reductase, encoded by banyuls in plant flavonoid biosynthesis[J].Science, 2003, 299: 396-399. DOI:10.1126/science.1078540.
[19] NIEMETZ R, GROSS G G. Enzymology of gallotannin and ellagitannin biosynthesis[J]. Phytochemistry, 2005, 66(17): 2001-2011.DOI:10.1016/j.phytochem.2005.01.009.
[20] GROSS G G. From lignins to tannins: forty years of enzyme studies on the biosynthesis of phenolic compounds[J]. Phytochemistry, 2008,69(18): 3018-3031. DOI:10.1016/j.phytochem.2007.04.031.
[21] LIU Yanjun, GAO Liping, LIU Li, et al. Purification and characterization of a novel galloyltransferase involved in catechin galloylation in the tea plant (Camellia sinensis)[J]. Journal of Biological Chemistry, 2012,287(53): 44406-44417. DOI:10.1074/jbc.M112.403071.
[22] ZHONG K, SHAO Z, HONG F. Enzymatic production of epigallocatechin by using an epigallocatechin gallate hydrolase induced from Aspergillus oryzae[J]. Biotechnology Progress, 2008,24(3): 583-587. DOI:10.1021/bp070409t.
[23] ZHONG K, ZHAO S Y, JÖNSSON L J, et al. Enzymatic conversion of epigallocatechin gallate to epigallocatechin with an inducible hydrolase from Aspergillus niger[J]. Biocatalysis and Biotransformation, 2009,26(4): 306-312. DOI:10.1080/10242420802090487.
[24] TANAKA H, CHINO A, TAKAHASHI T. Reagent-controlled stereoselective synthesis of (+/-)-gallo- and (+/-)-epigallocatechin gallates[J]. Tetrahedron Letters, 2012, 53(20): 2493-2495.DOI:10.1016/j,tetlet.2012.02.065.
[25] ASAKAWA T, HAMASHIMA Y, KAN T. Chemical synthesis of tea polyphenols and related compounds[J]. Current Pharmaceutical Design, 2013, 19(34): 6207-6217.
[26] OYAMA K I, YOSHIDA K, KONDO T. Recent progress in the synthesis of flavonoids: from monomers to supra-complex molecules[J]. Current Organic Chemistry, 2011, 15(15): 2567-2607.DOI:10.2174/138527211796367354.
[27] SUNDEEP D, DINESH M, SANTOSH R K, et al. Novel approch for synthesis of catechins: WO/2014/115174(A2)[P]. 2014-01-27[2017-03-10].http://www.freepatentsonline.com/y2015/0368223.html.
[28] OHMORI K, YANO T, SUZUKI K. General synthesis of epi-series catechins and their 3-gallates: reverse polarity strategy[J]. Organic& Biomolecular Chemistry, 2010, 8(12): 2693-2670. DOI:10.1039/c003464a.
[29] YOSHIDA A, HIROOKA Y, SUGATA Y, et al. Concise synthesis of catechin probes enabling analysis and imaging of EGCg[J]. The Royal Society of Chemistry, 2011, 47(6): 1794-1796. DOI:10.1039/C0CC03676E.
[30] 曾晓雄, 高远, 张鑫, 等. 富含甲基化儿茶素茶多酚的制备方法:CN102086186A[P]. 2011-06-08[2017-03-10]. http://dbpub.cnki.net/.
[31] KIDA K, SUZUKI M, MATSUMOTO N, et al. Identification of biliary metabolites of (-)-epigallocatechin gallate in rats[J]. Journal of Agricultural and Food Chemistry, 2000, 48(9): 4151-4155.DOI:10.1021/jf000386x.
[32] MENG X F, LEE M J, LI C, et al. Formation and identification of 4’-O-methyl-(-)-epigallocatechin in humans[J]. Drug Metabolism and Disposition, 2001, 29(6): 789-793.
[33] LU H, MENG X F, YANG C S. Enzymology of methylation of tea catechins and inhibition of catechol-O-methyltransferase by(-)-epigallocatechin gallate[J]. Drug Metabolism Disposition, 2003,31(5): 572-579. DOI:10.1124/dmd.31.5.572.
[34] OKUSHIO K, SUZUKI M, MATSUMOTO N, et al. Methylation of tea catechins by rat liver homogenates[J]. Bioscience Biotechnology and Biochemistry, 1999, 63(2): 430-432. DOI:10.1271/bbb.63.430.
[35] 吕海鹏, 费冬梅, 张悦, 等. EGCG-O-甲基转移酶(EOMT)催化EGCG形成的EGCG甲基化衍生物分析[J]. 茶叶科学, 2012, 32(2): 100-106. DOI:10.13305/j.cnki.jts.2012.02.003.
[36] 吕海鹏, 费冬梅, 张悦, 等. EGCG甲基化衍生物酶促合成的反应条件研究[J]. 茶叶科学, 2012, 32(5): 441-447. DOI:10.13305/j.cnki.jts.2012.05.001.
[37] 廖作庄. 表没食子儿茶素没食子酸酯衍生物的合成与逆转人肝癌细胞MDR作用的研究[D]. 南宁: 广西医科大学, 2011: 15-26.
[38] 李福星. 甲基化儿茶素衍生物的设计合成及抗肿瘤多药耐药活性研究[D]. 青岛: 中国海洋大学, 2015: 12-22.
[39] MAEDA-YAMAMOTO M, EMA K, SHIBUICHI I. In vitro and in vivo anti-allergic effects of ‘benifuuki’ green tea containing O-methylated catechin and ginger extract enhancement[J]. Cytotechnology, 2007,55(2/3): 135-142. DOI:10.1007/s10616-007-9112-1.
[40] 伍妍俊, 汪小钢, 宛晓春. 甲基化EGCG的研究现状及展望[J]. 茶叶科学, 2010, 30(6): 407-413. DOI:10.13305/j.cnki.jts.2010.06.013.
[41] 李哲, 朱松, 王洪新. 酶法酰化儿茶素EGCG及其产物在大豆油中的抗氧化性[J]. 食品科学, 2013, 34(8): 1-5.
[42] ZHU Song, LI Yue, LI Zhe, et al. Lipase-catalyzed synthesis of acetylated EGCG and antioxidant properties of the acetylated derivatives[J]. Food Research International, 2014, 56: 279-286.DOI:10.1016/j.foodres.2013.10.026.
[43] ZHU Song, LI Yue, MA Chaoyang, et al. Optimization of lipasecatalyzed synthesis of acetylated EGCG by response surface methodology[J]. Journal of Molecular Catalysis B-Enzymatic, 2013,97: 87-94. DOI:10.1016/j.molcatb.2013.08.002.
[44] 赵峰, 阙付有, 梁京, 等. 儿茶素单体EGCG酶法修饰研究及其产物抗氧化活性评价[J]. 天然产物研究与开发, 2015, 27(3): 490-495; 533.
[45] 霍清, 杨晓芳, 缪刚. 一种3-O-儿茶素高级脂肪酸酯及其制备方法:CN103524474A[P]. 2014-01-22[2017-03-10]. http://dbpub.cnki.net.
[46] PATTI A, PIATTELLI M, NICOLOSI G. Use of Mucor miehei lipasein the preparation of long chain 3-O-acylcatechins[J]. Journal of Molecular Catalysis B: Enzymatic, 2000, 10(6): 577-582.
[47] MORI S, MIYAKE S, KOBE T, et al. Enhanced anti-influenza A virus activity of (-)- epigallocatechin-3-O-gallate fatty acid monoester derivatives: effect of alkyl chain length[J]. Bioorganic & Medicinal Chemistry Letters, 2008, 18(14): 4249-4252.
[48] 刘飞, 熊政委, 李春华, 等. 表没食子儿茶素没食子酸酯分子修饰及抗癌研究进展[J]. 食品科学, 2015, 36(23): 321-328. DOI:10.7506/spkx1002-6630-201523058.
[49] OKUSHIO K, SUZUKI M, MATSUMOTO N, et al. Identification of(-)-epicatechin metabolites and their metabolic fate in the rat[J]. Drug Metabolism and Disposition, 1999, 27(2): 309-316.
[50] ROMANOV-MICHAILIDIS F, VITON F, FUMEAUX R, et al.Epicatechin B-ring conjugates: first enantioselective synthesis and evidence for their occurrence in human biological fluids[J]. Organic Letters, 2012, 14(15): 3902-3905. DOI:10.1021/ol3016463.
[51] KITAO S, ARIGA T, TMATSUDO T, et al. The syntheses of catechin-glucosides by transglycosylation with leuconostocmesenteroides sucrose phosphorylase[J]. Bioscience Biotechnology and Biochemistry, 1993, 57(12): 2010-2015.
[52] MOON Y H, LEE J H, JHON D Y, et al. Synthesis and characterization of novel quercetin-α-D-glucopyranosides using glucansucrase from Leuconostoc mesenteroides[J]. Enzyme and Microbial Technology,2007, 40(5): 1124-1129. DOI:10.1016/j.enzmictec.2006.08.019.
[53] FUNAYAMA M, NISHINO K, HIROTA A, et al. Enzymatic-synthesis of (+)-catechin-α-glucoside and its effect on tyrosinase activity[J].Bioscience Biotechnology and Biochemistry, 1993, 57(10): 1666-1669.
[54] ARAMSANGTIENCHAI P, CHAVASIRI W, ITO K, et al. Synthesis of epicatechin glucosides by a β-cyclodextrin glycosyltransferase[J].Journasl of Molecular Catalysis B-Enzymatic, 2011, 73(1/2/3/4): 27-34. DOI:10.1016/j.molcatb.2011.07.013.
[55] CHO H K, KIM H H, SEO D H, et al. Biosynthesis of (+)-catechin glycosides using recombinant amylosucrase from Deinococcus geothermalis DSM 11300[J]. Enzyme and Microbial Technology,2011, 49(2): 246-253. DOI:10.1016/j.enzmictec.2011.05.007.
[56] 张昕, 字成庭, 王宣军. 儿茶素糖苷修饰物研究现状[J]. 中国农业信息, 2016, 3(6): 54. DOI:10.3969/j.issn.1672-0423.2016.03.039.
[57] 吕海鹏, 林智, 孙业良, 等. 一种EGCG甲基化衍生物的制备方法:CN102344432A[P]. 2012-02-08[2017-03-10]. http://dbpub.cnki.net/.
[58] 吕海鹏, 林智, 谭俊峰, 等. 茶叶中EGCG3”Me的研究与开发[J].食品工业科技, 2008, 29(12): 275-277. DOI:10.13386/j.issn.1002-0306.2008.12.065.
[59] 吕海鹏, 孙业良, 林智, 等. 表没食子儿茶素没食子酸酯的甲基化分子修饰[J]. 食品科学, 2010, 31(15): 139-142.
[60] 伍妍俊, 汪小钢, 宛晓春. 甲基化EGCG的合成及其在人工模拟胃肠液中的稳定性[J]. 安徽农业大学学报, 2010, 37(4): 688-691.DOI:10.13610./j.cnki.1672-352x.2010.04.038.
[61] YANASE E, MATSUMOTO E, SHINODA Y, et al. Synthesis of methyl derivatives of epigallocatechin gallate (EGCG) and their stabilities[J]. ITE Letters on Batteries, New Technologies and Medicine, 2005, 6(1): 34-37.
[62] ZAVERI N T. Synthesis of a 3,4,5-trimethoxybenzoyl ester analogue of epigallocatechin-3-gallate (EGCG): a potential route to the natural product green tea catechin, EGCG[J]. Organic Letters, 2001, 3(6):843-846. DOI:10.1021/ol007000o.
[63] LAI Ronghui, ZHAO Wenfang, HUANG Yahui, et al. The synthesis of methylated epigallocatechin gallate[J]. Chemistry of Natural Compounds, 2015, 51(3): 472-475. DOI:10.1007/s10600-015-1317-5.
[64] AIHARA Y, YOSHIDA A, FURUTA T, et al. Regioselective synthesis of methylated epigallocatechin gallate via nitrobenzenesulfonyl (Ns)protecting group[J]. Bioorganic & Medicinal Chemistry Letters, 2009,19(15): 4171-4174. DOI:10.1016/j.bmcl.2009.05.111.
[65] ASAKAWA T, KAWABE Y, YOSHIDA A, et al. Syntheses of methylated catechins and theaflavins using 2-nitrobenzenesulfonyl group to protect and deactivate phenol[J]. Journal of Antibiotics, 2016,69(4): 299-312. DOI:10.1038/ja.2016.14.
[66] PARK K D, CHO S J. Synthesis and antimicrobial activities of 3-O-alkyl analogues of (+)-catechin: improvement of stability and proposed action mechanism[J]. European Journal of Medicinal Chemistry, 2010, 45(3): 1028-1033. DOI:10.1016/j.ejmech.2009.11.045.
[67] HONG Shan, LIU Songbai. Targeted acylation for all the hydroxyls of (+)-catechin and evaluation of their individual contribution to radical scavenging activity[J]. Food Chemistry, 2016, 197: 415-421.DOI:10.1016/j.foodchem.2015.10.134.
[68] LIN Shufu, LIN Y H, LIN Mengju, et al. Synthesis and structureactivity relationship of 3-O-acylated (-)-epigallocatechins as 5 α-reductase inhibitors[J]. European Journal of Medicinal Chemistry,2010, 45(12): 6068-6076. DOI:10.1016/j.ejmech.2010.10.011.
[69] UTENOVA B T, MALTERUD K E, RISE F. Antioxidant activity of O-protected derivatives of (-)-epigallocatechin-3-gallate: inhibition of soybean and rabbit 15-lipoxygenases[J]. Arkivoc, 2007(9): 6-16.
[70] 陈平, 孙东, 郑小明. EGCG棕榈酸酯的制备、结构及其抗氧化活性[J].浙江大学学报(理学版), 2003, 30(4): 422-425. DOI:10.3321/j.issn.1008.9497.2003.04.016.
[71] 孙东, 陈平. EGCG肉豆蔻酸酯的制备、结构及其抗氧化活性[J].温州医学院学报, 2006, 36(3): 225-227. DOI:10.3969/j.issn.1000-2138.2006.03.014.
[72] OSANAI K, LANDIS-PIWOWAR K R, DOU Q P, et al. A para-amino substituent on the D-ring of green tea polyphenol epigallocatechin-3-gallate as a novel proteasome inhibitor and cancer cell apoptosis inducer[J]. Bioorganic & Medicinal Chemistry, 2007, 15(15): 5076-5082. DOI:10.1016/j.bmc.2007.05.041.
[73] DUTTA S, BASAK A, DASGUPTA S. Synthesis and ribonuclease A inhibition activity of resorcinol and phloroglucinol derivatives of catechin and epicatechin: importance of hydroxyl groups[J].Bioorganic & Medicinal Chemistry, 2010, 18(17): 6538-6546.DOI:10.1016/j.bmc.2010.06.077.
[74] FUDOUJI R, TANAKA T, TAGURI T, et al. Coupling reactions of catechins with natural aldehydes and allyl alcohols and radical scavenging activities of the triglyceride-soluble products[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 6417-6424.DOI:10.1021/jf9010998.
[75] CRUZ L, BORGES E, SILVA A M S, et al. Synthesis of a new(+)-catechin-derived compound: 8-vinylcatechin[J]. Letters in Organic Chemistry, 2008, 5(7): 530-536. DOI:10.2174/157017808785982211.
[76] BERNINI R, CACCHI S, DE SALVE I, et al. Synthesis of 8-arylated catechin and epicatechin derivatives via Suzuki cross-coupling[J].Tetrahedron Letters, 2007, 48(29): 4973-4976. DOI:10.1016/j.tetlet.2007.05.114.
[77] TANAKA T, KUSANO R, KOUNO I. Synthesis and antioxidant activity of novel amphipathic derivatives of tea polyphenol[J].Bioorganic & Medicinal Chemistry Letters, 1998, 8(14): 1801-1806.DOI:10.1016/S0960-894X(98)00311-4.
[78] MULL E S, VAN ZANDT M, GOLEBIOWSKI A, et al. A versatile approach to the regioselective synthesis of diverse (−)-epicatechinβ-D-glucuronides[J]. Tetrahedron Letters, 2012, 53(12): 1501-1503.DOI:10.1016/j.tetlet.2012.01.054.
[79] ZHANG Xin, WANG Jing, HU Jiangmao, et al. Synthesis and biological testing of novel glucosylated epigallocatechin gallate(EGCG) derivatives[J]. Molecules, 2016, 21(5): 1-10. DOI:10.3390/molecules21050620.
[80] FURUTA T, HIROOKA Y, ABE A, et al. Concise synthesis of dideoxy-epigallocatechin gallate (DO-EGCG) and evaluation of its anti-influenza virus activity[J]. Bioorganic & Medicinal Chemistry Letters, 2007, 17(11): 3095-3098. DOI:10.1016/j.bmcl.2007.03.041.
[81] MAEDA-YAMAMOTO M, INAGAKI N, KITAURA J, et al.O-methylated catechins from tea leaves inhibit multiple protein kinases in mast cells[J]. Journal of Immunology, 2004, 172(7): 4486-4492.
[82] 刘晓辉, 江和源, 张建勇, 等. 儿茶素酰基化修饰研究进展[J]. 茶叶科学, 2009, 29(1): 1-8. DOI:10.13305/j.cnki.jts.2009.01.007.