表1 实验所用5 株婴幼儿食品分离菌的来源及药敏结果
Table1 Sources and antibiotic resistance of five isolates from foods for infants and young children

注:R.耐药;I.中介敏感;S.敏感。
石 超1,陈怡飞1,贾振宇1,孙 怡1,郭 都1,杨保伟1,杨 华2,*,夏效东1,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.浙江省农业科学院农产品质量标准研究所,浙江 杭州 310021)
摘 要:阪崎克罗诺肠杆菌(Cronobacter sakazkaii)是一种食源性条件致病菌,它能够引起菌血症、坏死性小肠结肠炎和新生儿脑膜炎等多种疾病。本研究选取50 种植物源化合物,检测其在含C. sakazkaii培养基中抑菌圈直径及最小抑菌浓度(minimum inhibitory concentration,MIC),旨在评价植物源化合物对C. sakazakii的抑菌作用并筛查优选高效抑菌剂。结果表明:使C. sakazakii ATCC 29544培养基产生可见抑菌圈的植物源化合物有40 种,其中7 种(香芹酚、百里醌、百里酚、肉桂醛、柠檬醛、原儿茶醛和原儿茶酸)的抑菌圈平均直径不小于13 mm;在本研究选取的50 种植物源化合物中,百里酚和香芹酚对C. sakazakii有着最强的抑制作用,对9 株C. sakazkaii的MIC均为0.1~0.2 mg/mL;百里醌、肉桂醛、柠檬醛和原儿茶醛对C. sakazkaii有良好的抑菌效果,对C. sakazkaii的MIC为0.30~1.25 mg/mL;阿魏酸、绿原酸、丁香酸、硫辛酸、原儿茶酸、表儿茶素、咖啡酸、丹皮酚和菊苣酸的MIC为2.50~5.00 mg/mL。以上结果表明,部分植物源化合物对C. sakazakii有良好的抑菌作用,有潜力作为天然抑菌剂应用于食品加工、流通、贮藏过程中,从而发挥其控制C. sakazakii的作用。
关键词:阪崎克罗诺肠杆菌;植物源化合物;抑菌圈;最小抑菌浓度
克罗诺肠杆菌(Cronobacter spp.),原名为Enterobacter sakazakii,是周生鞭毛、能运动、兼性厌氧的无芽孢革兰氏阴性菌[1-2]。克罗诺肠杆菌包含7 个种,分别为阪崎克罗诺肠杆菌(C. sakazakii)、丙二酸盐克罗诺肠杆菌(C. malonaticus)、都柏林克罗诺肠杆菌(C. dublinensis)、莫金斯克罗诺肠杆菌(C. muytjensi)、尤尼沃斯克罗诺肠杆菌(C. universaIis)、康帝蒙提克克罗诺肠杆菌(C. condimenti)和苏黎世克罗诺肠杆菌(C. turicensis),其中阪崎克罗诺杆菌是引起新生儿感染的主要病原菌,它能够引起菌血症、败血症、坏死性小肠结肠炎和脑膜炎等多种疾病,致死率高达50%~80%[3-4]。阪崎克罗诺肠杆菌在自然界中广泛存在,如土壤、螫蝇、水稻、小麦、草药和香料、肉类及一些家庭常见食物中[5]。它能在低水分活度的环境中存活,这种特性使其能在婴幼儿乳粉中存活两年及以上[6]。Fei Peng等[7]对2009—2012年中国婴幼儿乳粉及婴幼儿乳粉工厂的70 份样品进行了分离鉴定,发现阪崎克罗诺肠杆菌是最主要的分离菌。
起初有研究报道阪崎克罗诺肠杆菌对包括β-内酰胺类的多种抗生素敏感,但是,近期研究报道,一些菌株对四环素、新霉素和甲氧苄啶等抗生素具有抗性[8]。耐药菌株的出现,尤其是一些多重耐药菌株在全球的流行,给预防和控制细菌感染带来诸多困难[9]。合成的食品防腐剂往往具有潜在的毒性,并且随着社会的发展进步和人民生活水平的提高,消费者对天然和有机食品的市场需求日益增长,这一现状使得寻求天然、安全、高效且又不易导致耐药性产生的天然防腐抑菌和抗感染物质成为了近年的研究热点。研究发现,可食用并且具有多种生理功能的草本植物和它们的精油提取物由于含有大量的次级代谢产物从而可以抑制或杀灭细菌、酵母和霉菌[10]。
近几年,一些研究报道了部分植物源提取物对阪崎克罗诺肠杆菌具有抑制作用,包括蓝莓花青素和市售的蓝莓果汁[11]、反式肉桂醛[12]、葡萄籽水溶性提取物和红葡萄汁[13]。然而,由于阪崎克罗诺肠杆菌研究历史较短,大量的天然植物源抑菌剂对阪崎克罗诺肠杆菌的抑制作用未进行探究,并且,目前国内外研究通常是探究不同的实验室条件或不同食品模型中天然植物源抑菌物质对阪崎克罗诺肠杆菌的抑制作用,而未对多种物质进行统一条件和标准的评价与筛选,且对部分天然植物源化合物出现重复性研究。
因此,本研究通过前期查阅文献选取了50 种包括多酚类、黄酮类、醌类、萜类和皂苷类等天然植物源化合物,通过牛津杯法测定植物源化合物对阪崎克罗诺肠杆菌的抑菌圈大小,利用琼脂稀释法测定其对阪崎克罗诺肠杆菌的最小抑菌浓度(minimal inhibitory concentration,MIC),评价筛选对阪崎克罗诺肠杆菌有高效抑菌活性的植物源物质,旨在为阪崎克罗诺肠杆菌的控制提供新的思路,也为植物源抑菌剂的开发提供基础数据。
阪崎克罗诺肠杆菌(C. sakazakii)ATCC 29544、ATCC 29004、ATCC 12868和ATCC BAA-894购于美国模式菌株收集中心(American Type Culture Collection,ATCC)。阪崎克罗诺肠杆菌分离菌株12-2、14-15、18-7、18-8和18-13由西北农林科技大学食品科学与工程学院食品微生物研究团队分离自市售婴幼儿奶粉及米粉,采用临床实验室标准化委员会(2011)标准测定并判读菌株药敏结果,确定耐药表型(表1)。
胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、胰蛋白胨大豆肉汤(tryptone soya broth,TSB) 北京陆桥技术有限公司;氨苄西林、肉桂醛、百里醌 美国Sigma公司;其他有机试剂均为国产分析纯;其余天然植物源化合物均购于成都曼思特生物科技有限公司;植物源活性物质的提取来源见表2。实验时使用TSB溶液(含体积分数0.5%的二甲基亚砜(dimethyl sulfoxide,DMSO)溶液)配制10 mg/mL植物活性物质的母液,并使用0.22 µm的硝化纤维滤膜过滤除菌备用。
表1 实验所用5 株婴幼儿食品分离菌的来源及药敏结果
Table1 Sources and antibiotic resistance of five isolates from foods for infants and young children

注:R.耐药;I.中介敏感;S.敏感。
YT-CJ-LND超净工作台 北京亚泰科隆仪器技术有限公司;TH2-312恒温摇床 上海精宏实验设备有限公司;LMQ.CE高压蒸汽灭菌锅 山东新华医疗器械有限公司;Smart SpecTMplus分光光度计 美国Bio-Rad公司;5804R低温冷冻离心机 德国Eppendorf公司;YC-260C 4 ℃冰箱 合肥美菱股份有限公司;JA2003电子天平 上海良平仪器仪表有限公司;Vortex 6漩涡仪海门市其林贝尔仪器制造有限公司。
1.3.1 菌种活化
将冻存于-80 ℃的阪崎克罗诺肠杆菌采用划线法在TSA平板上活化,挑取单菌落接种于30 mL的TSB中,将其置于37 ℃培养18 h,使细菌处于对数生长后期,培养后的菌悬液经5 000×g离心15 min,去除上清液,使用磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤菌体沉淀,反复3 次洗涤后,使用一定量的PBS悬浮菌体沉淀,测定并调整菌悬液OD600 nm至0.5,使菌悬液浓度约为108CFU/mL。
1.3.2 抑菌圈的测定
参考王娣等[14]的方法利用牛津杯法测定抑菌圈,并作略微修改。将TSA培养基溶解均匀后高压灭菌,待冷却至50 ℃左右,使用无菌移液器准确量取20 mL转移至水平放置的无菌培养皿中,培养基冷却凝固后备用。按照1.3.1节的方法制备菌悬液,测定并调整ATCC 29544菌悬液OD600 nm至0.5(约108CFU/mL),使用PBS稀释菌悬液,使菌悬液浓度约为107CFU/mL,并取100 μL菌悬液均匀涂布至TSA平板上。随后夹取灭菌且烘干的牛津杯(外径8 mm、内径6 mm、高10 mm)置于TSA平板上,使用镊子调整使牛津杯放置水平并轻轻按压,每个培养皿中均匀放置3 只牛津杯。随后向牛津杯中添加200 μL植物源化合物溶液(质量浓度为10 mg/mL)。将培养皿正置放置于37 ℃培养箱中培养24 h后,使用游标卡尺测量透明抑菌圈的直径。以不含有植物源化合物的TSB培养液(含体积分数0.5% DMSO溶液)作为阴性对照,以含有1 mg/mL氨苄西林的TSB培养液(含体积分数0.5% DMSO溶液)为阳性对照。每个植物源化合物设置3 个重复,计算平均值。
1.3.3 MIC的测定
MIC的测定参考欧洲药敏试验委员会(European Committee for Antimicrobial Susceptibility Testing,EUCAST)的方法[15],将TSA培养基溶解均匀后高压灭菌,待冷却至50 ℃左右,加入24 孔细胞培养板中,向其中加入植物源化合物溶液,使植物源化合物的质量浓度分别为5.00、2.50、1.25、1.00、0.80、0.60、0.50、0.40、0.30、0.20、0.15 mg/mL和0.10 mg/mL,吹打使植物源化合物与培养基充分混匀,每孔中培养基最终体积为500 μL,等待培养基冷却凝固。按照1.3.1节中的方法制备菌悬液,调整菌悬液浓度至OD600 nm为0.5(约108CFU/mL),吸取2 μL菌悬液接种至24 孔板各孔中央。实验以不含有植物源化合物的TSA培养基作为阴性对照,以含有1 mg/mL氨苄西林的TSA培养基作为阳性对照。将样品置于37 ℃培养24 h后观测结果,MIC为肉眼观测下,植物源化合物使阪崎克罗诺肠杆菌不生长的最小质量浓度。每个质量浓度设置3 个重复。
数据以平均值±标准差的形式表示(n=3),使用SPSS 19.0软件对数据进行统计分析。
实验对含所选取的50 种植物源化合物的阪崎克罗诺肠杆菌ATCC 29544培养基中抑菌圈直径进行了测定(表2),其中具有肉眼可见抑菌圈的植物源化合物共有40 种。其中,抑菌圈平均直径不小于13 mm的植物源化合物有:香芹酚、百里醌、百里酚、肉桂醛、柠檬醛、原儿茶醛和原儿茶酸;抑菌圈平均直径为12~13 mm的植物源化合物有:丹皮酚、阿魏酸、丁香酸和硫辛酸。抑菌圈平均直径为11~12 mm的植物源化合物有:大蒜素、绿原酸、表儿茶素、咖啡酸、菊苣酸、苦参碱和没食子酸。含其他植物源化合物培养基的抑菌圈的平均直径都小于10 mm。
在所检测的40 种植物源化合物中,香芹酚和百里酚对阪崎克罗诺肠杆菌ATCC 29544有着最强的抑制效果,二者的MIC均为0.1 mg/mL。对比天然植物源化合物对阪崎克罗诺肠杆菌ATCC 29544的抑菌圈及MIC结果发现:对阪崎克罗诺肠杆菌生成抑菌圈较大的植物源化合物,其MIC较小,两组结果较为吻合。
表2 实验中所用植物源化合物对阪崎克罗诺肠杆菌ATCC 29544的抑菌圈直径及MIC
Table2 Growth inhibition zone diameter and MIC against C. sakazakii strain ATCC 29544 of plants-derived compounds used in this work

注:NI.无抑菌圈。
对于阪崎克罗诺肠杆菌引起的肠道炎症和系统性的感染,抗生素(如头孢噻肟和庆大霉素类)是目前主要的控制手段[16]。然而抗生素治疗不仅会引起耐药菌株的出现,还会影响早产儿的肠道免疫和营养功能,并使肠道原始菌相造成破坏,导致新生儿念珠菌病的风险增大[17-18]。为增强实验结果的广泛性,在本研究中,选取了具有不同药物敏感性的4 株ATCC标准菌株及5 株食品来源分离菌株(表1),测定植物源化合物对这9 株阪崎克罗诺肠杆菌的MIC(表3)。
表3 植物源化合物对阪崎克罗诺肠杆菌的MIC
Table3 MIC of plant-derived compounds against C. sakazakii mg/mL
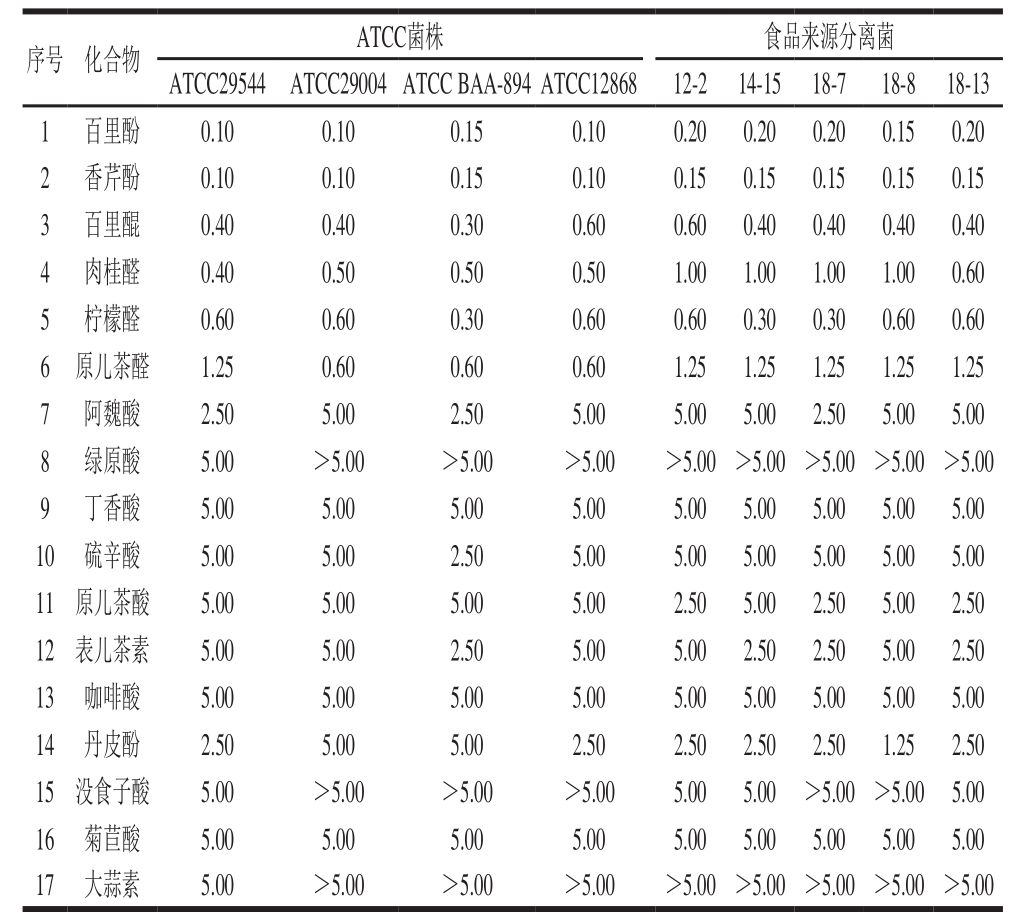
根据表2可知,对ATCC 29544的MIC不小于5 mg/mL的植物源化合物共18 种,选择除苦参碱(对人畜具有低毒性)以外的17 种植物源化合物继续进行研究。在所检测的17 种植物源化合物中,百里酚和香芹酚对阪崎克罗诺肠杆菌有着最强的抑菌效果,两者对9 株阪崎克罗诺肠杆菌的MIC均为0.1~0.2 mg/mL;百里醌、肉桂醛、柠檬醛和原儿茶醛也有良好的抑菌效果,四者的MIC为0.30~1.25 mg/mL;MIC为2.5~5.0 mg/mL的植物源化合物有:阿魏酸、绿原酸、丁香酸、硫辛酸、原儿茶酸、表儿茶素、咖啡酸、丹皮酚和菊苣酸(表3)。
本研究选取的50 种天然植物源化合物中,15 种植物源化合物是酚类化合物(丹酚酸B、松萝酸、阿魏酸、绿原酸、丁香酸、原儿茶酸、咖啡酸、没食子酸、菊苣酸、山柰酚、丹皮酚、百里酚、香芹酚、表儿茶素和厚朴酚)。由表2抑菌圈结果可知,除山柰酚以外,含其他14 种酚类植物源化合物的阪崎克罗诺肠杆菌培养基中均有较为明显的抑菌圈。除丹酚酸B、松萝酸、山柰酚和厚朴酚以外,其他11 种植物源化合物对阪崎克罗诺肠杆菌ATCC 29544的MIC均小于等于5 mg/mL。这说明酚类物质对阪崎克罗诺肠杆菌有着较好的抑菌作用。酚类物质具有多种化学结构,是次级代谢产物中最多样的一类物质,其羟基基团(—OH)被认为是发挥抑菌作用的主要原因[19]。并且,酚酸类物质被证明能够作用于细菌的细胞膜,并破坏细菌的细胞膜结构,导致细胞内容物流出[20-21]。
百里酚(图1A)和香芹酚(图1B)是一对同分异构的酚类单萜物质,在本研究中对阪崎克罗诺肠杆菌有着最强的抑菌效果。两者在结构上的区别仅为酚羟基在苯环上的位置不同,物理性质主要为熔点不同,香芹酚常温下为液体,而百里酚常温下为固体粉末。香芹酚和百里酚已经被欧盟委员会(European Commission,EU)认定可作为食品中的调味剂(Regulation EU 872/2012),并已被证明对蜡状芽孢杆菌、铜绿假单胞菌和金黄色葡萄球菌具有良好的抑菌作用[22],Xu等[23]研究表明,百里酚和香芹酚对大肠杆菌有相似的抑菌效果,MIC均为0.2 mg/mL,但是其对阪崎克罗诺肠杆菌的抑菌活性尚无报道。
百里醌(图1C)对阪崎克罗诺肠杆菌有着良好的抑菌作用,其MIC为0.3~0.6 mg/mL。百里醌是天然调味品黑种草的主要生物活性成分[24],其半数致死量(lethal dose 50%,LD50)是2 400 mg/kg[25],并已被证明具有抗氧化、抗高血压、抗炎、抗肿瘤、抗诱变剂、抗组胺和止痛等多种药理学功能[26]。Forouzanfar等[27]研究表明,百里醌对金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌及铜绿假单胞菌具有抑菌作用。
肉桂醛(图1D)对阪崎克罗诺肠杆菌的MIC为0.4~1.0 mg/mL。肉桂醛是肉桂树皮提取物的主要成分,自然界中天然存在的肉桂醛均为反式结构。由于其具有肉桂香气,目前被应用于化妆品、医药制品和香水中。肉桂醛具有抗癌、抗炎、治疗糖尿病、降低细菌耐药性等多种生物活性[28]。Ooi等[29]通过琼脂稀释法检测肉桂醛对多种细菌的MIC,结果表明肉桂醛对金黄色葡萄球菌、大肠杆菌、变形杆菌、铜绿假单胞菌、霍乱弧菌、副溶血型弧菌和鼠伤寒沙门氏菌的MIC为75~600 μg/mL。
在本研究中,柠檬醛对阪崎克罗诺肠杆菌也有着良好的抑菌作用,其对阪崎克罗诺肠杆菌的MIC为0.30~0.60 mg/mL。柠檬醛是一类单萜化合物,是柠檬草油的主要成分,常以几何异构体橙花醛(图1G)和香叶醛(图1H)的形式存在。目前,柠檬醛作为香辛料已广泛应用于加工食品和饮料中(如软饮料和甜点)[30]。一些实验及临床研究表明,柠檬醛具有良好的抗炎、防腐和抑菌作用[31-33],本研究首次评价了其对阪崎克罗诺肠杆菌的抑菌活性。
原儿茶酸(图1F)和原儿茶醛(图1E)有着相似的化学结构,但两者对阪崎克罗诺肠杆菌的抑菌效果却差异明显(原儿茶醛对阪崎克罗诺肠杆菌的MIC为0.60~1.25 mg/mL,但原儿茶酸的MIC为2.50~5.00 mg/mL);这可能归因于它们的结构及疏水性的不同[34]。使用ACD/ChemSketch 2012软件分析了两种化合物的疏水性,计算了原儿茶酸和原儿茶醛的油水分配系数(lg(Po/w))(lg(Po/w)值指某物质在正辛烷(油)和水中的分配系数的对数值,反映了物质在油-水两相中的分配情况,lg(Po/w)值越大说明该物质越亲油,反之则越亲水)。两者的lg(Po/w)分别为1.16±0.24和1.14±0.27,并无显著差异。因此推测:两者抑菌作用的不同可能是由原儿茶醛的官能基团醛基(—CHO)与原儿茶酸的官能基团羧基(—COOH)所导致。
阿魏酸(图1L)与咖啡酸(图1K)都为酚酸类物质,且有较为相似的化学结构,其二者对阪崎克罗诺肠杆菌的MIC分别为2.50~5.00 mg/mL和5.00 mg/mL。阿魏酸存在于多种食物中,如米糠、绿茶和咖啡豆中[34-35],并常常存在于植物细胞壁的半纤维素中[36];其已被证实具有抗氧化、预防动脉粥样硬化和抗炎等多种生理功能活性[37]。阿魏酸对食源性致病菌的抑制作用也多有报道,Campos等[38]发现它能够破坏乳酸菌的细胞壁,影响细胞膜正常的通透性;Gañan等[39]证明100 mg/L的阿魏酸能够降低空肠弯曲杆菌的存活能力。
丁香酸(图1I)存在于多种食物及中草药中,如香菇、谷物、石斛、板蓝根[40]和距花山姜的叶子[41]。前期研究表明,丁香酸能够防治慢性肝损伤的肝纤维化[42],并能在糖尿病小鼠模型中治疗糖尿病[41]。丁香酸对多种微生物的抑制作用也有大量研究,Zaldivar等[43]发现丁香酸能够通过改变胞内离子浓度从而抑制大肠杆菌LY01的生长并能降低乙醇的产量。并且,500 mg/L丁香酸能够在90 min内使PBS中酒类酒球菌的数量下降4.5(lg(CFU/mL))(起始菌量为7.0(lg(CFU/mL)))[44]。
硫辛酸含有两个巯基基团,通常以氧化态(图1M)和还原态(图1N)形式存在[45],它存在于菠菜、花椰菜、西红柿、豌豆、豆芽、米糠和动物内脏等多种食品中[46],其在人体血清内的质量浓度为16 mg/L[47]。前期研究表明,硫辛酸因能螯合金属离子从而具有较强的抗氧化能力,能够消除加速老化与致病的自由基,修复细胞氧化损伤[48]。越来越多的研究表明,硫辛酸是能够调控免疫功能和炎症反应基因的核转录因子(nuclear transcription factor,NF)-κB的重要抑制剂[49]。除此之外,大量实验及临床研究证明硫辛酸有潜力被用作治疗糖尿病、肝功能损伤、动脉粥样硬化和HIV感染[50-51]。由于上述特性,硫辛酸已在多个国家被用作膳食补充剂[52-53]。
实验所检测的50 种植物源化合物中,多种物质作为抑菌剂抑制细菌或作为民间医药治疗食源性致病菌所导致的疾病已有悠久的历史。并且,一些物质(百里酚、香芹酚、柠檬醛和肉桂醛)已被美国食品药品管理局(Food and Drug Administration,FDA)评价为公认安全的食品成分;因此,这些植物源化合物有潜力作为植物源抑菌剂添加入食品中,或用于食品包装和食品加工、流通和运输过程的抑菌处理。本实验的开展为天然植物源化合物在抑制阪崎克罗诺肠杆菌的研究方面提供了参考。

图1 部分植物源化合物的化学结构
Fig. 1 Chemical structures of plant-derived compounds
本研究评价了50 种植物源化合物对阪崎克罗诺肠杆菌的抑菌活性。结果表明:百里酚和香芹酚对阪崎克罗诺肠杆菌有着最强的抑制作用,对9 株阪崎克罗诺肠杆菌的MIC为0.10~0.20 mg/mL;百里醌、肉桂醛、柠檬醛和原儿茶醛有良好的抑菌效果,四者的MIC为0.30~1.25 mg/mL;阿魏酸、绿原酸、丁香酸、硫辛酸、原儿茶酸、表儿茶素、咖啡酸、丹皮酚和菊苣酸的MIC为2.50~5.00 mg/mL。以上结果表明,多种植物源抑菌剂对阪崎克罗诺肠杆菌有着良好的抑菌活性,有潜力作为抑菌剂在食品加工、流通、贮藏过程中应用,从而发挥其控制阪崎克罗诺肠杆菌的作用。本研究为阪崎克罗诺肠杆菌的控制提供了新的思路,也为植物源抑菌剂的开发提供了基础数据,但植物源抑菌剂的抑菌机制及在食品中的应用方式需要进一步探究。
参考文献:
[1] GURTLER J B, KORNACKI J L, BEUCHAT L R. Enterobacter sakazakii: a coliform of increased concern to infant health[J].International Journal of Food Microbiology, 2005, 104(1): 1-34.DOI:10.1016/j.ijfoodmicro.2005.02.013.
[2] KUCEROVA E, CLIFTON S W, XIA X Q, et al. Genome sequence of Cronobacter sakazakii BAA-894 and comparative genomic hybridization analysis with other Cronobacter species[J]. PLoS ONE,2010, 5(3): A51-A60. DOI:10.1371/journal.pone.0009556.
[3] TOWNSEND S, HURRELL E, FORSYTHE S. Virulence studies of Enterobacter sakazakii isolates associated with a neonatal intensive care unit outbreak[J]. BMC Microbiology, 2008, 8(1): 1-9.DOI:10.1186/1471-2180-8-64.
[4] BOWEN A B, BRADEN C R. Invasive Enterobacter sakazakii disease in infants[J]. Emerging Infectious Diseases, 2006, 12(8): 1185-1189.DOI:10.3201/eid1208.051509.
[5] FEENEY A, KROPP K A, O’CONNOR R, et al. Cronobacter sakazakii: stress survival and virulence potential in an opportunistic foodborne pathogen[J]. Gut Microbes, 2014, 5(6): 711-718. DOI:10.41 61/19490976.2014.983774.
[6] BARRON J C, FORSYTHE S J. Dry stress and survival time of Enterobacter sakazakii and other Enterobacteriaceae in dehydrated powdered infant formula[J]. Journal of Food Protection, 2007, 70(9):2111-2117. DOI:10.4315/0362-028X-70.9.2111.
[7] FEI Peng, MAN Chaoxin, LOU Binbin, et al. Genotyping and source tracking of Cronobacter sakazakii and C. malonaticus isolates from powdered infant formula and an infant formula production factory in China[J]. Applied & Environmental Microbiology, 2015, 81(16): 5430-5439. DOI:10.1128/AEM.01390-15.
[8] STOCK I. Natural antibiotic susceptibility of Enterobacter spp.,with special reference to Enterobacter aerogenes and Enterobacter intermedius strains[J]. Journal of Chemotherapy, 2002, 14(5): 444-460.DOI:10.1007/s10666-008-9149-3.
[9] VAN DE VELDE S, CARRYN S, VAN BAMBEKE F, et al.Penicillin-binding proteins (PBP) and Lmo0441 (a PBP-like protein)play a role in beta-lactam sensitivity of Listeria monocytogenes[J]. Gut Pathogens, 2009, 1: 23. DOI:10.1186/1757-4749-1-23.
[10] BURT S A, REINDERS R D. Antibacterial activity of selected plant essential oils against Escherichia coli O157:H7[J]. Letters in Applied Microbiology, 2003, 36(3): 162-167. DOI:10.1046/j.1472-765X.2003.01285.x.
[11] JOSHI S S, HOWELL A B, D’SOUZA D H. Cronobacter sakazakii reduction by blueberry proanthocyanidins[J]. Food Microbiology,2014, 39(5): 127-131. DOI:10.1016/j.fm.2013.11.002.
[12] AMALARADJOU M A R, HOAGLAND T A,VENKITANARAYANAN K. Inactivation of Enterobacter sakazakii in reconstituted infant formula by trans-cinnamaldehyde[J]. International Journal of Food Microbiology, 2009, 129(2): 146-149. DOI:10.1016/j.ijfoodmicro.2008.11.016.
[13] KIM K J, KIM M A, JUNG J H. Antitumor and antioxidant activity of protocatechualdehyde produced from Streptomyces lincolnensis M-20[J]. Archives of Pharmacal Research, 2008, 31(12): 1572-1577.DOI:10.1007/s12272-001-2153-7.
[14] 王娣, 许晖, 钱时权, 等. 麝香草酚对食品常见污染菌的抑菌作用[J].食品科学, 2013, 34(3): 119-122.
[15] European Committee for Antimicrobial Susceptibility Testing(Eucast) of the European Society of Clinical Microbiology and Infectious Diseases (ESCMID). Determination of minimum inhibitory concentrations (MICs) of antibacterial agents by agar dilution[J]. Clinical Microbiology and Infection, 2000, 6(9): 509-515.DOI:10.1046/j.1469-0691.2000.00142.x.
[16] COTTEN C M, TAYLOR S, STOLL B, et al. Prolonged duration of initial empirical antibiotic treatment is associated with increased rates of necrotizing enterocolitis and death for extremely low birth weight infants[J]. Pediatrics, 2009, 123(1): 58-66. DOI:10.1542/peds.2007-3423.
[17] RAKOFF-NAHOUM S, PAGLINO J, ESLAMI-VARZANEH F,et al. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis[J]. Cell, 2004, 118(2): 229-241.DOI:10.1016/j.cell.2004.07.002.
[18] RANGEL-FRAUSTO M S, WIBLIN T, BLUMERG H M, et al.National epidemiology of mycoses survey (NEMIS): variations in rates of bloodstream infections to Candida species in seven surgical intensive care units and six neonatal intensive care units[J]. Clinical Infectious Diseases, 1999, 29(2): 253-258. DOI:10.1086/520194.
[19] LAI P K, ROY J. Antimicrobial and chemopreventive properties of herbs and spices[J]. Current Medicinal Chemistry, 2004, 11(11): 1451-1460. DOI:10.2174/0929867043365107.
[20] JOHNSTON M D, HANLON G W, DENYER S P, et al. Membrane damage to bacteria caused by single and combined biocides[J]. Journal of Applied Microbiology, 2003, 94(6): 1015-1023. DOI:10.1046/j.1365-2672.2003.01923.x.
[21] XUE J, DAVIDSON P M, ZHONG Q X. Thymol nanoemulsified by whey protein-maltodextrin conjugates: the enhanced emulsifying capacity and antilisterial properties in milk by propylene glycol[J].Journal of Agricultural and Food Chemistry, 2013, 61(51): 12720-12726. DOI:10.1021/jf4043437.
[22] LAMBERT R J W, SKANDAMIS P N, COOTE P J, et al. A study of the minimum inhibitory concentration and mode of action of oregano essential oil, thymol and carvacrol[J]. Journal of Applied Microbiology,2001, 91(3): 453-462. DOI:10.1046/j.1365-2672.2001.01428.x.
[23] XU J, ZHOU F, JI B P, et al. The antibacterial mechanism of carvacrol and thymol against Escherichia coli[J]. Letters in Applied Microbiology, 2008, 47(3): 174-179. DOI:10.1111/j.1472-765X.2008.02407.x.
[24] EL-MAHMOUDY A, MATSUYAMA H, BORGAN M A, et al.Thymoquinone suppresses expression of inducible nitric oxide synthase in rat macrophages[J]. International Immunopharmacology,2002, 2(11): 1603-1611. DOI:10.1016/S1567-5769(02)00139-X.
[25] ALI B H, BLUNDEN G. Pharmacological and toxicological properties of Nigella sativa[J]. Phytotherapy Research, 2003, 17(4): 299-305.DOI:10.1002/Ptr.1309.
[26] RAGHEB A, ATTIA A, ELDIN W S, et al. The protective effect of thymoquinone, an anti-oxidant and anti-inflammatory agent, against renal injury: a review[J]. Saudi Journal of Kidney Diseases and Transplantation, 2009, 20(5): 741-752.
[27] FOROUZANFAR F, BAZZAZ B S F, HOSSEINZADEH H. Black cumin (Nigella sativa) and its constituent (thymoquinone): a review on antimicrobial effects[J]. Iranian Journal of Basic Medical Sciences,2014, 17(12): 929-938.
[28] ZHANG L Q, ZHANG Z G, FU Y, et al. Trans-cinnamaldehyde improves memory impairment by blocking microglial activation through the destabilization of iNOS mRNA in mice challenged with lipopolysaccharide[J]. Neuropharmacology, 2016, 110: 503-518.DOI:10.1016/j.neuropharm.2016.08.013.
[29] OOI L S, LI Y, KAM S L, et al. Antimicrobial activities of cinnamon oil and cinnamaldehyde from the Chinese medicinal herb Cinnamomum cassia Blume.[J]. American Journal of Chinese Medicine, 2005, 34(3): 511-522. DOI:10.1142/S0192415X06004041.
[30] CHOI S J, DECKER E A, HENSON L, et al. Inhibition of citral degradation in model beverage emulsions using micelles and reverse micelles[J]. Food Chemistry, 2010, 122(1): 111-116. DOI:10.1016/j.foodchem.2010.02.025.
[31] ORTIZ M I, GONZÁLEZ-GARCÍA M P, PONCE-MONTER H A, et al. Synergistic effect of the interaction between naproxen and citral on inflammation in rats[J]. Phytomedicine, 2010, 18(1): 74-79.DOI:10.1016/j.phymed.2010.05.009.
[32] KORENBLUM E, DE VASCONCELOS GOULART F R, DE ALMEIDA RODRIGUES I, et al. Antimicrobial action and anticorrosion effect against sulfate reducing bacteria by lemongrass(Cymbopogon citratus) essential oil and its major component, the citral[J].AMB Express, 2013, 3(1): 1-8. DOI:10.1186/2191-0855-3-44.
[33] DE BONA DA SILVA C, GUTERRES S S, WEISHEIMER V, et al.Antifungal activity of the lemongrass oil and citral against Candida spp.[J].The Brazilian Journal of Infectious Diseases, 2008, 12(1): 63-66.
[34] TAKAHASHI H, TAKADA K, TSUCHIYA T, et al. Listeria monocytogenes develops no resistance to ferulic acid after exposure to low concentrations[J]. Food Control, 2015, 47: 560-563. DOI:10.1016/j.foodcont.2014.07.062.
[35] ZHAO Z H, MOGHADASIAN M H. Chemistry, natural sources,dietary intake and pharmacokinetic properties of ferulic acid: a review[J]. Food Chemistry, 2008, 109(4): 691-702. DOI:10.1016/j.foodchem.2008.02.039.
[36] URAJI M, KIMURA M, INOUE Y, et al. Enzymatic production of ferulic acid from defatted rice bran by using a combination of bacterial enzymes[J]. Applied Biochemistry and Biotechnology, 2013, 171(5):1085-1093. DOI:10.1007/s12010-013-0190-6.
[37] OU S Y, KWOK K C. Ferulic acid: pharmaceutical functions,preparation and applications in foods[J]. Journal of the Science of Food and Agriculture, 2004, 84(11): 1261-1269. DOI:10.1002/jsfa.1873.
[38] CAMPOS F M, COUTO J A, FIGUEIREDO A R, et al. Cell membrane damage induced by phenolic acids on wine lactic acid bacteria[J]. International Journal of Food Microbiology, 2009, 135(2):144-151. DOI:10.1016/j.ijfoodmicro.2009.07.031.
[39] GAÑAN M, MARTÍNEZ-RODRÍGUEZ A J, CARRASCOSA A V. Antimicrobial activity of phenolic compounds of wine against Campylobacter jejuni[J]. Food Control, 2009, 20(8): 739-742.DOI:10.1016/j.foodcont.2008.09.012.
[40] KONG W J, ZHAO Y L, SHAN L M, et al. Thermochemical studies on the quantity-antibacterial effect relationship of four organic acids from Radix Isatidis on Escherichia coli growth[J]. Biological &Pharmaceutical Bulletin, 2008, 31(7): 1301-1305. DOI:10.1248/bpb.31.1301.
[41] MUTHUKUMARAN J, SRINIVASAN S, VENKATESAN R S, et al.Syringic acid, a novel natural phenolic acid, normalizes hyperglycemia with special reference to glycoprotein components in experimental diabetic rats[J]. Journal of Acute Disease, 2013, 2(4): 304-309.DOI:10.1016/S2221-6189(13)60149-3.
[42] ITOH A, ISODA K, KONDOH M, et al. Hepatoprotective effect of syringic acid and vanillic acid on CCl4-induced liver injury[J].Biological & Pharmaceutical Bulletin, 2010, 33(6): 983-987.DOI:10.1248/bpb.33.983.
[43] ZALDIVAR J, INGRAM L O. Effect of organic acids on the growth and fermentation of ethanologenic Escherichia coli LY01[J].Biotechnol Bioeng, 1999, 66(4): 203-210. DOI:10.1002/(Sici)1097-0290(1999)66:4<203::AID-BIT1﹥3.3.CO;2-R.
[44] CAMPOS F M, COUTO J A, HOGG T A. Influence of phenolic acids on growth and inactivation of Oenococcus oeni and Lactobacillus hilgardii[J]. Journal of Applied Microbiology, 2003, 94(2): 167-174.DOI:10.1046/j.1365-2672.2003.01801.x.
[45] NIKOLIĆ R S, KRSTIĆ N S, NIKOLIĆ G M, et al. Molecular mechanisms of beneficial effects of lipoic acid in copper intoxicated rats assessment by FTIR and ESI-MS[J]. Polyhedron, 2014, 80: 223-227. DOI:10.1016/j.poly.2014.04.033.
[46] PACKER L, KRAEMER K, RIMBACH G. Molecular aspects of lipoic acid in the prevention of diabetes complications[J]. Nutrition,2001, 17(10): 888-895. DOI:10.1016/S0899-9007(01)00658-X.
[47] BAUMGARTNER M R, SCHMALLE H, DUBLER E. The interaction of transition metals with the coenzyme α-lipoic acid: synthesis,structure and characterization of copper and zinc complexes[J].Inorganica Chimica Acta, 1996, 252(1/2): 319-331. DOI:10.1016/S0020-1693(96)05331-5.
[48] BIEWENGA G P, HAENEN G R, BAST A. The pharmacology of the antioxidant lipoic acid[J]. General Pharmacology, 1997, 29(3):315-331. DOI:10.1016/S0306-3623(96)00474-0.
[49] PACKER L. α-Lipoic acid: a metabolic antioxidant which regulates NF-κB signal transduction and protects against oxidative injury[J]. Drug Metabolism Reviews, 1998, 30(2): 245-275.DOI:10.3109/03602539808996311.
[50] PACKER L, WITT E H, TRITSCHLER H J. Alpha-lipoic acid as a biological antioxidant[J]. Free Radical Biology and Medicine, 1995,19(2): 227-250. DOI:10.1016/0891-5849(95)00017-R.
[51] EL-BESHBISHY H. Lipoic acid attenuates DNA fragmentation,oxidative stress and liver injury induced by tamoxifen in rats[J]. Asian Journal of Traditional Medicines, 2007, 2(5): 175-188.
[52] SMITH A R, SHENVI S V, WIDLANSKY M, et al. Lipoic acid as a potential therapy for chronic diseases associated with oxidative stress[J]. Current Medicinal Chemistry, 2004, 11(9): 1135-1146.DOI:10.2174/0929867043365387.
[53] ZHANG W J, BIRD K E, MCMILLEN T S, et al. Dietary alpha-lipoic acid supplementation inhibits atherosclerotic lesion development in apolipoprotein E-deficient and apolipoprotein E/low-density lipoprotein receptor-deficient mice[J]. Circulation, 2008, 117(3):421-428. DOI:10.1161/Circulationaha.107.725275.
Evaluation of Antibacterial Activities of Fifty Plant-Derived Compounds against Cronobacter sakazakii
SHI Chao1, CHEN Yifei1, JIA Zhenyu1, SUN Yi1, GUO Du1, YANG Baowei1, YANG Hua2,*, XIA Xiaodong1,*
(1. College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China;2. Institute of Quality and Standard for Agro-Products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China)
Abstract:Cronobacter sakazakii is an opportunistic pathogen transmitted by foods, which has been implicated in several forms of neonatal infections such as bacteraemia, necrotizing enterocolitis and neonatal meningitis. The aim of this study was to evaluate the antibacterial activity of plant-derived compounds to obtain potent antimicrobials. The antibacterial activity against C. sakazakii was determined by the Oxford cup method. Moreover, the minimum inhibitory concentration (MIC)against four American Type Culture Collection (ATCC) strains and five foodborne isolates was assessed using agar dilution method. Results indicated that 40 phytochemicals had obvious bacteriostatic action against C. sakazakii, and the diameters of the inhibition zones produced by 7 compounds (carvacrol, thymoquinone, thymol, cinnamaldehyde, citral, protocatechuic acid and protocatechualdehyde) were more than 13 mm. Among to 50 compounds tested, thymol and carvacrol had the most potent antimicrobial activity against 9 C. sakazakii strains with MICs ranging from 0.1 to 0.2 mg/mL. Thymoquinone, cinnamaldehyde,citral and protocatechualdehyde also demonstrated good antibacterial effect with MICs of 0.30 to 1.25 mg/mL. The MICs of ferulic acid, chlorogenic acid, syringic acid, lipoid acid, protocatechuic acid, epicatechin, caffeic acid, paeonol and cichoric acid ranged from 2.50 to 5.00 mg/mL. These findings suggest that some plant-derived compounds exhibit good antimicrobial effect against C. sakazakii strains and could be potentially used to control C. sakazakii during food processing, circulation and storage.
Keywords:Cronobacter sakazakii; plant-derived compounds; growth inhibition zone; minimum inhibitory concentration
DOI:10.7506/spkx1002-6630-201813008
收稿日期:2017-02-24
基金项目:“十二五”国家科技支撑计划项目(2015BAD16B08);教育部“新世纪优秀人才支持计划”项目(NCET-13-0488);浙江省植物有害生物防控重点实验室——省部共建国家重点实验室培育基地开放基金项目(2010DS700124-ZM1608);中央高校基本科研业务费专项资金项目(2452017146)
第一作者简介:石超(1989—),女,讲师,博士,研究方向为天然活性物质的抗菌功能。E-mail:meilixinong@126.com
*通信作者简介:杨华(1972—),男,副研究员,博士,研究方向为畜产品质量安全。E-mail:yanghua806@hotmail.com夏效东(1981—),男,教授,博士,研究方向为天然活性物质的营养及抗菌功能。E-mail:foodscixiaodong@yahoo.com
中图分类号:Q939.92
文献标志码:A
文章编号:1002-6630(2018)13-0047-08
引文格式:石超, 陈怡飞, 贾振宇, 等. 50 种植物源化合物对阪崎克罗诺肠杆菌的抑菌活性评价[J]. 食品科学, 2018, 39(13): 47-54.
DOI:10.7506/spkx1002-6630-201813008. http://www.spkx.net.cn
SHI Chao, CHEN Yifei, JIA Zhenyu, et al. Evaluation of antibacterial activities of fifty plant-derived compounds against Cronobacter sakazakii[J]. Food Science, 2018, 39(13): 47-54. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201813008. http://www.spkx.net.cn