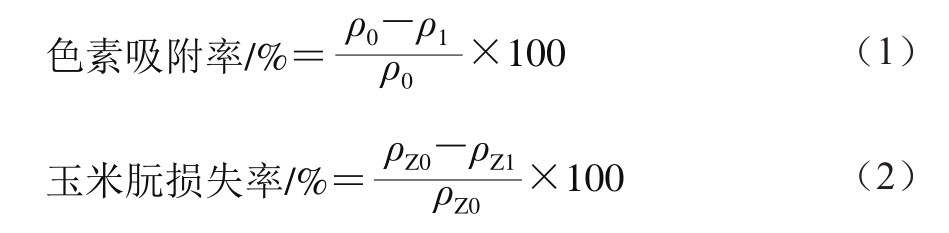
史嘉辰,韩及华,李运通,孙 俊,陈中伟,徐 斌*
(江苏大学食品与生物工程学院,江苏 镇江 212013)
摘 要:为研究国内外活性炭在玉米朊脱色过程中吸附色素特性的差异,以玉米朊的乙醇萃取溶液和商业玉米朊产品乙醇复溶溶液为研究对象,分别采用国产活性炭(ACP)和进口活性炭(ACD)对比研究其对玉米朊的脱色效果,并对活性炭的微观结构进行表征。静态吸附实验结果表明,活性炭对玉米朊复溶溶液和萃取液的脱色效果没有明显差异;ACP对玉米朊溶液中色素的吸附率(77.31%)略高于ACD(67.27%)。扫描电子显微镜分析表明,ACP结构向内延伸而ACD表面凹陷孔结构不明显;比表面积和孔隙结构分析表明,ACP的比表面积(1 438.082 m2/g)和总孔容积(1.310 cm3/g)大于ACD(779.809 m2/g、0.626 cm3/g),且ACP具有更多的微孔和中孔结构。ACD表面含有较多的羧酸和内酯类官能团,可与色素分子中的羟基结合,从而有效增强活性炭的化学吸附效果。ACD粒径分布更加集中,有利于脱色后的固-液分离。综合以上因素考虑,ACD更适合用于黄色玉米朊的脱色处理。
关键词:玉米朊;活性炭;脱色;微观结构表征
玉米朊是玉米的主要储藏蛋白,占籽粒总量的39%左右,胚乳的47%左右[1],具有良好的耐水耐油性、阻氧性、可成膜性、生物相容性,被视为理想的鲜食保鲜以及糖果和药片的包壁材料。目前,商业玉米朊的制备常采用有机溶剂浸提法,该方法在获得玉米朊的同时会使玉米黄粉中的色素(β-胡萝卜素、叶黄素和玉米黄素等)和异味物质溶出,导致玉米朊呈现黄色,影响包壁时的透明度和色泽,限制其在食品和医药领域的应用[2-3]。因此,对玉米朊的脱色处理十分必要。
活性炭具有优良的吸附特性,被广泛应用于对有机化合物、重金属以及色素的吸附[4-5]。采用活性炭作为吸附剂对玉米朊进行脱色纯化研究,已有几十年的历史[6-7]。在国外,以美国农业部Sessa等[8-11]为代表的科研团队的研究最为全面,并且取得了不错的效果;在国内,对活性炭脱色玉米朊的研究主要集中在两方面:其一是对国内来源不同的活性炭进行筛选;其二是通过单因素试验优化脱色工艺[12-14]。然而,对国产活性炭和国外活性炭脱色效果的对比研究依然存在空缺。此外,现有文献报道的玉米朊活性炭脱色技术研究大多以商业玉米朊的复溶溶液为主,对玉米朊萃取液的研究甚少。
为此,本研究以活性炭脱色玉米朊溶液后的色素含量和玉米朊损失率为脱色效果评价标准,通过静态吸附实验,对比了玉米朊复溶溶液和萃取液在活性炭脱色效果方面的差异。采用国外研究常用的Darco活性炭ACD[8]和国产活性炭ACP为吸附剂[12],对比了两种活性炭脱色玉米朊的效果。并通过扫描电子显微镜分析、表面化学基团分析、比表面积及孔径分析和粒径分析等手段对这两种活性炭进行结构表征,从微观角度揭示活性炭脱色差异的内在原因,以期为玉米朊的活性炭脱色处理提供理论参考和工艺指导。
玉米朊、玉米朊萃取液 高邮市日星药用辅料有限公司;Darco活性炭(ACD) 西格玛奥德里奇(上海)贸易有限公司;国产活性炭(ACP,以木屑为原料,采用磷酸法生产得到) 广州韩研活性炭有限公司;β-胡萝卜素标准品 TCI(上海)有限公司;其他试剂均为化学纯。
S-4800型扫描电子显微镜 日本日立建机株式会社;NOVA 3000e比表面积孔径分析仪 美国Quantachrome公司;UV-9600紫外-可见分光光度计 北京瑞利分析仪器公司;BR4i型高速冷冻离心机 法国Jouan公司;SHZ-88A型往复式水浴恒温振荡器 太仓市实验设备厂;CJJ-931六联磁力加热搅拌器 金坛市环宇科学仪器;Nicolet-iS5型傅里叶变换红外光谱仪 美国Thermo公司;电子分析天平 德国赛多利斯公司;Zetasizer Nano-ZS90激光粒径仪 英国马尔文仪器公司。
1.3.1 脱色效果评价方法
1.3.1.1 色素吸附率测定
选择β-胡萝卜素为基准,量化玉米朊中的色素含量[12]。选择体积分数90%乙醇溶液为溶剂,配制质量浓度为1~6 μg/mL的β-胡萝卜素标准液,测定各质量浓度标准溶液的A448 nm。以β-胡萝卜素标准液质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。得到β-胡萝卜素的标准曲线方程为y=0.137 6x-0.007 5(R2=0.999),β-胡萝卜素质量浓度在1.0~6.0 μg/mL之间呈良好的线性关系。
1.3.1.2 玉米朊损失率测定
据Sessa等[11]报道,玉米朊在280 nm波长处有最大吸收峰。采用分光光度法测定玉米朊损失率。准确称取0.400 0 g玉米朊溶于体积分数90%乙醇溶液中,定容至100 mL,配制成4 mg/mL玉米朊标准储备液。以上述溶液为母液,稀释成质量浓度为0~1.60 mg/mL玉米朊标准液。以体积分数90%乙醇溶液为参比,测定各质量浓度标准液的A280 nm。以玉米朊标准液质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。得到玉米朊的标准曲线方程为y=0.949 1x+0.009 9(R2=0.999 4),质量浓度在0~1.6 mg/mL之间呈良好的线性关系。
1.3.2 活性炭的静态吸附实验
1.3.2.1 活性炭对玉米朊复溶液的吸附
以体积分数90%乙醇溶液配制足量质量浓度为40 mg/mL的玉米朊复溶溶液。准确量取玉米朊复溶溶液30 mL,分别加入到编号为1和2的100 mL锥形瓶中。分别向1号和2号锥形瓶中加入0.4 g的ACD和ACP。35 ℃、100 r/min振荡吸附120 min。吸附完成后9 000 r/min离心20 min,分离活性炭。测定上清液的A448 nm和A280 nm,分别代入β-胡萝卜素的标准曲线方程和玉米朊的标准曲线方程,计算得到脱色后色素质量浓度ρ1/(mg/mL)和玉米朊质量浓度ρZ1/(mg/mL)。在不添加活性炭的条件下,测得玉米朊复溶溶液的色素质量浓度ρ0/(mg/mL)和玉米朊质量浓度ρZ0/(mg/mL)。色素吸附率和玉米朊损失率分别根据公式(1)、(2)计算。
1.3.2.2 活性炭对玉米朊萃取液的吸附
玉米朊萃取液是指采用体积分数90%乙醇溶液对玉米黄粉进行提取,使其中的玉米蛋白溶出,再经固-液分离得到的上层玉米蛋白提取液。取一定量的玉米朊萃取液在4 000 r/min下离心,准确量取上层清液(玉米朊萃取液质量浓度约100 mg/mL)2 mL至100 mL容量瓶中,用体积分数90%乙醇溶液定容。以体积分数90%乙醇溶液为参比,测玉米朊萃取液的A280 nm,根据玉米朊的标准曲线方程,计算得到玉米朊萃取液的质量浓度。
采用体积分数90%乙醇溶液稀释已知质量浓度的玉米朊萃取液至40 mg/mL,准确量取30 mL分别加入到编号为1和2的100 mL锥形瓶中。分别向1号和2号锥形瓶中加入0.4 g ACD和ACP,在35 ℃和100 r/min的振荡频率下,振荡吸附120 min。吸附完成后9 000 r/min离心20 min,分离活性炭,测定上清液的A448 nm和A280 nm。分别代入β-胡萝卜素的标准曲线方程和玉米朊的标准曲线方程,计算得到脱色后色素质量浓度ρ1和玉米朊质量浓度ρZ1。在不添加活性炭的条件下,测得玉米朊萃取液的色素质量浓度ρ0和玉米朊质量浓度ρZ0。分别代入公式(1)和(2)中,计算得到色素吸附率和玉米朊损失率。
1.3.3 活性炭的结构表征
1.3.3.1 扫描电子显微镜分析
通过对活性炭的表面形态结构进行观察,可以从理论上分析活性炭吸附性能的差异[15]。将两种活性炭样品用导电双面胶分别固定在样品台上,并吹去未固定的粉末样品。测试前对样品进行真空离子溅射喷金镀膜处理。测试条件:S-4800型热场发射电子显微镜扫描,加速电压为15 kV,放大倍数为100 倍和500 倍,获得相应的扫描电子显微镜图,并对两种活性炭扫描电子显微镜图进行比较。
1.3.3.2 比表面积和孔隙结构分析
参考Noonpui等[16]的方法,采用氮气物理吸附-脱附法测定。实验采用NOVA 3000e比表面积孔径分析仪测定,称取足量样品置于样品管中,测试前将样品在90 ℃下脱气2 h后,升温至150 ℃继续脱气12 h转入分析站,然后以氮气为吸附质,在液氮温度(-196 ℃)下进行吸附。比表面积及孔径分布均由NOVA 3000e比表面积孔径分析仪自带的分析软件进行分析处理。
1.3.3.3 碘吸附值和亚甲基蓝吸附值的测定
ACD和ACP的碘吸附值按GB/T 12496.8—2015《木质活性炭试验方法 碘吸附值的测定》进行测定。ACD和ACP的亚甲基蓝吸附值按GB/T 12496.10—1999《木质活性炭试验方法 亚甲基蓝吸附值的测定》进行测定。
1.3.3.4 傅里叶变换红外光谱分析
傅里叶变换红外表征采用Nicolet-iS5型傅里叶变换红外光谱仪进行检测,主要检测步骤按参考文献[17]进行:取ACP和ACD各1 mg置于研钵中,向研钵中添加0.10 g溴化钾,使样品与溴化钾充分研磨混匀,然后用压片机将混合物压成薄片,在400~4 000 cm-1波数范围内扫描64 次,分辨率1.9 cm-1。
1.3.3.5 粒径分析
分别称取1.0 mg左右的ACP和ACD分散至50 mL去离子水中,采用超声波处理样品至形成稳定的悬浮液。采用Zetasizer Nano-ZS90激光粒径仪分别对两种活性炭进行湿法粒径分析,测定两种活性炭的中值粒径(D50)和多分散性指数(polydispersity index,PDI),对两种活性炭的粒径分布和平均粒径进行表征。
采用SPSS 17.0软件进行数据分析,Duncan法进行显著性分析,用95%置信水平(P<0.05)来说明数据的差异性。每组实验重复3 次,结果取3 次实验的平均值。
表1 活性炭对玉米朊的静态吸附效果
Table1 Static adsorption efficiency of pigment in zein by ACD and ACP
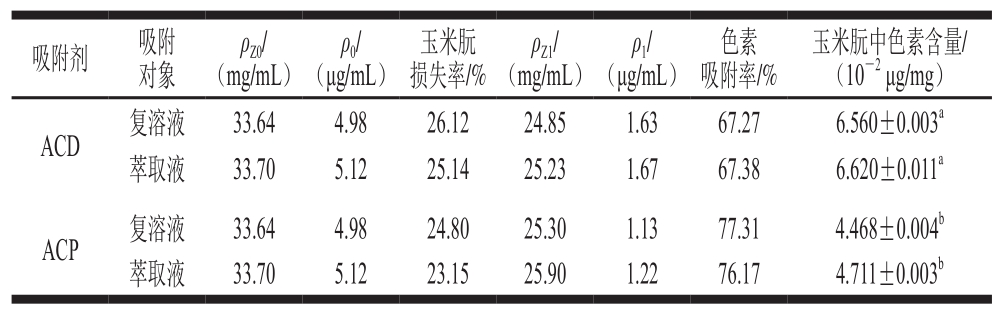
注:同列肩标小写字母不同表示差异显著(P<0.05)。
如表1所示,经ACP脱色后的色素吸附率和玉米朊的损失率分别为77.31%和24.80%,而ACD的色素吸附率和玉米朊损失率分别为67.27%和26.12%。由此可知,ACP的脱色效果要优于ACD。
以ACD为吸附剂,玉米朊复溶溶液和萃取液为吸附对象时,经活性炭脱色后,两种吸附对象玉米朊中的色素含量分别为6.560×10-2μg/mg和6.620×10-2μg/mg,无显著性差异(P>0.05)。因此,玉米朊生产企业可对玉米朊萃取液直接进行脱色处理。
2.2.1 扫描电子显微镜分析

图1 ACD(A)和ACP(B)的扫描电子显微镜图
Fig. 1 Scanning electron microscopic images of ACD (A) and ACP (B)
由图1A可以看出ACD颗粒块状较多,颗粒大小比较集中;ACP颗粒杆状较多,这可能增加脱色后活性炭分离的难度。由图1A2、B2可以看出ACD和ACP表面均含有丰富的孔结构。ACP结构向活性炭内部延伸,表面呈现蜂巢状,属中空结构;ACD颗粒表面有褶皱和凹陷现象,但孔结构不明显。这些现象可能表明ACP比表面积更大,吸附能力更强。通过扫描电子显微镜图可大致了解两种活性炭的表面形貌及孔数量的多少,但无法辨别出活性炭的中孔和微孔。
2.2.2 孔隙结构分析

图2 ACD(A)和ACP(B)吸附-脱附的氮气等温线
Fig. 2 Adsorption/desorption isotherms of ACD (A) and ACP (B)
如图2所示,ACD和ACP对氮气的吸/脱附等温线呈闭环形,高压范围内出现明显的滞后环。说明ACD和ACP对氮气的吸/脱附等温线属于Ⅱ型等温线,且两种活性炭中存在大量的中孔结构[18-20],因此,ACD和ACP的孔结构为微孔和中孔混合结构。
表 2 ACD和ACP的BET比表面积和孔结构参数
Table2 BET specific area and pore structure parameters of ACD and ACP

注:SBET.总比表面积;Sext.外比表面积;Smic表示微孔比表面积;Vtot.总孔容积;Vmic.微孔容积;Vext.中孔容积;Dp.平均孔径。
由表2可知,ACP具有较高的总比表面积(大于1 400 m2/g)和总孔容积(大于1.3 cm3/g),微孔和中孔容积占总容积总量30%和70%左右,微孔表面积占总表面积的一半以上,表明ACP的微孔和中孔结构发达,因此具有较强的吸附性能。ACD的比表面积仅为ACP的1/2左右,但脱色效果仅略逊于ACP,说明活性炭表面积大小和孔隙的分布情况不能单一的用来判定活性炭对玉米朊的脱色效果。活性炭吸附效果可能还与其他因素相关,如活性炭表面化学基团等。
2.2.3 活性炭的碘吸附值和亚甲基蓝吸附值
活性炭的碘吸附值与亚甲基蓝吸附值在一定程度上反映了活性炭孔隙的发达程度。活性炭中孔径在1.0~1.5 nm之间的孔隙较发达时,碘吸附值较大;而活性炭中孔径在1.5~2.8 nm之间的孔隙较多时,亚甲基蓝吸附值较大[21]。
表3 ACD和ACP的碘吸附值及亚甲基蓝吸附值
Table3 Iodine adsorption values and methylene blue adsorption values of ACD and ACP

由表3可知,ACP碘吸附值和亚甲基蓝吸附值分别为1 009 mg/g和120 mg/g,均大于ACD。由此说明与ACD相比,ACP在孔径为1.0~2.8 nm范围内的微孔更多,分析结果与两种活性炭对氮气的吸附-脱附结果一致。
2.2.4 傅里叶变换红外光谱分析
活性炭的表面化学性质决定了其化学吸附特性,表面的化学官能团、杂原子和化合物的不同,会导致活性炭对不同的吸附质产生明显的吸附差别[22-24]。活性炭表面官能团主要为含氧官能团和含氮官能团。其中,含氧官能团对活性炭吸附效果的影响最大。研究结果表明,含氧官能团的数量和种类极大地影响了活性炭的吸附性质,并对其表面电荷和骨架电子密度产生影响,进而影响其使用性能[25-26]。

图3 ACD和ACP的傅里叶变换红外光谱图
Fig. 3 Fourier transform infrared spectra of ACD and ACP
如图3所示,ACD和ACP在3 440、2 900、2 500 cm-1和1 080 cm-1处均有红外吸收峰,尤其是ACD在1 725 cm-1附近有明显的吸收峰。波长3 440 cm-1处的吸收峰主要是由于羟基(-OH)或者氢键的伸缩振动引起[27];活性炭表面甲基(-CH3)和亚甲基(-CH2-)的伸缩振动导致ACD和ACP在2 900 cm-1波长处产生了吸收峰[28];1 080 cm-1处的强吸收峰主要由CH2-O-CH2中的C-O伸缩振动引起。ACD在1 725 cm-1附近有明显的吸收峰,这一特征吸收峰属于羧酸基团及内酯基团中C=O的特征伸缩振动峰[29-30],说明ACD表面含有较多的羧酸和内酯类官能团,这些官能团可能与色素分子中的-OH结合,增强活性炭对色素分子的吸附能力。这就是在ACD的比表面积仅为ACP二分之一的情况下,对玉米朊的脱色效果却仅略逊于ACP的原因。
2.2.5 粒径分析
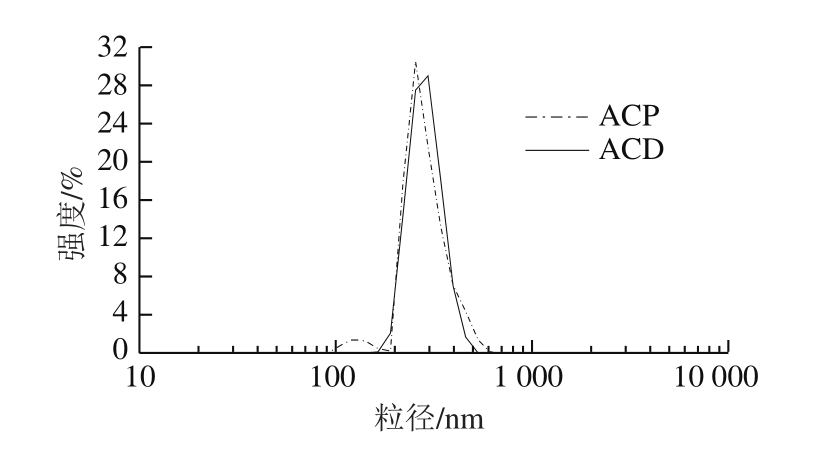
图4 ACP和ACD粒径分布强度
Fig. 4 Size distribution by intensity of ACP and ACD
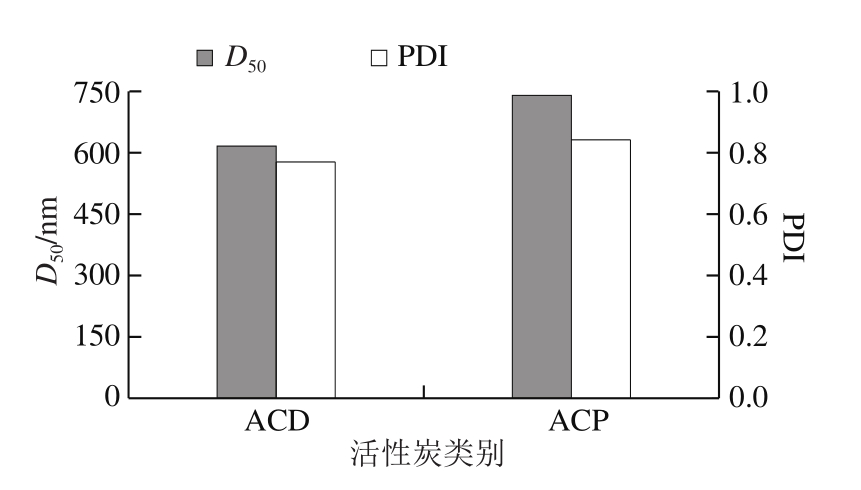
图5 ACP和ACD的D50和PDI比较
Fig. 5 Histogram of D50and PDI for ACD and ACP
由图4可知,ACD的粒径主要集中分布在300 nm左右。而ACP的粒径分布出现两个峰,其中绝大部分分布在250 nm左右,少部分分布在150 nm左右。说明ACD比ACP粒径分布更加集中。从图5中可看出,ACD的粒径分布更为集中,与图4结论一致。
由于工业生产中活性炭和玉米朊溶液主要靠压滤的方法实现固-液分离,ACP中少量粒径150 nm左右的颗粒会随溶液通过滤饼,对玉米朊产品造成不良影响。若通过反复过滤去除小颗粒活性炭,会导致溶剂乙醇大量蒸发,溶质玉米朊形成凝胶,脱色后玉米朊损失率明显上升。因此,从脱色玉米朊溶液后进行固-液分离操作的角度考虑,ACP粒径分布不集中与2.2.1节所述ACP含有大量杆状结构,都会增加后固-液分离的难度和成本,进而对最终的脱色效果造成不利影响。
本研究分别采用商业玉米朊的乙醇复溶溶液和玉米朊的乙醇萃取溶液作为活性炭脱色对象,对比发现活性炭对两种溶液的脱色效果无显著性差异。因此,建议生产企业可以直接对玉米朊萃取液进行脱色处理,以降低生产成本。
对比ACP和ACD两种活性炭的脱色效果,结果表明ACP对色素吸附率略高于ACD,同时玉米朊损失率更低。对两种活性炭的结构表征发现,ACP的比表面积大于ACD,因此ACP对玉米朊的脱色效果优于ACD。但是,ACD的吸附能力仅略逊于ACP,由此可推测活性炭脱色玉米朊的效果不仅受活性炭比表面积大小的影响,还与活性炭表面化学基团密切相关。通过傅里叶变换红外光谱分析发现,ACD含有较多的羧酸和内酯类官能团,可有效增强其化学吸附效果,进而提升总体吸附效果。此外,通过对ACD和ACP的粒径分析,表明ACD粒径分布相对集中,有利于脱色后的固-液分离。综上所述,在色素脱除率和玉米朊失率相当的情况下,ACD更适合用于黄色玉米朊的脱色处理。
参考文献:
[1] WU S W, MYERS D J, JOHNSON L A. Factors affecting yield and composition of zein extracted from commercial corn gluten meal[J]. Cereal Chemistry, 1997, 74(3): 258-263. DOI:10.1094/CCHEM.1997.74.3.258.
[2] SESSA D J. Decolorization/deodorization of corn zein products:7939633[P]. 2011-10-05.
[3] SHUKLA R, CHERYAN M. Zein: the industrial protein from corn[J].Industrial Crops & Products, 2001, 13(3): 171-192. DOI:10.1016/S0926-6690(00)00064-9.
[4] LIN Y B, FUGETSU B, TERUI N, et al. Removal of organic compounds by alginate gel beads with entrapped activated carbon[J].Journal of Hazardous Materials, 2005, 120(1): 237-241. DOI:10.1016/j.jhazmat.2005.01.010.
[5] DEVESA-REY R, BUSTOS G, CRUZ J M, et al. Optimisation of entrapped activated carbon conditions to remove coloured compounds from winery wastewaters[J]. Bioresource Technology, 2011, 102(11):6437-6442. DOI:10.1016/j.biortech.2011.03.072.
[6] LAWTON J W. Zein: a history of processing and use[J]. Cereal Chemistry, 2002, 79(1): 1-18. DOI:10.1094/CCHEM.2002.79.1.1.
[7] PEARCE L O G. Preparation and purification of zein: 2229870A[P]. 1941.
[8] SESSA D J, ELLER F J, PALMQUIST D E, et al. Improved methods for decolorizing corn zein[J]. Industrial Crops & Products, 2003,18(1): 55-65. DOI:10.1016/S0926-6690(03)00033-5.
[9] SESSA D J, PALMQUIST D E. Effect of heat on the adsorption capacity of an activated carbon for decolorizing/deodorizing yellow zein[J]. Bioresource Technology, 2008, 99(14): 6360-6364.DOI:10.1016/j.biortech.2007.11.076.
[10] SESSA D J, PALMQUIST D E. Decolorization/deodorization of zein via activated carbons and molecular sieves[J]. Industrial Crops &Products, 2009, 30(1): 162-164. DOI:10.1016/j.indcrop.2008.12.008.
[11] SESSA D J, WOODS K K. Purity assessment of commercial zein products after purification[J]. Journal of the American Oil Chemists’Society, 2011, 88(7): 1037-1043. DOI:10.1007/s11746-011-1765-4.
[12] 薛丁萍, 徐斌, 韩及华, 等. 玉米朊脱色用活性炭的筛选及其脱色工艺的优化[J]. 中国粮油学报, 2014, 29(8): 11-16.
[13] 马广亮, 董英, 徐斌. 玉米朊的活性炭脱色工艺研究[J]. 食品科技,2007, 32(2): 261-264. DOI:10.3969/j.issn.1005-9989.2007.02.075.
[14] 肖香, 薛丁萍, 王瑶, 等. 玉米朊的脱色技术研究进展[J]. 食品科技,2014, 39(1): 178-182.
[15] AL-OTHMAN Z A, ALI R, NAUSHAD M. Hexavalent chromium removal from aqueous medium by activated carbon prepared from peanut shell: adsorption kinetics, equilibrium and thermodynamic studies[J]. Chemical Engineering Journal, 2012, 184: 238-247.DOI:10.1016/j.cej.2012.01.048.
[16] NOONPUI S, THIRAVETYAN P, NAKBANPOTE W, et al. Color removal from water-based ink wastewater by bagasse fly ash, sawdust fly ash and activated carbon[J]. Chemical Engineering Journal, 2010,162(2): 503-508. DOI:10.1016/j.cej.2010.05.051.
[17] 韩及华, 吴其飞, 徐斌, 等. 活性炭对玉米朊中黄色素的吸附机理研究[J]. 中国粮油学报, 2016, 31(10): 98-107. DOI:10.3969/j.issn.1003-0174.2016.10.017.
[18] SUN R Q, SUN L B, CHUN Y, et al. Catalytic performance of porous carbons obtained by chemical activation[J]. Carbon, 2008, 46(13):1757-1764. DOI:10.1016/j.carbon.2008.07.029.
[19] 刘守新, 陈曦, 张显权. 活性炭孔结构和表面化学性质对吸附硝基苯的影响[J]. 环境科学, 2008, 29(5): 1192-1196. DOI:10.3321/j.issn:0250-3301.2008.05.007.
[20] 刘伟, 李立清, 刘峥, 等. 甲苯吸附与活性炭孔隙结构关系的研究[J]. 化学工业与工程, 2011, 28(4): 5-10. DOI:10.3969/j.issn.1004-9533.2011.04.002.
[21] 解晓翠, 常纪恒, 于川芳, 等. 活性炭在卷烟滤嘴中的应用研究综述[J]. 郑州轻工业学院学报(自然科学版), 2012, 27(2): 40-45.DOI:10.3969/j.issn.1004-1478.2012.02.010.
[22] RAMOS R L, OVALLE-TURRUBIARTES J, SANCHEZ-CASTILLO A M. Adsorption of fluoride from aqueous solution on aluminumimpregnated carbon[J]. Carbon, 1999, 37(4): 609-617. DOI:10.1016/S0008-6223(98)00231-0.
[23] 沈增明, 张文辉, 张学军. 活性炭材料的制备与应用[M]. 北京: 北京化学出版社, 2006: 2-6.
[24] 刘娟. 活性炭孔径分布分形表征与其吸附性能之间关系的研究[D].广州: 华南理工大学, 2011: 13-15.
[25] CHO H H, WEPASNICK K, SMITH B A, et al. Sorption of aqueous Zn[Ⅱ] and Cd[Ⅱ] by multiwall carbon nanotubes: the relative roles of oxygen-containing functional groups and graphenic carbon[J].Langmuir, 2009, 26(2): 967-981. DOI:10.1021/la902440u.
[26] ALMARRI M, MA X, SONG C. Role of surface oxygen-containing functional groups in liquid-phase adsorption of nitrogen compounds on carbon-based adsorbents[J]. Energy & Fuels, 2009, 23(8): 3940-3947.DOI:10.1021/ef900051r.
[27] XIAO Y, CHANG H, JIA A, et al. Trace analysis of quinolone and fluoroquinolone antibiotics from wastewaters by liquid chromatography-electrospray tandem mass spectrometry[J]. Journal of Chromatography A, 2008, 1214(1/2): 100-108. DOI:10.1016/j.chroma.2008.10.090.
[28] CHEN B, JOHNSON E J, CHEFETZ B, et al. Sorption of polar and nonpolar aromatic organic contaminants by plant cuticular materials:role of polarity and accessibility[J]. Environmental Science &Technology, 2005, 39(16): 6138-6146. DOI:10.1021/es050622q.
[29] 李娜, 朱健, 查庆芳. 活性炭表面基团的定性和定量分析[J].高等学校化学学报, 2012, 33(3): 548-554. DOI:10.3969/j.issn.0251-0790.2012.03.022.
[30] 李娜, ALMARRI M, 马筱良, 等. 活性炭表面含氧基团与其液相吸附脱氮性能的关系[J]. 新型炭材料, 2011, 26(6): 470-478.DOI:10.1016/S1872-5805(11)60093-0.
Effect of Microstructure of Activated Carbon on Decolorization of Zein
SHI Jiachen, HAN Jihua, LI Yuntong, SUN Jun, CHEN Zhongwei, XU Bin*
(School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China)
Abstract:In order to understand the difference between domestic activated carbon (ACP) and foreign activated carbon (ACD)in the decolorization efficiency of zein, the decolorization efficiency and microstructure of ACP and ACD were compared.The results showed that there was no significant difference between the decolorization efficiencies of zein solution and extract, but the pigment adsorption rate of ACP (77.31%) was higher than that of ACD (67.27%). Furthermore, scanning electron microscopic analysis showed that the structure of ACP was extended inwards while the structure of ACD was less porous. Then, specific surface analysis and pore size analysis showed that the specific surface area and total pore volume of ACP (1 438.082 m2/g, 1.310 cm3/g) were bigger than those of ACD (779.809 m2/g, 0.626 cm3/g) because there were more micropores and mesopores in the structure of ACP. Meanwhile, the surface of ACD showed more carboxylic acid and lactone functional groups, which could enhance the chemical adsorption of activated carbons effectively when bound to the hydroxyl groups in the pigment molecules. Simultaneously, ACD was more homogeneous in particle size, which was beneficial to the solid-liquid separation after decolorization. Taken together, ACD is more suitable for zein decolorization.
Keywords:zein; activited carbon; decolorization; microstructure characterization
DOI:10.7506/spkx1002-6630-201813016
收稿日期:2017-02-16
基金项目:江苏省重点研发计划(重点项目)(BE2016348)
第一作者简介:史嘉辰(1993—),男,硕士,研究方向为粮食加工副产物的深加工技术与产业化。E-mail:sjc12366@163.com
*通信作者简介:徐斌(1969—),男,教授,博士,研究方向为面条加工、粮食副产物深加工技术与装备开发。E-mail:food_oil@126.com
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2018)13-0100-06
引文格式:史嘉辰, 韩及华, 李运通, 等. 活性炭微观结构对玉米朊脱色效果的影响[J]. 食品科学, 2018, 39(13): 100-105.
DOI:10.7506/spkx1002-6630-201813016. http://www.spkx.net.cn
SHI Jiachen, HAN Jihua, LI Yuntong, et al. Effect of microstructure of activated carbon on decolorization of zein[J]. Food Science,2018, 39(13): 100-105. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201813016. http://www.spkx.net.cn