张雪莹,郭超凡,陶 飞,王云阳,傅虹飞*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
摘 要:研究了不同热处理方式(水浴、微波、射频)和处理终点温度(70、80、90 ℃)对玉米醇溶蛋白功能性质与结构的影响。结果表明:多种热处理均会提高玉米醇溶蛋白溶解度、乳化能力和巯基含量,且这3 项指标随着处理终点温度的升高而升高,射频处理至90 ℃使玉米醇溶蛋白溶解度、乳化能力和巯基含量分别提高了74.65%、171.7%和53.94%。应用差示扫描量热法测定玉米醇溶蛋白变性温度,发现微波处理后蛋白质变性温度略有升高。此外,紫外光谱分析提示,玉米醇溶蛋白经微波和射频加热处理后,蛋白质分子结构舒展、基团暴露,这使得蛋白质的溶解性和乳化能力有所改善。傅里叶变换红外光谱分析发现热处理改变了玉米醇溶蛋白的二级结构,其中微波和射频处理效果更明显。
关键词:玉米醇溶蛋白;蛋白质变性;热处理;微波;射频
玉米醇溶蛋白是玉米的主要贮藏蛋白,主要通过溶剂萃取法从玉米麸粉中获得[1]。玉米醇溶蛋白具有环保、无毒、可生物降解和乳化性、持水性、延展性良好等优点,是一种有广泛应用前景的食品材料。由于氨基酸组成不平衡,玉米醇溶蛋白形成了独特的溶解性、分子形态和分子结构,使其具有良好的成膜性,所成膜透明、均匀、有韧性[2]。作为两亲蛋白质,玉米醇溶蛋白还可形成胶体纳米粒子,使其成为食品和生物工业中药物和微量营养素的理想输送载体[3]。
通过了解蛋白质结构和功能特性之间的关系以预测蛋白质在食品加工中的适用性,从而通过适当的改性方法修饰蛋白以扩大其应用范围是非常重要的。有学者报道了脱酰胺[4]、磷酸化[5]、酶催化[6]以及挤压膨化法[7]修饰玉米醇溶蛋白的功能特性。热处理作为最受欢迎的修改蛋白质功能的物理改性方法之一,已经广泛应用于改变水溶性蛋白质如花生蛋白[8]、乳清蛋白[9]、乳铁蛋白[10]和大豆分离蛋白[11]的物理化学性质。然而关于醇溶蛋白的热处理和物理化学变化的报道较为少见。Selling等[12]通过圆二色谱研究了温度(25~70 ℃)对玉米醇溶蛋白的二级和三级结构的影响,发现在70 ℃热处理15 min引起了玉米醇溶蛋白初级结构的改变。Sun Cuixia等[13]采用不同热处理温度(75、85、95 ℃)和时间(15、30、45 min)处理玉米醇溶蛋白,发现不同温度和时间对蛋白质二级结构、稳定性、形态有不同的影响。
与传统处理方法相比,新的食品加工技术(如微波(microwave,MW)和射频(radio frequency,RF)技术)具有低能耗、产品品质高等优点,有望运用在蛋白质的热改性研究中。微波是指频率为300 MHz~300 GHz的电磁波,能够引起物料分子振动,从而在分子级对物料产生影响。微波使食品物料中的极性分子在高频电场作用下发生相互摩擦和碰撞,将微波场能转化为热能,使物料温度升高[14]。射频的加热原理类似于微波,但频率范围从1 MHz到300 MHz。Guan Junjun等[15]使用实验室规模的微波炉加热大豆分离蛋白,结果表明,微波处理30 min破坏了蛋白质分子的二硫键,增加了巯基和表面疏水基团的数量,促进了蛋白质分子之间的相互作用,形成了具有均匀紧凑网络的凝胶。张海华等[16]分别使用600、800、1 000 W微波功率处理小麦面筋蛋白,并采用傅里叶变换红外光谱对小麦面筋蛋白的二级结构进行分析,发现微波处理后面筋蛋白的二级结构随微波功率不同而发生不同变化,微波处理后面筋蛋白的表面疏水性以及巯基含量升高。Guo Chaofan等[17]使用27.12 MHz频率的射频在不同终点温度(70、80、90 ℃)和电极间隙(120、160、200 mm)下对大豆分离蛋白进行处理,发现射频加热引起蛋白巯基、二级结构和三级结构的明显变化。然而目前鲜见关于微波、射频对玉米醇溶蛋白处理的报道。
本研究的目的是探讨水浴(water bath,WB)加热、微波加热、射频加热3 种处理方式对玉米醇溶蛋白结构特性、功能特性的影响,为蛋白质改性提供基础研究,找出更有效的热改性方法以增加玉米醇溶蛋白的附加值,拓宽其应用领域。
玉米醇溶蛋白粉 西格玛奥德里奇公司;福林-酚试剂 上海荔达生物科技有限公司;其他化学试剂均为国产分析纯。
SJ-9A-27-JY射频加热器 河北华氏纪元高频设备有限公司;EMA34GTQ-SS微波炉 广东美的微波炉制造有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;UV-2450紫外-可见分光光度计日本岛津有限公司;Tensor 27傅里叶变换红外光谱仪德国布鲁克光谱仪器公司;Q200差示扫描量热(differential scanning calorimetry,DSC)仪 美国TA仪器公司;HQ-FTS-DIF00荧光光纤测温仪 西安和其光电科技有限公司。
1.3.1 样品制备
将0.8 g玉米醇溶蛋白溶解在80 mL蒸馏水中制备玉米醇溶蛋白分散液(10 mg/mL),密封振荡至完全水合。
1.3.2 样品升温曲线的测定
使用水浴、射频和微波3 种处理方式对玉米醇溶蛋白分散液进行加热,溶液中心温度分别达70、80、90 ℃时停止加热。将装有80 mL玉米醇溶蛋白分散液的100 mL离心管放入相应目标温度的水浴锅中进行水浴加热,将热电偶插入分散液中心位置;微波处理时设置微波强度为中火,将离心管放置在微波炉中心位置,使用热电偶测温;将离心管放入极板间距为120 mm、频率为27.12 MHz的射频底部电极板中心进行射频加热,并插入测温光纤探头至分散液中心位置。记录时间-温度曲线。
1.3.3 玉米醇溶蛋白溶解度测定
将热处理前后的玉米醇溶蛋白溶液在转速10 000 r/min下离心10 min,用福林-酚法测定上清液中蛋白质量浓度[18],取牛血清白蛋白作为标准品,绘制标准曲线,根据上清液中可溶性蛋白质量浓度来计算溶解度。
1.3.4 玉米醇溶蛋白乳化性能测定
玉米醇溶蛋白的乳化性能包括乳化能力(emulsifying capacity,EC)和乳化稳定性(emulsifying stability,ES)。参照Li Yuanyuan等[19]的方法并进行改进。
取玉米醇溶蛋白分散液24 mL,加入8 mL大豆油,使用高速分散均质机(10 000 r/min)分散2 min,迅速用微量注射器从均质后的样品底部吸取50 μL乳化液并移入5 mL 0.1%(质量分数,下同)的十二烷基硫酸钠溶液中,以十二烷基硫酸钠(0.1%)溶液为对照,测定500 nm波长处的吸光度。乳化能力以吸光度×100表示。
将测定乳化能力后的乳液在室温下放置30 min,按照上述方法再次测定乳化能力。按照公式(1)计算乳化稳定性。
式中:EC为乳化能力;EC30为30 min后的乳化能力。
1.3.5 玉米醇溶蛋白巯基含量测定
采用Beveridge[20]和Cabra[21]等的方法针对玉米醇溶蛋白进行了改进:将不同热处理后的蛋白样品经冷冻干燥后,用体积分数70%的乙醇溶液配成2.0 mg/mL的玉米蛋白乙醇溶液,取1 mL玉米蛋白乙醇溶液,加入5 mL含9 mol/L尿素的0.1%乙二胺四乙酸溶液(现配),再加入0.05 mL的4 mg/mL的5,5’-二硫代双(2-硝基苯甲酸)溶液添加颜色反应,迅速混匀后在35 ℃下反应30 min,在412 nm波长处比色,以1 mL 70%的乙醇溶液作为空白对照。按照公式(2)计算巯基含量。
式中:cSH为巯基含量/(μmol/g);A412 nm为412 nm波长处吸光度;ρS为样品质量浓度/(mg/mL);D为稀释因子,对于计算巯基含量为6.05。
1.3.6 玉米醇溶蛋白变性温度的测定
本实验使用DSC法测定热处理前后的玉米醇溶蛋白变性温度。将样品冷冻干燥,称取样品2~3 mg于铝坩锅中,氮气流速20 mL/min,升温速率为10 ℃/min;扫描范围为20~150 ℃,得到DSC曲线。使用TA Universal Analysis 2000软件分析。
1.3.7 玉米醇溶蛋白紫外光谱扫描
将不同热处理后的蛋白样品经冷冻干燥处理后,用体积分数70%的乙醇溶液溶解至1 mg/mL进行紫外光谱扫描,扫描波长为245~445 nm,扫描速率为0.1 nm/s。
1.3.8 玉米醇溶蛋白傅里叶变换红外光谱测定
使用Tensor 27傅里叶变换红外光谱仪,KBr与1 mg冻干样品研磨,压片。扫描范围4 000~400 cm-1,扫描264 次,分辨率4 cm-1。在相同条件下收集不同样品的光谱。二级结构使用Peak Fit V4.12软件进行分析。
用3 次重复实验结果计算平均值和标准差。数据在95%的置信度水平下,用SPSS软件进行Tukey检验,以P<0.05表示差异显著。
由图1可见,3 种加热方式中微波加热升温迅速,升温至90 ℃总用时约60 s,基本呈线性上升状态,无明显变快或变缓的趋势。水浴次之,升温至90 ℃总用时约为650 s,这是由于水浴加热主要靠热传导提高温度,而试管的导热性较差。水浴升温速度呈先快后慢趋势,原因为热传导过程中温差越大升温越快。射频加热升温速度较慢,升温至90 ℃大致用时900 s,整体趋势是先慢后快,但变化幅度较为平缓,可能的原因为射频加热主要是利用水中极性物质在电场中的振荡来实现温度的上升,由于蒸馏水中极性物质含量较少,因此升温较慢。当温度升高后,蛋白质溶解度提高,水中极性物质含量升高,加热速度变快。

图1 不同热处理方式下的玉米醇溶蛋白分散液的升温曲线
Fig. 1 Temperature-time curve of zein dispersion under different heat treatments

图2 不同热处理对玉米醇溶蛋白分散液溶解度的影响
Fig. 2 Effects of different heat treatments on the solubility of zein dispersion
由图2可以看出,射频处理对于玉米醇溶蛋白溶解度影响最大,微波次之,水浴影响最小,且溶解度皆随处理温度的提高而增大。比较发现,与未经处理的样品相比,经热处理后的玉米醇溶蛋白的溶解性发生了显著提高(P<0.05)。蛋白分散液在水浴加热至70 ℃时溶解度为181 μg/mL,比对照组提高了27.46%,这是在该系列热处理中变化程度最小的处理条件。其他不同热处理方式和终点温度下溶解度变化均超过40.00%,如溶解度变化最大的处理条件——射频处理至90 ℃,蛋白溶解度达248 μg/mL,相比对照组提高了74.65%。对于各种热处理方式而言,玉米醇溶蛋白在达到相同终点温度时,射频、微波处理比水浴处理的溶解度有显著提高(P<0.05)。在90 ℃时,射频处理的醇溶蛋白溶解度比水浴处理提高了20.30%。微波和射频的高频电场不但会引起物料内部极性分子摩擦生热,还可因摩擦使分子间共价键或非共价键发生断裂[22],使玉米醇溶蛋白结构展开,与水的相互作用增强,从而使溶解度提高。

图3 不同热处理对玉米醇溶蛋白分散液乳化能力的影响
Fig. 3 Effects of different heated treatments on emulsifying capacity of zein dispersion
每克蛋白质的乳状液在从O/W型乳状液转变成W/O型乳状液前所能乳化油的体积为蛋白质的乳化能力,而乳状液的稳定程度为乳化稳定性。蛋白质的乳化性能与其溶解性有一定关系[23]。如图3所示,经热处理后的玉米醇溶蛋白乳化能力显著提高(P<0.05),并随温度升高而增大,这可能是由于随着温度升高,玉米醇溶蛋白在溶液中的溶解度提高,使得O/W界面处的蛋白吸附增强,从而防止液滴聚集或沉淀[19]。当热处理终点温度为80 ℃时,玉米醇溶蛋白的乳化能力在3 种处理方式下均没有显著性差异,处理至70 ℃和90 ℃时,微波和射频处理的玉米醇溶蛋白乳化能力显著高于水浴处理。经射频处理至90 ℃的蛋白乳化能力比对照组提高了171.7%。

图4 不同热处理对玉米醇溶蛋白分散液乳化稳定性的影响
Fig. 4 Effects of different heat treatments on the emulsifying stability of zein dispersion
由图4可以看出,除微波处理至70 ℃的玉米醇溶蛋白,经其他处理后的蛋白乳化稳定性显著降低。乳化稳定性整体随着温度的升高而降低。热处理使玉米醇溶蛋白分子极化并展开,在蛋白质表面暴露出内部的疏水残基,促进生成O/W界面,这也是玉米醇溶蛋白乳化能力升高的原因[24]。而随着暴露出的疏水残基增多,新的非共价键在玉米醇溶蛋白分子之间形成,使玉米醇溶蛋白分子形成更大的分子聚集体,从而降低了O/W界面的稳定性,使蛋白的乳化能力下降。
巯基含量是蛋白质改性研究的一个重要指标[25]。从图5可以发现,与对照组样品相比,除70 ℃微波和水浴处理蛋白外,其他不同热处理方式和温度均使得玉米醇溶蛋白的巯基含量发生了显著变化(P<0.05),射频处理至90 ℃蛋白巯基含量增加最多,为20.315 μmol/g,相对未处理样品提高了约53.94%。说明蛋白分子中的部分亚基解离,二硫键断裂生成巯基,或热处理使蛋白内部结构展开导致内部巯基暴露[26]。这与Guo Chaofan等[17]使用不同极板间距的射频处理大豆分离蛋白均使蛋白巯基含量显著提高的结果一致。对于各种热处理方式而言,玉米醇溶蛋白的巯基含量均随处理温度的升高而增大。其中,除70 ℃外,对于相同温度,射频和微波处理的巯基含量均显著高于水浴处理。加热至90 ℃时,射频处理的玉米醇溶蛋白巯基含量比水浴处理高19.13%,而加热至80 ℃时,微波处理比水浴处理高17.87%。这可能是由于射频和微波处理使蛋白分子中的偶极子随快速变换的电磁场快速转变,不但可互相摩擦产生热量,还会引起微观分子空间结构上的变化[17]。微波相较于射频处理对玉米醇溶蛋白效果不明显,可能是由于达到相同温度微波作用时间较射频处理短。

图5 不同热处理对玉米醇溶蛋白巯基含量的影响
Fig. 5 Effects of different heat treatments on free sulfhydryl content of zein
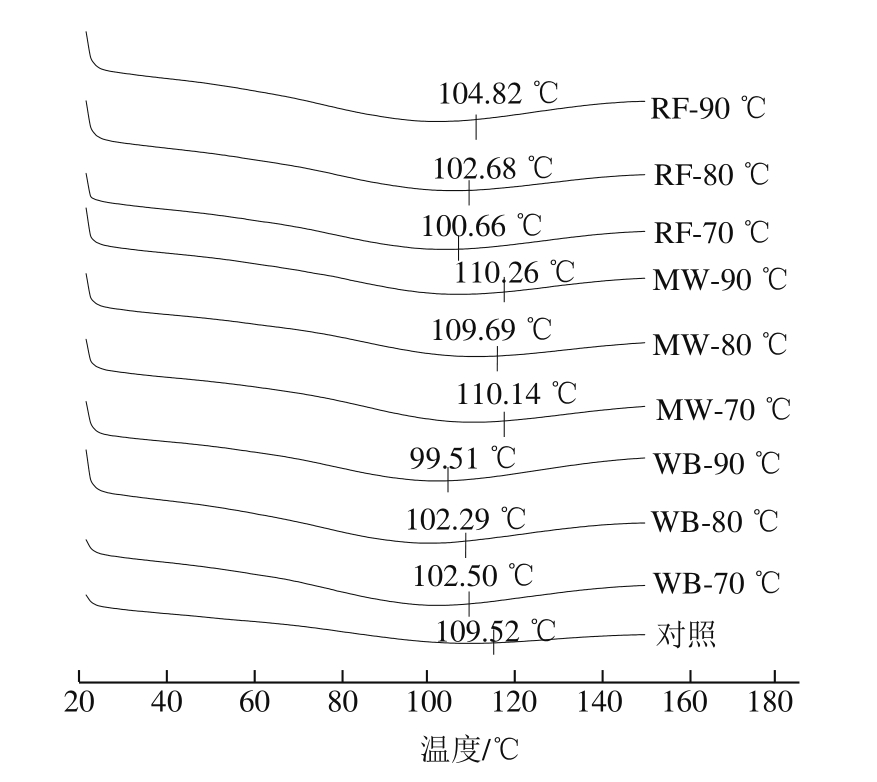
图6 不同热处理条件加热玉米醇溶蛋白分散液的DSC图谱
Fig. 6 DSC thermograms of zein dispersion under different heat treatment conditions
DSC法广泛应用于蛋白质热变性的研究[27]。在DSC图谱中,最大峰对应的温度通常被用来确定蛋白质变性温度,同时,变性温度代表了蛋白质的热稳定性及聚集程度。由图6
可以看出,微波处理的玉米醇溶蛋白变性温度略有上升,说明微波处理可提高玉米醇溶蛋白的热稳定性。经水浴和射频处理的玉米醇溶蛋白变性温度相对于未处理的样品有所降低,这可能归因于水浴和射频过长的热处理时间破坏了有利于玉米蛋白形成稳定网状结构的维持蛋白质分子结构的化学键及相互作用力[28],导致玉米醇溶蛋白的部分展开,因此热稳定性降低。水浴处理玉米醇溶蛋白至70、80、90 ℃时变性温度逐渐降低,而射频处理玉米醇溶蛋白至与水浴同样的终点温度变性温度逐渐升高,说明变性温度的变化不仅与加热终点温度有关,还与加热方式有关。
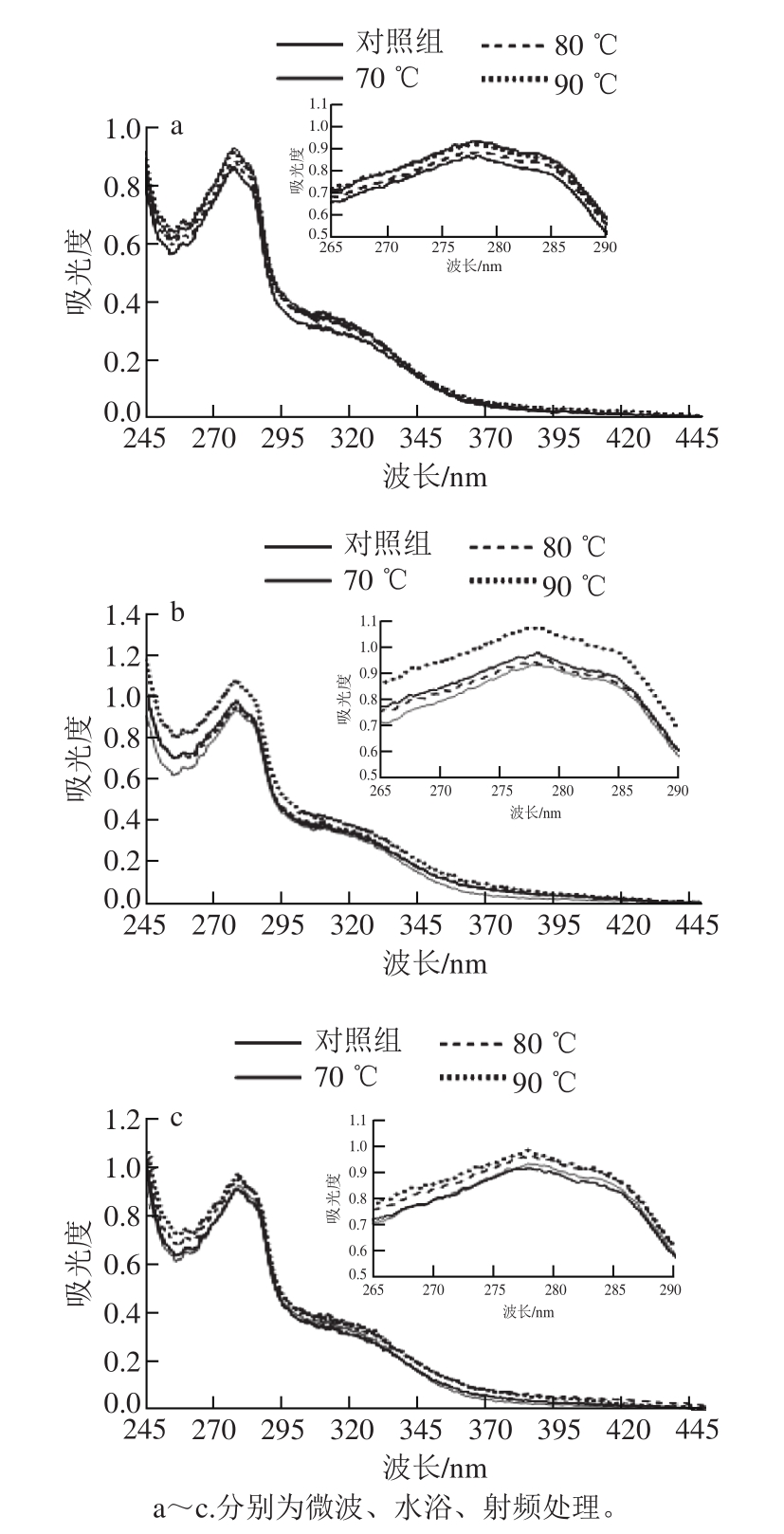
图7 不同热处理条件加热玉米醇溶蛋白分散液的紫外吸收光谱
Fig. 7 Ultraviolet absorption spectra of zein dispersion under different heat treatment conditions
紫外光谱扫描可以直接反应蛋白质的结构及化学变化。由图7观察到,玉米醇溶蛋白溶液在278 nm波长处表现出明显的紫外吸收,这归因于吸收峰波长分别为285 nm和277 nm的色氨酸和酪氨酸残基的振动。由图7a可知,在水浴加热条件下,峰强度相对于对照组有所下降,原因可能是蛋白质微观结构发生聚集,发色基团被包裹,紫外光吸收基团减少。微波加热(图7b)和射频加热(图7c)时,峰强度上升,可能的原因是蛋白质结构舒展,部分发色基团向外翻转,色氨酸和酪氨酸残基暴露。同样的,Sun Cuixia[13]和Tong Ping[29]等的研究表明,热处理可以增加玉米醇溶蛋白和卵转铁蛋白的紫外吸收。3 种不同的加热方式中,水浴加热峰强度整体下降,射频和微波加热峰强度整体上升。究其原因可能是因为热交换方式不同,水浴加热以热传导为主,射频和微波则通过电磁场达到热交换的目的。对于蛋白质分子微观结构,共价键、非共价键受分子振动摩擦发生断裂导致微观结构发生变化,这也可以解释微波加热时峰强度变化更明显,相较于射频处理,微波作用更加剧烈,对分子结构的影响也更大。
通过傅里叶变换红外光谱可对蛋白结构进行分析,3 600~3 300 cm-1位置的峰强度通常可以表示玉米醇溶蛋白分子间和分子内部氢键以及O—H、N—H键的伸缩振动强度[30]。如图8所示,3 600~3 300 cm-1位置的峰强度在70 ℃时先降低后随着处理温度升高而逐渐增强,表明热处理会改变玉米醇溶蛋白的水合能力。此外,位于2 932 cm-1位置的峰变化较小,说明射频加热处理没有对玉米醇溶蛋白分子内的C—H键产生较大的影响[31]。
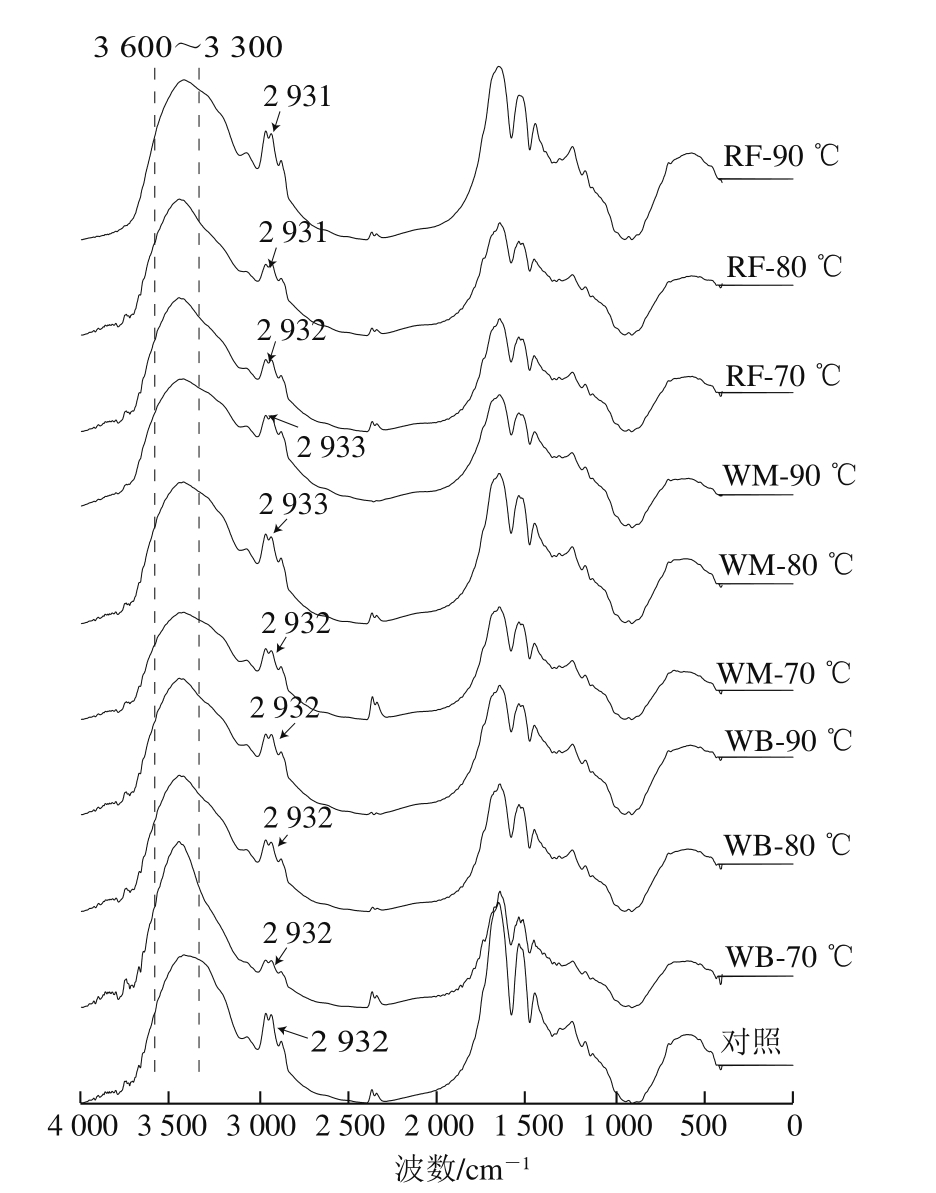
图8 不同热处理条件加热玉米醇溶蛋白分散液的傅里叶变换红外光谱图
Fig. 8 Fourier transform infrared spectra of zein dispersion under different heat treatment conditions
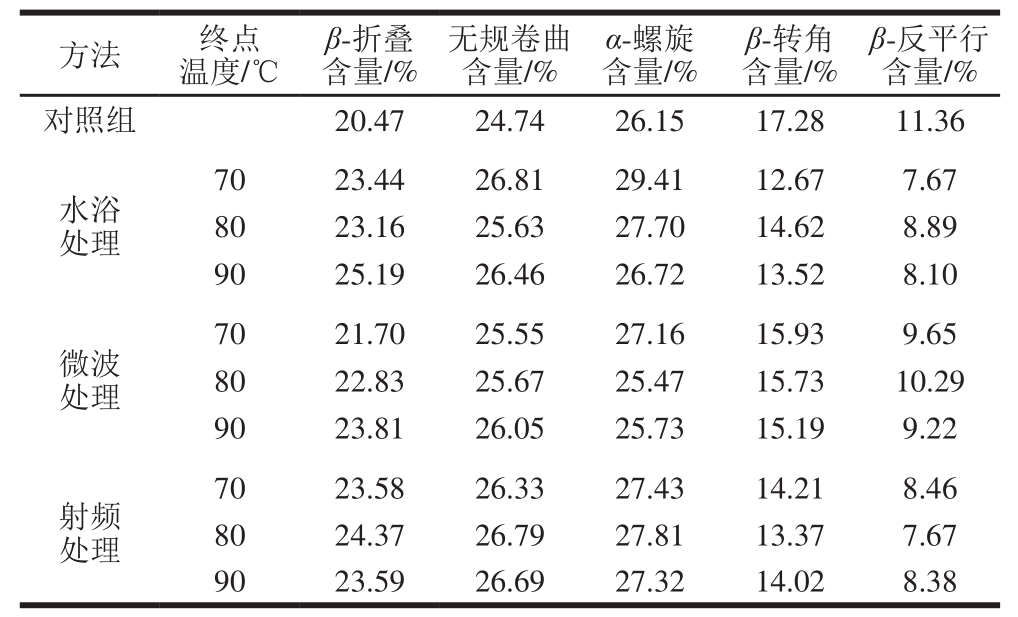
蛋白质红外光谱酰胺I带(1 700~1 600 cm-1)经傅里叶去卷积并转化为二阶导数图谱可以用来分析蛋白质的二级结构[32]。峰所处位置归属的二级结构如下:1 642~1 610 cm-1归属为β-折叠;1 650~1 642 cm-1归属为无规卷曲;1 660~1 650 cm-1归属为α-螺旋;1 680~1 660 cm-1归属为β-转角;1 700~1 680 cm-1归属为β-反平行[33]。热处理前后酰胺I带二阶导数图谱及玉米醇溶蛋白二级结构含量分别如图9和表1所示。3 种处理方式均使玉米醇溶蛋白的无规卷曲、β-折叠结构含量增加,但是减少了β-转角和β-反平行结构含量。其中,无规卷曲、β-折叠结构含量增加最明显的是射频处理,上升范围分别为6.43%~8.29%和15.19%~19.05%,水浴加热至70 ℃可使β-转角含量下降26.68%,射频处理至80 ℃可使β-反平行含量下降32.48%,说明热处理可有目的地改变玉米醇溶蛋白的二级结构。水浴和射频处理后的玉米醇溶蛋白α-螺旋结构含量均上升,微波处理至70 ℃时,α-螺旋结构含量也上升,但加热至80、90 ℃含量下降,这可能是更强的交变电场强度及温度同时作用导致的。微波加热处理蛋白质的研究也显示,在微波加热过程中麦谷蛋白二级结构发生的无规则变化可能是微波的非热效应导致的[16]。


图9 不同热处理及对照酰胺I带二阶导数谱图
Fig. 9 Deconvoluted infrared spectra of amide I band of native and heat treated zein samples
表1 玉米醇溶蛋白二级结构含量
Table1 Secondary structure contents of zein samples
3 种热处理方式均能显著提高玉米醇溶蛋白溶解度、乳化能力和巯基含量,并随着终点处理温度的升高而升高。在对蛋白溶解度和巯基含量的测定中,射频处理影响最大,微波处理次之,水浴处理影响最小。DSC分析表明除微波处理外,蛋白热稳定性基本呈下降趋势。紫外光谱分析表明,水浴处理使蛋白质聚集、基团被包裹,微波和射频处理使分子结构舒展、基团暴露。傅里叶变换红外光谱分析表明,热处理使玉米醇溶蛋白水合能力下降,二级结构由β-折叠、α-螺旋、无规卷曲向β-转角、β-反平行转变,射频和微波处理对其的影响更大。
参考文献:
[1] TORRES-GINER S, GIMENEZ E, LAGARON J M. Characterization of the morphology and thermal properties of zein prolamine nanostructures obtained by electrospinning[J]. Food Hydrocolloids,2008, 22(4): 601-614. DOI:10.1016/j.foodhyd.2007.02.005.
[2] 何东平, 胡传荣. 玉米醇溶蛋白生产技术[J]. 食品科技, 1997, 22(5):16-17. DOI:10.13684 /j.cnki.spkj.1997.05.008.
[3] ZHONG Q X, JIN M F. Zein nanoparticles produced by liquidliquid dispersion[J]. Food Hydrocolloids, 2009, 23(8): 2380-2387.DOI:10.1016/j.foodhyd.2009.06.015.
[4] 李红梅, 侯立琪, 马兴胜. 玉米蛋白去酰胺改性的研究[J]. 粮食与饲料工业, 2007(4): 19-21.
[5] 罗晶, 涂瑾, 黄婷玉, 等. 玉米醇溶蛋白的磷酸化修饰及结构研究[J]. 现代食品科技, 2015, 31(8): 88-94. DOI:10.13982/j.mfst.1673-9078.2015.8.016.
[6] 周利敏, 刘晓兰, 刘玥, 等. TGase催化玉米醇溶蛋白糖基化改性[J]. 食品科学, 2014, 35(24): 15-19. DOI:10.7506/spkx1002-6630-201424003.
[7] 郑喜群, 马艳秋, 刘晓兰, 等. 挤压膨化对玉米醇溶蛋白结构特性的影响[J]. 华南理工大学学报(自然科学版), 2014, 42(3): 131-136.DOI:10.3969/j.issn.1000-565X.2014.03.021.
[8] SHEN L L, ZHU Q Q, HUANG F W, et al. Effect of heat treatment on structure and immunogenicity of recombinant peanut protein Ara h 2.01[J]. LWT-Food Science and Technology, 2015, 60(2):964-969. DOI:10.1016/j.lwt.2014.10.044.
[9] GEAGEA H, GOMAA A I, REMONDETTO G, et al. Investigation of the protective effect of whey proteins on lactococcal phages during heat treatment at various pH[J]. International Journal of Food Microbiology,2015, 210: 33-41. DOI:10.1016/j.ijfoodmicro.2015.06.011.
[10] BOURBON A I, PINHEIRO A C, CARNEIRO-DA-CUNHA M G, et al.Development and characterization of lactoferrin-GMP nanohydrogels:evaluation of pH, ionic strength and temperature effect[J]. Food Hydrocolloids, 2015, 48: 292-300. DOI:10.1016/j.foodhyd.2015.02.026.
[11] 李杨, 王中江, 王瑞, 等. 不同热处理条件下大豆分离蛋白的红外光谱分析[J]. 食品工业科技, 2016, 37(8): 104-109. DOI:10.13386/j.issn1002-0306.2016.08.013.
[12] SELLING G W, SAH H, SESSA D J. Effect of solvent and temperature on secondary and tertiary structure of zein by circular dichroism[J]. Cereal Chemistry, 2007, 84(3): 265-270. DOI:10.1094/CCHEM-84-3-0265.
[13] SUN Cuixia, DAI Lei, HE Xiaoye, et al. Effect of heat treatment on physical, structural, thermal and morphological characteristics of zein in ethanol-water solution[J]. Food Hydrocolloids, 2016, 58: 11-19.DOI:10.1016/j.foodhyd.2016.02.014.
[14] 郭超凡, 王云阳. 蛋白质物理改性的研究进展[J]. 食品安全质量检测学报, 2017, 8(2): 428-433.
[15] GUAN Junjun, ZHANG Tongbin, HUI Ming, et al. Mechanism of microwave-accelerated soy protein isolate-saccharide graft reactions[J]. Food Research International, 2011, 44(9): 2647-2654.DOI:10.1016/j.foodres.2011.05.015.
[16] 张海华, 朱科学, 陈晔, 等. 微波处理对小麦面筋蛋白结构的影响[J].食品科学, 2011, 32(5): 65-69.
[17] GUO Chaofan, ZHANG Zhenna, CHEN Jiajia, et al. Effects of radio frequency heating treatment on structure changes of soy protein isolate for protein modification[J]. Food and Bioprocess Technology, 2017,10(8): 1574-1583. DOI:10.1007/s11947-017-1923-2.
[18] BECK M I, TOMKA I, WAYSEK E. Physico-chemical characterization of zein as a film coating polymer: a direct comparison with ethyl cellulose[J]. International Journal of Pharmaceutics, 1996, 141(1/2):137-150. DOI:10.1016/0378-5173(96)04630-3.
[19] LI Yuanyuan, KONG Baohua, LIU Qian, et al. Improvement of the emulsifying and oxidative stability of myofibrillar protein prepared oil-in-water emulsions by addition of zein hydrolysates[J]. Process Biochemistry, 2016, 53: 116-124. DOI:10.1016/j.procbio.2016.11.010.
[20] BEVERIDGE T, TOMA S J, NAKAI S. Determination of SH- and SS- groups in some food proteins using Ellman’s reagent[J]. Journal of Food Science, 1974, 39(1): 49-51. DOI:10.1111/j.1365-2621.1974.tb00984.x.
[21] CABRA V, ARREGUIN R, VAZQUEZDUHALT R, et al. Effect of temperature and pH on the secondary structure and processes of oligomerization of 19 kDa alpha-zein[J]. Biochimica et Biophysica Acta, 2006, 1764(6): 1110-1118. DOI:10.1016/j.bbapap.2006.04.002.
[22] THOSTENSON E T, CHOU T W. Microwave processing:fundamentals and applications[J]. Composites Part A Applied Science& Manufacturing, 1999, 30(9): 1055-1071. DOI:10.1016/S1359-835X(99)00020-2.
[23] RAMÍREZ-SUÁREZ J C, XIONG Y L. Rheological properties of mixed muscle/nonmuscle protein emulsions treated with transglutaminase at two ionic strengths[J]. International Journal of Food Science and Technology, 2003, 38(7): 777-785. DOI:10.1046/j.1365-2621.2003.00731.x.
[24] 蔡建荣, 张银志, 孙秀兰. 微波处理对大豆分离蛋白功能特性的影响[J]. 安徽农业科学, 2009, 37(2): 453-454. DOI:10.3969/j.issn.0517-6611.2009.02.007.
[25] WU W, WU X J, HUA Y F. Structural modification of soy protein by the lipid peroxidation product acrolein[J]. LWT-Food Science and Technology, 2010, 43(1): 133-140. DOI:10.1016/j.lwt.2009.05.006.
[26] 任晓锋. 扫频超声预处理对玉米醇溶蛋白特性及其酶法制备ACE抑制肽的影响[D]. 镇江: 江苏大学, 2014: 42-44.
[27] PETRUCCELLI S, ANON M C. Thermal aggregation of soy protein isolates[J]. Journal of Agricultural and Food Chemistry, 1996, 43(12):3035-3041. DOI:10.1021/jf00060a009.
[28] 王娜, 高育哲, 王庆峰, 等. 微波改性蛋白复合膜的制备及性质研究[J]. 食品与机械, 2015, 31: 160-164. DOI:10.13652/j.issn.1003-5788.2015.05.042.
[29] TONG Ping, GAO Jinyan, CHEN Hongbing, et al. Effect of heat treatment on the potential allergenicity and conformational structure of egg allergen ovotransferrin[J]. Food Chemistry, 2012, 131(2): 603-610. DOI:10.1016/j.foodchem.2011.08.084.
[30] SCHMIDT V, GIACOMELLI C, SOLDI V. Thermal stability of films formed by soy protein isolate-sodium dodecyl sulfate[J].Polymer Degradation & Stability, 2005, 87(1): 25-31. DOI:10.1016/j.polymdegradstab.2004.07.003.
[31] MONSOOR M A. Effect of drying methods on the functional properties of soy hull pectin[J]. Carbohydrate Polymers, 2005, 61(3):362-367. DOI:10.1016/j.carbpol.2005.06.009.
[32] CARBONARO M, NUCARA A. Secondary structure of food proteins by Fourier transform spectroscopy in the mid-infrared region[J]. Amino Acids, 2010, 38(3): 679-690. DOI:10.1007/s00726-009-0274-3.
[33] HE S, SHI J, WALID E, et al. Reverse micellar extraction of lectin from black turtle bean (Phaseolus vulgaris): optimisation of extraction conditions by response surface methodology[J]. Food Chemistry,2015, 166: 93-100. DOI:10.1016/j.foodchem.2014.05.156.
Effect of Different Heat Treatments on the Properties of Zein
ZHANG Xueying, GUO Chaofan, TAO Fei, WANG Yunyang, FU Hongfei*
(College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
Abstract:The effects of different heat treatments (hot water bath, microwave heating and radio frequency heating) and final temperatures (70, 80 and 90 ℃) on physicochemical properties and structure of zein were investigated. The results showed that three heat treatments could enhance the water solubility, emulsifying capacity and free thiol content of zein, and the effect increased with the increase in final temperature. The solubility, emulsifying capacity and of free sulfhydryl content of radio frequency treated samples at final temperature of 90 ℃ were increased by 74.65%, 171.7% and 53.94%, respectively.By differential scanning calorimetry, it was found that protein denaturation temperature increased slightly after microwave treatment. Furthermore, ultraviolet spectroscopy showed that the unfolding of the protein molecule associated with group exposure was induced by microwave and radio frequency, which improved the solubility and emulsifying ability of the protein. Meanwhile, Fourier transform infrared spectroscopy showed that heat treatment altered the secondary structure of zein, and the effects of microwave and radio frequency treatment were more pronounced.
Keywords:zein; protein denaturation; heat treatment; microwave; radio frequency
DOI:10.7506/spkx1002-6630-201813018
收稿日期:2017-06-21
基金项目:西北农林科技大学基本科研业务费专项资金项目(2452015067)
第一作者简介:张雪莹(1994—),女,硕士研究生,研究方向为食品工程与食品安全控制技术。E-mail:zhangxy1230@outlook.com
*通信作者简介:傅虹飞(1983—),女,讲师,博士,研究方向为天然产物化学。E-mail:fuhongfei@nwsuaf.edu.cn
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2018)13-0112-07
引文格式:张雪莹, 郭超凡, 陶飞, 等. 不同热处理方式对玉米醇溶蛋白特性的影响[J]. 食品科学, 2018, 39(13): 112-118.
DOI:10.7506/spkx1002-6630-201813018. http://www.spkx.net.cn
ZHANG Xueying, GUO Chaofan, TAO Fei, et al. Effect of different heat treatments on the properties of zein[J]. Food Science,2018, 39(13): 112-118. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201813018. http://www.spkx.net.cn