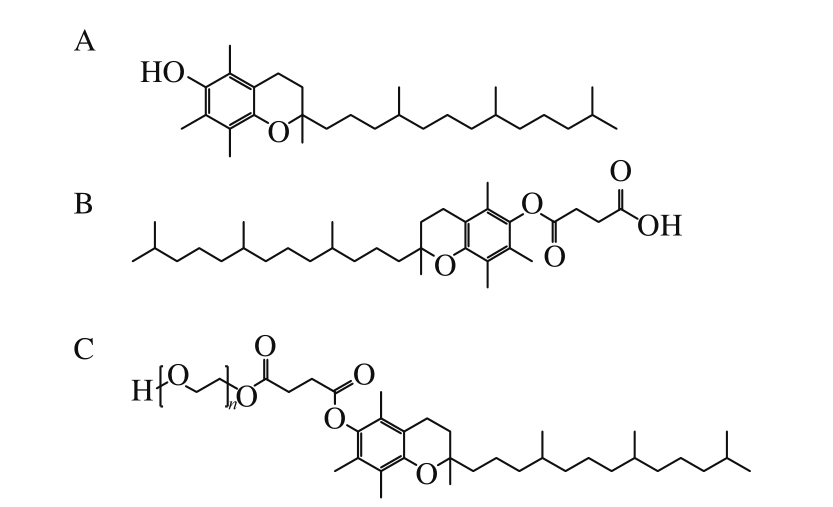
图1 VE(A)、α-TOS(B)和TPGS(C)的结构式
Fig. 1 Structures of VE (A), α-TOS (B) and TPGS (C)
韩静静,田丹丹,高玉星,肖春霞*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
摘 要:本研究对比了生育酚(tocopheryl,VE)、生育酚琥珀酸酯(α-tocopheryl succinate,α-TOS)、生育酚聚乙二醇1000琥珀酸酯(tocopheryl polyethylene glycol 1000 succinate,TPGS)对自由基诱导的蛋白质、脂质、DNA氧化损伤的保护作用,以及对人肝癌细胞(HepG2细胞)增殖抑制作用的差异。结果表明:TPGS对生物大分子氧化损伤的保护作用最明显,α-TOS次之,VE效果最弱。α-TOS、TPGS均能显著降低HepG2细胞存活率(P<0.05),其中TPGS效果更佳,而VE对HepG2细胞增殖无显著影响(P>0.05)。这可能是由于两亲性的TPGS疏水端吸附在生物大分子表面,亲水端在缓冲液中充分伸展,形成较大的空间位阻,保护生物大分子免受自由基攻击;同时,更好的水溶性使TPGS更易透过生物膜,提高了其在HepG2细胞内的有效浓度。本研究可为生育酚衍生物应用于健康营养食品提供理论依据。
关键词:生育酚;生育酚琥珀酸酯;生育酚聚乙二醇1000琥珀酸酯;生物大分子;HepG2细胞
VE又名生育酚,是生物体内的天然抗氧化剂,广泛分布于谷物、种子、果蔬和动物产品中,具有清除自由基[1]、维持哺乳动物及禽类生育[2-3]、调节免疫[4]、抑制血小板凝集和黏附[5]等功能。但VE不溶于水,遇碱不稳定,对氧气、光照敏感,易被氧化,并且某些金属离子如Fe2+可加速其氧化[6]。此外,Reboul等[7]发现VE的生物利用率不稳定,容易受到食物基质、食品加工过程等的影响,因此限制了其在食品、药品和化妆品等领域中的应用。随着研究的深入,一系列生育酚衍生物如生育酚醋酸酯(tocopheryl acetate,TA)、生育酚烟酸酯(tocopheryl nicotinate,TN)、生育酚琥珀酸酯(α-tocopheryl succinate,α-TOS)等被陆续报道。这些衍生物均是VE的游离羟基与醋酸、烟酸、琥珀酸的羧基酯化形成的酯类衍生物,由于VE的活泼羟基被保护,这些衍生物具有更好的稳定性,而亲水性羧基基团则增加了其水溶性。此外,这些衍生物还表现出良好的生物活性,这可能是由于新引入的酸酐结构导致了VE功能的变化[8]。Badraoui等[9]通过体内、体外实验证明,TA能抑制氧化应激损伤,并能诱导乳腺癌细胞凋亡。Schlieper等[10]发现TN具有改善心律不齐的功效。Prasad等[11]研究发现,与TA、TN相比,α-TOS对黑色素瘤细胞生长分化的抑制作用更明显。此外,α-TOS对结肠癌[12]、乳腺癌[13]、胃癌[14]等多种恶性肿瘤细胞的增殖有良好的抑制作用。Rego等[15]比较了TN和α-TOS对视网膜细胞氧化的抑制作用,结果表明后者作用更为明显。大量文献表明,在众多生育酚衍生物中α-TOS的生物活性较为突出[11-15]。近年来,一种新的生育酚衍生物——生育酚聚乙二醇1000琥珀酸酯(tocopheryl polyethylene glycol 1000 succinate,TPGS)的绿色合成研究备受关注[16],TPGS是α-TOS的游离羧基与大量聚乙二醇酯化而成,亲水性聚乙二醇极大地改善了TPGS的水溶性,由于其两亲性质,可作为增溶剂、乳化剂、稳定剂等使用[17-18]。Thi等[19]以TPGS为载体制备了不溶性药物的传递体系,可延长药物在血液及组织中的循环时间。Nguyen等[20]报道TPGS包裹紫杉醇可增加其体外摄取率,使其更容易进入固态瘤中心。Zhu Xianbing等[21]发现槲皮素经TPGS包裹,增加了其水溶性及抗紫外线损伤能力,并提高了其在皮肤表皮层和真皮层的存留量。TPGS已被美国食品药品监督管理局批准为安全的药用辅料[22],但关于TPGS的生物活性鲜有报道。
本研究对比了VE、α-TOS、TPGS对自由基诱导的生物大分子氧化损伤的保护作用,以及对人肝癌细胞(HepG2细胞)增殖的抑制作用,旨在比较研究VE不同衍生物之间生物活性的差异,探讨其内在机理,为VE及其衍生物在食品中的广泛应用提供一定的理论依据。
VE、α-TOS、TPGS(结构式见图1) 成都艾科化学技术有限公司;牛血清白蛋白(bovine serum albumin,BSA) 上海泽龙生物工程有限公司;2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis-2-methylpropanimidamide,dihydrochloride,AAPH)、鲱鱼精DNA(herring sperm DNA,hsDNA)、亚油酸(linoleic acid,LA)、偶氮二异庚腈(2,2’-azobis(2,4-dimethyl)valeronitrile,AMVN)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 美国Sigma公司;2,4-二硝基苯肼(2,4-dinitrophenyl hydrazine,DNPH)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Amresco公司;三氯乙酸 天津市博迪化工有限公司;硫代巴比妥酸(thiobarbituric acid,TBA) 国药集团药业股份有限公司;考马斯亮蓝 北京鼎国昌盛生物技术有限责任公司;五水硫酸铜、30%过氧化氢、七水合硫酸亚铁、磷酸二氢钠、磷酸氢二钠、无水乙醇、甲醇、冰乙酸均为分析纯。

图1 VE(A)、α-TOS(B)和TPGS(C)的结构式
Fig. 1 Structures of VE (A), α-TOS (B) and TPGS (C)
HepG2细胞购自上海生命科学研究院,用含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基在37 ℃、5% CO2条件下培养。
电泳仪(电泳供电装置)、凝胶成像系统 美国伯乐公司;UV-2450型紫外-可见分光光度计 日本Shimadzu公司;BP211D型精密电子天平 德国Startorius公司;HH-2型恒温水浴锅 江苏省金坛市环宇科学仪器厂;Max M2型多功能微孔板检测仪 美国Molecular公司。
1.3.1 Cu2+/H2O2诱导BSA氧化、羰基化的测定
在BSA终质量浓度为0.8 mg/mL的反应体系中,先加入不同浓度的VE、α-TOS和TPGS使其终浓度分别为10、50、100、500、1 000 µmol/L(均用甲醇溶解),空白组以等体积的磷酸盐缓冲液代替,模型组以等体积的甲醇代替,漩涡振荡混匀,置于37 ℃水浴中预处理10 min。然后加入Cu2+/H2O2反应体系(空白组不加),并将所有反应组用磷酸盐缓冲液定容至500 μL,使Cu2+和H2O2的终浓度分别为100 µmol/L和2.5 mmol/L,37 ℃水浴反应60 min。反应结束后,采用考马斯亮蓝R-250染色法检测BSA氧化损伤程度,采用DNPH比色法检测BSA羰基化程度[23]。
1.3.2 AAPH诱导BSA氧化、羰基化的测定
蛋白模型和VE、α-TOS、TPGS处理方法同1.3.1节,预处理结束后加入AAPH(空白组不加),使其终浓度为50 mmol/L,置于37 ℃水浴反应5 h。反应结束后,采用考马斯亮蓝R-250染色法检测BSA氧化损伤程度,采用DNPH比色法检测BSA羰基化程度[23]。
1.3.3 自由基诱导LA过氧化的测定
采用Fe2+/VC反应体系产生的羟自由基(·OH)[24]、AMVN热分解产生的烷氧自由基(ROO·)[25]诱导LA发生脂质过氧化反应。
在LA(甲醇助溶)终浓度为1 mmol/L的反应体系中,先分别加入不同浓度的VE、α-TOS和TPGS使其终浓度分别为10、50、100、500、1 000 µmol/L(均用甲醇溶解),空白组以等体积的磷酸盐缓冲液代替,模型组以等体积的甲醇代替,混匀后加入Fe2+/VC或AMVN(空白组不加),将所有反应组用磷酸盐缓冲液定容至1 mL,使反应体系中Fe2+、VC、AMVN的终浓度分别为50 µmol/L和1、10 mmol/L。Fe2+/VC体系37 ℃水浴避光反应24 h,AMVN体系反应12 h。反应结束后,以硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)浓度表示LA脂质过氧化水平[26]。
1.3.4 AAPH诱导DNA氧化损伤的测定
在hsDNA终质量浓度为2 mg/mL的反应体系中,先加入不同浓度的VE、α-TOS和TPGS使其终浓度分别为10、50、100、500、1 000 µmol/L(均用甲醇溶解),空白组以等体积的磷酸盐缓冲液代替,模型组以等体积的甲醇代替,再加入AAPH溶液(空白组不加),并用磷酸盐缓冲液将所有反应组定容至1 mL,使AAPH的终浓度为40 mmol/L,混匀后37 ℃水浴反应12 h。反应结束后采用TBA法检测DNA氧化损伤程度[27]。
1.3.5 MTT法测定细胞活力
将HepG2细胞接种于96 孔板中,置于37 ℃、5% CO2培养箱培养过夜,使细胞贴壁。分别加入不同浓度(10、20、30、40、50 µmol/L)的VE、α-TOS和TPGS,空白组不加。每组设置8 个平行,置于37 ℃、5% CO2培养箱中继续培养24 h。弃上清液,每孔加入100 μL终质量浓度为0.5 mg/mL的MTT溶液,置于培养箱中继续培养,4 h后弃去培养液,每孔加入100 μL DMSO,置于摇床上低速振荡10 min,使结晶物充分溶解。使用多功能微孔板检测仪测定各孔在570 nm波长处的OD值,并根据下式计算细胞存活率。
数据用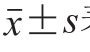 表示,采用SPSS 20.0软件进行单因素方差分析,使用Duncan’s法进行多重比较,以P<0.05表示差异显著,以P<0.01表示差异极显著。
表示,采用SPSS 20.0软件进行单因素方差分析,使用Duncan’s法进行多重比较,以P<0.05表示差异显著,以P<0.01表示差异极显著。
2.1.1 VE、α-TOS和TPGS对Cu2+/H2O2诱导BSA氧化降解的影响
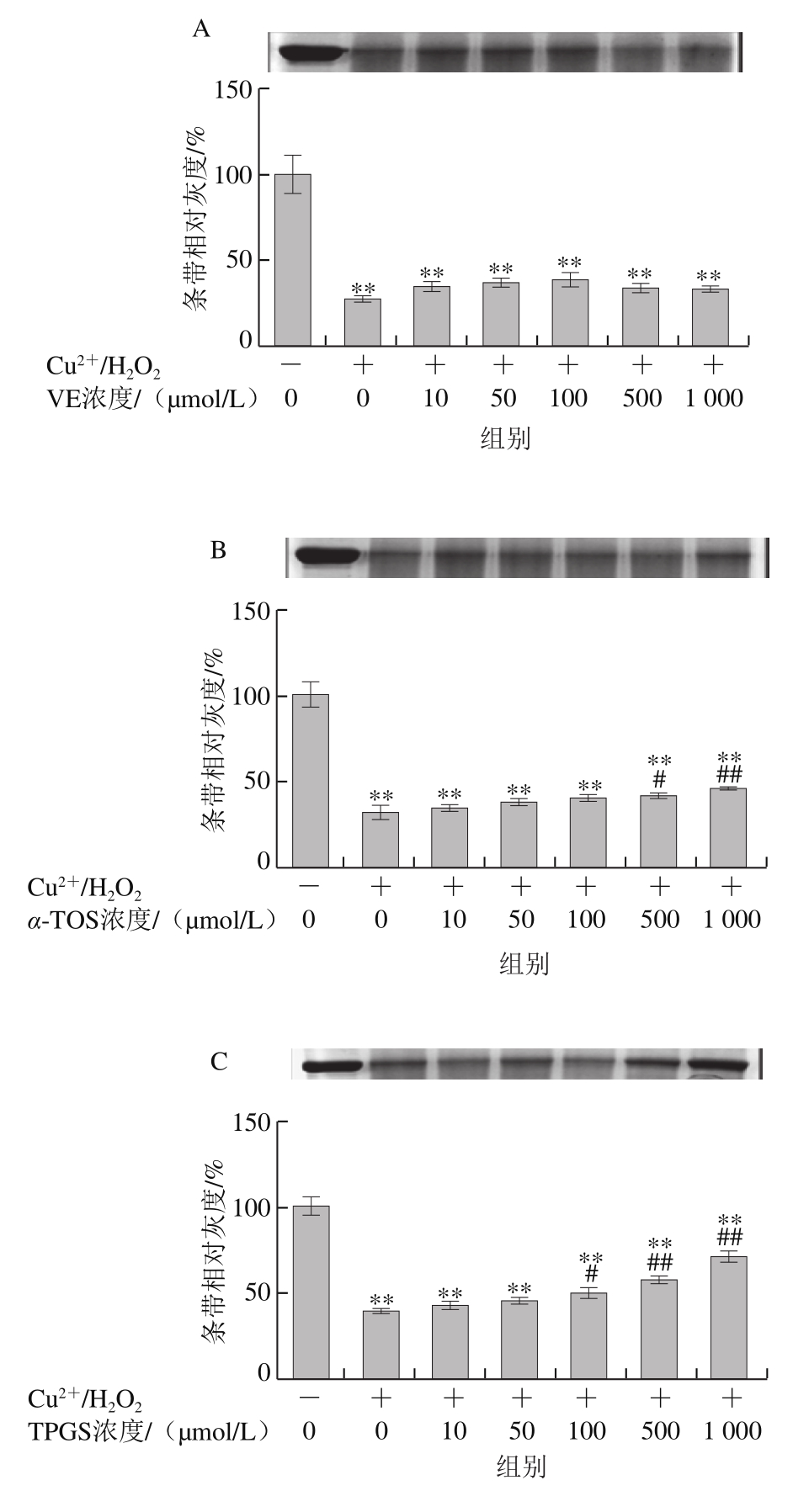
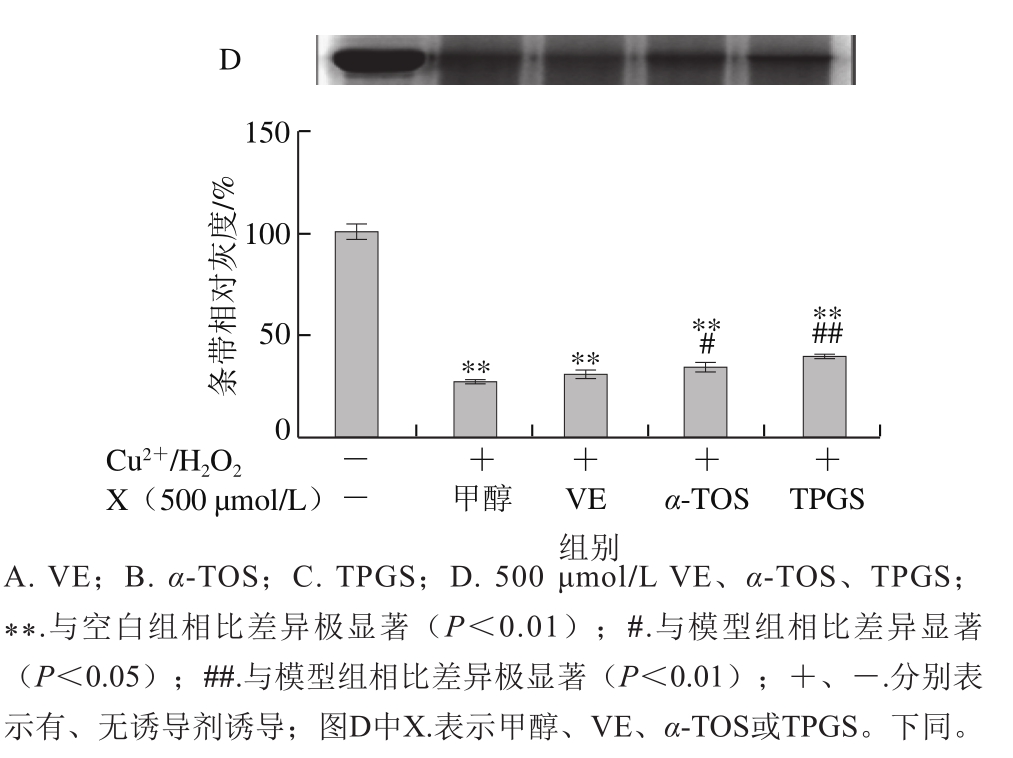
图2 VE、α-TOS和TPGS对Cu2+/H2O2诱导BSA氧化降解的影响
Fig. 2 Effects of VE, α-TOS and TPGS on Cu2+/H2O2-induced BSA oxidative degradation
Fe2+、Fe3+、Cu2+、Mn2+、Ni2+等金属离子可以催化H2O2分解,产生氧化活性更高的·OH,·OH能与所有氨基酸反应[28],因此本实验采用Cu2+/H2O2反应体系诱导BSA氧化损伤,探讨VE、α-TOS和TPGS对自由基诱导BSA氧化降解的抑制作用。从图2A可以看出,VE对Cu2+/H2O2诱导的BSA氧化降解没有明显规律性。而α-TOS、TPGS均浓度依赖性地抑制了BSA的氧化降解,在500、1 000 μmol/L浓度下,α-TOS和TPGS的抑制作用显著。由图2D可知,相同浓度下(500 μmol/L),与VE、α-TOS相比,TPGS对Cu2+/H2O2诱导的BSA氧化降解的抑制作用最明显,与模型组相比差异极显著(P<0.01)。
2.1.2 VE、α-TOS和TPGS对AAPH诱导BSA氧化降解的影响
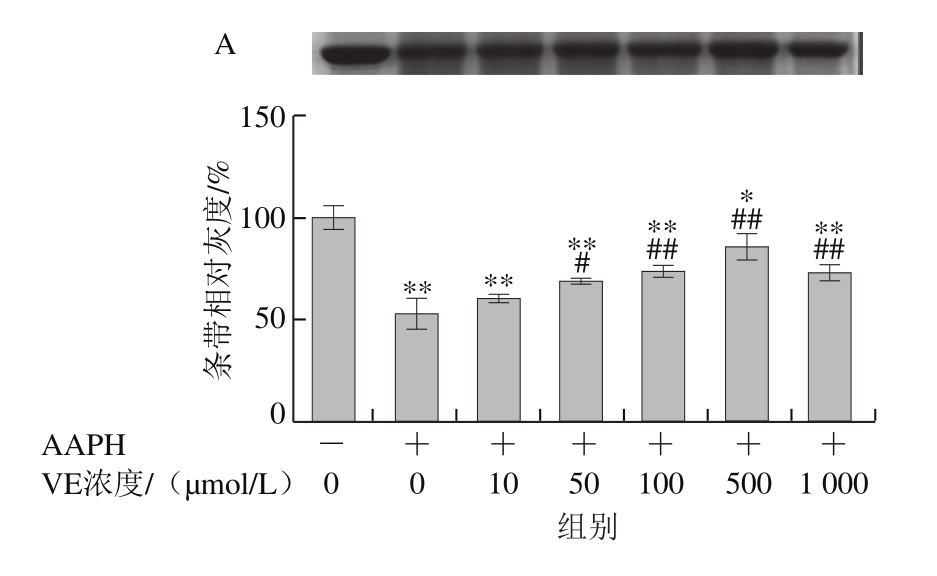
AAPH是一种水溶性的偶氮类化合物,通过均裂产生ROO·,在37 ℃和中性pH值条件下能稳定地产生自由基[29]。如图3所示,VE、α-TOS和TPGS均能显著抑制AAPH诱导的BSA氧化降解,在10~500 μmol/L浓度范围内呈浓度依赖性,并且在500 μmol/L时最强,在1 000 μmol/L时有所减弱,但与模型组相比仍有极显著差异(P<0.01)。图3D表明,相同浓度(500 μmol/L)处理时,TPGS的抑制作用最明显,且与空白组相比没有显著差异,即500 μmol/L的TPGS很好地抑制了AAPH诱导的BSA氧化降解。
2.1.3 VE、α-TOS和TPGS对Cu2+/H2O2诱导BSA羰基化的影响
如图4所示,BSA本身羰基化程度很低,在Cu2+/H2O2作用下发生明显的羰基化修饰。加入VE、α-TOS和TPGS后,BSA羰基化程度明显受到抑制,且抑制作用随浓度的升高而增强。由图4D可知,相同浓度(500 μmol/L)的VE、α-TOS和TPGS均能显著抑制BSA羰基的产生,但TPGS抑制作用最明显。
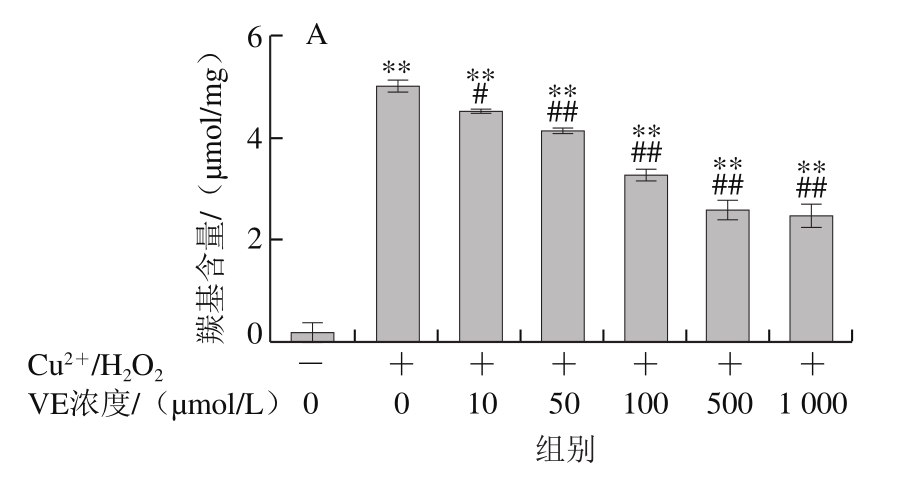
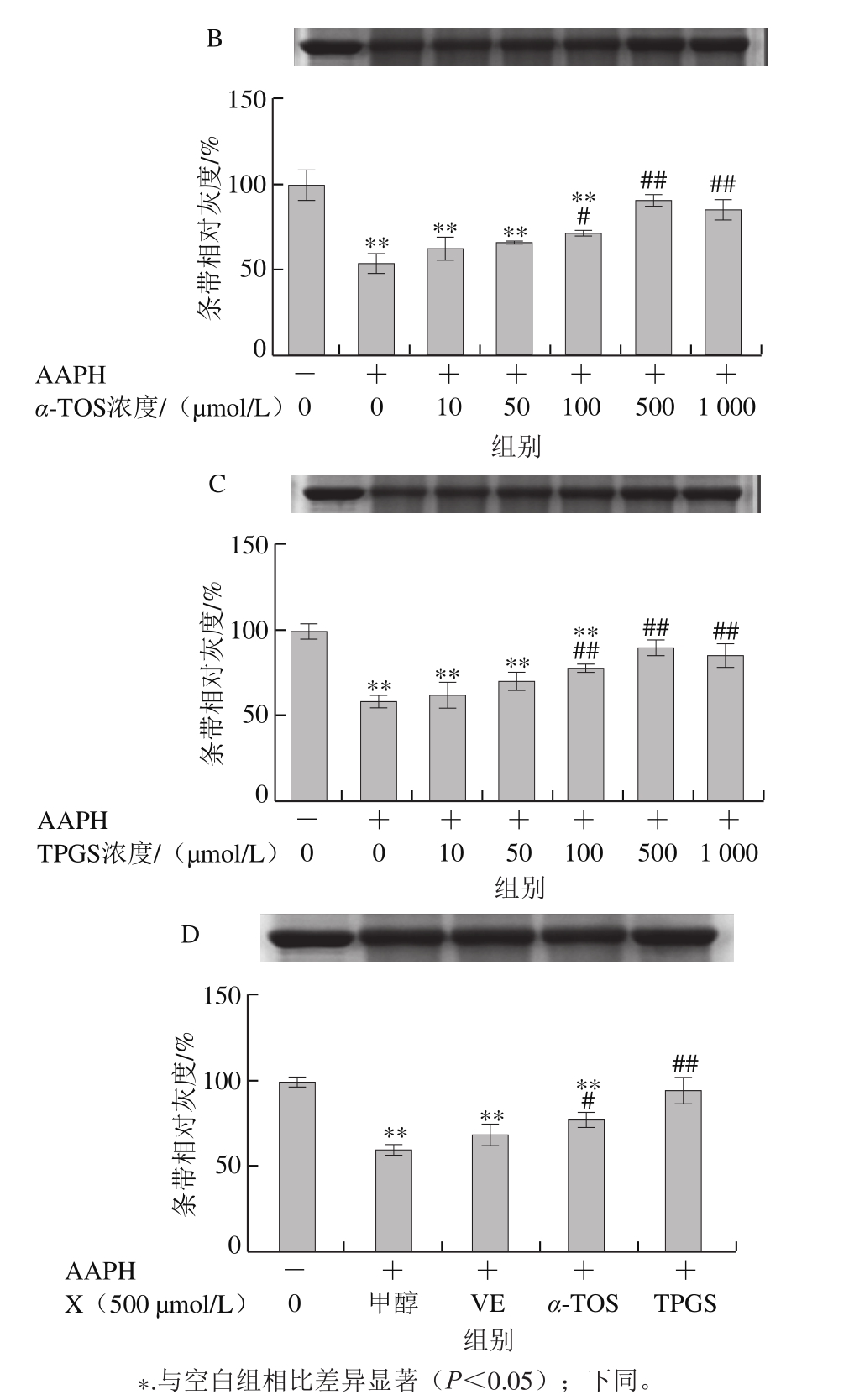
图3 VE、α-TOS和TPGS对AAPH诱导BSA氧化降解的影响
Fig. 3 Effects of VE, α-TOS and TPGS on AAPH -induced BSA oxidative degradation
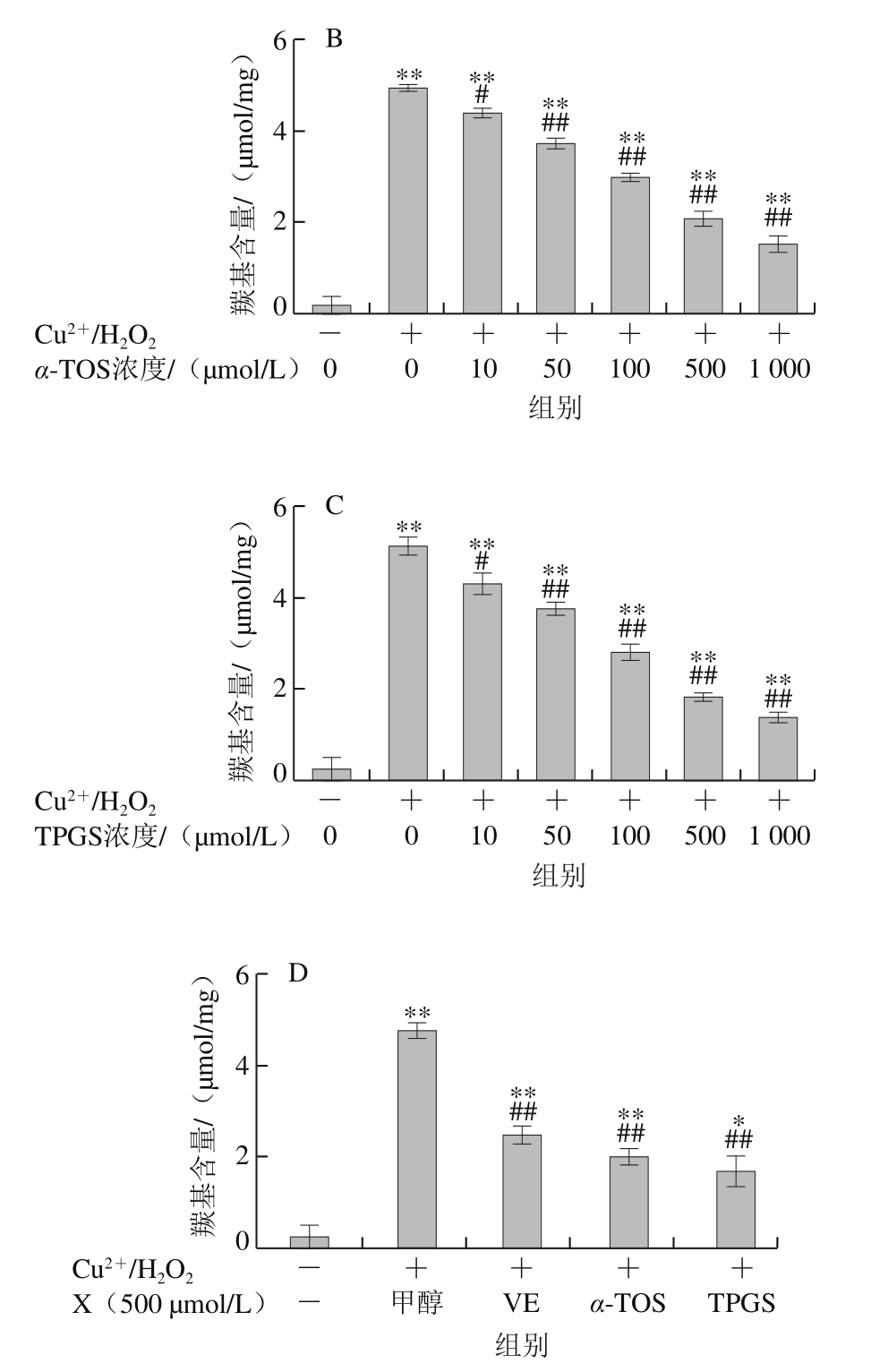
图4 VE、α-TOS和TPGS对Cu2+/H2O2诱导BSA羰基化的影响
Fig. 4 Effect of VE, α-TOS and TPGS on Cu2+/H2O2-induced carbonylation of BSA
2.1.4 VE、α-TOS和TPGS对AAPH诱导BSA羰基化的影响
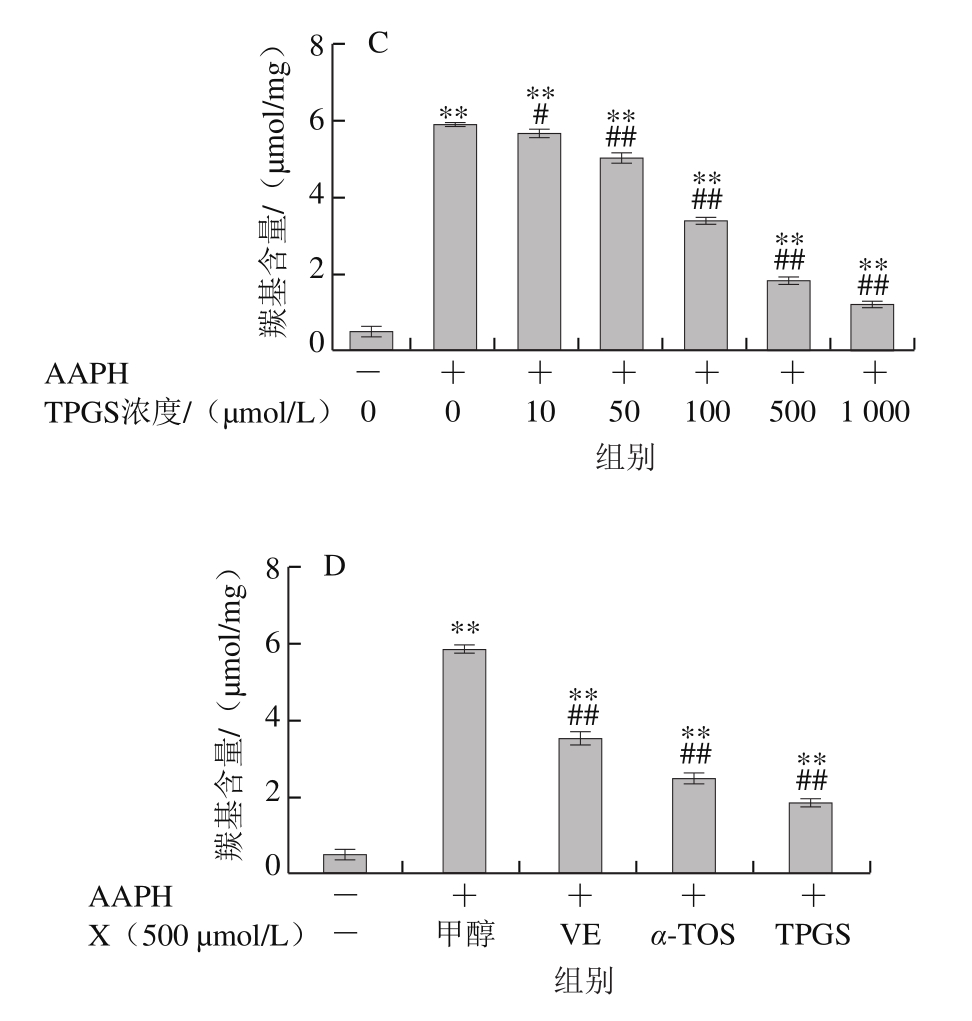
图5 VE、α-TOS和TPGS对AAPH诱导BSA羰基化的影响
Fig. 5 Effects of VE, α-TOS and TPGS on AAPH-induced carbonylation of BSA
由图5可知,AAPH诱导BSA发生明显的羰基化修饰。VE、α-TOS和TPGS均浓度依赖性地抑制BSA羰基化修饰。如图5D所示,500 μmol/L的VE、α-TOS和TPGS均显著抑制了BSA羰基的产生,其中TPGS对AAPH诱导的BSA羰基化损伤的抑制作用最明显。
2.2.1 VE、α-TOS和TPGS对Fe2+/VC诱导LA过氧化的影响
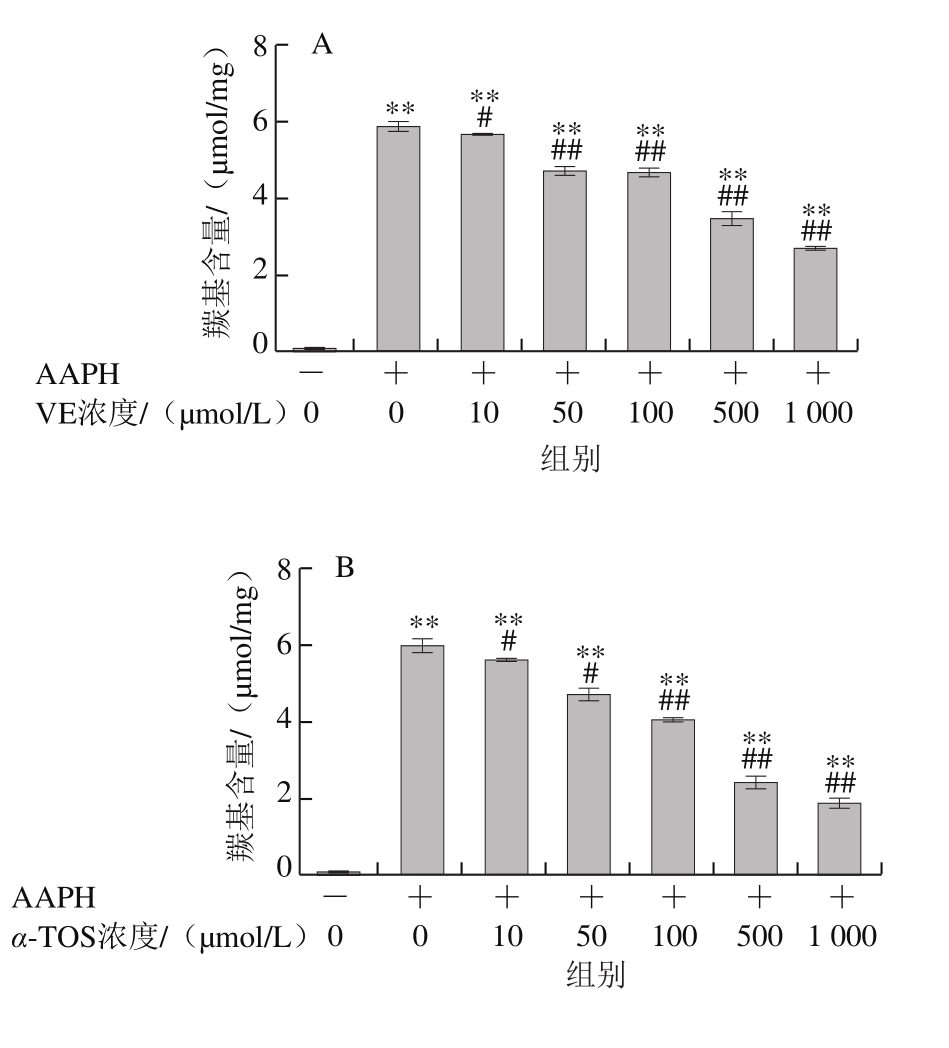
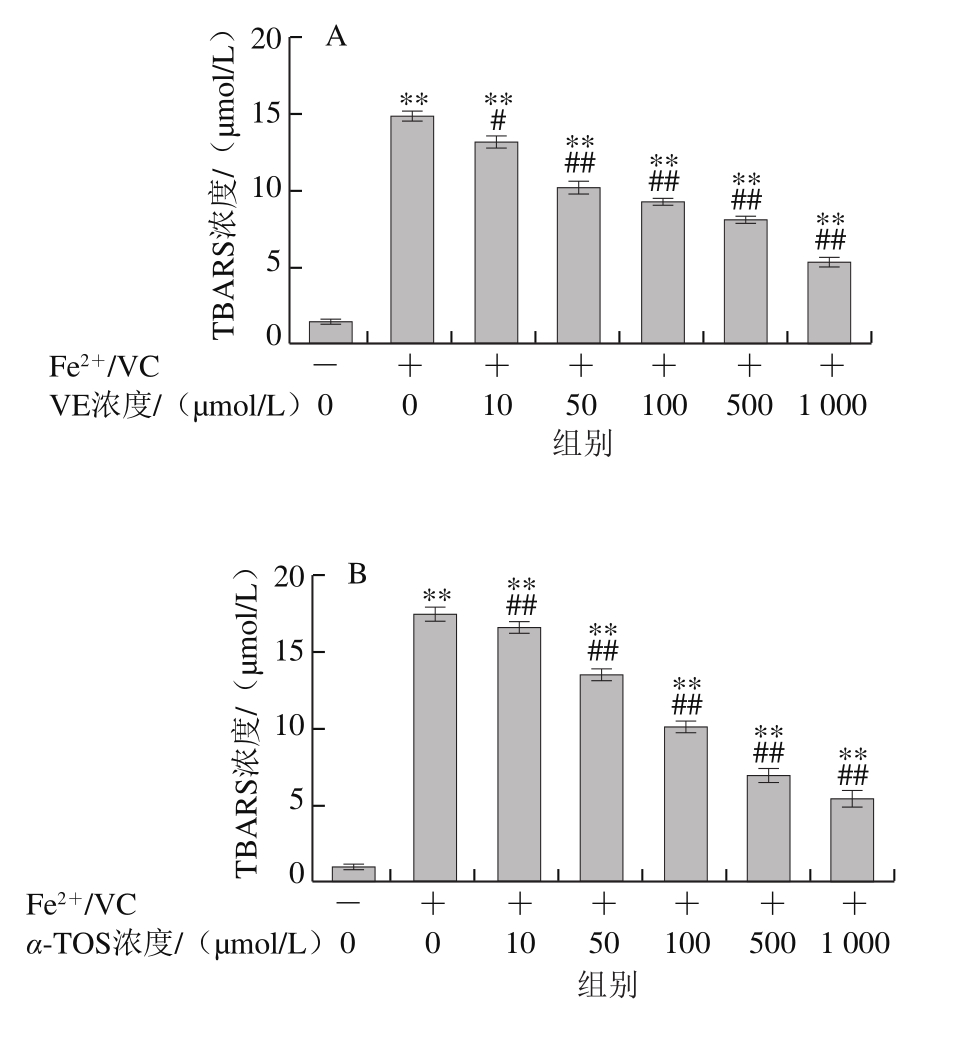

图6 VE、α-TOS和TPGS对Fe2+/VC诱导LA过氧化的影响
Fig. 6 Effects of VE, α-TOS and TPGS on LA peroxidation induced by Fe2+/VC
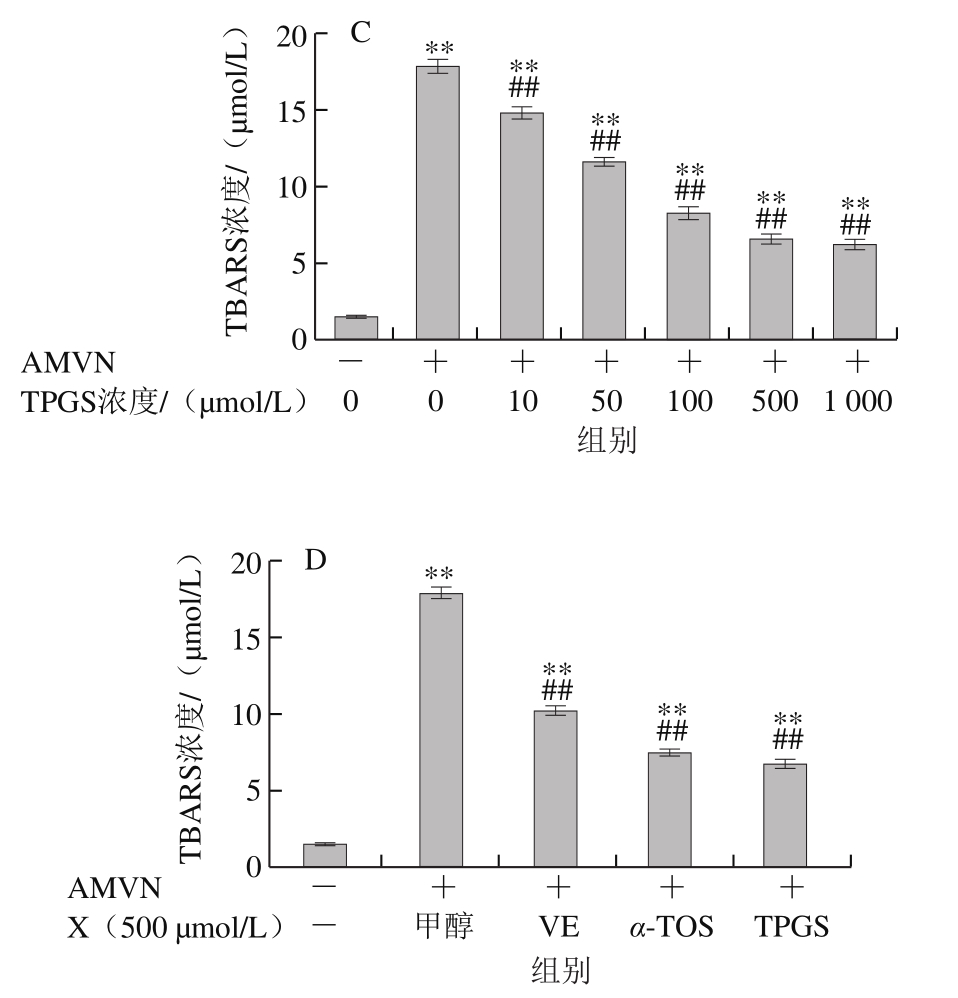
图7 VE、α-TOS和TPGS对AMVN诱导LA过氧化的影响
Fig. 7 Effects of VE, α-TOS and TPGS on LA peroxidation induced by AMVN
LA在脂质过氧化过程中会形成亚油酸氢过氧化物、4-羟基壬烯醛、丙二醛等氧化产物,这些产物能与TBA发生反应生成TBARS,其含量是衡量脂质过氧化程度的重要指标之一[30]。由图6可知,LA在自然条件下自氧化反应很慢,生成TBARS浓度较低,Fe2+/VC反应体系诱导LA发生过氧化反应,VE、α-TOS和TPGS均显著抑制了LA过氧化,且其抑制作用随浓度的升高而增强。图6D表明,相同浓度(500 μmol/L)下,TPGS对LA过氧化的抑制作用最强。
2.2.2 VE、α-TOS和TPGS对AMVN诱导LA过氧化的影响
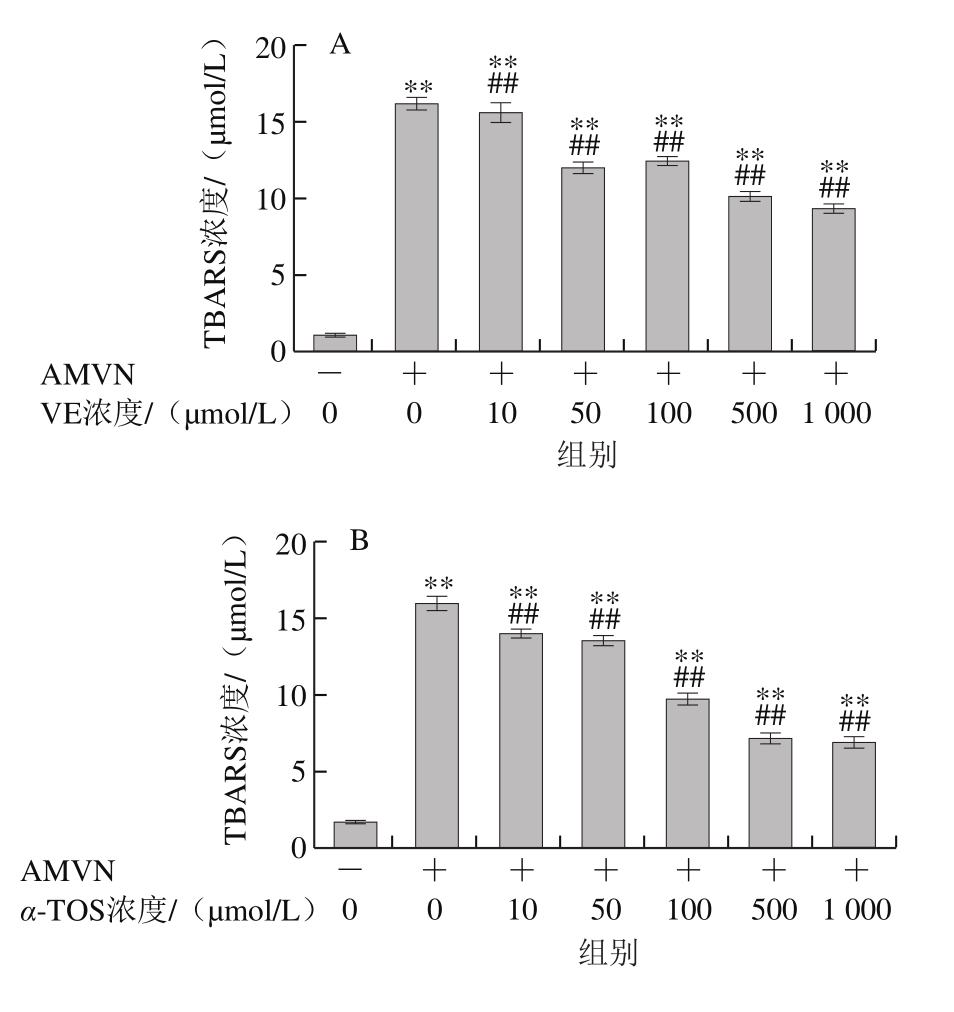
AMVN是一种脂溶性偶氮类化合物,通过热分解产生ROO·,常作为自由基引发剂用于脂质过氧化反应模型的建立[31]。如图7所示,LA自然条件下生成的TBARS浓度很低,AMVN诱导LA发生过氧化反应,TBARS浓度极显著增加(P<0.01)。图7A~C表明,VE、α-TOS和TPGS均浓度依赖性地抑制了LA过氧化。图7D表明,相同浓度(500 μmol/L)的VE、α-TOS和TPGS中,TPGS对AMVN诱导的LA过氧化的抑制作用最强。
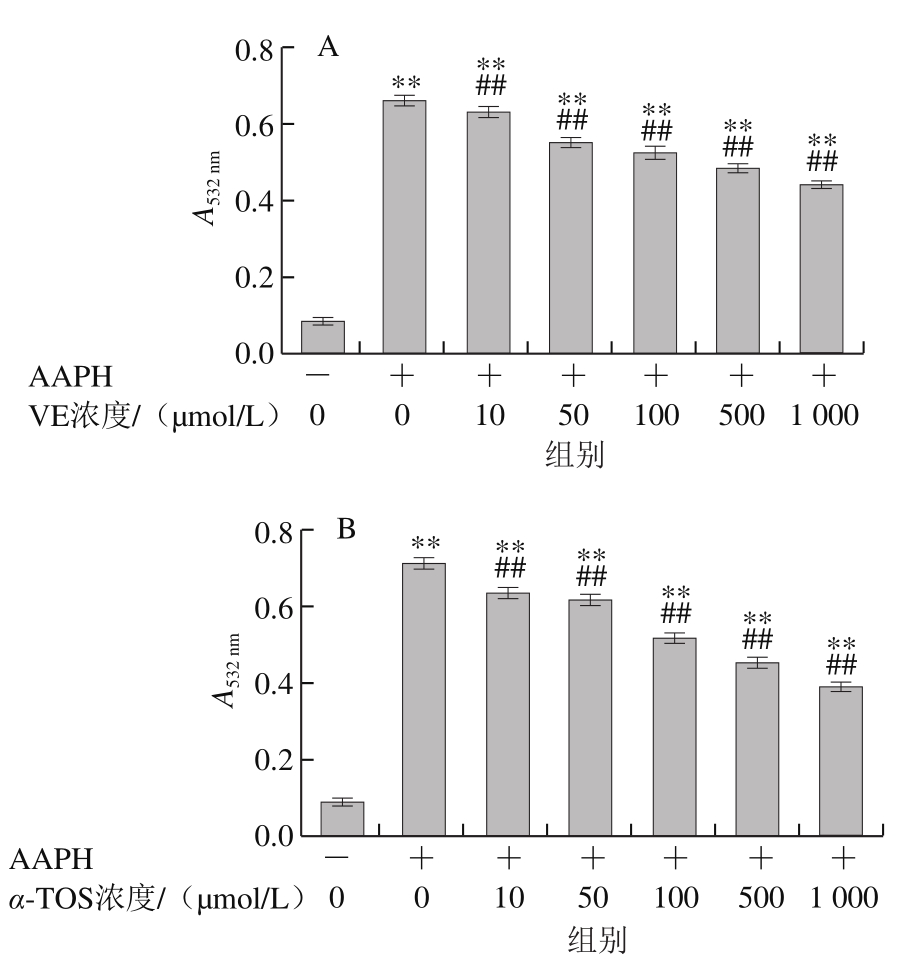

图8 VE、α-TOS和TPGS对AAPH诱导DNA氧化损伤的影响
Fig. 8 Effects of VE, α-TOS and TPGS on AAPH-initiated DNA oxidation
AAPH热分解生成的ROO·使DNA分子的双螺旋结构解旋,并最终生成含有羰基的20余种小分子化合物,DNA形成的裂解产物在酸性条件下与TBA反应生成TBARS[27],本实验通过检测TBARS含量来研究不同浓度的VE、α-TOS和TPGS对ROO·诱导DNA氧化损伤的抑制作用。由图8可知,hsDNA在AAPH诱导下发生氧化损伤。随着加入VE、α-TOS和TPGS浓度的增加,其对DNA氧化损伤的抑制作用增强。从图8D可以看出,相同浓度(500 μmol/L)下,TPGS对AAPH诱导的DNA氧化损伤的抑制作用最强。

图9 VE、α-TOS和TPGS对HepG2细胞活力的影响
Fig. 9 Effects of VE, α-TOS and TPGS on HepG2 cell viability
活细胞能将外源性的MTT还原为水不溶性的蓝紫色结晶甲瓒,并沉积在细胞中,经DMSO溶解并测定其OD值可间接反映活细胞数量。MTT法是测定细胞活力最常见、直接的方法[32]。如图9所示,以空白组细胞存活率为100%,VE对HepG2细胞存活率没有明显影响;而随着α-TOS、TPGS浓度的增加,HepG2细胞存活率逐渐下降,与空白组相比差异极显著(P<0.01),其中TPGS对HepG2细胞增殖抑制作用最强。
VE常作为油脂加工中的抗氧化剂应用在肉类腌制中防止亚硝胺的生成,此外还具有多种生理功能。Azzi等[33]报道VE能改善与氧化应激相关的心血管疾病、癌症、神经退行性疾病、白内障等疾病。Bošković等[34]发现补充一定量的VE可改善精神分裂症患者的运动阻滞状况。但VE在氧气存在条件下不稳定,α-TOS和TPGS通过酯化修饰提高了化学稳定性,其中α-TOS能显著抑制巨噬细胞NO的生成[35],并降低环孢菌素A对大鼠肝细胞的毒性[36]。TPGS由于具有良好的水溶性,被广泛应用于难溶药物的传递体系中,以提高药物的渗透性和吸收效率[18,37-38],但尚鲜有针对VE和其水溶性衍生物α-TOS、TPGS生物活性差异的报道。
自由基具有未配对电子,化学性质非常活泼。在正常条件下,自由基参与细胞内的信号转导、免疫防御、增殖、凋亡等多种生理活动[39]。当体内氧化和抗氧化体系平衡被打破时,过量的自由基就会攻击体内的蛋白质、脂质、DNA等生物大分子,最终造成机体损伤。活性氧簇(reactive oxygen species,ROS)是自由基的一种,在应激状态下可攻击蛋白质、脂质、DNA等,进而诱发多种疾病,例如肿瘤[40]、神经退行性疾病[41]等。研究表明,ROS不仅参与肿瘤的产生,还与肿瘤的转移密切相关[42]。
本实验以Cu2+/H2O2、AAPH、AMVN等体系诱导产生自由基,对比研究VE、α-TOS、TPGS对自由基引起的生物大分子体外损伤的保护作用,结果表明,与VE、α-TOS相比,TPGS对生物大分子(蛋白质、脂质、DNA)损伤的保护作用最强。许多学者曾认为α-TOS发挥抗肿瘤功效是由于α-TOS水解释放的VE发挥的作用,但多项研究表明,α-TOS是以整体的分子形式发挥作用,并不依赖于VE[43-44]。本研究结果显示,TPGS对自由基诱导的生物大分子损伤的保护作用优于VE,推测TPGS可能也是以整体分子形式发挥抗氧化作用的,而不依赖于其水解产生的VE。TPGS结构中的琥珀酸酯保护了化学性质活泼的酚羟基,提高其稳定性,而高度聚合的聚乙二醇结构保护琥珀酸的另一个游离羧基,随着聚乙二醇链段长度的增加,亲水性也随之增加。TPGS由于具有两亲性,在磷酸盐缓冲液中,其疏水端与生物大分子(蛋白质、脂质、DNA)相互作用,吸附在生物大分子表面,而聚乙二醇与水具有较强的亲和力,在磷酸盐缓冲液中充分伸展,为自由基攻击生物大分子提供了较大的空间位阻,从而达到对生物大分子的最佳保护效果。在HepG2细胞模型中,VE对HepG2细胞的存活率没有明显影响,而α-TOS和TPGS均能够显著降低HepG2细胞存活率,其中TPGS的抑制作用更为明显。这可能是由于TPGS亲水性强,与生物膜磷脂成分的相互作用弱,透过生物膜时的阻力减小、效率增加,在HepG2细胞内有效浓度大大增加。P-糖蛋白是一种由基因编码的跨膜蛋白,在小肠、肝、肾等组织中分布广泛,能够外排大量结构和功能各异的外源性分子,Dintaman等[45]的研究表明TPGS是一种P-糖蛋白的抑制剂,可以抑制P-糖蛋白的外排作用,由此推测TPGS可能通过抑制HepG2细胞膜P-糖蛋白的外排作用,增加其在细胞内的浓度,从而更有效地抑制HepG2细胞增殖。
本实验采用多种自由基体系对比研究VE及其衍生物α-TOS、TPGS对自由基引起的生物大分子体外损伤的保护作用,并从抑制HepG2细胞增殖方面比较其生物活性的差异,发现TPGS的抑制作用最显著。这可能是由于TPGS引入了亲水性强的聚乙二醇结构,在磷酸盐缓冲液中充分伸展,为自由基攻击生物大分子提供了较大的空间位阻;并且TPGS亲水性强,更容易透过生物膜,减少生物膜的外排作用,提高在细胞中的有效浓度。作为一种安全的食品药品传递载体,相较于VE和传统的VE衍生物,TPGS具有更好的水溶性和稳定性。本研究结果将对VE及其衍生物的广泛应用提供一定的理论依据。
参考文献:
[1] COATES M E, KON S K, PORTER J W. Vitamins in animal nutrition[J]. British Medical Bulletin, 1956, 12(1): 61-66.DOI:10.1093/oxfordjournals.bmb.a069518.
[2] BARRIE M M. Vitamin E deficiency in the rat: fertility in the female[J]. The Biochemical Journal, 1938, 32(12): 2134-2137. DOI:10.1042/bj0322134.
[3] RENGARAJ D, HONG Y H. Effects of dietary vitamin E on fertility functions in poultry species[J]. International Journal of Molecular Sciences, 2015, 16(5): 9910-9921. DOI:10.3390/ijms16059910.
[4] HAN S N, ADOLFSSON O, LEE C K, et al. Vitamin E and gene expression in immune cells[J]. Annals of the New York Academy of Sciences, 2004, 1031: 96-101. DOI:10.1196/annals.1331.010.
[5] FREEDMAN J E, FARHAT J H, LOSCALZO J, et al. Alphatocopherol inhibits aggregation of human platelets by a protein kinase C-dependent mechanism[J]. Circulation, 1996, 94(10): 2434-2440.DOI:10.1161/01.CIR.94.10.2434.
[6] 李静, 王之盛. 储藏中微量元素对维生素E稳定性的影响[J]. 饲料工业, 2001(1): 17-18. DOI:10.3969/j.issn.1001-991X.2001.01.007.
[7] REBOUL E, RICHELLE M, PERROT E, et al. Bioaccessibility of carotenoids and vitamin E from their main dietary sources[J]. Journal of Agricultural and Food Chemistry, 2006, 54(23): 8749-8755.DOI:10.1021/jf061818s.
[8] 李红卫, 吴坤. α-生育酚琥珀酸酯抗肿瘤作用的结构基础[J]. 卫生研究, 2004(4): 512-514. DOI:10.3969/j.issn.1000-8020.2004.04.048.
[9] BADRAOUI R, BLOUIN S, MOREAU M F, et al. Effect of alpha tocopherol acetate in Walker 256/B cells-induced oxidative damage in a rat model of breast cancer skeletal metastases[J]. Chemico-Biological Interactions, 2009, 182(2/3): 98-105. DOI:10.1016/j.cbi.2009.09.010.
[10] SCHLIEPER P, TAWFIK H. Antiarrhythmic activity of alphatocopherol nicotinate and related compounds and their physicochemical properties[J]. Arzneimittel-Forschung, 1987, 37(8): 920-923.
[11] PRASAD K N, EDWARDS-PRASAD J. Effects of tocopherol (vitamin E)acid succinate on morphological alterations and growth inhibition in melanoma cells in culture[J]. Cancer Research, 1982, 42(2): 550-555.
[12] LIM S J, LEE Y J, PARK D H, et al. Alpha-tocopheryl succinate sensitizes human colon cancer cells to exisulind-induced apoptosis[J].Apoptosis, 2007, 12(2): 423-431. DOI:10.1007/s10495-006-0620-9.
[13] BADR D M, HAFEZ H F, AGHA A M, et al. The combination of α-tocopheryl succinate and sodium selenite on breast cancer: a merit or a demerit?[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016:1-14. DOI:10.1155/2016/4741694.
[14] HOU L Y, ZHANG H J, XU P X, et al. Effect of vitamin E succinate on the expression of the tumor necrosis factor-related apoptosisinducing ligand (TRAIL) receptor in gastric cancer cells and CD4+T cells[J]. Molecular BioSystems, 2015, 11(11): 3119-3128.DOI:10.1039/c5mb00350d.
[15] REGO A C, SANTOS M S, PROENÇA M T, et al. Influence of vitamin E succinate on retinal cell survival[J]. Toxicology, 1998,128(2): 113-124. DOI:10.1016/S0300-483X(98)00054-7.
[16] LIPSHUTZ B H, GHORAI S, ABELA A R, et al. TPGS-750-M: a second-generation amphiphile for metal-catalyzed cross-couplings in water at room temperature[J]. The Journal of Organic Chemistry, 2011,76(11): 4379-4391. DOI:10.1021/jo101974u.
[17] QIAO H, CHEN L, RUI T, et al. Fabrication and in vitro/in vivo evaluation of amorphous andrographolide nanosuspensions stabilized by D-alpha-tocopheryl polyethylene glycol 1000 succinate/sodium lauryl sulfate[J]. International Journal of Nanomedicine, 2017, 12:1033-1046. DOI:10.2147/IJN.S120887.
[18] WAN T, PAN J T, LONG Y M, et al. Dual roles of TPGS based microemulsion for tacrolimus: enhancing the percutaneous delivery and anti-psoriatic efficacy[J]. International Journal of Pharmaceutics,2017, 528(1/2): 511-523. DOI:10.1016/j.ijpharm.2017.06.050.
[19] THI T D L, PHUONG T H, THI H Y T, et al. In vitro evaluation of Aurora kinase inhibitor-VX680-in formulation of PLA-TPGS nanoparticles[J]. Advances in Natural Sciences: Nanoscience and Nanotechnology, 2016, 7(2): 1-9. DOI:10.1088/2043-6262/7/2/025010.
[20] NGUYEN H N, HA P T, NGUYEN A S, et al. Curcumin as fluorescent probe for directly monitoringin vitrouptake of curcumin combined paclitaxel loaded PLA-TPGS nanoparticles[J]. Advances in Natural Sciences: Nanoscience and Nanotechnology, 2016, 7(2): 1-6.DOI:10.1088/2043-6262/7/2/025001.
[21] ZHU Xianbing, ZENG Xiaowei, ZHANG Xudong, et al. The effects of quercetin-loaded PLGA-TPGS nanoparticles on ultraviolet B-induced skin damages in vivo[J]. Nanomedicine: Nanotechnology, Biology, and Medicine, 2016, 12(3): 623-632. DOI:10.1016/j.nano.2015.10.016.
[22] GUO Y, LUO J, TAN S, et al. The applications of vitamin E TPGS in drug delivery[J]. European Journal of Pharmaceutical Sciences, 2013,49(2): 175-186. DOI:10.1016/j.ejps.2013.02.006.
[23] MAYO J C, TAN D X, SAINZ R M, et al. Protection against oxidative protein damage induced by metal-catalyzed reaction or alkylperoxyl radicals: comparative effects of melatonin and other antioxidants[J].Biochimica et Biophysica Acta, 2003, 1620(1/2/3): 139-150.DOI:10.1016/S0304-4165(02)00527-5.
[24] KAWAI Y, FUJII H, OKADA M, et al. Formation of nepsilon-(succinyl)lysine in vivo: a novel marker for docosahexaenoic acidderived protein modification[J]. The Journal of Lipid Research, 2006,47(7): 1386-1398. DOI:10.1194/jlr.M600091-JLR200.
[25] LIU X, OSAWA T. Cis astaxanthin and especially 9-cis astaxanthin exhibits a higher antioxidant activity in vitro compared to the all-trans isomer[J]. Biochemical and Biophysical Research Communications,2007, 357(1): 187-193. DOI:10.1016/j.bbrc.2007.03.120.
[26] ARDESTANI A, YAZDANPARAST R. Antioxidant and free radical scavenging potential of Achillea santolina extracts[J]. Food Chemistry,2007, 104(1): 21-29. DOI:10.1016/j.foodchem.2006.10.066.
[27] ZHAO F, LIU Z Q, WU D. Antioxidative effect of melatonin on DNA and erythrocytes against free-radical-induced oxidation[J].Chemistry and Physics of Lipids, 2008, 151(2): 77-84. DOI:10.1016/j.chemphyslip.2007.10.002.
[28] LIPINSKI B. Hydroxyl radical and its scavengers in health and disease[J]. Oxidative Medicine and Cellular Longevity, 2011, 2011:1-9. DOI:10.1155/2011/809696.
[29] BETIGERI S, THAKUR A, RAGHAVAN K. Use of 2,2’-azobis(2-amidinopropane) dihydrochloride as a reagent tool for evaluation of oxidative stability of drugs[J]. Pharmaceutical Research, 2005, 22(2):310-317. DOI:10.1007/s11095-004-1199-x.
[30] GOBERT M, REMOND D, LOONIS M, et al. Fruits, vegetables and their polyphenols protect dietary lipids from oxidation during gastric digestion[J]. Food & Function, 2014, 5(9): 2166-2174. DOI:10.1039/c4fo00269e.
[31] KANG M H, KATSUZAKI H, OSAWA T. Inhibition of 2,2’-azobis(2,4-dimethylvaleronitrile)-induced lipid peroxidation by sesaminols[J]. Lipids,1998, 33(10): 1031-1036. DOI:10.1007/s11745-998-0302-y.
[32] LIM S W, LOH H S, TING K N, et al. Reduction of MTT to purple formazan by vitamin E isomers in the absence of cells[J]. Tropical Life Sciences Research, 2015, 26(1): 111-120.
[33] AZZI A, MEYDANI S N, MEYDANI M, et al. The rise, the fall and the renaissance of vitamin E[J]. Archives of Biochemistry and Biophysics, 2016, 595: 100-108. DOI:10.1016/j.abb.2015.11.010.
[34] BOŠKOVIĆ M, VOVK T, KOPRIVŠEK J, et al. Vitamin E and essential polyunsaturated fatty acids supplementation in schizophrenia patients treated with haloperidol[J]. Nutritional Neuroscience, 2016,19(4): 156-161. DOI:10.1179/1476830514Y.0000000139.
[35] HASSOUN E A, BAGCHI D, BAGCHI M, et al. Effect of vitamin E succinate on smokeless tobacco-induced production of nitric oxide by rat peritoneal macrophages and J774A. 1 macrophage cells in culture[J]. Free Radical Biology & Medicine, 1995, 18(3): 577-583.DOI:10.1016/0891-5849(94)00156-E.
[36] ANDRÉS D, ALVAREZ A M, DÍEZ-FERNÁNDEZ C, et al. HSP70 induction by cyclosporine A in cultured rat hepatocytes: effect of vitamin E succinate[J]. Journal of Hepatology, 2000, 33(4): 570-579.DOI:10.1034/j.1600-0641.2000.033004570.x.
[37] WU J, FENG S, LIU W, et al. Targeting integrin-rich tumors with temoporfin-loaded vitamin-E-succinate-grafted chitosan oligosaccharide/D-α-tocopheryl polyethylene glycol 1000 succinate nanoparticles to enhance photodynamic therapy efficiency[J].International Journal of Pharmaceutics, 2017, 528(1/2): 287-298.DOI:10.1016/j.ijpharm.2017.06.021.
[38] MODI A, VERMA S K, BELLARE J. Graphene oxide nanosheets and D-α-tocopheryl polyethylene glycol 1000 succinate (TPGS) doping improves biocompatibility and ultrafiltration in polyethersulfone hollow fiber membranes[J]. Journal of Colloid and Interface Science,2017, 504: 86-100. DOI:10.1016/j.jcis.2017.05.035.
[39] DROGE W. Free radicals in the physiological control of cell function[J]. Physiological Reviews, 2002, 82(1): 47-95. DOI:10.1152/physrev.00018.2001.
[40] ACHARYA A, DAS I, CHANDHOK D, et al. Redox regulation in cancer: a double-edged sword with therapeutic potential[J]. Oxidative Medicine and Cellular Longevity, 2010, 3(1): 23-34. DOI:10.4161/oxim.3.1.10095.
[41] RAMALINGAM M, KIM S J. Reactive oxygen/nitrogen species and their functional correlations in neurodegenerative diseases[J]. Journal of Neural Transmission, 2012, 119(8): 891-910. DOI:10.1007/s00702-011-0758-7.
[42] 熊珊珊, 石英英, 石汉平. 活性氧与肿瘤研究进展[J]. 中华肿瘤防治杂志, 2014, 21(13): 1045-1048. DOI:10.16073/j.cnki.cjcpt.2014.13.017.
[43] KOGURE K, HAMA S, MANABE S, et al. High cytotoxicity of alpha-tocopheryl hemisuccinate to cancer cells is due to failure of their antioxidative defense systems[J]. Cancer Letters, 2002, 186(2):151-156. DOI:10.1016/S0304-3835(02)00344-0.
[44] 刘柏合, 吴坤, 赵丹阳. 维生素E琥珀酸酯抑制人胃癌细胞生长的研究[J]. 卫生研究, 2000(3): 172-174. DOI:10.3969/j.issn.1000-8020.2000.03.016.
[45] DINTAMAN J M, SILVERMAN J A. Inhibition of P-glycoprotein by D-alpha-tocopheryl polyethylene glycol 1000 succinate (TPGS)[J].Pharmaceutical Research, 1999, 16(10): 1550-1556. DOI:10.1023/A:1015000503629.
Tocopheryl and Derivatives Protect against Free Radical-Induced Damage to Biological Macromolecules and Inhibit the Proliferation of HepG2 Cells
HAN Jingjing, TIAN Dandan, GAO Yuxing, XIAO Chunxia*
(College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
Abstract:Herein, we investigated the protective effects of tocopheryl (VE), α-tocopheryl succinate (α-TOS) and tocopheryl polyethylene glycol 1000 succinate (TPGS) on free radical-induced oxidative damage to protein, lipid and DNA, as well as the inhibitory effect on the proliferation of human HepG2 hepatoma cells. The results showed that TPGS had the most protective effect on oxidative damage to biological macromolecules, followed by α-TOS and VE. Both α-TOS and TPGS could significantly decrease cell viability (P < 0.05), and TPGS was more effective. However, VE showed little effect on cell activity (P ﹥ 0.05). This could be due to the amphipathicity of TPGS, whose hydrophobic ends are adsorbed on the surface of biological macromolecules, while the hydrophilic ends are fully extended in the buffer, causing large steric hindrance to protect the biological macromolecules from being attacked by free radicals. Because of its good water solubility, TPGS could easily pass through the biofilm, increasing its effective concentration in HepG2 cells. This work will provide a theoretical basis for the application of tocopheryl derivatives in healthy nutritious foods and pharmaceuticals.
Keywords:tocopheryl; α-tocopheryl succinate; tocopheryl polyethylene glycol 1000 succinate; biological macromolecules;HepG2 cells
DOI:10.7506/spkx1002-6630-201813022
收稿日期:2017-04-19
基金项目:国家自然科学基金青年科学基金项目(21403169);中国博士后面上资助项目(2015M572603);陕西省自然科学基础计划青年人才计划项目(2015JQ2039);中央高校基本科研业务费专项资金项目(2452016083)
第一作者简介:韩静静(1993—),女,硕士研究生,研究方向为食品功能化学与营养。E-mail:jingjinghan01@163.com
*通信作者简介:肖春霞(1984—),女,副教授,博士,研究方向为食品功能化学与营养。E-mail:chunxiaxiao@nwsuaf.edu.cn
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2018)13-0144-09
引文格式:韩静静, 田丹丹, 高玉星, 等. 生育酚及其衍生物保护自由基诱导的生物大分子损伤和抑制HepG2细胞增殖的作用[J].食品科学, 2018, 39(13): 144-152.
DOI:10.7506/spkx1002-6630-201813022. http://www.spkx.net.cn
HAN Jingjing, TIAN Dandan, GAO Yuxing, et al. Tocopheryl and derivatives protect against free radical-induced damage to biological macromolecules and inhibit the proliferation of HepG2 cells[J]. Food Science, 2018, 39(13): 144-152. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201813022. http://www.spkx.net.cn