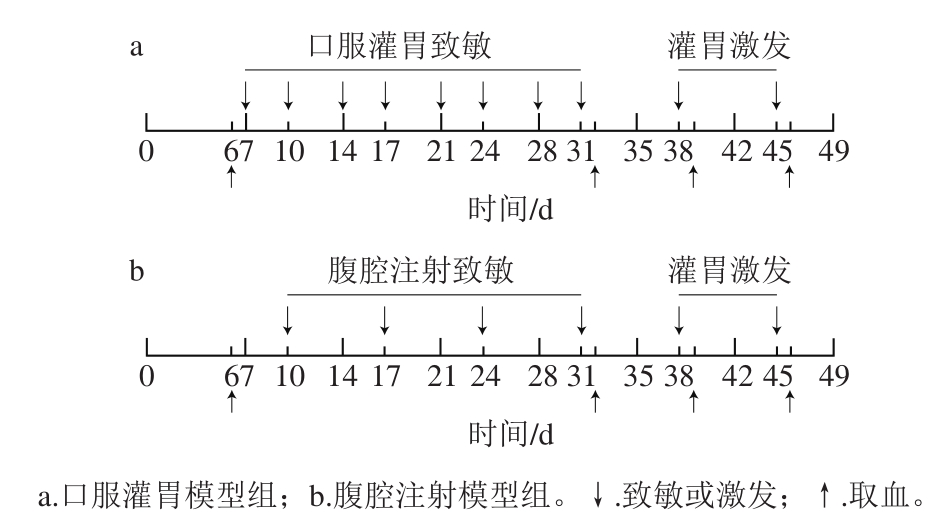
图1 BALB/c小鼠TM免疫方案
Fig. 1 Experimental design of in vivo sensitization with shrimp TM in BALB/c mice
傅玲琳1,2,谢梦华1,王 翀1,王海燕2,王彦波1,2,*
(1.浙江工商大学食品与生物工程学院,浙江 杭州 310018;2.浙江食品质量安全工程研究院,浙江 杭州 310018)
摘 要:随着食物过敏现象的日益普遍,其已成为工业化国家一个严重的公众健康问题。食物蛋白致敏机理的相关研究大多借助于两大类小鼠模型,即口服致敏模型和局部或皮肤致敏模型。然而,不同模型之间的差异以及如何选择合适的模型进行研究却鲜有人关注。鉴于此,本研究旨在通过比较对虾原肌球蛋白口服灌胃和腹腔注射两种给药途径对BALB/c小鼠致敏性的影响,寻求最佳给药方式,以便建立有效的动物模型,并在分子及免疫水平研究其致敏机理,从而为食物过敏原动物模型的构建提供一定的理论依据,也为研究食物过敏原致敏机制以及预防治疗食物过敏提供重要的模型依据。结果表明,腹腔注射小鼠血清中特异性免疫球蛋白(immunoglobulin,Ig)E、组胺以及辅助性T细胞(helper T cells,Th)2型细胞因子含量均高于口服灌胃小鼠,其致敏性更好。此外,口服灌胃小鼠血清特异性IgG2a、干扰素-γ、调节性T细胞水平增加,表明虽有黏膜佐剂作用,但口服给药仍可能使小鼠产生口服免疫耐受,从而降低对虾原肌球蛋白对其的致敏性。本研究表明,腹腔注射原肌球蛋白比口服灌胃更易使小鼠致敏,其Th1/Th2平衡被打破,Th2反应占据优势,更适合用于构建食物致敏动物模型。
关键词:原肌球蛋白;口服灌胃;腹腔注射;食物过敏;小鼠模型
食物过敏是对无害食物蛋白质产生的不良反应,分为免疫球蛋白(immunoglobulin,Ig)E和非IgE介导、IgE和非IgE混合介导,其中IgE介导最为常见。近些年来其发病率在全球范围内急剧上升,约8%的儿童及4%的成人对某种或多种食物有过敏现象,食物过敏严重影响了人们的生活[1]。目前除了避免接触过敏原及服用一些可能会产生副作用的药物外,对食物过敏还没有有效的预防及治疗手段[1]。我国东部地区水产丰富,消费群体庞大。因此,作为全球八大主要食物过敏原之一的甲壳类水产品在我国引起食物过敏的发病率居高不下。研究表明,甲壳类水产品中引起过敏现象的主要过敏原为原肌球蛋白(tropomyosin,TM),且氨基酸序列检测结果表明,多种甲壳类水产中的TM具有高达95%~100%的同源性[2-3]。但目前对于甲壳类水产品过敏原在分子及免疫学水平的研究还很匮乏。
食物过敏预防及治疗的研究大多会借助动物构建食物过敏原致敏模型,基于此模型可以评估食物过敏原致敏性,研究过敏相关免疫反应及机理,研发预防及治疗食物过敏的药物及治疗手段[4],其中小鼠是最常采用的实验动物。小鼠模型根据给药途径不同分为两大类,即口服致敏和局部或表皮致敏,局部致敏常采用腹腔注射(intraperitoneal,IP)[5]。过敏原的口服给药符合实际生活中食物蛋白经口摄入的情况,但易诱导产生口服耐受,若仅给药过敏原,则需要大量的过敏原才能引起免疫反应,因此必须借助黏膜佐剂以克服口服免疫耐受,降低过敏原剂量,使小鼠更容易致敏,其中最常用也是公认的最强佐剂是霍乱毒素(cholera toxin,CT)[3,5]。CT是一种AB5型蛋白毒素,由1 个带有毒性的A亚基(CTA)和5 个无毒的B亚基(CTB)组成,可诱导白细胞介素(interleukin,IL)-4、IL-5显著升高,而IL-2与干扰素-γ(interferon gamma,IFN-γ)水平无明显变化,而且还可选择性诱导以辅助性T细胞(helper T cells,Th)2为主的免疫反应[6]。过敏原腹腔注射作用部位接近黏膜,更易引起黏膜免疫反应,致敏效果好,但食物蛋白不经胃部消化,不能很好地反映其实际进入机体的情况。目前,这两种给药方法均被广大研究者采用,如利用腹腔注射模型或口服灌胃(intragastric,IG)模型评估膳食纤维、中草药、益生菌、海洋藻类、T细胞多肽等物质缓解食物过敏的效果、探究其生理学及免疫学水平机理[7-11]。Chen Chen等[12]为构建一个能全面评估食物过敏的BALB/c小鼠模型,采用腹腔注射,分别用花生凝集素(peanut agglutinin,PNA)、β-乳球蛋白(β-lactoglobulin,β-LG)和马铃薯酸性磷酸酶(potato acid phosphatase,PAP)3 种蛋白致敏小鼠,再采用口服灌胃或腹腔注射相应蛋白进行激发,通过测定血清特异性IgE(specific IgE,sIgE)、IgG1、组胺、临床症状及肺部炎症细胞浸润等指标水平,发现3 种蛋白的致敏性强弱为PNA>β-LG>PAP,且腹腔注射激发更易诱发系统性食物过敏。然而,目前关于甲壳类水产品的口服致敏模型研究有限,其致敏的具体机制也尚鲜有阐明。
本研究以甲壳类水产品主要过敏原TM为研究对象,对比口服灌胃与腹腔注射两种给药方式对BALB/c小鼠的致敏效果,寻求TM致敏动物模型的最佳给药途径,以便建立有效的TM致敏动物模型,并初步探究两种给药方式产生不同致敏效果的分子及免疫学机理,既为其他食物过敏原的动物模型构建提供一定的理论依据,也便为后期研究食物过敏预防及治疗提供一定的模型及理论依据。
南美白对虾购自杭州萧山养殖场;SPF级BALB/c小鼠购自浙江中医药大学实验动物中心,雌性,6 周龄,体质量为(16±2) g,共80 只,随机分组,每组8 只。
喹啉甲酸(bicinchoninic acid,BCA)蛋白质量浓度测定试剂盒 江苏凯基生物技术股份有限公司;小鼠组胺酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 杭州百细生物有限公司;大鼠抗小鼠IgE单克隆抗体(rat monoclonal 23G3 anti-mouse IgE epsilon chain)、大鼠抗小鼠IgG2a单克隆抗体(rat monoclonal SB84a anti-mouse IgG2a heavy chain) 美国Abcam公司;小鼠细胞因子IL-4、IL-5、IL-13、IL-10、IFN-γ ELISA试剂盒,Anti-mouse CD4 FITC、Anti-mouse CD25 PE、Anti-mouse CD127 APC单抗 美国eBioscience公司;RNA提取试剂盒 美国Omega公司;反转录试剂盒及荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)试剂盒 南京诺唯赞生物公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)相关用品 生工生物工程(上海)股份有限公司;其余常规化学试剂 上海阿拉丁生化科技股份有限公司。
Mini protein III垂直板电泳仪 美国Bio-Rad公司;Alpha化学发光凝胶成像仪(配有Alphaview SA电泳图像分析软件) 美国Proteinsimple公司;VersaMax型酶标仪 美国Molecular Devices公司;LightCycler Nano qPCR仪 瑞士Roche公司;CytoFLEX流式细胞仪美国Beckman Coulter公司。
1.3.1 TM的提取
参考傅玲琳等[13]的方法提取对虾肉中的TM。将对虾除去头、尾、虾线和外壳,虾肉浸泡于预冷的缓冲液A(50 mmol/L KCl、2 mmol/L NaHCO3)中,均质30 min后置于冰上浸提20 min并不断搅拌。4 ℃、10 000 r/min离心20 min,弃去上清液,将沉淀重悬于缓冲液A中,再次浸提后离心,重复浸提、离心5 次。沉淀浸泡于预冷的丙酮中,不断搅拌后经纱布过滤,用丙酮反复冲洗,直至沉淀完全变为白色,将制成的丙酮粉置于通风橱中,过夜风干。将风干的丙酮粉浸泡于缓冲液B(0.02 mol/L Tris-HCl、1 mol/L KCl、0.1 mmol/L二硫苏糖醇,pH 7.4)中抽提72 h,4 ℃、10 000 r/min离心30 min,将上清液转移至沸水浴中加热煮沸10 min,再经8 000 r/min离心15 min,取出上清液,加入30%(质量分数,下同)的硫酸铵,置于4 ℃孵育1 h,拿出后4 ℃、8 000 r/min离心15 min,将沉淀复溶于磷酸盐缓冲液(phosphate buffer saline,PBS,pH 7.2~7.4)中。用BCA蛋白质量浓度试剂盒测定蛋白质量浓度。
1.3.2 SDS-PAGE分析
配制12%的分离胶与5%的浓缩胶,厚度为1.0 mm。取少量溶于PBS的TM,用PBS稀释至1~3 ng/μL,与4×蛋白质SDS-PAGE上样缓冲液混匀,置于沸水浴中加热5 min后取7 μL上样。浓缩胶80 V电泳10 min后,分离胶120 V电泳60 min。
1.3.3 BALB/c小鼠致敏模型
口服灌胃致敏模型[14-16]:共5 组,分为正常对照组(PBS1)、霍乱毒素对照组(CT)、低剂量组(IG-L)、中剂量组(IG-M)、高剂量组(IG-H)。小鼠普通饮食饲养1 周后,实验组每只灌胃与10 μg CT充分混匀的相应剂量的TM(100、300、600 μg)进行致敏,PBS1组灌胃等体积PBS,CT组灌胃等体积含10 μg CT的PBS,每周2 次,连续4 周。之后灌胃对应致敏剂量6 倍的TM进行激发,每周1 次,连续2 周。在致敏前和致敏后、第一次激发以及第二次激发后1 d取血,具体方案见图1a。
腹腔注射致敏模型[9,11]:共5 组,分为正常对照组(PBS2)、弗氏佐剂对照组(F)、低剂量组(IP-L)、中剂量组(IP-M)、高剂量组(IP-H)。小鼠普通饮食饲养1 周后,实验组每只腹腔注射与弗氏佐剂(第一次致敏时使用弗氏完全佐剂,之后均为弗氏不完全佐剂)充分乳化的相应剂量的TM(100、300、600 μg)进行致敏,PBS2组注射等体积PBS,F组注射等体积的弗氏佐剂与PBS混合液,每周1 次,连续4 周;之后灌胃对应致敏剂量3 倍的TM进行激发,每周1 次,连续2 周。在致敏前、致敏后、第一次激发以及第二次激发的后1 d进行眼眶静脉取血,具体方案见图1b。

图1 BALB/c小鼠TM免疫方案
Fig. 1 Experimental design of in vivo sensitization with shrimp TM in BALB/c mice
1.3.4 小鼠临床过敏症状评分
在第二次激发后的30 min~2 h内观察小鼠的症状,根据评分标准进行评分,本实验中临床过敏症状评分标准如表1所示。
表1 小鼠临床过敏症状评分标准[7,9]
Table1 Scoring criteria for clinical anaphylactic symptoms in mice[7,9]

1.3.5 血清中TM特异性抗体IgE、IgG2a的测定
小鼠血清中TM特异性抗体IgE、IgG2a抗体反应均采用双抗体夹心间接ELISA法检测。EIA/RIA 96 孔板包被10 μg/mL纯化的TM,4 ℃孵育过夜;用PBS+0.05%吐温20溶液洗涤3 次后,用5%牛血清白蛋白封闭,37 ℃孵育1 h;洗涤3 次后加入小鼠血清样品(稀释5 倍用于IgE抗体,稀释20 倍用于IgG2a抗体),37 ℃孵育2 h;洗涤5 次后加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(HRP-大鼠抗小鼠IgE单克隆抗体或HRP-大鼠抗小鼠IgG2a单克隆抗体),37 ℃孵育1 h;洗涤5 次后加入3,3’,5,5’-四甲基联苯胺底物,37 ℃避光孵育20 min后加入终止液,在490 nm波长处测定各孔的OD值。
1.3.6 血清中组胺质量浓度的测定
血清中的组胺采用小鼠组胺ELISA试剂盒测定。在微孔酶标板中加入标准品或小鼠血清(稀释5 倍),再加入HRP标记的检测抗体,用封口膜封住反应孔,37 ℃孵育1 h;洗涤5 次后,加入底物A、B,37 ℃避光孵育15 min。加入终止液,在450 nm波长处测定各孔的OD值,根据标准曲线得到每组样品的组胺质量浓度。
1.3.7 脾脏共培养上清液中IL-4、IL-5、IL-13、IL-10、IFN-γ细胞因子质量浓度的测定
在第46天,将处死的小鼠浸泡于体积分数75%乙醇溶液中,于超净工作台中解剖取出小鼠脾脏,加入少量PBS,用无菌注射器研磨过200 目筛,将滤液转移至无菌15 mL离心管中,4 ℃、4 000 r/min离心5 min,加入红细胞裂解液,室温反应5 min后4 ℃、4 000 r/min离心3 min,再用PBS洗涤2 次后制成单细胞悬液,最后用RPMI-1640培养基重悬细胞,计数后调整细胞数目为106~107个/mL。取1 mL加入24 孔板中,加入已经过0.22 μm滤膜的TM(终质量浓度100 μg/mL),于37 ℃、5% CO2细胞培养箱中培养72 h。再经4 000 r/min离心5 min,取上清液。IL-4、IL-5、IL-13脾脏共培养上清液细胞因子质量浓度的检测均采用ELISA法,按照试剂盒说明书操作。
1.3.8 结肠中Th17相关转录因子IL-17A、IL-23 mRNA相对表达量的测定
无菌条件下解剖小鼠,剪下结肠部位,放入冻存管,迅速置于液氮中冷冻,后转移至-80 ℃冰箱保存。实验时取出样品,立即置于液氮中研磨,按照RNA提取试剂盒说明书提取RNA,用NanoDrop 2 000测定RNA质量浓度及纯度后,用反转录试剂盒及qPCR试剂盒进行RNA的反转录和IL-17A、IL-23 mRNA相对表达量的测定,内参基因为β-actin。各基因引物设计如下:IL-17A上游引物:AGGGAGAGCTTCATCTGTGG,下游引物:AGATTCATGGACCCCAACAG;IL-23上游引物:TGCTGGATTGCAGAGCAGTAA,下游引物:GCATGCAGAGATTCCGAGAGA;β-actin上游引物:CGCAAAGACCTGTATGCCAAT,下游引物:GGGCTGTGATCTCCTTCTGC。
1.3.9 流式细胞仪测定脾脏中Treg细胞比例
小鼠脾脏组织的单细胞悬液的制备方法同1.3.7节,用无菌PBS重悬细胞,计数后调整细胞数目为107~108个/mL。各组分别取100 μL单细胞悬液于流式管中,每管分别按照流式抗体说明书加入Anti-mouse CD4 FITC、Anti-mouse CD25 PE和Anti-mouse CD127 APC,室温下避光孵育30 min。1 000×g离心5 min后弃上清液,以100 μL无菌PBS洗涤2 次后,用PBS重悬细胞并混匀。同时设定空白组(只加细胞细胞悬液)以及阴性对照组(加入细胞悬液及各抗体单染组)用于流式细胞仪补偿的调节。混匀样品使用流式细胞仪检测,并设门测定调节性T细胞(regulatory T cell,Treg)(CD4+CD25+CD127Low)比例。
实验得到的所有数据使用软件GraphPad Prism 7.00进行独立样本t检验分析和单因素方差分析,结果以 的的形式呈现,以P<0.05表示差异显著,以NS表示差异不显著(P>0.05)。
的的形式呈现,以P<0.05表示差异显著,以NS表示差异不显著(P>0.05)。
2.1 TM的SDS-PAGE分析结果
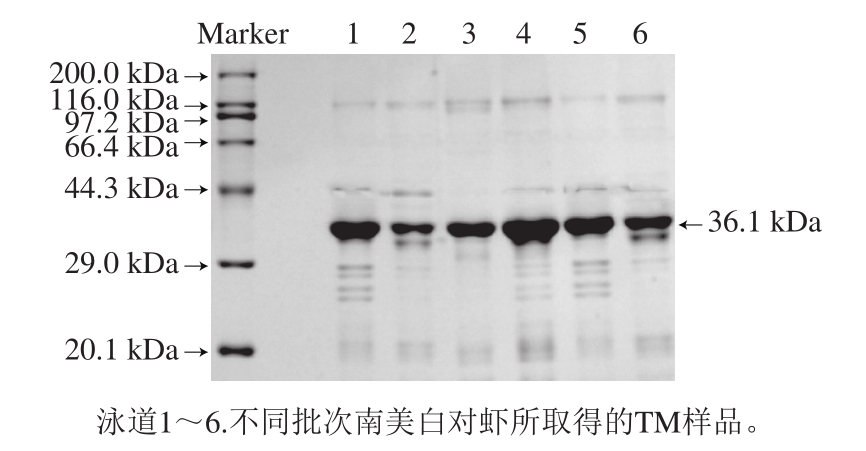
图2 纯化TM的SDA-PAGE分析
Fig. 2 SDS-PAGE analysis of purified TM
不同批次的南美白对虾肉通过硫酸铵沉淀、PBS复溶后的SDS-PAGE分析见图2。其中灰度最深的条带在36.1 kDa,与理论计算值相同[17],因此可以确定所提蛋白为TM,利用AlphaView SA 3.4.0电泳图像分析软件分析可知,TM纯度大于95%,其他分子质量位置虽有少量杂蛋白,但含量极低,不影响后续实验进行。
过敏原穿透皮肤或者黏膜屏障后,由树突状细胞等抗原递呈细胞(antigen-presenting cell,APC)收集并递呈给淋巴结中的初始辅助性T细胞Th0,激活的Th0在IL-4的存在下分化为Th2,行使T细胞功能,并促使B细胞表面的B细胞受体结合过敏原,从而激活B细胞。激活的B细胞和Th2效应细胞通过表达的组织特异性归巢受体,由胸导管和血液循环再回到过敏原进入的组织中,此时,Th2会产生丰富的IL-4、IL-5和IL-13,使活化的B细胞发生IgE类型转换,从而产生抗原sIgE。这些抗体一部分与抗原直接结合,一部分能与抗原穿透部位的肥大细胞所表达的高亲和力IgE-Fc段受体I(FcεRI)结合,其余的抗体则通过淋巴系统进入人体循环,与血液中的嗜碱性粒细胞和远隔组织中的肥大细胞相结合,使机体致敏。当致敏机体再次次摄入过敏原后,抗原会迅速与致敏肥大细胞或嗜碱性粒细胞表面的sIgE结合,使肥大细胞脱颗粒,释放组胺、白三烯、5-羟色胺、趋化因子等,而嗜碱性粒细胞分泌大量IL-4、IL-13等细胞因子,从而产生过敏反应组织特异性症状[18]。
2.2.1 食物过敏症状评分结果
致敏机体再次摄入过敏原后,会快速引发身体多个部位不同症状反应,如皮肤瘙痒、红肿、荨麻疹、哮喘、咳嗽、恶心、呕吐、腹泻等[5]。因此,临床过敏症状评分是评价食物过敏是否产生以及严重程度的重要指标。腹腔注射模型组小鼠临床过敏症状评分结果见图3,而口服灌胃模型组小鼠基本未有明显症状,因此没有显示数据。腹腔注射模型组中,IP-L组只有少数小鼠产生轻微的过敏症状,而随着过敏原剂量的增加,小鼠的过敏症状逐渐增强。IP-H组中小鼠的过敏症状评分已出现4 分及5 分,即肌肉抽搐和死亡,表明腹腔注射过敏原剂量已接近小鼠最大耐受量,致敏效果显著。
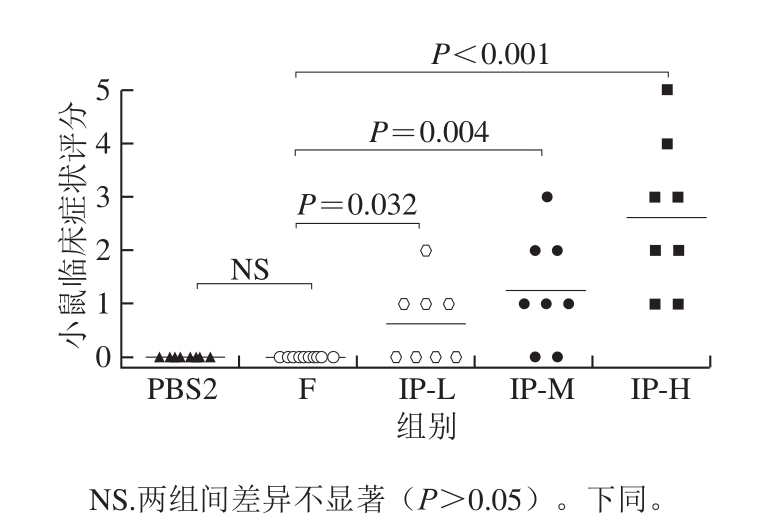
图3 腹腔注射模型组小鼠第二次激发后过敏症状评分
Fig. 3 Anaphylaxis scores of intraperitoneal sensitization model after the second challenge
2.2.2 不同致敏方式导致小鼠血清中TM特异性抗体IgE含量变化分析

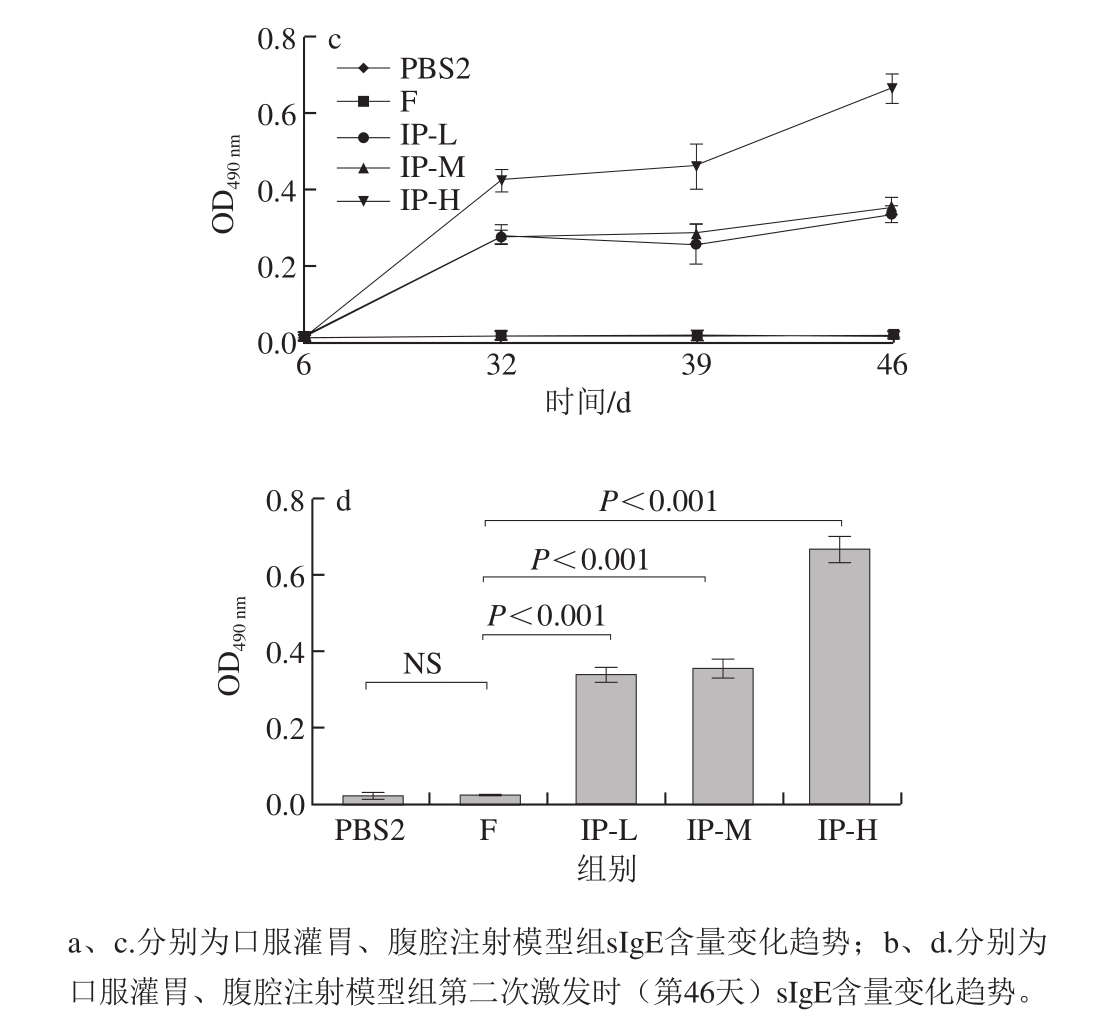
图4 两类致敏模型小鼠血清中TM-sIgE含量变化
Fig. 4 TM-sIgE levels in serum samples of two BALB/c mouse models
血清中sIgE的产生是评估食物过敏的重要指标,且大量研究表明食物过敏的严重程度与机体内特异性抗体水平密切相关[11-12,15,19]。在I型超敏反应动物模型中,摄入高浓度过敏原可能会导致小鼠产生免疫耐受,从而降低小鼠的致敏性[1,4,20-21],如胡德建等[20]通过对不同剂量致敏原对小鼠过敏性哮喘模型血清特异性抗体IgE、IgG2a和IL4、IL-5、IL-12、IFN-γ等炎性细胞因子的影响进行研究,发现不同剂量的卵清蛋白(ovalbumin,OVA)可能影响小鼠过敏性哮喘模型所产生的细胞因子类型,低剂量OVA造模的效果最为显著,高剂量OVA可能导致小鼠发生免疫耐受。根据图4a可知,口服灌胃模型组TM-sIgE的OD490 nm变化范围大多都在0.2以内,差别很小,只有IG-M组在第一次激发后IgE含量急剧上升,OD490 nm达到0.5左右。但所有组别基本变化趋势相同,在第一激发时,IgE含量均有所上升,但在第二次激发后,IgE含量均下降。在第二次激发后,与CT组相比,仅IG-M组差异显著,其他两组均无显著性差异。根据文献[20]报道,第二次激发后IgE含量不升反降的原因可能是:在39 d第一次激发时过敏原剂量为致敏时的6 倍,过敏原剂量的突然增大使小鼠体内产生耐受性,因此在第二次激发后sIgE的含量发生下降,此结论在后续实验中将进一步研究确认。而腹腔注射模型组小鼠在致敏结束后的IgE含量就已明显高于口服灌胃模型组,且在激发后IgE含量逐渐上升。IP-H组在第二次激发时IgE的OD490 nm超过0.6,IP-L和IP-M组的OD490 nm也超过0.3,且与F组相比,IP-L、IP-M、IP-H 3 个剂量组均有显著性差异,尤其是IP-H致敏效果最显著。
2.2.3 不同致敏方式导致小鼠血清TM特异性抗体IgG2a含量变化分析
IgG是血清中含量最高的免疫球蛋白,占血清中抗体Ig的70%~75%。当正常机体接触或摄入过敏原,也会触发一些免疫反应,但产生的是无害IgG,而非IgE。研究表明,在多个利用小鼠模型研究抗过敏物质及其机理的实验中,小鼠体内的过敏原特异性免疫应答会偏向Th1诱导的同型IgG2a转换,而sIgE水平显著下降[11,15]。Rupa等[11]将T细胞表位肽应用于鸡蛋过敏原卵类黏蛋白建立的BALB/c小鼠的口服免疫治疗中,发现sIgE含量显著下降,而特异性IgG2a(specific IgG2a,sIgG2a)含量显著提高。本研究中两种致敏模型小鼠血清中TM-sIgG2a含量如图5所示。

图5 两类致敏模型小鼠血清中TM-sIgG2a含量变化
Fig. 5 TM-sIgG2a levels in serum samples of two BALB/c mouse models
腹腔注射模型组中,TM-sIgG2a含量虽有轻微上升趋势,且第二次激发时IP-H组与F组相比有显著性差异,但口服灌胃模型组中IgG2a变化更为显著,第二次激发后,口服灌胃IG-M组sIgG2a的OD490 nm高达1.8,而腹腔注射的IP-H组的OD490 nm只达到0.22。因此,口服灌胃模型组中sIgE含量较少,可能是因为机体自身免疫调节使免疫应答趋向于Th1型,从而产生大量IgG2a,降低了致敏效果。
2.2.4 血清中组胺质量浓度变化分析
在食物过敏反应的效应期,由肥大细胞和嗜碱性粒细胞释放的组胺会与支持血管的平滑肌细胞的特异性受体结合,使血管舒张、通透性增加,并且能诱导分泌细支气管黏液,导致哮喘。除此之外,组胺还能作用于感觉神经末梢,诱发湿疹部位瘙痒和花粉热打喷嚏等症状[18]。因此,组胺质量浓度也是评估食物过敏严重程度的重要指标。

图6 两类致敏模型小鼠第二次激发后血清中组胺质量浓度
Fig. 6 Histamine levels in serum samples of two BALB/c mouse models after the second challenge
如图6所示,在第二次激发后,口服灌胃模型组中IG-L组和IG-H组小鼠血清中组胺质量浓度与CT组相比均无显著性差异,仅IG-M组差异显著;而腹腔注射模型组中IP-L、IP-M、IP-H组与F组相比均有显著性差异,特别是IP-H组,组胺质量浓度达到37 ng/mL,接近F组的2 倍。
2.2.5 小鼠脾脏细胞上清液中细胞因子IL-4、IL-5、IL-13、IL-10、IFN-γ的质量浓度分析
由于Th0所处微环境中各种细胞因子及其他因子的存在,Th0主要分化为两类不同的效应细胞:Th1和Th2。目前认为,Th1/Th2平衡紊乱、Th0向Th2分化、IgE含量增加是I型超敏反应发作的关键环节[20,22]。Th2分泌IL-4、IL-5等多种细胞因子,而IL-4可诱导B细胞的Ig类别转化,导致IgE含量增加;IL-5具有趋化嗜酸性粒细胞聚集的作用,而嗜酸性粒细胞是参与炎症浸润的主要效应细胞,可加速相关组织结构的破坏,这些炎症细胞和促炎性细胞因子共同引发或促进I型超敏反应的发生和发展。Th1及调节性T细胞则可分泌IFN-γ、IL-10等细胞因子,抑制Th2型细胞因子的促炎作用及致敏原引发的过敏作用[20,23-24]。Th1和Th2这两类效应细胞通过各类细胞因子相互交叉调节彼此的分化和活性,有相互拮抗的作用。根据上述指标,两类模型中各自致敏效果最好的一组的Th1及Th2型细胞因子质量浓度见图7、8。
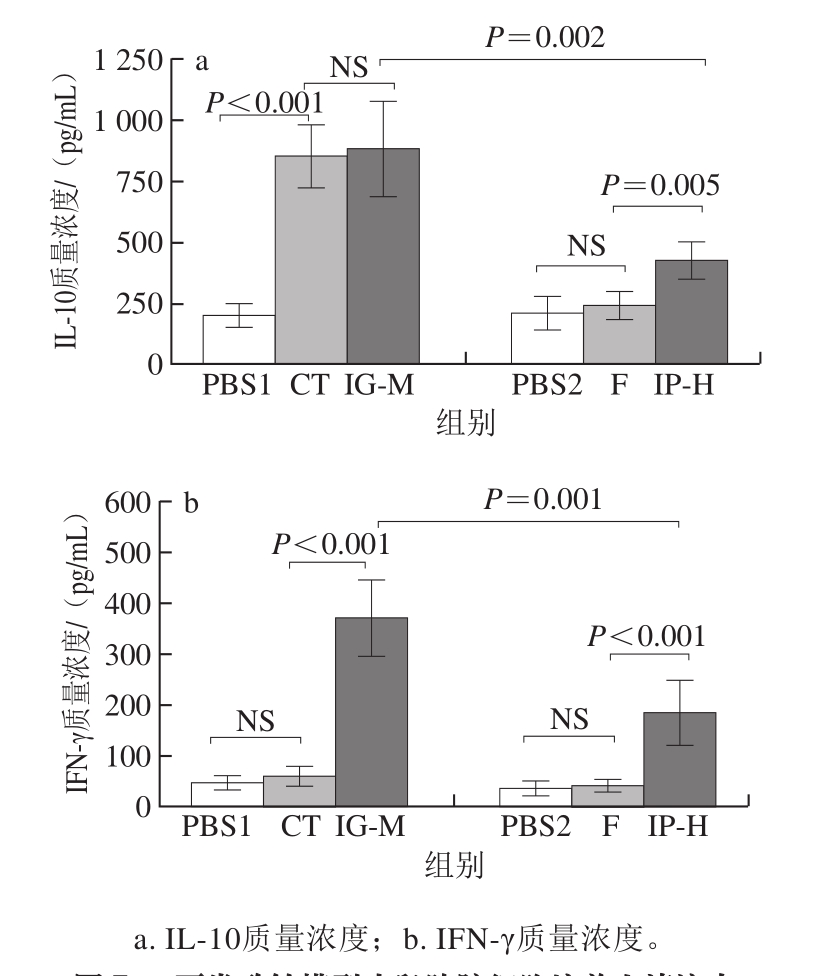
图7 两类致敏模型小鼠脾脏细胞培养上清液中Th1型细胞因子的质量浓度
Fig. 7 Th1 type cytokine concentrations in spleen cell culture supernatants from two BALB/c mouse models


图8 两类致敏模型小鼠脾脏细胞培养上清液中Th2型细胞因子的质量浓度
Fig. 8 Th2 type cytokine concentrations in spleen cell culture supernatants from two BALB/c mouse models
根据图7、8可知,与CT组相比,IG-M组的IL-5、IL-13质量浓度有所增加,IL-4质量浓度无显著性差异;而IP-H组与F组相比IL-4、IL-5、IL-13质量浓度均显著升高;IG-M组IFN-γ质量浓度显著升高,IL-10质量浓度无显著性差异,但与腹腔注射模型组相比质量浓度显著上升。IL-10并不是由Th1特定产生,几乎所有的淋巴细胞都能合成,因此可能是CT使某些其他淋巴细胞分泌IL-10使之质量浓度增加[24]。IG-M组的IL-5、IL-10及IFN-γ质量浓度均高于IP-H组,而IL-4、IL-13则低于IP-H组。分析可得:口服灌胃组Th2型细胞因子质量浓度大多低于腹腔注射组,而Th1型细胞因子则高于腹腔注射组,口服灌胃致敏效果不佳可能是由于机体产生耐受,影响Th1/Th2平衡,使得Th1细胞因子分泌增多,从而抑制了Th2型效应细胞的分化与活性,降低了Th2细胞因子的分泌[22,25]。
2.2.6 小鼠结肠中Th17相关转录因子IL-17A、IL-23 mRNA相对表达量分析

图9 两类致敏模型小鼠结肠中Th17转录因子mRNA相对表达量
Fig. 9 Relative expression of Th17 type transcription factor in colon of two BALB/c mouse models
Th17是一类分化及细胞因子分泌都与Th1和Th2不同的促炎症效应细胞,最早在小鼠的自身免疫病研究中被发现。Th0在转化生长因子-β(transforming growth factor β,TGF-β)和IL-6存在下会分化为Th17,然后依靠IL-23维持生存和增殖,并分泌IL-17、IL-6,其中分泌IL-17是这类细胞独特性质[26]。研究证明,Th17与食物过敏的发生也存在相关性,当食物过敏反应发生时,机体会诱导产生强烈的Th17型免疫应答并释放大量IL-17、IL-6和IL-23等炎性细胞因子[27-29]。由图9可知,分别与佐剂组相比:IG-M组的IL-17A mRNA相对表达量未有显著变化,而IP-H组则显著增加,且IG-M组与IP-H组相比也有显著性差异;IG-M组与IP-H组的IL-23 mRNA相对表达量均显著增加,且IG-M组与IP-H组相比无显著性差异,可能是由于IL-23是Th17存活、增殖、功能维持的主要因子,并不能促进Th17分化,因此在Th17达到一定量后即维持在此含量,但IL-17A是Th17的效应因子,其含量的多少决定下游过敏效应的强弱。综上,IP-H组的Th17的转录因子相对表达量高于IG-M组,其致敏效果更好,这也与上述sIgE、Th2型细胞因子的测定结果相对应。
2.2.7 小鼠脾脏中Treg细胞比例分析
Treg细胞是一类调控机体免疫功能的细胞群,能维持免疫系统对自身成分的耐受,使机体保持免疫稳态。Treg细胞在口服免疫耐受的产生、食物过敏及其他过敏性疾病的防治中发挥了重要的作用,可分为来源于胸腺的天然型Treg细胞和胸腺外的诱导型Treg细胞(induced regulatory T cells,iTreg)两种类型。口服耐受的形成依赖于iTreg的分化,而iTreg可以在黏膜表面调节Th2引起的免疫反应[19]。肠道、皮肤、呼吸道和口腔黏膜均可生成功能性Treg细胞并诱导免疫耐受的产生[30-32]。Treg细胞可通过分泌IL-10、IL-35、TGF-β等免疫抑制因子和/或上调IL-2受体的表达抑制其他T细胞与IL-2受体结合,从而抑制其他T细胞的分化与增殖,如抑制抗原特异性Th2的激活,进而抑制其介导的过敏反应[33-36]。由图10e可知,与对照组相比,IG-M组的Treg细胞比例显著上升,而IP-H组虽有增加,却无显著性,且IG-M组与IP-H组相比也有显著性上升。Treg细胞与Th17之间有密切关系,两者分化均需要TGF-β,但高浓度的TGF-β会抑制Th17细胞分化,且促进Treg细胞分化的IL-2会抑制Th17细胞分化,这可能是导致IL-17A mRNA相对表达量未上升的原因之一[25,37]。
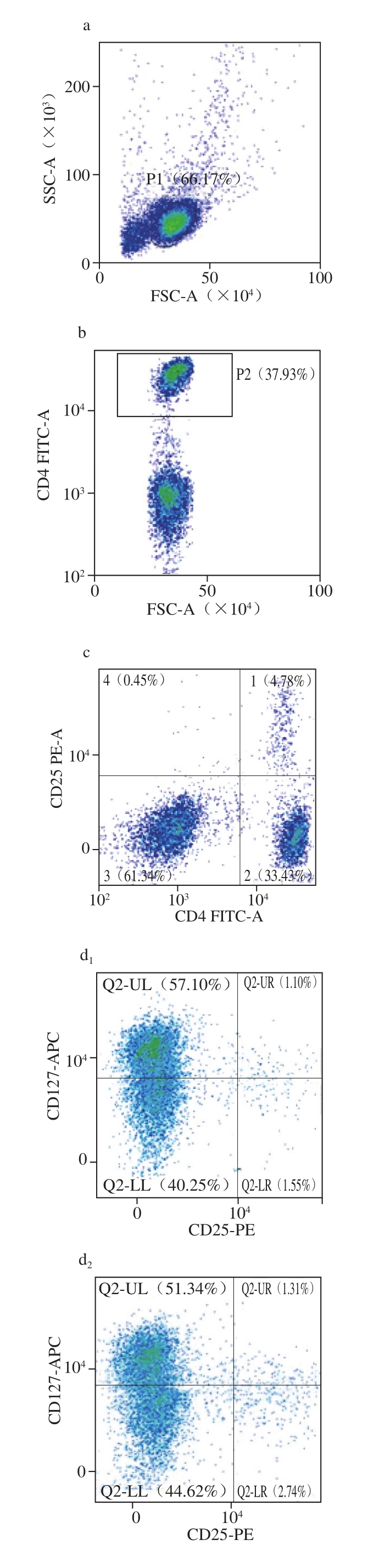

图10 两类致敏模型小鼠脾脏细胞中Treg细胞比例
Fig. 10 Ratio between Treg cells and CD4+cells in spleen cells from two BALB/c mouse models
近10 年,随着全球对虾消费量的增加,对虾过敏现象日益普遍。研究表明,对虾中主要过敏原TM的氨基酸序列在多类动物中具有很高的同源性,高同源性使得TM易发生交叉反应,一些对虾过敏的患者也会对环境中的螨虫、蟑螂等动物过敏,这也是近些年对虾过敏现象剧增的原因之一[3]。因此,针对TM建立小鼠致敏模型为研究食物过敏原致敏机制及其体内免疫调节提供了较好的工具,从而为临床上预防及治疗食物过敏提供了重要的理论依据。
本研究通过临床过敏症状评分、TM-sIgE、组胺、Th1及Th2型细胞因子、Th17型转录因子mRNA相对表达量等指标的测定,证明腹腔注射TM比口服灌胃更易使小鼠致敏,其Th1/Th2平衡被打破,Th2反应占据优势。而根据TM-sIgG2a、Th1型细胞因子IFN-γ以及Treg细胞比例的上升可知,虽有黏膜佐剂的作用,但口服灌胃致敏小鼠仍可能诱导口服免疫耐受的产生,使机体免疫应答偏向Th1型,产生大量无害的IgG2a。此外,本研究结果也显示,TM过敏受Th1、Th2、Treg、Th17这4 类细胞相互作用调控,但其确切的调控机理还需要进一步研究。
参考文献:
[1] PLATTS-MILLS T A E. The allergy epidemics: 1870—2010[J].Journal of Allergy and Clinical Immunology, 2015, 136(1): 3-13.DOI:10.1016/j.jaci.2015.03.048.
[2] KOEBERL M, KAMATH S D, SAPTARSHI S R, et al. Autoinduction for high yield expression of recombinant novel isoallergen tropomyosin from King prawn (Melicertus latisulcatus) for improved diagnostics and immunotherapeutics[J]. Journal of Immunological Methods, 2014, 415: 6-16. DOI:10.1016/j.jim.2014.10.008.
[3] FABER M A, PASCAL M, EL KHARBOUCHI E O, et al. Shellfish allergens: tropomyosin and beyond[J]. Allergy, 2017, 72(6): 842-848.DOI:10.1111/all.13115.
[4] LIU T, NAVARRO S, LOPATA A L. Current advances of murine models for food allergy[J]. Molecular Immunology, 2016, 70: 104-117. DOI:10.1016/j.molimm.2015.11.011.
[5] TORDESILLAS L, BERIN M C, SAMPSON H A. Immunology of food allergy[J]. Immunity, 2017, 47(1): 32-50. DOI:10.1016/j.immuni.2017.07.004.
[6] 郝海霞, 李润花, 殷国荣. 霍乱毒素作为黏膜佐剂的研究进展[J].中国病原生物学杂志, 2012, 7(1): 13; 70-74. DOI:10.13350/j.cjpb.2012.01.010.
[7] TAN J, MCKENZIE C, VUILLERMIN P J, et al. Dietary fiber and bacterial SCFA enhance oral tolerance and protect against food allergy through diverse cellular pathways[J]. Cell Reports, 2016, 15(12):2809-2824. DOI:10.1016/j.celrep.2016.05.047.
[8] LEE K P, KANG S, PARK S J, et al. Anti-allergic effect of alphacubebenoate isolated from Schisandra chinensis using in vivo and in vitro experiments[J]. Journal of Ethnopharmacology, 2015, 173: 361-369. DOI:10.1016/j.jep.2015.07.049.
[9] FU L L, PENG J X, ZHAO S S, et al. Lactic acid bacteria-specific induction of CD4+Foxp3+T cells ameliorates shrimp tropomyosin-induced allergic response in mice via suppression of mTOR signaling[J]. Science Reports, 2017, 7: 1-14. DOI:10.1038/s41598-017-02260-8.
[10] LIU Q M, WANG Y Z, CAO M J, et al. Anti-allergic activity of R-phycocyanin from Porphyra haitanensis in antigen-sensitized mice and mast cells[J]. International Immunopharmacology, 2015, 25(2):465-473. DOI:10.1016/j.intimp.2015.02.032.
[11] RUPA P, MINE Y. Oral immunotherapy with immunodominant T-cell epitope peptides alleviates allergic reactions in a Balb/c mouse model of egg allergy[J]. Allergy, 2012, 67(1): 74-82. DOI:10.1111/j.1398-9995.2011.02724.x.
[12] CHEN Chen, LU Lianhua, SUN Nana, et al. Development of a BALB/c mouse model for food allergy: comparison of allergyrelated responses to peanut agglutinin, β-lactoglobulin and potato acid phosphatase[J]. Toxicology Research, 2017, 6(2): 251-261.DOI:10.1039/C6TX00371K.
[13] 傅玲琳, 富舒洁, 王彦波, 等. 凡纳对虾原肌球蛋白硫酸铵沉淀分离纯化方法的优化[J]. 食品科学, 2017, 38(18): 187-192. DOI:10.7506/spkx1002-6630-201718030.
[14] LAM Y F, TONG K K, KWAN K M, et al. Gastrointestinal immune response to the shrimp allergen tropomyosin: histological and immunological analysis in an animal model of shrimp tropomyosin hypersensitivity[J]. International Archives of Allergy and Immunology,2015, 167(1): 29-40. DOI:10.1159/000431228.
[15] SCHIAVI E, BARLETTA B, BUTTERONI C, et al. Oral therapeutic administration of a probiotic mixture suppresses established Th2 responses and systemic anaphylaxis in a murine model of food allergy[J]. Allergy, 2011, 66(4): 499-508. DOI:10.1111/j.1398-9995.2010.02501.x.
[16] LONG F Y, YANG X, WANG R R, et al. Effects of combined high pressure and thermal treatments on the allergenic potential of shrimp(Litopenaeus vannamei) tropomyosin in a mouse model of allergy[J].Innovative Food Science and Emerging Technologies, 2015, 29:119-124. DOI:10.1016/j.ifset.2015.03.002.
[17] 刘光明, 沈苑, 曹敏杰, 等. 虾类过敏原的识别、纯化和检测技术研究[J]. 中国食品学报, 2008, 8(6): 142-148. DOI:10.16429/j.1009-7848.2008.06.022.
[18] 塔克·马可, 玛丽·桑德斯. 免疫应答导论[M]. 北京: 科学出版社,2012: 158-165.
[19] DE LAFAILLE M A C, KUTCHUKHIDZE N, SHEN S, et al.Adaptive Foxp3+regulatory T cell-dependent and -independent control of allergic inflammation[J]. Immunity, 2008, 29(1): 114-126.DOI:10.1016/j.immuni.2008.05.010.
[20] 胡德建, 张香梅. 不同剂量致敏原对小鼠过敏性哮喘模型特异性抗体和炎性细胞因子的影响[J]. 实用临床医药杂志, 2014, 18(21):8-11. DOI:10.7619/jcmp.201421003.
[21] 湛孝东, 姜玉新, 李良怿, 等. 不同浓度卵蛋白变应原对小鼠哮喘模型建立的影响[J]. 中国实验动物学报, 2012, 20(4): 16-20.DOI:10.3969/j.issn.1005-4847.2012.04.003.
[22] SHIN H S, SEE H J, JUNG S Y, et al. Turmeric (Curcuma longa)attenuates food allergy symptoms by regulating type 1/type 2 helper T cells (Th1/Th2) balance in a mouse model of food allergy[J].Journal of Ethnopharmacology, 2015, 175: 21-29. DOI:10.1016/j.jep.2015.08.038.
[23] DU TOIT G, SAMPSON H A, PLAUT M, et al. Food allergy: update on prevention and tolerance[J]. Journal of Allergy and Clinical Immunology, 2018, 141(1): 30-40. DOI:10.1016/j.jaci.2017.11.010.
[24] TRINCHIERI G. Interleukin-10 production by effector T cells: Th1 cells show self control[J]. Journal of Experimental Medicine, 2007,204(2): 239-243. DOI:10.1084/jem.20070104.
[25] YANG F L, WANG D, LI Y, et al. Th1/Th2 balance and Th17/Tregmediated immunity in relation to murine resistance to dextran sulfateinduced colitis[J]. Journal of Immunology Research, 2017, 2017: 1-11.DOI:10.1155/2017/7047201.
[26] WEAVER C T, HARRINGTON L E, MANGAN P R, et al. Th17: an effector CD4 T Cell lineage with regulatory T cell ties[J]. Immunity,2006, 24(6): 677-688. DOI:10.1016/j.immuni.2006.06.002.
[27] HE R, OYOSHI M K, JIN H, et al. Epicutaneous antigen exposure induces a Th17 response that drives airway inflammation after inhalation challenge[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(40): 15817-15822.DOI:10.1073/pnas.0706942104.
[28] WILSON R H, WHITEHEAD G S, NAKANO H, et al. Allergic sensitization through the airway primes Th17-dependent neutrophilia and airway hyperresponsiveness[J]. American Journal of Respiratory &Critical Care Medicine, 2009, 180(8): 720-730. DOI:10.1164/rccm.200904-0573OC.
[29] VERMA A K, KUMAR S, SHARMA A, et al. Allergic manifestation by black gram (Vigna mungo) proteins in allergic patients, BALB/c mice and RBL-2H3 cells[J]. International Immunopharmacology,2014, 23(1): 92-103. DOI:10.1016/j.intimp.2014.08.016.
[30] AKBARI O, DEKRUYFF R H, UMETSU D T. Pulmonary dendritic cells producing IL-10 mediate tolerance induced by respiratory exposure to antigen[J]. Nature Immunology, 2001, 2(8): 725-731.DOI:10.1038/90667.
[31] MASCARELL L, SAINT-LU N, MOUSSU H, et al. Oral macrophagelike cells play a key role in tolerance induction following sublingual immunotherapy of asthmatic mice[J]. Mucosal Immunology, 2011,4(6): 638-647. DOI:10.1038/mi.2011.28.
[32] AGÜERO M G D, VOCANSON M, HACINIRACHINEL F, et al.Langerhans cells protect from allergic contact dermatitis in mice by tolerizing CD8+T cells and activating Foxp3+regulatory T cells[J]. Journal of Clinical Investigation, 2012, 122(5): 1700-1711.DOI:10.1172/JCI59725.
[33] 陈硕, 聂汉祥, 刘琳琳. Treg细胞和Th17细胞的研究进展[J].临床肺科杂志, 2017, 22(10): 1899-1903. DOI:10.3969/j.issn.1009-6663.2017.010.041.
[34] DHUBAN K B, D’HENNEZEL E, BEN-SHOSHAN M, et al. Altered T helper 17 responses in children with food allergy[J]. International Archives of Allergy & Immunology, 2013, 162(4): 318-322.DOI:10.1159/000354028.
[35] HUANG X, CHEN Y, ZHANG F, et al. Peripheral Th17/Treg cell-mediated immunity imbalance in allergic rhinitis patients[J].Brazilian Journal of Otorhinolaryngology, 2014, 80(2): 152-155.DOI:10.5935/1808-8694.20140031.
[36] SHI Y H, SHI G C, WAN H Y, et al. Coexistence of Th1/Th2 and Th17/Treg imbalances in patients with allergic asthma[J]. Chinese Medical Journal, 2011, 124(13): 1951-1956. DOI:10.3760/cma.j.issn.0366-6999.2011.13.006.
[37] 王维维, 沈茜. Th17细胞和Treg细胞的细胞因子调节网络[J]. 生命的化学, 2010, 30(2): 269-273. DOI:10.13488/j.smhx.2010.02.024.
Allergenicity of Shrimp Tropomyosin from Different Sensitization Approaches on BALB/c Mice
FU Linglin1,2, XIE Menghua1, WANG Chong1, WANG Haiyan2, WANG Yanbo1,2,*
(1. School of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310018, China;2. Zhejiang Engineering Institute of Food Quality and Safety, Hangzhou 310018, China)
Abstract:Food allergy is an important public health issue in industrial countries due to the increasing prevalence and the potential life-threatening consequence. The understanding of food allergy mechanisms usually comes from experimental mouse models, which are broadly divided into two categories: oral sensitization model and topical or epicutaneous sensitization model. However, few studies have been focused on the difference between the two categories and the selection of the appropriate one. In this study, we aimed to develop a suitable route for tropomyosin administration by comparing the allergenicity of oral gavage and intraperitoneal injection in BALB/c mice in order to establish an effective animal model and to investigate the underlying mechanisms at the molecular and immunological levels, which will provide a theoretical basis for the establishment of animal model for food allergen research, the exploration of the mechanism of food allergen sensitization, and the prevention and treatment of food allergy. Results indicated that higher tropomyosin-specific immunoglobulin (Ig) E, histamine, and helper T cell (Th) type 2 cytokines were observed in intraperitoneally sensitized mice than those intragastrically sensitized, indicating that intraperitoneal injection was more sensitive in inducing systemic food allergy.Furthermore, higher levels of serum tropomyosin-specific IgG2a and interferon gamma, as well as regulatory T cell population were observed in intragastrically sensitized mice, suggesting that oral gavage may still develop oral tolerance to decrease the allergenicity of shrimp tropomyosin in BALB/c mice in spite of the presence of mucosal adjuvant. This experiment showed that intraperitoneal injection of tropomyosin to sensitized mice is easier than oral gavage, breaking the Th1/Th2 balance and making Th2 response dominant. Accordingly, intraperitoneal injection is more suitable to establish an animal model for food allergy research.
Keywords:tropomyosin; oral gavage; intraperitoneal injection; food allergy; mouse model
DOI:10.7506/spkx1002-6630-201813025
收稿日期:2018-01-25
基金项目:国家自然科学基金面上项目(31571770)
第一作者简介:傅玲琳(1981—),女,教授,博士,研究方向为食品安全与过敏原。E-mail:fulinglin@zjgsu.edu.cn
*通信作者简介:王彦波(1978—),男,教授,博士,研究方向为食品质量与安全。E-mail:wyb1225@163.com
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2018)13-0166-10
引文格式:傅玲琳, 谢梦华, 王翀, 等. 对虾原肌球蛋白不同致敏途径对BALB/c小鼠致敏性的影响[J]. 食品科学, 2018, 39(13):166-175.
DOI:10.7506/spkx1002-6630-201813025. http://www.spkx.net.cn
FU Linglin, XIE Menghua, WANG Chong, et al. Allergenicity of shrimp tropomyosin from different sensitization approaches on BALB/c mice[J]. Food Science, 2018, 39(13): 166-175. (in Chinese with English abstract)
DOI:DOI:10.7506/spkx1002-6630-201813025. http://www.spkx.net.cn