皮冰冰1,赵 晓1,吕萍萍2,彭钰凯1,潘 琳1,许晓曦1,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.绥芬河出入境检验检疫局,黑龙江 绥芬河 157300)
摘 要:以牛乳清乳铁蛋白(bovine whey lactoferrin,LFW)、牛初乳乳铁蛋白(bovine colostrum lactoferrin,LFC)、人乳铁蛋白(human lactoferrin,LFH)、牛乳铁蛋白素(bovine lactoferricin,LfcinB)和人乳铁蛋白素(human lactoferricin,LfcinH)为研究对象,研究其对小鼠脾淋巴细胞增殖的影响并比较不同来源乳铁蛋白(lactoferrin,LF)及乳铁蛋白素(lactoferricin,Lfcin)作用效果的差异性。采用CCK-8法检测不同来源的LF与Lfcin作用小鼠脾淋巴细胞24、48、72 h后,及其与丝裂原共同作用对小鼠T、B淋巴细胞增殖作用的影响。结果显示:LF与Lfcin均在48 h时对小鼠脾淋巴细胞增殖的促进效果最好,且在一定质量浓度范围内促进效果随质量浓度升高而加强;LF与Lfcin均在一定质量浓度范围内提高刀豆蛋白A诱导的T淋巴细胞的增殖和脂多糖诱导的B淋巴细胞的增殖。结果表明:两种牛乳铁蛋白(bovine lactoferrin,LFB)及LfcinB可替代LFH应用于婴幼儿配方产品中以提高婴幼儿免疫能力,LFB推荐添加质量浓度为0.50~2.00 mg/mL,Lfcin推荐添加质量浓度为75~125 μg/mL。
关键词:乳铁蛋白;乳铁蛋白素;脾淋巴细胞;增殖
婴儿配方奶粉作为一种母乳替代品[1],是非母乳喂养婴儿的首选食物。婴幼儿配方奶粉的研制,从宏观到微观都要求尽可能地接近人乳。目前配方奶粉在营养成分上已满足婴幼儿的生长需要[2-4],但其中缺少能够提高婴幼儿免疫能力的免疫活性物质[5-6]。人乳铁蛋白(human lactoferrin,LFH)作为母乳中重要的免疫活性成分,是人乳中主要的蛋白质之一,占普通母乳总蛋白含量的10%[7-8],是婴儿增强免疫系统能力的重要物质[9-10],是婴儿配方奶粉“母乳化”的重要指标。乳铁蛋白(lactoferrin,LF)经胃蛋白酶作用会释放生物活性物质乳铁蛋白素(lactoferricin,Lfcin)。研究表明,LF与Lfcin在抵抗真菌、炎症以及病菌感染[11-13],抗癌及提高机体的免疫调节能力促进伤口愈合[14-16]等方面具有显著作用。现阶段包括我国在内的许多国家均已将LF加到婴儿配方奶粉中[16-17],但用量不明确[18-19],且LFH来源受限,价格昂贵,限制了其的添加使用。牛乳铁蛋白(bovine lactoferrin,LFB)分子质量与LFH分子质量相近[20-21],且牛乳铁蛋白素(bovine lactoferricin,LfcinB)与人乳铁蛋白素(human lactoferricin,LfcinH)的顺序同源性高达69%[22-23],LFB原料来源便捷、价廉,尤其是小肽LfcinB的生产更节约成本。如何以低价等效成分替代母乳活性成分,对于降低婴儿配方奶粉中免疫活性物质的成本具有重要的意义。本研究以牛乳清乳铁蛋白(bovine whey lactoferrin,LFW)、牛初乳乳铁蛋白(bovine colostrum lactoferrin,LFC)与LFH及LfcinB与LfcinH为原料,探究其作用的最佳剂量及相互替代的用量比例关系,为LFB替代LFH在配方奶粉中的添加提供科学理论依据。
BALB/c小鼠SPF级雌性6~8 周,购自北京维通利华实验动物技术有限公司。LFW(产自新西兰) 北京银河路经贸有限公司;LFC 黑龙江康普生物科技有限公司;LFH 西安百川生物科技有限公司;LfcinB(氨基酸序列FKCRR WQWRM KKLGA PSITC VRRAF)、LfcinH(氨基酸序列GRRRR SVQWC AVSQP EATKC FQWQR NMRKV RGPPV SCIKR DSPIQ CIQA) 瀚海博兴生物技术有限公司。
RPMI-1640完全培养基 美国HyClone公司;胎牛血清 德国BI公司;双抗(青霉素和链霉素)、红细胞裂解液、L-谷氨酰胺 Solarbio生物科技有限公司;磷酸脂多糖(lipopolysaccharide,LPS)、刀豆蛋白(concanavalin A,ConA) 美国Sigma公司;CCK-8试剂盒 南京建成生物工程研究所;其余化学试剂均为分析纯。
HF90型CO2培养箱 北京市六一仪器厂;BPG-9070A鼓风干燥箱 上海一恒科技有限公司;MHBS-1096A酶标仪 南京DeTie公司;AE-31型倒置显微镜 麦克奥迪实业集团有限公司;DSX-280B高压灭菌锅 上海申安公司;血球计数板 上海求精生化试剂仪器有限公司;3K15高速冷冻离心机 德国Sigma公司;BSA224S分析天平、PB-10 pH计 德国Sartorius公司。
1.3.1 小鼠脾淋巴细胞的制备
将断粮12 h的小鼠脱颈处死,在体积分数75%乙醇溶液中浸泡15 min。将双手及超净无菌台面用体积分数75%乙醇溶液消毒,并用镊子将小鼠转移至解剖盘中。吸取10 mL无菌磷酸盐缓冲液(phosphate buffered saline,PBS)注入干净无菌培养皿中,用解剖剪剪开小鼠胸腔,取出脾脏置于PBS中,清除脂肪及筋膜组织,并用PBS淋洗1~2 次,放入盛有5 mL无菌PBS的离心管中,密封好带入细胞培养室[24-25]。用体积分数75%乙醇溶液擦拭双手及超净无菌台面,吸取10 mL含10%胎牛血清的RPMI-1640完全培养基注入无菌培养皿中,除去装有脾脏的离心管中的PBS,将小鼠脾脏转移至培养皿中,用1 mL无菌注射器吸满培养基,用针头在不刺穿脾脏的前提下冲洗并挤压小鼠脾脏,收集此时的脾细胞悬液到离心管中,用培养基冲洗培养皿1~2 次,同样收集至离心管中,1 500 r/min离心5 min后,倒掉上清液,加入约4 倍体积的红细胞裂解液并吹打细胞使其悬浮后静置5 min后加入等量的PBS,1 500 r/min离心5 min以除去血红细胞(若效果不够理想可再次重复操作),再用培养基洗涤细胞2 次[26-27]。将上述收集到的脾细胞置于装有15 mL完全培养基的培养瓶中,至于37 ℃含5% CO2的培养箱中培养4 h,除去其中所含的贴壁细胞,用血球计数板计算细胞数量待用。
1.3.2 LF及Lfcin对淋巴细胞增殖的影响
将LFW、LFC、LFH用含10%胎牛血清的完全RPMI-1640培养基配制的质量浓度为0.10、0.25、0.50、1.00、2.00、4.00 mg/mL的LF溶液,LfcinB与LfcinH用含10%胎牛血清的完全RPMI-1640培养基配制的质量浓度为50、75、100、125、150 μg/mL的Lfcin溶液,0.22 μL滤膜过滤备用。
将1.3.1节获得的细胞浓度调至1×106个/mL,以每孔100 μL接种到96 孔培养板中。LF实验组:细胞悬液中加入LF溶液;Lfcin实验组:细胞悬液中加入Lfcin溶液;同时设阳性对照组:细胞悬液中加入等量的质量浓度为5 μg/mL的ConA;阴性对照组:细胞悬液中只加入含10%的完全RPMI-1640培养基,添加量均为20 μL;空白组:每孔无细胞悬液,只含等量120 μL的RPMI-1640完全培养基。每一质量浓度设3 个复孔,置于37 ℃含5% CO2培养箱中培养24、48、72 h后,每孔避光加入10 μL CCK-8试剂[28-29],置于37 ℃、5% CO2培养箱中继续培养3~4 h,在酶标仪450 nm波长处振荡60 s测定OD值,比较各组OD值来判断处理细胞的最佳质量浓度及最佳时间。根据下式计算细胞相对存活率[30]。
1.3.3 LF及Lfcin在ConA刺激下对T淋巴细胞增殖的影响
将1.3.1节获得的细胞浓度调至1×106个/mL,然后接种到96 孔板中,每孔100 μL。LF+ConA实验组:细胞悬液中加入LF溶液20 μL及5 μg/mL的ConA溶液20 μL;Lfcin+ConA实验组:细胞悬液中加入配制的Lfcin溶液20 μL及5 μg/mL的Con A溶液20 μL;同时设对照组:细胞悬液中只加入等量含10%的完全RPMI-1640培养基及5 μg/mL ConA;空白组:每孔无细胞悬液、只含等量的RPMI-1640完全培养基。每一质量浓度设3 个复孔,置于37 ℃、5% CO2培养箱中培养48 h后,每孔避光加入10 μL CCK-8试剂,置于37 ℃、5% CO2培养箱中继续培养3~4 h,在酶标仪450 nm波长处振荡1 min测定OD值,比较各组OD值来判断处理细胞的最佳质量浓度。
1.3.4 LF及Lfcin在LPS刺激下对B 淋巴细胞增殖的影响
将上述1.3.1节获得的细胞浓度调至1×106个/mL,以每孔100 μL接种到96 孔板中。LF+LPS实验组:细胞悬液中加入配制的LF溶液20 μL及1 μg/mL的LPS溶液20 μL;Lfcin+LPS实验组:细胞悬液中加入配制的Lfcin溶液20 μL及5 μg/mL的LPS溶液20 μL;同时设对照组:细胞悬液中只加入等量含10%的完全RPMI-1640培养基及1 μg/mL LPS;空白组:无细胞悬液、只含等量的140 μL完全培养基。每一质量浓度设3 个复孔,37 ℃、5% CO2培养箱中培养48 h后,每孔避光加入10 μL CCK-8试剂,继续在培养箱中培养3~4 h,在酶标仪450 nm波长处振荡60 s测定OD值,比较各组OD值来判断处理细胞的最佳质量浓度。
每组实验重复3 次。数据均使用SPSS 19.0软件进行统计分析,单因素方差分析法比较差异显著性,并用Sigma Plot 12.5软件作图,结果以 ±s表示。
2.1.1 LF对小鼠脾淋巴细胞相对存活率的影响
表1 不同来源LF作用24 h后的淋巴细胞相对存活率
Table1 Relative survival rates of lymphocytes after 24 h culture in the presence of LF from different sources%
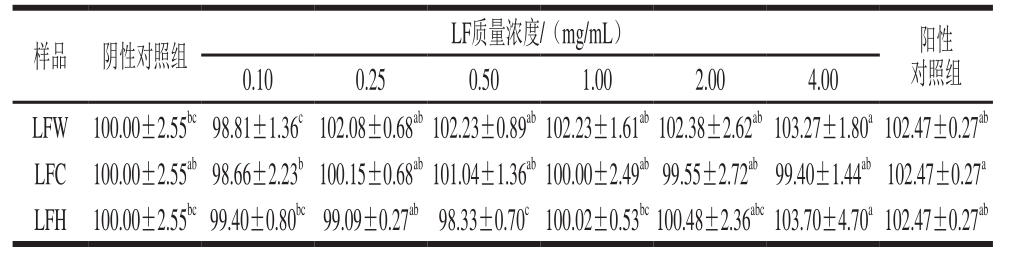
注:同行小写字母不同表示差异显著(P<0.05)。下同。
由表1可知,在24 h时,4.00 mg/mL LFW及4.00 mg/mL LFH与阴性对照组相比显著性差异(P<0.05)。由表1中细胞相对存活率可知,LFW对淋巴细胞的增殖效果相对高于其他两种LF,其他两种LF对细胞增殖既有促进作用也有抑制作用,但促进效果低于LFW的促进效果。
表2 不同来源LF作用48 h后的淋巴细胞相对存活率
Table2 Relative survival rates of lymphocytes after 48 h culture in the presence of LF from different sources%

由表2可以看出,在48 h时,1.00、2.00 mg/mL的LFC及1.00、2.00、4.00 mg/mL的LFH与阴性对照组相比有显著性差异(P<0.05)。由表2中细胞相对存活率可知,LF在48 h时作用效果随质量浓度增大呈先增强后下降的趋势,LFW的作用效果随时间及质量浓度的变化波动较小。
表3 不同来源LF作用72 h后的淋巴细胞相对存活率
Table3 Relative survival rates of lymphocytes after 72 h culture in the presence LF from different sources%

由表3可以看出,在72 h时,0.50、1.00、4.00 mg/mL LFC及1.00、2.00、4.00 mg/mL LFH与阴性对照组相比有显著性差异(P<0.05)。由表3中细胞相对存活率可知,LF在72 h时3 种LF对细胞的增殖作用效果无明显规律。
由表1~3可以看出,在不同时间内不同来源的LF对淋巴细胞的作用程度不同,3 种LF在48 h的细胞相对存活率较高。表2显示,LF在48 h时作用效果随质量浓度增大整体呈先增强后下降的趋势,LFW的作用效果随时间及质量浓度的变化波动较小。LFH在1.00 mg/mL时对淋巴细胞增殖的促进作用效果最高,而LFC在2.00 mg/mL时效果与其最为接近。结果表明,LFH的最佳质量浓度为1.00 mg/mL,与细胞的添加比例为1∶5,LFC对细胞的增殖作用可替代LFH的作用效果,替代质量浓度约为LFH的2 倍。
2.1.2 Lfcin对小鼠脾淋巴细胞相对存活率的影响
表4 不同来源Lfcin作用24、48、72 h后的小鼠脾淋巴细胞相对存活率
Table4 Relative survival rates of lymphocytes after 24, 48 and 72 h in the presence of LF from different sources
%

由表4可以看出,在24 h时,LfcinB及LfcinH与阴性对照组相比显著性不差异(P<0.05),但均在100 μg/mL时细胞相对存活率达到最大。在48 h时,75~150 μg/mL LfcinB及100 μg/mL LfcinH与阴性对照组相比有显著性差异(P<0.05)。LfcinH的最佳效果高于LfcinB的最佳效果。在72 h时,100 μg/mL LfcinH与对照组相比有显著性差异(P<0.05)。由细胞存活率可知,LfcinH的效果整体优于LfcinB的作用效果。
不同时间内LfcinB和LfcinH处理的淋巴细胞的存活率随质量浓度的升高均表现为先升高再降低的趋势,并且48 h是促进细胞增殖的最佳时间。表4中48 h的相对存活率显示,LfcinB对淋巴细胞的促进作用在125 μg/mL时达到最大,而LfcinH在100 μg/mL时达到最大,且效果优于LfcinB的最大效果。结果表明,LfcinH的最佳添加质量浓度为100 μg/mL,与细胞的添加比例为1∶5,LfcinB对细胞的增殖作用可替代LfcinH的作用效果,替代效果略差。
由表1~4可知,Lfcin与LF都在最大促进作用效果时LFH的添加用量约为LfcinH的10 倍,而LFB的添加量约为LfcinB的16 倍,来源于牛乳与人乳的LF及Lfcin均可增强免疫淋巴细胞的存活率,且来源于人的LF及Lfcin对淋巴细胞存活的促进效果高于来源于牛的LF及Lfcin,其中来源于牛乳的LFC作用效果大于LFW,并且使用Lfcin可大大降低使用剂量。
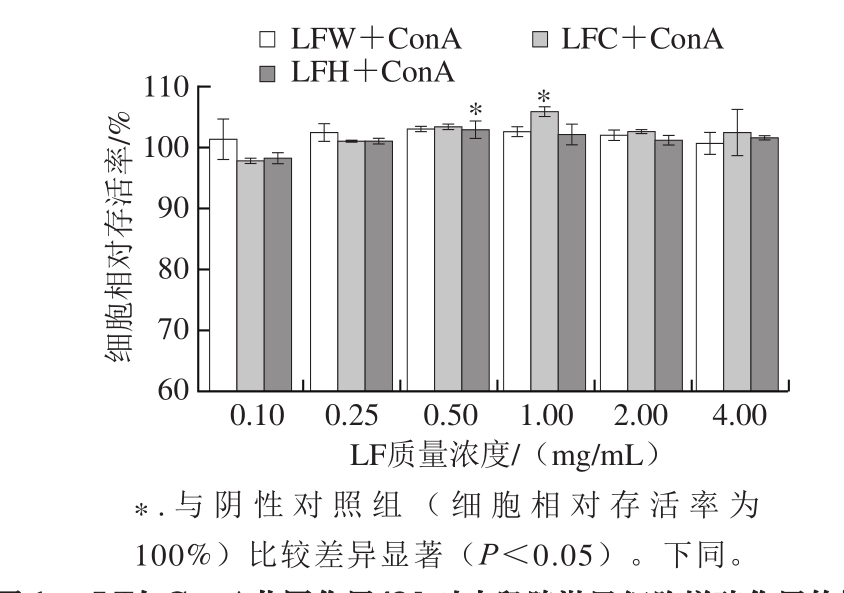
图1 LF与Con A共同作用48 h对小鼠脾淋巴细胞增殖作用的影响
Fig. 1 Effects of lactoferrin combined with ConA on the proliferation of spleen lymphocyte after 48 h culture
由图1可以看出,LF与在ConA的刺激下培养细胞48 h后,淋巴细胞的相对存活率均先升高后下降。LFW在0.10~4.00 mg/mL范围内对ConA刺激的淋巴细胞的增殖能力均为促进作用,在0.50 mg/mL达到最大效果,但整体效果差异较小。LFC与LFH在0.10 mg/mL时抑制ConA刺激的淋巴细胞增殖,在0.25~4.00 mg/mL范围内促进ConA刺激的淋巴细胞增殖,LFC在1.00 mg/mL时达到最大效果,LFH在0.50 mg/mL时达到最大效果,LFC高于其他两种LF的最佳效果。结果表明,两种LFB可在最大效果0.50 mg/mL处替代LFH的作用,且增加LFC的剂量可以达到更佳的效果。
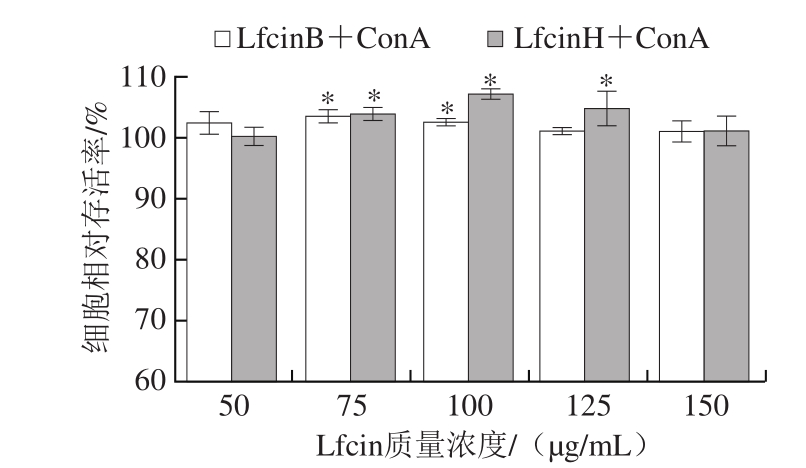
图2 Lfcin与ConA 共同作用48 h对小鼠脾淋巴细胞增殖作用的影响
Fig. 2 Effects of Lfcin combined with ConA on the proliferation of spleen lymphocyte after 48 h culture
由图2可知,Lfcin在与ConA的刺激下培养细胞48 h后,小鼠的免疫淋巴细胞的相对存活率均随着Lfcin质量浓度的增加而先升高后下降。LfcinB在75 μg/mL时作用效果达到最高,此质量浓度LfcinH的作用效果与LfcinB的作用效果基本持平,而LfcinH在100 μg/mL时作用效果达到最高。结果表明,在与ConA共同按1∶1作用淋巴细胞时,LfcinB与LfcinH的最佳添加质量浓度分别为75、100 μg/mL,按1∶5作用细胞悬液,但加大剂量会加强LfcinH的作用效果,LfcinB对细胞的增殖作用可替代LfcinH的作用效果,替代效果略差。
图1、2结果显示,Lfcin与LF都在最大促进作用效果时LFH的添加用量约为LfcinH的5 倍,而LFB的添加量约为LfcinB的13 倍。LFH与ConA共同作用的最佳使用质量浓度为0.50 mg/mL,此作用效果可用同质量浓度的LFW与LFC替代,且将LFC的剂量提高一倍所得效果远远高于LFH的作用效果。由此表明,来源于牛乳的LF及Lfcin可替代来源于人乳的LF及Lfcin对免疫淋巴细胞存活率的影响作用,并且使用Lfcin可大大降低使用剂量。

图3 LF与 LPS 共同作用48 h对小鼠脾淋巴细胞增殖作用的影响
Fig. 3 Effects of lactoferrin combined with LPS on the proliferation of spleen lymphocyte after 48 h culture
由图3可知,LF与LPS对免疫淋巴细胞协同刺激作用后,增强效果随质量浓度的提高先升高后降低,LFH在0.50~4.00 mg/mL范围内效果波动不明显,并在2.00 mg/mL时达到最大效果。LFW与LFC分别在0.50 mg/mL与2.00 mg/mL时可近似达到LFH的最大效果。结果表明,在与等量的LPS共同作用下,LFH的最佳添加质量浓度为2.00 mg/mL,与细胞的添加比例为1∶5,LFW与LFC质量浓度分别为0.50 mg/mL与2.00 mg/mL时对细胞的增殖作用可替代LFH的作用效果,替代效果略差。
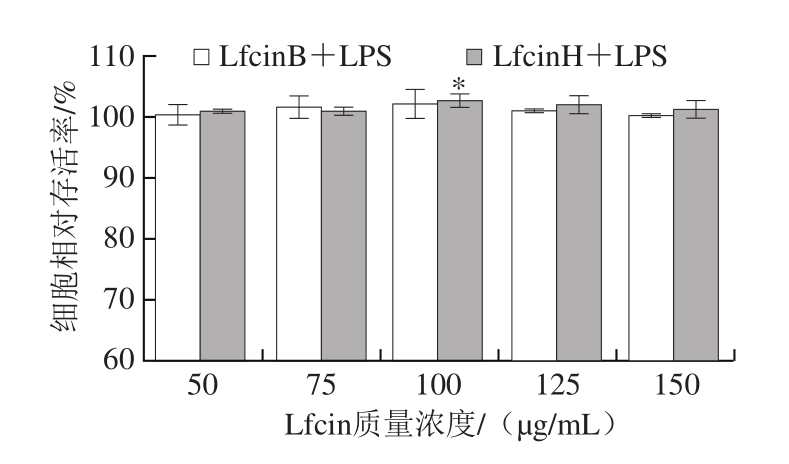
图4 Lfcin与LPS 共同作用48 h对小鼠脾淋巴细胞增殖作用的影响
Fig. 4 Effects of Lfcin combined with LPS on the proliferation of spleen lymphocyte after 48 h culture
由图4可知,在分别与LPS按1∶1比例的共同作用下,50~100 μg/mL LfcinB与LfcinH对淋巴细胞均具有促进增殖的作用,且均呈先升高后下降的趋势。且LfcinH与LfcinB均在100 μg/mL时对淋巴细胞的增殖促进效果最佳。结果表明,LfcinB可替代LfcinH对免疫淋巴细胞增殖的促进作用,但替代效果略差。
图3、4结果显示,在丝裂原LPS的作用下,Lfcin与LF都在最大促进作用效果时LFH的添加用量约为LfcinH的20 倍,而LFW的添加量约为LfcinB的5 倍,LFC的添加量约为LfcinB的20 倍,且来源于人乳的LF及Lfcin对淋巴细胞存活的促进效果略高于来源于牛乳的LF及Lfcin,由此表明来源于牛乳的LF及Lfcin可替代来源于人乳的LF及Lfcin对免疫淋巴细胞存活率的影响作用,并且使用Lfcin可大大降低使用剂量。
本实验以体外分离培养的脾淋巴细胞作为细胞模型,对比LFW、LFC、LFH、LfcinB和LfcinH对其增殖作用的差异及相关性。研究发现在相同用量的前提下,3 种LF及两种Lfcin在一定质量浓度范围内能有效地促进脾淋巴细胞增殖,同一质量浓度的LF或Lfcin其促进效果会随作用时间的延长而有所改变。LFW、LFC、LFH与ConA、LPS对T、B淋巴细胞增殖刺激作用与质量浓度有关,LfcinB、LfcinH与ConA、LPS对T、B淋巴细胞增殖有协同刺激作用,且随着质量浓度增加,协同作用增强。
根据LF单独作用及在分裂刺激源ConA与LPS共同作用免疫淋巴细胞对其增殖作用显示的最佳添加质量浓度可知,在3 种不同作用条件下LFH在0.50~2.00 mg/mL范围内对免疫淋巴细胞的促进效果最好,而LFW与LFC在此范围内可替代LFH的作用效果,且LFC效果更接近。LfcinH在3 种条件下在100 μg/mL时对免疫淋巴细胞的促进效果最好,而LfcinB在75~125 μg/mL范围内效果相对最优,在此质量浓度范围内LfcinB可替代LfcinH的作用效果。3 种LF与两种Lfcin的最大作用效果差距较小,说明Lfcin是LF发挥免疫提高功效的主要部分。LFW与LFC在提高免疫方面能达到LFH的作用效果,进一步说明两种LFB可替代LFH应用于婴儿配方产品中以提高婴幼儿免疫能力,推荐添加质量浓度为0.50~2.00 mg/mL,其中LFC的替代效果高于LFW的作用效果,此质量浓度可充分发挥LF的免疫增强能力。并且Lfcin推荐添加质量浓度为75~125 μg/mL,用相应的Lfcin替代LF可大大降低用量。
参考文献:
[1] 吴坤. 营养与食品卫生学[M]. 5版. 北京: 人民卫生出版社, 2003: 164.
[2] 刘宁玉, 夏明, 王慧铭, 等. 国产与进口婴儿配方奶粉的营养成分比较分析[J]. 中国食物与营养, 2013, 19(4): 70-72.
[3] 许崇辉, 温巧玲, 黄华军, 等. 12 种中外婴儿配方奶粉营养效应的比较研究[J]. 食品科学, 2013, 34(23): 326-332. DOI:10.7506/spkx1002-6630-201323066.
[4] 王英, 任小玲, 周忠义. 不同喂养方式对早产新生儿生长发育及健康状况的影响[J]. 检验医学与临床, 2015, 12(17): 2520-2522; 2525.
[5] 易新萍, 闫祝炜, 赵建勇. 中国婴幼儿配方奶粉市场的研究进展[J].乳业科学与技术, 2008, 31(5): 243-245. DOI:10.15922/j.cnki.jdst.2008.05.013.
[6] 寇明钰, 阚健全. 婴儿配方奶粉的研制、质量标准及其发展趋势[J]. 中国乳业, 2005, 4(11): 39-41. DOI:10.16172/j.cnki.114768.2005.11.014.
[7] HANEY E F, NAZMI K, BOLSCHER J G M, et al. Structural and biophysical characterization of an antimicrobial peptide chimera comprised of lactoferricin and lactoferrampin[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2012, 1818(3): 762-775.
[8] YAN D, CHEN D, HAWSE J R, et al. Bovine lactoferricin induces TIMP-3 via the ERK1/2-Sp1 axis in human articular chondrocytes[J].Gene, 2013, 517(1): 12-18. DOI:10.1016/j.gene.2013.01.001.
[9] LIAO Y, JIANG R, LONNERDAL B. Biochemical and molecular impacts of lactoferrin on small intestinal growth and development during early life[J]. Biochemistry and Cell Biology, 2012, 90(3): 476-484.
[10] MANZONI P, MEYER M, STOLFI I, et al. Bovine lactoferrin supplementation for prevention of necrotizing enterocolitis in verylow-birth-weight neonates: a randomized clinical trial[J]. Early Human Development, 2014, 90: S60-S65. DOI:10.1016/S0378-3782(14)70020-9.
[11] TOMITA M, WAKABAYASHI H, YAMAUCHI K, et al. Bovine lactoferrin and lactoferricin derived from milk: production and applications[J]. Biochemistry and Cell Biology, 2002, 80(1): 109-112.DOI:10.1139/o01-230.
[12] WANG W P, IIGO M, SATO J, et al. Activation of intestinal mucosal immunity in tumor-bearing mice by lactoferrin[J]. Japanese Journal of Cancer Science, 2000, 91(10): 1022-1027. DOI:10.1111/j.1349-7006.2000.tb00880.x.
[13] 杨海燕, 侯建明, 吴曼, 等. 乳铁蛋白对大鼠成骨细胞增殖及IGF-1/IGF-1RmRNA表达的影响[J]. 中华骨质疏松和骨矿盐疾病杂志,2014, 7(1): 35-41.
[14] 韩兆莲, 李萌, 刘宁, 等. 流式细胞术分析牛乳铁蛋白素促进Jurkat细胞早期凋亡[J]. 食品工业科技, 2013, 34(18): 210-212; 216.
[15] LEGRAND D, MAZURIER J. A critical review of the roles of host lactoferrin in immunity[J]. Biometals, 2010, 23(3): 365-376.
[16] SIQUEIROS-CENDÓN T, ARÉVALO-GALLEGOS S, IGLESIASFIGUEROA B, et al. Immunomodulatory effects of lactoferrin[J]. Acta Pharmacologica Sinica, 2014, 35(5): 557-566.
[17] 戴智勇, 莫红卫, 董玲, 等. 第四代婴儿配方奶粉的研制及应用[J].中国乳业, 2015(2): 65-68. DOI:10.16172/j.cnki.114768.2015.02.025.
[18] 赵红霞. 乳铁蛋白的功能特性及其在婴儿配方奶粉中的应用[J]. 中国乳品工业, 2016, 44(6): 36-39.
[19] LONNERDAL B, SUZUKI Y. Lactoferrin[M]// FOX P F,MCSWEENEY P L H. Advanced Dairy Chemistry. New York:Springer, 2013: 295-315.
[20] PAUCIULLO A, COSENZA G, NICODEMO D, et al. Molecular cloning, promoter analysis and SNP identification of Italian Nicastrese and Saanen lactoferrin gene[J]. Veterinary Immunology and Immunopathology, 2010, 134(3): 279-283.
[21] WANG W Y, WONG J H, IP D T, et al. Bovine lactoferrampin,human lactoferricin, and lactoferrin 1-11 inhibit nuclear translocation of HIV integrase[J]. Applied Biochemistry and Biotechnology, 2016,179(7): 1202-1212. DOI:10.1007/s12010-016-2059-y.
[22] 杨鹏华, 倪凤娥. 牛乳铁蛋白稳定性的研究[J]. 中国乳业, 2009(6):40-41. DOI:10.16172/j.cnki.114768.2010.02.005.
[23] HUNTER H N, DEMCOE A R, JENSSEN H, et al. Human lactoferricin is partially folded in aqueous solution and is better stabilized in a membrane mimetic solvent[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(8): 3387-3395.
[24] 赵宁, 许晓曦, 张艳杰, 等. 不同来源Lfcin对小鼠脾淋巴细胞增殖及分泌细胞因子影响的对比研究[J]. 现代食品科技, 2015, 31(10):7-12; 121. DOI:10.13982/j.mfst.1673-9078.2015.10.002.
[25] 任国艳, 张凡, 郭金英, 等. 乳铁蛋白及其多肽对淋巴细胞增殖活性的影响[J]. 食品科技, 2015, 40(3): 260-264.
[26] 宋博翠. 瑞香素对小鼠淋巴细胞免疫抑制效果及其作用机制的研究[D]. 长春: 吉林大学, 2014: 49-63.
[27] 李娜娜. 松花粉硫酸酯化多糖对小鼠T淋巴细胞的免疫调节作用[D].济南: 山东师范大学, 2013: 33-34.
[28] 彭珍桂, 卢小玲. MTT法和CCK-8法检测人肝癌细胞活性的对比研究[J]. 生物技术世界, 2016(3): 319-319.
[29] 谢光洪, 许远靖, 田武林, 等. β-HB对牛皱胃平滑肌细胞活性影响:MTT法和CCK-8法的比较研究[J]. 中国兽医学报, 2013, 33(3):436-438; 449. DOI:10.16303/j.cnki.1005-4545.2013.03.024.
[30] WANG S, TU J, ZHOU C, et al. The effect of Lfcin-B on non-small cell lung cancer H460 cells is mediated by inhibiting VEGF expression and inducing apoptosis[J]. Archives of Pharmacal Research, 2015,38(2): 261-271. DOI:10.1007/s12272-014-0373-x.
Comparative Study on the Effects of Lactoferrin and Lactoferricin from Different Sources on Proliferation of Mouse Spleen Lymphocytes
PI Bingbing1, ZHAO Xiao1, LÜ Pingping2, PENG Yukai1, PAN Lin1, XU Xiaoxi1,*
(1. Food Science College, Northeast Agricultural University, Harbin 150030, China;2. Suifenhe Entry-Exit Inspection and Quarantine Bureau, Suifenhe 157300, China)
Abstract:The effects of lactoferrin from bovine whey (LFW), lactoferrin from bovine colostrum (LFC), human lactoferrin(LFH), human lactoferricin (LfcinH) and bovine lactoferricin (LfcinB) on the proliferation of spleen lymphocytes from mice were studied, and different lactoferrin (LF) and lactoferricin (Lfcin) were compared. The cell counting kit-8 assay was used to measure cell proliferation after 24, 48 and 72 h of culture. Moreover, the effects of different LF and Lfcin combined with mitogen on the proliferation of mouse T and B lymphocytes were also evaluated. The results showed that both LF and Lfcin had the most significant effect in promoting the proliferation of spleen lymphocytes at 48 h,which was concentration-dependent in a certain range. Both LF and LFcin enhanced T lymphocyte proliferation induced by concanavalin A and B lymphocyte proliferation induced by lipopolysaccharide in a certain concentration range. These findings indicated that the two types of bovine lactoferrins (LFB) as well as Lfcin can substitute LFH in infant formula products to enhance immune function in infants and young children, and the recommended concentration for LFB and Lfcin was 0.50–2.00 mg/mL and 75–125 μg/mL, respectively.
Keywords:lactoferrin; lactoferricin; spleen lymphocyte; proliferation
DOI:10.7506/spkx1002-6630-201813027
收稿日期:2017-02-05
基金项目:“十二五”国家科技支撑计划项目(2013BAD18B00)
第一作者简介:皮冰冰(1992—),女,硕士研究生,研究方向为乳品科学与技术、乳品安全与质量管理。E-mail:pibingbing418@163.com
*通信作者简介:许晓曦(1968—),女,教授,博士,研究方向为乳品科学与技术、乳品安全与质量管理。E-mail:xiaoxi_xu01@163.com
中图分类号:TS252.1
文献标志码:A
文章编号:1002-6630(2018)13-0184-06
引文格式:皮冰冰, 赵晓, 吕萍萍, 等. 不同来源乳铁蛋白及乳铁蛋白素对小鼠脾淋巴细胞增殖影响的比较[J]. 食品科学, 2018,39(13): 184-189.
DOI:10.7506/spkx1002-6630-201813027. http://www.spkx.net.cn
PI Bingbing, ZHAO Xiao, LÜ Pingping, et al. Comparative study on the effects of lactoferrin and lactoferricin from different sources on proliferation of mouse spleen lymphocytes[J]. Food Science, 2018, 39(13): 184-189. (in Chinese with English abstract)
DOI:DOI:10.7506/spkx1002-6630-201813027. http://www.spkx.net.cn