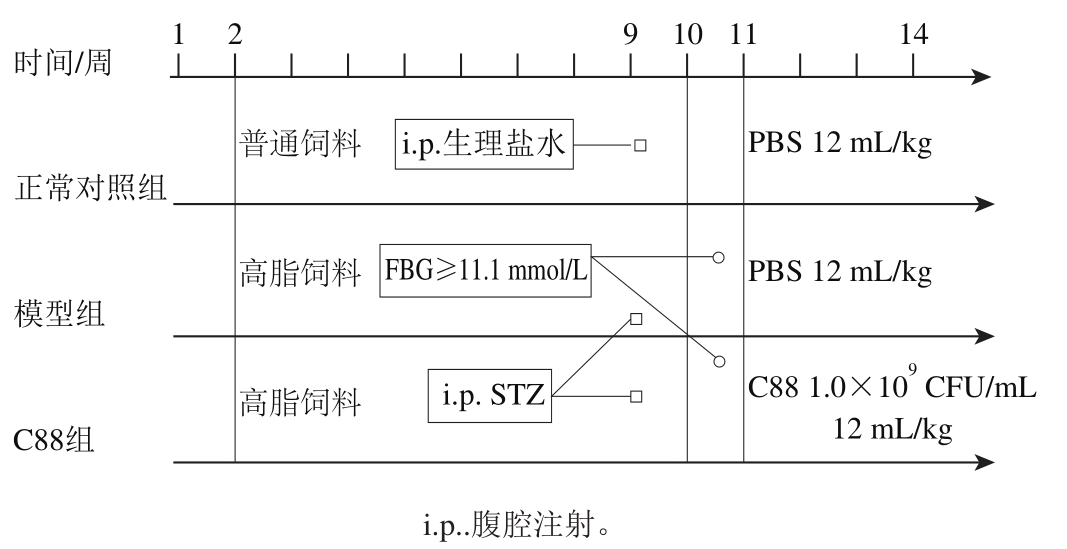
图1 动物分组、饲喂及造模
Fig. 1 Animal grouping, feeding and modeling
罗 宏1,段翠翠2,栾 畅2,高 磊2,赵玉娟2,牛春华2,李盛钰2,*
(1.长春大学特殊教育学院,吉林 长春 130022;2.吉林省农业科学院农产品加工研究所,吉林 长春 130033)
摘 要:目的:探究植物乳杆菌(Lactobacillus plantarum)C88对2型糖尿病大鼠模型降血糖作用。方法:采用高脂饲料结合腹腔注射链脲佐菌素的方法建立2型糖尿病大鼠模型,连续灌胃植物乳杆菌C88,28 d后检测大鼠空腹血糖量、葡萄糖耐受量、血脂、胰岛素、炎症因子、肠道屏障功能和菌群水平。Western blot分析核因子-κB(nuclear factor-κB,NF-κB)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、闭锁小带蛋白-1(zonula occludens-1,ZO-1)、occludin、claudin-1的表达。结果:植物乳杆菌C88可有效改善2型糖尿病大鼠高血糖和血脂代谢紊乱;显著降低2型糖尿病大鼠血清中TNF-α、白细胞介素-6、C反应蛋白、脂多糖、D-乳酸等炎症相关因子水平;植物乳杆菌C88能促进胰岛素的分泌,提高胰高血糖素样肽-2水平,降低2型糖尿病大鼠血清中二胺氧化酶和连蛋白水平;显著降低肝脏中炎症相关蛋白NF-κB、TNF-α的表达,提高回肠中肠道通透性相关蛋白ZO-1、occludin、claudin-1的表达。结论:植物乳杆菌C88是一株具有辅助降血糖功能的益生菌。
关键词:植物乳杆菌;糖尿病;降血糖;肠道菌群;炎症
益生菌是一类对宿主有益的活性微生物,其定植于肠道中,能够维持肠道菌群正常生长代谢,缓解乳糖不耐症,并具有改善便秘和腹泻、调节血脂代谢、降低过敏反应、提高机体免疫力等生理功能[1-3]。目前,益生菌潜在的防治糖尿病的功能已得到动物体内及临床实验的证实和广泛认可。当机体摄入适量的益生菌时,能有效调节能量代谢,降低脂肪和胆固醇堆积,有效补充糖尿病引起的肠道菌群缺失,建立新的肠道平衡稳态,恢复健康肠道菌群结构,降低肠道渗透性,提高肠道屏障作用,抑制炎症反应,减轻葡萄糖不耐受并提高葡萄糖耐量和胰岛素敏感性。例如,干酪乳杆菌干预糖尿病模型小鼠后,血糖水平显著下降,可能其通过保护或修复胰岛细胞功能降低胰岛损伤,改善血糖代谢异常[4]。高脂膳食诱导的2型糖尿病模型小鼠摄入动物双歧乳杆菌后,减少了肠黏膜中革兰氏阴性菌的细菌易位及大肠杆菌的数量,并降低肠系膜脂肪组织中肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素-1β(interleukine-1β,IL-1β)、纤溶酶原激活物抑制剂-1和IL-6水平,改善葡萄糖耐受,提高胰岛素敏感性[5]。约氏乳杆菌(Lactobacillus johnsonii)可减少机体氧化应激反应并增加紧密连接蛋白的表达,降低糖尿病倾向小鼠的发病率[6],另有研究表明约氏乳杆菌可调节Th17的表达,缓解糖尿病的发生发展[7]。然而,目前益生菌改善和治疗糖尿病的机理还未深入阐明,可能与体内氧化应激反应、免疫反应、炎症反应及肠道菌群结构有关[8]。
植物乳杆菌C88是从传统发酵食品奶豆腐中分离获得的一株益生菌。研究表明,植物乳杆菌C88具有抗氧化、抗衰老、降胆固醇、调节肠道菌群、提高机体免疫力和保护肝损伤等生理功能[9-10]。本研究采用高脂饲料结合腹腔注射链脲佐菌素诱导建立2型糖尿病模型,通过检测灌胃植物乳杆菌C88对大鼠的血糖、血脂、血清炎症因子、肠道通透性以及肠道菌群的影响,评价植物乳杆菌C88对2型糖尿病大鼠的降血糖作用。
SPF级健康雄性SD大鼠150 只,体质量180~200 g,购自长春市亿斯实验动物技术有限责任公司,动物许可证号:SCXK(吉)-2011-0004。基础饲料:粗蛋白20%(质量分数,下同)、粗脂肪4%、粗纤维5%、粗灰分8%、水分10%、钙10%、磷1%、赖氨酸1%;高脂饲料:基础饲料75%、猪油10%、蛋黄粉10%、胆盐5%。
植物乳杆菌(L. plantarum)C88为吉林省农业科学院自有菌株,由内蒙古奶豆腐中分离获得,其保藏编号为CCTCC NO:M 209254。菌株在添加20%(体积分数)甘油的MRS(de Man, Rogosa and Sharpe,MRS)培养基中于-80 ℃保存。
MRS液体培养基:牛肉膏10 g、蛋白胨10 g、酵母浸粉5 g、柠檬酸钠5 g、无水乙酸钠5 g、K2HPO42 g、MgSO4·7H2O 0.2 g、MnSO4·5H2O 0.05 g、吐温-80 1 mL、葡萄糖20 g,加三级水定容至1 L,醋酸调节pH值至6.6。115 ℃高压灭菌15 min。
链脲佐菌素(streptozotocin,STZ) 美国Sigma公司;大鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、脂联素(adiponectin,ADPN)、D-乳酸(D-lactic acid,D-Lac)、TNF-α、IL-6、IL-1、IL-1β、C反应蛋白(C-reactive protein,CRP)、脂多糖(lipopolysaccharide,LPS)、胰岛素(insulin,INS)、胰高血糖素样肽-2(glucagon like peptide-2,GLP-2)、二胺氧化酶(diamine oxidase,DAO)、连蛋白(zonulin,ZON)等的酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒上海朗顿生物技术有限公司;放射免疫沉淀(radio immunoprecipitation assay,RIPA)蛋白提取试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒北京鼎国昌盛生物技术有限公司;β-actin抗体、抗核因子-κB(nuclear factor-κ-gene binding,NF-κB)单克隆抗体、兔抗TNF-α单克隆抗体、抗闭锁小带蛋白-1(zonula occludens-1,ZO-1)单克隆抗体、兔抗occludin单克隆抗体、兔抗claudin-1单克隆抗体 北京博奥森生物技术有限公司;辣根过氧化物酶标记的山羊抗兔二抗 北京中杉金桥生物技术有限公司;Western blot化学发光辣根过氧化物酶(horseradish peroxidase,HRP)底物 美国Millipore公司。
LBS(Lactobacillus selection agar)琼脂培养基、双歧杆菌琼脂(MRS+neomycin nalidixic acid lithium chllloride paromomycin agar,MRS+NNLP)培养基、肠杆菌计数琼脂(violet red bile dextrose agar,VRBDA)培养基、胰胨-亚硫酸盐-环丝氨酸琼脂(tryptose sulfite cycloserine agar base,TSC)培养基、胆盐-七叶苷-叠氮钠琼脂(bile esculin azide agar,BEA)培养基 青岛海博生物技术有限公司。
卓越型血糖仪 德国Roche诊断有限公司;Sorvall Evolotion RC型高速冷冻离心机 美国Thermo公司;Cary300紫外-可见分光光度计 美国Varian公司;HZQ-Q型电热恒温培养箱 上海一恒实验设备有限公司;ELx800型全自动酶标仪 美国BioTek公司;XW-80A涡旋混合器 上海精科实业有限公司;电泳和转印系统 美国Bio-Rad公司;ChemiScope 5600化学发光成像系统 上海勤翔科学仪器有限公司。
1.3.1 菌株活化和培养
菌株在MRS液体培养基中连续活化培养3 代,按体积分数3%接种于MRS液体培养基中,37 ℃培养16 h,4 ℃、3 800 r/min离心15 min,弃上清液,菌泥用灭菌生理盐水洗涤2 次,调整C88菌数为1010CFU/mL备用[11]。
1.3.2 2型糖尿病大鼠模型建立及分组

图1 动物分组、饲喂及造模
Fig. 1 Animal grouping, feeding and modeling
室温(20±3)℃、12 h昼/夜循环、自由进水、基础饲料适应性喂养1 周后,随机选取35 只SD大鼠作为正常对照组,饲喂普通饲料;其余115 只大鼠饲喂高脂饲料,连续饲养8 周(实验期为第2~9周)后测定体质量,体质量增加量超过空白对照组平均体质量20%选为肥胖模型,排除造模不成功大鼠。肥胖大鼠空腹12 h(实验期为第9周),一次性腹腔注射30 mg/kg STZ[12]。1 周后(实验第10周),测定大鼠空腹血糖浓度,连续2 次测定空腹血糖浓度不小于11.1 mmol/L即判定为造成2型糖尿病模型,去除造模不成功大鼠。随机选取70 只大鼠分为模型组和C88组(每组35 只),C88组大鼠灌胃12 mL/(kg·d)植物乳杆菌C88(1.0×109CFU/mL),正常对照组和模型组大鼠灌胃12 mL/(kg·d)无菌磷酸盐缓冲溶液,连续灌胃28 d,实验设计如图1所示。
1.3.3 指标测定
1.3.3.1 大鼠体质量及空腹血糖含量测定
从第10周大鼠造成2型糖尿病模型开始,治疗期间每周测定大鼠体质量,并用血糖仪测定大鼠空腹血糖浓度[13]。
1.3.3.2 口服葡萄糖耐量测定
第14周治疗结束后,大鼠空腹12 h,灌胃葡萄糖溶液(2 g/kg)。分别于0、30、60、90、120 min后测定大鼠血糖浓度,并按照下式计算血糖曲线下面积(area under the curve,AUC)[14]。
AUC/(mmol•h/L)=1/2(G0+G30)×30+1/2(G30+G60)×30+1/2(G60+G90)×30+1/2(G90+G120)×30
式中:G0、G30、G60、G90、G120分别为0、30、60、90、120 min时大鼠的血糖浓度/(mmol/L);30为测定间隔时间。
1.3.3.3 大鼠血清指标检测
口服葡萄糖耐量实验结束后,腹腔注射1 mL/kg 3%戊巴比妥钠麻醉,固定于手术台,一次性采血针心脏采血(约5 mL),血液样本室温凝固60 min,3 500 r/min 4 ℃离心15 min,收集上清液分装,置于-80 ℃冰箱中保存。参照ELISA试剂盒说明书方法测定血清中TC、TG、HDL-C、LDL-C、TNF-α、IL-1、IL-6、IL-1β、INS、GLP-2、ADPN、LPS、D-Lac、DAO、ZON水平。
1.3.3.4 大鼠肠道菌群计数
分别于实验期间第10、11、12、13、14周(实验结束时),每组随机取大鼠3 只,脱颈处死,无菌条件下取大鼠成形肠内容物于试管内,无菌生理盐水梯度稀释,分别取50 µL涂布于LBS、MRS+NNLP、VRBDA、BEA、TSC琼脂平板,每个稀释度做3 个平行,37 ℃培养24~48 h,分别检测乳杆菌、双歧杆菌、肠杆菌、肠球菌和产气荚膜梭菌数量。以显微镜镜检、革兰氏染色等方法鉴定目的菌落,并进行菌落计数[15]。
肠道内主要菌群鉴定方法:1)乳杆菌(LBS琼脂)在37 ℃培养48 h,白色或乳白色革兰氏阳性无芽孢杆菌;2)双歧杆菌(MRS+NNLP琼脂)在37 ℃厌氧培养48 h,微白色、表面光滑、凸起、革兰氏阳性的叉状或棒状菌落;3)肠杆菌(VRBDA琼脂)在37 ℃培养24 h,发酵乳糖、革兰氏阴性的菌落;4)肠球菌(BEA琼脂)在37 ℃培养24 h,明显褐色圈、革兰氏阳性的菌落;5)产气荚膜梭菌(TSC琼脂)在37 ℃厌氧培养24 h,在紫外光下观察有荧光的黑色菌落。
1.3.3.5 Western blot检测相关蛋白的表达
实验结束处死小鼠后取肝脏、回肠组织,预冷生理盐水冲洗,迅速放入-80 ℃冰箱冻存。分别取肝脏、回肠组织加入RAPI裂解液充分匀浆(置于冰上),提取总蛋白,参照BCA试剂盒说明书检测蛋白质量浓度。样品蛋白变性处理后,用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离胶分离蛋白,并转移至硝酸纤维素膜上,用5%牛血清白蛋白封闭2 h,在1∶1 000稀释的抗体中4 ℃条件下孵育过夜,0.1% TBST洗膜3 次,每次20 min,再用1∶2 000稀释的HRP标记的二抗室温孵育2 h,0.1%TBST洗膜3 次,每次20 min,加入Western blot化学发光HRP底物,用化学发光成像系统观察结果并拍照。应用Clinx Image Analysis图像分析软件对硝酸纤维素膜上的条带进行灰度值比较分析。
实验数据处理采用SPSS 19.0软件进行分析,结果以 表示,不同剂量组间与模型组的采用方差分析比较,以P<0.05判断为具有显著性差异,P<0.01为具有极显著性差异。
表示,不同剂量组间与模型组的采用方差分析比较,以P<0.05判断为具有显著性差异,P<0.01为具有极显著性差异。
表1 植物乳杆菌C88对2型糖尿病模型大鼠体质量的影响(n= 20)
Table1 Effect of L. plantarum C88 on body weight in rats with type 2 diabetes (n= 20)g

注:与模型组比较,*.差异显著(P<0.05)。下同。
由表1可知,与正常对照组相比,高脂饲料结合STZ诱导大鼠糖尿病后明显增加大鼠体质量。治疗期间,模型组和C88组大鼠的体质量持续增加,但C88组大鼠体质量增加速度缓慢,与模型组相比体质量增加量下降,但仍然高于正常对照组。第12~14周,模型组大鼠每周体质量增加量在15.76~17.79 g之间,C88组大鼠每周体质量增加量为8.37~13.30 g,第14周实验结束时C88组大鼠体质量为514.46 g,与模型组相比差异显著(P<0.05)。结果表明灌胃植物乳杆菌C88能明显抑制2型糖尿病模型大鼠体质量的增加。
如表2所示,第10周模型组和C88组大鼠空腹血糖浓度与正常对照组相比含量明显提高,表明高脂饲料结合STZ诱导的2型糖尿病模型造模成功。与正常对照组相比,2型糖尿病大鼠空腹血糖浓度随着治疗时间的延长呈下降趋势。灌胃植物乳杆菌C88一周后(第11周),C88组大鼠空腹血糖浓度明显下降,血糖浓度降低3.01 mmol/L。第12周C88组大鼠空腹血糖浓度降低至13.55 mmol/L,与模型组相比差异性显著(P<0.05)。第13、14周血糖浓度持续降低,与模型组相比均有极显著差异(P<0.05)。治疗结束时(第14周),C88组大鼠空腹血糖浓度降低至13.25 mmol/L。以上结果表明,植物乳杆菌C88对2型糖尿病大鼠高血糖症有治疗作用,能显著降低大鼠的空腹血糖浓度。
表2 植物乳杆菌C88对2型糖尿病模型大鼠空腹血糖浓度的影响(n= 20)
Table2 Effects of L. plantarum C88 on fasting blood glucose levels in rat model of type 2 diabetes (n= 20)mmol/L

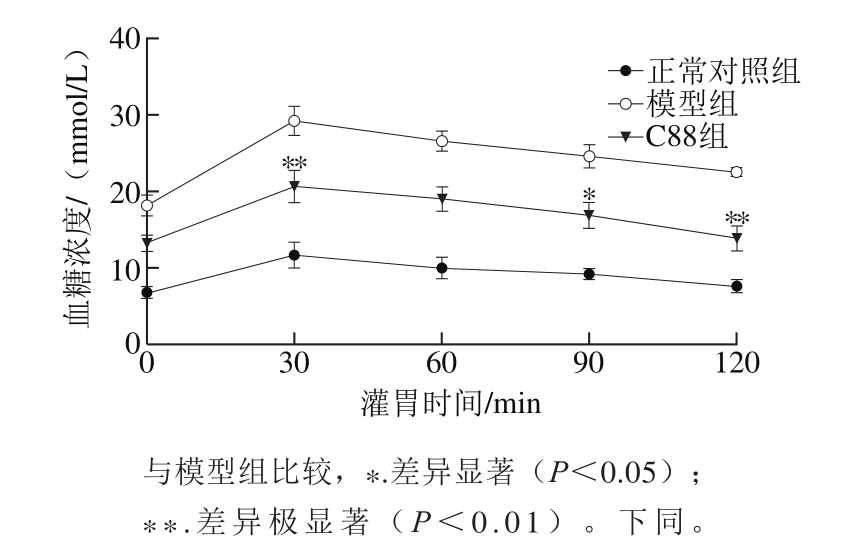
图2 植物乳杆菌C88对2型糖尿病模型大鼠口服葡萄糖耐量的影响(n=20)
Fig. 2 Effect of L. plantarum C88 on glucose tolerance in rats with type 2 diabetes (n = 20)
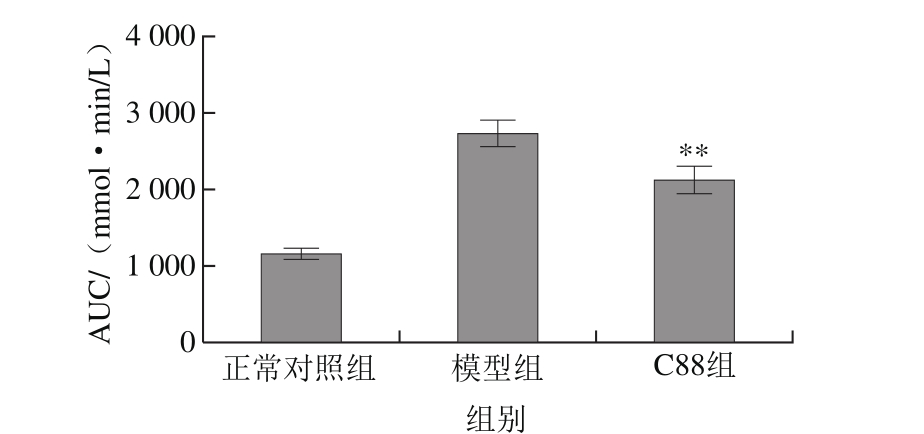
图3 植物乳杆菌C88对2型糖尿病模型大鼠血糖AUC的影响(n= 20)
Fig. 3 Effect of L. plantarum C88 on area under curve of rats with type 2 diabetes (n = 20)
口服葡萄糖耐量实验中,葡萄糖灌胃初始时(0 min)葡萄糖负荷为0,C88组大鼠的血糖浓度明显低于模型组,为模型组的72.64%。葡萄糖负荷30 min时,各组大鼠血糖浓度升高达到峰值,模型组大鼠血糖浓度最高,为28.24 mmol/L,C88组大鼠血糖浓度为20.07 mmol/L,说明植物乳杆菌C88改善了糖尿病大鼠的血糖调控能力。随着葡萄糖负荷时间的延长,各组大鼠血糖浓度均呈下降趋势,但模型组大鼠的血糖浓度仍在较高的水平。在葡萄糖负荷60~120 min时,C88组大鼠血糖浓度持续降低,90 min和120 min时血糖浓度与模型组相比有显著性差异(P<0.05)或极显著性差异(P<0.01)。如图3所示,与模型组相比C88组血糖AUC降低,具有极显著性差异(P<0.01)。结果说明植物乳杆菌C88能有效改善2型糖尿病大鼠的血糖调节能力,有效减缓餐后血糖水平迅速升高。
表3 物乳杆菌C88对2型糖尿病模型大鼠血清中TC、TG、HDL-C、LDL-C浓度的影响(n=20)
Table3 Effect of L. plantarumC88 on serum levels of TC, TG, HDL-C and LDL-C in rats with type 2 diabetes (n= 20)mmol/L

注:*.与模型组比较差异极显著(P<0.01)。下同。
2型糖尿病大鼠体内血糖代谢异常同时会引起血脂代谢紊乱,如表3所示,与空白对照组相比,模型组大鼠的TC、TG、LDL-C浓度均升高,HDL-C浓度降低。植物乳杆菌C88灌胃可显著降低糖尿病大鼠血清中TC、TG、LDL-C浓度(P<0.01或P<0.05),显著提高HDL-C浓度(P<0.05),缓解2型糖尿病大鼠高血脂症状,改善血脂代谢紊乱。
表4 植物乳杆菌C88对2型糖尿病模型大鼠血清中TNF-α、IL-1、IL-6、IL-1β、CRP质量浓度的影响(n=20)
Table4 Effect of L. plantarumC88 on serum levels of TNF-α, IL-1,IL-6, IL-1β and CRP in rats with type 2 diabetes (n= 20)

2型糖尿病引起的葡萄糖和脂质代谢紊乱会诱发大鼠体内慢性炎症,血清中炎症标志物TNF-α、IL-1、IL-6、IL-1β、CRP水平升高。与模型组相比,治疗后C88组大鼠血清中TNF-α、IL-1β、CRP质量浓度均极显著下降(P<0.01),基本恢复到正常对照组水平。血清中IL-1质量浓度降低到50.09 ng/L,与模型组相比有显著性差异(P<0.05)。血清中IL-6水平降低到24.10 ng/L,与空白组水平相当,与模型组相比有显著性差异(P<0.05)。结果表明,植物乳杆菌C88能有效改善2型糖尿病大鼠血清中炎症标志物水平,缓解机体慢性炎症状态。
表5 植物乳杆菌C88对2型糖尿病模型大鼠血清中INS、GLP-2、ADPN水平的影响(n=20)
Table5 Effect of L. plantarumC88 on serum levels of INS, GLP-2 and ADPN in rats with type 2 diabetes (n= 20)

如表5所示,第14周治疗结束时,C88组大鼠血清中INS水平恢复到32.61 mU/L,与模型组相比有极显著性差异(P<0.01)。GLP-2质量浓度提高到2.14 ng/mL,与模型组相比有显著性差异(P<0.05)。ADPN质量浓度提高到12.41 ng/mL,与模型组相比差异不明显(P>0.05)。结果表明,植物乳杆菌C88能促进胰岛素的分泌,提高血清中胰高血糖素样肽-2、脂联素水平。
表6 植物乳杆菌C88对2型糖尿病模型大鼠血清中LPS、D-Lac、DAO、ZON水平的影响(n=20)
Table6 Effect of L. plantarum C88 on serum levels of LPS, D-Lac,DAO and ZON in rats with type 2 diabetes (n= 20)

2型糖尿病大鼠体内胰岛素分泌不足导致血清中LPS、D-Lac水平明显增加,灌胃植物乳杆菌C88 28天后,LPS、D-Lac水平均有显著降低(P<0.05)。治疗后C88组大鼠血清中DAO质量浓度下降到26.43 ng/mL,与模型组相比有极显著性差异(P<0.01),ZON质量浓度降低到5.93 ng/mL,与模型组相比差异性显著(P<0.05)。结果表明,植物乳杆菌C88能有效调节血清中脂多糖、D-Lac水平,降低2型糖尿病大鼠血清中DAO、ZON水平。
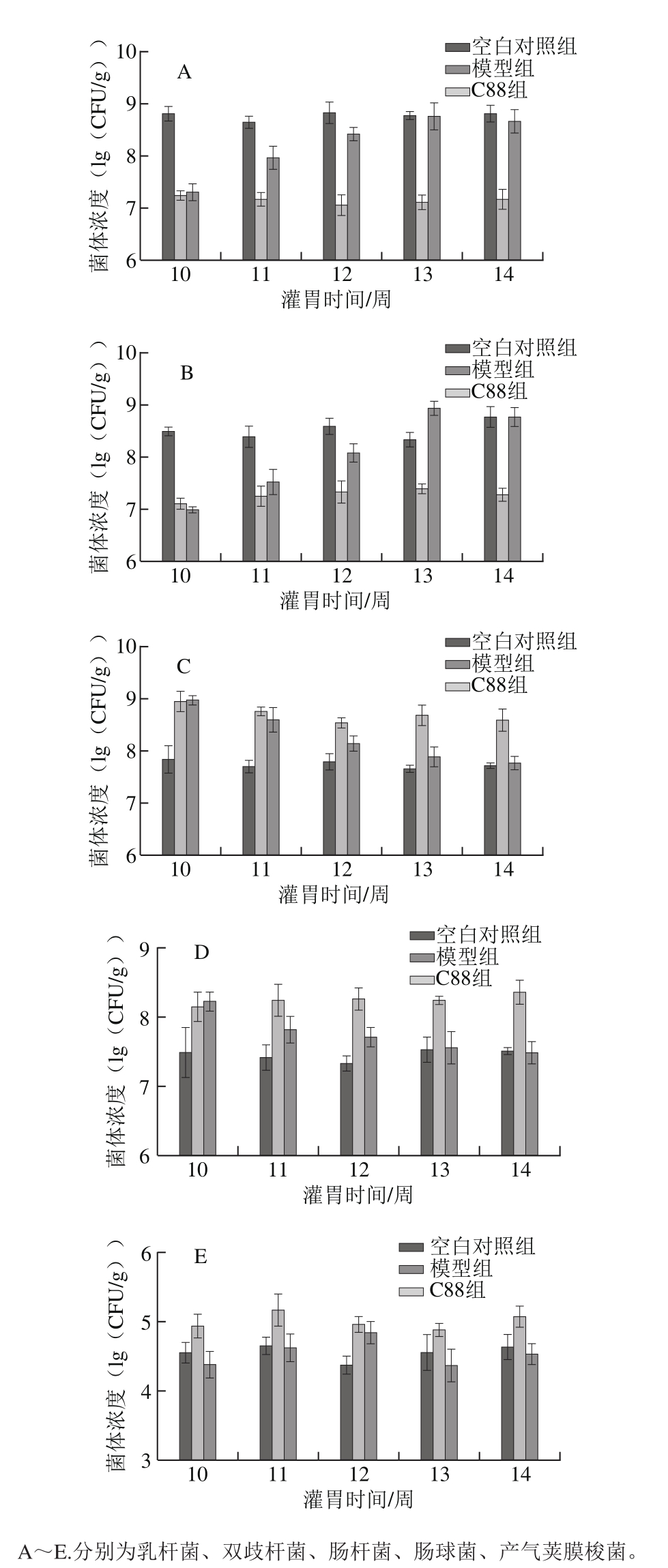
图4 植物乳杆菌C88对2型糖尿病模型大鼠肠道菌群的影响
Fig. 4 Effect of L. plantarum C88 on intestinal microflora of rats with type 2 diabetes
图4 显示了2型糖尿病大鼠灌胃植物乳杆菌C88后肠道中乳杆菌、双歧杆菌、肠杆菌、肠球菌和产气荚膜梭菌菌体浓度的变化。治疗期间,C88组大鼠粪便中乳杆菌和双歧杆菌的数量随着灌胃时间的延长逐渐增加。到第13~14周,乳杆菌和双歧杆菌数量基本恢复到正常对照组水平。大鼠肠道中肠杆菌、肠球菌和产气荚膜梭菌随着灌胃植物乳杆菌C88时间的延长,数量逐渐下降。第11周时,C88组大鼠肠道中的肠球菌数量呈明显下降趋势。第12周时C88组大鼠肠道中肠球菌数量明显降低。到第14周时,C88组大鼠肠道中肠球菌、肠杆菌和产气荚膜梭菌数量基本恢复到正常对照组水平。结果表明,植物乳杆菌C88能缓解2型糖尿病大鼠肠道损伤,平衡肠道微生态,促进有益菌乳杆菌和双歧杆菌的增殖,抑制有害菌肠杆菌、肠球菌和产气荚膜梭菌的生长,促进肠道微生态向健康方向发展。

图5 植物乳杆菌C88对2型糖尿病模型大鼠蛋白表达的影响
Fig. 5 Effect of L. plantarum C88 on protein expression in rats with type 2 diabetes
由图5可知,与空白对照组相比,模型组大鼠肝脏中NF-κB、TNF-α蛋白表达明显升高,表明2型糖尿病诱发了机体炎症。与模型组相比,C88组NF-κB、TNF-α蛋白的表达被不同程度地抑制,表明植物乳杆菌C88可能调节2型糖尿病大鼠NF-κB信号通路的表达。由图5可知,2型糖尿病大鼠回肠中ZO-1、occludin、claudin-1蛋白的表达量降低,肠道屏障受损,肠道通透性增加。与模型组相比,C88组大鼠回肠中ZO-1、occludin、claudin-1蛋白的表达量不同程度增加,表明植物乳杆菌C88能够通过上调肠上皮细胞间紧密连接蛋白表达量,改善肠道屏障损伤。
2型糖尿病是由于胰岛分泌功能缺陷、胰岛素抵抗等引起的慢性代谢综合征,主要包括肥胖、高血糖、高胰岛素血症、高脂血症。研究中采用高脂膳食结合STZ诱导大鼠2型糖尿病模型[16],实验第10周模型组和C88组大鼠空腹血糖量与正常对照组相比明显提高,表明成功建立2型糖尿病模型。在实验第10~14周模型组大鼠体质量增加量高于空白对照组大鼠体质量增加量,表明高脂膳食诱导的肥胖导致2型糖尿病模型大鼠体质量持续增加。植物乳杆菌C88可有效减少2型糖尿病模型大鼠体质量的增加,缓解大鼠肥胖状态。Huang Huiyu等[17]研究发现植物乳杆菌K68抑制高脂肪-果糖诱导的糖尿病大鼠的体质量增加,这与本研究结果一致。研究发现益生菌主要通过抑制血清中总胆固醇、甘油三酯等相关血脂水平的升高,缓解2型糖尿病小鼠胰岛素抵抗症状[18-19]。随着灌胃植物乳杆菌C88时间的延长,促进大鼠体内HDL-C的生成,抑制LDL-C的生成,减少胆固醇的沉积,加快肝脏对脂类的降解,降低脂多糖的活性,减少机体对甘油三酯的吸收,缓解2型糖尿病模型大鼠高血脂症状。同时恢复了血清中脂联素水平,有效发挥胰岛素增敏作用,刺激组织对机体葡萄糖的摄取,降低空腹血糖浓度,增强葡萄糖耐受,有效减缓餐后血糖水平的迅速升高,缓解2型糖尿病模型大鼠胰岛素分泌不足。
2型糖尿病患者因存在胃肠动力障碍及高糖高脂的膳食结构等造成革兰阴性菌异常增殖,产生大量脂多糖,引发全身慢炎症反应,通过作用于细胞膜受体,激活NF-κB通路、c-Jun氨基端激酶通路等细胞内信号转导途径,促进促炎症因子及炎症标志物如TNF-α、IL-1、IL-6、CRP、PAI-1等分泌[20-22]。治疗结束后C88组大鼠血清中TNF-α、IL-1β、CRP含量降低,基本恢复到正常水平,IL-1、IL-6水平有不同程度降低,肝脏中NF-κB、TNF-α蛋白的表达被不同程度地抑制。有研究报道口服罗伊氏乳杆菌GMNL-263改善糖尿病大鼠体内TNF-α、IL-6水平[23],鼠李糖乳杆菌CCFM0528能调节2型糖尿病小鼠炎症因子TNF-α、IL-6,IL-等相关mRNA的表达[16]。本研究结果表明植物乳杆菌C88可能通过激活2型糖尿病模型大鼠NF-κB信号通路来调节炎症反应,下调炎症因子及炎症标志物的表达和释放而发挥抗炎作用。
健康状态下,肠道菌群与宿主、外界环境建立起一个动态的平衡,保证各项生理活动正常运行。植物乳杆菌C88具有较强的耐酸、耐胆盐能力,表面黏附蛋白能够黏附在Caco-2单层细胞的表面并形成占位,从而阻碍大肠杆菌、金黄色葡萄球菌、鼠伤寒沙门氏菌和福氏志贺氏菌对Caco-2细胞的黏附[24]。植物乳杆菌C88可在小鼠盲肠、结肠、回肠中定植,在小肠黏膜表面呈弥散状分布,形成生物性占位。摄入植物乳杆菌C88可有效修复2型糖尿病大鼠失调的肠道菌群,1.0×109CFU/mL可促进双歧杆菌和乳杆菌数量增加,降低肠杆菌数量,调节产气荚膜梭菌和肠球菌数量恢复至正常水平。2型糖尿病大鼠连续灌服植物乳杆菌C88 4 周后,血清中脂多糖、DAO、ZON水平有不同程度的降低,回肠中肠黏膜细胞间黏附的紧密连接蛋白ZO-1、occludin、claudin-1的表达增加。有研究证明益生菌VSL#3通过激活p38和ERK信号转导通路,提高紧密连接蛋白表达水平,改善肠黏膜屏障功能[25],大肠杆菌Nissle 1917促进小鼠回肠组织ZO-1的mRNA和蛋白的表达,提高肠上皮屏障的保护功能[26],鼠李糖乳杆菌通过调节NF-κB通路相关蛋白的表达,减轻促炎细胞因子对肠黏膜屏障的损伤[27]。植物乳杆菌C88可能通过定植在肠道内,提供防御病原菌的天然屏障,修复或提高肠黏膜防御功能,促进2型糖尿病大鼠肠黏膜屏障的完整性,改善肠道通透性。
综上所述,植物乳杆菌C88通过调节脂类代谢,改善葡萄糖耐受,降低血清炎症因子水平,恢复胰岛素敏感性,平衡肠道微生态和修复肠道屏障功能等降低2型糖尿病模型大鼠的血糖水平。本研究结果为植物乳杆菌C88开发辅助降血糖功能性食品提供了理论依据。
参考文献:
[1] KASSAYOVÁ M, BOBROV N, STROJNÝ L, et al. Preventive effects of probiotic bacteria Lactobacillus plantarum and dietary fiber in chemically-induced mammary carcinogenesis[J]. Anticancer Research,2014, 34(9): 4969-4975. DOI:10.1245/s10434-014-3557-1.
[2] HON Y F, KIM H, KIM H R, et al. Different immune regulatory potential of Lactobacillus plantarum and Lactobacillus sakei isolated from kimchi[J]. Journal of Microbiology & Biotechnology, 2014,24(12): 1629-1635. DOI:10.4014/jmb.1406.06062.
[3] KONIECZNA P, SCHIAVI E, ZIEGLER M, et al. Human dendritic cell DC-SIGN and TLR-2 mediate complementary immune regulatory activities in response to Lactobacillus rhamnosus JB-1[J]. PLoS ONE,2014, 10(3): e0120261. DOI:10.1371/journal.pone.0120261.
[4] MATSUZAKI T, NAGATA Y, KADO S, et al. Effect of oral administration of Lactobacillus casei on alloxan-induced diabetes in mice[J]. Acta Pathologica, Microbiologica, et Immunologica Scandinavica, 1997, 105: 637-642.
[5] AMAR J, CHABO C, WAGET A, et al. Intestinal mucosal adherence and translocation of commensal bacteria at the early onset of type 2 diabetes: molecular mechanisms and probiotic treatment[J].EMBO Molecular Medicine, 2011, 3(9): 559-572. DOI:10.1002/emmm.201100159.
[6] VALLADARES R, SANKAR D, LI N, et al. Lactobacillus johnsonii N6. 2 mitigates the development of type 1 diabetes in BB-DP rats[J].PLoS ONE, 2010, 5(5): e10507. DOI:10.1371/journal.pone.0010507.
[7] LAU K, BENITEZ P, ARDISSONE A, et al. Inhibition of type 1 diabetes correlated to a Lactobacillus johnsonii N6.2-mediated Th17 bias[J]. Journal of Immunology, 2011, 186(6): 3538-3546.DOI:10.4049/jimmunol.1001864.
[8] EJTAHED H S, MOHTADI-NIA J, HOMAYOUNI-RAD A, et al.Probiotic yogurt improves antioxidant status in type 2 diabetic patients[J]. Nutrition, 2012, 28(5): 539-543. DOI:10.1016/j.nut.2011.08.013.
[9] HE Z M, WANG X H, LI G F, et al. Antioxidant activity of prebiotic ginseng polysaccharides combined with potential probiotic Lactobacillus plantarum C88[J]. International Journal of Food Science and Technology, 2015, 50(7): 1673-1682. DOI:10.1111/ijfs.12824.
[10] ZHANG L, LIU C H, LI D, et al. Antioxidant activity of an exopolysaccharide isolated from Lactobacillus plantarum C88[J].International Journal of Biological Macromolecules, 2012, 54(1):270-275. DOI:10.1016/j.ijbiomac.2012.12.037.
[11] RICCI G, FORTINA M G. Characterization of Lactobacillus helveticus strains isolated from cheeses by distribution studies of insertion sequences[J]. International Journal of Food Microbiology,2006, 112(2): 112-119. DOI:10.1016/j.ijfoodmicro.2006.05.018.
[12] JIANG S, DU P G, AN L P, et al. Anti-diabetic effect of Coptis Chinensis polysaccharide in high-fat diet with STZ-induced diabetic mice[J]. International Journal of Biological Macromolecules, 2013,55(3): 118-122. DOI:10.1016/j.ijbiomac.
[13] CHEN X H, BAI X, LIU Y H, et al. Anti-diabetic effects of water extract and crude polysaccharides from tuberous root of Liriope spicata var. prolifera in mice[J]. Journal of Ethnopharmacology, 2009,122(2): 205-209. DOI:10.1016/j.jep.2009.01.016.
[14] XU J, WANG Y, XU D S, et al. Hypoglycemic effects of MDG-1,a polysaccharide derived from Ophiopogon japonicas, in the ob/ob mouse model of type 2 diabetes mellitus[J]. International Journal of Biological Macromolecules, 2011, 49(4): 657-662. DOI:10.1016/j.ijbiomac.2011.06.026.
[15] 马治宇, 赵献军, 张晓庆, 等. 乳酸菌及其培养液对肉鸡盲肠菌群的影响[J]. 西北农业学报, 2008, 17(3): 33-36. DOI:10.3969/j.issn.1004-1389.
[16] CHEN P, ZHANG Q X, DANG H, et al. Oral administration of Lactobacillus rhamnosus CCFM0528 improves glucose tolerance and cytokine secretion in high-fat-fed, streptozotocin-induced type 2 diabetic mice[J]. Journal of Functional Foods, 2014, 10(9): 318-326.DOI:10.1016/j.jff.2014.06.014.
[17] HUANG Huiyu, KORIVI M, TSAI C H, et al. Supplementation of Lactobacillus plantarum K68 and fruit-vegetable ferment along with high fat-fructose diet attenuates metabolic syndrome in rats with insulin resistance[J]. Evidence-Based Complementary and Alternative Medicine, 2013, 2013: 943020. DOI:10.1155/2013/943020.
[18] EJTAHED H S, MOHTADI-NIA J, HOMAYOUNI-RAD A, et al.Probiotic yogurt improves antioxidant status in type 2 diabetic patients[J]. Nutrition, 2012, 28(5): 539-543.
[19] YADAV H, JAIN S, SINHA P R. Antidiabetic effect of probiotic dahi containing Lactobacillus acidophilus and Lactobacillus casei in high fructose fedrats[J]. Nutrition, 2007, 23(1): 62-68. DOI:10.1016/j.nut.2011.08.013.
[20] GREGOR M F, HOTAMISLIGIL G S. Inflammatory mechanisms in obesity[J]. Annual Review of Immunology, 2011, 29: 415-425.DOI:10.1146/annurev-immunol-031210-101322.
[21] LU Y C, YEY W C, OHASHI P S. LPS/TLR4 signal transduction pathway[J]. Cytokine, 2008, 42(2): 145-151. DOI:10.1016/j.cyto.2008.01.006.
[22] CANI P D, DELELZENNE N M. The role of the gut microbiota in energy metabolism and metabolic disease[J].Current Pharmaceutical Design, 2009, 15(13): 1546-1558.DOI:10.2174/138161209788168164.
[23] HSIEH F C, LEE C L, CHAI C Y, et al. Oral administration of Lactobacillus reuteri GMNL-263 improves insulin resistance and ameliorates hepatic steatosis in high fructose-fed rats[J]. Nutrition and Metabolism, 2013, 10(1): 35-42. DOI:10.1186/1743-7075-10-35.
[24] 张莉. 植物乳杆菌的黏附特性研究及其在益生菌干酪中的应用[D].长春: 吉林大学, 2013: 31-33.
[25] DAI C, ZHAO D, JIANG M. VSL#3 probiotics regulate the intestinal epithelial barrier in vivo and in vitro via the p38 and ERK signaling pathways[J]. International Journal of Molecular Medicine, 2012, 29(2):202-208. DOI:10.3892/ijmm.2011.839.
[26] UKENA S N, SINGH A, DRINGENBERG U, et al. Probiotic Escherichia coli Nissle 1917 inhibits leaky gut by enhancing mucosal integrity[J]. PLoS ONE, 2007, 2(12): e1308. DOI:10.1371/journal.pone.0001308.
[27] DONATO K A, GAREAU M G, WANG Y J, et al. Lactobacillus rhamnosus GG attenuates interferon-γ and tumour necrosis factor-α induced barrier dysfunction and pro-inflammatory signalling[J].Microbiology, 2010, 156: 3288-3297. DOI:10.1099/mic.o.040139-0.
Antidiabetic Effect of Lactobacillus plantarum C88 in a Rat Model of High-Fat Diet and Streptozotocin-Induced Type 2 Diabetes
LUO Hong1, DUAN Cuicui2, LUAN Chang2, GAO Lei2, ZHAO Yujuan2, NIU Chunhua2, LI Shengyu2,*
(1. Special Education College, Changchun University, Changchun 130022, China;2. Institute of Agro-Food Technology, Jilin Academy of Agricultural Sciences, Changchun 130033, China)
Abstract:Objective: To investigate the antidiabetic effect of Lactobacillus plantarum C88 in a type 2 diabetic rat model.Methods: Type 2 diabetes was induced in rats by feeding high-fat diet followed by single intraperitoneal injection of streptozotocin. The diabetic rats were intragastrically administrated with L. plantarum C88 for 28 consecutive days, and then the fasting blood-glucose, glucose tolerance, blood lipids, insulin, inflammatory factors, intestinal barrier function and intestinal flora were measured. Western blot was used to analyze the expression of nuclear factor-κB (NF-κB), tumor necrosis factor-α (TNF-α), zonula occludens-1 (ZO-1), occludin and claudin-1. Results: L. plantarum C88 could effectively improve hyperglycemia and lipid metabolism disorder in type 2 diabetic rats and significantly decrease the levels of TNF-α, interleukine-6, C-reactive protein, lipopolysaccharide, D-lactic acid and other inflammatory factors in the serum.L. plantarum C88 could promote the secretion of insulin, increase glucagon-like peptide-2 level and decrease diamine oxidase and zonulin. In addition, this strain significantly down-regulated the expression of inflammation-associated protein(NF-κB and TNF-α) in the liver and up-regulated the expression of ZO-1, occludin and claudin-1, associated with intestinal permeability in the ileum. Conclusion: L. plantarum C88 is a probiotic with hypoglycemic activity.
Keywords:Lactobacillus plantarum; diabetes; hypoglycemic; intestinal flora; inflammation
DOI:10.7506/spkx1002-6630-201813028
收稿日期:2017-01-10
基金项目:现代农业产业技术体系建设专项(CARS-36);长春市产学研协同创新示范点建设专项(16CX20);吉林省农业科技创新工程重大攻关项目(CXGC2017ZD011)
第一作者简介:罗宏(1962—),女,副教授,学士,研究方向为中医临床。E-mail:376885230@qq.com
*通信作者简介:李盛钰(1977—),男,副研究员,博士,研究方向为发酵食品及乳品加工。E-mail:lisy720@126.com
中图分类号:R587.1;Q939.117
文献标志码:A
文章编号:1002-6630(2018)13-0190-08
引文格式:罗宏, 段翠翠, 栾畅, 等. 植物乳杆菌C88对高脂饲料和链脲佐菌素诱导2型糖尿病模型大鼠的降血糖作用[J]. 食品科学,2018, 39(13): 190-197.
DOI:10.7506/spkx1002-6630-201813028. http://www.spkx.net.cn
LUO Hong, DUAN Cuicui, LUAN Chang, et al. Antidiabetic effect of Lactobacillus plantarum C88 in a rat model of high-fat diet and streptozotocin-induced type 2 diabetes[J]. Food Science, 2018, 39(13): 190-197. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201813028. http://www.spkx.net.cn