羊肚菌菌丝体锌多糖的体内、体外抗氧化作用
冮 洁,王 艳,李佳桐,范丽娟,曹 蕾,庞士磊,刘文玲,陈涛涛
(大连民族大学 生物技术与资源利用教育部重点实验室,辽宁 大连 116600)
摘 要:对羊肚菌菌丝体通过液体富锌培养获得锌多糖,对其体内、体外抗氧化作用进行了研究。采用Fenton法、邻苯三酚自氧化法和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)还原法对羊肚菌菌丝体锌多糖的体外抗氧化性进行了研究。通过腹腔注射D-半乳糖(100 mg/(kg•d))诱导致衰老小鼠为对照组,羊肚菌菌丝体多糖和羊肚菌菌丝体锌多糖(320 mg/(kg•d))为治疗组。30 d后检测小鼠肝脏、肾脏和血清中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活力和丙二醛(malondialdehyde,MDA)含量,研究羊肚菌菌丝体多糖体内抗氧化作用。羊肚菌菌丝体多糖和羊肚菌菌丝体锌多糖清除羟自由基半数抑制浓度(half maximal inhibitory concentration,IC50)分别为0.56 mg/mL和0.36 mg/mL;清除超氧阴离子自由基IC50分别为0.62 mg/mL和0.46 mg/mL;清除DPPH自由基IC50分别为0.68 mg/mL和0.58 mg/mL。羊肚菌菌丝体锌多糖能够提高衰老小鼠肝脏中SOD和CAT活力,显著降低MDA含量(P<0.05),与羊肚菌菌丝体多糖组相比使SOD活力提高了9.32%,CAT活力提高了36.73%,MDA含量降低了90.71%。羊肚菌菌丝体锌多糖具有更强的抗氧化活性,并在设定的质量浓度范围呈剂量效应关系。
关键词:羊肚菌;多糖;富锌培养;抗氧化作用
锌是人体必需的微量元素,能促进人体生长发育和增强人体免疫机能[1]。全球近1/3的人口面临着缺锌引起的健康问题,缺锌已成为影响人类健康的主要因素之一[2]。在我国,约50%的儿童表现出轻微的缺锌症状,而在以谷类作物为主食的北方尤其是偏远地区,这种情况更为严重。锌有“儿童生长素”之称,缺锌可致免疫力低下、佝偻病、贫血、营养不良及反复呼吸道感染,不同程度影响儿童生长发育[3-4],甚至导致出现异食癖[5]。食用菌具有较强的富锌能力,通过将锌摄入食用菌菌丝细胞内进行物质代谢转化,将无机锌结合到大分子活性物质(如多糖和蛋白质)上,形成有机锌多糖和锌蛋白,可以避免无机锌的缺点,并更有利于有机锌的免疫功能和食药用菌的抗病功能的发挥[6]。锌多糖作为第三代的补锌产品,能被人体更高效、更安全地吸收利用。锌多糖具有抗氧化的功效,陈宏伟等[7]研究蛹虫草胞外锌多糖的抗氧化能力时发现锌多糖对超氧阴离子自由基( )、羟自由基(•OH)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力与空白对照组相比分别提高了7.05%、23.50%和17.49%,胞外锌多糖对自由基的清除能力与多糖质量浓度呈正向关系,实验证明锌多糖具有明显的抗氧化功效。李正鹏等[8]研究发现,树舌胞外锌多糖质量浓度达到2.5 g/L时,对油脂过氧化物的抑制、•OH的清除、DPPH自由基和
)、羟自由基(•OH)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力与空白对照组相比分别提高了7.05%、23.50%和17.49%,胞外锌多糖对自由基的清除能力与多糖质量浓度呈正向关系,实验证明锌多糖具有明显的抗氧化功效。李正鹏等[8]研究发现,树舌胞外锌多糖质量浓度达到2.5 g/L时,对油脂过氧化物的抑制、•OH的清除、DPPH自由基和 •的清除能力比对照组分别提高了12.50%、26.83%、30.00%、20.00%,胞外锌多糖抗氧化活性与多糖质量浓度呈显著的量效关系。刘芳[9]在研究金针菇中的锌多糖抗氧化活性时发现,多糖质量浓度相同的条件下,锌含量与抗氧化活性有一定的正相关性。目前,研究较多是锌多糖体外抗氧化活性,对体内抗氧化活性研究的较少。羊肚菌(Morchella esculenta),是一种名贵的大型食药兼用真菌,羊肚菌多糖是其主要的活性成分之一,能够保护肝脏损伤[10]、延缓细胞衰老[11]、减少脂褐质的沉积[12],对胃溃疡[13]和胃黏膜有保护作用[14],对辐射危害有辅助保护功能[15],具有抗氧化、抗炎症和抗肿瘤的作用[16-18]。目前,羊肚菌没有实现大规模人工栽培[19],主要采用菌丝体的液体发酵培养方法[20],适合生产的工业化,且深层液体发酵培养的食用菌菌丝体与其子实体在化学组成、生理功能上都很相似[21]。液态培养提取出的羊肚菌胞外多糖有较明显的抑制肿瘤、促进细胞凋亡的作用[22-23]。本课题组在已经研究了羊肚菌菌丝体液体富锌条件[24]和羊肚菌菌丝体硒多糖抗氧化活性的基础上[25],对羊肚菌菌丝体锌多糖体内、外抗氧化性进行了研究,以期阐明羊肚菌菌丝体锌多糖抗氧化、抗衰老的功效,为食用菌锌多糖的开发应用提供参考。
•的清除能力比对照组分别提高了12.50%、26.83%、30.00%、20.00%,胞外锌多糖抗氧化活性与多糖质量浓度呈显著的量效关系。刘芳[9]在研究金针菇中的锌多糖抗氧化活性时发现,多糖质量浓度相同的条件下,锌含量与抗氧化活性有一定的正相关性。目前,研究较多是锌多糖体外抗氧化活性,对体内抗氧化活性研究的较少。羊肚菌(Morchella esculenta),是一种名贵的大型食药兼用真菌,羊肚菌多糖是其主要的活性成分之一,能够保护肝脏损伤[10]、延缓细胞衰老[11]、减少脂褐质的沉积[12],对胃溃疡[13]和胃黏膜有保护作用[14],对辐射危害有辅助保护功能[15],具有抗氧化、抗炎症和抗肿瘤的作用[16-18]。目前,羊肚菌没有实现大规模人工栽培[19],主要采用菌丝体的液体发酵培养方法[20],适合生产的工业化,且深层液体发酵培养的食用菌菌丝体与其子实体在化学组成、生理功能上都很相似[21]。液态培养提取出的羊肚菌胞外多糖有较明显的抑制肿瘤、促进细胞凋亡的作用[22-23]。本课题组在已经研究了羊肚菌菌丝体液体富锌条件[24]和羊肚菌菌丝体硒多糖抗氧化活性的基础上[25],对羊肚菌菌丝体锌多糖体内、外抗氧化性进行了研究,以期阐明羊肚菌菌丝体锌多糖抗氧化、抗衰老的功效,为食用菌锌多糖的开发应用提供参考。
1 材料与方法
1.1 动物、材料与试剂
昆明种小鼠,雄性,(15±2)g,5~6 周龄,由大连医科大学实验动物中心提供。羊肚菌(M. esculenta)菌种由辽宁朝阳食用菌研究所提供。
DPPH、氮蓝四唑、二硫苏糖醇 美国Sigma-Aldirch公司;乙二胺四乙酸、Tris-HCl、硫酸亚铁铵、邻二氮菲、VC、邻苯三酚、D-半乳糖、乙醇、HNO3、苯酚、硫酸、核黄素、聚乙烯吡咯烷酮、H2O2、硫代巴比妥酸等均为国产分析纯。
1.2 仪器与设备
Z-2000火焰原子吸收光谱仪 日本日立公司;BS223S精密电子天平 赛多利斯科学仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;ZHJH-C2112B超净工作台 上海智城分析仪器制造有限公司;UV-2000紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;HYG-3多功能摇床 金坛市杰瑞尔电器有限公司;GRP-9080隔水式恒温培养箱 上海森信实验仪器有限公司;MLS-3750高压灭菌锅 日本三洋公司;TDZ5-WS离心机 长沙湘仪离心机仪器有限公司。
1.3 方法
1.3.1 羊肚菌菌丝体液体培养
斜面培养基(综合PDA培养基):马铃薯200 g、葡萄糖20 g、KH2PO41.5 g、MgSO41.0 g、琼脂粉20 g、水1 000 mL,pH值自然。菌种液体发酵采用不加琼脂的综合PDA培养基。
菌种活化:将保存菌种用接种针接入斜面培养基中,25 ℃恒温培养7 d。
菌种液体培养:将活化的斜面菌种4 块(黄豆粒大小)接种到装有100 mL液体PDA综合培养基的250 mL三角瓶中,25 ℃、150 r/min恒温振荡培养5 d。
菌丝体液体培养:将PDA液体培养基中的菌液按体积分数10%接种量接入液体发酵培养基中,25 ℃、150 r/min摇床培养5~7 d。发酵培养液5 000 r/min离心20 min,菌丝沉淀用蒸馏水洗涤3 次,菌丝体60 ℃干燥,测定其菌丝体多糖含量和锌含量。富锌组在培养基中加入600 mg/L硫酸锌。不加锌的为空白组。
1.3.2 多糖的提取及测定
采用热水浸提法提取菌丝体多糖,料液比为1∶10(m/V),80 ℃水浴3 h,水浴浸提后过滤,滤液浓缩,加入无水乙醇溶液使乙醇体积分数达到80%,静置于4 ℃冰箱内醇沉12 h。取出后5 000 r/min离心15 min,沉淀用体积分数75%乙醇溶液重复洗涤3 次,然后60 ℃干燥。
多糖含量的测定:采用苯酚-硫酸比色法[26]。菌丝体锌含量的测定:采用微波消解-火焰原子吸收光谱法测定,富锌率根据式(1)计算[24]。
式中:w为富锌菌丝体锌含量/(μg/g);w0为空白菌丝体锌含量/(μg/g);ρ为培养基内富锌菌丝体质量浓度/(μg/100 mL);ρ0为培养基内锌质量浓度/(μg/100 mL)。
1.3.3 体外抗氧化性实验
分别测定羊肚菌菌丝体多糖和羊肚菌菌丝体锌多糖的•OH、 和DPPH自由清除率[25],以VC作对照。
和DPPH自由清除率[25],以VC作对照。
1.3.4 体内抗氧化实验
小鼠10 只为一组,正常饲养的为空白组;用每天腹腔注射D-半乳糖(100 mg/(kg•d))诱导致衰老小鼠作对照组;将羊肚菌菌丝体多糖溶于小鼠饮用水中,以每只小鼠饮用量为320 mg/(kg•d)进行喂养,喂养羊肚菌菌丝体多糖组小鼠为实验多糖组,喂养羊肚菌菌丝体锌多糖组小鼠为实验富锌组。小鼠喂养条件:自然昼夜,节律光照,温度(18±5)℃,相对湿度40%~60%。自然采食,连续喂养30 d后,空腹12 h期间只供给饮水,之后摘除眼球取血,4 ℃、3 000 r/min离心10 min取血清,-20 ℃保存待用。脱臼处死,取肝和肾,用生理盐水清洗,匀浆,4 ℃、3 000 r/min离心10 min,取上清液,-20 ℃保存待用。
1.3.5 抗氧化酶活力和MDA含量的测定
超氧化物歧化酶(superoxide dismutase,SOD)活力采用氮蓝四唑光化还原法测定[27];过氧化氢酶(catalase,CAT)活力测定采用紫外分光光度法[28];丙二醛(malondialdehyde,MDA)含量的测定采用硫代巴比妥酸比色法[29]。
1.3.6 小鼠脏器系数
脏器系数根据式(2)计算。
1.4 数据统计分析
所有实验数据采用SPSS 13.0软件进行统计学分析,数据以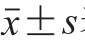 表示,组间比较采用单因素方差分析,P<0.05具有统计学意义。
表示,组间比较采用单因素方差分析,P<0.05具有统计学意义。
2 结果与分析
2.1 羊肚菌菌丝体多糖提取及富锌率
采用液体深层发酵技术进行羊肚菌菌丝体富锌培养,其菌丝体多糖提取和富锌率计算结果如表1所示。
表1 羊肚菌菌丝体多糖提取结果和富锌率
Table1 Extraction yield and zinc enrichment percentage of polysaccharides from Morchella esculenta mycelium

?
由表1可知,羊肚菌菌丝体不加锌培养,菌丝体中多糖含量为641.10 mg/g;而添加了锌源培养的菌丝体中多糖含量为695.40 mg/g。说明添加锌能促进羊肚菌菌丝体多糖的合成。羊肚菌菌丝体具有较强的富锌能力,富锌率可达18.20%,提取的粗多糖中锌含量可达0.860 mg/g。
2.2 羊肚菌菌丝体多糖体外抗氧化作用
2.2.1 羊肚菌菌丝体多糖•OH清除率

图1 羊肚菌菌丝体多糖对•OH清除率
Fig. 1 Scavenging effect of mycelial polysaccharides from Morchella esculenta mycelium on hydroxyl free radicals
通过 体系测定羊肚菌菌丝体锌多糖和没富锌的菌丝体多糖清除•OH活性,结果如图1所示。羊肚菌菌丝体锌多糖清除•OH活性的回归方程为y=34.55x+36.085(R2=0.968 6),经上述方程计算,•OH半数抑制浓度(half maximal inhibitory concentration,IC50)为0.41 mg/mL;未富锌的羊肚菌菌丝体多糖的回归方程为y=47.75x+24.225(R2=0.983 5),IC50为0.54 mg/mL;VC的回归方程为y=61.97x+25.002(R2=0.997 5),IC50为0.40 mg/mL。对•OH的清除活性大小为:VC>羊肚菌菌丝体锌多糖>羊肚菌菌丝体多糖。羊肚菌菌丝体锌多糖清除•OH的活性比羊肚菌菌丝体多糖提高31.71%。
体系测定羊肚菌菌丝体锌多糖和没富锌的菌丝体多糖清除•OH活性,结果如图1所示。羊肚菌菌丝体锌多糖清除•OH活性的回归方程为y=34.55x+36.085(R2=0.968 6),经上述方程计算,•OH半数抑制浓度(half maximal inhibitory concentration,IC50)为0.41 mg/mL;未富锌的羊肚菌菌丝体多糖的回归方程为y=47.75x+24.225(R2=0.983 5),IC50为0.54 mg/mL;VC的回归方程为y=61.97x+25.002(R2=0.997 5),IC50为0.40 mg/mL。对•OH的清除活性大小为:VC>羊肚菌菌丝体锌多糖>羊肚菌菌丝体多糖。羊肚菌菌丝体锌多糖清除•OH的活性比羊肚菌菌丝体多糖提高31.71%。
2.2.2 羊肚菌菌丝体多糖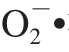 •清除率
•清除率
通过测定VC、羊肚菌菌丝体锌多糖和没添加锌源的菌丝体多糖对邻苯三酚的自氧化抑制作用来表明它们清除 活性,结果如图2所示。
活性,结果如图2所示。

图2 羊肚菌菌丝体多糖对 •的清除率
•的清除率
Fig. 2 Scavenging effect of mycelial polysaccharides from Morchella esculenta mycelium on superoxide anion free radicals
由图2可见,羊肚菌菌丝体锌多糖清除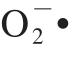 •活性的回归方程为y=63.915x+19.487(R2=0.985 3),IC50为
•活性的回归方程为y=63.915x+19.487(R2=0.985 3),IC50为
0.48 mg/mL;未加锌的羊肚菌菌丝体多糖的回归方程为y=70.5x+6.77(R2=0.991),IC50为0.61 mg/mL;VC的回归方程为y=79.835x+19.544(R2=0.986 1),IC50为0.38 mg/mL。对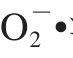 •清除作用大小为:VC>羊肚菌菌丝体锌多糖>羊肚菌菌丝体多糖。羊肚菌菌丝体锌多糖清除
•清除作用大小为:VC>羊肚菌菌丝体锌多糖>羊肚菌菌丝体多糖。羊肚菌菌丝体锌多糖清除 活性比羊肚菌菌丝体多糖提高27.08%。
活性比羊肚菌菌丝体多糖提高27.08%。
2.2.3 羊肚菌菌丝体多糖DPPH自由基清除率

图3 羊肚菌菌丝体多糖对DPPH自由基的清除率
Fig. 3 Scavenging effect of mycelial polysaccharides from Morchella esculenta mycelium on DPPH free radicals
由图3可得,羊肚菌菌丝体锌多糖清除DPPH自由基的回归方程为y=36.47x+28.317(R2=0.988 1),IC50为0.59 mg/mL;未加锌的羊肚菌菌丝体多糖的回归方程为y=49.415x+16.792(R2=0.993),IC50为0.67 mg/mL;VC的回归方程为y=67.51x+34.876(R2=0.970 1),IC50为0.22 mg/mL。对DPPH自由基清除作用大小为:VC>羊肚菌菌丝体锌多糖>羊肚菌菌丝体多糖。羊肚菌菌丝体锌多糖清除DPPH自由基活性比羊肚菌菌丝体多糖提高13.56%。
2.3 羊肚菌菌丝体多糖体内抗氧化作用
2.3.1 羊肚菌菌丝体多糖对小鼠脏器系数的影响
表2 羊肚菌菌丝体多糖对小鼠脏器系数的影响
Table2 Effect of mycelial polysaccharides from Morchella esculenta mycelium on visceral organ indices in mice

注:与对照组相比,*.差异显著(P<0.05);**.差异极显著(P<0.01)。下同。
?
对照组小鼠脏器系数变小,说明小鼠脏器发生萎缩或其他退行性改变,即小鼠衰老模型建模成功。羊肚菌菌丝体多糖组和羊肚菌菌丝体锌多糖组小鼠脏器系数均大于对照组,说明羊肚菌菌丝体多糖和羊肚菌菌丝体锌多糖对衰老小鼠脏器萎缩均有抑制作用,羊肚菌菌丝体锌多糖的抑制作用更强。
2.3.2 羊肚菌菌丝体多糖对小鼠体内SOD活力的影响
由表3可见,羊肚菌菌丝体多糖组、羊肚菌菌丝体锌多糖组和对照组小鼠SOD活力具有显著性差异(P<0.05),其中以肝脏最为显著。与对照组相比,羊肚菌菌丝体锌多糖使肝脏中SOD活力提高51.52%、血清SOD活力提高16.65%、肾脏SOD活力提高6.43%;未富锌的羊肚菌菌丝体多糖使肝脏中SOD活力提高38.60%、血清SOD活力提高12.09%、肾脏SOD活力提高4.08%。羊肚菌多糖组小鼠体内的SOD活力明显高于对照组,羊肚菌多糖可明显提高SOD活力,从而达到抗氧化作用。而羊肚菌锌多糖组小鼠体内的SOD活力与羊肚菌菌丝体多糖组小鼠体内的SOD活力具有显著性差异,说明羊肚菌锌多糖抗衰老效果更佳。
表3 羊肚菌菌丝体多糖对小鼠体内SOD活力的影响
Table3 Effect of mycelial polysaccharides from Morchella esculenta mycelium on SOD activity in mice U/mg

注:锌多糖组与多糖组相比,#.差异显著(P<0.05);##.差异极显著(P<0.01)。下同。
?
2.3.3 羊肚菌菌丝体多糖对小鼠体内CAT活力的影响
表4 羊肚菌菌丝体多糖对小鼠体内CAT活力的影响
Table4 Effect of mycelial polysaccharides from Morchella esculenta mycelium on catalase activity in mice

?
表4结果表明,小鼠肝脏中,羊肚菌菌丝体多糖组和对照组无明显差异,但羊肚菌菌丝体锌多糖组与对照组相比具有显著性差异(P<0.05)。羊肚菌菌丝体锌多糖使肝脏中CAT活力提高81.08%,肾脏CAT活力提高75.56%;未富锌的羊肚菌菌丝体多糖使肝脏中CAT活力提高32.43%,肾脏CAT活力提高42.22%。羊肚菌菌丝体多糖可明显提高小鼠体内CAT活力,而羊肚菌菌丝体锌多糖组小鼠体内的CAT活力明显高于羊肚菌多糖组,说明羊肚菌菌丝体锌多糖抗衰老效果更佳。多糖通过提高机体内SOD、CAT、谷胱甘肽过氧化物酶等的活力,间接清除自由基[25]。
2.3.4 羊肚菌菌丝体多糖对小鼠体内MDA含量的影响
表5结果表明,羊肚菌菌丝体多糖组、羊肚菌菌丝体锌多糖组和对照组小鼠MDA具有显著性差异(P<0.05),其中以肝脏最为显著。羊肚菌菌丝体锌多糖使肝脏中MDA含量下降58.50%,血清MDA含量下降44.57%,肾脏MDA含量下降76.69%;未富锌的羊肚菌菌丝体多糖使肝脏中MDA含量下降20.86%,血清MDA含量下降29.03%,肾脏MDA含量下降46.63%。羊肚菌菌丝体多糖组小鼠体内的MDA含量明显低于对照组,说明羊肚菌多糖可明显减少小鼠体内MDA含量,从而达到抗氧化作用。而羊肚菌锌多糖组小鼠体内的MDA含量与羊肚菌菌丝体多糖组也有显著性差异,说明羊肚菌菌丝体锌多糖抗衰老效果更佳。
表5 羊肚菌菌丝体多糖对小鼠体内MDA含量的影响
Table5 Effect of mycelial polysaccharides from Morchella esculenta mycelium on MDA content in mice nmol/mg

?
3 结 论
羊肚菌菌丝体具有较强的富锌能力,通过液体深层培养其菌丝体富锌率可达18.20%,提取的粗多糖中锌含量可达0.86 mg/g。清除•OH、 和DPPH自由基的实验结果证明了羊肚菌菌丝体多糖具有较强的体外抗氧化性,而通过富锌培养获得的羊肚菌菌丝体锌多糖比羊肚菌菌丝体多糖具有更强的体外抗氧化活性。羊肚菌菌丝体多糖和羊肚菌富锌菌丝体多糖能够显著提高D-半乳糖致衰老小鼠肝脏、肾脏和血清中的SOD和CAT活力,降低MDA含量(P<0.05)。并且,羊肚菌菌丝体锌多糖比羊肚菌菌丝体多糖具有更强的抗衰老作用。
和DPPH自由基的实验结果证明了羊肚菌菌丝体多糖具有较强的体外抗氧化性,而通过富锌培养获得的羊肚菌菌丝体锌多糖比羊肚菌菌丝体多糖具有更强的体外抗氧化活性。羊肚菌菌丝体多糖和羊肚菌富锌菌丝体多糖能够显著提高D-半乳糖致衰老小鼠肝脏、肾脏和血清中的SOD和CAT活力,降低MDA含量(P<0.05)。并且,羊肚菌菌丝体锌多糖比羊肚菌菌丝体多糖具有更强的抗衰老作用。
参考文献:
[1] 贾乐, 于克学, 姚良同, 等. 富锌冬虫夏草菌丝体有机化程度及氨基酸含量分析[J]. 食品与发酵工业, 2004, 30(11): 95-98. DOI:10.3321/j.issn:0253-990X.2004.11.022.
[2] SCHERZ H, KIRCHHOFF E. Trace elements in foods: zinc contents of raw foods: a comparison of data originating from different geographical regions of the world[J]. Journal of Food Composition and Analysis, 2006, 19(5): 420-433. DOI:10.1016/j.jfca.2005.10.004.
[3] 胡爱华, 徐惠民, 胡国华, 等. 厌食症患儿外周血食欲调节因子水平变化与小儿厌食颗粒干预的影响[J]. 中国中药杂志, 2014, 39(23):4685-4688. DOI:10.4268/cjcmm20142339.
[4] 苏婵, 邵莉, 胡国华. 儿宝颗粒联合锌硒宝治疗小儿厌食症临床疗效观察[J]. 中国中西医结合消化杂志, 2016, 24(8): 639-641.DOI:10.3969/j.issn.1671-038X.2016.08.20.
[5] 王亚萍, 李江全. 小儿厌食症的中西药发病机制研究进展[J].浙江中西医结合杂志, 2013, 23(4): 335-337. DOI:10.3969/j.issn.1005-4561.2013.04.049.
[6] 刘坤, 沈卫, 章克昌. 姬松茸深层发酵富集锌的研究[J]. 食品与发酵工业, 2005, 31(4): 84-86. DOI:10.3321/j.issn:0253-990X.2005.04.022.
[7] 陈宏伟, 陈安徽, 邵颖, 等. 蛹虫草胞外锌多糖抗氧化能力的研究[J].食品与发酵工业, 2009, 35(6): 54-58. DOI:10.13995/j.cnki.11-1802/ts.2009.06.041.
[8] 李正鹏, 吴萍, 孙玉军, 等. 树舌胞外富锌多糖体外抗氧化活性研究[J]. 热带作物学报, 2012, 33(5): 890-893. DOI:10.3969/j.issn.1000-2561.2012.05.021.
[9] 刘芳. 金针菇(Flammulina velutipes)中锌的形态分析及锌多糖的结构和抗氧化活性研究[D]. 南京: 南京农业大学, 2014: 66.
[10] 孙玉军, 陈彦, 周正义, 等. 羊肚菌胞内多糖对小鼠急性肝损伤的影响[J]. 中国食用菌, 2008, 27(2): 41-42; 45. DOI:10.3969/j.issn.1003-8310.2008.02.015.
[11] 马利, 李霞, 张松. 尖顶羊肚菌胞外多糖提取物对皮肤成纤维细胞增殖和衰老的影响[J]. 菌物学报, 2014, 33(2): 385-393.DOI:10.13346/j.mycosystema.130281.
[12] HELENO S A, STOJKOVIC D, BARROS L, et al. A comparative study of chemical composition, antioxidant and antimicrobial properties of Morchella esculenta (L.) Pers. from Portugal and Serbia[J]. Food Research International, 2013, 51(1): 236-243.DOI:10.1016/j.foodres.2012.12.020.
[13] 高明燕, 郑林用, 余梦瑶, 等. 尖顶羊肚菌菌丝体水提液对实验型胃溃疡的作用[J]. 菌物学报, 2011, 30(2): 325-330. DOI:10.13346/j.mycosystema.2011.02.023.
[14] 魏巍, 余梦瑶, 许晓燕, 等. 不同羊肚菌菌株的遗传差异性与胃黏膜保护作用的比较研究[J]. 食品科学, 2014, 35(7): 160-163.DOI:10.7506/spkx1002-6630-201407032.
[15] NITHA B, DE S, ADHIKARI S K, et al. Evaluation of free radical scavenging activity of morel mushroom, Morchella esculenta mycelia: a potential source of therapeutically useful antioxidants[J].Pharmaceutical Biology, 2010, 48(4): 453-460. DOI:10.1016/j.foodres.2012.12.020.
[16] 李谣, 陈金龙, 王丽颖, 等. 羊肚菌多糖抑制人乳腺癌细胞MDAMB-231增殖和诱导细胞凋亡研究[J]. 食品科学, 2016, 37(21): 214-218. DOI:10.7506/spkx1002-6630-201621036.
[17] NITHA B, MEERA C K, JANARDHANAN K K. Anti-inflammatory and antitumor activities of cultured mycelium of morel mushroom Morchella esculenta[J]. Current Science, 2007, 92(2): 235-239.DOI:10.1126/science.1135926.
[18] FU L H, WANG Y P, WANG J J, et al. Evaluation of the antioxidant activity of extracellular polysaccharides from Morchella esculenta[J].Food and Function, 2013, 4(6): 871-879. DOI:10.1039/C3FO60033E.
[19] YANG H, YIN T, ZHANG S. Isolation, purification, and characterization of polysaccharides from wide Morchella esculenta (L.)Pers[J]. International Journal of Food Properties, 2015, 18(7): 1385-1390. DOI:10.1080/10942912.2014.915849.
[20] 康小虎, 蔡亚东, 孙宜法, 等. 甘南州尖顶羊肚菌菌丝体液体发酵培养研究[J]. 中国食用菌, 2012, 31(6): 40-43. DOI:10.13629/j.cnki.53-1054.2012.06.025.
[21] 杨建, 张光宇, 杜秀娟, 等. 羊肚菌液体发酵培养基成分及培养条件的优化[J]. 中国酿造, 2013, 32(10): 113-116. DOI:10.3969/j.issn.0254-5071.2013.10.027.
[22] 马利, 李霞, 张松. 尖顶羊肚菌胞外多糖提取物对皮肤成纤维细胞增殖和衰老的影响[J]. 菌物学报, 2014, 33(2): 385-393.DOI:10.13346/j.mycosystema.130281.
[23] HU M L, CHEN Y, WANG C, et al. Induction of apoptosis in HepG2 cells by polysaccharide MEP-II from the fermentation broth of Morchella esculenta[J]. Biotechnology Letters, 2013, 35(1): 1-10.DOI:10.1007/s10529-012-0917-4.
[24] 王艳, 冮洁, 沈冰, 等. 羊肚菌菌丝体富锌条件的优化[J]. 食品工业科技, 2013, 34(3): 281-283. DOI:10.13386/j.issn1002-0306.2013.03.017.
[25] 冮洁, 麦海美, 解彬, 等. 羊肚菌菌丝体富硒条件优化及其硒多糖抗氧化活性研究[J]. 食品与发酵工业, 2016, 42(9): 120-125.DOI:10.13995/j.cnki.11-1802/ts.201609021.
[26] 王文平, 郭祀远, 李琳, 等. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学, 2007, 28(4): 276-279. DOI:10.3321/j.issn:1002-6630.2007.04.065.
[27] 于孝保, 朱继宏, 付德峰, 等. 4 种蔬菜中SOD活性测定研究[J]. 现代农业科技, 2012(11): 82-88. DOI:10.3969/j.issn.1007-5739.2012.11.052.
[28] 杨兰芳, 庞静, 彭小兰, 等. 紫外分光光度法测定植物过氧化氢酶活性[J]. 现代农业科技, 2009(20): 364-366. DOI:10.3969/j.issn.1007-5739.2009.20.247.
[29] 方海田, 刘慧燕, 张光弟. 不同贮藏温度下辣椒中丙二醛含量的变化[J]. 农产品加工(创新版), 2010(5): 29-31; 35. DOI:10.3969/j.issn.1671-9646(C).2010.05.001.
[30] 田敏, 王荣荣, 冯翠萍, 等. 珊瑚状猴头菌多糖抗氧化作用研究[J]. 中国食品学报, 2015, 15(1): 25-33. DOI:10.16429/j.1009-7848.2015.01.005.
Antioxidant Activities in Vivo and in Vitro of Zinc-Containing Polysaccharides from Morchella esculenta Mycelium
GANG Jie, WANG Yan, LI Jiatong, FAN Lijuan, CAO Lei, PANG Shilei, LIU Wenling, CHEN Taotao
(Key Laboratory of Biotechnology and Bioresources Utilization, Ministry of Education,Dalian Minzu University, Dalian 116600, China)
Abstract:In this paper, the antioxidant activities in vitro of polysaccharides (MEMP) and zinc-containing polysaccharides(MEMZP) from Morchella esculenta mycelium cultured in liquid PDA medium with and without added zinc were studied using the Fenton method, the pyrogallol self-oxidation method and the 1,1-diphenyl-2-picrylhydrazyl (DPPH) scavenging method. Moreover, in order to evaluate the antioxidant activities in vivo, aging mice induced by intraperitoneal injection of D-galactose (100 mg/(kg·d)) served as control and aging mice treated with MEMP and MEMZP (320 mg/(kg·d)) as treatment groups. The activities of superoxide dismutase (SOD) and catalase (CAT) and malondialdehyde (MDA) content were measured in liver, kidney and serum after 30 consecutive days of administration. The half maximal inhibitory concentration(IC50) values of MEMP and MEMZP were 0.56 and 0.36 mg/mL for scavenging of hydroxyl radical, 0.62 and 0.46 mg/mL for scavenging of superoxide anion radical, and 0.68 and 0.58 mg/mL for scavenging of DPPH radical, respectively.MEMZP could improve SOD and CAT activities (by 9.32% and 36.73%) in the liver of aging mice, decrease significantly MDA content (by 90.71%) (P < 0.05) when compared with MEMP. The antioxidant activities of MEMZP were higher than those of MEMP in a dose-dependent manner in a certain dose range.
Keywords:Morchella esculenta; polysaccharose; zinc-enriched culture; antioxidant activity
DOI:10.7506/spkx1002-6630-201813031
收稿日期:2017-01-16
基金项目:辽宁省自然科学基金项目(2015020676);中央高校基本科研业务费专项资金项目(wd01200);大连民族大学·铜仁科学院联合科研项目(TR02003)
第一作者简介:冮洁(1965—),女,教授,博士,研究方向为食品生物技术。E-mail:gangjie@dlnu.edu.cn
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2018)13-0211-05
引文格式:冮洁, 王艳, 李佳桐, 等. 羊肚菌菌丝体锌多糖的体内、体外抗氧化作用[J]. 食品科学, 2018, 39(13): 211-215.
DOI:10.7506/spkx1002-6630-201813031. http://www.spkx.net.cn
GANG Jie, WANG Yan, LI Jiatong, et al. Antioxidant activities in vivo and in vitro of zinc-containing polysaccharides from Morchella esculenta mycelium[J]. Food Science, 2018, 39(13): 211-215. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201813031. http://www.spkx.net.cn
 )、羟自由基(•OH)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力与空白对照组相比分别提高了7.05%、23.50%和17.49%,胞外锌多糖对自由基的清除能力与多糖质量浓度呈正向关系,实验证明锌多糖具有明显的抗氧化功效。李正鹏等[8]研究发现,树舌胞外锌多糖质量浓度达到2.5 g/L时,对油脂过氧化物的抑制、•OH的清除、DPPH自由基和
)、羟自由基(•OH)和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除能力与空白对照组相比分别提高了7.05%、23.50%和17.49%,胞外锌多糖对自由基的清除能力与多糖质量浓度呈正向关系,实验证明锌多糖具有明显的抗氧化功效。李正鹏等[8]研究发现,树舌胞外锌多糖质量浓度达到2.5 g/L时,对油脂过氧化物的抑制、•OH的清除、DPPH自由基和 •的清除能力比对照组分别提高了12.50%、26.83%、30.00%、20.00%,胞外锌多糖抗氧化活性与多糖质量浓度呈显著的量效关系。刘芳[9]在研究金针菇中的锌多糖抗氧化活性时发现,多糖质量浓度相同的条件下,锌含量与抗氧化活性有一定的正相关性。目前,研究较多是锌多糖体外抗氧化活性,对体内抗氧化活性研究的较少。羊肚菌(Morchella esculenta),是一种名贵的大型食药兼用真菌,羊肚菌多糖是其主要的活性成分之一,能够保护肝脏损伤[10]、延缓细胞衰老[11]、减少脂褐质的沉积[12],对胃溃疡[13]和胃黏膜有保护作用[14],对辐射危害有辅助保护功能[15],具有抗氧化、抗炎症和抗肿瘤的作用[16-18]。目前,羊肚菌没有实现大规模人工栽培[19],主要采用菌丝体的液体发酵培养方法[20],适合生产的工业化,且深层液体发酵培养的食用菌菌丝体与其子实体在化学组成、生理功能上都很相似[21]。液态培养提取出的羊肚菌胞外多糖有较明显的抑制肿瘤、促进细胞凋亡的作用[22-23]。本课题组在已经研究了羊肚菌菌丝体液体富锌条件[24]和羊肚菌菌丝体硒多糖抗氧化活性的基础上[25],对羊肚菌菌丝体锌多糖体内、外抗氧化性进行了研究,以期阐明羊肚菌菌丝体锌多糖抗氧化、抗衰老的功效,为食用菌锌多糖的开发应用提供参考。
•的清除能力比对照组分别提高了12.50%、26.83%、30.00%、20.00%,胞外锌多糖抗氧化活性与多糖质量浓度呈显著的量效关系。刘芳[9]在研究金针菇中的锌多糖抗氧化活性时发现,多糖质量浓度相同的条件下,锌含量与抗氧化活性有一定的正相关性。目前,研究较多是锌多糖体外抗氧化活性,对体内抗氧化活性研究的较少。羊肚菌(Morchella esculenta),是一种名贵的大型食药兼用真菌,羊肚菌多糖是其主要的活性成分之一,能够保护肝脏损伤[10]、延缓细胞衰老[11]、减少脂褐质的沉积[12],对胃溃疡[13]和胃黏膜有保护作用[14],对辐射危害有辅助保护功能[15],具有抗氧化、抗炎症和抗肿瘤的作用[16-18]。目前,羊肚菌没有实现大规模人工栽培[19],主要采用菌丝体的液体发酵培养方法[20],适合生产的工业化,且深层液体发酵培养的食用菌菌丝体与其子实体在化学组成、生理功能上都很相似[21]。液态培养提取出的羊肚菌胞外多糖有较明显的抑制肿瘤、促进细胞凋亡的作用[22-23]。本课题组在已经研究了羊肚菌菌丝体液体富锌条件[24]和羊肚菌菌丝体硒多糖抗氧化活性的基础上[25],对羊肚菌菌丝体锌多糖体内、外抗氧化性进行了研究,以期阐明羊肚菌菌丝体锌多糖抗氧化、抗衰老的功效,为食用菌锌多糖的开发应用提供参考。 和DPPH自由清除率
和DPPH自由清除率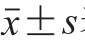 表示,组间比较采用单因素方差分析,P<0.05具有统计学意义。
表示,组间比较采用单因素方差分析,P<0.05具有统计学意义。

 体系测定羊肚菌菌丝体锌多糖和没富锌的菌丝体多糖清除•OH活性,结果如图1所示。羊肚菌菌丝体锌多糖清除•OH活性的回归方程为y=34.55x+36.085(R
体系测定羊肚菌菌丝体锌多糖和没富锌的菌丝体多糖清除•OH活性,结果如图1所示。羊肚菌菌丝体锌多糖清除•OH活性的回归方程为y=34.55x+36.085(R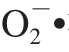 •清除率
•清除率 活性,结果如图2所示。
活性,结果如图2所示。
 •的清除率
•的清除率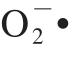 •活性的回归方程为y=63.915x+19.487(R
•活性的回归方程为y=63.915x+19.487(R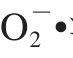 •清除作用大小为:VC>羊肚菌菌丝体锌多糖>羊肚菌菌丝体多糖。羊肚菌菌丝体锌多糖清除
•清除作用大小为:VC>羊肚菌菌丝体锌多糖>羊肚菌菌丝体多糖。羊肚菌菌丝体锌多糖清除 活性比羊肚菌菌丝体多糖提高27.08%。
活性比羊肚菌菌丝体多糖提高27.08%。




 和DPPH自由基的实验结果证明了羊肚菌菌丝体多糖具有较强的体外抗氧化性,而通过富锌培养获得的羊肚菌菌丝体锌多糖比羊肚菌菌丝体多糖具有更强的体外抗氧化活性。羊肚菌菌丝体多糖和羊肚菌富锌菌丝体多糖能够显著提高D-半乳糖致衰老小鼠肝脏、肾脏和血清中的SOD和CAT活力,降低MDA含量(P<0.05)。并且,羊肚菌菌丝体锌多糖比羊肚菌菌丝体多糖具有更强的抗衰老作用。
和DPPH自由基的实验结果证明了羊肚菌菌丝体多糖具有较强的体外抗氧化性,而通过富锌培养获得的羊肚菌菌丝体锌多糖比羊肚菌菌丝体多糖具有更强的体外抗氧化活性。羊肚菌菌丝体多糖和羊肚菌富锌菌丝体多糖能够显著提高D-半乳糖致衰老小鼠肝脏、肾脏和血清中的SOD和CAT活力,降低MDA含量(P<0.05)。并且,羊肚菌菌丝体锌多糖比羊肚菌菌丝体多糖具有更强的抗衰老作用。