姜 爽1,徐婧瑶2,苏 鑫1,刘 智1,宋 伍1,*
(1.长春中医药大学基础医学院,吉林 长春 130117;2.长春中医药大学附属医院,吉林 长春 130021)
摘 要:目的:探讨山慈菇多糖的免疫调节作用及对小鼠骨肉瘤细胞S180的抑制作用。方法:噻唑蓝法及吞噬中性红法测定小鼠脾淋巴细胞增殖能力及脾巨噬细胞活性;体内肿瘤抑制实验检测山慈菇多糖对S180荷瘤小鼠肿瘤生长、脾脏指数和胸腺指数的影响;流式细胞术及酶联免疫吸附测定法检测山慈菇多糖对S180荷瘤小鼠T淋巴细胞亚群及血清细胞因子水平的影响。结果:山慈菇多糖可以增强淋巴细胞增殖能力和巨噬细胞活性;同时,山慈菇多糖也可以抑制S180荷瘤小鼠肿瘤生长,增加小鼠脾脏指数和胸腺指数;此外,山慈菇多糖还可以增加荷瘤小鼠CD4+、CD8+ T细胞浓度,提高CD4+/CD8+比值及白细胞介素-2、肿瘤坏死因子-α、干扰素-γ水平。结论:山慈菇多糖具有明显的肿瘤抑制作用,其对肿瘤细胞生长的抑制作用与提高免疫能力有关。
关键词:山慈菇多糖;骨肉瘤;免疫调节;细胞因子
山慈菇为药食同源植物,是兰科植物独蒜兰、云南独蒜兰或杜鹃兰的干燥假鳞茎,其味甘、微辛、性寒,归肝、脾经,具有化痰散结、清热解毒之功效[1]。现代药学研究表明,山慈菇的主要活性成分包括联苄类、菲类、黄烷类、木脂素类及苷类,其药理作用涉及抗肿瘤、抗菌、降压、抗血管生成及对乙酰胆碱受体M3的阻断作用等[2]。关于山慈菇多糖(Pseudobulbus cremastrae seu pleiones polysaccharide,PCSPP)的活性研究较少,有研究表明,PCSPP具有抑制荷H22肝癌小鼠的肿瘤生长作用,该作用与其使Bcl-2表达减少进而促进肿瘤细胞凋亡有关[3]。在多种植物多糖的免疫调节及抗肿瘤作用已被证实[4-7],传统中医多应用山慈菇水提取物治疗癌症,本研究将着重探讨PCSPP的免疫调节及抑制小鼠骨肉瘤细胞S180在体内生长的作用,为进一步研究和开发PCSPP提供参考。
C57BL/6J小鼠,18~22 g,购于北京维通利华公司,雌雄各半,许可证号:SCXK(京)2014-0016。
小鼠骨肉瘤细胞S180购于中国科学院典型培养物保藏委员会细胞库,并定期进行腹腔接种传代。
PCSPP(纯度>85%,批号:20140706) 西安一文生物科技有限公司;小牛血清 杭州四季青生物工程材料研究所;环磷酰胺(cyclophosphamide,CTX)、刀豆蛋白(concanavalin A,Con A)、细菌脂多糖(lipopolysaccharide,LPS) 美国Sigma公司;抗小鼠CD4+(FITC标记)和CD8+(PE标记)抗体 美国eBioscience公司;白细胞介素-2(interleukin-2,IL-2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-γ(interferon-γ,IFN-γ)检测试剂盒 北京中杉金桥生物技术有限公司。
680型酶标仪 美国Bio-Rad公司;BCM-1000型生物洁净工作台 苏州苏洁净化设备公司;FA1004N型电子天平 上海精天电子仪器厂;TGL-16G型低温台式高速离心机 上海安亭科学仪器厂;FACS Calibur型流式细胞仪 美国BD公司。
1.3.1 小鼠脾淋巴细胞增殖检测
取正常小鼠,颈椎脱臼法处死后,无菌操作摘取小鼠脾脏,置于预冷的含1%胎牛血清的R/MINI-1640培养液中,小心剪去脂肪和结缔组织;用无菌注射器芯将脾脏挤压通过200 目筛,获得单个细胞。沿离心管壁缓慢加入4 倍体积的红细胞裂解液,在冰浴中裂解5~10 min,1 500 r/min离心10 min;Hank’s液漂洗后,加入5 倍体积含有10%胎牛血清的R/MINI-1640培养液重悬细胞,经台盼蓝(0.4%)染色确保细胞活度大于95%后,用完全培养基调整细胞密度为1×107个/mL。每孔100 μL,加入96 孔细胞培养板中,每孔细胞为1×106个。设空白对照(生理盐水)组、PCSPP低、中、高剂量(150、300、600 μg/mL)组、Con A(5 μg/mL)和LPS(10 μg/mL)阳性对照组,每组3 个复孔。继续培养48 h,在492 nm波长处采用噻唑蓝法测吸光度,根据公式(1)计算淋巴细胞增殖刺激率。
1.3.2 小鼠脾巨噬细胞活性测定
取荷瘤小鼠,颈椎脱臼法处死后,无菌操作摘取小鼠脾脏,置于预冷的含1%胎牛血清的R/MINI-1640培养液中,小心剪去脂肪和结缔组织;用无菌注射器芯将脾脏挤压通过200 目筛,获得单个细胞。1 500 r/min离心10 min,去上清液,用含10%小牛血清的R/MINI-1640培养液重悬细胞,制备约1×108~5×108个/mL的细胞悬液,采用贴壁法纯化巨噬细胞。将纯化后的脾巨噬细胞加入96 孔细胞培养板中,每孔100 μL(1×105个)。设空白对照(生理盐水)组,PCSPP低、中、高剂量(150、300、600 μg/mL)组,每组3 个复孔。培养48 h后,每孔吸弃100 μL上清液,加入100 μL中性红;继续培养30 min,1 500 r/min离心10 min,弃掉上清液,用磷酸盐缓冲液(phosphate buffered saline,PBS)反复冲洗3 次,加入200 μL裂解液室温放置过夜,在589 nm波长处测吸光度,根据公式(2)计算吞噬率。
1.3.3 体内抗肿瘤实验
取50 只C57BL/6J小鼠,每只注射0.2 mL(1×107个/mL)S180细胞悬液于右前肢腋窝下。注射24 h后将小鼠随机分为5 组,每组10 只,即模型组,PCSPP低、中、高剂量(150、300、600 mg/kg)组,CTX(25 mg/kg)组。腹腔注射给药,每日1 次,给药21 d,注射体积均为0.2 mL,模型组给予等体积生理盐水。末次给药后24 h,摘眼球取血,制备血清并分装冻存。小鼠采用颈椎脱臼法处死,取瘤块、脾脏和胸腺称质量并计算肿瘤抑制率、脾脏指数和胸腺指数,分别根据公式(3)~(5)计算。

1.3.4 流式细胞术检测荷瘤小鼠脾细胞中T淋巴细胞亚群
按照1.3.1节方法制备荷瘤小鼠脾淋巴细胞悬液,取100 μL脾淋巴细胞悬液于1.5 mL离心管中,按照说明书中的操作步骤加入适量抗小鼠CD4+和抗小鼠CD8+抗体,充分振荡混匀后,4 ℃静置30 min,加入1 mL PBS,离心后弃上清液,再加入0.5 mL PBS,在流式细胞仪中进行检测。
1.3.5 ELISA法检测荷瘤小鼠血清中细胞因子含量
采用间接酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法,按照试剂盒操作手册中的实验步骤,检测荷瘤小鼠血清中IL-2、TNF-α和IFN-γ的表达量。
所得数据以 表示,采用SPSS 16.0版统计软件进行数据处理,两两比较采用SNK-q法,多组间比较用单因素方差分析法。P<0.05或P<0.01时,表明差异具有统计学意义。
表示,采用SPSS 16.0版统计软件进行数据处理,两两比较采用SNK-q法,多组间比较用单因素方差分析法。P<0.05或P<0.01时,表明差异具有统计学意义。
表1 PCSPP对小鼠脾淋巴细胞增殖刺激率的影响(n=5)
Table1 Effect of PCSPP on proliferation stimulation ratio of spleen lymphocytes (n= 5)

注:与空白对照组比较,*.差异显著(P<0.05);**.差异极显著(P<0.01)。下同。
表2 PCSPP对小鼠巨噬细胞吞噬率的影响(n= 5)
Table2 Effect of PCSPP on phagocytic activity of macrophages (n= 5)

由表1可知,与空白对照组相比,PCSPP各剂量组小鼠脾淋巴细胞增殖活性均呈显著提高趋势,差异具有统计学意义(P<0.05或P<0.01),并呈剂量依赖效应;同时,PCSPP对小鼠脾巨噬细胞活性也均有一定的促进作用,与空白对照组比较差异具有统计学意义(P<0.01)(表2);以上结果表明,PCSPP具有促进免疫功能的作用。
表3 PCSPP对S180荷瘤小鼠肿瘤生长的影响(n=10)
Table 3Antitumor effects of PCSPP in S180 tumor-bearing mice (n= 10)

注:##.与模型组比较,差异极显著(P<0.01)。下同。
由表3可知,CTX对S180荷瘤小鼠生长的抑制作用最为明显,抑制率高达52.2%;低、中、高剂量组的PCSPP对S180的生长也具有明显抑制作用,其抑制率分别为11.9%、20.9%和25.4%;以上结果表明,PCSPP对小鼠骨肉瘤细胞S180体内生长具有抑制作用,且该作用具有剂量依赖效应。
表4 PCSPP对S180荷瘤小鼠脾脏指数和胸腺指数的影响(n= 10)
Table4 Effect of PCSPP on spleen index and thymus index in S180 tumor-bearing mice (n= 10)

注:#.与模型组比较,差异显著(P<0.05)。下同。
由表4可知,CTX可以极显著降低荷瘤小鼠脾脏指数和胸腺指数(P<0.01),而低、中、高剂量组的PCSPP均可以明显增加荷瘤小鼠的脾脏指数和胸腺指数(P<0.05或P<0.01),表明PCSPP对S180荷瘤小鼠的免疫器官具有一定的保护作用。
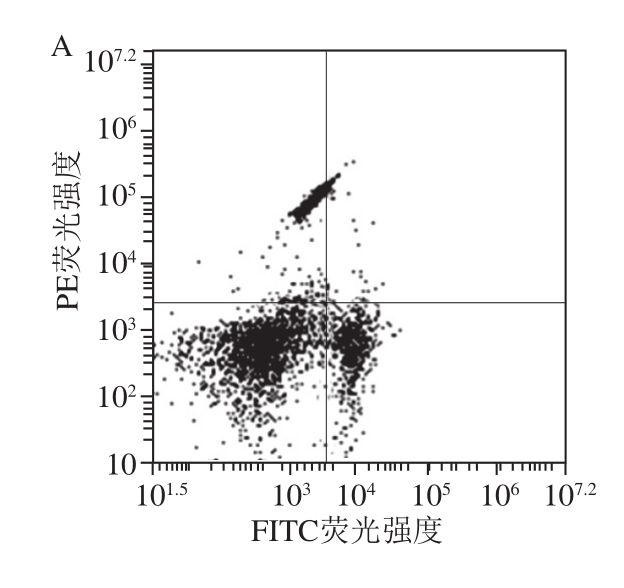

图1 流式细胞术检测PCSPP对S180荷瘤小鼠T细胞亚群CD4 和CD8
和CD8 的影响
的影响
Fig. 1 Effect of PCSPP on CD4+ and CD8+ for T cells subset in S180 tumor-bearing mice by flow cytometry
由图1、表5可知,给予低、中、高剂量的PCSPP后,各给药组小鼠CD4+、CD8+ T细胞浓度较模型组均有极显著提高,差异具有统计学意义(P<0.01),但CD8+T细胞浓度增加幅度要低于CD4+ T细胞浓度;同时,PCSPP各剂量组的CD4+/CD8+比值与模型组比较,也呈现极显著性增加(P<0.01);以上结果进一步表明,PCSPP的抗肿瘤作用与免疫调节作用有关。
表5 PCSPP对S180荷瘤小鼠T细胞亚群CD4 和CD8
和CD8 的影响(n=10)
的影响(n=10)
Table5 Effect of PCSPP on CD4 and CD8
and CD8 for T cells subset in S180 tumor-bearing mice (n= 10)
for T cells subset in S180 tumor-bearing mice (n= 10)
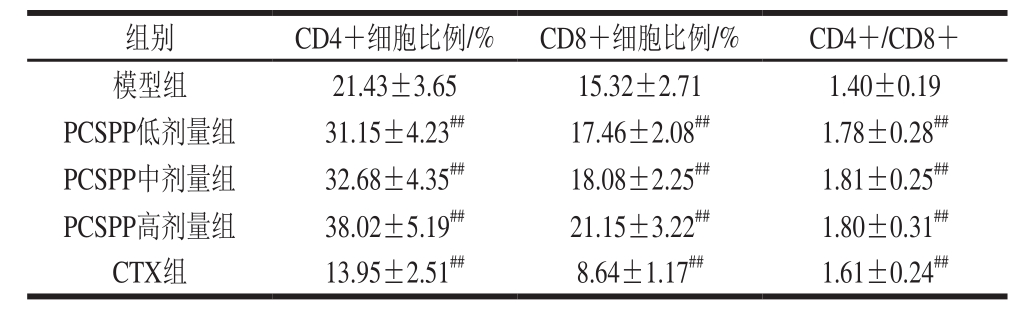
表6 PCSPP对S180荷瘤小鼠血清细胞因子的影响(n= 10)
Table6 Effect of PCSPP on serum cytokine levels in S180 tumor-bearing mice (n= 10)pg/mL
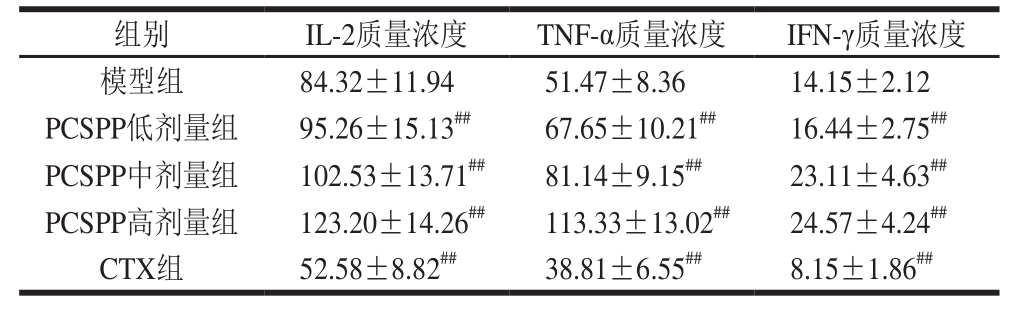
由表6可知,与模型组相比,CTX组小鼠血清中细胞因子IL-2、TNF-α及IFN-γ的水平极显著降低(P<0.01);而低、中、高剂量的PCSPP均可以极显著提高荷瘤小鼠血清中细胞因子IL-2、TNF-α及IFN-γ的水平(P<0.01),且具有剂量依赖性;以上结果表明,PCSPP的抗肿瘤作用可能与IL-2、TNF-α及IFN-γ等细胞因子的表达水平提高有关。
恶性肿瘤的死亡率和发病率逐年增加,对人类生命和健康造成严重威胁。目前为止,化疗仍是多种恶性肿瘤的主要治疗手段,但其选择性差,且存在严重的毒副作用及耐药性,临床效果往往不能令人满意[8-10]。近年来,从传统中药材中筛选具有肿瘤抑制作用的活性成分或先导化合物越来越受到抗肿瘤药物研究人员的重视。迄今为止,来源于植物的抗肿瘤制剂如紫杉醇、喜树碱、长春新碱等已成为多种肿瘤化疗的首选,此类药物已占抗肿瘤药物市场的30%以上[11-13]。中药应用历史悠久、资源丰富,从中药中筛选抗肿瘤先导化合物或有效成分,并开展相关机制研究,将具有非常重要的意义。本研究以PCSPP为研究对象,发现其具有较好的抑制S180荷瘤小鼠肿瘤生长的作用,其在低、中、高剂量下的肿瘤抑制率分别为11.9%、20.9%和25.4%,具有较好的应用前景。
机体免疫防御功能的强弱与抗肿瘤作用密切相关,脾脏指数和胸腺指数常作为观察药物对免疫功能影响的重要指标[14-15]。本研究发现低、中、高剂量组的PCSPP均可以使荷瘤小鼠的脾脏指数和胸腺指数明显增加,表明其具有保护S180荷瘤小鼠免疫功能的作用;此外,本研究也发现PCSPP具有促进正常小鼠脾淋巴细胞增殖和巨噬细胞吞噬活性的作用。机体抗肿瘤免疫的主要机制以T细胞介导的细胞免疫为主,成熟的T细胞可以分为CD4+和CD8+两个细胞亚群,而T细胞亚群的数目和比值是评价免疫功能状态最有价值的指标[16-17]。CD4+T细胞可产生大量细胞因子如IL-2、TNF-α、IFN-γ等,也可以直接杀伤肿瘤细胞[18-19];CD8+ T细胞在细胞因子以及CD4+ T细胞的协同作用下发挥杀伤肿瘤细胞作用[20-21]。本研究结果证实,给予荷瘤小鼠PCSPP后,CD4+、CD8+ T细胞浓度及CD4+/CD8+比值与模型组比较,均显著增加。以上结果进一步表明,PCSPP的抗肿瘤作用与免疫调节作用有关。
在肿瘤出现时,机体通过促使IL-2、TNF-α及IFN-γ等细胞因子分泌增加,进而发挥抗肿瘤作用[22-23]。IL-2具有辅助抗体生成、促进淋巴细胞有丝分裂和增强对杀伤细胞的杀伤功能等生物学作用,是细胞因子网络的重要成员[24-25]。TNF-α除了能够和IL-2等细胞因子相互协调发挥一系列的免疫功能外,还具有诱导细胞凋亡、坏死及激活淋巴细胞因子等多种抗肿瘤活性[26-28]。IFN-γ具有上调MHC分子的表达和激活巨噬细胞等功能,是调节免疫系统的主要细胞因子[29-30]。本研究结果发现,CTX组S180荷瘤血清中IL-2、TNF-α及IFN-γ的水平显著降低,细胞毒性较强,可以损害机体的免疫功能;而PCSPP能促进IL-2、TNF-α及IFN-γ等细胞因子水平的表达。此结果进一步提示,PCSPP的抗肿瘤作用与提高S180荷瘤小鼠血清中IL-2、TNF-α及IFN-γ等细胞因子水平,增强机体免疫能力有关。综上所述,PCSPP具有明显的肿瘤抑制作用,其对肿瘤细胞生长的抑制作用与提高免疫能力有关。
参考文献:
[1] 李琦, 陈宇纵, 辛海量. 山慈菇的化学成分及药理作用研究进展[J].药学实践杂志, 2014, 32(4): 250-253; 260. DOI:10.3969/j.issn.1006-0111.2014.04.003.
[2] 杨广, 江巍, 张敏州, 等. 化痰中药半夏及山慈菇抗动脉粥样硬化的作用机制研究[J]. 中药新药与临床药理, 2013, 24(3): 230-233.DOI:10.3969/j.issn.1003-9783.2013.03.005.
[3] 徐小娟, 蔡懿鑫, 毛宇, 等. 山慈菇多糖对荷H22肝癌小鼠的抗肿瘤机制研究[J]. 食品研究与开发, 2015, 36(7): 23-25. DOI:10.3969/j.issn.1005-6521.2015.07.006.
[4] LIAO W Z, LU Y J, FU J N, et al. Preparation and characterization of dictyophora indusiata polysaccharide-zinc complex and its augmented antiproliferative activity on human cancer cells[J]. Journal of Agricultural and Food Chemistry, 2015, 63(29): 6525-6534.DOI:10.1021/acs.jafc.5b00614.
[5] SUN H, NI X Q, SONG X, et al. Fermented Yupingfeng polysaccharides enhance immunity by improving the foregut microflora and intestinal barrier in weaning rex rabbits[J]. Applied Microbiology and Biotechnology, 2016, 100(18): 8105-8120.DOI:10.1007/s00253-016-7619-0.
[6] SHEN C, MAO J, CHEN Y Q, et al. Extraction optimization of polysaccharides from Chinese rice wine from the Shaoxing region and evaluation of its immunity activities[J]. Journal of the Science of Food and Agriculture, 2015, 95(10): 1991-1996. DOI:10.1002/jsfa.6909.
[7] ZHONG K, WANG Q, HE Y, et al. Evaluation of radicals scavenging, immunity-modulatory and antitumor activities of longan polysaccharides with ultrasonic extraction on in S180 tumor mice models[J]. International Journal of Biological Macromolecules, 2010,47(3): 356-360. DOI:10.1016/j.ijbiomac.2010.05.022.
[8] ROLLAND B, REID S, STELLING D, et al. Toward rigorous data harmonization in cancer epidemiology research: one approach[J].American Journal of Epidemiology, 2015, 182(12): 1033-1038.DOI:10.1093/aje/kwv133.
[9] FAIVRE C, EL CHEIKH R, BARBOLOSI D, et al. Mathematical optimisation of the cisplatin plus etoposide combination for managing extensive-stage small-cell lung cancer patients[J]. British Journal of Cancer, 2017, 116(3): 344-348. DOI:10.1038/bjc.2016.439.
[10] NICHOLS R C, HU C, BAHARY J P, et al. Serum testosterone changes in patients treated with radiation therapy alone for prostate cancer on NRG oncology RTOG 9408[J]. Advances in Radiation Oncology, 2017, 2(4): 608-614. DOI:10.1016/j.adro.2017.07.004.
[11] WU Q, YANG Z P, NIE Y Z, et al. Multi-drug resistance in cancer chemotherapeutics: mechanisms and lab approaches[J]. Cancer Letters,2014, 347(2): 159-166. DOI:10.1016/j.canlet.2014.03.013.
[12] DESSAI S B, CHAKRABORTY S, BABU T V S, et al. Tolerance of weekly paclitaxel and carboplatin as neoadjuvant chemotherapy in advanced ovarian cancer patients who are unlikely to tolerate 3 weekly paclitaxel and carboplatin[J]. Indian Journal of Cancer, 2016, 53(2):280-283. DOI:10.4103/0019-509X.197742.
[13] TANG Q, JI F L, SUN W H, et al. Combination of baicalein and 10-hydroxy camptothecin exerts remarkable synergetic anti-cancer effects[J]. Phytomedicine, 2016, 23(14): 1778-1786. DOI:10.1016/j.phymed.2016.10.018.
[14] 范晓艳, 金岳雷, 于洋, 等. 毛尖蘑子实体粗多糖对肿瘤生长及免疫器官的影响[J]. 中国老年学杂志, 2012, 32(24): 5480-5481.DOI:10.3969/j.issn.1005-9202.2012.24.051.
[15] RAJOKA M S R, SHI J L, ZHU J, et al. Capacity of lactic acid bacteria in immunity enhancement and cancer prevention[J]. Applied Microbiology and Biotechnology, 2017, 101(1): 35-45. DOI:10.1007/s00253-016-8005-7.
[16] 陈志强, 张英志. 莪术多糖对Lewis肺癌小鼠的抑制作用及机制[J]. 中国老年学杂志, 2015, 35(7): 1925-1927. DOI:10.3969/j.issn.1005-9202.2015.07.087.
[17] 李航, 刘小虹, 徐卫方, 等. 中药对哮喘T细胞亚型免疫调节作用的研究进展[J]. 中药新药与临床药理, 2017, 28(1): 132-136.DOI:10.19378/j.issn.1003-9783.2017.01.027.
[18] OZKAZANC D, YOYEN-ERMIS D, TAVUKCUOGLU E, et al.Functional exhaustion of CD4+ T cells induced by co-stimulatory signals from myeloid leukaemia cells[J]. Immunology, 2016, 149(4):460-471. DOI:10.1111/imm.12665.
[19] KNOCKE S, FLEISCHMANN-MUNDT B, SABOROWSKI M, et al.Tailored tumor immunogenicity reveals regulation of CD4 and CD8 T cell responses against cancer[J]. Cell Reports, 2016, 17(9): 2234-2246.DOI:10.1016/j.celrep.2016.10.086.
[20] HASSANZADEH-KIABI N, YÁÑEZ A, DANG I, et al. Autocrine type I IFN signaling in dendritic cells stimulated with fungal β-glucans or lipopolysaccharide promotes CD8 T cell activation[J].Journal of Immunology, 2017, 198(1): 375-382. DOI:10.4049/jimmunol.1601143.
[21] WEISKIRCHEN R, TACKE F. Immune surveillance of liver cancer in non-alcoholic fatty liver disease: excess lipids cause CD4 T-cells loss and promote hepatocellular carcinoma development[J]. Hepatobiliary Surgery and Nutrition, 2016, 5(5): 433-437. DOI:10.21037/hbsn.2016.09.10.
[22] NI C, WU P, ZHU X T, et al. IFN-γ selectively exerts pro-apoptotic effects on tumor-initiating label-retaining colon cancer cells[J]. Cancer Letters, 2013, 336(1): 174-184. DOI:10.1016/j.canlet.2013.04.029.
[23] GERBER S A, SEDLACEK A L, CRON K R, et al. IFN-γ mediates the antitumor effects of radiation therapy in a murine colon tumor[J]. American Journal of Pathology, 2013, 182(6): 2345-2354.DOI:10.1016/j.ajpath.2013.02.041.
[24] OHRI C M, SHIKOTRA A, GREEN R H, et al. Tumour necrosis factor-alpha expression in tumor islets confers a survival advantage in non-small cell lung cancer[J]. BMC Cancer, 2010, 10: 323.DOI:10.1186/1471-2407-10-323.
[25] ROSENBERG S A. IL-2: The first effective immunotherapy for human cancer[J]. Journal of Immunology, 2014, 192(12): 5451-5458.DOI:10.4049/jimmunol.1490019.
[26] HABIJANIC J, BEROVIC M, BOH B, et al. Submerged cultivation of Ganoderma lucidum and the effects of its polysaccharides on the production of human cytokines TNF-α, IL-12, IFN-γ, IL-2, IL-4, IL-10 and IL-17[J]. New Biotechnology, 2015, 32(1): 85-95. DOI:10.1016/j.nbt.2014.07.007.
[27] CHENG K B, WU Z H, GAO B L, et al. Analysis of influence of baicalin joint resveratrol retention enema on the TNF-α, SIgA, IL-2,IFN-γ of rats with respiratory syncytial virus infection[J]. Cell Biochemistry and Biophysics, 2014, 70(2): 1305-1309. DOI:10.1007/s12013-014-0055-9.
[28] PARNSAMUT C, BRIMSON S. Effects of silver nanoparticles and gold nanoparticles on IL-2, IL-6, and TNF-α production via MAPK pathway in leukemic cell lines[J]. Genetics and Molecular Research,2015, 14(2): 3650-3668. DOI:10.4238/2015.April.17.15.
[29] SPALLANZANI R G, TORRES N I, AVILA D E, et al. Regulatory dendritic cells restrain NK cell IFN-γ production through mechanisms involving NKp46, IL-10, and MHC class I: specific inhibitory receptors[J]. The Journal of Immunology, 2015, 195(5): 2141-2148.DOI:10.4049/jimmunol.1403161.
[30] CHIU B L, LI C H, CHANG C C. Selective modulation of MHC class II chaperons by a novel IFN-γ-inducible class II transactivator variant in lung adenocarcinoma A549 cells[J]. Biochemical and Biophysical Research Communications, 2013, 440(1): 190-195. DOI:10.1016/j.bbrc.2013.09.066.
Effects of Pseudobulbus cremastrae seu pleiones Polysaccharide on the Regulation of Immune Function and the Inhibition of Tumor Growth in Sarcoma S180 Tumor-Bearing Mice
JIANG Shuang1, XU Jingyao2, SU Xin1, LIU Zhi1, SONG Wu1,*
(1. College of Basic Medical Sciences, Changchun University of Chinese Medicine, Changchun 130117, China;2. Affiliated Hospital, Changchun University of Chinese Medicine, Changchun 130021, China)
Abstract:Objective: To explore the effects of Pseudobulbus cremastrae seu pleiones polysaccharide (PCSPP) on the regulation of immune functionand the inhibition of tumor growth in sarcoma S180 tumor-bearing mice. Methods:Lymphocyte proliferation capacity and the phagocytic activity of spleen macrophages were determined by 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide and neutral red methods; the effects of PCSPP on tumor growth,spleen index and thymus index in S180 tumor-bearing mice were evaluated through tumor suppression test in vivo,and the effects on T lymphocyte subgroup and serum cytokine levels were detected by flow cytometry and enzymelinked immunosorbent assay, respectively. Results: PCSPP could enhance lymphocyte proliferation capacity and macrophage phagocytic activity. PCSPP could inhibit tumor growth and increase spleen index and thymus index in S180 tumor-bearing mice; meanwhile, it could also increase the levels of CD4+ and CD8+ T cells in mice and elevate the CD4+/CD8+ ratio, interleukin-2, tumor necrosis factor-α and interferon-γ levels. Conclusion: PCSPP has a potent antitumor effect and its inhibitory effect may be related to ithe improvement of immune function.
Keywords:Pseudobulbus cremastrae seu pleiones polysaccharide; sarcoma; immunoregulation; cytokines
DOI:10.7506/spkx1002-6630-201813032
收稿日期:2017-01-13
基金项目:吉林省科技发展计划项目(20140520016JH);吉林省教育厅“十三五”科学技术研究项目(吉教科合字2016第27号)
第一作者简介:姜爽(1982—),男,讲师,博士,研究方向为食品营养与保健食品开发。E-mail:jiangshuang_2000@163.com
*通信作者简介:宋伍(1985—),男,讲师,博士,研究方向为食品营养与保健食品开发。E-mail:five841110@126.com
中图分类号:R151.3
文献标志码:A
文章编号:1002-6630(2018)13-0216-06
引文格式:姜爽, 徐婧瑶, 苏鑫, 等. 山慈菇多糖的免疫调节作用及对小鼠骨肉瘤细胞S180体内生长抑制作用[J]. 食品科学, 2018,39(13): 216-221.
DOI:10.7506/spkx1002-6630-201813032. http://www.spkx.net.cn
JIANG Shuang, XU Jingyao, SU Xin, et al. Effects of Pseudobulbus cremastrae seu pleiones polysaccharide on the regulation of immune function and the inhibition of tumor growth in sarcoma S180 tumor-bearing mice[J]. Food Science,2018, 39(13): 216-221. (in Chinese with English abstract)
DOI:DOI:10.7506/spkx1002-6630-201813032. http://www.spkx.net.cn