姜速峰1,赵谋明1,江虹锐1,*,刘小玲1,白 洋2
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.广西嘉盈生物科技有限公司,广西 南宁 530000)
摘 要:研究经不同商业酶水解后得到的罗非鱼皮胶原酶解物对人皮肤角质细胞HaCaT生长的影响,并对胶原酶解物的抗氧化活性与促进细胞生长作用的关系进行探讨。结果表明:罗非鱼皮经中性蛋白酶(neutral enzyme,NE)、碱性蛋白酶、胰蛋白酶水解得到的酶解产物中,NE酶解物(neutral enzymatic hydrolysate,NEH)具有显著的体外抗氧化活性和促进HaCaT细胞增殖的活性(P<0.05);NEH(1~5 ku)在质量浓度为25 mg/mL时对HaCaT细胞的生长具有显著的促进作用(P<0.05),并在24 h内能显著促进细胞划痕处伤口愈合(愈合率(81.10±5.77)%,P<0.05)。经氨基酸组成分析和凝胶色谱分析发现,NEH(1~5 ku)主要包含2 个肽组分,NEH(1~5 ku)的抗氧化氨基酸苯丙氨酸、亮氨酸、酪氨酸、赖氨酸、精氨酸和组氨酸的质量分数要显著高于其他分子质量的肽组分(P<0.05)。研究认为,经NE水解得到胶原肽分子质量为1~5 ku组分对HaCaT细胞生长具有促进作用,这可能与肽组分中抗氧化氨基酸质量分数较高有关。
关键词:罗非鱼皮;胶原酶解物;抗氧化活性;细胞生长;HaCat细胞
胶原是脊椎动物中最丰富的蛋白质,占脊椎动物总蛋白质的25%[1]。一些胶原肽已被证明具有很好的生物学活性,如美白[2]、抗氧化[3]、增加骨密度[4]和降低血压[5]等,含胶原产品已被广泛应用于食品、制药等多个行业[1]。近几年来,我国罗非鱼的产量稳步增加,其加工鱼片在水产品出口市场中占主要地位[6],越来越多的研究关注于罗非鱼皮、鱼骨等副产物中胶原蛋白或肽的提取工艺及活性研究。庄永亮等[7]研究表明罗非鱼皮经中性酶与碱性酶法制备的胶原蛋白水解液有很强的羟自由基清除能力,并发现水解液中的抗氧化性肽段主要由甘氨酸、亮氨酸、谷氨酸组成。Ngo[8]和Sun Liping[9]等也证实罗非鱼胶原酶水解物具有很好的清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基的能力。
胶原蛋白、胶原肽对皮肤损伤或生长也有促进作用。Pati等[10]研究发现南亚野鲮鱼鳞胶原蛋白制备的骨架对成纤维细胞具有很好的生长促进作用;Tanaka[11]和Yaar[12]等的研究也发现罗非鱼鳞胶原产品对治愈紫外诱导的皮肤损伤具有一定的有利作用;陈俊等[13]的研究发现罗非鱼皮胶原酶解物和鲨鱼皮酶解物具有可以替代谷胱甘肽在化妆品领域应用的潜力,同时胶原酶解物通过分离纯化之后有良好的促进表皮细胞生长的能力。人永生化表皮细胞属于成人表皮细胞自发转化而来的细胞系,它与人体正常的角质形成细胞有相同的增殖、分化特性和遗传稳定性[14],常被用于生物医学领域,作为体外研究的细胞系,比如皮肤修复愈合和防晒等[15]研究。Zhao Xin[16]和Zhou Tian[17]等以人皮肤角质HaCaT细胞作为研究对象,研究明胶、胶原对上皮细胞增殖分化的影响,结果发现HaCaT细胞在明胶与胶原基质上具有良好的生长能力,且能大量表达细胞增殖分化黏附相关因子。但是,关于罗非鱼皮肽的抗氧化作用与促进上皮角质细胞的伤口愈合及生长相关性的研究很少报道。本研究利用下脚料罗非鱼皮酶解物及膜分离组分,探讨其体外抗氧化活性对人HaCat细胞生长和人上皮伤口愈合的影响。
罗非鱼皮 广西百洋食品有限公司;HaCaT细胞上海中乔新舟生物科技有限公司;中性酶、碱性酶、胃蛋白酶 广西南宁庞博生物工程有限公司;胎牛血清、DMEM高糖培养基 以色列BI公司;胰酶消化液、双抗上海碧云天生物技术有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,MTT) 北京索莱宝科技有限公司;DPPH 美国Sigma公司。
722型分光光度计 上海仪电分析仪器有限公司;细胞培养箱 德国BINDER公司;倒置显微镜 奥林巴斯(中国)有限公司;酶标仪 帝肯(上海)贸易有限公司;低速离心机 湖南湘仪实验室仪器开发有限公司;超滤装置 上海摩速科技有限公司;紫外-可见光分光光度计 上海美谱达仪器有限公司。
1.3.1 罗非鱼皮胶原酶解物的制备
罗非鱼皮经脱色、脱脂、酸法[18]制备得胶原蛋白液,用碱性蛋白酶(alkaline enzyme,AE)、中性蛋白酶(neutral enzyme,NE)、胰蛋白酶(pancreatin enzyme,PE)分别对其酶解,相应得到酶解物AEH、NEH和PEH。各酶解条件如下:2%(质量分数,下同)AE(1×106U/g),温度55 ℃,pH 9.0;2.5% NE(2×105U/g),温度55 ℃,pH 7.0;0.2% PE(4×103U/g),温度50 ℃,pH 8.0;酶解时间1~180 min,所得酶解液经沸水浴灭酶10 min,4 000 r/min离心10 min,收集上清液。经真空浓缩和冷冻干燥得到AEH、NEH和PEH,将各酶解物蛋白质量浓度调为10、25、50、75、100、150 mg/mL备用。
1.3.2 DPPH自由基清除能力测定
罗非鱼皮胶原蛋白酶解,每30 min测定各酶解物清除DPPH的能力,参考张玉等[19]的方法,取2 mL罗非鱼皮酶解物于试管中,加入2 mL 0.04 g/L的DPPH无水乙醇溶液,混合均匀,在室温下暗处理20 min,于517 nm波长处测其吸光度,记为Ai;取2 mL待测样品于试管中,再加入2 mL无水乙醇,混合均匀,在室温下暗处理20 min,于517 nm波长处测其吸光度,记为Aj;取2 mL 0.04 g/L的DPPH无水乙醇溶液,加入2 mL无水乙醇,混合均匀,在室温下暗处理20 min,于517 nm波长处测其吸光度,记为A0。根据式(1)计算DPPH自由基清除率。
1.3.3 细胞增殖作用分析
采用MTT法[20]分析NEH、AEH、PEH对HaCat细胞生长的影响。在96 孔板中接种HaCat细胞的密度为3×103个/孔,总体积180 μL,6 h细胞贴壁后,各孔中加入10 μL质量浓度分别为10、25、50、75、100、150 mg/mL的NEH、AEH、PEH,培养12、24、36、48 h。在检测前4 h时每孔加入10 μL MTT溶液(5 mg/mL)孵育,检测前弃上清液,加入110 μL二甲基亚砜,置摇床上低速振荡10 min,酶标仪检测490 nm波长处OD值,记为OD实验组。以不添加酶解物的细胞培养液培养不同时间后得到的OD值为对照,记为OD对照组,根据式(2)计算细胞增殖率,绘制细胞增殖曲线。
式中:OD空白为含有不同质量浓度酶解物培养基在490 nm波长处的OD值;OD零孔为细胞培养基在490 nm波长处的OD值。
1.3.4 膜分离
对NEH、AEH、PEH 3 种酶解物作用于HaCat细胞,检测其细胞增殖作用与DPPH自由基清除能力,筛选具有最佳活性的酶解物进行超滤膜分离,共分为<1 ku、1~5 ku、5~10 ku、>10 ku的4 个组分,并对该4 个组分进行MTT实验,筛选出促细胞增殖活性最好的一个组分,经真空冷冻干燥保存于-20 ℃。
1.3.5 细胞划痕实验
经膜分离及MTT实验筛选出的最佳胶原酶解物组分进行HaCat细胞划痕实验,体外研究胶原酶解物对皮肤刮伤愈合作用的活性。参照文献[21],在96 孔板中接种细胞3×103个/孔,培养12 h后用10 μL枪头在细胞表面划出约5 mm的划痕,磷酸盐缓冲液冲洗3 次,去除损伤的细胞,加入含25 mg/mL胶原酶解物组分的无血清培养基,于37 ℃、5% CO2培养箱中培养。于0、12、24、36、48 h经倒置显微镜拍照观察,将不含胶原肽的无血清培养基作用组设为空白组,测量不同时间HaCaT细胞划痕处伤口愈合距离,并按式(3)计算伤口愈合率。
式中:Lt为取样时间点伤口的平均距离/mm;L0为0 h处的伤口平均距离/mm。
1.3.6 氨基酸组成测定
将膜分离后的胶原酶解物组分经6 mol/L HCl溶液110 ℃消化22 h,除去盐酸,经超纯水定容之后,0.22 μm滤膜过滤后,利用全自动氨基酸分析仪检测酶解物中的氨基酸组成。
1.3.7 凝胶色谱分析罗非鱼皮胶原肽组分
参照文献[22],将作用于HaCaT细胞进行划痕实验的肽样品配成10 mg/mL的溶液,经0.22 μm微孔膜过滤后取2 mL过凝胶过滤分离层析系统,层析柱为Sephadex G-25(1.6 cm×40 cm)。用超纯水洗脱样品,流速为1 mL/min,检测波长为220 nm,洗脱液自动部分收集,并对收集的液体测定吸光度。
实验数据的统计与分析以及作图采用SPSS 18.0和Origin 8.5软件。对所有数据进行单因素方差分析,显著水平为P<0.05。

图1 TSCH清除DPPH自由基能力与酶解时间的关系
Fig. 1 Scavenging effect of TSCH on DPPH free radical as a function of hydrolysis time
由图1可以看出,罗非鱼皮胶原酶解物对DPPH自由基的清除能力具有时间依赖性,随着酶解时间的延长,NEH、AEH、PEH的DPPH自由基清除能力也升高,但酶解120~150 min后,各酶解物的DPPH自由基清除能力不再明显升高。陈日春[23]研究酶解时间与酶解物清除DPPH自由基能力,发现当酶解到达一定程度,酶解物清除DPPH自由基的能力不再升高,与本研究结果一致。图1中各酶解物清除DPPH自由基能力从高到低依次是:NEH>AEH>PEH,分别在酶解150、120、150 min时达到最大,在各酶解物清除DPPH自由基能力达到最大时,NEH与另外两种酶解物有显著性差异(P<0.05),这与林金莺[24]研究酶解种类与清除DPPH自由基能力之间的关系中,发现的AEH清除DPPH自由基能力要高于NEH稍有不同,可能是由于酶解底物的氨基酸残基序列与组成不同,经过特异性酶解后,不同的特异性酶切位点会直接影响酶解产物中肽的分子质量和氨基酸组成。此外,Kim等[25]的研究证实胶原酶解物的抗氧化活性与增强细胞活性之间有相关关系,因此本实验根据胶原蛋白酶解时间与抗氧化活性的相关性,分别选择酶解150 min的NEH、酶解120 min的AEH、酶解150 min的PEH为研究对象进行后续研究。
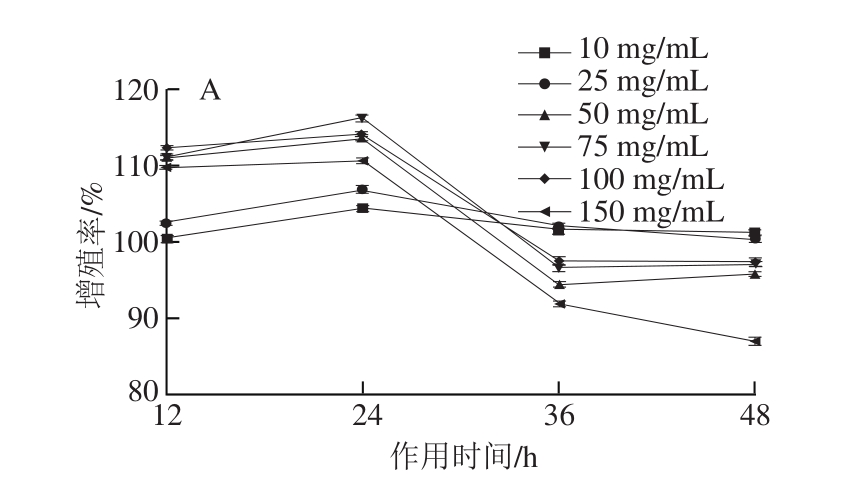
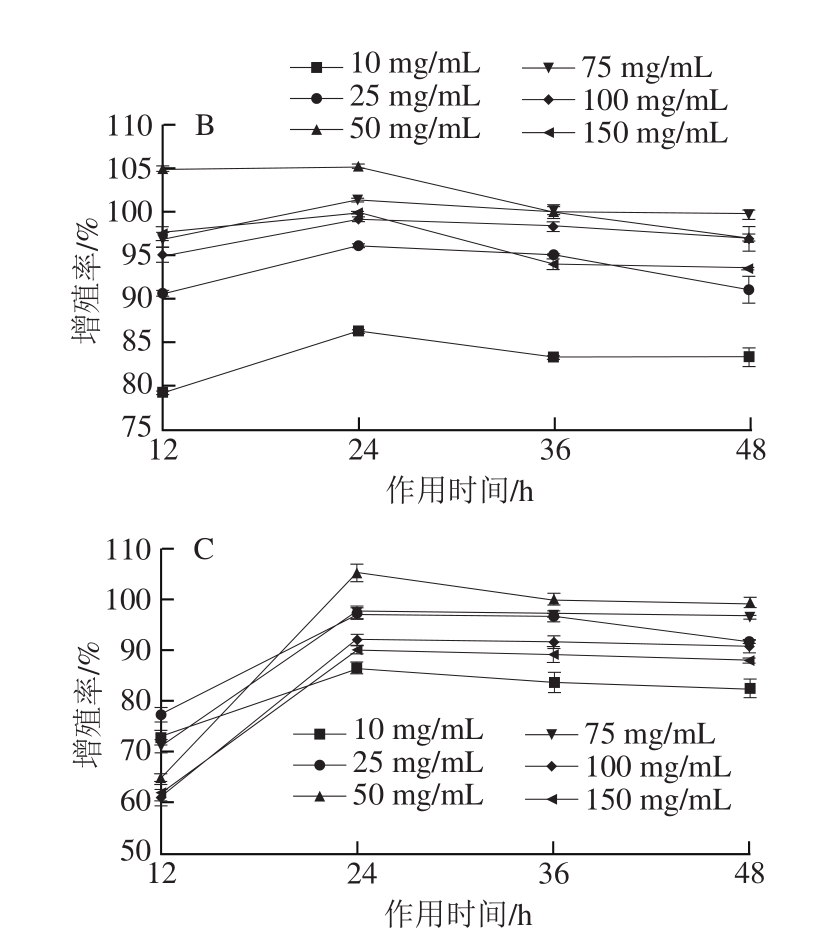
图2 不同质量浓度NEH(A)、AEH(B)、PEH(C)对HaCaT细胞的增殖作用
Fig. 2 Effects of NEH (A), AEH (B) and PEH (C) on the growth stimulation of HaCaT cells at different concentrations and treatment periods
由图2可知,NEH、AEH和PEH对HaCat细胞的增殖作用随着作用时间的延长呈现先增后减的趋势,与Wang Yaowen等[26]报道丝裂霉素作用HaCaT细胞生长规律类似,同时也与Ohara等[27]研究Pro-Hyp二肽作用成纤维细胞生长作用规律相同,在细胞生长潜伏期,胶原肽对细胞生长不会产生明显影响,当细胞进入对数生长期,胶原肽会显著促进细胞增殖。同时由图2可知,NEH、AEH和PEH促进细胞增殖的最佳作用时长为24 h,进一步说明细胞在24 h之内经历了从潜伏期到生长期的变化。

图3 作用24 h后酶解物质量浓度对HaCaT细胞的作用
Fig. 3 Effects of enzymatic hydrolysates at different concentrations on the proliferation of HaCaT cells after 24 h
由图3可知,随NEH、AEH和PEH质量浓度增加,促细胞增殖活性也呈现先增后减的趋势,这可能是低质量浓度(5~20 mg/mL)酶解物对细胞无作用,而高质量浓度酶解物导致细胞渗透压增大,破坏细胞原有稳定的生存环境,对细胞产生毒性。这与Chung等[28]研究绿茶提取物对HaCaT细胞生长作用时,中、低质量浓度提取物促进细胞生长明显,高质量浓度反而会抑制细胞生长趋势类似。此外,图3中酶解物质量浓度为10~150 mg/mL时,NEH、AEH和PEH促细胞增殖活性规律大致相似,作用效果依次为:NEH>AEH>PEH,75 mg/mL NEH对细胞的增殖活性最大,与AEH、PEH的最大增殖活性有显著性差异(P<0.05)。各酶解物MTT实验结果与DPPH自由基清除实验结果呈正相关,说明罗非鱼皮胶原蛋白水解物的体外抗氧化活性与促进细胞增殖能力之间可能有正相关关系。相比于另外两种酶解物,NEH具有最高的细胞增殖活性与抗氧化活性。

图4 膜分离NEH不同组分与质量浓度对HaCaT细胞的作用
Fig. 4 Effects of peptide fractions from NEH at different concentrations on HaCaT cells
如图4所示,随酶解物质量浓度增加,膜截留得到的4 个组分的NEH对HaCaT细胞的增殖作用呈现先增强后减弱趋势,但其活性均高于未经膜分离NEH,这说明超滤膜截留不同分子质量的胶原肽酶解物富集了细胞增殖活性组分,1~5 ku组分促进细胞增殖作用最为突出,质量浓度为25 mg/mL时,细胞的增殖率达到(129.37±0.03)%,而<1 ku、5~10 ku、>10 ku的组分在质量浓度为10 mg/mL时,对细胞的增殖作用最大,其增殖率分别为(123.40±0.03)%、(122.84±0.02)%、(117.40±0.04)%,但其增殖作用显著小于1~5 ku。结果说明1~5 ku组分表现出优越的促HaCaT细胞增殖能力,陈日春[23]证实鲢鱼鱼鳞胶原肽分子质量在1~5 ku的组分表现出较强的清除DPPH能力,而Kim[29]和Mendis[30]等的研究也发现阿拉斯加鳕鱼皮胶原酶解物的抗氧化活性与增强细胞活性之间有相关关系,即体外抗氧化活性越高,促进细胞增殖作用表现得越大。因此,综合本实验结果与其他相关研究,体外抗氧化活性与促进细胞增殖之间呈正相关。为了进一步验证膜分离NEH获得的1~5 ku组分的细胞活性,以下细胞划痕实验选择25 mg/mL进行分析。
HaCaT细胞经NEH(分子质量1~5 ku)作用12、24、36、48 h的迁移状况如图5所示。
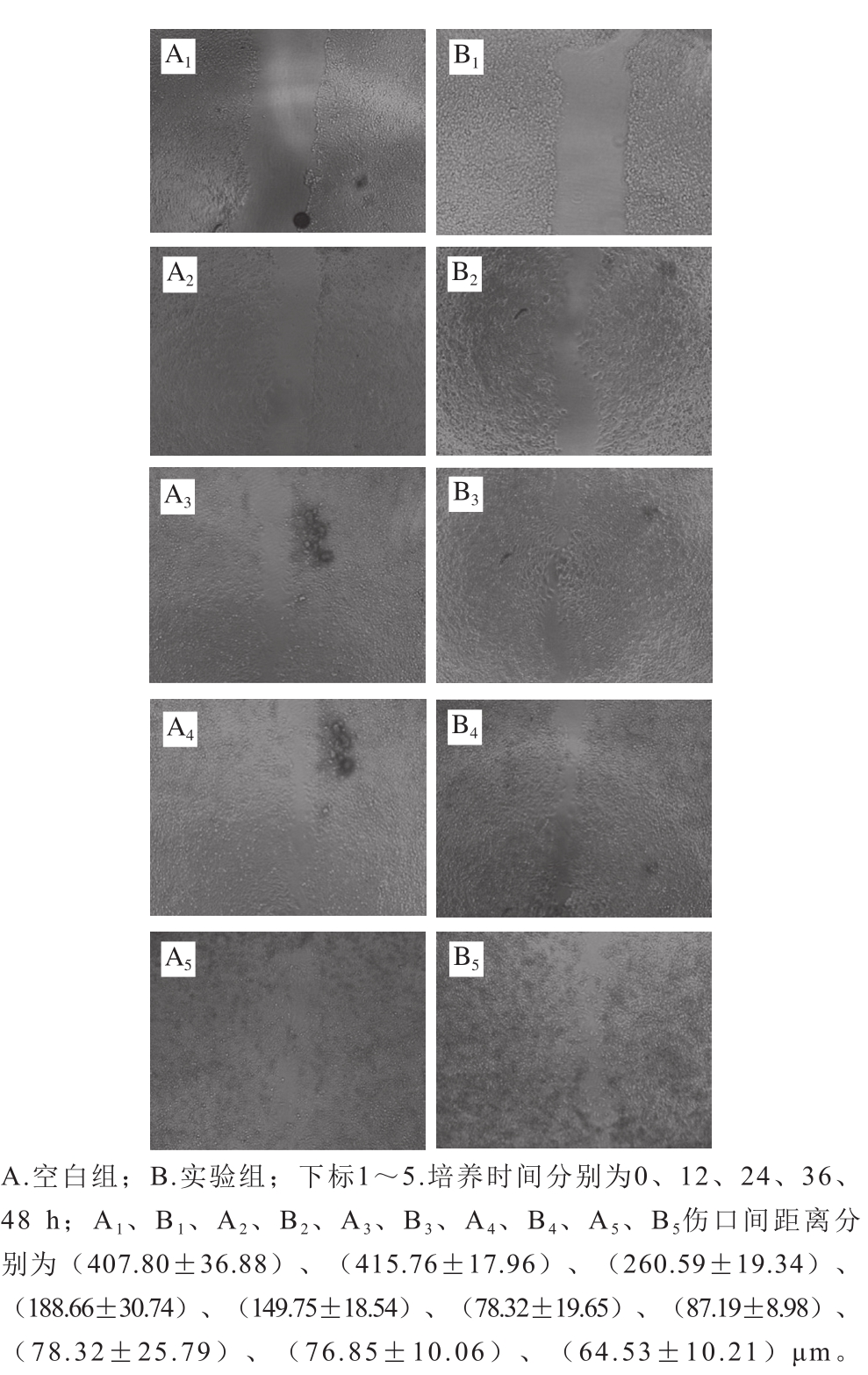
图5 分子质量1~5 ku胶原肽在不同时间对HaCaT细胞迁移的影响
Fig. 5 Effects of collagen peptides on the migration of HaCaT cells at different treatment periods
研究细胞的迁移能力时,体外细胞划痕实验能在很大程度上模拟体内细胞生长迁移过程[31]。上皮细胞生长与增殖过程本质是创伤愈合过程。图5显示,实验组和空白组HaCaT细胞在划痕处伤口中的迁移速率与时间存在相关关系,即随培养时间延长,划痕处伤口间距离也相对应缩短。

图6 分子质量1~5 ku胶原肽在不同时间对HaCaT细胞迁移中伤口愈合的影响
Fig. 6 Effects of collagen peptides on the wound healing and migration of HaCaT cells at different treatment periods
图6 显示,培养24 h,实验组划痕处伤口愈合率(81.10±5.04)%与36 h伤口愈合率(81.22±5.77)%、48 h伤口愈合率(84.47±2.34)%划痕处伤口愈合率已无显著性差异(P>0.05),这与之前胶原酶解物最佳作用HaCaT细胞时间24 h相符,而与12 h划痕处伤口愈合率(54.62±6.88)%存在显著性差异(P<0.05),这说明添加胶原肽能使HaCat细胞划痕处伤口24 h内基本愈合完全。与实验组不同,未添加胶原肽的空白组,在培养时长36 h,划痕处伤口愈合率(78.54±2.23)%与48 h划痕处伤口愈合率(80.98±3.32)%无显著性差异(P>0.05),而与24 h划痕处伤口愈合率(62.93±6.33)%存在显著性差异(P<0.05),这说明未加胶原肽的空白组HaCaT细胞划痕处伤口需36 h基本愈合完全,比实验组划痕处伤口愈合迟12 h。图6同时还显示,培养12 h,实验组划痕处伤口愈合率(54.62±6.88)%与空白组划痕处伤口愈合率(35.48±9.40)%有着极显著性差异(P<0.01),在24 h处也同样如此。因此结果表明,实验制备的胶原肽对HaCaT细胞划痕处实验伤口愈合有很大促进作用。Haapasalmi等[32]报道,细胞表面有一种整合蛋白,在人和动物的伤口处会大量分布,特别是含β1的整合蛋白会在伤口处高表达,整合素作为一种细胞外基质的受体,与胞外配体结合,从而启动信号通路来促进细胞的生长。细胞与胞外基质之间的相互作用会很大程度的控制细胞的生长[33],因此,胶原肽能促进伤口快速愈合,可能与这种调控机制有关。

图7 Sephadex G-25分离NEH
Fig. 7 Column chromatography separation of NEH on Sephadex G-25
如图7所示,对分子质量1~5 ku的NEH进行凝胶层析分离,在220 nm波长处检测,得到2 个洗脱峰,分别在12、23 min左右出峰,且在23 min时的吸光度最大。因此,1~5 ku组分对HaCaT细胞生长与划痕处伤口愈合效果很可能与23 min分离的组分紧密相关,而这有待进一步的研究。
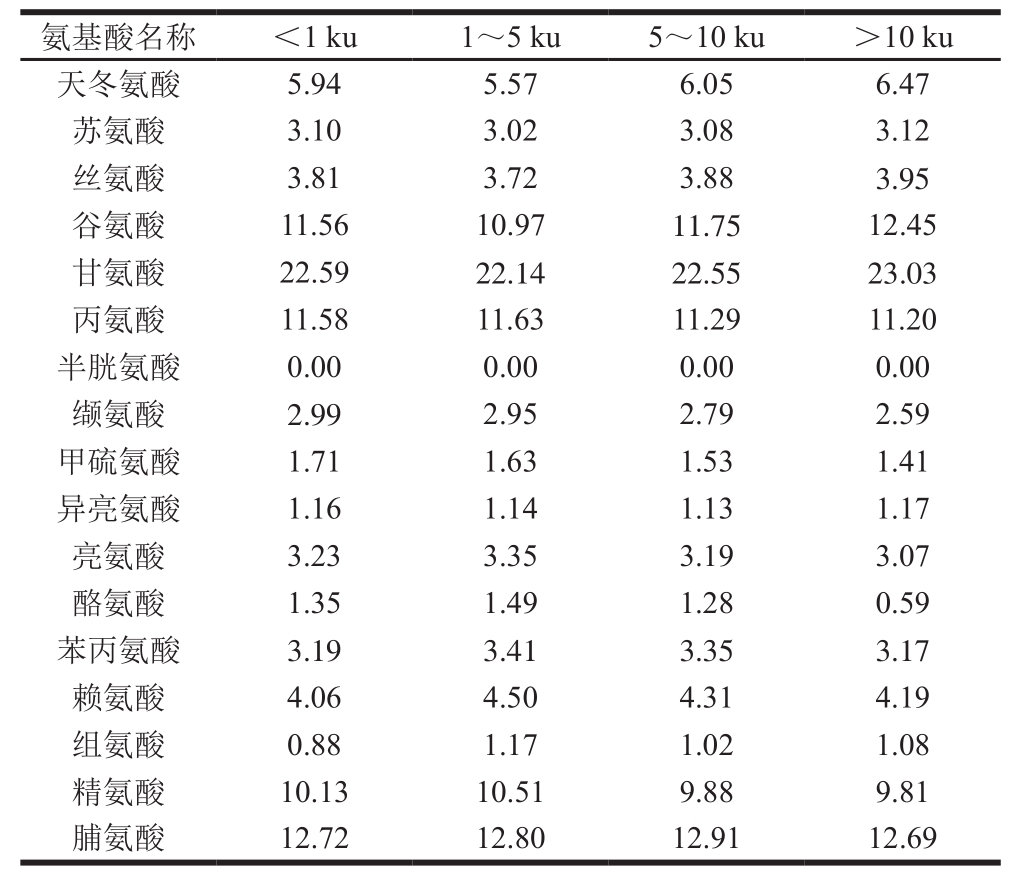
以上实验表明胶原肽促进HaCaT细胞增殖很可能与其含有抗氧化氨基酸有关。由表1可知,膜分离NEH 4 个组分的甘氨酸与脯氨酸质量分数最高,这主要来源于罗非鱼皮胶原中的Gly-X-Y结构;因此,甘氨酸与脯氨酸质量分数最高[18]。同时,表1中显示1~5 ku的肽段中,苯丙氨酸、亮氨酸、酪氨酸、赖氨酸、精氨酸、组氨酸的质量分数都显著性高于其他3 种肽段(P<0.05),膜分离NEH组分的细胞实验结果显示,分子质量在1~5 ku的肽段促进HaCaT细胞增殖效果最好,这可能与该肽中上述几种氨基酸的高质量分数有关。Liu Dasong等[34]的研究发现甘氨酸、脯氨酸以及亮氨酸出现在肽链C端,而组氨酸出现在N端时都表现出高效清除氧自由基活性,并且含酪氨酸的肽具有高的抗氧化活性,究其原因,酪氨酸具有酚基,作为氢供体终止自由基诱导的链式反应。同时林金莺[24]的研究报道碱性氨基酸中的赖氨酸和精氨酸可与不饱和脂肪酸进行反应生成盐,从而抑制脂氧化,表现出好的抗氧化特性,进一步研究发现含组氨酸的肽一般都表现出高抗氧化活性。陈俊等[13]的研究表明,罗非鱼皮胶原肽对HaCaT细胞生长和增殖有促进作用,而主要原因是鱼皮胶原肽具有高的抗氧化活性,通过增强细胞活性从而防止氧化诱导的细胞死亡,而其中起抗氧化关键作用的氨基酸是甘氨酸-酪氨酸。祝婧[35]证实鱼胶原肽中苯丙氨酸和赖氨酸是影响成纤维细胞生长增殖的主要因素之一;李喜艳等[36]也报道赖氨酸对奶牛乳腺上皮细胞增殖起促进作用。因此,相比于膜分离NEH中的其他3 个组分,1~5 ku组分对细胞生长起到良好促进作用,其抗氧化氨基酸亮氨酸(3.35%)、酪氨酸(1.49%)、苯丙氨酸(3.41%)、赖氨酸(4.50%)、组氨酸(1.17%)、精氨酸(10.51%)的质量分数显著高于其他组分,对HaCaT细胞生长和伤口愈合起重要作用。由于氨基酸序列也会在一定程度上影响细胞活性,本研究中分子质量1~5 ku组分含有两组肽成分,其氨基酸组成对抗氧化活性及细胞增殖作用的影响有待进一步研究。
表1 NEH各肽段的氨基酸质量分数
Table1 Amino acid composition of NEH%
本实验研究了罗非鱼皮胶原酶解物对HaCaT细胞增殖的影响,并对胶原酶解物的抗氧化活性与促进细胞生长之间关系进行了探讨。结果表明,NEH有较高的体外抗氧化活性与促进HaCaT细胞增殖能力,膜分离NEH获得的1~5 ku组分促进HaCaT细胞生长最显著,并能在24 h内促进HaCaT细胞划痕处伤口愈合。经氨基酸分析发现,NEH(分子质量1~5 ku)组分抗氧化氨基酸质量分数高于小于1 ku、5~10 ku和大于10 ku组分,罗非鱼皮胶原肽促进上皮细胞的生长机制可能其抗氧化活性有关。
参考文献:
[1] OGAWA M, PORTIER R J, MOODY M W, et al. Biochemical properties of bone and scale collagens isolated from the subtropical fish black drum (Pogonia cromis) and sheepshead seabream(Archosargus probatocephalus)[J]. Food Chemistry, 2004, 88(4): 495-501. DOI:10.1016/j.foodchem.2004.02.006.
[2] ZHUANG Y, SUN L, ZHAO X, et al. Antioxidant and melanogenesisinhibitory activities of collagen peptide from jellyfish (Rhopilema esculentum)[J]. Journal of the Science of Food and Agriculture, 2009,89(10): 1722-1727. DOI:10.1002/jsfa.3645.
[3] YANG J, HO H, CHU Y, et al. Characteristic and antioxidant activity of retorted gelatin hydrolysates from cobia (Rachycentron canadum)skin[J]. Food Chemistry, 2008, 110(1): 128-136. DOI:10.1016/j.foodchem.2008.01.072.
[4] 刘俊丽, 宋淑军, 司少艳, 等. 牛骨胶原蛋白肽促进HOB增殖[J].中国骨质疏松杂志, 2013, 19(7): 703-706; 717. DOI:10.3969/j.issn.1006-7108.2013.07.011.
[5] MORIMURA S, NAGATA H, Y U, et al. Development of an effective process for utilization of collagen from livestock and fish waste[J].Process Biochemistry, 2002, 37(12): 1403-1412. DOI:10.1016/S0032-9592(02)00024-9.
[6] ZENG S K, ZHANG C H, LIN H, et al. Isolation and characterisation of acid-solubilised collagen from the skin of Nile tilapia (Oreochromis niloticus)[J]. Food Chemistry, 2009, 116(4): 879-883. DOI:10.1016/j.foodchem.2009.03.038.
[7] 庄永亮, 张玉锋. 罗非鱼鱼皮抗氧化肽的制备及分离纯化[J]. 昆明理工大学学报(自然科学版), 2014, 39(1): 87-93. DOI:10.3969/j.issn.1007-855x.2014.01.017.
[8] NGO D, QIAN Z, RYU B, et al. In vitro antioxidant activity of a peptide isolated from Nile tilapia (Oreochromis niloticus) scale gelatin in free radical-mediated oxidative systems[J]. Journal of Functional Foods, 2010, 2(2): 107-117. DOI:10.1016/j.jff.2010.02.001.
[9] SUN Liping, ZHANG Yufeng, ZHUANG Yongliang. Antiphotoaging effect and purification of an antioxidant peptide from tilapia(Oreochromis niloticus) gelatin peptides[J]. Journal of Functional Foods, 2013, 5(1): 154-162. DOI:10.1016/j.jff.2012.09.006.
[10] PATI F, DATTA P, ADHIKARI B, et al. Collagen scaffolds derived from fresh water fish origin and their biocompatibility[J]. Journal of Biomedical Materials Research, 2012, 100(4): 1068-1079.DOI:10.1002/jbm.a.33280.
[11] TANAKA M, KOYAMA Y, NOMURA Y. Effects of collagen peptide ingestion on UV-B-induced skin damage[J]. Bioscience,Biotechnology, and Biochemistry, 2009, 73(4): 930-932. DOI:10.1271/bbb.80649.
[12] YAAR M, GILCHREST B A. Photoageing:mechanism, prevention and therapy[J]. British Journal of Dermatology, 2007, 157(5): 874-887.DOI:10.1111/j.1365-2133.2007.08108.x.
[13] 陈俊, 叶燕军, 王宝周, 等. 鱼皮胶原肽对人皮肤角质细胞生长的影响[J]. 现代食品科技, 2015, 31(3): 49; 55-59. DOI:10.13982/j.mfst.1673-9078.2015.3.010.
[14] BOUKAMP P, PETRUSSEVSKA R T, BREITKREUTZ D. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line[J]. The Journal of Cell Biology, 1988, 106: 761-771. DOI:10.1083/jcb.106.3.761.
[15] 骆丹, 林向飞, 徐晶, 等. 3 种中药对中波紫外线辐射HaCaT细胞的干预及其机制[J]. 中国药理学通报, 2007, 23(6): 750-755.DOI:10.3321/j.issn:1001-1978.2007.06.013.
[16] ZHAO Xin, LANG Qi, YILDIRIMER L, et al. Photocrosslinkable gelatin hydrogel for epidermal tissue engineering[J]. Advanced Healthcare Materials, 2016, 5(1): 108-118. DOI:10.1002/adhm.201500005.
[17] ZHOU Tian, WANG Nanping, XUE Yang, et al. Electrospun tilapia collagen nanofibers accelerating wound healing via inducing keratinocytes proliferation and differentiation[J]. Colloids and Surfaces B: Biointerfaces, 2016, 143: 415-422. DOI:10.1016/j.colsurfb.2016.03.052.
[18] KIEW P L, MASHITAH M D. Isolation and characterization of collagen from the skin of Malaysian catfish (Hybrid Clarias sp.)[J].Journal of the Korean Society for Applied Biological Chemistry, 2013,56(4): 441-450. DOI:10.1007/s13765-013-3114-9.
[19] 张玉, 李洪军, 窦华亭, 等. 川皮苷体外抗氧化活性及对肿瘤细胞生长抑制作用[J]. 食品科学, 2015, 36(19): 233-237. DOI:10.7506/spkx1002-6630-201519042.
[20] GAUTAM S, CHOU C, DINDA A K, et al. Fabrication and characterization of PCL/gelatin/chitosan ternary nanofibrous composite scaffold for tissue engineering applications[J]. Journal of Materials Science, 2014, 49(3): 1076-1089. DOI:10.1007/s10853-013-7785-8.
[21] TURK H F, MONK J M, FAN Y Y, et al. Inhibitory effects of omega-3 fatty acids on injury-induced epidermal growth factor receptor transactivation contribute to delayed wound healing[J]. AJP: Cell Physiology, 2013, 304(9): 905-917. DOI:10.1152/ajpcell.00379.2012.
[22] 张晶, 张怡一, 徐斐然, 等. 菜籽多肽体外和细胞内抗氧化性评价及氨基酸分析[J]. 食品科学, 2016, 37(13): 36-41. DOI:10.7506/spkx1002-6630-201613007.
[23] 陈日春. 鲢鱼鱼鳞胶原蛋白肽的制备及其抗氧化活性的研究[D].福州: 福建农林大学, 2013: 56-62.
[24] 林金莺. 火麻仁蛋白水解及其抗氧化肽的研究[D]. 广州: 华南理工大学, 2010: 65-77.
[25] KIM S K, KIM Y T, BYUN H G, et al. Purification and characterization of antioxidative peptides from bovine skin[J]. Journal of Biochemistry and Molecular Biology, 2001, 34(3): 219-224.
[26] WANG Yaowen, REN Jihao, XIA Kun, et al. Effect of mitomycin on normal dermal fibroblast and HaCat cell: an in vitro study[J].Journal of Zhejiang University: Science B, 2012, 13(12): 997-1005.DOI:10.1631/jzus.B1200055.
[27] OHARA H, ICHIKAWA S, MATSUMOTO H, et al. Collagen-derived dipeptide, proline-hydroxyproline, stimulates cell proliferation and hyaluronic acid synthesis in cultured human dermal fibroblasts[J].Journal of Dermatology, 2010, 37(4): 330-338. DOI:10.1111/j.1346-8138.2010.00827.x.
[28] CHUNG J H, HAN J H, HWANG E J, et al. Dual mechanisms of green tea extract-induced cell survival in human epidermal keratinocytes[J].FASEB Journal, 2003, 17(11): 1913-1915. DOI:10.1096/fj.02-0914fje.
[29] KIM S K, KIM Y T, BYUN H G, et al. Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska pollack skin[J]. Journal of Agricultural and Food Chemistry, 2001, 49(4):1984-1989. DOI:10.1021/jf000494j.
[30] MENDIS E, RAJAPAKSE N, BYUN H, et al. Investigation of jumbo squid (Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects[J]. Life Sciences, 2005, 77(17): 2166-2178.DOI:10.1016/j.lfs.2005.03.016.
[31] 孟文霞, 刘传霞, 高庆红. TGF-β1对口腔癌相关成纤维细胞迁移特性的影响[J]. 口腔医学研究, 2013, 28(8): 707-709. DOI:10.13701/j.cnki.kqyxyj.2013.08.006.
[32] HAAPASALMI K, ZHANG K, TONNESEN M, et al. Keratinocytes in human wounds express αvβ6 integrin[J]. Journal of Investigative Dermatology, 1996, 106(1): 42-48.
[33] FRIEDL P, BROCKER E B. The biology of cell locomotion within three-dimensional extracellular matrix[J]. Cellular and Molecular Life Sciences, 2000, 57(1): 41-64. DOI:10.1007/s000180050498.
[34] LIU Dasong, NIKOO M, BORAN G, et al. Collagen and gelatin[J].The Annual Review of Food Science and Technology, 2015, 6: 527-557. DOI:10.1146/annurev-food-031414-111800.
[35] 祝婧. 海鲈鱼胶原蛋白肽的制备分离及对皮肤伤口的愈合作用[D].福州: 福建农林大学, 2014: 46-63.
[36] 李喜艳, 王加启, 魏宏阳, 等. MTT比色法检测赖氨酸、蛋氨酸对体外培养的奶牛乳腺上皮细胞增殖的影响[J]. 生物技术通报, 2010(3):143-148. DOI:10.13560/j.cnki.biotech.bull.1985.2010.03.039.
Impact of Tilapia Skin Hydrolysates on HaCaT Cell Growth
JIANG Sufeng1, ZHAO Mouming1, JIANG Hongrui1,*, LIU Xiaoling1, BAI Yang2
(1. Light Industry and Food Engineering College, Guangxi University, Nanning 530004, China;2. Guangxi Giant Bio-Tech Company, Nanning 530000, China)
Abstract:In the present study, the effect of tilapia skin hydrolysates (TSCH) produced with neutral enzyme (NE), alkaline enzyme and pancreatin enzyme on the growth of human skin keratinocyte HaCaT cells was investigated as well as the relationship between antioxidant capacity and cell growth stimulation of TSCH. Results showed that neutral enzymatic hydrolysate (NEH) had significant antioxidant capacity in vitro and cell growth-promoting effect (P < 0.05). When treated by NEH (1–5 ku) at 25 mg/mL, the proliferation of HaCaT cells was most significantly promoted when compared with other hydrolysates (P < 0.05), and NEH also could promote cell scratch healing ((81.10 ± 5.77)%) after treatment for 24 h. Two major peptide components (1–5 ku) were detected from NEH by Sephadex G-25 gel filtration chromatography and amino acid composition analysis. The contents of antioxidant amino acids such as phenylalanine, leucine, tyrosine, lysine,arginine and histidine in NEH 1–5 ku were much higher than those in other molecular mass amino acid residues (P < 0.05).The study suggests that the growth-promoting effect of NEH from tilapia skin collagen on HaCaT cells may be related to the significant amount of antioxidant amino acid residues in the peptides.
Keywords:tilapia skin; collagen hydrolysate; antioxidant activity; cell growth; HaCaT cell
DOI:10.7506/spkx1002-6630-201813033
收稿日期:2017-01-15
基金项目:广西自然科学基金项目(2016GXNSFEA380003);南宁市科学研究与技术开发计划项目(20171120-4);广西科技重大专项(桂科AA17204075)
第一作者简介:姜速峰(1990—),男,硕士研究生,研究方向为食品质量与安全。E-mail:942012218@qq.com
*通信作者简介:江虹锐(1984—),女,副教授,博士,研究方向为海洋蛋白资源的开发与利用。E-mail:hrjiang@gxu.edu.cn
中图分类号:TS254.9
文献标志码:A
文章编号:1002-6630(2018)13-0222-07
引文格式:姜速峰, 赵谋明, 江虹锐, 等. 罗非鱼皮胶原酶解物对HaCaT细胞生长的影响[J]. 食品科学, 2018, 39(13): 222-228.
DOI:10.7506/spkx1002-6630-201813033. http://www.spkx.net.cn
JIANG Sufeng, ZHAO Mouming, JIANG Hongrui, et al. Impact of tilapia skin hydrolysates on HaCaT cell growth[J]. Food Science, 2018, 39(13): 222-228. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201813033. http://www.spkx.net.cn