
刘艳双1,2,侯 焘1,2,郭丹郡1,2,刘维维1,2,石 文1,2,何 慧1,2,*
(1.华中农业大学食品科学与技术学院,湖北 武汉 430070;2.环境食品学教育部重点实验室,湖北 武汉 430070)
摘 要:目的:研究胶原肽(collagen peptides,CPs)对小鼠的促钙吸收作用。方法:采用小鼠低钙膳食模型法,以昆明雄性小鼠为实验动物,设置正常组、低钙模型组、碳酸钙组、CPs低剂量(500 mg/kg mb+CaCO3)、高剂量(1 000 mg/kg mb+CaCO3)组、酪蛋白磷酸肽对照组,连续灌胃6 周,考察小鼠血清钙、磷、碱性磷酸酶(alkaline phosphatase,ALP)活力、钙吸收率、各项骨指标及骨微观结构、骨小梁形态变化。结果:CPs低、高剂量组小鼠的ALP活力显著低于低钙模型组(P<0.05),其骨长度、干质量指数、骨钙含量、骨矿物密度(bone mineral density,BMD)、骨矿物含量(bone mineral content,BMC)均显著高于低钙模型组(P<0.05),CPs低剂量组可使喂食低钙饲料的小鼠的各项指标达到正常组小鼠的水平。CPs低剂量组小鼠的ALP活力显著低于碳酸钙组(P<0.05),其骨钙含量、BMD、BMC均显著高于碳酸钙组(P<0.05),提示补充碳酸钙的同时补充CPs,其促钙吸收效果更好。结论:CPs可提高小鼠钙吸收率,增加骨小梁数目及强度,促进骨骼生长,从而能有效促进钙的吸收。
关键词:鲫鱼皮;胶原肽;钙吸收;低钙膳食模型;骨微观结构
胶原肽(collagen peptides,CPs)是胶原蛋白或明胶经酶解后的分子质量几百至几千Da不等的产物,具有美容[1-2]、降血压[3-5]、抗癌[5]、抗氧化[6-9]、促进骨代谢[10-12]、伤口愈合[13]、抑菌[14]等多种生理功能。贡雯玉等[15]采用高效液相色谱法检测鲫鱼(Carassius auratus)不同组织中胶原蛋白含量,结果显示鱼皮、鱼肉组织中胶原蛋白含量分别为106.62、24.75 mg/g,可见以鲫鱼皮为原料提取胶原蛋白,制备生物活性胶原肽,既可以实现下脚料的再利用,又可以满足人们对胶原蛋白安全性和产量的需求。
我国营养调查结果表明,国民钙摄入量普遍偏低,每天约为400~500 mg,仅达到推荐量的50%左右。仅仅通过提高饮食中钙的绝对含量,仍不能有效改善缺钙现象。在补钙的同时增加饮食中促钙吸收因子的摄入,提高机体对钙的有效吸收,将是有效之策。VD[16]、酪蛋白磷酸肽(casein phosphopeptides,CPPs)[17-18]、卵黄高磷蛋白肽(phosvitin peptides,PPPs)[19]、菊粉[20]等都是已知的具有良好促钙吸收作用的生物活性物质。近年来,越来越多的研究倾向于从食品加工下脚料中提取蛋白用于生物活性肽的制备,如鱼骨[21]和鱼鳞[22]、咸鸭蛋清[23-24]等。成静等[25]以胶原肽螯合钙(200~400 Da小肽)为受试物,通过测定动物实验中血清钙、股骨钙含量及股骨指数,评价胶原肽钙螯合物对缺钙模型小鼠具有补钙功能。分子质量在20 000 Da以下,特别是4 000~6 000 Da的水解明胶能有效改善和抑制骨强度的下降,维持骨的机能,预防骨折,是预防、治疗骨质疏松症的有效成分[26]。鲫鱼是我国国民消费的大众品种,在淡水鱼中营养最为丰富,本实验以昆明小鼠为实验动物建立低钙膳食模型,通过考察血清、骨生物学及骨微观结构,对鲫鱼皮胶原肽促进钙吸收及增加骨密度进行研究,以期为鲫鱼皮下脚料的高值化利用提供依据。
昆明雄性小鼠,3~4 周龄,体质量20~22 g,湖北省动物研究中心提供,实验动物许可证:SCXK(鄂):2015-0018。
CPPs(蛋白质量分数98%) 南京通升食品配料有限公司;血清钙试剂盒、血清磷试剂盒、血清碱性磷酸酶试剂盒 南京建成生物生物有限公司;碳酸钙(钙质量分数36.8%)、盐酸、硝酸、高氯酸(均为分析纯)国药集团化学试剂有限公司。
AL204型电子天平 梅特勒-托利多(上海)仪器有限公司;LGJ-12冷冻干燥机 北京松源华兴科技发展有限公司;DF-101S集热式恒温加热磁力搅拌器巩义市予华仪器有限责任公司;PB-10标准型pH计德国赛多利斯股份公司;Laborota4000旋转蒸发器德国Heidolph公司;板式膜(截留分子质量小于5 kDa)美国Millipore公司;AA-6300C原子吸收分光光度仪日本岛津公司;Exploit数显游标卡尺 开拓工具有限公司;TA.XT.PLUS物性测试仪 英国Stable Micro Systems公司;XR-46双能X射线骨密度仪 美国Norland公司;JEOL JSM-6390/LV扫描电子显微镜 日本NTC公司;Microfuge 20R高速冷冻离心机 贝克曼库尔特商贸(中国)有限公司;DM3000荧光显微镜 徕卡仪器(德国)有限公司。
1.3.1 鲫鱼皮CPs的制备
将胶原蛋白用蒸馏水配制成质量浓度为3 g/100 mL的溶液,沸水浴中加热,并搅拌20 min,冷却后放入恒温水浴搅拌器中,设置温度为50 ℃,调至pH 7.0后,加入复合蛋白酶(加酶量3×103U/g),滴加1 mol/L NaOH溶液使酶解pH值维持在7.0左右,并记录加碱量,酶解3 h后,沸水浴加热10 min,使酶钝化,冷却至室温后,4 000 r/min离心10 min,取上清液。将上述酶解液通过截留分子质量小于5 kDa的超滤膜,将超滤膜透过物旋转蒸发、冷冻干燥,得到分子质量小于5 kDa的胶原肽CPs(用凯氏定氮法测得其质量分数大于90%)。
1.3.2 动物低钙饲料配方
参照美国营养学会AIN-93啮齿类动物纯化饲料配方标准并略作修改,制作小鼠低钙饲料。低钙饲料由南通特洛菲饲料科技有限公司(实验动物饲料高科技平台)制作,配方为(以质量分数计):酪蛋白21.85%、玉米淀粉48.10%、蔗糖10.00%、玉米油5.00%、纤维素5.00%、半胱氨酸0.30%、氯化胆碱0.25%、矿物盐混合物0.35%(含0.1%钙)、维生素混合物1.00%。
1.3.3 动物分组及给药
4 周龄昆明雄性小鼠60 只,按体质量随机分成6 组,分别为正常组、低钙模型组、碳酸钙组、CPs低剂量组(CPs低+CaCO3)、CPs高剂量组(CPs高+CaCO3)、CPPs对照组(CPPs+CaCO3),适应喂养1 周后,期间自由进食和饮水。实验采取灌胃方式给予各组相应药品。正常组喂食正常饲料(钙质量分数0.5%),其余各组喂食低钙饲料(钙质量分数0.1%),各组碳酸钙剂量参照人体每日推荐摄入量800 mg/60 kg mb(13.33 mg/kg mb)的10 倍,设置为133.3 mg/kg mb,选择CPPs、CPs低、高剂量分别为500、500、1 000 mg/kg mb。
1.3.4 检测指标及方法
实验期间,两天记录一次小鼠体质量,6 周实验期满后,禁食12 h,眼球取血,4 ℃条件下3 500 r/min离心分离血清,待测血清指标,脱颈椎处死。实验至第5 周末,将小鼠移入代谢笼进行钙代谢实验。期间定时灌胃,准确记录饲料摄入量,收集粪便冻干称质量。粪钙量采用原子吸收分光光谱法测定。钙的摄入量、表观吸收率分别按照公式(1)、(2)计算。

血清生化指标测定:血清钙、血清磷和碱性磷酸酶含量均按照试剂盒说明书要求的条件和程序进行测定。
股骨、胫骨指标测定:取出两侧股骨、胫骨,去除肌肉及软组织后,测量长度及骨钙含量,用浸泡过生理盐水的纱布包裹骨头,-20 ℃保存备用。骨矿物密度(bone mineral density,BMD)及骨矿物含量(bone mineral content,BMC)采用XR46双能X射线骨密度仪测定。
骨微观结构观察:取各组小鼠处理后的胫骨烘干至恒质量,扫描电子显微镜下观察胫骨表面结构。
骨小梁形态学观察:剥离小鼠右侧股骨,将附着的肌肉和筋膜剔除干净,然后浸入4%的多聚甲醛中固定,固定后逐级脱水,硝酸法脱钙,石蜡切片,苏木精-伊红(hematoxylin-eosin,HE)染色,100 倍光学显微镜观察胫骨组织形态结构。
所有数据以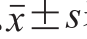 表示,采用SPSS 17.0软件对数据进行Duncan多重比较检验。以P<0.05为有显著性差异。
表示,采用SPSS 17.0软件对数据进行Duncan多重比较检验。以P<0.05为有显著性差异。
表1 CPs对小鼠血清生化指标的影响(n=6)
Table1 Effects of CPs on serum biochemical parameters of mice (n= 6)

由表1可知,与模型组相比,正常组、碳酸钙组、CPs低剂量组、CPs高剂量组和CPPs对照组血清钙、血清磷含量均无显著差异(P>0.05);但CPs低剂量组、CPs高剂量组、CPPs组和碳酸钙组血清碱性磷酸酶(alkaline phosphatase,ALP)活力却显著降低(P<0.05);且CPs低剂量组血清ALP活力显著低于碳酸钙组(P<0.05)。
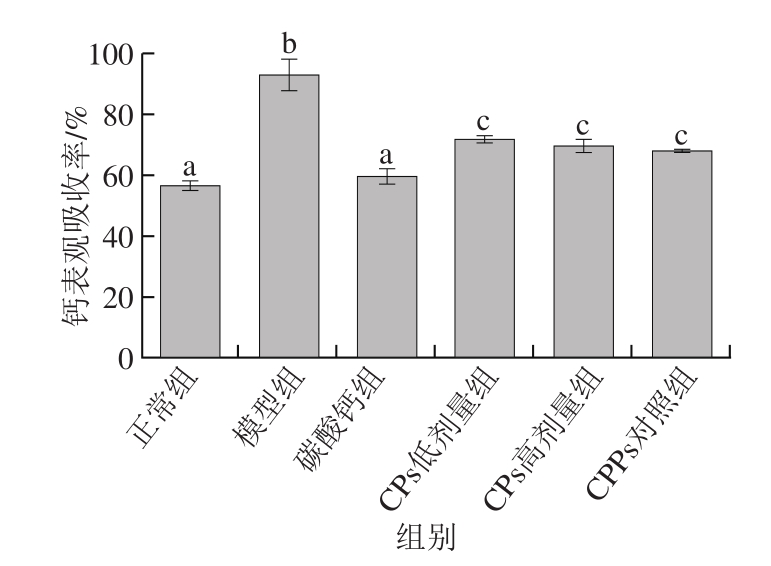
图1 各组小鼠钙表观吸收率
Fig. 1 Apparent calcium absorption rate of mice
从图1可知,由于低钙模型组处于钙缺乏状态,其钙表观吸收率显著高于正常组、碳酸钙组、CPs低剂量组、CPs高剂量组、CPPs对照组(P<0.05);CPs低剂量组、CPs高剂量组、CPPs对照组的钙表观吸收率显著高于正常组、碳酸钙组(P<0.05)。以上结果表明,补充碳酸钙、CPs、CPPs可增加钙在小鼠体内的表观吸收率,补充CPs效果与公认补钙肽CPPs相比无显著性差异(P>0.05);CPs低剂量组、CPs高剂量组其钙表观吸收率显著高于碳酸钙组(P<0.05)。
表2 CPs对小鼠股骨、胫骨干质量指数和长度的影响(n=6)
Table2 Effect of CPs on length and dry mass index of femurs and tibiae in mice (n= 6)
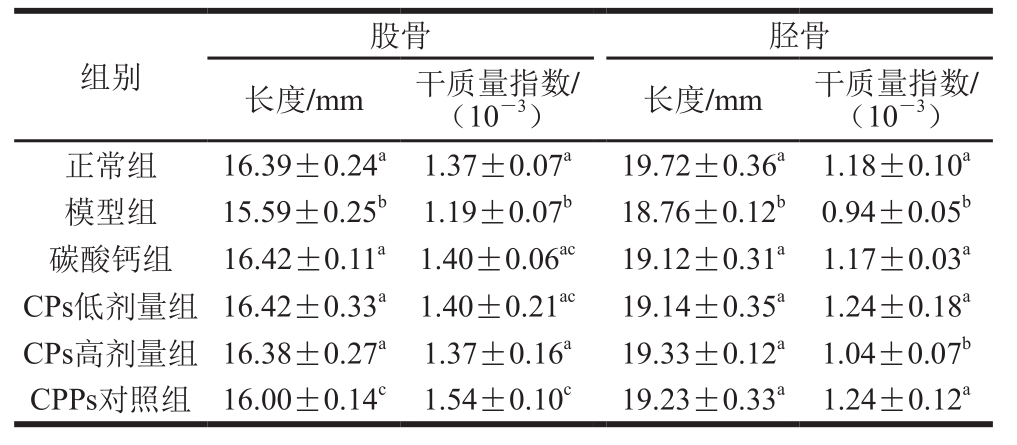
由表2可知,与正常组相比,模型组的股骨、胫骨长度和干质量指数显著降低(P<0.05);CPs低剂量组各指标无显著性差异(P>0.05)。CPs低剂量组其胫骨干质量指数显著高于CPs高剂量组(P<0.05);其股骨、胫骨干质量指数、胫骨长度与CPPs对照组相比,均无显著性差异(P>0.05),但股骨长度却显著高于CPPs对照组(P<0.05),提示低剂量CPs组比同剂量的CPPs补钙效果略好。
表 3 CPs对小鼠股骨、胫骨骨钙含量、BMD、BMC的影响(n= 6)
Table3 Effect of CPs on calcium content, BMD and BMC of femurs and tibiae in mice (n= 6)
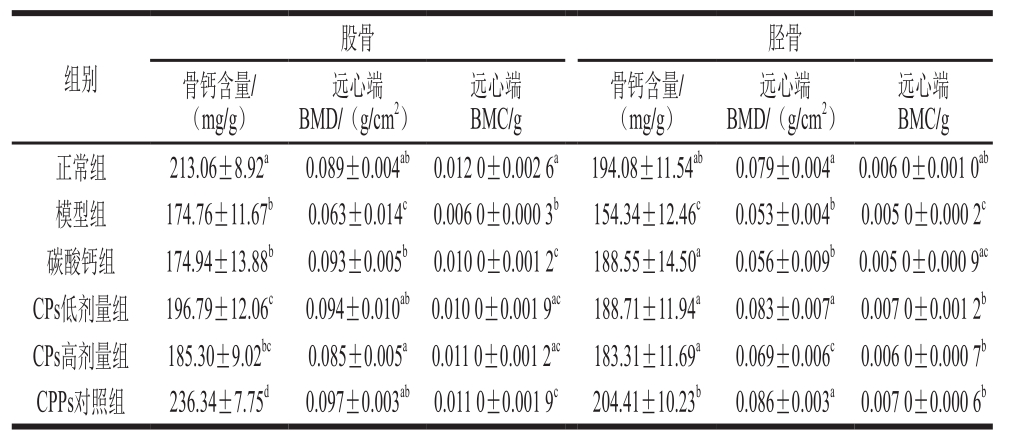
由表3可知,与模型组相比,正常组、CPs低剂量组、CPPs对照组其股骨钙含量、远心端BMD、BMC显著提高(P<0.05);与碳酸钙组相比,CPs低剂量组股骨骨钙含量显著提高(P<0.05)。与模型组相比,正常组、CPs低剂量组、CPs高剂量组、CPPs对照组胫骨钙含量、远心端BMD、BMC显著提高(P<0.05)。与CPs高剂量组相比,CPs低剂量组胫骨远心端BMD显著增加(P<0.05);与CPPs对照组相比,CPs低、高剂量组远心端BMC无显著性差异(P>0.05)。
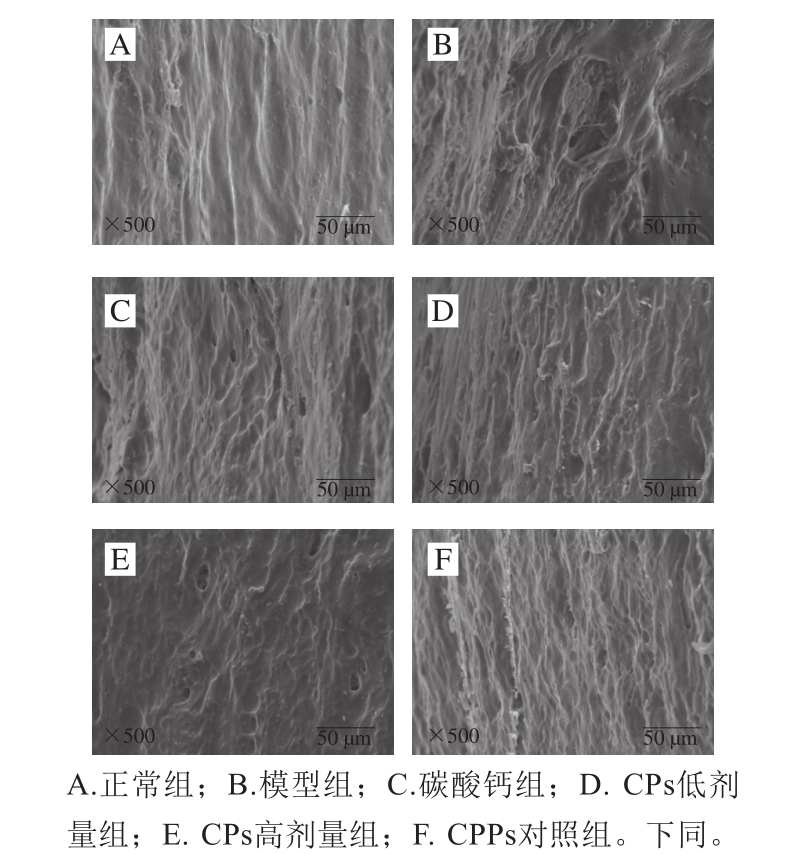
图2 各组小鼠胫骨扫描电子显微镜图(×500)
Fig. 2 Scanning electron microscope of tibiae in mice (× 500)
从图2可以看出,正常组在电子显微镜下表面几乎无明显孔隙,呈较浅沟壑状。与正常组相比,模型组骨骼表面疏松多孔、孔径较大,碳酸钙组、CPs低剂量组、CPs高剂量组、CPPs对照组疏松情况明显改善,孔径变小、排列紧密,其中CPs高剂量组表面平整,CPs低剂量组表面与正常组较为相似。

图3 各组小鼠股骨HE染色(×100)
Fig. 3 Hematoxylin-eosin staining of femurs in mice (× 100)
从图3可以看出,正常组单位面积骨小梁数目多且紧密排列,无明显溶解断裂现象;模型组单位面积骨小梁数目明显减少,断裂溶解严重;与模型组相比,碳酸钙组、CPs低剂量组、CPs高剂量组、CPPs对照组骨小梁数目增加,有序紧密连接,无明显断裂现象。以上结果表明,CPs可以增加骨小梁数目及强度,从而促进骨骼生长。
本实验以昆明雄性小鼠为研究对象,在成功建立小鼠缺钙模型的基础上,研究CPs对小鼠钙吸收的促进作用。
喂食低钙饲料小鼠的血清ALP活力、骨长度、骨干质量指数、骨钙含量、远心端BMD、BMC含量均显著低于正常组,表明小鼠缺钙模型构建成功。钙的吸收主要发生在小肠,小肠吸收的钙占钙吸收总量的90%[27],通过饮食摄取的钙不同时,机体对钙的吸收率也会不同;当机体处于钙缺乏状态下,钙的吸收率会显著提高。本研究中小鼠钙代谢实验表明,低钙组小鼠处于严重钙缺乏状态,故其钙吸收率显著高于其他各组。CPs低、高剂量组钙吸收率显著高于正常组和碳酸钙组,表明灌胃无机钙与食物摄取钙的钙吸收效果相当,而同时灌胃CPs时,其钙吸收率显著高于仅灌胃无机钙的碳酸钙组,表明CPs可以促进钙在肠道中的吸收,从而达到促钙吸收的效果。股骨指数可以反映骨骼生长。模型组小鼠处于钙缺乏状态,骨长度、骨干质量指数显著低于正常组、碳酸钙组、CPs低、高剂量组和CPPs组;血清钙与骨钙水平维持动态平衡,当血钙出现降低趋势,甲状旁腺激素会促进骨钙释放入血,以维持血钙稳定,因此内环境血钙较为稳定。血清磷参与内环境的缓冲体系,故本实验中各组之间血清钙、磷无显著差异。与此同时骨中成骨细胞活跃,合成血清ALP,使之释放进入血液,此时会发生高骨转化现象,表现为血清ALP活力的升高、骨钙、远心端BMD、BMC的降低。扫描电子显微镜、HE染色结果可以看出模型组小鼠骨表面疏松多孔,骨小梁变细且出现明显断裂现象,正常组与CPs组、CPPs组情况有明显改善。从CPs低、高剂量组各指标比较可以看出,低剂量组促钙吸收效果优于高剂量组,但组间无显著性差异,这可能是由于CPs通过与钙形成螯合物防止钙在小肠中的沉积从而达到促钙吸收效果,而当CPs浓度过高时,由于钙离子已全部参与反应,肽的螯合率可能会有所下降所致。
由以上分析可得出如下结论:CPs通过提高钙在小肠的吸收率,增加骨钙含量、远心端BMD、BMC,从而达到促钙吸收作用;同时增加骨小梁强度,促进钙在骨骼上的沉积,改善低钙膳食引起的骨质疏松。
参考文献:
[1] 王静凤, 王奕, 崔凤霞, 等. 鱿鱼皮胶原蛋白多肽对B16黑素瘤细胞黑素合成的影响[J]. 中国药理学通报, 2007, 23(9): 1181-1184.DOI:10.3321/j.issn:1001-1978.2007.09.016.
[2] 成静, 陈栋梁, 江雪琼, 等. 胶原三肽对B16黑素瘤细胞黑素合成的影响[J]. 中国美容医学, 2011, 20(6): 939-941. DOI:10.3969/j.issn.1008-6455.2011.06.023.
[3] ALEMÁN A, GIMÉNEZ B, PÉREZ-SANTIN E, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry, 2011, 125: 334-341. DOI:10.1016/j.foodchem.2010.08.058.
[4] FU Y, YOUNG F, RASMUSSEN M K, et al. Angiotensin I-converting enzyme-inhibitory peptides from bovine collagen: insights into inhibitory mechanism and transepithelial transport[J]. Food Research International,2016, 89(1): 373-381. DOI:10.1016/j.foodres.2016.08.037.
[5] ALEMAN A, PEREZ-SANTIN E, BORDENAVE-JUCHEREAU S,et al. Squid gelatin hydrolysates with antihypertensive, anticancer and antioxidant activity[J]. Food Research International, 2011, 44: 1044-1051. DOI:10.1016/j.foodres.2011.03.010.
[6] JEEVITHAN E, BAO B, BU Y, et al. Type II collagen and gelatin from silvertip shark (Carcharhinus albimarginatus) cartilage: isolation,purification, physicochemical and antioxidant properties[J]. Marine Drugs, 2014, 12(7): 3852-3873. DOI:10.3390/md12073852.
[7] DING J F, LI Y Y, XU J J, et al. Study on effect of jellyfish collagen hydrolysate on anti-fatigue and anti-oxidation[J]. Food Hydrocolloids,2011, 25(5): 1350-1353. DOI:10.1016/j. foodhyd.2010.12.013.
[8] LI Z R, WANG B, CHI C F, et al. Influence of average molecular weight on antioxidant and functional properties of cartilage collagen hydrolysates from Sphyrna lewini, Dasyatis akjei and Raja porosa[J].Food Research International, 2013, 51(1): 283-293. DOI:10.1016/j.foodres.2012.12.031.
[9] 丁进锋, 苏秀榕, 李妍妍, 等. 海蜇胶原蛋白肽的降血脂及抗氧化作用的研究[J]. 天然产物研究与开发, 2012, 24(3): 362-365.DOI:10.3969/j.issn.1001-6880.2012.03.019.
[10] CÚNEO F, COSTA-PAIVA L, PINTO-NETO A M, et al. Effect of dietary supplementation with collagen hydrolysates on bone metabolism of postmenopausal women with low mineral density[J].Maturitas, 2010, 65: 253-257. DOI:10.1016/j.maturitas.2009.10.002.
[11] GUILLERMINET F, BEAUPIED H, FABIEN-SOULÉV, et al.Hydrolyzed collagen improves bone metabolism and biomechanical parameters in ovariectomized mice: an in vitro and in vivo study[J].Bone, 2009, 46(3): 827-834. DOI:10.1016/j.bone.2009.10.035.
[12] WU J, FUJIOKA M, SUGIMOTO K, et al. Assessment of effectiveness of oral administration of collagen peptide on bone metabolism in growing and mature rats[J]. Journal of Bone and Mineral Metabolism,2004, 22(6): 547-553. DOI:10.1007/s00774-004-0522-2.
[13] 张召锋, 戴小倩, 丁叶, 等. 海洋胶原肽促进大鼠术后伤口愈合的实验研究[J]. 中国保健营养, 2013(11): 71-73.
[14] ENNAAS N, HAMMAMI R, GOMAA A, et al. Collagencin, an antibacterial peptide from fish collagen: activity, structure and interaction dynamics with membrane[J]. Biochemical and Biophysical Research Communications, 473(2): 642-647. DOI:10.1016/j.bbrc.2016.03.121.
[15] 贡雯玉, 卞欢, 吴海虹, 等. 高效液相色谱法检测鲫鱼不同组织中的胶原蛋白含量[J]. 食品科学, 2015, 36(14): 65-69. DOI:10.7506/spkx1002-6630-201514013.
[16] DE BARBOZA G D, GUIZZARDI S, DE TALAMONI N T.Molecular aspects of intestinal calcium absorption[J]. World Journal of Gastroenterology, 2015, 21(23): 7142. DOI:10.3748/wjg.v21.i23.7142.
[17] COSENTINO S, GRAVAGHI C, DONETTI E, et al.Caseinphosphopeptide-induced calcium uptake in human intestinal cell lines HT-29 and Caco2 is correlated to cellular differentiation[J].Journal of Nutritional Biochemistry, 2010, 21(3): 247-254.DOI:10.1016/j. jnutbio.2008.12.016.
[18] COSENTIN S, DONIDA B M, MARASCO E, et al. Calcium ions enclosed in casein phosphopeptide aggregates are directly involved in the mineral uptake by differentiated HT-29 cells[J]. International Dairy Journal, 2010, 20(11): 770-776. DOI:10.1016/j.idairyj.2010.06.002.
[19] CHOI I, JUNG C, CHOI H, et al. Effectiveness of phosvitin peptides on enhancing bioavailability of calcium and its accumulation in bones[J]. Food Chemistry, 2005, 93(4): 577-583. DOI:10.1016/j.food chemistry.2004.10.028.
[20] WANG Y, ZENG T, WANG S E, et al. Fructo-oligosaccharides enhance the mineral absorption and counteract the adverse effects of phytic acid in mice[J]. Basic Nutritional Investigation, 2010, 26(3):305-311. DOI:10.1016/j.nut.2009.04.014.
[21] PENG Z, HOU H, ZHANG K, et al. Effect of calcium-binding peptide from Pacific cod (Gadus macrocephalus) bone on calcium bioavailability in rats[J]. Food Chemistry, 2017, 221: 373-378.DOI:10.1016/j.food chemistry.2016.10.078.
[22] 朱俊颖, 王耀松, 赵黎明, 等. 复合酶法制备高纯度鱼基质胶原蛋白肽[J]. 中国食品学报, 2015, 15(12): 47-54. DOI:10.16429/j.1009-7848.2015.12.007.
[23] ZHAO N N, HU J, HOU T, et al. Effects of desalted duck egg white peptides and their products on calcium absorption in rats[J]. Journal of Functional Foods, 2014, 8: 234-242. DOI:10.1016/j.jff.2014.03.022.
[24] HOU T, WANG C, MA Z L, et al. Desalted duck egg white peptides:promotion of calcium uptake and structure characterization[J].Journal of Agriculture Food Chemistry, 2015, 63(37): 8170-8176.DOI:10.1021/acs.jafc.5b03097.
[25] 成静, 陈栋梁, 倪萌, 等. 胶原肽螯合钙的吸收实验研究[J]. 食品科技, 2012(5): 64-67. DOI:10.13684/j.cnki.spkj.2012.05.061.
[26] KAWASHIMA S. Osteoprosis preventive and treatment agent: JP11-321932A[P]. 1999.
[27] BRONNER F. Recent developments in intestinal calcium absorption[J]. Nutrition Reviews, 2009, 67(2): 109-113. DOI:10.1111/j.1753-4887.2008.00147.x.
Effect of Collagen Peptides from Skin of Carassius auratus on Promoting Calcium Absorption in Mice
LIU Yanshuang1,2, HOU Tao1,2, GUO Danjun1,2, LIU Weiwei1,2, SHI Wen1,2, HE Hui1,2,*
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;2. Key Laboratory of Environment Correlative Dietology, Ministry of Education, Wuhan 430070, China)
Abstract:This study was designed to investigate the effect of collagen peptides (CPs) on calcium absorption in mice. The animals were randomly divided into normal control group, low calcium model group, calcium carbonate (CaCO3) group,low- (500 mg/kg mb+ CaCO3) and high-dose (1 000 mg/kg mb+ CaCO3) CPs treatment groups and casein phosphopeptides(CPPs) control group. After 6 weeks of oral administration, the serum levels of calcium, phosphorus and alkaline phosphatase (ALP), calcium absorption rate, bone indices, bone microstructure and trabecular bone morphological changes were measured. The results showed that ALP activity of the CPs treatment groups was significantly lower than that of the low calcium model group (P < 0.05), while bone length, dry mass index, bone calcium content, bone mineral density (BMD),and bone mineral content (BMC) were significantly higher (P < 0.05). CPs at low dose could reverse almost all indexes of the low calcium model group to normal. We observed a significant decrease in ALP activity and a significant increase in bone calcium content, BMD and BMC for the low dose CPs group compared with the CaCO3group (P < 0.05), suggesting that supplementation of both calcium carbonate and CPs could promote calcium absorption and improve bone microstructure and trabecular morphology. Therefore, CPs could increase calcium absorption rate by increasing the number and intensity of trabecular bone and promoting bone growth.
Keywords:Carassius auratus skin; collagen peptides; calcium absorption; calcium deficiency model; bone microstructure
DOI:10.7506/spkx1002-6630-201813036
收稿日期:2017-01-19
第一作者简介:刘艳双(1993—),女,硕士研究生,研究方向为食品化学。E-mail:ysliu@webmail.hzau.edu.cn
*通信作者简介:何慧(1960—),女,教授,博士,研究方向为食品化学。E-mail:hehui@mail.hzau.edu.cn
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2018)13-0241-05
引文格式:刘艳双, 侯焘, 郭丹郡, 等. 鲫鱼皮胶原肽对小鼠的促钙吸收作用[J]. 食品科学, 2018, 39(13): 241-245.
DOI:10.7506/spkx1002-6630-201813036. http://www.spkx.net.cn
LIU Yanshuang, HOU Tao, GUO Danjun, et al. Effect of collagen peptides from skin of Carassius auratus on promoting calcium absorption in mice[J]. Food Science, 2018, 39(13): 241-245. (in Chinese with English abstract)
DOI:DOI:10.7506/spkx1002-6630-201813036. http://www.spkx.net.cn