表1 梯度洗脱程序
Table1 Gradient elution program

张新笑1,章 彬1,2,卞 欢1,王道营1,吴满刚2,孙芝兰1,*,诸永志1,*,徐为民1,3
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.扬州大学食品科学与工程学院,江苏 扬州 225127;3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
摘 要:为研究不同体积分数二氧化碳气调包装对冷鲜鸡保鲜效果的影响,以辐照灭菌后接种荧光假单胞菌为103CFU/g左右的冷鲜鸡胸肉为原料,设置各组气调比例:M1组(V(CO2)∶V(N2)=0∶100)、M2组(V(CO2)∶V(N2)=20∶80)、M3组(V(CO2)∶V(N2)=40∶60)、M4组(V(CO2)∶V(N2)=60∶40),以托盘包装作为对照,在(4±1)℃贮藏条件下测定气调包装盒的凹陷程度、荧光假单胞菌总数、pH值、挥发性盐基氮和腐胺含量的变化。结果表明:荧光假单胞菌总数、挥发性盐基氮和腐胺含量随着贮藏时间延长而上升,随二氧化碳体积分数的升高而下降;凹陷程度随着贮藏时间的延长及二氧化碳体积分数的升高而升高,即M4组气调包装盒的凹陷程度显著高于其他3 组(P<0.05),影响产品的外观。M2组的气调包装盒的凹陷程度和腐胺含量与M3组无显著性差异(P>0.05),在贮藏9~12 d之间,挥发性盐基氮含量也与M3组无显著差异(P>0.05),能达到同样的保鲜效果。此外,同体积的二氧化碳的成本高于氮气。整体来看,在(4±1)℃贮藏条件下,20%~40%体积分数的二氧化碳气调包装能抑制冷鲜鸡胸肉中荧光假单胞菌的生长繁殖。
关键词:冷鲜鸡;气调包装;二氧化碳;货架期;荧光假单胞菌
冷鲜鸡指检疫后的活鸡屠宰后迅速冷却,使鸡胴体中心温度保持在0~4 ℃,然后进行分割、修整、包装,并在后续的贮存、运输和销售过程中始终保持在0~4 ℃范围内的新鲜鸡[1]。相比热鲜鸡而言,冷鲜鸡由于温度迅速降低而使肌肉僵直程度减弱,再经过充分的解僵成熟过程,肉质变得柔软、有弹性,并且具有滋味鲜美、安全卫生、营养价值高等优点[2]。近年来动物性H7N9流感的爆发,导致我国鸡肉消费结构发生变化,由传统的活鸡交易方式转变为定点屠宰,冷鲜上市。加之消费者消费观念的转变、政府相关规定的完善、食品企业的转型升级,冷鲜鸡的市场需求不断增加。然而,目前市售的冷鲜鸡主要采用保鲜膜/托盘等相对简单的包装方式,方法单一且保鲜效果不佳,落后的宰后保鲜技术严重制约着冷鲜鸡的加工和发展[3];因此通过冷鲜鸡的保鲜技术以延长冷鲜鸡的货架期已成为冷鲜鸡市场亟需解决的关键问题,具有重要的社会价值和实际指导意义。
气调包装技术的原理是通过合适的气体组成替换包装内的气体环境,并利用包装材料的阻气性和透气性,使食品始终处于稳定的适宜气体环境中,以抑制微生物的生长繁殖和酶促反应,抑制新陈代谢从而达到延长保质期的目的[4-6]。气调包装技术因能有效保持肉类新鲜且产生的副作用小而备受青睐[7]。以鸡肉为代表的冷鲜白肉类产品对色泽的要求低于红肉类(猪肉、牛肉)产品,因此气调保鲜主要以二氧化碳和氮气为主。Patsias等[8]的研究表明,4 ℃冷藏条件下90% CO2/10% N2的气调包装方式可使冷鲜鸡肉货架期至少延长至20 d,与托盘包装相比延长了6 d以上。Jiménez等[9]发现70% CO2/30% N2、4 ℃的贮藏条件使冷鲜鸡的货架期得到显著延长。Latou等[10]将冷鲜鸡肉在1 g/100 mL的壳聚糖中浸泡1.5 min后,再运用70% CO2/30% N2于4 ℃下进行贮藏,结果使货架期由5 d延长至14 d。Esmer[11]、Gill[12]等研究证实,在低温不利条件下,虽然大多数微生物也能够存活,但是假单胞菌占据主要的生长资源,它通过利用冷鲜肉中的葡萄糖和氨基酸,加速其自身的增殖;此外假单胞菌还破坏冷鲜肉的蛋白质以及胺类物质的代谢产生具有异味的含硫化合物、酯类和酸类,从而造成冷却肉类腐败。假单胞菌是冷鲜鸡肉中的优势腐败菌[13-15],荧光假单胞菌是假单胞菌中的一个典型微生物菌株;因此,重点研究气调包装下冷鲜鸡肉中的荧光假单胞菌显得尤为必要。目前国内外已有大量关于气调包装方式对冷鲜鸡保鲜效果的研究,但不同二氧化碳体积分数的气调包装对冷鲜鸡肉中优势腐败菌株抑制效果的研究较少。
本实验以冷鲜鸡肉源荧光假单胞菌为对象,研究不同比例二氧化碳气调包装对其抑制作用及对冷鲜鸡肉的保鲜效果,通过测定理化及微生物指标进行综合分析,得到较优的二氧化碳气调比例,以期为气调包装在冷鲜鸡肉的保鲜技术推广应用提供理论依据。
实验所用的冷鲜鸡由江苏立华食品有限公司提供。
荧光假单胞菌株是江苏省农业科学院农产品加工研究所实验室从江苏立华食品有限公司冷鲜鸡样品中分离鉴定的典型微生物菌株。
假单胞分离琼脂 北京陆桥技术有限责任公司;丹磺酰氯 上海蓝季生物公司;腐胺标准品 美国Sigma公司;一次性医用无菌注射器 上海楚定分析仪器有限公司;乙腈、丙酮(均为色谱纯) 德国Merck公司;氨水、高氯酸、氢氧化钠、碳酸氢钠、氯化钠等(均为分析纯) 西陇化工股份有限公司。
MAP-FM280型气调包装机系统及气调包装盒上海帆铭机械有限公司;JY5002型电子天平 上海良平仪器仪表有限公司;LDZX-50KBS型灭菌锅 上海申安医疗器械厂;SW-CJ-1FD型无菌操作台 苏州净化设备有限公司;T25型匀浆机 德国IKA公司;HH-4数显恒温水浴锅 国华电器有限公司;OXYBABY6.0便携式气体测定仪 德国WITT公司;HI-9025酸度计 意大利HANNA公司;OM-09无菌均质器 上海欧蒙实业有限公司;SPX-100B-Z生化培养箱 上海博迅实业有限公司设备厂;5424R台式高速冷冻离心机 德国Eppendorf公司;Alliance 2695 液相色谱系统 美国Waters公司。
1.3.1 原料鸡胸肉的制备及预处理
随机选取52 只已屠宰的鸡(日龄为120 d),取胸肉修剪称量,每个无菌袋包装(50±2)g,置于干冰保温箱中密封保存,运至南京喜悦科技股份有限公司,24 kGy剂量辐照后接近无菌状态。取1.1节中分离出的荧光假单胞菌菌株,过夜培养,将菌液活化培养到浓度1×109CFU/mL,稀释到适当浓度后接种到辐照后的肉样中,使最终肉样含菌量为103CFU/g左右,然后进行气调包装。本实验选取4 种二氧化碳体积分数包装,分别为:0%、20%、40%、60%,以保鲜膜封口作为对照,以氮气作为补充气体,即V(CO2)∶V(N2)分别为:0∶100(M1组)、20∶80(M2组)、40∶60(M3组)、60∶40(M4组),气体比例用气体测定仪测定后进行充气包装。将样品置于(4±1)℃贮藏,15 d内每隔3 d分别随机取4 盒样品测定相关指标。
1.3.2 指标测定
1.3.2.1 凹陷程度的测定
将需测量的气调包装盒用吸水纸吸干表面水分后置放于水平位置,测量气调包装盒的盖膜低于气调包装盒水平面最大位置处的深度即为凹陷程度。
1.3.2.2 荧光假单胞菌总数的测定
荧光假单胞菌总数参照GB 4789.2—2010《食品安全国家标准 食品微生物学检验 菌落总数测定》[16]中的方法测定,将温度设置为25 ℃。
1.3.2.3 pH值的测定
pH值的测定参照徐益民[17]的方法,并略作修改。用插入式pH计测量肉的pH值。
1.3.2.4 挥发性盐基氮含量的测定
挥发性盐基氮(total volatile base nitrogen,TVB-N)含量的测定参照GB/T 5009.44—2003《肉与肉制品卫生标准的分析方法》[18]中的微量扩散法进行。
1.3.2.5 腐胺含量的测定
腐胺含量的测定参照Lu Shilin[19]、徐振[20]等的方法,并略作修改。
腐胺标样的制备和柱前衍生:准确称取腐胺标准品50.0 mg,使用0.4 mol/L的高氯酸定容到50 mL,配制成1 mg/mL的标准品原液备用。取以上制备的标准品原液,用0.4 mol/L的高氯酸配制成终质量浓度分别为0.5、1.0、2.0、5.0、10.0、20.0 μg/mL的6 个标准混合液,并用铝箔包裹4 ℃避光保存备用;吸取上述制备好的腐胺标准液2 mL,依次加入0.4 mL 2 mol/L NaOH溶液、0.6 mL的饱和碳酸氢钠溶液、4 mL的丹磺酰氯(10 mg/mL,丙酮为溶剂),然后置于40 ℃的水浴锅中反应45 min,同时要锡箔纸包装避光。水浴结束后加入0.2 mL氨水终止反应,去除残留的丹磺酰氯溶液,最后用乙腈定容至10 mL。衍生后用0.22 μm的有机滤膜过滤,滤液用于分析检测。
样品的处理:准确称取2.5 g待测样品,加入10 mL 0.4 mol/L的高氯酸,利用匀浆机彻底匀浆,在10 ℃下4 000 r/min离心10 min,吸取上清液到容量瓶中,沉淀部分再加入10 mL 0.4 mol/L的高氯酸,匀浆,离心,取二次上清液加入容量瓶,最后用0.4 mol/L高氯酸定容至25 mL。取2 mL的样液如标准溶液一样进行柱前衍生。
色谱条件:采用Alliance 2695液相色谱系统测定,色谱柱是Agilent ZORBAX Eclipes XDB-C18,流速为1 mL/min,UV-2487紫外检测器,检测波长为254 nm,进样量20 μL,柱温30 ℃,流动相A为水,流动相B为乙腈,采用梯度洗脱程序,洗脱程序如表1所示。
表1 梯度洗脱程序
Table1 Gradient elution program

实验重复4 次,数据以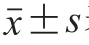 表示。所得数据用SAS 9.1.3软件进行方差分析,用Duncan’s multiple range test进行显著性差异分析(P<0.05表示差异性显著);采用Origin Pro 8.0软件作图。
表示。所得数据用SAS 9.1.3软件进行方差分析,用Duncan’s multiple range test进行显著性差异分析(P<0.05表示差异性显著);采用Origin Pro 8.0软件作图。
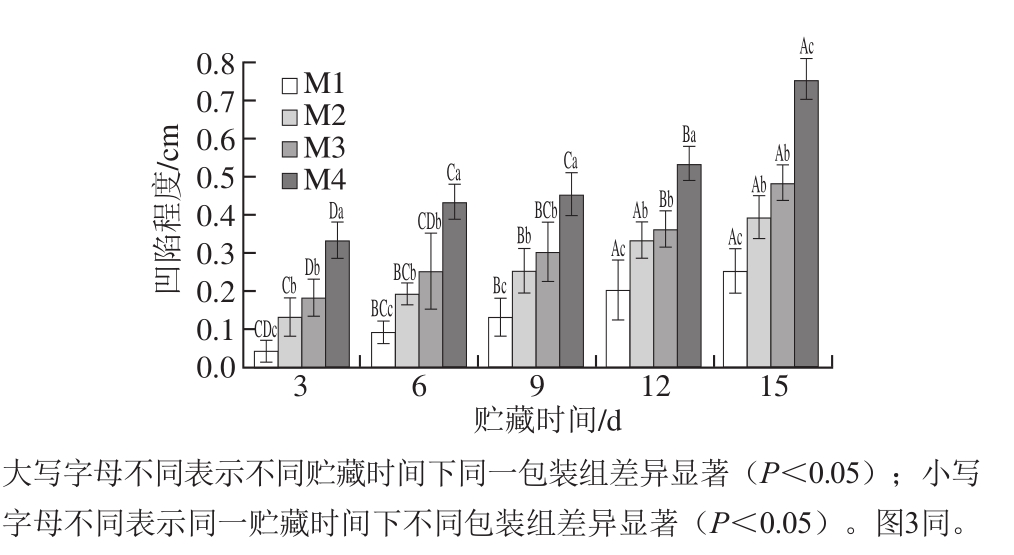
图1 贮藏期中不同二氧化碳体积分数气调包装下气调包装盒的凹陷程度
Fig. 1 Changes in degree of concavity during storage at 4 ℃ in modified atmosphere with different concentrations of carbon dioxide
由图1可以看出,不同处理组的凹陷程度随着贮藏时间的延长上升,随二氧化碳体积分数的升高而升高。第9天后,M4组的凹陷程度显著高于与其他3 组(P<0.05)。整个贮藏期间M3、M4组和M1组的凹陷程度均有显著性差异(P<0.05),而M2组与M3组均无显著性差异(P>0.05)。贮藏末期,M1组的外观最好,凹陷0.25 cm,而M4的外观最差,凹陷0.75 cm。
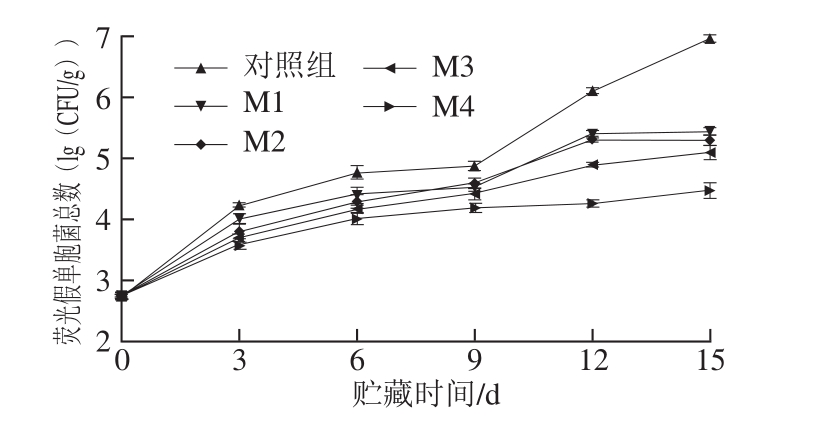
图2 贮藏期中不同二氧化碳比例气调包装下冷鲜鸡胸肉中荧光假单胞菌总数
Fig. 2 Changes in Pseudomonas fluorescent during storage at 4 ℃ in modified atmospheres with different concentrations of carbon dioxide
荧光假单胞菌是革兰氏阴性菌,能够在低温环境下生长繁殖,是导致冷鲜鸡肉腐败的主要优势菌[21]。由图2可知,在(4±1)℃温度下贮藏,不同处理组的荧光假单胞菌总数随着贮藏时间的延长上升,随二氧化碳体积分数的升高而下降,说明二氧化碳气调包装能抑制荧光假单胞菌的生长繁殖。样品的初始接菌数为2.89(lg(CFU/g)),其中对照组荧光假单胞菌总数增长最快,在贮藏的第15天,荧光假单胞菌总数达到6.98(lg(CFU/g)。贮藏6 d后,M4组鸡胸肉中荧光假单胞菌总数显著低于其他组(P<0.05),说明60% CO2气调包装抑菌效果最好,这是因为荧光假单胞菌为严格好氧菌,与Seydim[22]、Chouliara[23]等的研究结果相一致。M2组和M3组对荧光假单胞菌的抑菌效果相近,无显著性差异(P>0.05)(除贮藏12 d外)。
表2 贮藏期中不同二氧化碳比例气调包装下冷鲜鸡胸肉中pH值
Table2 Changes in pH value of chilled chicken during storage at 4 ℃in modified atmospheres with different concentrations of carbon dioxide

注:同行肩标大写字母不同表示差异显著(P<0.05);同列肩标小写字母不同表示差异显著(P<0.05)。表3同。
pH值是测定鸡肉时重要和常见的指标之一,它对鸡肉的贮藏有着重要的影响[24]。如表2所示,在15 d的贮藏过程中,5 个处理组样品的pH值始终在5.59~6.25内,在整个贮藏期间,M2和M3组之间无显著性差异(P>0.05),这与Al-Nehlawi[25]和Economou[26]等的研究结果相一致。研究表明,导致鸡肉pH值变化的原因有很多,高浓度二氧化碳导致有少部分溶解在肉的表面,从而导致pH值改变[24],而有关研究表明二氧化碳在样品包装结束的24 h后不再溶解。也有相关研究表明,气调包装中二氧化碳的溶解对样品pH值变化无显著影响[27]。
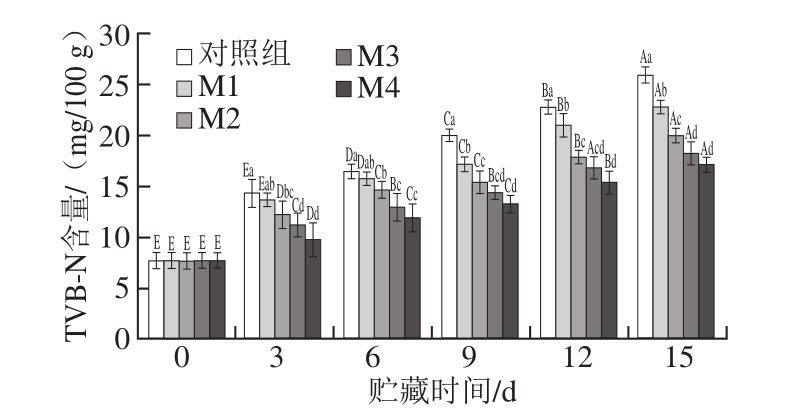
图3 贮藏期中不同二氧化碳比例气调包装下冷鲜鸡胸肉中TVB-N含量
Fig. 3 Changes in TVB-N content of chilled chicken during at 4 ℃ in modified atmospheres with different concentrations of carbon dioxide
由图3可以看出,在整个贮藏过程中,TVB-N含量随贮藏时间的延长上升,随二氧化碳体积分数的升高而下降,M4、M3、M2、M1和对照组样品的TVB-N含量从初始的7.70 mg/100 g,分别增长到17.15、18.20、19.95、22.75、25.90 mg/100 g,M4、M3组与对照组相比,均能抑制TVB-N的产生,且这两个处理组的TVB-N含量无显著性差异(P>0.05),且M4组在贮藏过程中均显著低于其他组(P<0.05);贮藏9~12 d,M2组和M3样品中TVB-N含量无显著差异(P>0.05)。荧光假单胞菌利用氨基酸作为生长基质,产生含硫化合物、胺类等有异味的物质,同时造成TVB-N含量的升高[28],由图2可知,高体积分数的二氧化碳可抑制荧光假单胞菌的生长繁殖,因此也可抑制TVB-N的产生。
表3 贮藏期中不同二氧化碳比例气调包装下冷鲜鸡胸肉中腐胺含量的变化
Table3 Changes in putrescine content during storage at 4 ℃ in modified atmospheres with different concentrations of carbon dioxide mg/kg

不同二氧化碳气调包装下冰鲜鸡肉的腐胺含量随贮藏时间的变化如表3所示,在整个贮藏期间,腐胺的含量不断增加(P<0.05)。结果显示:贮藏15 d后,不同处理组样品中的腐胺含量均显著增加(P<0.05),对照组、M1、M2、M3和M4组样品的腐胺含量由初始的2.58 mg/kg分别增加到28.99、23.63、16.95、14.95 mg/kg和11.01mg/kg,M4组样品的腐胺含量最低,与其他组相比均有显著性差异(P<0.05);这说明高浓度的二氧化碳气调包装方式能有效抑制冷鲜鸡腐胺的产生,从而延长货架期。M3和M2组的腐胺含量无显著性差异(P>0.05),但显著低于对照组(P<0.05)。
鸡肉营养丰富,具有高蛋白、低脂肪,且水分活度高的特点,是微生物生长繁殖的天然“沃土”;因此,冷鲜鸡肉极易腐败变质,保质期短,这严重制约了冷鲜鸡肉的生产、流通和销售。有关研究表明:气调包装能延长冷鲜鸡的货架期[29]。由于二氧化碳气体能溶解在冷鲜鸡胸肉表面[30],引起盖膜塌陷,影响气调包装盒外观,进而影响消费者的购买欲,所以气调包装盒里易溶于水的气体应尽可能少。前期的研究实验发现100%和80%的二氧化碳比例气调包装凹陷程度严重,故本实验未设置这两个比例。
微生物是引起冷鲜肉腐败变质的主要原因,冷鲜肉的货架期与其初始表面的污染程度有着密切的联系[31],即冷鲜肉表面初始微生物数量越大,污染越严重,其变质速率越快。
TVB-N是指外界微生物污染食品后,随着微生物生长繁殖并进入肉品的深层组织,在酶和细菌的作用下引起蛋白质脱羧、脱氨作用分解而形成的产物[32]。肉样中的TVB-N含量随着腐败的进行而逐渐增加,与肉品腐败程度成正比,因此常用来鉴定肉品的新鲜度[33]。TVB-N具有挥发性,在37 ℃碱性溶液释出,挥发后吸收于吸收液中,可用标准酸溶液滴定来计算含量。GB 16869—2005《鲜、冻禽产品》[33]规定的鲜、冻禽产品中TVB-N含量不得超过15 mg/100 g。Economou等[26]同样指出二氧化碳气调包装方式对冷鲜鸡肉中TVB-N的产生有着显著抑制作用。
腐胺是在鸟氨酸脱羧酶作用下脱羧的产物,具有腐臭气味,是评价肉类鲜度的重要指标之一[34-35]。Balamatsia等[36]测定了冷鲜肉整个货架期中生物胺含量的变化,其研究结果表明腐胺与腐败微生物之间有着密切的联系。
本研究以冷鲜鸡在(4±1)℃贮藏条件下,从气调包装盒的凹陷程度和肉的荧光假单胞菌落总数、pH值、TVB-N含量、腐胺含量这5 项指标进行综合评价,比较不同体积分数二氧化碳气调包装对冷鲜鸡肉中荧光假单胞菌抑制效果的影响。结果表明:凹陷程度随着贮藏时间的延长上升,随二氧化碳体积分数的升高而升高,而荧光假单胞菌总数、TVB-N和腐胺含量随着贮藏时间的延长上升,随二氧化碳体积分数的升高而下降,M4组的保鲜效果最好,但是M4组气调包装盒的凹陷程度显著高于其他3 组,影响产品的外观。M2组的气调包装盒凹陷程度、TVB-N(贮藏9~12 d)和腐胺含量与M3组无显著性差异,能达到同样的保鲜效果。此外,同体积的二氧化碳成本高于氮气。整体来看,(4±1)℃贮藏条件下,20%~40%的二氧化碳包装方式能抑制冷鲜鸡肉中假单胞菌的生长。本研究为冷鲜鸡保鲜、防腐提供了参考。
参考文献:
[1] 上海市食品药品监督管理局. 食品安全地方标准 冷鲜鸡生产经营卫生规范: DB 31/2022—2014[S]. 上海: 上海市技术监督情报研究所, 2014: 1.
[2] 李诚, 廖敏, 刘书亮, 等. 气调包装及天然保鲜剂对冷却鲜猪肉的保鲜效果研究[J]. 食品科学, 2004, 25(11): 307-311. DOI:10.3321/j.issn:1002-6630.2004.11.081.
[3] HINTON A J, CASON J A, INGRAM K D. Enumeration and identification of yeasts associated with commercial poultry processing and spoilage of refrigerated broiler carcasses[J]. Journal of Food Protection, 2002, 65(6): 993-998. DOI:10.4315/0362-028X-65.6.993.
[4] AZLIN-HASIM S, CRUZ-ROMERO M C, MORRIS M A, et al.Effects of a combination of antimicrobial silver low density polyethylene nanocomposite films and modified atmosphere packaging on the shelf life of chicken breast fillets[J]. Food Packaging and Shelf Life, 2015, 4: 26-35. DOI:10.1016/j.fpsl.2015.03.003.
[5] KONTOMINAS M G. Modified atmosphere packaging of foods[J]. Encyclopedia of Food Microbiology, 2014, 2: 1012-1016.DOI:10.1016/B978-0-12-384730-0.00432-8.
[6] MCMILLIN K W. Where is MAP going? a review and future potential of modified atmosphere packaging for meat[J]. Meat Science, 2008,80(1): 43-65. DOI:10.1016/j.meatsci.2008.05.028.
[7] 赵素芬. 气调包装(MAP)在冷却肉保鲜中的应用[J]. 包装与食品机械, 2007, 25(5): 53-55. DOI:10.3969/j.issn.1005-1295.2007.05.015.
[8] PATSIAS A, CHOULIARA I, BADEKA A, et al. Shelf-life of a chilled precooked chicken product stored in air and under modified atmospheres: microbiological, chemical, sensory attributes[J]. Food Microbiology, 2006, 23(5): 423-429. DOI:10.1016/j.fm.2005.08.004.
[9] JIMÉNEZ S M, SALSI M S, TIBURZI M C, et al. Spoilage microflora in fresh chicken breast stored at 4 ℃: influence of packaging methods[J]. Journal of Applied Microbiology, 1997, 83(5): 613-618.DOI:10.1046/j.1365-2672.1997.00276.x.
[10] LATOU E, MEXIS S F, BADEKA A V, et al. Combined effect of chitosan and modified atmosphere packaging for shelf life extension of chicken breast fillets[J]. LWT-Food Science and Technology, 2014,55(1): 263-268. DOI:10.1016/j.lwt.2013.09.010.
[11] ESMER O K, IRKIN R, DEGIRMENCIOGLU N, et al. The effects of modified atmosphere gas composition on microbiological criteria,color and oxidation values of minced beef meat[J]. Meat Science,2011, 88(2): 221-226. DOI:10.1016/j.meatsci.2010.12.021.
[12] GILL C O. Extending the storage life of raw chilled meats[J]. Meat Science, 1996, 43S1(12): 99-109. DOI:10.1016/0309-1740(96)00058-7.
[13] ERCOLINI D, RUSSO F, TORRIERI E, et al. Changes in the spoilagerelated microbiota of beef during refrigerated storage under different packaging conditions[J]. Applied & Environmental Microbiology,2006, 72(7): 4663-4671. DOI:10.1128/AEM.00468-06.
[14] NYCHAS G J E, SKANDAMIS P N, TASSOU C C, et al. Meat spoilage during distribution[J]. Meat Science, 2008, 78(1/2): 77-89.DOI:10.1016/j.meatsci.2007.06.020.
[15] TU R J, WU H Y, LOCK Y S, et al. Evaluation of microbial dynamics during the ripening of a traditional Taiwanese naturally fermented ham[J]. Food Microbiology, 2010, 27(4): 460-467. DOI:10.1016/j.fm.2009.12.011.
[16] 卫生部, 中国国家标准化管理委员会. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2010[S]. 北京: 中国标准出版社, 2010: 2-7.
[17] 许益民. 肉和肉制品pH测定的国际标准方法[J]. 中国动物保健,2000(5): 27.
[18] 卫生部, 中国国家标准化管理委员会. 肉与肉制品卫生标准的分析方法: GB 5009.44—2003[S]. 北京: 中国标准出版社, 2003: 355.
[19] LU Shiling, XU Xinglian, ZHOU Guanghong, et al. Effect of starter cultures on microbial ecosystem and biogenic amines in fermented sausage[J]. Food Control, 2010, 21(4): 444-449. DOI:10.1016/j.foodcont.2009.07.008.
[20] 徐振. 冷却猪肉贮藏过程中生物胺种类及含量变化的研究[D]. 南京: 南京农业大学, 2008: 20-21. DOI:10.7666/d.Y1491627.
[21] 聂炎炎, 刘冬虹, 黄宇锋, 等. 肉和肉制品中假单胞菌的检验和计数[J]. 现代食品科技, 2008, 24(2): 184-187. DOI:10.3969/j.issn.1673-9078.2008.02.024.
[22] SEYDIM A C, ACTON J C, HALL M A, et al. Effects of packaging atmospheres on shelf-life quality of ground ostrich meat[J]. Meat Science, 2006, 73(3): 503-510. DOI:10.1016/j.meatsci.2006.01.010.
[23] CHOULIARA E, KARATAPANIS A, SAVVAIDIS I N, et al.Combined effect of oregano essential oil and modified atmosphere packaging on shelf-life extension of fresh chicken breast meat, stored at 4 ℃[J]. Food Microbiology, 2007, 24(6): 607-617. DOI:10.1016/j.fm.2006.12.005.
[24] 杨勇, 王存堂, 任健, 等. 鹅肉嫩化技术的研究进展[J]. 中国家禽,2010, 32(1): 41-44.
[25] AL-NEHLAWI A, SALDO J, VEGA L F, et al. Effect of high carbon dioxide atmosphere packaging and soluble gas stabilization pretreatment on the shelf-life and quality of chicken drumsticks[J]. Meat Science, 2013, 94(1): 1-8. DOI:10.1016/j.meatsci.2012.12.008.
[26] ECONOMOU T, POURNIS N, NTZIMANI A, et al. Nisin-EDTA treatments and modified atmosphere packaging to increase fresh chicken meat shelf-life[J]. Food Chemistry, 2009, 114(4): 1470-1476.DOI:10.1016/j.foodchem.2008.11.036.
[27] BYUN J S, MIN J S, KIM I S, et al. Comparison of indicators of microbial quality of meat during aerobic cold storage[J]. Journal Food Protection, 2003, 66(9): 1733-1737. DOI:10.4315/0362-028X-66.9.1733.
[28] MCMEEKIN T A. Microbial spoilage of meats[M]. London: Applied Science Pulishers, 1982: 1-40.
[29] 刘鹭, 李洪军. 鲜肉保鲜技术研究进展及现状[J]. 肉类研究, 2001,11(4): 36-38. DOI:10.3969/j.issn.1001-8123.2001.04.013.
[30] YANG X Y, ZHANG Y M, ZHU L X, et al. Effect of packaging atmospheres on storage quality characteristics of heavily marbled beef longissimus steaks[J]. Meat Science, 2016, 117: 50-56. DOI:10.1016/j.meatsci.2016.02.030.
[31] KOLSARICI N, CANDOGAN K. The effects of potassium sorbate and lactic acid on the shelf-life of vacuum-packed chicken meats[J].Poultry Science, 1995, 74(11): 1884-1893.
[32] 王志琴, 姚刚, 张晓红, 等. 牛肉保存过程中总挥发性盐基氮变化规律的探索[J]. 畜牧与饲料科学, 2011, 32(7): 84-86. DOI:10.3969/j.issn.1672-5190.2011.07.047.
[33] 卫生部, 中国国家标准化管理委员会. 鲜、冻禽产品: GB/T 16869—2005[S]. 北京: 中国标准出版社, 2005: 362.
[34] FAVARO G, PASTORE P, SACCANI G, et al. Determination of biogenic amines in fresh and processed meat by ion chromatography and integrated pulsed amperometric detection on Au electrode[J].Food Chemistry, 2007, 105(4): 1652-1658. DOI:10.1016/j.foodchem.2007.04.071.
[35] RODRIGUEZ M B R, CONTE C A Jr, DA SILVA CARNEIRO C,et al. Biogenic amines as a quality index in shredded cooked chicken breast fillet stored under refrigeration and modified atmosphere[J].Journal of Food Processing and Preservation, 2015, 39(6): 2043-2048.DOI:10.1111/jfpp.12447.
[36] BALAMATSIA C C, PALEOLOGOS E K, KONTOMINAS M G, et al.Correlation between microbial flora, sensory changes and biogenic amines formation in fresh chicken meat stored aerobically or under modified atmosphere packaging at 4 ℃: possible role of biogenic amines as spoilage indicators[J]. Antonie van Leeuwenhoek, 2006,89(1): 9-17. DOI:10.1007/s10482-005-9003-4.
Inhibitory Effect of Modified Atmosphere Packaging with Different Carbon Dioxide Concentrations on Pseudomonas fluorescens in Chilled Chicken
ZHANG Xinxiao1, ZHANG Bin1,2, BIAN Huan1, WANG Daoying1, WU Mangang2, SUN Zhilan1,*, ZHU Yongzhi1,*, XU Weimin1,3
(1. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2. College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China;3. Jiangsu Collaborative Innovation Center of Meat Production and Processing, Quality and Safety Control, Nanjing 210095, China)
Abstract:In order to investigate the effect of modified atmospheres with varying carbon dioxide levels on the preservation of chilled chicken, chilled chicken was inoculated with 103CFU/g Pseudomonas fluorescent after sterilization by irradiation,packaged in different modified atmospheres: M1 group ((V(CO2):V(N2) = 20:80), M2 group ((V(CO2):V(N2) = 20:80), M3 group ((V(CO2):V(N2) = 40:60) and M4 group ((V(CO2):V(N2) = 60:40) and then stored at (4 ± 1) ℃. Normal air package was used as control. Changes in the degree of concavity, P. fluorescent count, pH, total volatile basic nitrogen (TVB-N) and putrescine content were measured during storage. Results showed that P. fluorescent count, TVB-N and putrescine content increased with increasing storage time, whereas they decreased with increasing CO2level. The degree of concavity increased with increasing storage time or CO2level; the degree of concavity in group M4 was significantly higher than that in other groups (P < 0.05), impacting the visual appearance of chicken. No difference in the degree of concavity or putrescine content was observed comparing groups M2 and M3 (P > 0.05). Similarly, no difference in TVB-N content was found from the ninth day to the twelfth day of storage (P > 0.05). Thus, an identical preservation effect was achieved. However, CO2is more expensive than N2of the same volume. Overall, we concluded that modified atmospheres containing 20%–40% of CO2could strongly inhibit the growth of P. fluorescent in chilled chicken under the storage of (4 ± 1) ℃.
Keywords:chilled chicken; modified atmosphere packaging; carbon dioxide; shelf-life; Pseudomonas fluorescent
DOI:10.7506/spkx1002-6630-201813040
收稿日期:2017-03-20
基金项目:江苏省产学研合作项目(BY2015073);现在农业产业技术体系专项(CARS-41)
第一作者简介:张新笑(1990—),女,实习研究员,硕士,研究方向为肉品加工与质量控制。E-mail:xinxiao220@163.com
*通信作者简介:孙芝兰(1984—),女,副研究员,博士,研究方向为肉品安全与质量控制。E-mail:zhilan408@163.com诸永志(1975—),男,研究员,硕士,研究方向为肉品安全与质量控制。E-mail:yongzhizhu@163.com
中图分类号:TS251
文献标志码:A
文章编号:1002-6630(2018)13-0266-06
引文格式:张新笑, 章彬, 卞欢, 等. 不同二氧化碳比例气调对冷鲜鸡肉中荧光假单胞菌的抑制作用[J]. 食品科学, 2018, 39(13):266-271.
DOI:10.7506/spkx1002-6630-201813040. http://www.spkx.net.cn
ZHANG Xinxiao, ZHANG Bin, BIAN Huan, et al. Inhibitory effect of modified atmosphere packaging with different carbon dioxide concentrations on Pseudomonas fluorescens in chilled chicken[J]. Food Science, 2018, 39(13): 266-271. (in Chinese with English abstract)
DOI:DOI:10.7506/spkx1002-6630-201813040. http://www.spkx.net.cn