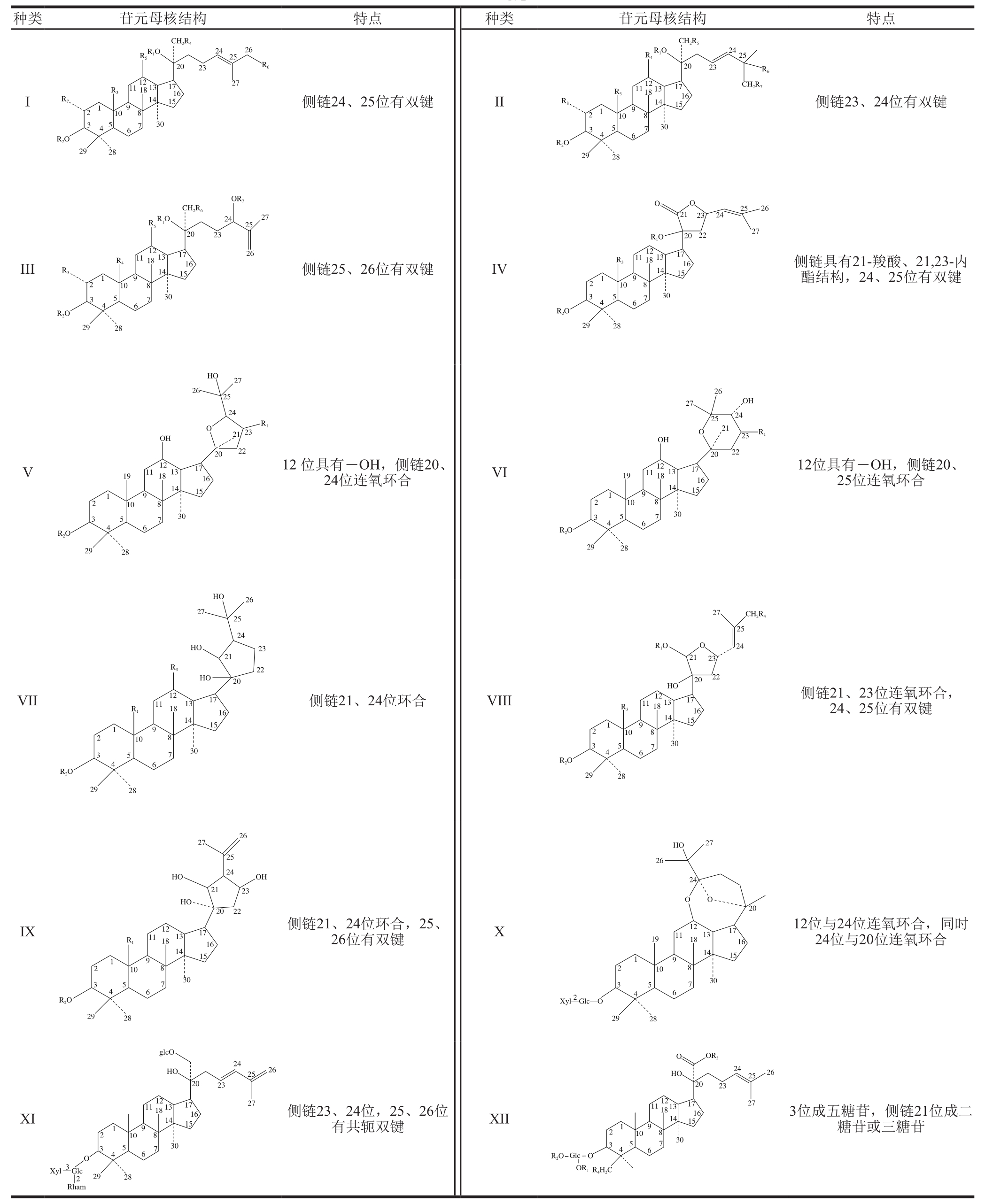
表1 绞股蓝皂苷苷元结构的分类[3]
Table1 Classification of gypenoside structures[3]
郑 溢1,2,李 旎1,2,郑志忠2,3,陈良华1,3,童庆宣2,3,明艳林1,2,3,*,林河通1,*
(1.福建农林大学食品科学学院,福建 福州 350002;2.厦门华侨亚热带植物引种园,厦门市植物引种检疫与植物源产物重点实验室,福建 厦门 361002;3.福建省亚热带植物研究所,福建省亚热带植物生理生化重点实验室,福建 厦门 361006)
摘 要:绞股蓝为葫芦科绞股蓝属植物,含皂苷、黄酮、多糖等多种成分,具有防衰老、降血糖、降血脂、抑制肿瘤等多种生物活性。绞股蓝皂苷是绞股蓝的主要活性成分之一,因其具有与人参皂苷相同的四环三萜达玛烷型母核结构而备受关注。近年来,通过生物转化对绞股蓝皂苷上的糖基进行改造以制备活性较高的次生皂苷成为研究热点,并出现大量相关的研究报道,但鲜有较为系统的文献整理。鉴于此,本文综述了绞股蓝皂苷的结构与类别、绞股蓝皂苷与人参皂苷的异同、绞股蓝皂苷的生物转化及其生物活性的研究进展,并就绞股蓝皂苷未来的研究方向提出建议,以期为绞股蓝皂苷的进一步研究提供思路。
关键词:绞股蓝;绞股蓝皂苷;生物转化;生物活性
绞股蓝(Gynostemma pentaphyllum (Thunb.)Makino.)是葫芦科绞股蓝属多年生草质藤本植物,是目前所知非五加科人参属植物中唯一含有人参皂苷类成分的植物,素有“南方人参”的美称[1]。绞股蓝喜阴湿温和的气候,广泛分布于东南亚等地以及我国秦岭、长江以南各地区。据统计,迄今全世界的绞股蓝共有17 个种和2 个变种[2]。绞股蓝皂苷(gypenoside,Gyp)是绞股蓝中最重要的功能性成分之一,因具有与人参皂苷类似的四环三萜达玛烷型基本结构而倍受关注。由于达玛烷型皂苷本身具有热不稳定性,在加热提取过程中易发生水解,因此,近年来不断有新的绞股蓝皂苷的报道,迄今已明确的绞股蓝皂苷共有165 个,苷元有12 类[3]。研究表明,绞股蓝皂苷具有抗衰老、抗肿瘤、降血糖、降血脂、保护肝脏和神经等多方面生物活性,且其药理活性与其侧链糖基关系密切,一般绞股蓝皂苷侧链糖基分子越少其活性越高。最新代谢组学及药理学研究发现,在体内发挥药理作用的绞股蓝皂苷成分主要为含量较少的绞股蓝皂苷单体或不存在于绞股蓝中的次生苷元,值得关注的是,由于绞股蓝皂苷与人参皂苷的苷元骨架结构相同,部分绞股蓝皂苷在体内可以转化为稀有人参皂苷。因此,近年来通过生物转化对绞股蓝皂苷上的糖基进行改造以制备出活性较高的次生皂苷以及高活性的稀有人参皂苷的研究受到国内外学者及制药企业广泛关注,每年均有许多相关的研究报道。
生物转化是指外源化合物在机体内经多种酶催化的结构变化,并形成其他结构化合物的过程,其本质是利用生物体系本身所产生的酶在体外对外源化合物进行酶催化反应。生物转化的反应条件温和、副产物少、对环境友好,且能弥补一些化学修饰反应上的缺陷。目前,绞股蓝皂苷在体外的转化方法主要有生物转化法、酸水解法、碱裂解法及热处理法等。其中绞股蓝生物转化法主要包括微生物转化法和酶法转化法。由于化学法和物理法具有反应条件剧烈、水解程度难以控制、反应副产物多、易造成环境污染等缺陷,所以很少使用。利用生物法转化绞股蓝皂苷,既能改造已有皂苷成分、产生新型皂苷、提高目标物得率,又能克服化学法和物理法的缺点;因此,近年来通过该法水解掉某些含量高、药效低的绞股蓝皂苷末端糖基以制备稀有次生皂苷成为研究的热点。
为了寻找新的、活性更高的稀有绞股蓝皂苷,近几年本课题组及国内外其他学者较系统地研究了绞股蓝皂苷体内代谢组学、绞股蓝体外生物转化通路、高活性绞股蓝皂苷类物质的分离鉴定、提取制备,同时也对新发现的绞股蓝皂苷的抗肿瘤、抗衰老等生物活性进行了较深入全面的探讨,但尚鲜有较为系统的文献整理和综述。鉴于此,本文较系统地综述了绞股蓝皂苷的结构与类别、生物转化及其生物活性等方面的研究进展,重点分析了近5 年来的最新研究,并对绞股蓝皂苷未来的研究方向提出了建议,旨在为绞股蓝皂苷进一步研究提供思路。
迄今为止的研究发现,绞股蓝皂苷大部分具有达玛烷型的基本结构,主要由四环三萜达玛烷型皂苷苷元与糖基组成。其C20位上手性中心的绝对构型分为R-构型和S-构型,其中绞股蓝皂苷Gyp-XXXIX、Gyp-XL、Gyp-XLI、Gyp-LI、Gyp-LIII为R-构型,其余均为S-构型。随着研究的深入,越来越多的新型绞股蓝皂苷被发现,因此,为了更好地开展研究,将绞股蓝皂苷进行系统地分类整理就显得尤为重要。学术界主要根据绞股蓝皂苷苷元结构的相似度对其进行分类,2011年,史琳等[3]在前人研究基础上,补充了侧链23、24位和25、26位有共轭双键的苷元类型,将已明确的165 个绞股蓝皂苷按苷元结构相似的程度划分为12 类(表1)。其中,绞股蓝皂苷的达玛烯双键在24、25位的最多,有102 个;侧链21、23位具有环氧结构的有13 种;侧链23、24位有双键以及侧链具有21-羧酸、21,23-内酯结构的各有9 种。此外,研究还发现绞股蓝皂苷的糖基大多连在C3和C20位,主要由葡萄糖、阿拉伯糖、鼠李糖和木糖构成单糖、双糖和三糖等。随着研究的深入,越来越多的绞股蓝皂苷被发现,绞股蓝皂苷的苷元分类表也将被补充更新。
绞股蓝属植物有2 个主要的分布中心,分别是日本冲绳地区和我国西南地区。绞股蓝属于葫芦科绞股蓝属绞股蓝亚属,是绞股蓝属植物中分布最广、资源最丰富的药用植物,因其具有较强的环境适应性而广泛分布于东南亚国家及我国滇、鄂、陕、皖、桂、黔、粤、浙、琼、蜀、湘、豫、赣、陇、闽、藏等地区。
学术界对于绞股蓝属植物的种间分类一直存在争议。孙文基[4]认为,绞股蓝与同一亚属的长梗绞股蓝常在名称和形态、作用上被混为一谈,然而二者实为绞股蓝亚属中的2 个物种:绞股蓝味甜、多为5 叶,故称“五叶参”;长梗绞股蓝味苦、有7 叶,又名“七叶胆”、“小苦药”。长梗绞股蓝与绞股蓝的化学成分不同,它的苷元水解不产生人参二醇、人参三醇类,不是四环三萜,而是多一个呋喃骈环。而另一种观点认为,单叶绞股蓝、光叶绞股蓝、长梗绞股蓝与绞股蓝应为同一物种[5]。随着分子系统学的发展,利用分子标记技术和DNA条形码技术对物种进行鉴定,对植物种间、近缘属间及科内的系统发育和分类问题进行探讨,将有利于该属物种的学名鉴定。
表1 绞股蓝皂苷苷元结构的分类[3]
Table1 Classification of gypenoside structures[3]

表2 不同产地绞股蓝的总皂苷含量
Table2 Gypenoside contents of G. pentaphyllum from different habitats

注:表中所用材料为全草;—.未报道。
绞股蓝皂苷的含量和成分与产地、品种、采收时间、采样部位以及内源性真菌的种类有关(表2)。研究表明,产于日本的绞股蓝化学成分主要为达玛烷类三萜皂苷,含人参皂苷类成分;江西、陕西等地生产的绞股蓝,生物活性物质以黄酮类成分为主。乐圆[6]对人工种植绞股蓝面积较大的陕西、湖北、湖南、安徽、江西、贵州、云南7 个省份进行了考察,并检测了不同品系绞股蓝总皂苷及绞股蓝二醇组皂苷的含量,结果显示:绞股蓝中的总皂苷含量以陕西平利PL.1最高,为12.18%;绞股蓝中的二醇组皂苷含量以湖北HB.02最高,为0.88%。绞股蓝皂苷含量与绞股蓝的品种也有密切关系,绞股蓝品种的不同主要体现在植株的叶片数和口感上的区别。彭亮等[7]测定绞股蓝中的三萜皂苷含量时发现,7 叶绞股蓝叶片中的三萜皂苷含量显著高于5 叶绞股蓝。在口感方面,苦味和甜味绞股蓝总皂苷含量较高,苦甜味绞股蓝次之,淡味绞股蓝的总皂苷含量最少。绞股蓝皂苷的含量还与采收时间和采样部位有关。一般来说,7月为绞股蓝的开花季,绞股蓝中的皂苷含量开始上升,至10月绞股蓝结果前,采收的绞股蓝皂苷含量最高。不同部位中皂苷含量从叶、茎和地上部分依次降低[8],例如从河北引种的绞股蓝,叶中的总皂苷含量比茎中高4~5 倍[9]。Ma Shenglong等[10]研究不同生长环境下,不同种类绞股蓝的活性成分与内源性真菌种类的相关性,从绞股蓝的根、根茎和叶中分离出125 种内生真菌,并通过高效液相色谱测定绞股蓝中主要皂苷成分Gyp-XLIX的含量后发现,镰孢菌属、柱孢霉属和小球腔菌属真菌的存在能促进绞股蓝皂苷Gyp-XLIX的合成积累,而青霉菌属真菌则抑制绞股蓝皂苷Gyp-XLIX的合成积累,这可能是因为青霉菌属内生真菌产生的一些代谢产物对绞股蓝皂苷Gyp-XLIX合成的某一环节有影响。通过对比不同品种间绞股蓝中的成分,有利于人们依据自身需求对绞股蓝进行选择。
绞股蓝皂苷是目前所知非五加科人参属植物中唯一含有人参皂苷类成分的植物[1],在我国民间已有较长的用药历史。绞股蓝皂苷与人参皂苷的苷元部分都为达玛烷型四环三萜构型,在基因转录水平上的相似度为25%[18]。皂苷Re、Rg2、Rc、F1、丙二酰-Rbl、丙二酰-Rd、Rf是人参和绞股蓝的共同成分[19-22]。与人参皂苷相比,绞股蓝皂苷主要为原人参二醇,其中,绞股蓝皂苷Gyp-III、Gyp-IV、Gyp-VIII、Gyp-XII、Gyp-I、Gyp-A-AH的结构分别与人参皂苷Rb1、Rb3、Rd、F2、K和Rg3结构相同[23-24],且Gyp-III、Gyp-IV、Gyp-VIII、Gyp-XII在绞股蓝优良株系中的含量均较人参中相应组分高[25]。研究还表明,许多绞股蓝皂苷产生的次级产物与人参皂苷水解的产物相同,例如绞股蓝皂苷Gyp-I~XVI经水解即可得人参皂苷CK(Compound K),绞股蓝皂苷Gyp-III、Gyp-IV和Gyp-V等经弱酸水解得人参皂苷Rg3[26]。研究显示CK可抑制脂肪细胞中甘油三酯的积累[27]、抗肝癌细胞的生长[28]并抑制高转移肝癌细胞MHCC97-H的侵袭转移[29],20(S)-Rg3通过抑制氧化应激和晚期糖基化终产物的形成来预防2型糖尿病大鼠肾损伤和功能障碍的进一步发展[30]。同时,一些绞股蓝皂苷间也可通过增加或减少糖基来实现相互转化[24]。因此,绞股蓝皂苷在体内、体外转化途径的研究深受关注。
代谢组学的研究表明,皂苷类化合物是许多药用植物的重要活性成分,但一般其通过肠道代谢后的产物才是体内最终发挥药理药效的主要形式[31]。例如,人参皂苷是人参中的主要生物活性物质,天然存在的人参皂苷被称为主皂苷,而仅存在痕量或不存在的、需后天转化形成的皂苷单体常被称为稀有人参皂苷(如Rd、Rg3、F2、Rh2、CK和CMc等)[32]。据文献报道,口服人参后,人参总皂苷难以被人体吸收,需要经人肠道微生物转化成稀有人参皂苷后被人体吸收并发挥主要的药理活性。鉴于此,研究绞股蓝皂苷在体内的代谢途径,对绞股蓝皂苷在体外的生物转化研究具有重要意义。通过研究绞股蓝皂苷的药物动力学发现,家兔肌肉注射绞股蓝皂苷后,血药浓度出现双峰现象,主要由肠肝循环引起,由此发现胆道排泄是绞股蓝皂苷体内的排泄途径之一[33]。大鼠口服和静脉内注射绞股蓝皂苷Gyp-LVI,分别在尿液中得到6、8 种代谢物,其中达木林B、达木林A、绞股蓝皂苷Gyp-L、Gyp-LI和Gyp-XLVI对A549细胞具有更强的细胞毒性[34](图1)。通过对绞股蓝皂苷体内代谢途径的研究,为其在体外通过生物转化制备更高活性的皂苷类物质和生产人参皂苷替代品提供了理论依据。
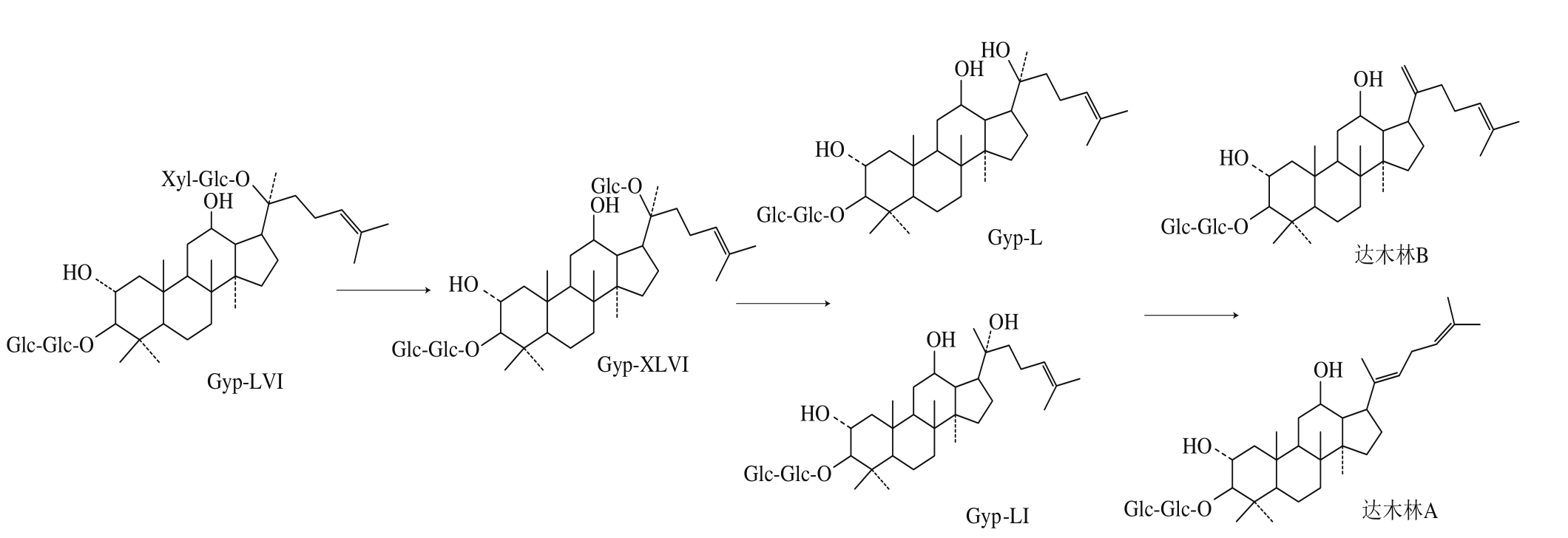
图1 Gyp-LVI体内代谢途径[34]
Fig. 1 Metabolic pathway of Gyp-LVI in vivo[34]

图2 Gyp-V、Gyp-XVII、Gyp-LXXV及稀有人参皂苷体外转化途径[36-38]
Fig. 2 Transformation pathways of Gyp-V, Gyp-XVII, Gyp-LXXV and some rare ginsenosides in vivo[36-38]
2.2.1 微生物转化
微生物转化人参皂苷的实质是微生物产生的酶水解掉人参皂苷化合物中的糖基,得到生物活性较高的水解产物,该法的使用能够降低生产成本,适于大规模制备目标产物。本课题组以福建绞股蓝为材料提取绞股蓝皂苷,经灰绿曲霉微生物转化后的产物抗癌效果增强[35]。Kim等[36]的研究发现,从多食鞘氨醇杆菌 GIN723中得到的纯化酶对葡萄糖部分具有特异性,通过高效液相色谱和电喷雾离子化串联质谱的分析,得到Rb1的生物转化途径:Rb1→Gyp-XVII→Gyp-LXXV→CK→PPD(S)。马吉胜等[37]采用有潜在β-葡萄糖苷酶分泌能力的真菌,转化人参皂苷Rb1及人参二醇系皂苷,证实了代谢过程:Rb1→Rd→F2→CK→PPD,并认为可通过控制这一过程提高稀有人参皂苷CK的得率。Min等[38]利用菌株GS514分泌的酶,将绞股蓝皂苷Gyp-V定向转化为人参皂苷Rd和Rg3,米曲霉中的酶可将绞股蓝皂苷Gyp-V转变为人参皂苷F2。本文结合前人的研究推测出了Gyp-V、Gyp-XVII、Gyp-LXXV的体外转化途径(图2)。虽然利用微生物转化绞股蓝皂苷的生产成本较低,但反应副产物多,为后续分离纯化目标产物带来一定的难度,而酶法转化的出现能够克服微生物转化的劣势,因此成为了学者们研究的热点。
2.2.2 酶法转化
酶转化法有反应专一、转化率高、产物纯度高等特点,是目前体外转化绞股蓝皂苷制备稀有人参皂苷的主要方法。目前,在皂苷间相互转化的研究中,β-葡萄糖苷酶的使用最为广泛,为寻找新的实验突破点,研究者们陆续在不同菌株中分离出β-葡萄糖苷酶并进行工艺优化(表3)。嗜热菌中的β-葡萄糖苷酶能水解掉原人参二醇型人参皂苷上C20位的葡萄糖,将绞股蓝皂苷Gyp-XVII转化为人参皂苷F2,摩尔转化率达到100 %,产率为4 g/(L·h),为迄今为止报道过的最高水平[39]。Yu Hongshan等[24]从FFCDL-90菌株得到的鼠李糖苷酶能够水解绞股蓝皂苷Gyp-V的C20位上的α-(1→6)-L-鼠李糖苷,生成人参皂苷Rd。CK是人参皂苷在体内发挥生物活性作用的最终形式,因此CK体外制备方法的研究极具价值。Zhong Feiliang等[40]从短乳杆菌中克隆得到β-葡萄糖苷酶基因(bgy1),可用于水解绞股蓝皂苷Gyp-XVII上C3处的葡萄糖基和C20处的外接葡萄糖基,在6 h内将绞股蓝皂苷Gyp-XVII转化得到0.58 mg/mL的CK,摩尔转化率为89%。
表3 绞股蓝与人参中共有皂苷成分以及绞股蓝皂苷的酶水解途径
Table3 Hydrolysis pathways and biotransformation enzymes of ginsenosides and gypenosides

续表3

实验数据显示,绞股蓝总皂苷能够抑制结肠癌细胞SW620和食道癌细胞Eca-109的增殖和迁移,诱导癌细胞凋亡[61]。而从绞股蓝总皂苷中寻找发挥主要作用的皂苷单体在对癌症患者的临床治疗上更具有实用价值。研究发现,在达玛烷骨架C20位有游离羟基的绞股蓝皂苷Gyp-XXIII、Gyp-XXIV、Gyp-XXV、Gyp-XXVII、Gyp-XXVIII、Gyp-XXIX和C21位有游离羟基的绞股蓝皂苷Gyp-XXII、Gyp-XXVI对肝癌、肺癌等多种癌细胞的增殖有明显抑制作用,但对正常细胞无任何影响[62]。Gyp-L能通过引起蛋白质的泛素化和内质网应激反应,导致二磷酸肌醇受体Ca2+释放,最终导致人食管癌细胞[63]、人肝细胞癌细胞[64]死亡。
除上述的绞股蓝皂苷单体外,本课题组采用酶法转化绞股蓝总皂苷,分离纯化得到的绞股蓝皂苷Gyp-XLV Ed[65-66]、Gyp-LVII[67]对人肝癌细胞株SMMC7721、Bel7402的生长皆具有显著的抑制作用。此外,绞股蓝皂苷还具有抗肺癌、抑制口腔肿瘤细胞生长和抗多药耐药性等作用。这为抗癌新药的研制提供了新的途径。
研究表明,绞股蓝皂苷能有效调节血脂的稳定性,治疗高脂饮食引起的高脂血症,防止非酒精性脂肪性肝病[68],并减少肠道对胆固醇的吸收[69]。值得一提的是,不同含量(40%、80%、98%)的绞股蓝皂苷都能有效降低高脂血症大鼠血脂水平,且对肝组织有一定的保护作用,尤其当绞股蓝皂苷含量为98 %时,改善效果更显著[70]。绞股蓝皂苷Gyp-XVII由于其抗氧化性能,可以通过雌激素受体α介导的PI3K/Akt途径缓解动脉粥样硬化[71]。
林臻桢等[72]采用小鼠腹腔注射四氧嘧啶建立糖尿病模型,对糖尿病小鼠灌胃绞股蓝提取物后发现,绞股蓝皂苷对糖尿病小鼠有较好的降血糖作用,并能够提高肝糖原的合成,保护肾脏。赵涛等[73]通过探讨绞股蓝总皂苷对2型糖尿病大鼠游离脂肪酸代谢的影响及其改善胰岛素抵抗的作用机制,发现绞股蓝总皂苷可明显改善2型糖尿病中出现的胰岛素抵抗,其机制与绞股蓝总皂苷改善脂代谢紊乱和降血糖的作用有关。
绞股蓝皂苷通过其抗氧化和抗凋亡的生物活性,有效地防止了局部缺血/再灌注诱导的肝损伤[74]、CCl4诱导的肝纤维化[75]。赵世印等[76]通过使用绞股蓝总皂苷,抑制2型糖尿病并非酒精性脂肪性肝病的大鼠血清中的血清瘦素水平的上升和脂联素水平的下降,抑制脂肪肝和肝纤维化。同时,绞股蓝皂苷通过调节肝脂肪生成过程中参与脂肪酸氧化的关键转录因子和脂肪生成酶[77],辅助治疗非酒精性脂肪性肝病,从而提高总体预后[78]。其中,抑制线粒体通路介导的肝细胞凋亡是绞股蓝总皂苷抗肝纤维化的重要机制之一[79]。
张猛猛等[80]对不同纯化条件下(总皂苷A:30%;总皂苷B:50%;总皂苷A′:总皂苷A经硅胶柱层析后得到)得到的绞股蓝皂苷样品的体外抗氧化能力进行比较后发现,30%(体积分数,下同)乙醇溶液洗脱出的皂苷纯化样品的体外抗氧化能力最强。而肖凡等[81]测定发现40%乙醇溶液分离物的抗氧化活性最强。实验结果的不同与洗脱方案不同有关,若在30%~40%乙醇溶液间增加几个洗脱梯度,可得到较准确的实验结论。基于绞股蓝皂苷显著的抗氧化活性,对绞股蓝皂苷进行皮肤的抗氧化实验,发现其具有延缓细胞衰老的作用[82-83]。
绞股蓝皂苷具有改善抑郁症和焦虑症等神经障碍,治疗帕金森、阿尔茨海默病等神经系统变性疾病和保护视神经等作用。Meng Xiangbao等[84]发现,绞股蓝皂苷Gyp-XVII通过激活PI3K/Akt、Nrf2/ARE/HO-1通路和GSK-3β的失活,抑制β-淀粉样蛋白25~35引起的神经毒性损伤。进一步研究其潜在机制发现,Gyp-XVII通过激活转录因子EB对阿尔茨海默病的细胞和啮齿类动物模型起到保护的作用[85]。抑郁症和焦虑症的发生与单胺类物质减少有关,绞股蓝皂苷可抑制焦虑性障碍的产生并保护由1-甲基-4-苯基-1,2,3,6-四氢吡啶缺陷而产生神经毒性的帕金森大鼠模型[86]。此外,绞股蓝总皂苷还有防止视网膜神经节细胞凋亡、改善视神经炎患者的视力、治疗中风和促进神经干细胞分化等神经保护作用。
绞股蓝皂苷还能改善和治疗缺血再灌注引起的大鼠心脏功能的损伤,保护心肌细胞[87-88]和大脑中动脉闭塞的细胞,加速口腔溃疡的愈合、调节代谢、抗运动疲劳和增强机体免疫等。其中,绞股蓝皂苷Gyp-TN-2和Gyp-LXXIV能够抑制莨菪碱处理小鼠的记忆力和学习障碍[89-90]。
我国是绞股蓝植物的分布和分化中心,具有丰富的绞股蓝资源,民间有通过饮用绞股蓝茶保健的传统,这些因素非常有利于发展绞股蓝相关产业。其中,利用生物法转化制备绞股蓝皂苷提取物以得到生物活性较高的绞股蓝皂苷单体和稀有人参皂苷,是深度开发、发展绞股蓝产业的主要途径之一。目前,绞股蓝的品种分布、皂苷骨架结构特点和苷元类别、皂苷酶转化的酶制剂及生物活性已基本阐明。绞股蓝有效成分的提取、分离与鉴定技术在延续传统的基础上不断改进,但对绞股蓝单体皂苷的成分含量、化学成分的动态变化缺乏研究;皂苷体内代谢的途径阐明与调控研究较少被报道,皂苷生物定向转化和转化产率较低等问题也有待解决。鉴于此,建议未来对绞股蓝的研究应从以下几个方面进行:
在绞股蓝皂苷含量的研究方面,系统研究我国特色绞股蓝品种中特征单体皂苷的化学成分和含量,以品种特征皂苷为成分指标建立化学指纹图谱,作为绞股蓝品种品系鉴定的依据。
随着分子系统学的发展,利用分子标记技术和DNA条形码技术对物种进行鉴定,对植物种间、近缘属间及科内的系统发育和分类问题进行探讨,将有利于该属物种的学名鉴定。
随着生物技术的发展,将生物转化方法与转录组分析和计算机生物学分析等技术联合,以此确定次生代谢产物,这有助于完善绞股蓝皂苷体内、体外代谢通路,为定向转化制备绞股蓝皂苷类成分提供理论指导。
在生物定向转化和转化产率方面,针对具有低毒性、高活性的稀有皂苷,筛选具备转化能力的微生物和生物酶制剂,提高生物转化率。
在绞股蓝皂苷生物活性的研究方面,加强对生物转化的皂苷单体的生物活性研究,如绞股蓝皂苷Gyp-IX、Gyp-III、Gyp-XVIII、Gyp-XVII、Gyp-CO和Gyp-Mb等,这有利于发现绞股蓝总皂苷中发挥生物活性的皂苷成分,为定向转化制备绞股蓝皂苷类成分提供理论依据。
绞股蓝皂苷具有广泛的生物活性,目前,由绞股蓝制成的产品一般由绞股蓝皂苷直接加工生产,如薇菜甜味绞股蓝复合功能保健泡腾片[91]、绞股蓝黑蚂蚁复合保健饮料[92]、富硒箬竹叶绞股蓝复合保健饮料[93]等。可将绞股蓝皂苷经过转化,再加工制成含绞股蓝皂苷的烘焙产品、冲泡颗粒或者果冻等即食产品,并进行推广。
参考文献:
[1] 史琳, 赵红, 张璐雅, 等. 绞股蓝药理作用的研究进展[J]. 药物评价研究, 2011, 34(2): 125-129.
[2] 刘世彪. 绞股蓝结构和发育与其总皂甙积累相关性的研究[D]. 西安: 西北大学, 2005: 9.
[3] 史琳, 宋东平, 潘明佳, 等. 绞股蓝皂苷成分的研究进展[J]. 药物评价研究, 2011, 34(6): 456-464.
[4] 孙文基. 关于长梗绞股蓝的初步考证[J]. 西北药学杂志, 1993, 8(3):137-138.
[5] 陈书坤. 绞股蓝属植物的分类系统和分布[J]. 植物分类学报, 1995,33(4): 403-410.
[6] 乐圆. 绞股蓝中皂苷含量的研究[D]. 西安: 陕西师范大学, 2010: 39-49.
[7] 彭亮, 李诒光, 陈杰, 等. 不同产地、不同品种间绞股蓝总皂苷和总多糖含量比较研究[J]. 亚太传统医药, 2015, 11(22): 21-24.DOI:10.11954/ytctyy.201522009.
[8] 周建华, 张兴亚. 绞股蓝开发研究新进展及应用[J]. 食品科技, 2010,35(2): 74-76. DOI:10.13684/j.cnki.spkj.2010.02.058.
[9] 李兰芳, 陈玲燕. 河北引种绞股蓝中总皂甙、总黄酮、多糖及氨基酸的分析[J]. 时珍国药研究, 1997, 8(2): 151-153.
[10] MA Shenglong, WANG Fengxia, YANG Xue, et al. Diversity of endogeny eumycetes in Gynostemma pentaphyllum and its correlation with gypenoside XLIX[J]. Journal of Chinese Medicinal Materials,2015, 38(3): 476-480. DOI:10.13863/j.issn1001-4454.2015.03.012.
[11] 秦江, 陈良华, 刘轩, 等. 不同地区绞股蓝总皂苷的分析及纯化[J].厦门大学学报(自然科学版), 2012, 51(1): 125-129.
[12] 梁晓庆, 肖娅萍, 王晶, 等. 不同产地绞股蓝Se、总蛋白及总皂苷含量及三者相关性分析[J]. 药物生物技术, 2012, 19(1): 52-54.
[13] 靳冰. 河南省野生绞股蓝资源调查保护及利用研究[D]. 郑州: 郑州大学, 2013: 26.
[14] 卢金清, 肖波, 陈黎, 等. 分光光度法测定绞股蓝中总皂苷的含量[J]. 湖北中医杂志, 2007, 29(1): 50-52. DOI:10.3969/j.issn.1000-0704.2007.01.033.
[15] 陈丹, 李柯, 吴梅青, 等. 湖南省不同产地绞股蓝药材中总皂苷含量测定[J]. 中国民族民间医药, 2013, 22(7): 17-18. DOI:10.3969/j.issn.1007-8517.2013.07.011.
[16] 李风华, 陈素红, 吕圭源. 7 个不同产地绞股蓝皂苷含量测定[J].中华中医药学刊, 2012, 30(4): 887-888. DOI:10.13193/j.archtcm.2012.04.217.lifh.061.
[17] 谭书明, 丁筑红, 朱庆刚, 等. 绞股蓝总皂甙提取工艺[J]. 贵州农学院学报, 1996, 15(4): 55-57. DOI:10.15958/j.cnki.Sdnyswxb.1996.04.012.
[18] SUBRAMANIYAM S, MATHIYALAGAN R, GYO I J, et al.Transcriptome profiling and insilico analysis of Gynostemma pentaphyllum using a next generation sequencer[J]. Plant Cell Reports,2011, 30(11): 2075-2083. DOI:10.1007/s00299-011-1114-y.
[19] RAZMOVSKI-NAUMOVSKI V, HUANG H W, TRAN V H, et al.Chemistry and pharmacology of Gynostemma pentaphyllum[J].Phytochemistry Reviews, 2005, 4(2/3): 197-219. DOI:10.1007/s11101-005-3754-4.
[20] 任颖, 王秋玉, 吴泽民, 等. 绞股蓝皂甙的药理研究进展[J]. 中华实用中西医杂志, 2001, 1(5): 988-989.
[21] 黄玉兰, 殷奎德, 岳才军. 响应面法优化微波提取绞股蓝愈伤组织中人参皂苷Rb1的工艺研究[J]. 激光生物学报, 2013, 22(6): 521-527.DOI:10.3969/j.issn.1007-7146.2013.06.008.
[22] 洪秀云, 吴晓英. 高效液相色谱-蒸发光检测法检测绞股蓝皂苷大孔树脂纯化产物[J]. 食品科学, 2012, 33(14): 251-254.
[23] 孔玉琼. 绞股蓝皂苷单体的分离纯化及其酶转化的研究[D]. 大连:大连工业大学, 2010: 4.
[24] YU Hongshan, LIU Hai, ZHANG Chunzhi, et al. Purification and characterization of gypenoside-α-L-rhamnosidase hydrolyzing gypenoside-5 into ginsenoside Rd[J]. Process Biochemistry, 2004,39(7): 861-867. DOI:10.1016/s0032-9592(03)00196-1.
[25] 朴香兰, 吴倩. 绞股蓝研究进展[J]. 时珍国医国药, 2010, 21(7):1758-1760. DOI:10.3969/j.issn.1008-0805.2010.07.091.
[26] 沈宏伟, 肖彦春, 车仁国, 等. 绞股蓝中总皂苷的提取及含量研究[J]. 食品科技, 2008, 33(4): 158-160. DOI:10.3969/j.issn.1005-9989.2008.04.047.
[27] HUANG Y C, LIN C Y, HUANG S F, et al. Effect and mechanism of ginsenosides CK and Rg1on stimulation of glucose uptake in 3T3-L1 adipocytes[J]. Journal of Agricultural and Food Chemistry, 2010,58(10): 6039-6047. DOI:10.1021/jf9034755.
[28] 明艳林, 郑志忠, 陈良华, 等. 人参皂苷IH901抗肝癌生长及其侵袭转移的作用机理[J]. 中国科学: 生命科学, 2011, 41(3): 219-225.DOI:10.1360/052010-540.
[29] 明艳林. 人参皂甙肠道代谢物IH-901抗肝癌分子靶点研究[D]. 厦门:厦门大学, 2007: 141.
[30] KANG K S, YAMABE N, KIM H Y, et al. Effects of heat-processed ginseng and its active component ginsenoside 20(S)-Rg3on the progression of renal damage and dysfunction in type 2 diabetic Otsuka Long-Evans Tokushima Fatty rats[J]. Biological & Pharmaceutical Bulletin, 2010, 33(6): 1077-1081. DOI:10.1248/bpb.33.1077.
[31] 李道中, 徐先祥. 皂苷类化学成分抗糖尿病作用研究概况[J]. 中南药学, 2008, 6(6): 741-742. DOI:10.11949/j.issn.0438-1157.20150914.
[32] KIM S K, PARK J H. Trends in ginseng research in 2010[J].Journal of Ginseng Research, 2011, 35(4): 389-398. DOI:10.5142/jgr.2011.35.4.389.
[33] 杨辉. 绞股蓝皂甙药理研究进展[J]. 淮南师范学院学报, 2001, 3(2):42-43. DOI:10.3969/j.issn.1009-9530.2001.02.016.
[34] CHEN D J, HU H G, XING S F, et al. Metabolite profiling of gypenoside LVI in rat after oral and intravenous administration[J].Archives of Pharmacal Research, 2015, 38(6): 1157-1167.DOI:10.1007/s12272-014-0506-2.
[35] 陈良华, 翁梦婷, 秦江, 等. 灰绿曲霉对绞股蓝皂苷的微生物转化及其生物活性[J]. 厦门大学学报(自然科学版), 2016, 55(5): 775-780.DOI:10.6043/j.issn.0438-0479.201603017.
[36] KIM E M, SEO J H, KIM J, et al. Production of ginsenoside aglycons and Rb1deglycosylation pathway profiling by HPLC and ESI-MS/MS using Sphingobacterium multivorum GIN723[J]. Applied Microbiology and Biotechnology, 2013, 97(18): 8031-8039. DOI:10.1007/s00253-013-4982-y.
[37] 马吉胜, 周秋丽, 费晓方, 等. 真菌对人参皂苷Rb1及人参二醇系皂苷的代谢作用[J]. 药学学报, 2001, 36(8): 603-605. DOI:10.16438/j.0513-4870.2001.08.010.
[38] MIN J W, KIM S H, KIM H B, et al. Transformation of gypenoside to ginseng saponin by crude enzymes from microorganisms[J]. 고려인삼학회 학술대회, 2008, 12: 98.
[39] SHIN K C, SEO M J, OH H J, et al. Highly selective hydrolysis for the outer glucose at the C-20 position in ginsenosides by β-glucosidase from Thermus thermophilus and its application to the production of ginsenoside F2from gypenoside XVII[J]. Biotechnology Letters, 2014,36(6): 1287-1293. DOI:10.1007/s10529-014-1472-y.
[40] ZHONG Feiliang, DONG Weiwei, WU Songquan, et al.Biotransformation of gypenoside XVII to Compound K by a recombinant β-glucosidase[J]. Biotechnology Letters, 2016, 38(7): 1-7.DOI:10.1007/s10529-016-2094-3.
[41] PARK S Y, BAE E A, SUNG J H, et al. Purification and characterization of ginsenoside Rb1-metabolizing beta-glucosidase from Fusobacterium K-60, a human intestinal anaerobic bacterium[J].Bioscience Biotechnology and Biochemistry, 2001, 65(5): 1163-1169.DOI:10.1271/bbb.65.1163.
[42] 张春燕. 人参皂苷微生物转化的代谢调控研究[D]. 上海: 复旦大学,2012: 59-68.
[43] 宋成程, 赵雪淞, 杜秀丽, 等. 毁灭柱孢菌中一种人参皂苷Rb1水解酶的纯化及酶学性质研究[J]. 微生物学杂志, 2011, 31(5): 20-26.DOI:10.3969/j.issn.1005-7021.2011.05.004.
[44] 于兆慧, 刘其媛, 崔莉, 等. 蜗牛酶转化人参皂苷Rb1制备人参稀有皂苷Compound K的研究[J]. 中华中医药杂志, 2015, 30(2): 412-416.
[45] 于兆慧, 刘其媛, 崔莉, 等. 微球固定化蜗牛酶转化人参皂苷Rb1制备人参稀有皂苷Compound K研究[J]. 中草药, 2014, 45(21): 3092-3097. DOI:10.7501/j.issn.0253-2670.2014.21.011.
[46] 姬庆, 郜玉钢, 赵岩, 等. 酶法转化制备人参皂苷单体的研究进展[J]. 中草药, 2014, 45(22): 3356-3360. DOI:10.7501/j.issn.0253-2670.2014.22.026.
[47] 程雅韵, 李志华, 汪庭瑞, 等. 产人参皂苷转化β-葡萄糖苷酶乳酸菌菌株的筛选[J]. 食品科技, 2014, 39(8): 13-17. DOI:10.13684/j.cnki.spkj.2014.08.004.
[48] CHENG L Q, NA J R, BANG M H, et al. Conversion of major ginsenoside Rb1to 20(S)-ginsenoside Rg3by Microbacterium sp.GS514[J]. Phytochemistry, 2008, 69(1): 218-224. DOI:10.1007/s10529-006-9059-x.
[49] YAN Q, ZHOU W, LI X W, et al. Purification method improvement and characterization of a novel ginsenoside hydrolyzing β-glucosidase from Paecilomyces Bainier sp. 229[J]. Bioscience Biotechnology and Biochemistry, 2008, 72(2): 352-359. DOI:10.1271/bbb.70425.
[50] 赵雪淞. 一种番茄褐孢霉产生的高选择性转化人参皂甙Rb1为Rd的β-葡萄糖苷酶[D]. 长春: 东北师范大学, 2009: 15-33.
[51] 刘欣, 崔昱, 杨凌, 等. 蜗牛酶中一种人参皂苷Rb1水解酶的分离纯化[J]. 生物工程学报, 2005, 21(6): 929-933. DOI:10.3321/j.issn.1000-3061.2005.06.013.
[52] 李东霄, 邓小莉, 王改霞, 等. 酵母菌对高含量人参皂苷的转化及其分子鉴定[J]. 江苏农业学报, 2013, 29(1): 33-38. DOI:10.3969/j.issn.1000-4440.2013.01.006.
[53] 苏金环. 镰孢霉菌β-葡萄糖苷酶的性质及应用研究[D]. 上海: 华东理工大学, 2009: 63-75.
[54] CHI H, JI G E. Transformation of ginsenosides Rb1and Re from Panax ginseng by food microorganisms[J]. Biotechnology Letters,2005, 27(11): 765-771. DOI:10.1007/s10529-005-5632-y.
[55] 许春春, 于渤浩, 王红蕾, 等. 重组嗜热β-葡萄糖苷酶转化稀有人参皂苷Rd和CK[J]. 高等学校化学学报, 2016, 37(2): 281-289.DOI:10.7503/cjcu20150536.
[56] 赵雪淞, 梁飞, 胡彦波, 等. 稀有人参皂苷C-K转化菌株的筛选鉴定及其转化特性[J]. 食品与生物技术学报, 2013, 32(9): 914-920.
[57] 南京林业大学. 一种酶法制备稀有人参皂苷20(S)-Rg3的方法:201610219176.5[P]. 2016-06-22[2017-04-15].
[58] QUAN L H, WANG C, JIN Y, et al. Isolation and characterization of novel ginsenoside-hydrolyzing glycosidase from Microbacterium esteraromaticum, that transforms ginsenoside Rb2to rare ginsenoside 20(S)-Rg3[J]. Antonie van Leeuwenhoek, 2013, 104(1): 129-137.DOI:10.1007/s10482-013-9933-1.
[59] 成乐琴, 金瑜真, 梁德春. 微生物酶催化制备人参皂苷20(S)-Rg2,20(S)-Rh1和20(S)-PPT[J]. 高等学校化学学报, 2011, 32(1): 67-73.
[60] 万会达, 李丹, 张珏. β-半乳糖苷酶选择性催化人参皂苷Rg3水解制备Rh2初探[J]. 食品与发酵工业, 2015, 41(8): 54-58. DOI:10.13995/j.cnki.11-1802/ts.201508010.
[61] YAN H, WANG X, WANG Y, et al. Antiproliferation and antimigration induced by gypenosides in human colon cancer SW620 and esophageal cancer Eca-109 cells[J]. Human & Experimental Toxicology, 2014, 33(5): 522-533. DOI:10.1177/0960327113497771.
[62] 郭绪林, 王铁军, 边宝林. 长梗绞股蓝的化学成分研究[J]. 药学学报,1997, 32(7): 524-529. DOI:10.16438/j.0513-4870.1997.07.009.
[63] LIAO C, ZHENG K, LI Y, et al. Gypenoside L inhibits autophagic flux and induces cell death in human esophageal cancer cells through endoplasm reticulum stress-mediated Ca2+release[J]. Oncotarget, 2016,7(30): 47387-47402. DOI:10.18632/oncotarget.10159.
[64] ZHENG K, LIAO C H, LI Y, et al. Gypenoside L, isolated from Gynostemma pentaphyllum, induces cytoplasmic vacuolation death in hepatocellular carcinoma cells through reactive-oxygen-speciesmediated unfolded protein response[J]. Journal of Agricultural and Food Chemistry, 2016, 64(8): 1702-1711. DOI:10.1021/acs.jafc.5b05668.
[65] 厦门华侨亚热带植物引种园. 绞股蓝皂苷XLV Ed及其制备方法:201410149616.5[P]. 2014-07-16[2017-04-15].
[66] 厦门华侨亚热带植物引种园. 绞股蓝皂苷XLVEd在制备抗肝癌药物中的应用: 201410388941.7[P]. 2014-12-10[2017-04-15].
[67] 厦门华侨亚热带植物引种园. 绞股蓝皂苷LVII在制备抗肝癌药物中的应用: 201410389665.6[P]. 2014-11-19[2017-04-15].
[68] GOU S H, HUANG H F, CHEN X Y, et al. Lipid-lowering,hepatoprotective, and atheroprotective effects of the mixture Hong-Qu and gypenosides in hyperlipidemia with NAFLD rats[J]. Journal of the Chinese Medical Association, 2016, 79(3): 111-121. DOI:10.1016/j.jcma.2015.09.002.
[69] SU J H, WANG H X, MA C Y, et al. Hypolipidemic mechanism of gypenosides via inhibition of pancreatic lipase and reduction in cholesterol micellar solubility[J]. European Food Research &Technology, 2016, 242(3): 305-312. DOI:10.1007/s00217-015-2540-9.
[70] 雷婧, 许韩婷, 苏洁, 等. 不同含量绞股蓝皂苷对高脂血症大鼠血脂的影响[J]. 上海中医药大学学报, 2014, 28(2): 60-64.
[71] YANG K, ZHANG H, LUO Y, et al. Gypenoside XVII prevents atherosclerosis by attenuating endothelial apoptosis and oxidative stress: insight into the ER α-mediated PI3K/Akt pathway[J].International Journal of Molecular Sciences, 2017, 18(2): 77-96.DOI:10.3390/ijms18020077.
[72] 林臻桢, 陈彤. 绞股蓝皂甙对实验性糖尿病小鼠的降糖作用研究[J]. 龙岩学院学报, 2011, 29(增刊 1): 51-53. DOI:10.3969/j.issn.1673-4629.2011.z1.019.
[73] 赵涛, 乐静, 李传静, 等. 绞股蓝总皂苷对2型糖尿病大鼠游离脂肪酸代谢的影响及改善胰岛素抵抗相关机制研究[J]. 安徽医药, 2017,21(1): 42-46. DOI:10.3969/j.issn.1009-6469.2017.01.011.
[74] ZHAO J, MING Y Z, WAN Q Q, et al. Gypenoside attenuates hepatic is chemia/reperfusion injury in mice via anti-oxidative and antiapoptotic bioactivities[J]. Experimental & Therapeutic Medicine,2014, 7(5): 1388-1392. DOI:10.3892/etm.2014.1569.
[75] SONG Y N, DONG S, WEI B, et al. Metabolomic mechanisms of gypenoside against liver fibrosis in rats: an integrative analysis of proteomics and metabolomics data[J]. PLoS ONE, 2017, 12(3):e0173598. DOI:10.1371/journal.pone.0173598.
[76] 赵世印, 邱华, 贺琴, 等. 绞股蓝皂苷对2型糖尿病合并非酒精性脂肪性肝病模型大鼠肝纤维化影响[J]. 医药导报, 2014, 33(2): 156-159. DOI:10.3870/yydb.2014.02.006.
[77] LI H, YING H, HU A, et al. Therapeutic effect of gypenosides on nonalcoholic steatohepatitis via regulating hepatic lipogenesis and fatty acid oxidation[J]. Biological & Pharmaceutical Bulletin, 2017,40(5): 650-657. DOI:10.1248/bpb.b16-00942.
[78] 黎展桃, 谢杏榕. 绞股蓝皂苷对非酒精性脂肪肝患者肝纤维化及肝功能的影响[J]. 中医药导报, 2015, 21(12): 70-73. DOI:10.13862/j.cnki.cn43-1446/r.2015.12.030.
[79] 陈亮, 彭景华, 冯琴, 等. 绞股蓝总皂苷对四氯化碳诱导的大鼠肝纤维化肝细胞凋亡的影响[J]. 中华中医药杂志, 2015, 30(1): 211-215.
[80] 张猛猛, 田冰洁, 洪秀云, 等. 纯化的绞股蓝皂苷的抗氧化活性研究[J]. 生物技术, 2013, 23(1): 76-78. DOI:10.3969/j.issn.1004-311X.2013.01.021.
[81] 肖凡, 杨艳芳, 陈会玲, 等. 绞股蓝大孔树脂分离物对DPPH自由基的清除作用研究[J]. 中国药师, 2015, 18(2): 241-243. DOI:10.3969/j.issn.1008-049X.2015.02.018.
[82] 丛敬, 郭丽, 丁晓慧, 等. 绞股蓝皂苷对人衰老皮肤成纤维细胞抗氧化酶活性的影响[J]. 中国医药导报, 2014, 11(2): 32-34.
[83] JU Y K, KIM J Y, CHI H C, et al. Development of pre-assessment indicator for skin aging and anti-aging effect of inner skin by the cream product containing Gynostemma pentaphyllum gypenoside fraction[J].Journal of the Society of Cosmetic Scientists of Korea, 2016, 42(3):303-309. DOI:10.15230/SCSK.2016.42.3.303.
[84] MENG Xiangbao, WANG Ming, SUN Guibo, et al. Attenuation of Aβ25-35-induced parallel autophagic and apoptotic cell death by gypenoside XVII through the estrogen receptor-dependent activation of Nrf2/ARE pathways[J]. Toxicology & Applied Pharmacology,2014, 279(1): 63-75. DOI:10.1016/j.taap.2014.03.026.
[85] MENG X B, LUO Y, LIANG T, et al. Gypenoside XVII enhances lysosome biogenesis and autophagy flux and accelerates autophagic clearance of amyloid-β through TFEB activation[J]. Journal of Alzheimers Disease, 2016, 52(3): 1135-1150. DOI:10.3233/JAD-160096.
[86] ZHAO T T, SHIN K S, CHOI H S, et al. Ameliorating effects of gypenosides on chronic stress-induced anxiety disorders in mice[J].BMC Complementary & Alternative Medicine, 2015, 15(1): 323-333.DOI:10.1186/s12906-015-0856-4.
[87] YU H J, SHI L Y, QI G X, et al. Gypenoside protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of mitogenactivated protein kinase mediated nuclear factor kappa B pathway in vivo and in vitro[J]. Frontiers in Pharmacology, 2016, 7: 148.DOI:10.3389/fphar.2016.00148.
[88] YU H J, ZHANG H S, ZHAO W H, et al. Gypenoside protects against myocardial ischemia-reperfusion injury by inhibiting cardiomyocytes apoptosis via inhibition of CHOP pathway and activation of PI3K/Akt pathway in vivo and in vitro[J]. Frontiers in Pharmacology,2016, 39(1): 123-136. DOI:10.1159/000445611.
[89] HONG S W, YANG J H, JOH E H, et al. Gypenoside TN-2 ameliorates scopolamine-induced learning deficit in mice[J]. Journal of Ethnopharmacology, 2011, 134(3): 1010-1013. DOI:10.1016/j.jep.2011.02.002.
[90] JOH E H, YANG J W, KIM D H. Gypenoside LXXIV ameliorates scopolamine-induced learning deficit in mice[J]. Planta Medica, 2010,76(8): 793-795. DOI:10.1055/S-0029-1240795.
[91] 刘金龙, 郑小江, 孙东发, 等. 薇菜甜味绞股蓝复合功能保健泡腾片研究[J]. 食品科学, 2009, 30(22): 394-398. DOI:10.3321/j.issn:1002-6630.2009.22.094.
[92] 任仙娥, 杨锋, 江丰, 等. 绞股蓝黑蚂蚁复合保健饮料的研制[J]. 食品科学, 2008, 29(11): 734-736. DOI:10.3321/j.issn:1002-6630.2008.11.171.
[93] 但悠梦. 富硒箬竹叶绞股蓝复合保健饮料的研制[J]. 食品科学,2000, 21(4): 67-68. DOI:10.3321/j.issn:1002-6630.2000.04.021.
Advances in Research on Bioactivity and Biotransformation of Gypenoside
ZHENG Yi1,2, LI Ni1,2, ZHENG Zhizhong2,3, CHEN Lianghua1,3, TONG Qingxuan2,3, MING Yanlin1,2,3,*, LIN Hetong1,*
(1. College of Food Science, Fujian Agriculture and Forestry University, Fuzhou 350002, China;2. Xiamen Key Laboratory of Plant Introduction and Quarantine and Plant Derived Products, Xiamen Overseas Chinese Subtropical Plant Introduction Garden, Xiamen 361002, China; 3. Fujian Key Laboratory of Subtropical Plant Physiology and Biochemistry,Fujian Institute of Subtropical Botany, Xiamen 361006, China)
Abstract:Gynostemma pentaphyllum, a plant of the Cucurbitaceae family, contains saponins, flavonoids, polysaccharides and other bioactive ingredients and has many bioactivities such as inhibiting tumor, reducing blood fat and blood sugar, antiaging, and protecting cells. Gypenoside, a major active ingredient in G. pentaphyllum, has arisen much attention in recent years, because it contains the same mother nucleus of dammarane-type tetracyclic triterpenoids as ginsenoside. In recent years, modification of the glycosidic moiety of gypenoside by bioconversion for derivatives with improved activity has become a research hotspot, and abundant studies on this topic exist in the literature. However, a systematic review is still lacking. In this context, this paper reviews recent advances in research on the structure and classification of gypenosides, the difference and similarity between gypenosides and ginsenosides, and the biotransformation and bioactivity of gypenosides.Finally, directions for future research are put forward. Hopefully, this review will provide insights for gypenosides biotransformation in vitro.
Keywords:Gynostemma pentaphyllum; gypenoside; biotransformation; bioactivities
DOI:10.7506/spkx1002-6630-201813048
收稿日期:2017-04-15
基金项目:厦门市科技惠民项目(3502Z20154083);厦门市科技创新项目(3502Z20132009);福建农林大学高水平大学建设项目(612014042)
第一作者简介:郑溢(1991—),女,硕士研究生,研究方向为食品科学。E-mail:960246011@qq.com
*通信作者简介:明艳林(1972—),男,研究员,博士,研究方向为食品科学、植物功能性活性成分。E-mail:xmyanlin@gmail.com林河通(1967—),男,教授,博士,研究方向为食品科学。E-mail:hetonglin@163.com
中图分类号:TS201.4;Q819
文献标志码:A
文章编号:1002-6630(2018)13-0324-10
引文格式:郑溢, 李旎, 郑志忠, 等. 绞股蓝皂苷生物转化与活性的研究进展[J]. 食品科学, 2018, 39(13): 324-333.
DOI:10.7506/spkx1002-6630-201813048. http://www.spkx.net.cn
ZHENG Yi, LI Ni, ZHENG Zhizhong, et al. Advances in research on bioactivity and biotransformation of gypenoside[J].Food Science, 2018, 39(13): 324-333. (in Chinese with English abstract)
DOI:DOI:10.7506/spkx1002-6630-201813048.http://www.spkx.net.cn