王 聪,樊 燕*,李兆杰,薛 勇,侯 虎,薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
摘 要:研究发酵温度(15、25 ℃和35 ℃)对南极磷虾虾酱静态和动态流变性质及风味品质的影响。结果表明,南极磷虾虾酱是一种剪切变稀的非牛顿流体,具有弱凝胶特性。随着发酵温度的升高和时间的延长,样品的凝胶特性减弱,35 ℃对虾酱凝胶结构的弱化作用最显著。25 ℃发酵能提高虾酱的凝胶稳定性,发酵至9 d时样品的表观黏度、储能模量和损耗模量均达到最大。利用顶空固相微萃取-气相色谱-质谱联用技术在3 个温度发酵虾酱中分别分离鉴定出39、41、37 种挥发性风味物质,其中(E,E)-2,4-庚二烯醛、壬醛、癸醛、苯甲醛和苯并噻唑在3 种虾酱中均被检出,为南极磷虾虾酱的主体风味成分;25 ℃发酵虾酱中还鉴定出3-乙基-2,5,-二甲基吡嗪和2,3,5-三甲基-6-乙基吡嗪,其增强了虾酱的风味;35 ℃发酵虾酱中则检出产生腥臭味的成分三甲胺。结合感官评价,25 ℃发酵9~12 d的南极磷虾虾酱具有最佳的流变特性和风味品质。
关键词:南极磷虾虾酱;流变特性;固相微萃取-气相色谱-质谱;挥发性风味成分;发酵温度
虾酱是我国沿海地区及东南亚各国常见的调味品之一,是小型虾在高盐条件下利用传统发酵方法制成的紫红色黏稠状食品[1]。因其含有大量的必需氨基酸和不饱和脂肪酸等营养物质,同时具有鲜美独特的风味,深受沿海居民的喜爱[2]。南极磷虾(Euphausia superba)生物量巨大,蛋白质量分数约为11.9%~15.4%,且富含人体所需的全部9 种必需氨基酸,是地球上最大的动物蛋白库之一[3-4]。南极磷虾蛋白营养价值极高,其生物价优于牛奶蛋白和其他动物蛋白,仅次于鸡蛋蛋白[5],是生产发酵虾酱的理想原料。
虾酱发酵过程伴随着复杂的微生物、理化和生化变化,蛋白质、糖类、脂肪等物质在内源酶和微生物酶的作用下发生降解及进一步反应[6-7]。这些反应一方面产生多肽、氨基酸等营养物质和多种风味成分,影响产品的营养价值和风味[8];另一方面会改变产品的组织结构,影响产品的质地和流动性[9]。利用有效的分析检测技术,研究发酵食品的特征风味及风味形成机理已成为研究者关注的问题。顶空固相微萃取-气相色谱-质谱(solid phase micro-extraction-gas chromatography-mass spectrometry,SPME-GC-MS)联用技术操作简单,又具有样品用量少、检测限低、精度高等优点,是目前食品行业常用的挥发性成分分离与鉴定方法。Kleekayai等[10]利用SPMEGC-MS联用技术分析了泰国传统发酵虾酱Kapi中的挥发性风味成分,结果表明,Kapi的主要呈香物质是含氮化合物,尤其是吡嗪类物质。李莹等[11]采用SPME-GC-MS结合保留指数方法分析传统锦州虾酱中的挥发性物质,并对萃取条件进行优化,共得到44 种挥发性化合物,主要包括醛类、酮类、酯类、酸类、酚类、烷烃类和吡嗪类物质。目前,国内外对于虾酱的研究主要集中于生产工艺、营养成分、生物活性物质及菌株分离纯化等方面,对其流变特性,尤其对产品品质与流变特性之间的定量关系研究尚鲜见报道[12-14]。对于酱体食品,流变特性的优劣能直接决定食品的口感和生产、贮存过程中的稳定性,对保证产品的品质具有重要意义[15]。
温度是影响发酵的重要因素之一。本实验以南极磷虾为原料,在不同温度条件下发酵制备虾酱,利用流变仪在静态和动态流动模式下测定流变特征参数,对其流变特性进行比较分析;采用SPME-GC-MS分离鉴定南极磷虾虾酱中的挥发性风味物质组成,结合感官评价,分析虾酱风味品质变化规律,为优化传统虾酱的生产工艺和提高产品品质提供理论参考。
南极磷虾(Euphausia superba)购于中国水产有限公司,于-18 ℃冰箱中贮存备用。
2-甲氧基-5-硝基吡啶(纯度99%) 北京百威科技有限公司;甲醇(色谱纯) 霍尼伟东(上海)贸易有限公司。
DS-1型高速组织捣碎机 上海标本模型厂;SPX智能型生化培养箱 宁波市科技园区新江南仪器有限公司;MCR101型流变仪 奥地利安东帕有限公司;AB135-S型精密电子分析天平 瑞士梅特勒-托利多公司;DF-101S型集热式恒温加热磁力搅拌器 邦西科技有限公司;50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(DVB/CAR/PDMS)萃取头、SPME手动进样柄、HP-5MS(30 m×0.25 mm,0.25 μm)毛细管色谱柱、6890N-5973i GC-MS联用仪 美国安捷伦公司;15 mL棕色顶空萃取瓶 上海安谱科学仪器有限公司。
1.3.1 南极磷虾虾酱制备
南极磷虾解冻后挑选、去除杂质,用组织捣碎机打碎成虾糜,称取虾糜600 g并按虾糜质量的18%添加食盐后充分混合均匀,装入经消毒的250 mL加胶塞锥形瓶中,置于恒温培养箱中分别在15 ℃(AK-1)、25 ℃(AK-2)、35 ℃(AK-3)条件下发酵15 d,发酵期间每隔3 d取样一次,分别记为D0(发酵0 d)、D3(发酵3 d)、D6(发酵6 d)、D9(发酵9 d)、D12(发酵12 d)、D15(发酵15 d)。
1.3.2 流变特征参数
采用MCR101型流变仪,选择直径为50 mm的不锈钢平行板测量系统,平行板间距为1 mm。
1.3.2.1 静态流变性质
剪切速率对表观黏度的影响:固定流变仪温度为25 ℃,使剪切速率从0.1 s-1上升到1 000 s-1,记录整个过程表观黏度随剪切速率的变化情况。
1.3.2.2 动态流变性质
在进行动态流变性质测定时,需要在线性黏弹区域内进行,才能不破坏样品的结构。线性黏弹区是指复合模量G*(G*=G+iG”)随振荡应变的变化而恒定的区域。在振荡应变为0.1%~1.0%的范围内,虾酱样品的复合模量G*与应变呈线性关系,因此本实验选择0.5%的振荡应变来测定南极磷虾虾酱的动态流变性质。
频率扫描:固定流变仪温度为25 ℃,振荡频率范围为0.1~10 Hz,测定频率扫描过程中储能模量G’、损耗模量G”和损失正切tan δ(tan δ=G”/G’)的变化。
温度扫描:温度扫描范围为10~100 ℃,升温速率为0.5 ℃/s,振荡频率为1 Hz,测定温度扫描过程中储能模量G’、损耗模量G”和损失正切tan δ(tan δ=G”/G’)的变化。
1.3.3 挥发性风味成分分析
1.3.3.1 SPME条件
准确称取3 g(精确到0.001 g)样品装入15 mL顶空萃取瓶中,同时加入10 μL内标物2-甲氧基-5-硝基吡啶(50 mg/L),置于磁力搅拌台上,设定搅拌转速为300 r/min,85 ℃水浴加热平衡10 min后,将萃取头针管插入顶空瓶的硅胶瓶垫,伸出50/30 μm DVB/CAR/PDMS萃取头,萃取45 min后取出,迅速插入GC仪进样口,250 ℃解吸5 min。
1.3.3.2 GC-MS条件
G C条件:色谱柱:H P-5 M S毛细管柱(30 m×0.25 mm,0.25 μm);程序升温:初温35 ℃,保持3 min,以8.0 ℃/min升温至250 ℃,保持10 min;进样口和汽化室温度均为250 ℃;载气为He,体积流量1.3 mL/min,不分流。
MS条件:电子轰击离子源;电子能量70 eV;接口温度280 ℃;离子源温度230 ℃;扫描周期2.84 次/s;质量扫描范围m/z 50~500。
1.3.3.3 挥发性成分的定性及定量方法
定性方法参照文献[16]:各挥发性成分经GC分离,用MS仪进行分析鉴定,将挥发性成分MS图与计算机NIST标准谱库进行匹配,仅报道正、反匹配度大于800(最大值为1 000)的鉴定结果。
定量方法参照文献[17]:通过内标法计算待测挥发性成分的含量(假定各挥发性成分的绝对校正因子为1.0),计算公式如下。
式中:峰面积比例=挥发性成分峰面积/内标物峰面积;5为内标物质量/μg;3为虾酱样品质量/g。
1.3.4 感官评价
感官评价参考李丽华等[18]的方法。选取10 名成员组成感官评定小组,在对样品进行品评前,先对感官评定人员进行特殊培训,使之对感官属性的特征描述达成一致,以提高感官评价结果的准确性。对样品的色泽、形态、滋味及香气等感官属性进行评分(表1),每个样品重复3 次,评分结果取平均值。采用10 分制(0~10 分),其中8 分以上为最佳品质;6~8 分为较好品质;4~6 分为一般品质;4 分为感官评价可接受的界限,有腥味,虾酱开始出现轻微分层,色泽变暗,但仍可以食用;4 分以下为不合格品质。
表 1 南极磷虾虾酱的感官评分标准
Table 1 Criteria for sensory evaluation of krill paste

2.1.1 静态流变性质
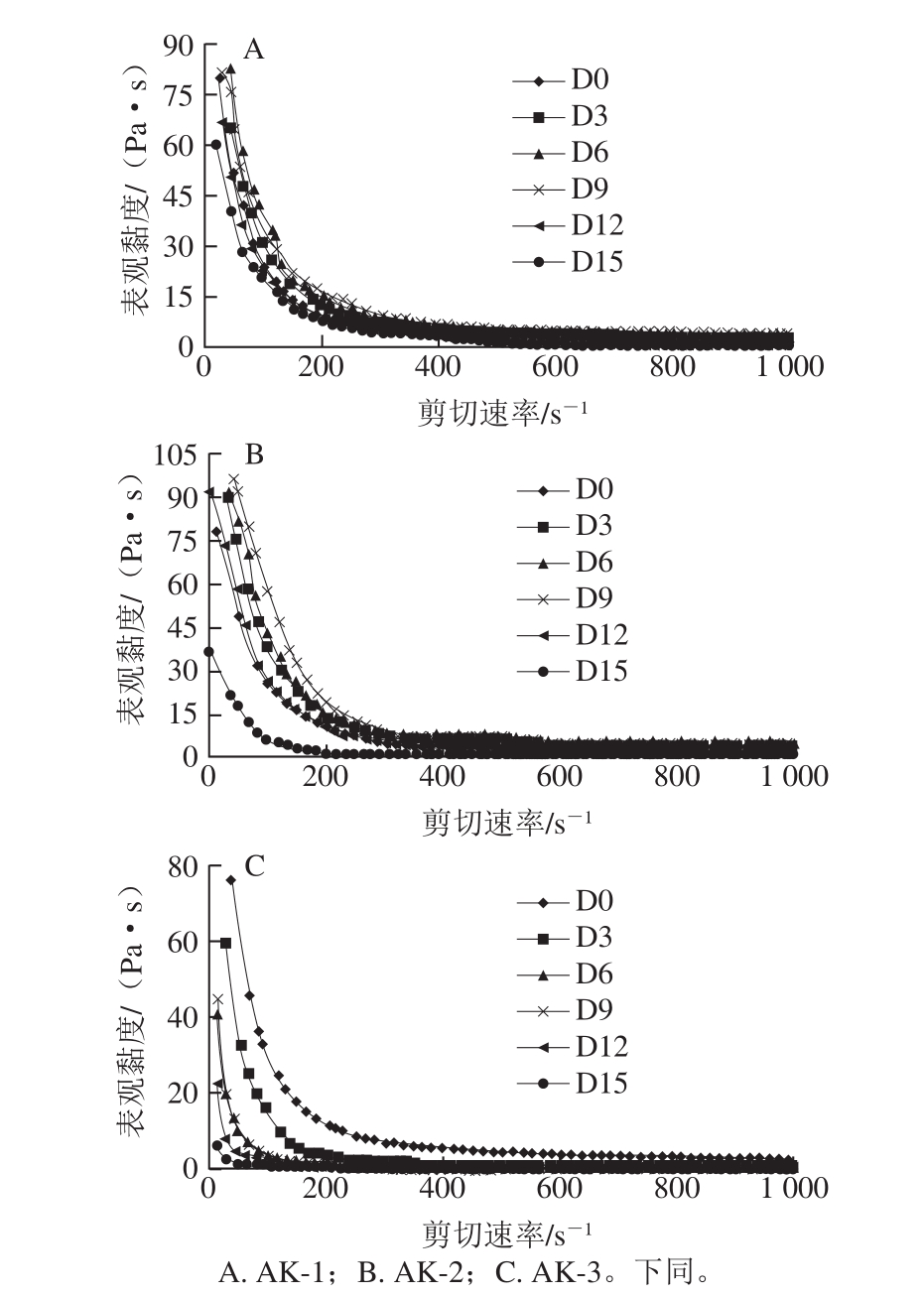
图 1 不同温度发酵过程中南极磷虾虾酱的流动曲线
Fig. 1 Flowing curves of Antarctic krill pastes fermented at different temperatures
剪切速率对不同温度发酵过程中南极磷虾虾酱表观黏度的影响如图1所示。随着剪切速率的增大,虾酱的表观黏度下降,当剪切速率大于400 s-1后,表观黏度的变化趋于平缓,说明该南极磷虾虾酱是具有剪切变稀特性的非牛顿流体,与文献[19]报道的结果一致。虾酱体系的表观黏度主要取决于蛋白质分子间的相互作用。静止时,大分子蛋白质相互交联形成网状结构,受到剪切力的作用,分子间的相互缠结被破坏,流层间的黏滞阻力下降,表观黏度减小。随着剪切运动的进行,蛋白质分子沿流动方向重新排列成线,当剪切速率增大到某一值时,这种排列逐渐完善,表观黏度趋于稳定[20]。
温度是调控各种生化反应和影响微生物生长的重要因素。15 ℃发酵时,发酵时间对虾酱表观黏度影响相对较小,这可能是因为,在低温条件下,虾酱中的酶活力较弱,微生物生长繁殖速率缓慢,发酵作用不显著;随着发酵温度的升高,微生物代谢速率增加,内源性蛋白酶和微生物蛋白酶活力增强,促进蛋白质分解,发酵时间对虾酱表观黏度的影响显著。当发酵温度为35 ℃时,不同时期样品间的表观黏度差异最大,且随着发酵时间的延长迅速下降。剪切速率相同时,不同发酵温度下同一发酵时期的虾酱样品的表观黏度大小顺序为:AK-2>AK-1>AK-3,且AK-3的表观黏度明显小于AK-1和AK-2。随着温度的升高,蛋白质降解生成多肽、氨基酸和其他小分子含氮化合物,从而破坏了蛋白质分子之间的交联,使原来的紧密连接的蛋白网状结构劣化而变得松散,导致表观黏度减小[21-22]。
另外,25 ℃发酵虾酱的表观黏度在发酵前期随时间的延长呈递增趋势,并在发酵9 d时达到最大,后又迅速减小。这可能是因为发酵初始阶段,在蛋白酶的水解作用下,更多的疏水基团被暴露出来,蛋白质分子的疏水相互作用得到加强[23];另一方面,微生物生长繁殖分解碳水化合物产生有机酸,使体系pH值下降,逐渐接近蛋白质的等电点,分子间静电斥力减弱,有利于蛋白质分子的聚集[24]。但当发酵超过9 d后,蛋白酶的水解作用占据主导,虾酱中的大量蛋白质被酶解,分子链断裂,虾酱蛋白质网络骨架被大范围破坏,此时再增强分子间的相互作用力也无法阻止体系交联结构的弱化和黏度的下降[25]。
2.1.2 动态流变性质
2.1.2.1 频率扫描

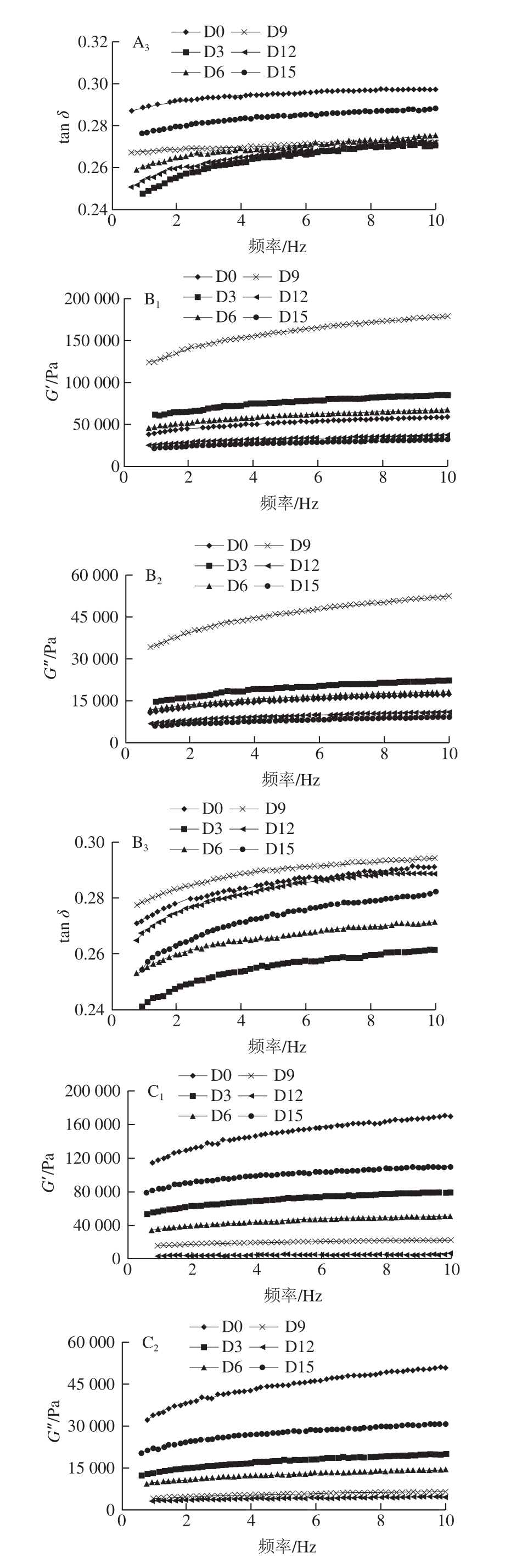
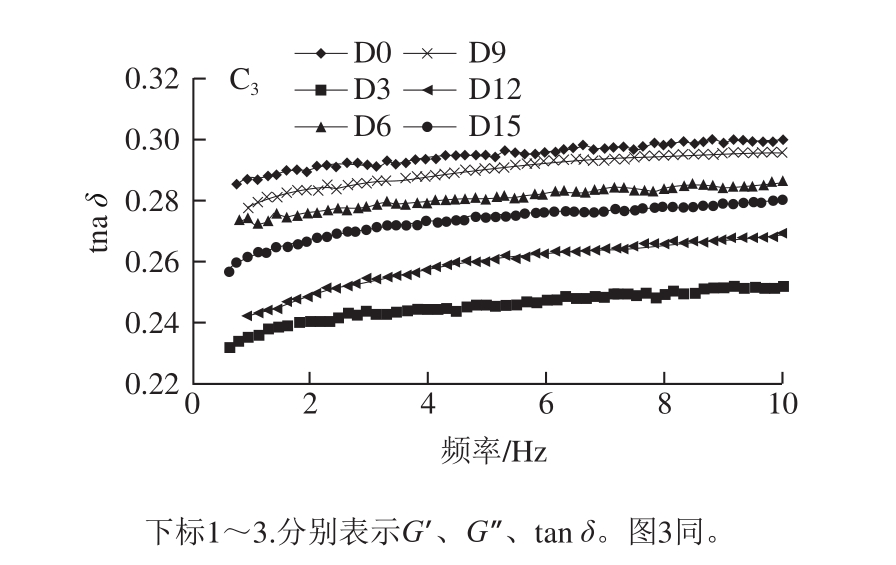
图 2 不同温度发酵过程中南极磷虾虾酱的G’、G”和tan δ在频率扫描中的变化
Fig. 2 Frequency-dependent changes in G’, G” and tan δ of Antarctic krill pastes fermented at different temperatures
G’反映材料在发生形变时储存能量的能力和弹性大小,G”反映材料在发生形变时释放能量的能力和黏性大小。体系的黏弹性由tan δ(G”/G’)表示,tan δ>1,体系中黏性成分占主导,表现流体的特征;tan δ<1,体系中弹性成分占主导,表现固体的特征[26]。由图2可知,在整个频率范围内,虾酱样品的G’始终明显大于G”,即tan δ<1,呈现出类固体的弱凝胶特性。根据黏弹性模量与频率的关系,蛋白凝胶可分为纠缠态网络(生物聚合体,强频率依赖性)、化学凝胶(共价交联,非频率依赖性)和物理凝胶(非共价连接,弱频率依赖性)[27]。从图2可以观察到,随着频率的升高,G’缓慢增大,表现为较小的频率依赖性,且G’和G”无交叉;因此可以判定南极磷虾虾酱蛋白凝胶体系属于以非共价键连接为主的物理凝胶。
AK-3不同发酵时期的样品G’差距最大,AK-2次之,AK-1的G’相差最小。在相同频率下,AK-2发酵9 d的G’明显高于其他样品,由静态流变特性的分析可知,此样品的黏度也最大,说明此发酵条件下的虾酱因蛋白分子的交联增强而内部结构更紧密,在遭受变形后的能量恢复能力较强。最低的G’出现在AK-3发酵后期的样品中,G”的变化趋势与G’相同,G’的下降表明了体系凝胶结构的弱化[28]。
2.1.2.2 温度扫描
从图3可以看出,当温度由10 ℃程序升温至100 ℃ 时,体系的G’和G”均显著减小,但在整个升温过程中,G’始终大于G”,表明体系的黏弹性随着温度的升高而逐渐下降,但依然维持着弱凝胶结构。氢键、疏水相互作用、静电斥力等非共价键以及二硫键是维持蛋白凝胶结构的主要化学作用力[29]。初始升温过程中,蛋白质分子运动加剧,分子间距增大,蛋白网络结构变得疏松,松散结合的分子会随温度的升高更加剧烈地运动,导致分子链断裂,体系的G’和G”下降。该过程中虾酱体系凝胶结构的软化主要是由蛋白质分子间氢键作用力的减弱引起的。随着温度的继续升高,蛋白质变性,蛋白分子间发生聚集,最后形成沉淀。形成沉淀的蛋白聚集体不利于蛋白胶粒之间的相互连接,导致蛋白凝胶网络结构的弱化。此过程中G’和G”的下降取决于疏水相互作用、静电斥力或二硫键。

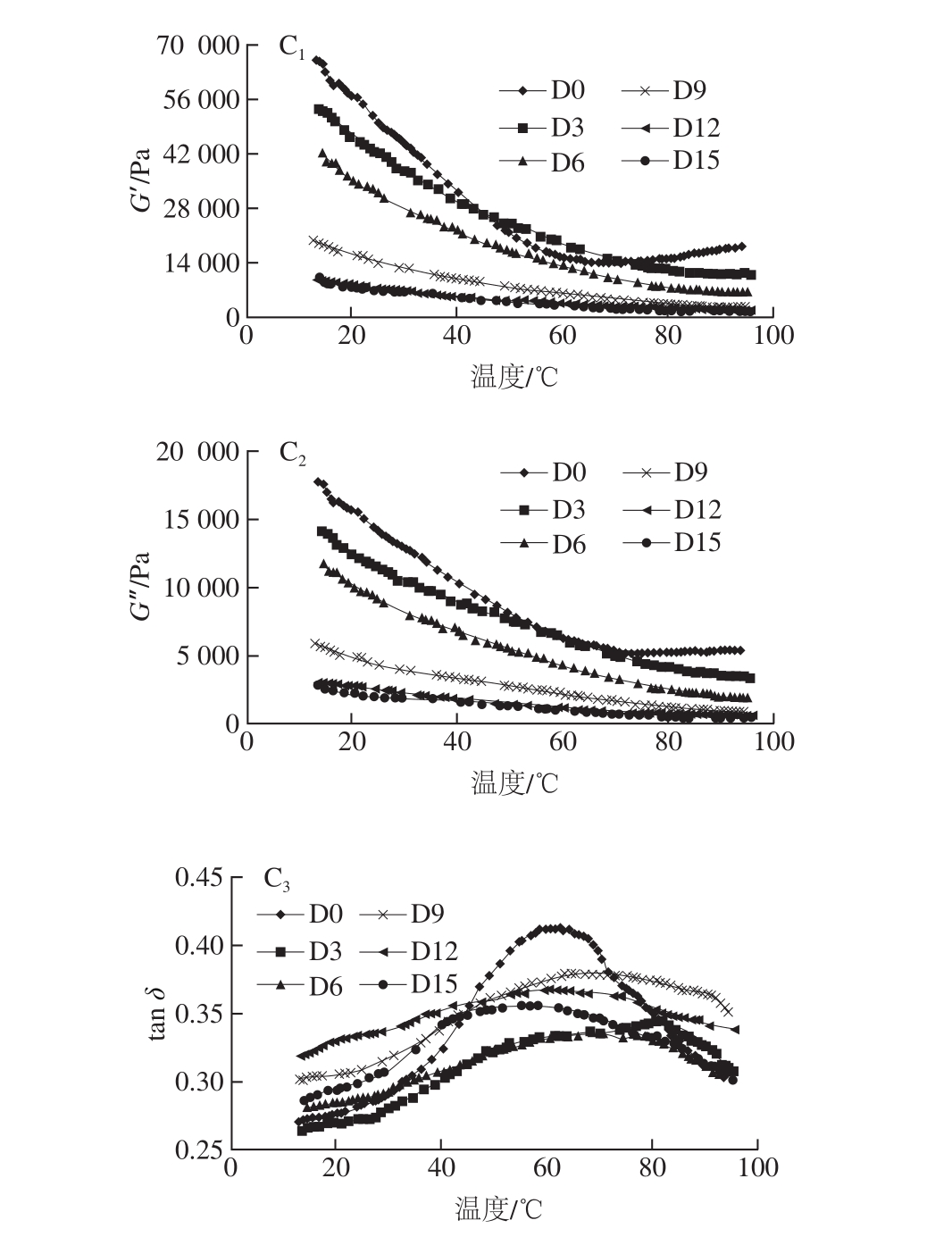
图 3 不同温度发酵过程中南极磷虾虾酱的G’、G”和tan δ 在温度扫描中的变化
Fig. 3 Temperature-dependent changes in G’, G” and tan δ of Antarctic krill pastes fermented at different temperatures
在相同温度下,AK-2的G’和G”略高于AK-1,且明显高于AK-3的G’和G”。AK-2发酵过程中的G’和G”呈现先上升后下降的趋势,并于发酵9 d时达到最大,这与静态流变学测定的结果相吻合。
通过GC-MS检测,并经NIST谱库检索分析,得到南极磷虾虾酱挥发性风味成分鉴定结果见表2。从南极磷虾虾酱中共分离鉴定出50 种挥发性风味物质,AK-1、AK-2和AK-3分别检出39、41、37 种,主要由醛类、酯类、酮类、酸类、醇类、烃类及含氮、硫类化合物组成,其中对南极磷虾虾酱风味影响最大的是醛类和含氮、硫化合物。
已有研究表明,羰基化合物(包括醛类和酮类)是多种传统腌腊肉制品中重要的挥发性风味物质,其赋予产品青香、水果香和坚果香等芳香特质[11]。醛类化合物因其阈值相对较低,具有很强的与其他物质重叠的风味效应,对产品整体香气的形成有着显著影响[30],是南极磷虾虾酱中的主要挥发性风味成分。在南极磷虾虾酱中共检测到9 种醛类化合物,具有风味活性的物质有7 种,其中苯甲醛、(E,E)-2,4-庚二烯醛、壬醛和癸醛在不同温度发酵的虾酱中均被检出。这些醛类化合物主要来源于亚油酸、亚麻酸等不饱和脂肪酸的氧化分解,也有可能来源于氨基酸的Strecker降解[31]。在发酵期间,醛类化合物的含量随发酵时间的延长基本呈上升趋势,含量最高的是(E,E)-2,4-庚二烯醛,呈现出油脂香和青香;壬醛和癸醛次之,呈现出蜡香、橘香和植物香气;苯甲醛在发酵后期含量较高,具有强烈的苦杏仁气息。另外,AK-3于15 d还检测出3-甲基丁醛和(E,E)-2,4-辛二烯醛,分别呈现坚果香和黄瓜的青香;AK-2检测到(E,E)-2,4-辛二烯醛,具有花香和蜂蜜香。
不同温度条件下发酵的虾酱样品中均检出苯并噻唑,因在其他产品中含量普遍偏低而其感觉阈值较高(80 μg/kg),通常被认为对产品的风味贡献不大。但在发酵过程中,其含量不断增大并超过感觉阈值,因此可能为南极磷虾虾酱特有的风味物质。AK-2检测出2 种吡嗪类物质,分别是3-乙基-2,5,-二甲基吡嗪和2,3,5-三甲基-6-乙基吡嗪,具有烘烤香、坚果香和土豆香。吡嗪类化合物主要来源于氨基酸的Strecker降解,体现烤香和肉香,是多种发酵酱类食品中均有的重要呈香物质[10]。另外,AK-3于15 d检测出三甲胺,它是海产生物中存在的氧化三甲胺经还原产生的;同时,南极磷虾虾酱中的其他胺类物质含量极高,这些胺类物质对水产品腥味、氨味的产生起着至关重要的作用,并会随着贮藏时间的延长而含量继续增加[32]。
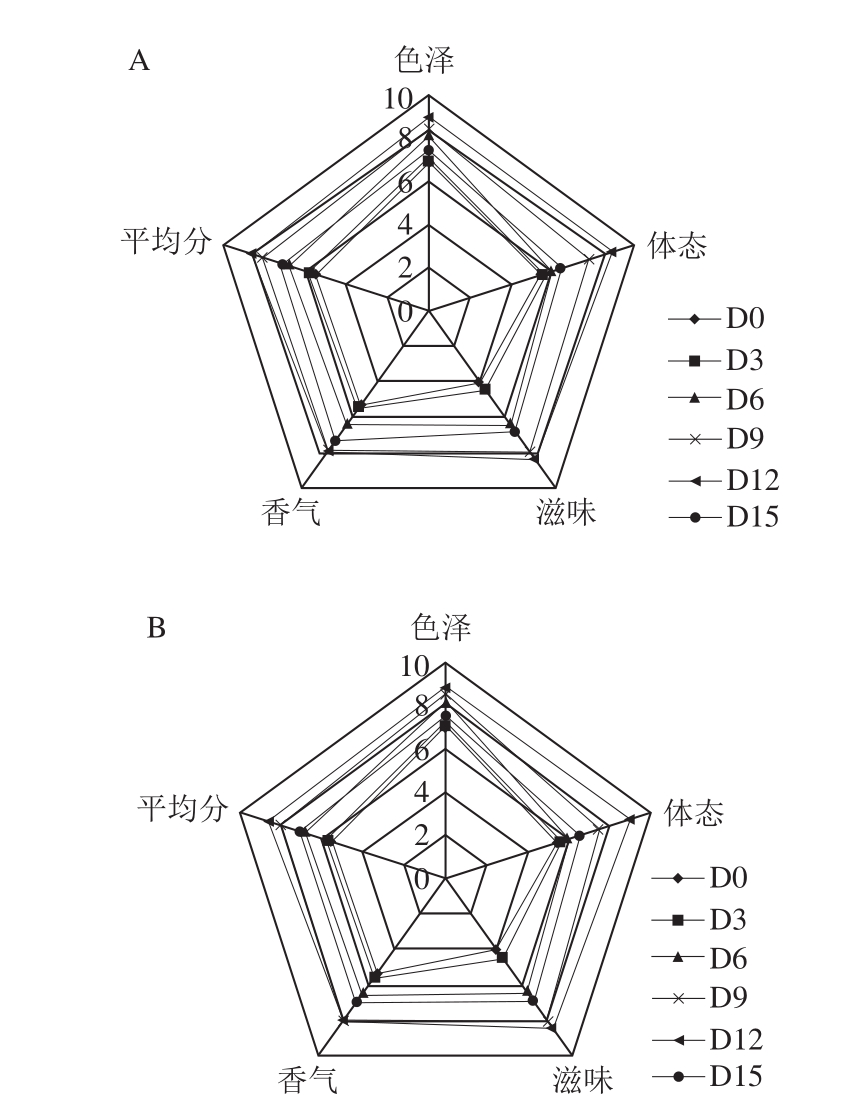
表 2 不同南极磷虾虾酱的挥发性风味成分及其含量
Table 2 Volatile composition of different Antarctic krill pastes μg/kg

注:ND.未检出。
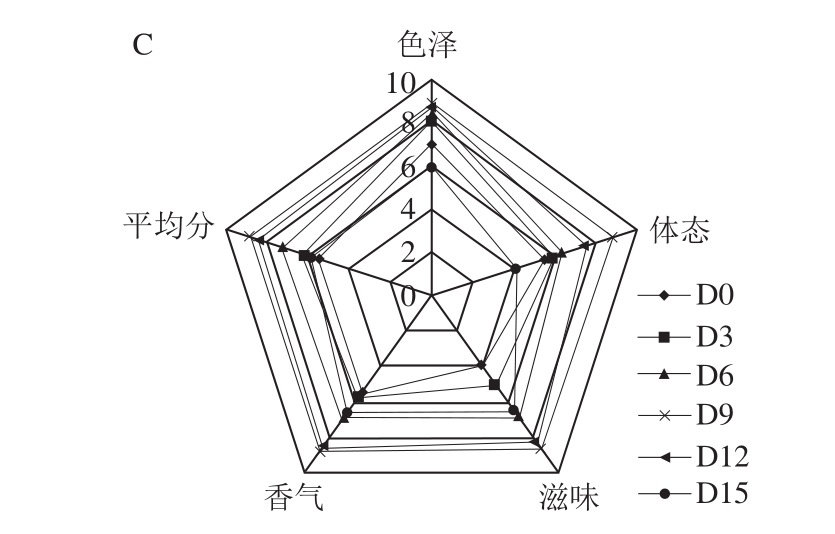
图 4 不同温度发酵过程中南极磷虾虾酱的感官特性
Fig. 4 Sensory profiles of Antarctic krill pastes fermented at different temperatures during fermentation periods
由图4可知,不同温度发酵过程中的南极磷虾虾酱的色泽、香气、滋味及整体评定结果无明显差异。而在体态方面,AK-3发酵15 d的样品评分明显低于其他样品,虾酱发酵至12 d时即出现了分层现象,流变特性测定结果也显示,发酵时间相同时,AK-3的黏度和黏弹性模量也低于其他两组,说明发酵温度过高、时间过长会劣化产品的组织结构,影响其口感。AK-1和AK-2均在12 d时感官评分最高,AK-3的感官评分在9 d时达到最高,且AK-2发酵12 d的感官评分略高于AK-1和AK-3。根据流变学测定结果,AK-2发酵9 d时具有最佳的流变特性,且AK-2中呈香化合物种类最为丰富;因此可初步判断AK-2发酵9~12 d时的虾酱具有最佳品质。
通过静态和动态流变性质测定,结果表明南极磷虾虾酱形成了弱凝胶结构,是具有剪切变稀特性的非牛顿流体。发酵温度越高,发酵过程中虾酱的流变学特性变化越大,发酵温度过高、发酵时间过长对虾酱的凝胶结构有明显的弱化作用,而25 ℃发酵能提高虾酱的凝胶稳定性,发酵至9 d时样品的表观黏度、G’和G”达到最大。利用SPME-GC-MS技术从南极磷虾虾酱中共分离鉴定出50 种挥发性风味物质,其中对南极磷虾虾酱风味贡献最大的是醛类和含氮、硫类化合物。南极磷虾虾酱的特征香气以脂肪香、坚果香和青香为主,其特征风味物质是(E,E)-2,4-庚二烯醛、壬醛、癸醛、苯甲醛、3-乙基-2,5,-二甲基吡嗪、2,3,5-三甲基-6-乙基吡嗪和苯并噻唑。25 ℃发酵9~12 d的南极磷虾虾酱具有最佳的流变学性质和风味特性,本研究结果可为优化传统虾酱的生产工艺和提高产品品质提供参考。
参考文献:
[1] 戴萍, 李展锐, 潘裕, 等. 温度对传统虾酱发酵过程中安全性品质影响[J]. 食品科技, 2013, 38(4): 286-290. DOI:10.13684/j.cnki.spkj.2013.04.032.
[2] 吴帅, 杨锡洪, 解万翠, 等. 低值虾发酵制备传统虾酱风味的综合分析与比较[J]. 食品科学, 2016, 37(2): 121-127. DOI:10.7506/spkx1002-6630-201602021.
[3] 丁浩宸, 李栋芳, 张燕平, 等. 南极磷虾肉糜冷藏过程中蛋白水解酶的稳定性及自溶特性[J]. 食品科学, 2014, 35(4): 200-204.DOI:10.7506/spkx1002-6630-201404041.
[4] WANG Y C, WANG R, CHANG Y G, et al. Preparation and thermoreversible gelling properties of protein isolate from defatted Antarctic krill (Euphausia superba) byproducts[J]. Food Chemistry, 2015, 188:170-176. DOI:10.1016/j.foodchem.2015.04.126.
[5] CHEN Y C, JACZYNSKI J. Gelation of protein recovered from whole Antarctic krill (Euphausia superba) by isoelectric solubilization/precipitation as affected by functional additives[J].Journal of Agricultural and Food Chemistry, 2007, 55(5): 1814-1822.DOI:10.1021/jf0629944.
[6] HAJEB P, JINAP S. Fermented shrimp products as source of umami in Southeast Asia[J]. Journal of Nutrition & Food Sciences, 2013(Suppl 10): 6. DOI:10.4172/2155-9600.S10-006.
[7] PRAPASUWANNAKUL N, SUWANNAHONG K. Chemical composition and antioxidant activity of klongkone shrimp paste[J].Procedia-Social and Behavioral Sciences, 2015, 197: 1095-1100.DOI:10.1016/j.sbspro.2015.07.351.
[8] KIM Y B, CHOI Y S, KU S K, et al. Comparison of quality characteristics between belacan from Brunei Darussalam and Korean shrimp paste[J]. Journal of Ethnic Foods, 2014, 1(1): 19-23.DOI:10.1016/j.jef.2014.11.006.
[9] VUKIC V R, HMJEZ D V, KANURIC K G, et al. The effect of kombucha starter culture on the gelation process, microstructure and rheological properties during milk fermentation[J]. Journal of Texture Studies, 2014, 45(4): 261-273. DOI:10.1111/jtxs.12071.
[10] KLEEKAYAI T, PINITKLANG S, LAOHAKUNJIT N, et al. Volatile components and sensory characteristics of Thai traditional fermented shrimp pastes during fermentation periods[J]. Journal of Food Science and Technology, 2016, 53(3): 1399-1410. DOI:10.1007/s13197-015-2142-3.
[11] 李莹, 吕欣然, 马欢欢, 等. 应用顶空-固相微萃取结合气相色谱-质谱联用技术分析传统锦州虾酱中挥发性物质[J]. 食品与发酵工业,2016, 42(9): 210-216. DOI:10.13995/j.cnki.11-1802 /ts.201609036.
[12] JUNG J Y, LEE S H, LEE H J, et al. Microbial succession and metabolite changes during fermentation of saeu-jeot: traditional Korean salted seafood[J]. Food Microbiology, 2013, 34(2): 360-368.10. DOI:1016/j.fm.2013.01.009.
[13] FAITHONG N, BENJAKUL S. Changes in antioxidant activities and physicochemical properties of Kapi, a fermented shrimp paste, during fermentation[J]. Journal of Food Science and Technology, 2014,51(10): 2463-2471. DOI:10.1007/s13197-012-0762-4.
[14] 连鑫, 杨锡洪, 解万翠, 等. 中国传统虾酱中产香酵母的分离鉴定及其耐盐性分析[J]. 现代食品科技, 2014, 30(7): 92-97. DOI:10.13982/j.mfst.1673-9078.2014.07.015.
[15] 王颖颖, 侯利霞. 酱体食品的流变学特性及稳定性研究进展[J]. 中国调味品, 2016, 41(7): 153-156. DOI:10.3969/j.issn.1000-9973.2016.07.03.
[16] 许刚, 丁浩宸, 张燕平, 等. 南极磷虾头胸部和腹部挥发性风味成分对比[J]. 食品科学, 2014, 35(22): 146-149. DOI:10.7506/spkx1002-6630-201422027.
[17] 顾赛麒, 王锡昌, 陶宁萍, 等. 顶空固相微萃取-气质联用及电子鼻技术检测中华绒螯蟹不同可食部位中的香气成分[J]. 食品科学, 2013,34(18): 239-244. DOI:10.3724/SP.J.1096.2011.01852.
[18] 李丽华, 赵玲, 曹荣, 等. 原料虾新鲜度对虾酱品质的影响[J]. 保鲜与加工, 2014, 14(5): 31-35; 47. DOI:10.3969/j.issn.1009-6221.2014.05.006.
[19] GUO Q, MU T H. Emulsifying properties of sweet potato protein: effect of protein concentration and oil volume fraction[J]. Food Hydrocolloids,2011, 25(1): 98-106. DOI:10.1016/j.foodhyd.2010.05.011.
[20] 雷莉, 赵强, 范婷, 等. 高压微射流处理对白木通籽分离蛋白结构及流变性质的影响[J]. 现代食品科技, 2015, 31(2): 145-150; 293.DOI:10.13982/j.mfst.1673-9078.2015.2.02.
[21] CREUSOT N, GRUPPEN H. Enzyme-induced aggregation and gelation of proteins[J]. Biotechnology Advances, 2007, 25(6): 597-601. DOI:10.1016/j.biotechadv.2007.07.007.
[22] XU Y S, XIA W S, YANG F, et al. Effect of fermentation temperature on the microbial and physicochemical properties of silver carp sausages inoculated with Pediococcus pentosaceus[J]. Food Chemistry,2010, 118(3): 512-518. DOI:10.1016/j.foodchem.2009.05.008.
[23] 杨方, 夏文水. 鱼肉内源酶对发酵鱼糜凝胶特性的影响[J]. 食品与发酵工业, 2015, 41(11): 18-22. DOI:10.13995/j.cnki.11-1802/ts.201511004.
[24] WANG Y C, CHANG Y G, XUE Y, et al. Rheology and microstructure of heat-induced fluid gels from Antarctic krill(Euphausia superba) protein: effect of pH[J]. Food Hydrocolloids,2015, 52: 510-519. DOI:10.1016/j.foodhyd.2015.07.032.
[25] TAKEDA H, SEKI N. Enzyme-catalyzed cross-linking and degradation of myosin heavy chain in walleye Pollack surimi paste during setting[J]. Fish Science, 1996, 62: 462-467.
[26] MARTÍNEZ-PRECIADO A H, ESTRADA-GIRÓN Y, GONZÁLEZÁLVAREZ A, et al. Physicochemical, morphological and rheological properties of canned bean pastes “negro Queretaro” variety (Phaseolus vulgaris L.)[J]. Journal of Food Science and Technology, 2014, 51(9):1795-1805. DOI:10.1007/s13197-012-0737-5.
[27] TUNICK M H. Small-strain dynamic rheology of food protein networks[J]. Journal of Agricultural and Food Chemistry, 2011, 59(5):1481-1486. DOI:10.1021/jf1016237.
[28] 于甜. 软质食品流变学特性及测量方法的研究[D]. 青岛: 中国海洋大学, 2012: 21-22.
[29] 王彦超. 南极磷虾(Euphausia superba)蛋白肽的精制及应用基础研究[D]. 青岛: 中国海洋大学, 2016: 61-62.
[30] ZHOU X X, CHONG Y Q, DING Y T, et al. Determination of the effects of different washing processes on aroma characteristics in silver carp mince by MMSE-GC-MS, e-nose and sensory evaluation[J]. Food Chemistry, 2016, 207(2): 205-213. DOI:10.1016/j.foodchem.2016.03.026.
[31] 李来好, 丁丽丽, 吴燕燕, 等. 咸鱼中的挥发性风味成分[J]. 水产学报, 2012, 36(6): 979-988. DOI:10.3724/SP.J.1231.2012.27682.
[32] 夏延斌. 食品风味化学[M]. 北京: 化学工业出版社, 2008: 182.
Effect of Fermentation Temperature on Rheological Properties and Flavor Quality of Antarctic Krill(Euphausia superba) Paste
WANG Cong, FAN Yan*, LI Zhaojie, XUE Yong, HOU Hu, XUE Changhu
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Abstract:Static and dynamic rheological properties, volatile compounds and sensory characteristics of Antarctic krill(Euphausia superba) pastes fermented at different temperatures (15, 25, and 35 ℃) were investigated. The results showed that krill paste was non-Newtonian pseudoplastic fluid with shear thinning behavior, and had weak gel characteristics.Higher fermentation temperature and longer fermentation time could more significantly break up the gel structure of krill paste, especially at 35 ℃. Fermentation at 25 ℃ improved the stability of krill paste gel. The apparent viscosity, storage modulus and loss modulus of the samples reached maximum levels on the 9thday. A total of 39, 41 and 37 volatile flavor compounds were identified in the three different krill pastes by solid phase microextraction-gas chromatography-mass spectrometry. (E,E)-2,4-Heptadienal, nonanal, decanal, benzaldehyde and benzothiazole were found to significantly contribute to the characteristic odor of krill paste; in krill paste fermented at 25 ℃, 3-ethyl-2,5-dimethyl-pyrazine and 2,3,5-trimethyl-6-ethyl-pyrazine, enhancing its flavor, were also identified, and trimethylamine in krill paste fermented at 35 ℃, responsible for stinky, fishyodor. Krill paste fermented at 25 ℃ for 9 to 12 days showed the best rheological and flavor characteristics.
Keywords:Antarctic krill (Euphausia superba) paste; rheological properties; solid phase micro-extraction-gas chromatography-mass spectrometry; volatile flavor compounds; fermentation temperature
DOI:10.7506/spkx1002-6630-201815001
收稿日期:2017-04-13
基金项目:国家自然科学基金面上项目(31571865);国家自然科学基金重点项目(31330060);山东省科技重大专项(2015ZDZX05003)
第一作者简介:王聪(1993—),女,硕士研究生,研究方向为食品风味化学。E-mail:wangcongqdu@163.com
*通信作者简介:樊燕(1984—),女,实验师,博士,研究方向为食品风味化学。E-mail:fanyan@ouc.edu.cn
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2018)15-0001-09
引文格式:
王聪, 樊燕, 李兆杰, 等. 发酵温度对南极磷虾虾酱流变特性和风味品质的影响[J]. 食品科学, 2018, 39(15): 1-9.DOI:10.7506/spkx1002-6630-201815001. http://www.spkx.net.cn
>WANG Cong, FAN Yan, LI Zhaojie, et al. Effect of fermentation temperature on rheological properties and flavor quality of Antarctic krill (Euphausia superba) paste[J]. Food Science, 2018, 39(15): 1-9. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201815001. http://www.spkx.net.cn