李 普,刘贵梅,卢永翎,郑铁松,吕丽爽*
(南京师范大学金陵女子学院,江苏 南京 210097)
摘 要:模拟蛋白糖基化改性条件,建立小麦醇溶蛋白-糖体系,用气相色谱法和荧光光谱法(λex/λem=340 nm/465 nm)分别测定糖种类(包括单糖、二糖、多糖)、常用多糖(葡聚糖)质量浓度、改性温度、时间,以及天然抑制剂对体系中有害产物甲基乙二醛(methyl glyoxal,MGO)、乙二醛(glyoxal,GO)和荧光性晚期糖基化终产物(advanced glycation end products,AGEs)形成的影响,并对改性蛋白的乳化性能进行了验证。结果表明:单糖产生的各种有害产物的量远远高于多糖,尤其是MGO含量远高于GO;随着葡聚糖质量浓度的增加、改性温度的升高、改性时间的延长,3 种有害产物的量均呈先增加后趋于稳定的趋势;由于醇溶蛋白-葡聚糖改性是在强碱性、高温条件下进行,而常用的天然抑制剂儿茶素、槲皮素、芦丁、染料木素、阿魏酸、绿原酸、大黄素、辣椒素等在此条件下结构不稳定,所以对MGO和AGEs的抑制效果不够理想,但是半胱氨酸的抑制率均能达到70%以上,而且使改性蛋白乳化性得到较好的改善。
关键词:小麦醇溶蛋白;糖基化改性;1,2-二羰基化合物;晚期糖基化终产物;黄酮
目前世界小麦产量为每年6亿 t左右,而我国是小麦生产大国,随着小麦亩产量和种植面积的增加,小麦总产量逐年增加。小麦谷朊蛋白是小麦加工淀粉的副产物,最早由意大利科学家Beccari从小麦粉中洗出来[1]。醇溶蛋白占小麦谷朊蛋白的40%~50%[2],主要为面团提供黏性和延展性,这一特性使其可用作食用膜[3]或作为添加剂加入面包中提高面包的品质[4]。由于小麦醇溶蛋白结构中非极性氨基酸组分较多,使得其在水中的溶解性很小[5],限制了在食品中的应用。为了进一步拓展小麦谷朊蛋白的应用范围,国内外研究学者通常通过改性的方法提高植物蛋白的功能特性。糖基化改性以其安全性高、改性效果显著的特点被广泛应用。
当前用于糖基化改性的糖有:多糖(如葡聚糖、淀粉等)、双糖(如麦芽糖等)、单糖(如葡萄糖、果糖等)。牛丽亚等[6]用葡聚糖作糖基供体,通过糖基化反应对小麦胚芽蛋白改性,其溶解性得到改善;孔繁惠等[7]用葡萄糖、D-麦芽糖、β-环糊精作糖基供体对玉米醇溶蛋白进行糖基化改性,同样玉米醇溶蛋白的接枝度和溶解性得到明显改善;王成波[8]用葡萄糖对玉米谷蛋白进行糖基化改性,其溶解性、乳化性和起泡性以及泡沫稳定性均得到一定程度的改善。
目前诸多研究表明糖基化改性行之有效,且对蛋白质的功能活性有很大的提高,然而,蛋白质与糖改性过程中,由于发生美拉德反应,会产生一系列的有害中间产物(如甲基乙二醛(methyl glyoxal,MGO)、乙二醛(glyoxal,GO))和终产物(晚期糖基化终产物(advanced glycation end products,AGEs))。GO可以引起DNA病变[9],会抑制细胞中DNA的合成,引起线粒体功能紊乱,导致内皮细胞形态发生改变[10];MGO通过产生凋亡物质诱导细胞死亡,诱导调节细胞生存和增殖的生长因子改变[11],且能抑制蛋白质、DNA、RNA在绒毛细胞、隐窝细胞和结肠细胞中的形成[12]。AGEs可以与胶原蛋白和晶状体蛋白等组织蛋白结合,改变蛋白质的结构和构象,引起一系列病变[13],从而促进动脉粥样硬化的形成[14],引起白内障和视网膜病[15-16],导致机体出现老化或者与老化有关的疾病[17],加速生物个体衰老[18]等。目前国内外对糖基化改性过程中有害产物的检测及控制鲜见报道。大量研究表明,黄酮、酚酸等天然产物可以减少或抑制糖基化过程中有害产物的形成。Wu等[19]研究表明木犀草素、芦丁、(-)-表没食子儿茶素-3-没食子酸酯(epigallocatechin gallate,EGCG)、槲皮素对MGO诱导产生的AGEs有明显的抑制作用;Sang Shengmin等[20]研究了EGCG、根皮素、根皮苷[21]、染料木素[22]对等MGO的抑制机理,发现这4 种物质均能捕获MGO形成加合产物,从而进一步抑制AGEs的产生。以上报道均在模拟生理条件下研究其抑制活性;但是,在食品加工或改性条件下的抑制功效尚有待进一步验证。
本研究以醇溶蛋白为对象,采用气相色谱法(测定MGO和GO含量)和荧光光谱法(λex/λem=340 nm/465 nm,测定AGEs含量)探究不同因素(糖种类、葡聚糖质量浓度和改性温度、时间)对糖基化改性过程中有害产物MGO/GO和AGEs产生的影响,在醇溶蛋白改性体系中,选择儿茶素、芦丁、染料木素、槲皮素、阿魏酸、绿原酸、大黄素、辣椒素、谷胱甘肽(glutathione,GSH)和半胱氨酸(cysteine,Cys)等天然产物,筛分有效抑制剂;并考察了添加抑制剂对改性蛋白乳化性的影响。以期为小麦蛋白糖基化改性的工业化生产提供有效的理论支持和安全保障。
小麦醇溶蛋白由南京师范大学食品生物技术实验室自制;MGO(40%水溶液)、GO(40%水溶液)、衍生化试剂邻苯二胺、槲皮素 美国Sigma-Aldrich公司;二氯甲烷(分析纯) 南京化学试剂有限公司;甲醇(色谱纯)、葡萄糖、Cys、GSH、2,3-丁二酮均为分析纯 上海国药集团化学试剂有限公司;儿茶素、芦丁、染料木素、阿魏酸、绿原酸、大黄素、辣椒素、木樨草素 南京广润生物试剂有限公司。
7820气相色谱系统(柱温箱、H P-5色谱柱(30 m×0.32 mm,0.25 μm)、FID检测器) 美国安捷伦公司;Infinite 200Pro多功能酶标仪 瑞士Tecan有限公司;QL-861微型漩涡混合仪 海门市其林贝尔仪器制造有限公司;FA2104N电子分析天平 上海精密科学仪器有限公司;PHS-3C数字式pH计 上海三信仪表厂;UV1600紫外-可见分光光度计 北京瑞利分析仪器公司;T18高速匀浆机 德国IKA公司。
1.3.1 醇溶蛋白的制备与蛋白含量的测定
参考文献[23]方法,称取小麦谷朊粉100 g,加入10 倍体积的体积分数70%的乙醇溶液,磁力搅拌提取2 h后,10 000 r/min离心20 min,取上清液。将上清液减压旋转蒸发浓缩,浓缩液用去离子水透析(透析袋截留分子质量12~14 kDa)24 h后,改用体积分数0.1%的醋酸溶液透析24 h,溶出小分子的谷蛋白,再用去离子水透析24 h至中性,冷冻干燥,得到醇溶蛋白。
采用双缩脲法测定蛋白含量。1)标准蛋白溶液的配制:用0.05 mol/L的NaOH溶液配制质量浓度为0.0、2.0、4.0、6.0、8.0、10.0 mg/mL的牛血清白蛋白溶液;2)双缩脲试剂的配制:取1.5 g硫酸铜(CuSO4·5H2O)和6.0 g的酒石酸钾钠(NaKC4H4O6·4H2O)溶于500 mL蒸馏水中,在搅拌下加入300 mL质量分数10% NaOH溶液,用水稀释至1 000 mL;3)取1 mL不同质量浓度的标准蛋白液于不同的试管中,每个试管中分别加入4 mL双缩脲试剂,37 ℃水浴20 min,冷却至室温,用可见光分光光度计测定其在540 nm波长处的吸光度。以牛血清白蛋白溶液的质量浓度为横坐标、吸光度为纵坐标作标准曲线。配制质量浓度为2 mg/mL的醇溶蛋白溶液测定其吸光度,同上操作测定醇溶蛋白含量。
1.3.2 气相色谱法检测MGO/GO的含量
以2,3-丁二酮为内标,邻苯二胺为衍生化试剂,采用共衍生化方法(参照前期研究建立的方法[24])测定体系中MGO/GO的含量。
1.3.3 荧光分光光度法检测样品中AGEs的含量
取样品1 mL,15 000 r/min离心20 min,取0.3 mL上清液测定λex/λem=340 nm/465 nm处相对荧光值,所有试样均做3 组平行。
1.3.4 影响醇溶蛋白改性过程中MGO/GO和AGEs形成的因素分析
1.3.4.1 糖种类的影响
用0.05 mol/L、pH 11.0的磷酸盐缓冲液(phosphate buffered saline,PBS)分别溶解醇溶蛋白和糖类。在8 支10 mL样品管中各加入2 mL质量浓度为6 mg/mL的醇溶蛋白溶液,并分别加入1 mL质量浓度为12 mg/mL的麦芽糊精、葡聚糖、可溶性淀粉、蔗糖、葡萄糖、果糖、木糖和阿拉伯糖溶液,加入PBS至6 mL。每组样品在100 ℃水浴中加热30 min后立即放入冰浴中冷却5 min终止反应。然后以8 000 r/min离心30 min,取2 mL上清液加入2 mL甲醇,并于-80 ℃冷冻贮藏。以PBS代替糖溶液作空白组,同一种糖做3 组平行。样品解冻并离心(8 000 r/min,10 min)除蛋白后,分别按照1.3.2节和1.3.3节所述方法检测MGO/GO和AGEs含量。
1.3.4.2 葡聚糖质量浓度的影响
在4 支10 mL样品管中各加入2 mL质量浓度为6 mg/mL的醇溶蛋白溶液,分别加入0.5、1.0、2.0、4.0 mL质量浓度为12 mg/mL的葡聚糖溶液,加入PBS至6 mL。同1.3.2节和1.3.3节步骤测定样品中检测MGO/GO和AGEs含量。
1.3.4.3 改性反应温度的影响
用0.05 mol/L、pH 11.0的PBS分别溶解醇溶蛋白和葡聚糖。取4 支10 mL样品管各加入2 mL质量浓度为6 mg/mL的醇溶蛋白溶液、1 mL质量浓度为12 mg/mL的葡聚糖溶液,加入PBS至6 mL。在80、90、100 ℃沸水浴,110 ℃油浴下加热30 min后立即放入冰浴中冷却5 min终止反应。然后以8 000 r/min离心30 min后,取2 mL上清液加入2 mL甲醇,-80 ℃冷冻贮藏。以PBS代替糖溶液作空白组,同一温度做3 组平行。样品解冻并离心(8 000 r/min,10 min)除蛋白后,分别按照1.3.2节和1.3.3节所述方法检测MGO/GO和AGEs含量。
1.3.4.4 改性反应时间的影响
用0.05 mol/L、pH 11.0的PBS分别溶解醇溶蛋白和葡聚糖。在7 支10 mL样品管中各加入2 mL 6 mg/mL的醇溶蛋白溶液、1 mL 12 mg/mL的葡聚糖溶液,加入PBS至6 mL。在100 ℃沸水浴中分别加热0、5、10、20、30、60、120 min后立即放入冰浴中冷却5 min终止反应。然后以8 000 r/min离心30 min后,取2 mL上清液加入2 mL甲醇,-80 ℃冷冻贮藏。以PBS代替糖溶液作空白组,同一温度做3 组平行。样品解冻并离心(8 000 r/min,10 min)除蛋白后,分别按照1.3.2节和1.3.3节所述方法检测MGO/GO和AGEs含量。
1.3.4.5 改性条件下MGO/GO和AGEs天然抑制剂的筛选
用0.05 mol/L、pH 11.0的PBS分别溶解醇溶蛋白和葡聚糖。在40 支10 mL样品管中各加入2 mL 6 mg/mL醇蛋白、1 mL 12 mg/mL葡聚糖溶液和10 种不同体积(0.05、0.10、0.50、1.00 mL)抑制剂,包括6 mmol/L儿茶素、芦丁、染料木素、槲皮素、阿魏酸、绿原酸、大黄素、辣椒素甲醇溶液,6 mg/mL GSH、Cys PBS(0.05 mol/L、pH 11.0)溶液,再加入PBS至6 mL。样品在100 ℃水浴中加热30 min后立即放入冰浴中冷却5 min终止反应。然后以8 000 r/min离心30 min,取2 mL上清液加入2 mL甲醇,并于-80 ℃冷冻贮藏。以PBS代替糖溶液作空白组,同一种糖做3 组平行。样品解冻并离心(8 000 r/min,10 min)除蛋白后,分别按照1.3.2节和1.3.3节所述方法检测MGO/GO和AGEs含量。
1.3.5 抑制剂对改性醇溶蛋白乳化性能的影响
1.3.5.1 样品制备
根据1.3.4.5节的结果,选择浓度为0.5 mmol/L的染料木素、芦丁和质量浓度为0.5 mg/mL的Cys、GSH作为抑制剂。同1.3.4节方法,100 ℃沸水浴中加热30 min进行蛋白改性,分别制备添加和不添加抑制剂的改性醇溶蛋白,将所得蛋白样品冷冻干燥。
1.3.5.2 乳化性测定
分别取原醇溶蛋白、改性醇溶蛋白、添加抑制剂的改性蛋白样品于0.1 mol/L、pH 7.0的PBS中,使得蛋白终质量浓度为2 mg/mL,将6 mL样品溶液和2 mL大豆油放入离心管中,高速匀浆1 min,立即从匀浆液底部吸取50 μL,加入到5 mL质量分数0.1%的十二烷基硫酸钠溶液中,混匀后在500 nm波长处测定吸光度A0,代入下式计算乳化活性,以质量分数0.1%十二烷基硫酸钠溶液作为空白对照,每个样品进行3 次平行实验,取平均值。
式中:ρ为蛋白质量浓度/(g/mL);φ为光径(1 cm);θ为大豆油质量分数(0.25%);100为稀释倍数;A0为乳状液在0 min时的吸光度。
采用Excel 2010、SPSS 17.0软件分析实验数据,采用Duncan’s多重比较法进行显著性检验,P<0.05表示差异显著。
用双缩脲法测定的牛血清白蛋白的质量浓度(横坐标)与各质量浓度蛋白在540 nm波长处的吸光度(纵坐标)绘制标准曲线,线性回归方程为:y=0.047 8x+0.009 2(R2=0.998 3)。通过标准曲线测定制备所得的醇溶蛋白含量为95%。
以MGO质量浓度为横坐标,MGO与内标峰的面积之比为纵坐标,MGO的质量浓度在0~20 μg/mL范围内与峰面积呈现良好的线性关系。测得MGO的线性回归方程为:y=0.063 7x+0.010 6(R2=0.999 2)。以GO质量浓度为横坐标,GO与内标峰的面积之比为纵坐标,GO的质量浓度在0~20 μg/mL范围内与峰面积呈现良好的线性关系。测得GO的线性回归方程为:y=0.062 5x+0.002(R2=0.999 3)。
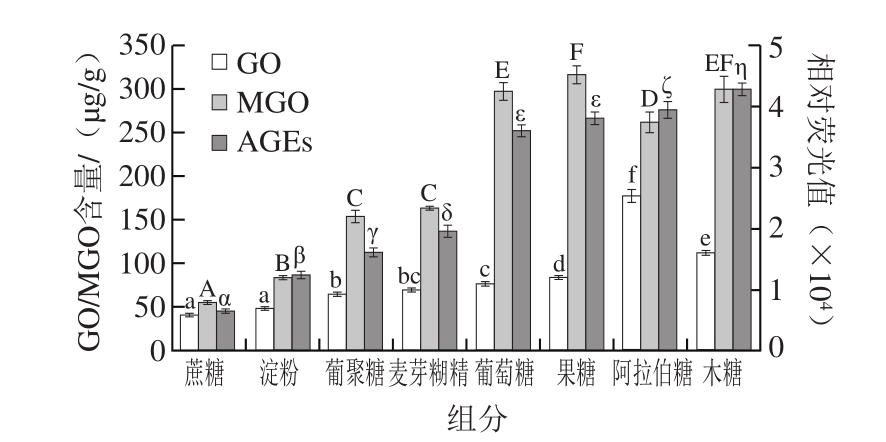
图 1 糖种类对醇溶蛋白改性过程中MGO/GO和AGEs含量的影响
Fig. 1 Effect of sugar type on the amount of MGO/GO and AGEs in modified gliadin
小写字母不同表示不同糖对GO含量影响差异显著(P<0.05);大写字母不同表示不同糖对MGO含量影响差异显著(P<0.05);希腊字母不同表示不同糖对AGEs含量影响差异显著(P<0.05)。图2~4同。
目前用于蛋白糖基化改性的既有单糖也有多糖。为了研究不同糖对醇溶蛋白改性过程中产生MGO/GO和AGEs的影响,选择五碳糖(木糖、阿拉伯糖)、六碳糖(果糖、葡萄糖)、多糖(麦芽糊精、葡聚糖、淀粉)和二糖(蔗糖)进行实验。由图1可知,不同种类糖对醇溶蛋白糖基化过程中有害产物MGO/GO和AGEs量的变化趋势较为一致。在体系中,MGO产生的量远远高于GO的量。不同糖产生MGO的量由大到小依次为果糖、葡萄糖、木糖、阿拉伯糖、麦芽糊精、葡聚糖、淀粉、蔗糖;不同糖产生GO的量由大到小依次为阿拉伯糖、木糖、果糖、葡萄糖、麦芽糊精、葡聚糖、淀粉、蔗糖;AGEs产生量由大到小依次为:木糖、阿拉伯糖、果糖、葡萄糖、麦芽糊精、葡聚糖、淀粉、蔗糖。其中,单糖产生的美拉德反应产物明显多于多糖,这是由于在质量相同时,大分子质量的糖含有的羰基数目较少,不容易与蛋白质发生反应,而且空间效应降低了反应活性,支链的空间位阻效应限制反应的进行[25];并且反应程度与糖的分子质量有一定的正相关,开环比例高的短链糖具有高反应性[26]。阿拉伯糖和木糖产生的GO和AGEs的量多于其他几种糖。蔗糖产生的3 种有害产物明显低于多糖,可能因为多糖易于水解产生还原性单糖葡萄糖。在同等改性条件下,优先选择多糖作为改性剂,以提高其安全性。而比较常用的3 种多糖改性剂,有害产物形成量依次为:淀粉<葡聚糖<麦芽糊精。
由图1可知,多糖在蛋白质改性过程中产生的有害产物较少,而且多糖改性比单糖和双糖更能提高蛋白的功能性[27],由于葡聚糖是葡萄糖单元脱水聚合而成的一种高分子葡萄糖聚合物,无臭无味,易溶于水,具有高亲水性,因此常用葡聚糖作为改性剂[28]。因此后续实验均选用葡聚糖进行改性条件优化。
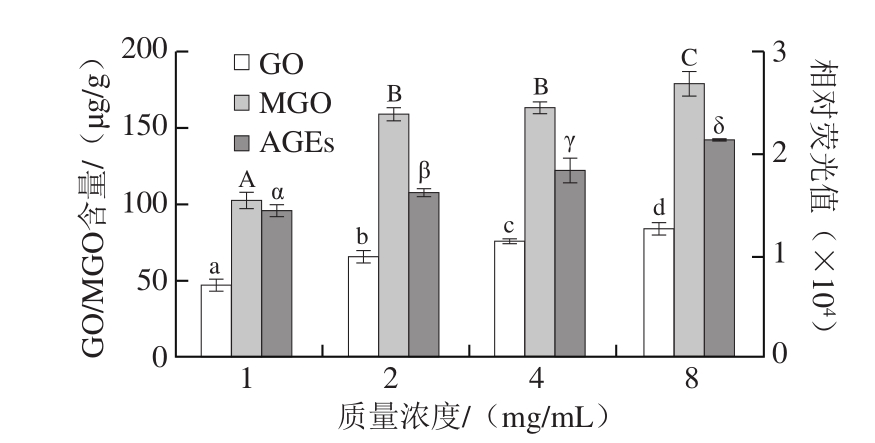
图 2 葡聚糖质量浓度对醇溶蛋白改性过程中MGO/GO和AGEs含量的影响
Fig. 2 Effect of dextran concentration on the amount of MGO/GO and AGEs in modified gliadin
由图2可知,随着葡聚糖质量浓度的增加,MGO/GO和AGEs的生成量均呈上升趋势,且3 个指标不同葡聚糖质量浓度之间存在显著性差异(P<0.05);当葡聚糖质量浓度在1.0~2.0 mg/mL范围,有害产物MGO/GO的增加幅度较大,尤其是MGO的生成的量远高于GO,MGO增加了约50%;当质量浓度由2.0 mg/mL增加到8.0 mg/mL,有害产物的量缓慢增加。牛丽亚等[6]在小麦胚芽蛋白糖基化改性反应体系(底物质量分数2%、pH 11.0、90 ℃、30 min)中发现,随着葡聚糖比例的增加,接枝度呈上升趋势,但产物的溶解性呈先上升后下降趋势,在改性比例1∶1(相当于葡聚糖质量浓度为2 mg/mL)时改性效果最佳。因此,在保证改性效果的前提下,应该尽量选择低质量浓度的糖基化剂,如葡聚糖质量浓度控制在2 mg/mL以内以减少有害物质的产生。
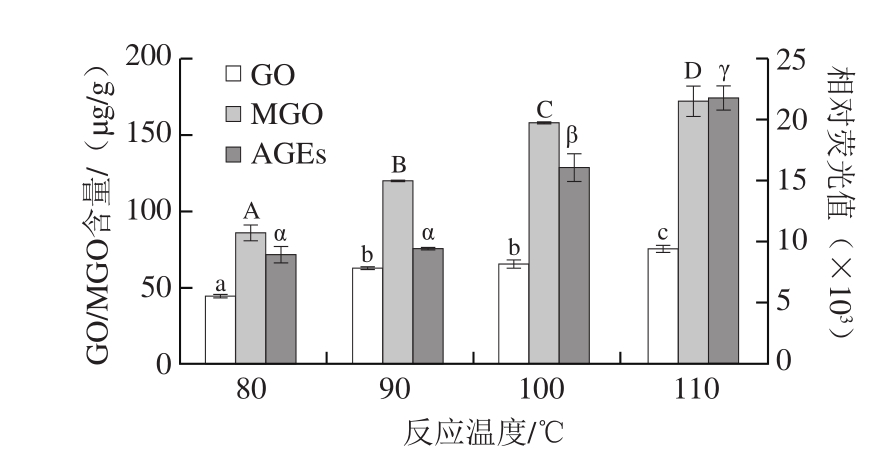
图 3 反应温度对醇溶蛋白改性过程中MGO/GO和AGEs含量的影响
Fig. 3 Effect of reaction temperature on the amount of MGO/GO and AGEs in modified gliadin
温度越高,有害产物MGO/GO和AGEs的生成量均越多,各个产物在不同温度产生量的差异性如图3所示。从增长趋势来看,80~100 ℃,体系中3 种有害产物大幅度增长,MGO和AGEs生成量分别增加了约85%和81%,
GO生成量增加了约50%。这是由于美拉德反应属于吸热反应,随着温度的升高,蛋白质链展开度增加,从而暴露出更多的游离氨基,其与糖的羰基反应进一步使反应加剧[29],有害产物的量随之增大。由此,结合改性效果考虑,控制改性在较低温度下进行,可以降低体系中美拉德反应有害产物的形成。据报道,大麦蛋白、玉米谷蛋白均能在90 ℃达到良好的改性效果[29-30]。

图 4 反应时间对醇溶蛋白改性过程中MGO/GO和AGEs含量的影响
Fig. 4 Effect of reaction time on the amount of MGO/GO and AGEs in modified gliadin
由图4可知,糖基化反应5 min,体系产生一定量有害产物MGO/GO和AGEs,其中MGO产生的量最高,约为GO的2 倍。5~20 min 3 种有害产物生成量快速增加,随后20~120 min有害产物生成量呈现缓慢增加趋势。除个别时间点外,3 种产物几乎所有不同时刻均存在着显著性差异(P<0.05)。以葡聚糖对小麦胚芽蛋白改性30 min时(m(蛋白质)∶m(葡聚糖)=1∶1、pH 11.0、温度110 ℃),接枝度和溶解性最好[6]。张蓓等[25]以葡聚糖对燕麦蛋白糖基化改性(90 ℃,pH 9.0),随着时间的延长,接枝度和溶解度先增加后趋于平缓,反应60 min时,蛋白质-糖的接枝度和溶解度达到最大。这是由于反应初期暴露在蛋白表面的游离氨基较快与糖反应,后期由于大量葡聚糖支链的引入,其空间位阻限制了反应的进行,导致美拉德反应进行缓慢,产物趋于平缓,接枝度和溶解性也趋于平缓。鉴于有害产物生成量随着时间延长而增加的趋势,改性时间不宜过长,长时间反应既能增加有害产物又能降低改性效果。然而,20 min内,有害产物尤其是MGO快速增加到接近峰值(138.21 μg/g),而仅仅靠缩短时间,安全性问题不可能得到解决,因此考虑添加天然抑制剂控制有害产物的形成。
图5c表明除辣椒素外(辣椒素有荧光吸收,干扰荧光性AGEs的测定),其他9 种抑制剂均能有效抑制AGEs的活性,抑制率依次为槲皮素>大黄素>芦丁>Cys>绿原酸>染料木素>儿茶素>GSH>阿魏酸,且抑制活性与添加浓度存在明显量效关系(P<0.05)。而阿魏酸对AGEs的抑制率较低,低于10%,且在0.05~1.00 mmol/L没有显著量效关系。结合图5a、b可知,儿茶素、芦丁、染料木素、槲皮素4 种黄酮在浓度为0.10 mmol/L时对GO有一定的抑制效果,抑制率在14%~30%;而其他几种天然抑制剂对GO没有抑制活性;芦丁、阿魏酸、染料木素、辣椒素和槲皮素对MGO有一定的抑制效果,抑制率在20%左右。本实验中天然抑制剂对醇溶蛋白体系中MGO/GO的抑制率较低,且随添加量的变化没有一定的规律性,可能是由于醇溶蛋白改性是在强碱性(pH 11.0)、高温(100 ℃)条件下进行的,天然抑制剂在高温、碱性条件下不稳定,难以捕获MGO/GO形成加合产物,从而影响MGO和GO抑制效果。Moon等[31]研究不同pH值(2.7、7.0、10.0)槲皮素溶液在不同温度(室温、4、-20 ℃)条件下的稳定性,结果表明在pH 10.0下反应120 min,槲皮素完全降解;有研究报道绿原酸在碱性条件下更容易被氧化,释放两个质子形成半醌结构[32-33];大黄素结构中有3 个羟基,将其置于碱性溶液中会生成稳定的红色络合物[34],破坏了大黄素原有的结构,因此在碱性改性条件下,以上天然产物不宜作为美拉德反应有害产物的抑制剂。
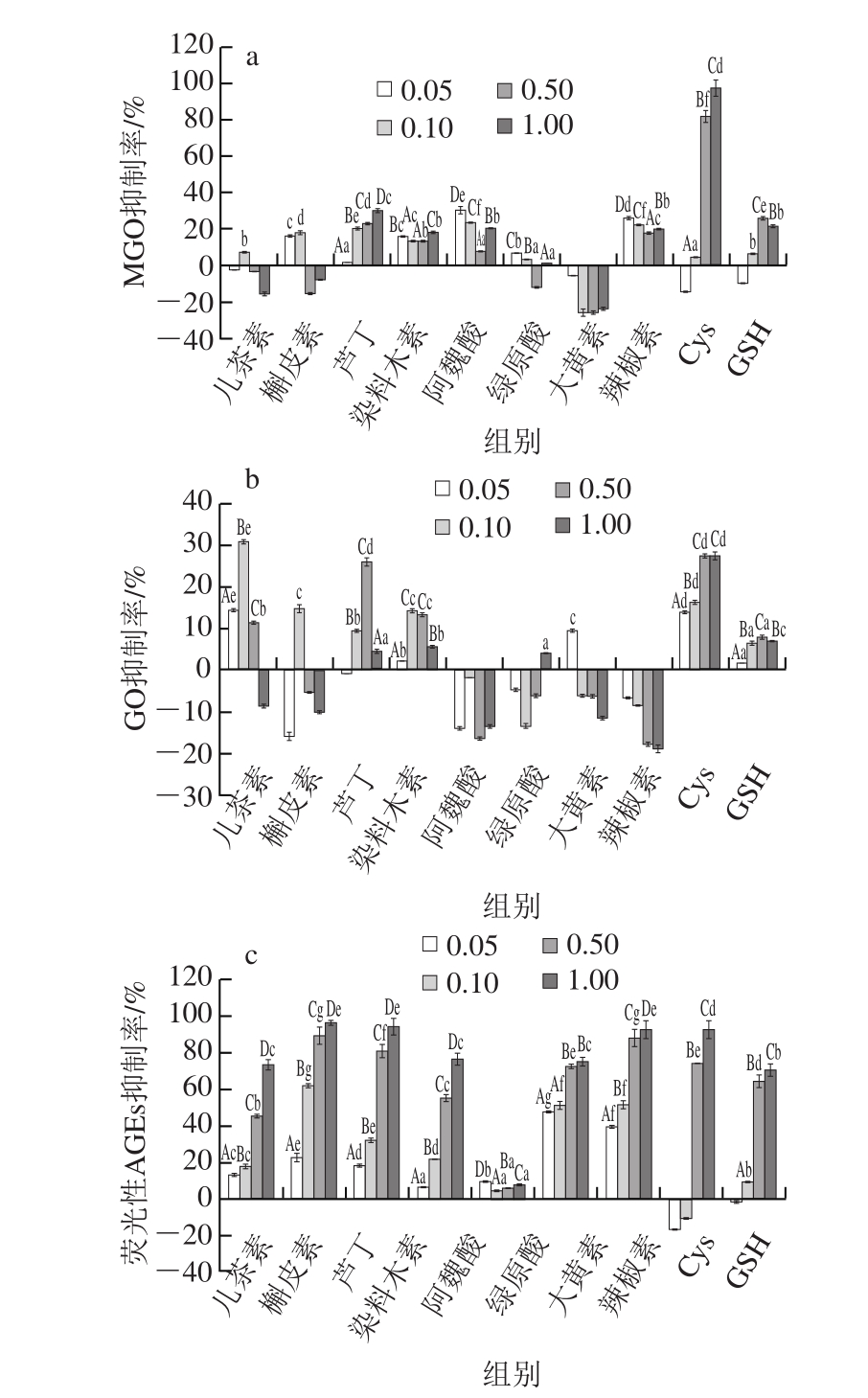
图 5 抑制剂对改性条件下醇溶蛋白-葡聚糖体系糖基化有害产物的抑制效应
Fig. 5 Impacts of inhibitors on the formation of MGO/GO and AGEs in the gliadin-dextran reaction system
a. MGO抑制率;b. GO抑制率;c.荧光性AGEs抑制率。Cys、GSH质量浓度为0.05~1.00 mg/mL;其他抑制剂浓度为0.05~1.00 mmol/L。不同小写字母代表相同浓度或质量浓度不同抑制剂对抑制率影响差异显著(P<0.05);不同大写字母代表同种抑制剂不同浓度或质量浓度对抑制率影响差异显著(P<0.05)。
当Cys质量浓度在0.50~1.00 mg/mL时,对GO的抑制率维持在27%,而对MGO的抑制率高达82%~97%,对AGEs抑制率为72%~83%。而低于0.50 mg/mL时,对GO和AGEs没有抑制效果。推测其原因可能是当质量浓度较小时,Cys参与到美拉德反应中,随着质量浓度增大,Cys的巯基、氨基均能与MGO/GO发生反应,从而减少体系中MGO和GO含量,同时抑制了AGEs的产生。与Cys相比,GSH对MGO的抑制率最高达到26%,远远低于Cys。Nomi等[35]报道了GSH可以通过谷氨酸残基上的α-NH2基团与GO反应从而达到抑制GO的效果。而GSH对AGEs的抑制率高达62%~69%。推测可能为GSH的抗氧化作用抑制了AGEs生成。Zeng Jingmin等[36]研究表明GSH、Cys等有效抑制糖基化反应的机制为Cys残基与1,2-二羰基化合物反应得到的硫醇醛加合物。因此,可以在醇溶蛋白改性过程中添加Cys或GSH作为有害产物的抑制剂。
表 1 糖基化产物与抑制剂抑制产物的乳化活性
Table 1 Emulsifying properties of glycosylated products as affected by added inhibitors

注:同行不同小写字母表示不同样品之间差异性显著(P<0.05)。
由表1可知,糖基化改性后醇溶蛋白的乳化活性得到显著改善,提高了2.7 倍,改性效果良好;糖基化提高蛋白乳化性的主要原因是其溶解性的增加,同时糖链与蛋白质的共价交联使得蛋白质的亲水性增加,空间结构松散,蛋白质分子可以较快地吸附在油/水界面,表现出更高的乳化性[37]。添加抑制剂后两种蛋白的乳化性依然显著高于原蛋白,但明显低于未添加抑制剂改性蛋白。添加了染料木素和Cys的蛋白,与单一改性组比,仍然保持了较高的乳化性能,且显著降低MGO/GO和AGEs(图5),与未改性的蛋白相比,乳化活性均有大幅度提高。推测抑制剂在抑制有害糖基化产物过程中对蛋白糖基化程度可能有一定影响,从而损失了一定的乳化性能,但在提高安全性的基础上仍大大改善了蛋白乳化性能。
本研究建立了醇溶蛋白-糖体系,考察了糖种类、糖质量浓度、改性时间和温度等因素对改性条件下美拉德反应有害产物MGO/GO和AGEs含量的影响;选择儿茶素、芦丁、染料木素、槲皮素、阿魏酸、绿原酸、大黄素、辣椒素、GSH和Cys等筛分有效抑制剂,并考察了添加抑制剂对改性蛋白乳化性的影响。
8 种糖基化剂(木糖、阿拉伯糖、果糖、葡萄糖、麦芽糊精、葡聚糖、淀粉、蔗糖)在醇溶蛋白改性过程中均能与蛋白反应产生有害产物MGO/GO和AGEs。其中单糖产生的各种有害产物的量远远高于多糖,尤其是MGO含量远高于GO。对比常用3 种多糖改性剂淀粉、葡聚糖、麦芽糊精,麦芽糊精产生的有害产物最多。
选择葡聚糖作为改性剂,体系中MGO/GO和AGEs的生成量均随着葡聚糖质量浓度(1.0、2.0、4.0、8.0 mg/mL)的增加、改性温度(80、90、100、110 ℃)的升高以及改性时间的延长而增加,且趋势均为先增加后趋于稳定。
选择儿茶素、槲皮素、芦丁、染料木素、阿魏酸、绿原酸、大黄素、辣椒素、Cys、GSH 10 种抑制剂。由于改性是在强碱(pH 11.0)、高温(100 ℃)条件下进行的,导致儿茶素、槲皮素、芦丁、染料木素、阿魏酸、绿原酸、大黄素、辣椒素的结构不稳定,抑制效果较差。而Cys和GSH则有一定的抑制作用,尤其是Cys,当Cys质量浓度在0.50~1.00 mg/mL时,对GO的抑制率维持在27%,而对MGO的抑制率高达82%~97%,对AGEs抑制率为72%~83%。
选择效果较好的抑制剂芦丁、染料木素、GSH和Cys,研究抑制剂对改性蛋白乳化性的影响,结果表明添加抑制剂后的改性蛋白组与常规改性组比,乳化活性有所下降,但仍然远高于未改性的蛋白组。其中Cys、染料木素在降低有害产物的同时,仍然保持了较高的乳化性能。
参考文献:
[1] BAILEY C. A translation of Beccari’s lecture concerning Grain’s 1728[J]. Cereal Chemistry, 1941, 18: 555-561.
[2] ORTH R, BUSHUK W. Comparative study of the proteins of wheats of diverse baking qualities[J]. Cereal Chemistry, 1972, 39(4): 463-484.
[3] 宋义虎, 孙少敏, 张其斌, 等. 小麦醇溶蛋白膜拉伸性能研究[C]//2005年全国高分子学术论文报告会. 北京: 中国化学会, 2005.
[4] KHATKAR B S, FIDO R J, TATHAM A S, et al. Functional properties of wheat gliadins. Ⅱ. effects on dynamic rheological properties of wheat gluten [J]. Journal of Cereal Science, 2002, 35(3): 307-313.DOI:10.1006/jcrs.2001.0430.
[5] 钟耕, 陈宗道, 闵燕萍, 等. 小麦面筋蛋白及其化学改性研究[J]. 粮食与饲料工业, 2001(5): 41-43. DOI:10.3969/j.issn.1003-6202.2001.05.019.
[6] 牛丽亚, 姜绍通, 潘丽军, 等. 小麦胚芽蛋白糖基化反应改性的研究[J]. 食品工业科技, 2013, 34(8): 257-261. DOI:10.13386/j.issn1002-0306.2013.08.055.
[7] 孔繁惠, 刘景圣, 修琳, 等. 玉米醇溶蛋白湿热法糖基化初步研究[J]. 中国食物与营养, 2012, 18(4): 55-58. DOI:10.3969/j.issn.1006-9577.2012.04.015.
[8] 王成波. 玉米谷蛋白的糖基化改性研究[J]. 黑龙江农业科学,2012(7): 110-115. DOI:10.3969/j.issn.1002-2767.2012.07.032.
[9] UENO H, NAKAMURO K, SAYATO Y, et al. DNA lesion in rat hepatocytes induced by in vitro and in vivo exposure to glyoxal[J].Mutation Research/Genetic Toxicology, 1991, 260(1): 115-119.DOI:10.1016/0165-1218(91)90087-3.
[10] SLIMAN S M, EUBANK T D, KOTHA S R, et al. Hyperglycemic oxoaldehyde, glyoxal, causes barrier dysfunction, cytoskeletal alterations, and inhibition of angiogenesis in vascular endothelial cells:aminoguanidine protection[J]. Molecular and Cellular Biochemistry,2010, 333(1/2): 9-26. DOI:10.1016/j.ijpe.2004.05.016.
[11] LEE H K, SEO I A, SUH D J, et al. A novel mechanism of methylglyoxal cytotoxicity in neuroglial cells[J]. Journal of Neurochemistry, 2009, 108(1): 273-284. DOI:10.1111/j.1471-4159.2008.05764.x.
[12] SCHNUCH A, UTER W, GEIER J, et al. Contact allergies in healthcare workers. results from the IVDK[J]. Acta Dermato-Venereologica, 1998, 78: 358-363. DOI:10.1080/000155598443060.
[13] TESSIER F J. The Maillard reaction in the human body. the main discoveries and factors that affect glycation[J]. Pathologie Biologie,2009, 58(3): 214-219. DOI:10.1016/j.patbio.2009.09.014.
[14] GOH S Y, COOPER M E. The role of advanced glycation end products in progression and complications of diabetes[J]. Journal of Clinical Endocrinology &Metabolism, 2013, 93(4): 1143-1152. DOI:10.1210/jc.2007-1817.
[15] KUMAR P A, KUMAR M S, REDDY G B. Effect of glycation on alpha-crystallin structure and chaperone-like function[J]. Biochemical Journal, 2007, 408(2): 251-258. DOI:10.1042/BJ20070989.
[16] MILNE R, BROWNSTEIN S. Advanced glycation end products and diabetic retinopathy[J]. Amino Acids, 2013, 44(6): 1397-1407.DOI:10.1007/s00726-011-1071-3.
[17] BAYNES J W. The role of AGEs in aging: causation or correlation[J].Experimental Gerontology, 2001, 36(9): 1527-1537. DOI:10.1016/S0531-5565(01)00138-3.
[18] SEMBA R D, NICKLETT E J, FERRUCCI L. Does accumulation of advanced glycation end products contribute to the aging phenotype?[J]. Journals of Gerontology, 2010, 65(9): 963-975.DOI:10.1093/gerona/glq074.
[19] WU C H, YEN G C. Inhibitory effect of naturally occurring flavonoids on the formation of advanced glycation endproducts[J].Journal of Agricultural and Food Chemistry, 2005, 53(8): 3167-3173.DOI:10.1021/jf048550u.
[20] SANG Shengmin, SHAO Xi, BAI Naisheng, et al. Tea polyphenol(−)-epigallocatechin-3-gallate: a new trapping agent of reactive dicarbonyl species[J]. Chemical Research in Toxicology, 2007, 20(12):1862-1870. DOI:10.1021/tx700190s.
[21] SHAO X, BAI N, HE K, et al. Apple polyphenols, phloretin and phloridzin: new trapping agents of reactive dicarbonyl species[J].Chemical Research in Toxicology, 2008, 21(10): 2042-2050.DOI:10.1021/tx800227v.
[22] LÜ L S, SHAO X, CHEN H D, et al. Genistein inhibits advanced glycation end product formation by trapping methylglyoxal[J].Chemical Research in Toxicology, 2011, 24(4): 579-586.DOI:10.1021/tx100457h.
[23] 王丽娟, 胡二坤, 黎亢抗, 等. 水溶性小麦醇溶蛋白纳米粒子的制备及表征[J]. 食品与发酵工业, 2014, 40(5): 6-10. DOI:10.13995/j.cnki.11-1802/ts.2014.05.049.
[24] 王晨, 李晓明, 卢永翎, 等. 气相色谱法检测饮料中二羰基化合物[J]. 食品科学, 2015, 36(24): 235-241. DOI:10.7506/spkx1002-6630-201524044.
[25] 张蓓, 郭晓娜, 朱科学, 等. 燕麦蛋白糖基化改性研究[J]. 中国粮油学报, 2016, 31(6): 41-46. DOI:10.3969/j.issn.1003-0174.2016.06.008.
[26] NIU L Y, JIANG S T, PAN L J, et al. Characteristics and functional properties of wheat germ protein glycated with saccharides through Maillard reaction[J]. International Journal of Food Science &Technology, 2011, 46(10): 2197-2203. DOI:10.1111/j.1365-2621.2011.02737.x.
[27] SHU Y W, SAHARA S, NAKAMURA S, et al. Effects of the length of polysaccharide chains on the functional properties of the Maillard-type lysozyme-polysaccharide conjugate[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2544-2548. DOI:10.1021/jf950586m.
[28] 刘娟. 酪蛋白-葡聚糖接枝改性研究[D]. 无锡: 江南大学, 2008: 9-23.DOI:10.7666/d.y1398008.
[29] 吴惠玲, 王志强, 韩春, 等. 影响美拉德反应的几种因素研究[J].现代食品科技, 2010, 26(5): 441-444. DOI:10.3969/j.issn.1673-9078.2010.05.003.
[30] 徐晶, 刘晓兰, 郑喜群. 玉米谷蛋白的美拉德糖基化改性[J]. 食品科技, 2016, 41(7): 244-250. DOI:10.13684/j.cnki.spkj.2016.07.048.
[31] MOON Y J, WANG L, DICENZO R, et al. Quercetin pharmacokinetics in humans[J]. Biopharmaceutics & Drug Disposition, 2008, 29(4):205-217. DOI:10.1002/bdd.605.
[32] HOTTA H, UEDA M, NAGANO S, et al. Mechanistic study of the oxidation of caffeic acid by digital simulation of cyclic voltammograms[J]. Analytical Biochemistry, 2002, 303(1): 66-72.DOI:10.1006/abio.2002.5577.
[33] ARAKAWA R, YAMAGUCHI M, HOTTA H, et al. Product analysis of caffeic acid oxidation by on-line electrochemistry/electrospray ionization mass spectrometry[J]. Journal of The American Society for Mass Spectrometry, 2004, 15(8): 1228-1236. DOI:10.1016/j.jasms.2004.05.007.
[34] YIM H, LEE Y H, LEE C H, et al. Emodin, an anthraquinone derivative isolated from the rhizomes of Rheum palmatum, selectively inhibits the activity of casein kinase II as a competitive inhibitor[J].Planta Medica, 1999, 65(1): 9-13. DOI:10.1055/s-1999-13953.
[35] NOMI Y, AIZAWA H, KURATA T, et al. Glutathione reacts with glyoxal at the N-terminal[J]. Bioscience Biotechnology &Biochemistry, 2009, 73(11): 2408-2411. DOI:10.1271/bbb.90340.
[36] ZENG Jingmin, DAVIES M. Protein and low molecular mass thiols as targets and inhibitors of glycation reactions[J]. Chemical Research in Toxicology, 2006, 19(12): 1668-1676. DOI:10.1021/tx0602158.
[37] DIFTIS N, KIOSSEOGLOU V. Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J]. Food Chemistry, 2003, 81(1): 1-6.DOI:10.1016/S0308-8146(02)00236-4.
Analysis of Factors Influencing on the Formation of Harmful Products during Glycosylation of Wheat Gliadin
LI Pu, LIU Guimei, LU Yongling, ZHENG Tiesong, LÜ Lishuang*
(Ginling College, Nanjing Normal University, Nanjing 210097, China)
Abstract:The gliadin-sugar system was established to simulate the glycosylation modification conditions. The effects of sugar species (monosaccharides, disaccharides and polysaccharides), natural antistatic (dextran) concentration,modification temperature and time, and natural inhibitors on the formation of methyl glyoxal (MGO), glyoxal (GO) and advanced glycation end products (AGEs) were determined by gas chromatography and fluorescence spectroscopy (λex/λem=340 nm/465 nm). The emulsifying properties of the modified protein were evaluated. The results showed that the amount of various harmful products produced from monosaccharides was much higher than that from polysaccharides, especially a significantly increased amount of MGO compared with GO. Furthermore, the formation of three harmful products increased with increasing dextran concentration, temperature or time prior to reaching a plateau. Under alkaline and high temperature conditions, required for the gliadin-dextran modification system, the common natural inhibitors catechins, quercetin, rutin, genistein,ferulic acid, chlorogenic acid, emodin and capsaicin were unstable, making them less effective. The inhibitory effect of cysteine on MGO and AGEs was more than 70% while still improving the emulsifying properties of the modified protein.
Keywords:wheat gliadin; glycosylation modification; 1,2-dicarbonyl compounds; advanced glycation end products; flavonoids
DOI:10.7506/spkx1002-6630-201815002
收稿日期:2017-04-03
基金项目:国家自然科学基金面上项目(31571783)
第一作者简介:李普(1992—),男,硕士研究生,研究方向为食品化学。E-mail:1445808278@qq.com
*通信作者简介:吕丽爽(1969—),女,教授,博士,研究方向为食品化学、功能性食品的分离及活性。E-mail:lishuanglv@126.com
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2018)15-0010-07
引文格式:
李普, 刘贵梅, 卢永翎, 等. 小麦醇溶蛋白糖基化改性过程中有害产物形成的影响因素分析[J]. 食品科学, 2018, 39(15):10-16. DOI:10.7506/spkx1002-6630-201815002. http://www.spkx.net.cn
LI Pu, LIU Guimei, LU Yongling, et al. Analysis of factors influencing on the formation of harmful products during glycosylation of wheat gliadin[J]. Food Science, 2018, 39(15): 10-16. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815002. http://www.spkx.net.cn