钱书意1,2,李 侠2,孙 圳2,尚 柯2,关文强1,*,张春晖2,*
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京 100193)
摘 要:为明确冷冻温度对牛肉肌原纤维蛋白变性和肌肉持水性(water-holding capacity,WHC)的影响、探讨肌原纤维蛋白变性与WHC的相关性。以牛背最长肌作实验材料,探究-9、-18、-23、-38 ℃下冻结后肌原纤维蛋白理化特性和牛肉WHC。通过测定巯基含量、蛋白质溶解度、Ca2+-三磷酸腺苷酶(adenosine triphosphatase,ATPase)活力及蛋白质热稳定性考察牛肉冻结后肌原纤维蛋白变性情况,利用解冻汁液流失与加压失水率指标衡量牛肉WHC,采用低场核磁共振(low field-nuclear magnetic resonance,LF-NMR)波谱和磁共振成像(magnetic resonance imaging,MRI)技术对比分析了肌肉水分分布情况,并于4 ℃解冻后测定了色差与剪切力。结果表明:-23 ℃与-38 ℃下冻结试样较-9 ℃与-18 ℃肌原纤维蛋白变性程度小:-23 ℃与-38 ℃下冻结试样蛋白质溶解度、Ca2+-ATPase活力、巯基含量和总变性焓相比-9 ℃与-18 ℃实验组较高(P<0.05)。-23 ℃与-38 ℃下冻结牛肉解冻后L*值、b*值、剪切力、解冻汁液流失和加压失水率显著低于-9 ℃与-18 ℃(P<0.05)。LF-NMR及MRI结果相互佐证了肉样在-23 ℃与-38 ℃冻结下肌肉WHC高于-9 ℃与-18 ℃的实验结果。肌原纤维蛋白理化特性(蛋白质溶解度、Ca2+-ATPase活力、巯基含量、总变性焓)与WHC(解冻汁液流失率、加压失水率)均呈极显著相关(P<0.01),L*、b*值及剪切力亦与WHC存在极显著相关(P<0.01)。相关性分析结果验证了牛肉冻结过程中肌原纤维蛋白变性对肌肉持水性存在显著影响,进而导致牛肉解冻后出现肉色劣变、嫩度下降及汁液流失。
关键词:冻结温度;牛肉;肌原纤维蛋白变性;持水性
自20世纪90年代以来,中国成为世界第一大肉类生产国[1]。现代肉与肉制品加工业中,畜禽冷冻肉是国家调节肉食品市场的重要产品。冻藏作为肉类重要贮藏方式,可有效延长产品货架期,增加肉制品消费的机动性和可支配性[2],是肉类产品进出口贸易和国内地区间的主要流动形态。然而,肉制品在冷冻贮藏期间蛋白质变性、持水性降低,导致冻藏肉在解冻后出现严重的汁液流失和品质劣变现象,造成严重的经济损失[3]。肌原纤维蛋白作为肉类蛋白中的最主要成分,占总蛋白质含量的70%左右,肉类冻藏过程中的蛋白质变性主要是肌原纤维蛋白变性[4]。目前涉及冻结温度对冻藏肉影响的研究主要集中在贮藏品质方面[5-6],对于肌原纤维蛋白变性的影响鲜有研究;而对影响冻藏肉肌肉持水性因素的研究集中在冻结过程中的冰晶生长[7]、肌肉蛋白质组学[8]、脂肪氧化[9]等方面。有研究表明汁液流失和品质劣变可能在很大程度上是由于肌肉蛋白变性引起的[10]:李银等[11]研究发现牛肉冻结解冻过程中蛋白质氧化导致其持水性降低;魏秀丽等[12]研究发现猪肉肌原纤维蛋白降解引起蛋白水合力下降进而形成汁液流失。然而,亦有研究认为蛋白变性与肌肉持水性变化之间并不存在直接联系[9,13]。关于不同冻结温度对牛肉肌原纤维蛋白变性的影响缺乏深入研究,肌肉蛋白质变性对汁液流失的作用机制尚不清楚。
目前我国冻藏肉工业生产中常用的冻结温度-18、-23 ℃及-38 ℃,本实验以牛背最长肌(bovine longissmus dorsi)作为研究对象,比较研究-9、-18、-23 ℃及-38 ℃ 4 组温度条件下牛肉肌原纤维蛋白理化特性与肌肉持水性变化,旨在揭示不同冻结温度下牛肉肌原纤维蛋白变性与肌肉持水性,并探讨牛肉冻结过程中蛋白变性对肌肉持水性的影响,为研究新的抑制牛肉冻结过程中的蛋白变性方法,从而为控制冻藏肉解冻汁液流失提供理论依据。
原料肉为北京御香苑畜牧有限公司提供的经检疫合格、质量约为400 kg的2 岁草原鲁西黄牛牛背最长肌。牛屠宰后在一定温度(0~4 ℃)、相对湿度(90%)和循环冷风(风速2 m/s)的外部环境条件下吊挂风冷排酸48 h,从6 头情况相近的公牛胴体中分别取2 块背最长肌,共12 块肉样,每块长、宽、高约为5 cm×4 cm×4 cm,运回实验室后4 ℃冷藏并进行后续实验。
ATPase测试盒 苏州科铭生物技术有限公司。
电子天平 赛多利斯科学仪器(北京)有限公司;735型温度仪 德国德图仪器有限公司;CR-400色差仪日本柯尼卡美能达公司;BCDW-228冰箱、DW-86L386型立式超低温保存箱 青岛海尔特种电器有限公司;Q200差示扫描量热(differential scanning calorimeter,DSC)仪 美国TA公司;T6紫外-可见分光光度计北京普析通用仪器有限责任公司;MesoMR23-060H-I低场核磁共振(low field-nuclear magnetic resonance,LF-NMR)分析仪及成像系统 上海纽迈电子科技有限公司;钢环式膨胀压缩仪 湖南湘仪实验室仪器开发有限公司;C-LM型肌肉嫩度计 北京朋利驰科技有限公司等。
1.3.1 样品冻结与解冻
将12 块肉样随机分为4 组,放置于-9、-18、-23 ℃及-38 ℃条件下进行冷冻处理,将温度仪传感器插入肉样几何中心记录中心温度。为避免长时间冷冻对牛肉品质的影响,当样品中心温度均达到设定相应冻结温度后平衡24 h,随即取出样品待测。解冻过程置于4 ℃冰箱,中心温度达4 ℃后解冻完成。
1.3.2 指标测定
1.3.2.1 总巯基含量
参照李银等[11]的方法,从牛背最长肌中分离提取肌原纤维蛋白。总巯基的测定使用Ellman试剂法[14]。将提取的蛋白溶液质量浓度调整为2 mg/mL,与1 mL含有6 mol/L盐酸胍、1 mmol/L乙二胺四乙酸的50 mmol/L Tris-HCl缓冲液(pH 8.3)以及含有10 μL 10 mmol/L 5,5’-二硫代双(2-硝基苯甲酸)的100 mmol/L Tris-HCl溶液(pH 7.6)混合,25 ℃环境下静置25 min后于412 nm波长处测定其吸光度,巯基含量(nmol/mg)使用摩尔吸光系数13 600 L/(mol·cm)计算。
1.3.2.2 肌原纤维蛋白质溶解度
参考Joo等[14]的方法,准确称取1.0 g肉样,加入10 mL预冷的0.025 mol/L的磷酸钾缓冲液(pH 7.2)后冰浴匀浆。样品处理后于4 ℃摇床上过夜抽提后离心(4 ℃、4 000×g、20 min),采用双缩脲法测定上清液蛋白质量浓度,所得结果即为肌浆蛋白溶解度。称取1.0 g肉样,加入20 mL预冷的含1.1 mol/L碘化钾的0.1 mol/L磷酸钾缓冲液(pH 7.2)后冰浴匀浆,样品处理后于4 ℃摇床上过夜抽提后离心(4 ℃、4 000×g、20 min),采用双缩脲法测定上清液蛋白质量浓度,所得结果即为肌肉全蛋白溶解度。肌原纤维蛋白溶解度为全蛋白溶解度与肌浆蛋白溶解度之差。
1.3.2.3 Ca2+-ATPase活力
采用ATPase测试盒(用于Ca2+、Mg2+-ATPase活力测定,微量法,100 管/48 样)测定。通过测定酶解ATP产生的无机磷含量来确定ATP活力的高低。规定每小时每克组织中Ca2+-ATP酶分解ATP产生1 μmol无机磷的量为一个酶活力单位。
1.3.2.4 肌肉热稳定性分析
参考Deng等[15]的方法,取10~15 mg肉样密封于铝盒中进行DSC测定,以铝盒为空白对照。测定条件如下:样品于20 ℃平衡2 min,再以5 ℃/min的升温速率升到100 ℃。每个样品测定3 个平行,结果取3 次测定的平均值。用Universal Analysis 2000软件分析各组样品DSC图谱各峰的变性温度和变性焓。
1.3.2.5 持水性
用解冻汁液流失率和加压失水率指标评价牛肉持水性能。
准确称量解冻前后肉块质量,按式(1)计算样品的解冻汁液流失率。
加压失水率参考Farouk等[16]的方法。顺肉样肌纤维方向切成约1 cm厚的薄片,准确称量样品质量。用双层纱布包裹肉样并在肉样上下各垫18 层定性滤纸,使用钢环式膨胀压缩仪将肉样加压至35 kg并保持5 min,记录加压后肉样质量。按式(2)计算样品的加压失水率。
1.3.2.6 水分分布及组成
参照谢小雷等[17]的方法。采用核磁共振分析软件中的CPMG脉冲序列测定样品中的横向弛豫时间T2。将精确称量的样品置于核磁共振成像仪永磁场中心位置的射频线圈中心,进行磁共振波谱测定。CPMG脉冲序列参数为:主频23 MHz、偏移频率286.781 3 kHz、90°脉冲时间17 μs;180°脉冲时间35 μs;采样点数54 996;重复时间3 000 ms;累加次数4 次;回波数2 000。
1.3.2.7 质子密度成像
参照谢小雷等[17]的方法。使用MesoMR23-060H-I核磁共振分析及成像系统测定,将实验样品放入永磁场中心位置的射频线圈中心,进行成像实验。主要参数为:重复时间2 000 ms,重复次数4 次,纵向弛豫时间20 ms,根据CPMG序列测得的T2值,选择自旋回波时间20 ms。
1.3.2.8 色差和剪切力
用色差仪直接测定样品表面的L*值(亮度)、a*值(红度)、b*值(黄度),每个样品平行测定5 次,结果取5 次测量平均值。色差计在使用前用白板进行校准。
用直径1.5 cm的取样器平行于肉样纤维方向取2.0 cm高的圆柱形,采用C-LM型肌肉嫩度计测定其剪切力,单位为N,每个处理的样品平行测定5 次,结果取5 次测定平均值。
采用Microsoft Excel 2007软件处理数据并绘制图表,结果以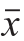 ±s表示。利用IBM SPSS Statistics 19统计分析软件的Duncan法多重比较进行显著性分析,P<0.05表示差异显著,用Pearson相关系数法进行相关性分析。
±s表示。利用IBM SPSS Statistics 19统计分析软件的Duncan法多重比较进行显著性分析,P<0.05表示差异显著,用Pearson相关系数法进行相关性分析。
2.1.1 巯基含量
肌原纤维蛋白主要成分是肌动蛋白和肌球蛋白,二者分子中含有大量巯基,冻结过程中巯基的氧化形成二硫键[18],测定肌原纤维蛋白的巯基含量可反映出蛋白质的氧化变性程度。不同冻结温度对肌原纤维蛋白巯基含量的影响见图1。不同实验组牛肉肌原纤维蛋白的巯基含量差异显著,冻藏的温度越低,巯基含量越高。-9、-18、-23 ℃及-38 ℃下冻结的试样肌原纤维蛋白的巯基含量分别为75.30、78.73、81.56 nmol/mg和93.43 nmol/mg。其中-38 ℃下冻结试样巯基含量显著高于其他实验组(P<0.05),肌原纤维蛋白氧化程度最低。氧化效应是蛋白变性的重要表现,肌原纤维蛋白氧化使其构象发生改变,肌肉细胞受到损伤,导致肌肉持水性降低[11],研究结果表明低温冻结有利于抑制冻结过程中牛肉肌原纤维蛋白的氧化变性。
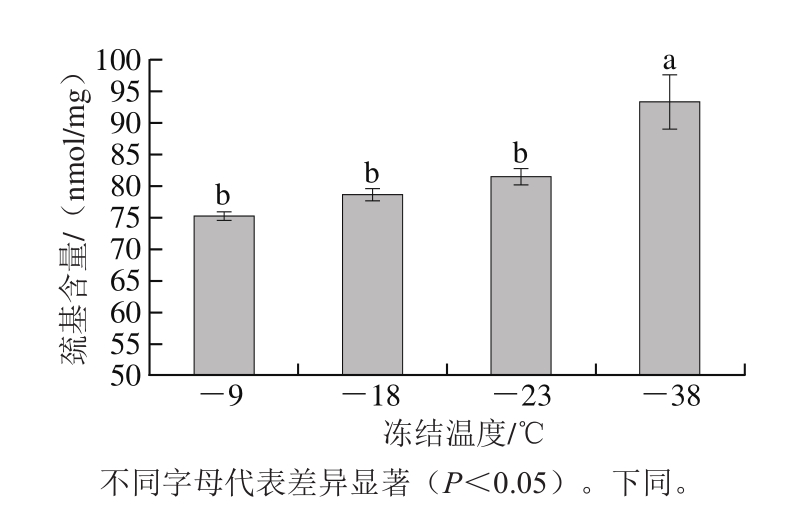
图 1 不同冻结温度下牛肉的肌原纤维蛋白巯基含量
Fig. 1 Sulfrydryl contents of beef myofibrillar protein after freezing at different temperatures
2.1.2 蛋白质溶解度
蛋白质溶解度是评价肌肉蛋白质变性程度主要指标之一,溶解度越低说明蛋白聚集程度越高,常伴随严重的变性现象。如图2所示,-9、-18、-23 ℃及-38 ℃下冻结的试样肌原纤维蛋白质溶解度分别为136.25、139.76、147.55 mg/g及153.13 mg/g。-23 ℃及-38 ℃实验组蛋白质溶解度显著高于-9 ℃与-18 ℃实验组(P<0.05)。冷冻使蛋白质的结构受到破坏,二硫键、氢键及疏水键形成,蛋白质之间的作用增强出现聚集现象,导致蛋白质溶解度降低[19],蛋白质和水分子之间的作用力减弱,蛋白质疏水性增强,肌肉持水性受到影响。实验结果表明,冻结温度越低,越有利于维持牛肉肌原纤维蛋白质溶解度,减轻蛋白质聚集程度。

图 2 不同冻结温度下牛肉蛋白质溶解度
Fig. 2 Protein solubility of beef after freezing at different temperatures
2.1.3 Ca2+-ATPase活力
Ca2+-ATPase活力是衡量肌球蛋白分子完整性的有效指标[20],冻藏过程中肌原纤维蛋白变性会引起Ca2+-ATPase活力下降。不同冻结温度下牛肉的肌原纤维蛋白Ca2+-ATPase活力见图3,冻结温度越低,试样肌原纤维蛋白Ca2+-ATPase活力越高。-9、-18、-23 ℃及-38 ℃下冻结的试样肌原纤维蛋白Ca2+-ATPase活力分别为32.68、33.88、35.76 μmol/(g·h)和36.38 μmol/(g·h),-38 ℃下冻结试样Ca2+-ATPase活力显著高于-9 ℃实验组(P<0.05)。结果表明冻结温度越低,越有利于维持牛肉肌原纤维蛋白Ca2+-ATPase活力。肌原纤维蛋白的主要成分是肌球蛋白,牛肉冻结过程中肌球蛋白头部构象改变及蛋白质聚集现象导致Ca2+-ATPase活力下降[21]。此外,Ca2+-ATPase活力降低也可能与肌球蛋白头部巯基的氧化相关[20]。本研究中,冻结温度越低的试样Ca2+-ATPase活力越高,这与此前所得的蛋白质溶解度及巯基含量结果相符。
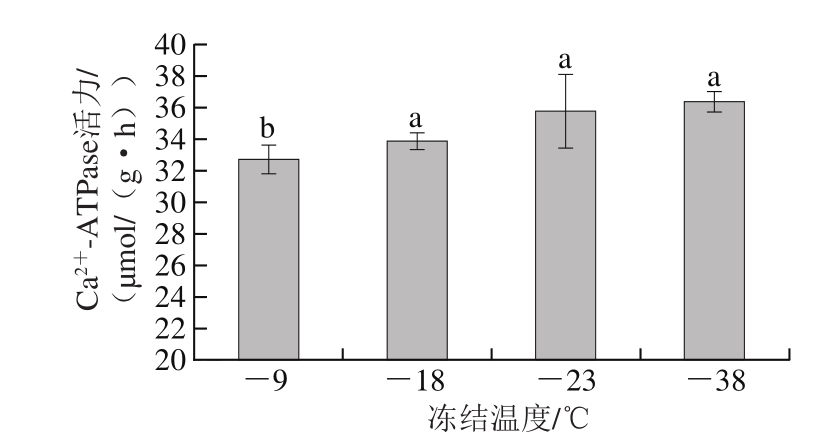
图 3 不同冻结温度下牛肉的肌原纤维蛋白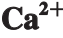 -ATPase活力
-ATPase活力
Fig. 3 Ca2+-ATPase activity of beef myofibrillar protein after freezing at different temperatures
2.1.4 蛋白热稳定性
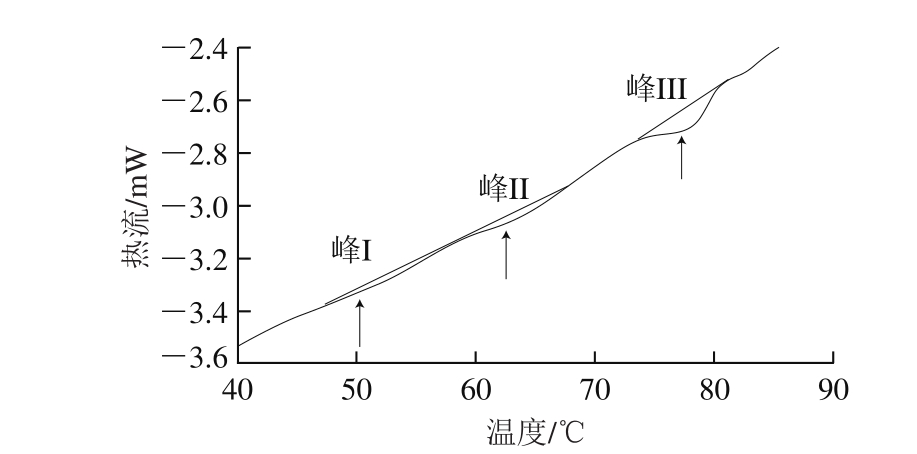
图 4 DSC热流图
Fig. 4 DSC heat flow diagram
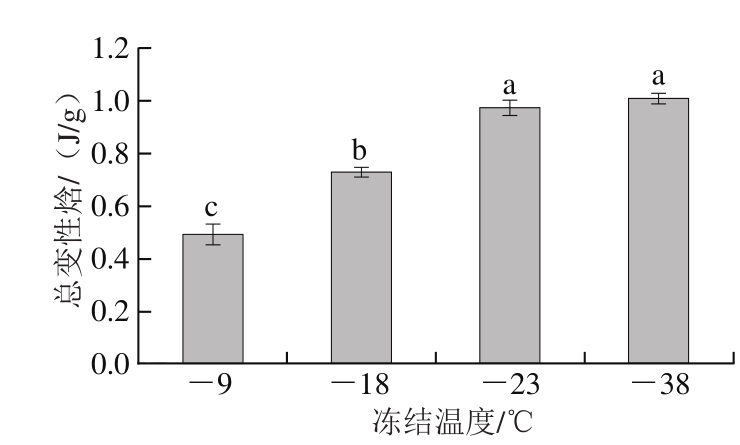
图 5 不同冻结温度下牛肉蛋白总变性焓
Fig. 5 Total denaturation enthalpy of beef myofibrillar proteins after freezing at different temperatures
表 1 牛肉蛋白质DSC分析结果
Table 1 DSC analysis of beef myofibrillar proteins

注:同列肩标小写字母不同表示差异显著(P<0.05)。表3同。
由图4可见,DSC图谱中有3 个峰,峰I、峰II、峰III分别代表肌球蛋白头部、肌球蛋白尾部和肌浆蛋白、肌动蛋白变性引起的热流变化[22]。峰顶点对应的温度为蛋白变性温度,峰面积则代表蛋白质变性焓。蛋白质变性温度与变性焓可反映蛋白质的热稳定性,变性温度与变性焓越高,蛋白质的热稳定性越高、变性程度越小[23]。总变性焓可以反映出样品整个蛋白的变性程度,值为峰I、峰II、峰III的变性焓值之和[24]。结果表明,不同温度下冻结的牛肉蛋白热变性温度总体无显著差异;随着冻结温度降低,肌球蛋白头部、肌球蛋白尾部和肌浆蛋白以及肌动蛋白的变性焓总体呈上升趋势(表1)。图5为不同温度下冻结牛肉蛋白质总变性焓,-23 ℃和-38 ℃试样的总变性焓值分别为0.98 J/g和1.01 J/g,显著高于-9 ℃和-18 ℃的0.50 J/g和0.73 J/g(P<0.05),说明-23 ℃和-38 ℃试样蛋白质热稳定性较高,变性程度低。DSC结果分析可以看出,冻结温度越低,牛肉肌原纤维蛋白的热稳定性越高。任丽娜[25]研究白鲢鱼肌原纤维蛋白冷冻变性时发现冻藏温度越低鱼肉蛋白质热稳定性越高,与本实验结果一致。
表 2 不同冻结温度下牛肉的解冻汁液流失率及加压失水率
Table 2 Thawing loss and pressing loss of beef after freezing at different temperatures
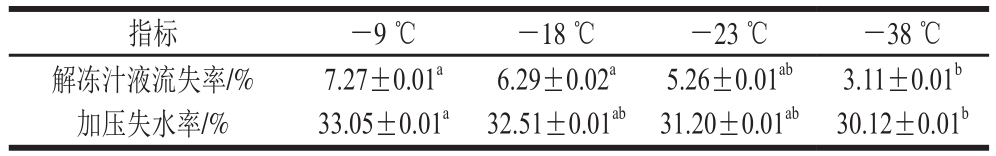
注:同行肩标小写字母不同表示差异显著(P<0.05)。表4同。
解冻汁液流失率和加压失水率为衡量肌肉持水性的重要指标,与肌肉持水性呈负相关[26]。由实验结果可知(表2),牛肉的解冻汁液流失率随着冻结的温度降低而减小。-38 ℃下冻结试样的解冻汁液流失率为3.11%,显著低于-9 ℃的7.27%(P<0.05)。加压失水率与解冻汁液流失实验结果相符,-38 ℃下冻结试样的加压失水率为30.12%,显著低于-9 ℃的33.05%(P<0.05)。结果表明,解冻牛肉的持水性随冻结温度降低而升高,李侠等[27]也得到相似实验结果。本研究旨在验证肌原纤维蛋白变性对肌肉持水性的影响,然而,牛肉在冻结过程中冰晶大量生长,肌肉组织受到严重破坏,也是导致解冻时水分易从肌肉中释放造成汁液流失的重要原因。温度越低,冻结速率越快,生长的冰晶体积越小且分布越均匀[28],肌肉受破坏程度小,肌肉持水性越高。
利用LF-NMR可定量分析肌肉中3 种状态水(结合水、不易流动水及自由水)的分布和组成[29]。
由表3可知,随着冻结温度降低,牛肉中自由水和不易流动水相对比例显著降低(P<0.05),结合水相对比例显著升高(P<0.05)。自由水是指胞外能自由流动的水,是汁液流失的来源[30]。比较解冻后样品不同状态水分的相对含量可知,-23 ℃和-38 ℃实验组肉样解冻后自由水相对比例显著低于-9 ℃与-18 ℃(P<0.05)。自由水是汁液流失的来源,LF-NMR结果表明,低温冻结肉样解冻后自由水比例显著降低(P<0.05),这也验证了此前持水性实验结果。冻结过程中的蛋白变性导致蛋白结构的改变会使肌肉水分的分布与迁移发生变化[31],进而影响肌肉持水性。
表 3 不同温度冻结后牛肉水分分布及组成
Table 3 Moisture distribution and composition of beef after freezing at different temperatures

注:F.样品在该温度下冻结;T.样品在该温度下冻结后,解冻至4 ℃。
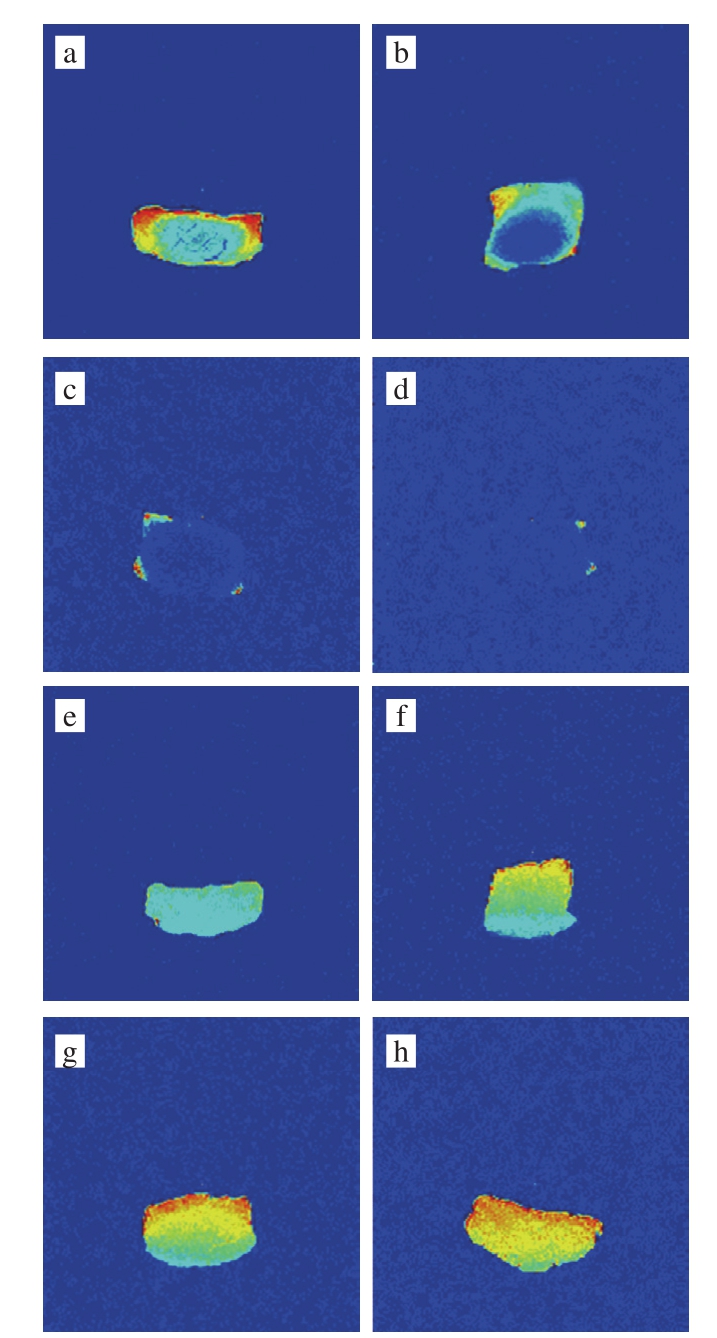
图 6 牛肉冻结、解冻后的H质子密度加权伪彩图
Fig. 6 Proton density weighted pseudocolor images of beef after freezing-thawing at different temperatures
a~h.分别为-9 ℃ F、-18 ℃ F、-23 ℃ F、-38 ℃ F、-9 ℃ T、-18 ℃ T、-23 ℃ T、-38 ℃ T;F.样品在该温度下冻结;T.样品在该温度下冻结后,解冻至4 ℃。
MRI可将物料内部H质子的分布以图像的形式表达出来,图像中亮度越强,表明H质子密度越高,即该部分的含水率越高[17]。由图6可见,随着冻结温度的降低,H质子密度图像中褐色逐渐消失,-23 ℃和-38 ℃下冻结的肉样仅存零星的“亮点”。解冻后各组肉样出现彩色的H
质子密度图像,且冻结温度越低,肉块较多地呈现亮褐色。-9 ℃和-18 ℃温度下冻结后解冻肉样较多地呈现蓝色,说明该两组肉样解冻后汁液流失严重,与2.2节解冻汁液流失率的实验结果一致。
表 4 不同冻结温度下牛肉的色泽和剪切力
Table 4 Color and shear force of beef after freezing at different temperatures

肉的色泽与持水性有一定相关性[32]。肉色的L*值、a*值及b*值分别代表肉样的亮度、红度和黄度[33]。实验结果表明(表4),冻结温度越低,牛肉解冻后表面L*值越小:-38 ℃下冻结肉样L*值为38.62,显著低于-9、-18 ℃和-23 ℃的45.34、44.42和42.85(P<0.05)。分析原因可能由于低温冻结试样解冻汁液流失少,肉样表面不至于附着过多水分,导致光线折射率低、亮度下降;a*值越大说明肉色越鲜艳,肉样越新鲜。-23 ℃和-38 ℃试样的a*值分别为23.82和24.01,显著高于-9℃和-18℃的21.31和20.60。肉样红度主要决定于所含氧合肌红蛋白数目,低温冻结可抑制氧合肌红蛋白进一步氧化为高铁肌红蛋白[34];b*值越高说明肉色越黄,肉样越不新鲜。-23 ℃和-38 ℃试样的b*值分别为13.35和9.57,显著低于-9 ℃和-18 ℃的16.88和14.30。b*值升高是由于脂肪氧化和蛋白质的变性[35],此前研究结果表明,冻结温度越低对蛋白变性抑制效果越明显,解释了b*值的实验结果。
细胞间隙中的水分对肌肉嫩度有重要影响,肌肉的持水能力越高,嫩度越好[36]。剪切力能够反映肉样嫩度,剪切力越小对应嫩度越高。实验结果表明(表4),不同温度下冻结的牛肉剪切力差异显著(P<0.05),冻结温度越低,解冻后牛肉的剪切力越小,嫩度越好。-9 ℃下冻结牛肉解冻后剪切力为82.43 N,显著高于-18、-23 ℃及-38 ℃的67.14、61.21 N及56.20 N。牛肉解冻时出现水分流失导致肌肉收缩,剪切力因此增加,牛肉嫩度降低[23]。低温冻结更有利于减少牛肉汁液流失,进而维持解冻后牛肉的嫩度。
表 5 肌原纤维蛋白理化特性与肌肉持水性相关性分析
Table 5 Pearson correlation coefficients between myofibrillar protein denaturation and water-holding capacity

注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
对-9、-18、-23 ℃及-38 ℃下冻结牛肉的色泽、嫩度、解冻汁液流失率和加压失水率以及肌原纤维蛋白理化特性进行相关性分析,结果如表5所示。蛋白质溶解度与解冻汁液流失率(r=-0.876,P<0.01)和加压失水率(r=-0.918,P<0.01)呈极显著负相关,亦与L*值、b*值及剪切力均呈极显著负相关(P<0.01);Ca2+-ATPase活力与解冻汁液流失率(r=-0.820,P<0.01)、加压失水率(r=-0.863,P<0.01)呈极显著负相关,与L*值、b*值及剪切力均呈显著负相关(P<0.01,P<0.05);巯基含量与解冻汁液流失率(r=-0.861,P<0.01)、加压失水率(r=-0.792,P<0.01)呈极显著负相关,与L*值、b*值及剪切力均呈极显著负相关(P<0.01);蛋白质总变性焓与解冻汁液流失率(r=-0.765,P<0.01)、加压失水率(r=-0.822,P<0.01)呈极显著负相关,亦与L*值、b*值及剪切力呈极显著负相关(P<0.01)。L*值及b*值均与解冻汁液流失率和加压失水率呈极显著正相关(P<0.01)。剪切力与解冻汁液流失率、加压失水率呈极显著正相关(P<0.01)。肌原纤维蛋白理化特性(蛋白质溶解度、Ca2+-ATPase活力、巯基含量、总变性焓)与肌肉持水性(解冻汁液流失率、加压失水率)均呈极显著相关(P<0.01)。结果表明,牛肉在冻结过程中,肌原纤维蛋白出现变性,引起蛋白质溶解度、Ca2+-ATPase活力、巯基含量及总变性焓的变化,对肌肉持水性产生显著影响,进而导致不同温度冻结的牛肉解冻后色泽和嫩度出现差异。
牛肉在-9、-18、-23 ℃及-38 ℃下冻结,温度越低,肌原纤维蛋白变性程度越小(肌原纤维蛋白质溶解度、Ca2+-ATPase活力、巯基含量及总变性焓均显著升高)。
解冻汁液流失率随着冻结的温度降低而减小(P<0.05),-38 ℃下冻结试样的解冻汁液流失率为3.11%,显著低于-9 ℃实验组的7.27%(P<0.05),解冻后肉样的加压失水率也存在相同规律。冻结温度越低,越有利于维持牛肉持水性,解冻后肉色维持越好、嫩度越高。
肌原纤维蛋白理化特性(溶解度、Ca2+-ATPase活力、巯基含量、总变性焓)与肌肉持水性(解冻汁液流失、加压失水率)均呈极显著相关(P<0.01),L*、b*值及剪切力肌肉持水性亦存在极显著相关(P<0.01),表明牛肉冻结过程中肌原纤维蛋白变性对肌肉持水性存在显著影响,并表现于牛肉解冻后的色泽、嫩度和汁液流失方面。
参考文献:
[1] 李金平, 周光宏, 徐幸莲, 等. 反复冻融对牛肉解冻温度变化和持水能力的影响[J]. 食品科学, 2009, 30(增刊1): 46-48.
[2] PIETRASIK Z, JANZ J A M. Influence of freezing and thawing on the hydration characteristics, quality, and consumer acceptance of whole muscle beef injected with solutions of salt and phosphate[J]. Meat Science, 2008, 81(3): 523-532. DOI:10.1016/j.meatsci.2008.10.006.
[3] 张春晖, 李侠, 李银, 等. 低温高湿变温解冻提高羊肉的品质[J].农业工程学报, 2013, 29(6): 267-273. DOI:10.3969/j.issn.1002-6819.2013.06.033.
[4] 丁一, 黄莉, 夏秀芳, 等. 冻藏对肌原纤维蛋白结构特性与功能特性的影响[J]. 包装与食品机械, 2013, 31(4): 55-59. DOI:10.3969/j.issn.1005-1295.2013.04.015.
[5] LIU Q, KONG B H, HAN J C, et al. Effects of superchilling and cryoprotectants on the quality of common carp (Cyprinus carpio)surimi: microbial growth, oxidation, and physiochemical properties[J].LWT-Food Science and Technology, 2014, 57(1): 165-171.DOI:10.1016/j.lwt.2014.01.008.
[6] UTRERA M, MORCUENDE D, ESTÉVEZ M. Temperature of frozen storage affects the nature and consequences of protein oxidation in beef patties[J]. Meat Science, 2014, 96(3): 1250-1257. DOI:10.1016/j.meatsci.2013.10.032.
[7] PETZOLD G, AGUILERA J M. Ice morphology: fundamentals and technological applications in foods[J]. Food Biophysics, 2009, 4(4):378-396. DOI:10.1007/s11483-009-9136-5.
[8] ZUO H X, HAN L, YU Q L, et al. Proteome changes on waterholding capacity of yak longissimus lumborum during postmortem aging[J]. Meat Science, 2016, 121: 409-419. DOI:10.1016/j.meatsci.2016.07.010.
[9] MEDINA I, GONZÁLEZ M J, IGLESIAS J, et al. Effect of hydroxycinnamic acids on lipid oxidation and protein changes as well as water holding capacity in frozen minced horse mackerel white muscle[J]. Food Chemistry, 2009, 114(3): 881-888. DOI:10.1016/j.foodchem.2008.10.031.
[10] SIGURGISLADOTTIR S, INGVARSDOTTIR H, TORRISSEN O J,et al. Effects of freezing/thawing on the microstructure and the texture of smoked Atlantic salmon (Salmo salar)[J]. Food Research International, 2000, 33(10): 857-865.
[11] 李银, 孙红梅, 张春晖, 等. 牛肉解冻过程中蛋白质氧化效应分析[J]. 中国农业科学, 2013, 46(7): 1426-1433. DOI:10.3864/j.issn.0578-1752.2013.07.013.
[12] 魏秀丽, 谢小雷, 张春晖, 等. 猪宰后肌肉体系中μ-calpain及肌原纤维蛋白理化特性的变化规律[J]. 中国农业科学, 2015, 48(12):2428-2438. DOI:10.3864/j.issn.0578-1752.2015.12.016.
[13] JOO S T, KAUFFMAN R G, KIM B C, et al. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and waterholding capacity in porcine longissimus muscle[J]. Meat Science,1999, 52(3): 291-297.
[14] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry &Biophysics, 1959, 82(1): 70-77.
[15] DENG Y, ROSENVOLD K, KARLSSON A H, et al. Relationship between thermal denaturation of porcine muscle proteins and waterholding capacity[J]. Journal of Food Science, 2002, 67(5): 1642-1647.
[16] FAROUK M M, WIELICZKO K J, MERTS I. Ultra-fast freezing and low storage temperatures are not necessary to maintain the functional properties of manufacturing beef[J]. Meat Science, 2004, 66(1): 171-179. DOI:10.1016/S0309-1740(03)00081-0.
[17] 谢小雷, 李侠, 张春晖, 等. 不同干燥方式对牛肉干物性特性的影响[J]. 农业工程学报, 2015, 31(增刊1): 346-354. DOI:10.11974/nyyjs.20150733012.
[18] DEAN R T, FU S L, STOCKER R, et al. Davies Biochemistry and pathology of radical mediated protein oxidation[J]. Biochemical Journal, 1997, 324: 1-18.
[19] CHEN C S, HWANG D C, JIANG S T. Effect of storage temperatures on the formation of disulfides and denaturation of milkfish actomyosin(Chanos chanos)[J]. Journal of Food Science, 1988, 37(5): 1333-1335.
[20] BENJAKUL S, VISESSANGUAN W, TUEKSUBAN J. Changes in physico-chemical properties and gel-forming ability of lizardfish(Saurida tumbil) during post-mortem storage in ice[J]. Food Chemistry, 2003, 80(4): 535-544.
[21] 郭园园, 孔保华. 冷冻贮藏引起的鱼肉蛋白质变性及物理化学特性的变化[J]. 食品科学, 2011, 32(7): 335-340.
[22] KORZENIOWSKA M, CHEUNG I W Y, LI-CHAN E C Y.Effects of fish protein hydrolysate and freeze-thaw treatment on physicochemical and gel properties of natural actomyosin from Pacific cod[J]. Food Chemistry, 2013, 138(2/3): 1967-1975. DOI:10.1016/j.foodchem.2012.09.150.
[23] ZHOU A, BENJAKUL S, PAN K, et al. Cryoprotective effects of trehalose and sodium lactate on tilapia (Sarotherodon nilotica) surimi during frozen storage[J]. Food Chemistry, 2006, 96(1): 96-103.DOI:10.1016/j.foodchem.2005.02.013.
[24] 廖彩虎. 冻结、解冻和冻藏对温氏鸡品质的影响的研究[D]. 广州:华南理工大学, 2010: 21-23..
[25] 任丽娜. 白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D]. 无锡: 江南大学, 2014: 19-20.
[26] 余小领. 冷冻和解冻工艺对猪肉保水性和组织结构的影响研究[D].南京: 南京农业大学, 2007: 11-12.
[27] 李侠, 孙圳, 杨方威, 等. 适宜冻结温度保持牛肉蛋白稳定性抑制水分态变[J]. 农业工程学报, 2015, 31(23): 238-245. DOI:10.11975/j.issn.1002-6819.2015.23.032.
[28] KAALE L D, EIKEVIK T M, BARDAL T, et al. The effect of cooling rates on the ice crystal growth inair-packed salmon fillets during superchilling andsuperchilled storage[J]. International Journal of Refrigeration, 2013, 36(1): 110-119. DOI:10.1016/j.ijrefrig.2012.09.006.
[29] 谢小雷, 李侠, 张春晖, 等. 牛肉干中红外-热风组合干燥工艺中水分迁移规律[J]. 农业工程学报, 2014, 30(14): 322-330. DOI:10.3969/j.issn.1002-6819.2014.14.040.
[30] BERTRAM H C, SCHAFER A, ROSENVOLD K, et al. Physical changes of significance for early post mortem water distribution in porcine M. longissimus[J]. Meat Science, 2004, 66(4): 915-924.DOI:10.1016/S0309-1740(03)00188-8.
[31] KOOHMARAIE M, GEESINK G H. Contribution of postmortem muscle biochemistry to the delivery of consistent meat quality with particular focus on the calpain system[J]. Meat Science, 2006, 74(1):34-43. DOI:10.1016/j.meatsci.2006.04.025.
[32] HUGHES J M, OISETH S K, PURSLOW P P, et al. A structural approach to understanding the interactions between colour, waterholding capacity and tenderness[J]. Meat Science, 2014, 98(3):520-532. DOI:10.1016/j.meatsci.2014.05.022.
[33] KIM Y H, KEETON J T, SMITH S B, et al. Evaluation of antioxidant capacity and colour stability of calcium lactate enhancement on fresh beef under highly oxidising conditions[J]. Food Chemistry, 2009,115(1): 272-278. DOI:10.1016/j.foodchem.2008.12.008.
[34] BENJAKUL S, VISESSANGUAN W, TUEKSUBAN J. Changes in physico-chemical properties and gel-forming ability of lizardfish(Saurida tumbil) during post-mortem storage in ice[J]. Food Chemistry,2003, 80(4): 535-544. DOI:10.1016/S0308-8146(02)00339-4.
[35] TIRONI V, DE LAMBALLERIE M, LE-BAIL A. Quality changes during the frozen storage of sea bass (Dicentrarchus labrax) muscle after pressure shift freezing and pressure assisted thawing[J].Innovative Food Science & Emerging Technologies, 2010, 11(4):565-573. DOI:10.1016/j.ifset.2010.05.001.
[36] 孙金辉. 冻藏、反复冻融及解冻方式对兔肉品质的影响[D]. 重庆:西南大学, 2013: 2-3.
Myofibrillar Protein Denaturation and Water-Holding Capacity of Beef Frozen at Different Temperatures
QIAN Shuyi1,2, LI Xia2, SUN Zhen2, SHANG Ke2, GUAN Wenqiang1,*, ZHANG Chunhui2,*
(1. Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce,Tianjin 300134, China; 2. Comprehensive Key Laboratory of Agro-products Processing, Ministry of Agriculture,Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract:This study aimed to research the effect of freezing temperature on beef myofibrillar protein denaturation and water-holding capacity (WHC), and to explore the correlation between myofibrillar protein denaturation and WHC. Beef Longissimus dorsi frozen at −9, −18, −23 and −38 ℃ were tested. Myofibrillar protein denaturation was investigated by the determination of sulfrydryl content, protein solubility, Ca2+-adenosine triphosphatase (ATPase) activity and protein thermal stability. WHC was evaluated by thawing loss and pressing loss. In addition, muscle water distribution was analyzed by low field nuclear magnetic resonance (LF-NMR) and magnetic resonance imaging (MRI). Color difference and shear force were also measured after thawing at 4 ℃. Results demonstrated that samples frozen at −23 and −38 ℃ showed lower degree of protein denaturation, higher protein solubility, Ca2+-ATPase activity and total denaturation enthalpy than those frozen at −9 and −18 ℃ (P < 0.05). In addition, L* value, b* value and shear force in thawed samples, thawing loss and pressing loss dropped significantly compared to those frozen at −9 and −18 ℃ (P < 0.05). LF-NMR and MRI analyses consistently showed that freezing at −23 and −38 ℃ resulted in higher WHC than at −9 and −18 ℃. Furthermore, the physicochemical properties (solubility, Ca2+-ATPase activity, sulfrydryl content and total denaturation enthalpy) as well as L* value, b*value and shear force of beef myofibrillar protein were highly significantly correlated with WHC (P < 0.01). Consequently,myofibrillar protein denaturation during beef freezing had a significant impact on WHC, causing color deterioration, reduced tenderness and juice loss after thaw.
Keywords:freezing temperature; beef; myofibrillar protein denaturation; water-holding capacity
DOI:10.7506/spkx1002-6630-201815004
收稿日期:2017-03-23
基金项目:国家自然科学基金面上项目(31371797)
第一作者简介:钱书意(1994—),男,硕士,研究方向为农产品加工与贮藏。E-mail:1409648708@qq.com
*通信作者简介:
关文强(1974—),男,教授,博士,研究方向为农产品贮藏与加工。E-mail:gwq18@163.com
张春晖(1971—),男,研究员,博士,研究方向为肉品科学。E-mail:dr_zch@163.com
中图分类号:TS251.1
文献标志码:A
文章编号:1002-6630(2018)15-0024-07
引文格式:
钱书意, 李侠, 孙圳, 等. 不同冻结温度下牛肉的肌原纤维蛋白变性与肌肉持水性[J]. 食品科学, 2018, 39(15): 24-30.DOI:10.7506/spkx1002-6630-201815004. http://www.spkx.net.cn
QIAN Shuyi, LI Xia, SUN Zhen, et al. Myofibrillar protein denaturation and water-holding capacity of beef frozen at different temperatures[J]. Food Science, 2018, 39(15): 24-30. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815004. http://www.spkx.net.cn