表 1 挤压添加酶制剂脱胚玉米取料实验挤压系统参数
Table 1 Extrusion parameters of degerminated corn with and without thermostable α-amylase

马成业1,2,范玉艳1,2,于双双1,2,张东亮1,2
(1.山东理工大学农业工程与食品科学学院,山东 淄博 255091;2.山东省高校农产品功能化技术重点实验室,山东 淄博 255091)
摘 要:本研究通过偏光显微镜、扫描电子显微镜、热台显微镜、X射线衍射、差示扫描量热分析、傅里叶变换红外光谱分析等手段,研究原脱胚玉米、挤压脱胚玉米和添加耐高温α-淀粉酶挤压脱胚玉米的淀粉结构及性质变化,并探究其相互关系,揭示挤压剪切活化对脱胚玉米的淀粉颗粒机械力化学效应。研究表明:与原脱胚玉米和挤压脱胚玉米相比较,挤压处理对添加耐高温α-淀粉酶脱胚玉米的淀粉结构及性质产生显著影响,酶解力和糊化度增大,碘蓝值、直链淀粉含量减小。添加耐高温α-淀粉酶挤压脱胚玉米淀粉颗粒形貌破坏,偏光十字破坏,结晶度变小;升温糊化过程中,焓变降低;挤压使淀粉颗粒的结晶结构破坏,淀粉颗粒发生聚集,破损淀粉颗粒易糊化和裂解。
关键词:淀粉;挤压;脱胚玉米;结构;理化特性
挤压技术因生产效率高、成本低、能耗低、环境友好等特点,在食品、化工、制药中有着广泛的应用[1-2]。通过挤压膨化,可以改变谷物内部组分的分子结构,使得谷物中淀粉降解,还原糖和糊精含量增多,从而明显提高原料的利用率[3]。挤压剪切活化技术是淀粉生物和机械降解、加快淀粉酶的水解速率和提高淀粉利用率的一种重要、有效的方法和手段[4]。挤压过程中淀粉受到水分、热、机械剪切等的联合作用,维持颗粒结构的部分氢键断裂、结晶结构解体,膨胀的淀粉颗粒破裂[5]。同时淀粉结晶结构消失,分子质量降低,使淀粉颗粒和半结晶体系转变成高黏态和塑性态[6];此外,挤压还可增加淀粉酶与颗粒形态消失的淀粉的作用面积,加快酶的水解速率。以干法脱胚玉米为原料,添加淀粉酶后制得的挤压淀粉用于淀粉糖浆生产,与采用湿法淀粉为原料生产淀粉糖浆相比较,工艺流程短、设备投资低、污水排放少,具有可观的经济效益和良好的环保效益[7-8]。而淀粉作为脱胚玉米的主要成分,其结晶结构、糊化特性等对产品的加工特性等有重要影响。因此,脱胚玉米添加淀粉酶后,深入研究挤压剪切活化对淀粉结晶结构、热特性、颗粒形貌、相变等的影响显得尤为重要。本研究使用加酶挤压技术处理脱胚玉米,采用偏光显微镜、扫描电子显微镜、热台显微镜、X射线衍射分析、差示扫描量热分析、傅里叶变换红外光谱等技术探究添加耐高温α-淀粉酶挤压脱胚玉米中的淀粉结构及性质变化,为研究淀粉改性和淀粉深加工提供基础参考和技术支持。
脱胚玉米(水分质量分数12.46%、淀粉质量分数76.25%、蛋白质量分数6.47%、脂肪质量分数0.98%) 天津宝坻玉米加工厂;耐高温α-淀粉酶(活力20 000 U/mL)博立生物工程有限公司;中温α-淀粉酶(活力4 000 U/g)北京奥博星生物技术有限公司;其他所需的化学试剂均为分析纯。
剖分式单螺杆挤压机由山东理工大学农产品精深加工实验室自制,生产效率为100 kg/h。由三段加热组合套筒和螺杆组成,长径比17.4∶1,螺杆直径77 mm,螺杆转速为0~1 200 r/min(无级可调),套筒温度为0~300 ℃(连续可调),配有温度数显仪表闭环自控系统。
D8 ADVANCE多晶X射线衍射仪 德国Brucker公司;NICOLET 5700傅里叶变换红外光谱仪 美国Thermo公司;Q100 差示扫描量热法(differential scanning calorimetry,DSC)仪 美国TA公司;501万能显微镜日本尼康株式会社;QUANTA250场发射扫描电子显微镜美国FEI公司;BHS-2光学显微镜 日本Olympus公司;THMS600热台设备和温度控制操作系统 英国Linkam Scientific公司。
1.3.1 挤压脱胚玉米制备工艺
添加耐高温α-淀粉酶挤压脱胚玉米:称取2 kg脱胚玉米粉,调整原料水分质量分数为30%,添加耐高温α-淀粉酶,添加量为10 U/g原料;设置挤压机操作参数:螺杆转速为110 r/min,从喂料口到出料口三段套筒温度分别设置为40、50、60 ℃,模孔直径12 mm(3 个);挤压未加酶脱胚玉米:原料不添加耐高温α-淀粉酶,其他物料参数和挤压系统参数与加酶挤压相同(表1)。挤出物室温晾干,使用锤片式粉碎机粉碎,全部物料通过80 目筛,密封于塑料袋中,低温保存。
表 1 挤压添加酶制剂脱胚玉米取料实验挤压系统参数
Table 1 Extrusion parameters of degerminated corn with and without thermostable α-amylase

1.3.2 酶解力测定
取试样0.1 g,加50.0 mL蒸馏水,摇匀后取样10.0 mL,加5 g/100 mL中温α-淀粉酶2.0 mL,39 ℃水浴振荡90 min;加入1 mol/L HCl 1.0 mL,定容至50.0 mL,漩涡振荡混匀后过滤。滤液稀释6倍,取1.0 mL稀释液和1.0 mL DNS试剂于50 mL比色管中,沸水浴5 min,快速冷却至室温,加10.0 mL的蒸馏水;于540 nm波长处比色(以不加样品的空白调节零点),以1 g淀粉的吸光度作为酶解力[9]。
1.3.3 碘蓝值测定
准确称取0.1 g样品(干基),使用1.0 mL无水乙醇将样品湿润后,加入10 mL 1.0 mol/L NaOH溶液后,置于沸水浴中加热10 min,冷却后定容至100 mL,混匀即为样品溶液。移取1.4 mL样品溶液于50 mL容量瓶,依次加入4 mL 0.09 mol/L NaOH溶液、0.48 mL 1 mol/L乙酸溶液和0.8 mL 1 mol/L碘试剂,用蒸馏水定容至50 mL,混匀后10 min,于620 nm波长处测吸光度,吸光度即为碘蓝值。空白用0.7 mL蒸馏水加入2 mL 0.09 mol/L NaOH溶液、0.4 mL 1 mol/L乙酸溶液和0.4 mL 1 mol/L碘试剂定容至50 mL配制[10]。
1.3.4 糊化度测定
参照碘呈色分析法测定[11]。
1.3.5 直链淀粉含量测定
脱胚玉米及挤出物中直链淀粉含量参照GB 7648—1987《水稻、玉米、谷子籽粒直链淀粉测定法》中的方法测定。
1.3.6 偏光十字观察
配制5 mL甘油、水体积比为1∶1的溶液,加约0.5 g样品于其中调成乳浊液,滴适量到载玻片上,盖上盖玻片后在偏振光下观察淀粉的形态,放大倍数为500 倍[12]。
1.3.7 X射线衍射分析和结晶度测定
将样品紧密地充填到塑料磨具(直径20 mm,深1.5 mm)中,放在X射线衍射仪下进行测定。特征射线Cu Kα,测试电压35 kV、测试电流30 mA。扫描条件为:扫描2θ范围为3°~50°,步长为0.02°,扫描速率为3(°)/min[13-14]。
结晶度使用MDI Jade软件曲线平滑的方法计算[15]。利用MDI Jade软件打开样品X射线衍射图谱,取2θ 4°~30°的图谱并平滑,扣除背底,左键点击每个峰两端最低点,描出微晶区和结晶区分割线,读出样品结晶度。
1.3.8 样品颗粒形貌观察
采用扫描电子显微镜进行样品的颗粒形貌观察。取少许样品均匀粘在导电胶上,然后喷金处理,喷金70 s,放入电子显微镜室观察。在操作电压10 kV下观察淀粉的形态,并拍摄具有代表性的淀粉颗粒形貌[16]。
1.3.9 热台显微镜观察
实验采用BHS-2光学显微镜进行颗粒形态观察,同时,连接THMS600热台设备和温度控制操作系统进行实时观察。称取一定量的样品配成质量分数2%的乳浊液待用,滴1~2 滴上述浆液于玻片上,用专用的热台实验胶密封,放入热台中加热;加热温度从28 ℃开始,至淀粉颗粒偏光十字完全消失停止加热;加热过程中,升温速率为2 ℃/min,每隔30 s分别用数码相机拍摄淀粉颗粒的普通光学显微镜图片[17]。
1.3.10 样品傅里叶变换红外光谱扫描
将样品和溴化钾于真空干燥至恒质量,称取1 mg 样品于玛瑙研钵中,加入100 mg溴化钾粉末,研磨均匀,装入压片模具中制成簿片。采用傅里叶变换红外光谱仪对样品进行扫描和测定,波数范围为400~4 000 cm-1,扫描次数为32,分辨率为4 cm-1[18]。
1.3.11 样品DSC分析
准确称量5 mg样品,加入去离子水10 mg,密封于普通铝盘中在20 ℃平衡16 h,之后放入DSC中进行扫描,用铝制空坩埚样品池作参比物,升温区间为20~100 ℃,升温速率为5 ℃/min,载气为氮气,流速为50 mL/min[19]。描绘各样品的糊化吸热曲线,测定样品的峰起始温度To,峰值温度Tp,峰结束温度Tc和相变焓ΔH。
实验数据重复3 次,以平均值±标准差表示,采用Origin 9.1软件进行数据处理和绘制结果状态图,使用MDI Jade软件计算样品的结晶度。以SPSS统计软件的Duncan法进行单因素方差分析,比较不同处理间的差异显著性,P<0.05表示差异显著。
酶解力、碘蓝值和糊化度是研究脱胚玉米物理化学特性的重要指标,脱胚玉米经过挤压和加酶挤压处理后,酶解力、碘蓝值和糊化度与原脱胚玉米有较大的差异。碘蓝值、酶解力和糊化度与脱胚玉米的直链淀粉含量、颗粒结构和晶体结构等有着密切的关系。
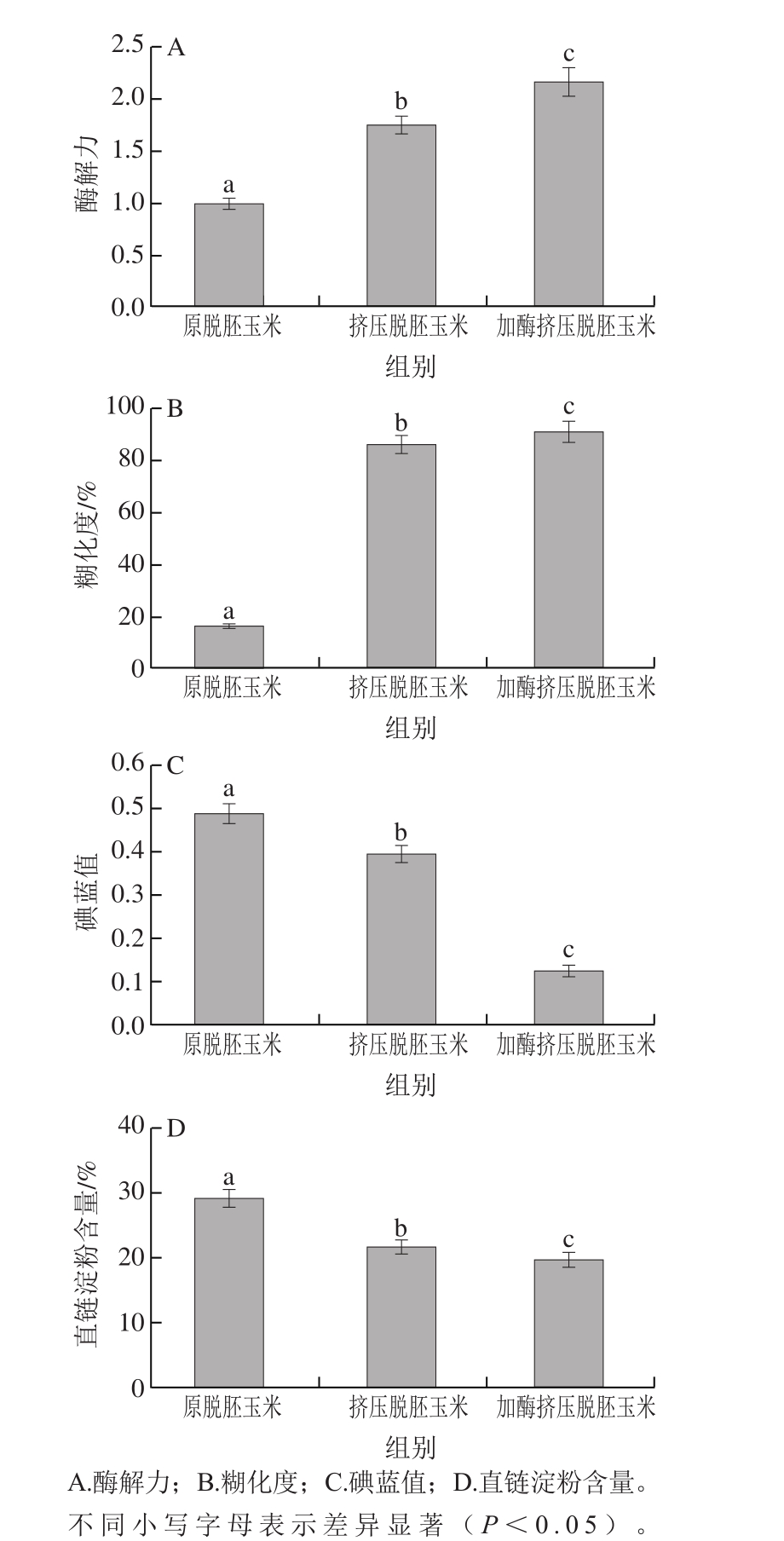
图 1 样品的酶解力、碘蓝值、糊化度和直链淀粉含量
Fig. 1 Enzymatic hydrolysis efficiency, iodine blue value, gelatinization degree and amylose content of native, extruded and enzymatic extruded degerminated corn starch
原脱胚玉米的酶解力为1.0,挤压脱胚玉米的酶解力可达1.7,脱胚玉米经过加酶挤压后,酶解力进一步升高,可达2.1(图1A)。原脱胚玉米晶体结构紧密,故酶解力较低。脱胚玉米中的淀粉颗粒经过挤压后,结晶区被破坏,使位于淀粉粒核心部分的直链淀粉暴露出来,易于酶解,酶解力较大(图1A)。脱胚玉米经过挤压和加酶挤压后,糊化度到86%和91%以上(图1B)。挤压膨化过程中的淀粉糊化,是一个在低水分含量状态下的糊化过程[20]。淀粉分子间的氢键断裂是淀粉糊化的本质。脱胚玉米在加酶挤压过程受到温度、压力、机械剪切和淀粉酶的联合影响,淀粉分子间的氢键断裂,使淀粉糊化。脱胚玉米在挤压机螺杆的推动下不规则前进,在推进力和摩擦力机械作用下受压变热,使氢键断裂[21-22]。
脱胚玉米经过挤压和加酶挤压后,淀粉内的部分氢键断裂,淀粉发生糊化,直链淀粉含量降低。而碘蓝值是表示淀粉结合碘能力的一个指标,可反映直链淀粉含量和链长的变化[23]。碘分子与直链淀粉反应,形成蓝色络合物,淀粉的分解量越小,颜色越深,碘蓝值越大。当直链淀粉的含量较高或链长较长时,碘蓝值较大[10,24]。挤压脱胚玉米的碘蓝值明显高于加酶挤压脱胚玉米的碘蓝值,但是均小于原脱胚玉米的碘蓝值(图1C)。直链淀粉与碘产生蓝色,而支链淀粉则生成紫红色。脱胚玉米经过挤压和加酶挤压后,直链淀粉含量降低(图1D)。
在使用偏光显微镜观察具有球状微晶结构的淀粉颗粒时,能够观察到双折射现象,又叫偏光十字现象。淀粉颗粒内部存在分子链有序排列的结晶结构和分子链无序排列的无定形结构,这两种结构在密度和折射率上存在差别,具有各向异性,在偏振光通过淀粉颗粒时形成了偏光十字[23];因此通过偏光十字是否消失来判断微晶结构的存在状况[26]。

图 2 样品的偏光十字观察
Fig. 2 Polarizing microscopic observation of the samples
A.脱胚玉米;B.挤压脱胚玉米;C.加酶挤压脱胚玉米。图4同。
由图2可以看出,脱胚玉米偏光十字较为清晰,经挤压和加酶挤压处理后,大量淀粉颗粒的偏光十字消失,即使存在偏光十字,也较为模糊。挤压和加酶挤压能够破坏淀粉颗粒的结晶结构,利于淀粉的糊化和液化。
淀粉颗粒由形状和大小不一的颗粒组成,可以分为结晶区和无定形区。射线衍射是目前研究淀粉类物质晶体结构最普遍和最有效的方法,可以判定淀粉的结晶类型和品种以及淀粉在物理化学处理过程中的晶型变化特性[27]。在X射线衍射图谱中结晶结构对应尖峰衍射特征,无定形区对应弥散衍射特征,通过对比和研究X射线衍射图谱中尖峰衍射特征和弥散衍射特征的比例及变化规律就可以确定淀粉颗粒的结晶性质[28]。

图 3 原脱胚玉米、挤压和加酶挤压脱胚玉米的X射线衍射图谱
Fig. 3 X-ray diffraction patterbs of native, extruded and enzymatic extruded degerminated corn
表 2 原脱胚玉米、挤压和加酶挤压脱胚玉米X射线衍射图谱数据
Table 2 X-ray diffraction data of native, extruded degerminated corn and enzymatic extruded degerminated corn

注:/.无衍射峰。
根据淀粉类物质的X射线衍射图谱和特征值,淀粉结晶结构可分为4 类,分别为天然淀粉的A、B、C型和直链淀粉-脂类复合物的V型[29-30]。利用X射线衍射对原脱胚玉米、挤压脱胚玉米和加酶挤压脱胚玉米的测试结果如见图3所示。原脱胚玉米在2θ为15°、17°、18°、23°时都存在尖峰衍射,表明原脱胚玉米的淀粉晶型为A型的淀粉特征[29-30],相对结晶度为40.35%。挤压脱胚玉米和加酶挤压脱胚玉米相对结晶度分别为34.41%和30.31%(表2),表明挤压破坏了脱胚玉米中淀粉的结晶结构,这与偏光十字结果相一致。在挤压脱胚玉米和加酶挤压脱胚玉米的X射线衍射图谱中,在2θ 20°有新的衍射峰出现[29]。原脱胚玉米含有约1.0%的粗脂肪和约29%的直链淀粉,脂肪和直链淀粉在挤压过程中复合,形成淀粉脂复合物[19],这种复合物具有一定的结晶性,在2θ 20°有特征衍射峰[32-33]。挤压脱胚玉米和加酶挤压脱胚玉米的晶型为A+V型。脱胚玉米在挤压和加酶挤压过程中,由于受到热、水分散失、压力、剪切和酶等的综合作用,部分淀粉颗粒的结晶结构破坏,淀粉糊化,这与图1B糊化度的结果相一致。
脱胚玉米在挤压机内受到摩擦、剪切、压力的作用,使淀粉颗粒解体,同时挤压机套筒温度、压力升高,脱胚玉米从模孔瞬间挤出,瞬间降至低温常压,大部分水分在此压差下急剧汽化散失,进一步破坏淀粉晶体结构,同时变成片状结构[34]。

图 4 样品的扫描电子显微镜图
Fig. 4 Scanning electron microscopic images of three samples
从图4可以看出,原脱胚玉米颗粒比较完整,表面光滑,颗粒形状不规则,多数颗粒为多角形,颗粒表面存在多个平面和棱角。经过挤压处理后,脱胚玉米颗粒在挤压剪切、摩擦等作用下,绝大部分颗粒破碎,变成扁长状,破碎后的小颗粒在强烈的挤压剪切作用下聚集成团,表面有孔洞。加酶挤压脱胚玉米颗粒团聚而成的颗粒较少,颗粒成多角,这种结构利于酶的水解,可提高糖浆收率和缩短糖化时间[7]。
热台显微镜法能够观察到脱胚玉米颗粒在升温过程中结构的破坏过程,能够原位、在线实时地观察颗粒在加热时的形态变化、膨胀程度以及晶体结构破坏的过程[35]。用热台显微镜在无剪切力条件下连续测定原脱胚玉米、挤压脱胚玉米和加酶挤压脱胚玉米在升温过程中的颗粒变化情况。
图5是加热速率为2 ℃/min时,在线观察同一视野内,普通光下3 种物料在不同温度下的显微镜照片。30 ℃时是物料的最初形态,从显微镜下观察到样品颗粒变化和糊化是非线性的。在30~60 ℃,原脱胚玉米颗粒发生了细微的膨胀,颗粒保持原有的形态;在65~70 ℃,颗粒的形态基本未发生改变,颗粒变大;75~80 ℃,颗粒继续变大,并且形态开始发生改变,颗粒外部破损严重,还有一些碎片存在;85~90 ℃时,原有颗粒形态消失,颗粒破碎,弥散到浆液中,此时淀粉完成糊化。

图 5 普通光下3 种物料在不同温度下的颗粒形态
Fig. 5 Real time light microscopic images of three samples at different temperatures under normal light
挤压脱胚玉米和加酶挤压脱胚玉米的大部分颗粒形态发生变化,淀粉糊化,在热台显微镜观察到的颗粒形态变化与原脱胚玉米有差异。在30~60 ℃时,聚集成团的颗粒吸水膨胀,颗粒之间距离增大;在65~70 ℃时团簇解体,部分损伤颗粒破裂,这部分颗粒吸水膨胀程度比原脱胚玉米高;在75~80 ℃时,团簇完全解体,损伤颗粒吸水膨胀到最大程度,并裂解;85~90 ℃时,颗粒完全解体,原有形态完全消失,裂解后的颗粒远远小于原脱胚玉米。
挤压和加酶挤压脱胚玉米在升温糊化过程中,淀粉吸水膨胀速率比原脱胚玉米快,糊化裂解后的粒度小于原脱胚玉米,利于淀粉酶的水解。
在水和热共同作用下,淀粉-水混合体系糊化过程中发生相变,淀粉颗粒经历不可逆的无序相变过程。糊化热焓则被看作是糊化过程解开双螺旋所需要的能量,热焓值越大,则表示淀粉颗粒结构越紧密,分子间相互作用力越强[36]。由图6和表3可以看出,破碎的脱胚玉米颗粒(挤压和加酶挤压脱胚玉米)在DSC分析中吸热量小。

图 6 原脱胚玉米、挤压脱胚玉米和加酶挤压脱胚玉米的DSC曲线
Fig. 6 Thermal properties of native, extruded and enzymatic extruded degerminated corn by DSC analysis
表 3 原脱胚玉米、挤压脱胚玉米和加酶挤压脱胚玉米的热特性值
Table 3 Enthalpy change values of native, extruded and enzymatic extruded degerminated corn

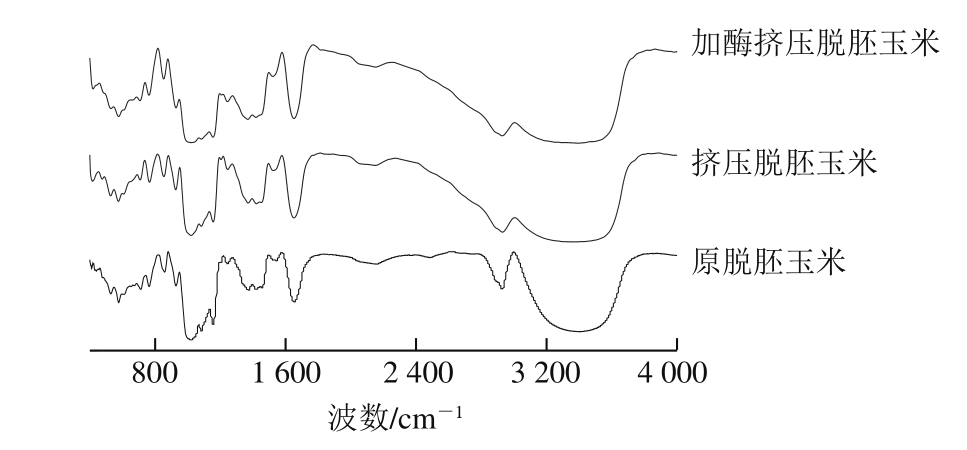
图 7 原脱胚玉米、挤压和加酶挤压脱胚玉米的傅里叶变换红外光谱
Fig. 7 Fourier transform infrared spectra of native, extruded and enzymatic degerminated corn
由图7可知,原脱胚玉米、挤压脱胚玉米和加酶挤压脱胚玉米的傅里叶变换红外谱带主要集中在3 371~3 320、2 935~2 925、1 649~1 644、1 423~1 240、1 161~1 016、931~708、610~430 cm-17 个波段,并且峰强度大。3 种物料的傅里叶变换红外光谱最大吸收峰波数范围基本相同,特征吸收峰位置和特征指纹相同,但相同峰位的峰吸收强度有较大差异,表明3 种物料化学成分基本相同。
原脱胚玉米在3 750~3 000 cm-1的峰是淀粉分子间和分子内的氢键伸缩振动产生的吸收峰,为多个O—H伸缩振动吸收峰,并重叠在一起。但是挤压和加酶挤压的峰比原脱胚玉米的峰窄而且强度低。原脱胚玉米淀粉分子靠分子间氢键结合而排列得很紧密,形成束状的胶束,彼此之间间隙很小,即使水分子也难以渗透进去。峰向低波数方向位移距离越大,氢键增强程度也越大。因为脱胚玉米经过挤压和酶联合处理后,淀粉颗粒受到剪切、热或酶的作用发生糊化和降解,破坏淀粉颗粒的晶体结构,分子间和分子内氢键断裂,导致挤出物中淀粉的—OH吸收振动峰向高波数方向移动。挤压脱胚玉米淀粉分子中的C—O键的伸缩振动峰均发生了位移[37]。
2930 c m-1为—C H2的反对称伸缩振动,1 480~1 300 cm-1为—CH2和—CH的变角伸缩振动范围,—CH2变角振动频率位于高频一侧,—CH变角振动频率位于低频一侧,挤压脱胚玉米与挤压和原脱胚玉米相比较,此范围内—CH2和—CH的振动加强。1 417 cm-1为C—C伸缩振动,1 422 cm-1为C—O不对称伸缩振动。1 155 cm-1为淀粉中C—O—C强极性特征吸收峰,1 020 cm-1淀粉中C—OH伸缩振动[37],挤压脱胚玉米与挤压和原脱胚玉米相比较,此范围内—CH2和—CH的振动减弱,表明淀粉晶体破坏。669~539 cm-1为淀粉特征吸峰,挤压脱胚玉米与挤压和原脱胚玉米相比较,振动减弱,说明挤压和加酶挤压使降解淀粉。980 cm-1处峰面积变化显示脱胚玉米中淀粉原有结晶结构变化,1 020 cm-1处峰面积变化显示脱胚玉米中淀粉无定形结构的变化[38]。挤压和加酶挤压脱胚玉米在此两处的峰面积均呈下降趋势,表明挤压和加酶挤压对脱胚玉米中淀粉的结晶结构有较大变化,结晶度降低。
脱胚玉米经过加酶挤压后的酶解力是原脱胚玉米的2.1 倍,比挤压脱胚玉米高23.3%;直链淀粉含量和碘蓝值下降,糊化度升高。
脱胚玉米经挤压和加酶挤压处理后,大量淀粉颗粒的偏光十字消失,即使存在偏光十字,也较为模糊。脱胚玉米的淀粉结晶结构破裂,原脱胚玉米表面光滑完整的颗粒消失。在加酶挤压作用下,团聚而成的颗粒较少,颗粒成多角的片状,这种结构利于酶的水解。
热台显微镜观察发现,加酶挤压脱胚玉米在升温糊化过程中,淀粉吸水膨胀速率比挤压和原脱胚玉米快,糊化裂解后的粒度小于原脱胚玉米,利于淀粉酶的水解。
在水和热共同作用下,淀粉-水混合体系糊化过程中发生相变,淀粉颗粒经历不可逆的无序相变过程。破碎的脱胚玉米颗粒(挤压和加酶挤压脱胚玉米)在DSC测试中吸热量小。
脱胚玉米挤压和加酶挤压后的傅里叶变换红外光图谱相似,基团位置发生位移,挤压和加酶挤压使脱胚玉米中的淀粉晶体结构发生改变。
参考文献:
[1] CHUANG G C C, YEH A I. Effect of screw profile on residence time distribution and starch gelatinization of rice flour during single screw extrusion cooking[J]. Journal of Food Engineering, 2004, 63(1): 21-31. DOI:10.1016/S0260-8774(03)00278-4.
[2] MOSCICKI L. Extrusion cooking: principles and practice[J].Encyclopedia of Food and Health, 2016: 576-580. DOI:10.1016/B978-0-12-384947-2.00265-8.
[3] LI M, HASJIM J, XIE F W, et al. Shear degradation of molecular,crystalline, and granular structures of starch during extrusion[J].Starch-Stärke, 2014, 66(7/8): 595-605. DOI:10.1002/star.201300201.
[4] BAKS T, KAPPEN F H J, JANSSEN A E M, et al. Towards an optimal process for gelatinisation and hydrolysis of highly concentrated starch-water mixtures with alpha-amylase from B. licheniformis[J]. Journal of Cereal Science, 2008, 47(2): 214-225.DOI:10.1016/j.jcs.2007.03.011.
[5] RAPHAELIDES S N, DIMITRELI G, EXARHOPOULOS S,et al. Effect of processing history on the physicochemical and structural characteristics of starch-fatty acid extrudates plasticized with glycerol[J]. Carbohydrate Polymers, 2011, 83(2): 727-736.DOI:10.1016/j.carbpol.2010.08.041.
[6] O’BRIEN S, WANG Y J. Effects of shear and pH on starch phosphates prepared by reactive extrusion as a sustained release agent[J]. Carbohydrate Polymers, 2009, 76(4): 557-566. DOI:10.1016/j.carbpol.2008.11.024.
[7] 马成业, 申德超. 脱胚玉米添加中温酶挤出物制取葡萄糖浆试验研究[J]. 农业机械学报, 2010, 41(5): 126-130. DOI:10.3969/j.issn.1000-1298.2010.05.026.
[8] 申德超, 奚可畏, 马成业. 低温挤压加酶脱胚玉米粉生产糖浆糖化试验[J]. 农业机械学报, 2010, 41(8): 140-145. DOI:10.3969/j.issn.1000-1298.2010.08.029.
[9] 田翠华, 严守雷, 李洁, 等. 莲藕淀粉的糊化特性研究[J]. 食品科学,2009, 30(11): 29-32. DOI:10.3321/j.issn:1002-6630.2009.11.005.
[10] 陈颖, 陈勉, 王瓛, 等. 几种淀粉的相对分子质量分布、微晶结构及形貌的研究[J]. 中国粮油学报, 2014, 29(3): 19-23.DOI:1003-0174(2014)03-0019-05.
[11] 廖娜, 谭鹤群. 不同微细化程度玉米粉的淀粉糊化度研究[J].饲料工业, 2007, 28(21): 27-30. DOI:10.3969/j.issn.1001-991X.2007.21.012.
[12] 李素玲, 邓晓聪, 高群玉. 颗粒型抗性淀粉的制备及性质[J].农业工程学报, 2011, 27(5): 385-391. DOI:10.3969/j.issn.1002-6819.2011.05.067.
[13] SUKHIJA S, SINGH S, RIAR C S. Physicochemical, crystalline,morphological, pasting and thermal properties of modified lotus rhizome (Nelumbo nucifera) starch[J]. Food Hydrocolloids, 2016, 60:50-58. DOI:10.1016/j.foodhyd.2016.03.013.
[14] 李坚斌, 温雪馨, 李琳, 等. 超声场对马铃薯淀粉颗粒形貌与结晶结构的影响[J]. 农业工程学报, 2008, 24(4): 284-286. DOI:10.3321/j.issn:1002-6819.2008.04.056.
[15] 陈翠兰,张本山, 陈福泉. 淀粉结晶度计算的新方法[J]. 食品科学,2011, 32(9): 68-71. DOI:1002-6630(2011)09-0068-04.
[16] 张本山, 刘培玲. 几种淀粉颗粒的结构与形貌特征[J]. 华南理工大学学报(自然科学版), 2005, 33(6): 68-73. DOI:10.3321/j.issn:1000-565X.2005.06.016.
[17] 张献梅, 程力, 洪雁, 等. 马铃薯渣中淀粉组分抵抗α-淀粉酶降解的机制[J]. 食品科学, 2015, 36(11): 54-59. DOI:10.7506/spkx1002-6630-201511011.
[18] LIAN X J, WANG C J, ZHANG K S, et al. The retrogradation properties of glutinous rice and buckwheat starches as observed with FT-IR,13C NMR and DSC[J]. International Journal of Biological Macromolecules, 2014, 64: 288-293. DOI:10.1016/j.ijbiomac.2013.12.014.
[19] 马成业, 李宏军, 陈善峰, 等. 脱胚玉米和淀粉挤出物中淀粉-脂热特性分析[J]. 中国粮油学报, 2013, 28(7): 23-28. DOI:10.3969/j.issn.1003-0174.2013.07.005.
[20] 杜双奎, 魏益民, 张波. 挤压膨化过程中物料组分的变化分析[J].中国粮油学报, 2005, 20(3): 39-43; 47. DOI:10.3321/j.issn:1003-0174.2005.03.010.
[21] 李彬, 王金鹏, 谢正军, 等. 挤压法制备交联辛烯基琥珀酸木薯淀粉酯工艺与结构表征[J]. 食品与生物技术学报, 2012, 31(8): 802-809.DOI:10.3969/j.issn.1673-1689.2012.08.003.
[22] 杨庆余, 罗志刚, 肖志刚, 等. 低温挤压法制备玉米淀粉-GMS复合物及其回生性质研究[J]. 现代食品科技, 2017, 33(1): 132-138; 158.DOI:10.13982/j.mfst.1673-9078.2017.1.021.
[23] 涂宗财, 朱秀梅, 陈钢, 等. 动态超高压微射流对糯米淀粉结构的影响[J]. 光谱学与光谱分析, 2010, 30(3): 834-837. DOI:10.3964/j.issn.1000-0593(2010)03-0834-04.
[24] 陈芸, 李江涛, 赵思明, 等. 籼米凝胶的应力松弛特性研究[J]. 中国粮油学报, 2014, 29(12): 1-4; 11. DOI:1003-0174(2014)12-0001-05.
[25] 何小维, 黄强, 罗发兴, 等. 超声处理后的玉米淀粉与环氧丙烷的反应机理[J]. 华南理工大学学报(自然科学版), 2005, 33(8): 91-94.DOI:10.3321/j.issn:1000-565X.2005.08.022.
[26] 徐立宏, 张本山, 杨连生, 等. 醇碱法制备非晶颗粒态淀粉[J]. 华南理工大学学报(自然科学版), 2007, 35(4): 39-41; 57. DOI:10.3321/j.issn:1000-565X.2007.04.009.
[27] 孙健, 冯美琴, 王鹏, 等. 亚麻籽胶对玉米淀粉糊化特性的影响[J].食品科学, 2012, 33(23): 8-12. DOI:1002-6630(2012)23-0008-05.
[28] 李贵萧, 牛凯, 侯汉学, 等. 均质压力对玉米淀粉机械力化学效应的影响[J]. 农业工程学报, 2017, 33(1): 271-277. DOI:10.11975/j.issn.1002-6819.2017.01.037.
[29] CONTRERAS-GALLEGOS E, DOMÍNGUEZ-PACHECO F A,HERNÁNDEZ-AGUILAR C, et al. Study of thermal and structural properties of starch granules from different maize genotypes[J]. Food Biophysics, 2015, 10(1): 1-6. DOI:10.1007/s11483-014-9344-5.
[30] FROST K, KAMINSKI D, KIRWAN G, et al. Crystallinity and structure of starch using wide angle X-ray scattering[J]. Carbohydrate Polymers, 2009, 78(3): 543-548. DOI:10.1016/j.carbpol.2009.05.018.
[31] XIE X J, LIU Q, CUI S W. Studies on the granular structure of resistant starches (type 4) from normal, high amylose and waxy corn starch citrates[J]. Food Research International, 2006, 39(3): 332-341.DOI:10.1016/j.foodres.2005.08.004.
[32] SHOGREN R L, FANTA G F, FELKER F C. X-ray diffraction study of crystal transformations in spherulitic amylose/lipid complexes from jet-cooked starch[J]. Carbohydrate Polymers, 2006, 64(3): 444-451.DOI:10.1016/j.carbpol.2005.12.018.
[33] WANG S J, YU J L, YU J G, et al. The partial characterization of C-type rhizoma Dioscorea starch granule during acid hydrolysis[J].Food Hydrocolloids, 2008, 22(4): 531-537. DOI:10.1016/j.foodhyd.2007.02.004.
[34] 洪雁, 顾正彪. 淀粉及变性淀粉颗粒形貌结构的研究[J]. 食品与发酵工业, 2006, 32(7): 19-23. DOI:10.3321/j.issn:0253-990X.2006.07.006.
[35] LI Q, XIE Q, YU S J, et al. New approach to study starch gelatinization applying a combination of hot-stage light microscopy and differential scanning calorimetry[J]. Journal of Agricultural & Food Chemistry,2013, 61(6): 1212-1218. DOI:10.1021/jf304201r.
[36] 冷雪, 曹龙奎. 利用差示扫描量热仪研究小米淀粉及小米粉的糊化特性[J]. 食品科学, 2015, 36(19): 60-66. DOI:10.7506/spkx1002-6630-201519011.
[37] FLORES-MORALES A, JIMÉNEZ-ESTRADA M, MORAESCOBEDO R. Determination of the structural changes by FT-IR,Raman, and CP/MAS13C NMR spectroscopy on retrograded starch of maize tortillas[J]. Carbohydrate Polymers, 2012, 87(1): 61-68.DOI:10.1016/j.carbpol.2011.07.011.
[38] 陈玲, 黄嫣然, 李晓玺, 等. 红外光谱在研究改性淀粉结晶结构中的应用[J]. 中国农业科学, 2007, 40(12): 2821-2826. DOI:10.3321/j.issn:0578-1752.2007.12.022.
Physicochemical and Structural Properties of Native, Extruded and Enzymatic Extruded Degerminated Corn Starch
MA Chengye1,2, FAN Yuyan1,2, YU Shuangshuang1,2, ZHANG Dongliang1,2
(1. School of Agricultural Engineering and Food Science, Shandong University of Technology, Zibo 255091, China;2. Key Laboratory of Shandong Provincial Universities for Technologies in Functional Agricultural Products, Zibo 255091, China)
Abstract:In this study, the structural properties of degerminated corn starch modified by enzymatic extrusion, such as crystallinity and morphological structure, were analyzed by X-ray diffraction, polarizing microscope, scanning electron microscope,hot-stage microscope, differential scanning calorimetry and Fourier transform infrared spectroscopy. The physicochemical properties of native, extruded and enzymatic extruded degerminated corn starch, including enzymatic hydrolysis, iodine blue value,gelatinization degree and amylose content, were studied by using various techniques such as differential scanning calorimetry and Fourier transform infrared spectroscopy. Extrusion and enzymatic extrusion had great influence on starch structure and properties.Enzymatic extrusion could increase the efficiency of enzymatic hydrolysis and the degree of gelatinization degerminated corn,and decrease iodine blue value and amylase content. The morphology and birefringence of enzymatic extruded degeminated corn starch granules was partially destroyed and aggregation of starch granules was observed. The enthalpy change of gelatinization was reduced. The crystal structure of starch granules was destroyed, along with a significant decrease in the degree of crystallinity. The broken starch granules were susceptible to gelatinization and decomposition.
Keywords:starch; extrusion; degerminated corn; structure; physicochemical properties
DOI:10.7506/spkx1002-6630-201815005
收稿日期:2017-04-03
基金项目:国家自然科学基金面上项目(31471676);“十三五”国家重点研发计划重点专项(2016YFD040130301)
第一作者简介:马成业(1978—),男,副教授,博士,研究方向为农产品贮藏与加工。E-mail:mcycn2002@163.com
中图分类号:TS231
文献标志码:A
文章编号:1002-6630(2018)15-0031-07
引文格式:
马成业, 范玉艳, 于双双, 等. 挤压剪切活化对添加耐高温α-淀粉酶脱胚玉米淀粉结构和理化特性的影响[J]. 食品科学,2018, 39(15): 31-37. DOI:10.7506/spkx1002-6630-201815005. http://www.spkx.net.cn
MA Chengye, FAN Yuyan, YU Shuangshuang, et al. Physicochemical and structural properties of native, extruded and enzymatic extruded degerminated corn starch[J]. Food Science, 2018, 39(15): 31-37. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201815005. http://www.spkx.net.cn