高 芳1,2,3,李兴民2,马鹏飞4,曾 心4,徐宝才3,5,*
(1.中国食品药品检定研究院,北京 102629;2.中国农业大学食品科学与营养工程学院,北京 100083;3.南京农业大学食品科技学院,江苏 南京 210095;4.江南大学食品学院,江苏 无锡 214122;5.江苏雨润肉食品有限责任公司,肉品加工与质量控制国家重点实验室,江苏 南京 210041)
摘 要:为了建立超高压协同温度处理对绿色魏斯氏菌在低温烟熏火腿中的失活模型,采用40、45、50 ℃结合200~500 MPa对接种108~109CFU/mL绿色魏斯氏菌的烟熏火腿进行5、10、15、20、25、30 min的超高压处理,同时做相同条件的离体实验进行对比。采用薄层平板计数,以时间为横坐标,亡菌数量级为纵坐标作失活曲线,选择一级线性模型和非线性模型(Weibull和Logistic)进行模型的拟合,用模型的评价因子相关系数R2、准确因子Af和均方差验证方程的拟合度。结果表明:经热压结合处理后,接种于烟熏火腿中的绿色魏斯氏菌比相同条件下离体状态的绿色魏斯氏菌的失活更缓慢,可能因为火腿基质中存在一些大分子物质(如蛋白质、脂肪等)对菌体的保护作用。Logistic方程最适合描述绿色魏斯氏菌在两种状态下的失活情况,为预测绿色魏斯氏菌在烟熏火腿中的失活提供了理论依据。
关键词:超高压;绿色魏斯氏菌;烟熏火腿;离体;Logistic模型
超高压技术是将食品包装后,放入超高压容器中,以液体作为传压介质,施以100~1 000 MPa的压力处理的一种新兴的非热加工技术,具有良好的杀菌作用[1]。超高压的一个主要特性是作用于非共价键,保证共价键的完整性,从而最大程度地保持食品的营养价值和风味物质[2]。此外,超高压杀菌的原理主要是破坏细胞形态和使细胞内大分子物质变性并流出,从而达到杀菌保鲜、延长产品货架期的目的,目前多用于果蔬汁的保鲜[3-5]。低温肉制品是采用较低温度(68~85 ℃)进行热加工,将肉制品中心温度加热至68~72 ℃保持30 min,在严格的低温车间(0~4 ℃)条件下生产,在低温冷链条件下运输、销售的一类熟肉制品[6]。对于低温肉制品而言,热杀菌由于温度的限制往往难以达到彻底杀菌的目的,对其贮藏存在一定的隐患。超高压结合适度的热处理,会达到更好的杀菌效果,不仅能够改善产品的感官品质,还能减少热杀菌带来的营养损失,很大程度上保持了产品原有的商业价值[7]。低温肉制品由于加工温度低,存在杀菌不彻底和货架期短等问题,因此研究以热压结合的方式能否更大程度地减少微生物的数量级,这种处理方式称为热压结合灭菌(high pressure thermal sterilization,HPTS)。
耐压腐败菌是超高压处理低温肉制品后的优势腐败菌,主要是乳酸菌[8-9]。有研究表明,绿色魏斯氏菌(Weissella viridescens)和肠膜明串珠菌(Leuconostoc mesenterorides)是超高压处理低温肉制品中的两株典型腐败乳酸菌,也是目前低温肉制品加工中常见的优势污染微生物[10-12]。Diez等[12]应用变性梯度凝胶电泳技术分析了超高压处理后血肠的微生物多样性的变化,确定绿色魏斯氏菌和肠膜明串珠菌是优势耐压腐败菌。Patterson等[11]从超高压处理后的鸡肉制品中分离到的优势腐败菌主要为绿色魏斯氏菌。早在1988年Borch等[9]的研究中也发现,引起该产品腐败的优势腐败菌为绿色魏斯氏菌。研究认为,绿色魏斯氏菌具备抵抗外界很多不利条件的能力,除能够耐受超高压处理外,其他不利条件如有机酸处理也无法彻底将其杀灭[9,11-13]。以上研究主要采用单一的超高压手段进行处理,杀菌不彻底,且对耐压乳酸菌的研究主要集中在分离鉴定方面。
失活动力学模型的意义是可以预测微生物在特定杀菌条件下的死亡趋势,使微生物的失活具有一定的规律可循,因此可为特定微生物在特定条件下的杀菌工艺参数提供理论依据。目前,国外有关超高压失活动力学模型的研究较多,但大多集中在产芽孢杆菌类、大肠杆菌和单增李斯特菌等致病菌生长模型上,研究基质也多为牛乳和肉类。而对腐败乳酸菌的失活动力学研究很少。王卫力等[14]构建了冷冻鱼糜制品中的大肠杆菌的生长模型,选择了Gompertz模型对生长曲线拟合并获得了较好的拟合优度。冯晓慧等[15]研究了单增李斯特菌在牛肉中的失活模型,选择了修正后的Gompertz模型拟合了55~70 ℃条件下的热失活模型。董庆利等[16]研究了猪肉解冻过程中损伤型气单胞菌的失活模型,最终选择了Polynomial模型拟合损伤型气单胞菌的失活过程,达到了良好的效果。
本实验主要研究不同的温度和压力水平的热压结合处理对耐压腐败菌绿色魏斯氏菌在离体和接种烟熏火腿条件下的失活动力学模型,为低温烟熏火腿中的耐压腐败菌的控制提供一定的理论支撑。
耐压性较强的绿色魏斯氏菌CGMCC1.2494购自中国微生物菌种保藏中心;平板计数琼脂、MRS琼脂、MRS肉汤 北京陆桥生物技术有限责任公司;磷酸氢二钠、磷酸二氢钠、1,2-丙二醇(分析纯) 国药集团化学制剂有限公司;烟熏火腿切片(180 g)取自江苏雨润肉食品有限责任公司第一生产车间。
SPF-S-1L-100-850-9-W型超高压处理装置 英国Stansted Fluid Power公司;FR-400A型手压式塑料薄膜封口机 上海森和包装器材有限公司;XFP-DZ600真空包装机 北京鑫飞鹏业机械设备有限公司;HM140234型均质机 日本Toyozumi Dengenkiki公司。
1.3.1 样品前处理
活化冻干菌粉,与MRS肉汤混合,调整菌液浓度为108~109CFU/mL,用磷酸盐缓冲液(phosphate buffered saline,PBS)离心洗涤混合液两次,最后加入一定量的PBS得到乳白色菌悬液,取4 mL分装于无菌采样袋中,热封口,不留顶隙,此即为离体条件样品。在超净工作台中,将紫外杀菌15 min后的烟熏火腿切片正反面各接种100 µL的菌悬液,并用无菌玻璃涂布棒涂抹均匀,置于无菌真空包装袋中抽真空包装,室温下放置40 min左右,让细菌充分黏附于火腿样品表面,此即为接种火腿样品。两种样品均放于4 ℃冰箱中冷藏备用。
1.3.2 超高压处理
压力的选择是根据耐压实验的结果,耐压实验选择压力250、350、450 MPa对绿色魏斯氏菌进行处理,在200~500 MPa压力范围内菌有很大的死亡空间,再结合一定的温度处理以探究杀菌效果的优劣。而温度的选择是根据本研究所选用的介质为低温肉制品,其杀菌温度在68~72 ℃之间,因此热杀菌的温度范围应低于此温度区间,经过前期的实验探索,选择40~50 ℃的热处理温度。经过不同条件的探索,最终选定两种样品分别在40 ℃(300~400 MPa)、45 ℃(400~500 MPa)和50 ℃(400~500 MPa)下处理5~30 min,处理时间不包括升压和卸压时间,体积分数30%的1,2-丙二醇溶液作为传压介质。处理结束后,置于4 ℃中待计数处理。每个处理做3 个平行。
1.3.3 绿色魏斯氏菌计数
微生物经受不利条件(超高静压、冻融、热处理、超声波、辐照、微波等)后存在损伤修复现象[17-18],这种受伤状态的微生物以传统培养方法无法检测,针对这种情况,有学者研究了培养受伤微生物的薄层平板培养方法[18]。本研究采用此方法对受伤的绿色魏斯氏菌进行培养计数。
在培养皿中无菌倒入20~25 mL的MRS琼脂,待其凝固后倒入约10~14 mL的平板计数琼脂,制成薄层平板培养基,紫外灯下凝固备用。超高压处理后,将烟熏火腿击碎、混匀,取10 g,稀释于90 mL无菌生理盐水中,拍打60 s,充分混匀,取1 mL,一系列梯度稀释后,选择3 个合适的稀释度,参考GB 4789.2—2003《食品卫生微生物学检验 菌落总数测定》进行薄层平板涂布计数操作,每个稀释度做两个重复,30 ℃培养48 h后计数。
1.3.4 失活曲线的建立以及模型的选择和拟合
1.3.4.1 建立失活曲线
记录热压处理后耐受菌的数量Nt(CFU/mL)和对照样即未经热压处理的耐受菌的数量No(CFU/mL),将计数结果以绿色魏斯氏菌的亡菌数量级lg(Nt/No)表示,以保压时间t为横坐标,亡菌数量级为纵坐标,绘制出不同温度和压力结合条件下的失活曲线。用Curve Expert 1.3软件进行数据的线性和非线性方程的拟合,并计算相应的参数。
1.3.4.2 模型的选择
一级动力学模型(Linear)是一种线性模型,假定了热压结合下耐受菌的存活与保压时间之间的线性关系[19]。方程如式(1)所示。
式中:Nt和No同1.3.4.1节;t表示热压结合处理时间/min;D表示使90%的耐受菌死亡所需的时间/min。
Weibull模型,假定了失活曲线是各种致死因素累积的效应,描述了营养体和细胞具有不同的耐受性[20]。方程如式(2)所示。
式中:Nt和No同1.3.4.1节;n和b是与数据范围和曲线形状有关的因子。
log-Logistic模型,此模型最初是由Cole等[21]提出,用来拟合微生物热失活的非线性模型,后来Chen等[22]对此模型进行改进,将方程中的参数减少为4 个,方程如式(3)所示。
式中:Nt和No同1.3.4.1节;A表示高低渐近线之差(lg(CFU/mL));σ表示最大失活速率(lg(CFU/mL)/lg min);τ表示最大失活速率的对数时间(lg min)。
1.3.4.3 模型拟合参数(评价因子)
均方差(mean square error,MSE):MSE值越小,表明模型拟合实验数据越好。其计算公式如式(4)所示。
式中:n是预测值的数量;p是待评估的参数。
回归系数(R2):R2值越接近于1,表明模型拟合实验数据越好。
准确因子(Af):Af值用来评估模型的准确性,值越接近于1,表明模型的拟合度越好。值越大,表明模型的拟合度越差[23]。其计算公式如式(5)所示。
式中:n是预测值的数量。
数据以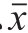 ±s表示,采用SPSS 16.0软件进行数据统计,并用单因素方差分析及Duncan’s多重检验进行显著性分析,P<0.05表示差异显著。
±s表示,采用SPSS 16.0软件进行数据统计,并用单因素方差分析及Duncan’s多重检验进行显著性分析,P<0.05表示差异显著。
前言中提到绿色魏斯氏菌是耐压菌,为了验证本实验拟采用的绿色魏斯氏菌CGMCC1.2494具有超高压耐受性,特进行了耐压实验,将制备好的待测菌菌悬液在常温下分别使用250、350、450 MPa压力保压处理10 min,结果如表1所示。
有研究发现,绿色魏斯氏菌能够耐受超高压[11]和有机酸[12]处理,同时也能够耐受一定浓度的乳酸链球菌素处理。由表1可以看出,绿色魏斯氏菌具有很高的耐压性,在250~450 MPa处理后的菌落数均在一个数量级(8~9之间),验证了绿色魏斯氏菌具有耐压性,可以进行热压结合杀菌实验。对于微生物抵抗外界不良条件的原因目前研究较少,但从微生物自身角度考虑,不同种属微生物之间和同种微生物不同菌株之间对压力的耐受性均不同,对压力敏感程度也不同[24]。不考虑外界因素,单纯从微生物自身角度出发,绿色魏斯氏菌对压力的耐受性可能源于细胞膜结构上的脂肪酸种类及其组成,其也决定了细胞膜自身的回复性[25];另一方面,压力的耐受性可能与组成菌体细胞蛋白质的功能活性对压力的耐受强度有关[26]。
表 1 绿色魏斯氏菌的耐压实验结果
Table 1 Pressure resistance of Weissella viridescens

注:同列肩标小写字母不同表示差异显著(P<0.05)。表2同。
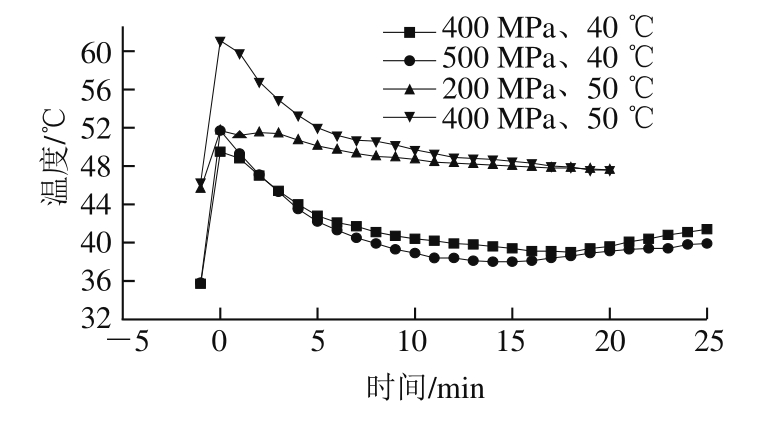
图 1 热压结合处理时高压腔内温度波动
Fig. 1 Temperature fluctuation in high pressure chamber during HPTS treatment
在升压过程中,由于绝热压缩加热导致的温度波动如图1所示,在忽略温度选择的情况下,压力越高,由于压缩加热升高的温度也越高,加压200 MPa升温6~8 ℃,加压400 MPa升温12~14 ℃,加压500 MPa升温16~18 ℃。因此,高压腔体内初始温度应该调整为低于目标温度5 ℃左右,这样通过一段时间的升压,才能使加压后的温度不至于超过目标温度,并随着保压时间的延长,温度迅速降低,慢慢趋近于目标温度附近,以此获得在保压时间内稳定的温度。
由于超高压升压期间的绝热压缩所导致的温度急剧升高,因此许多研究者在做热压结合处理对微生物的失活动力学研究实验中均考虑了绝热压缩所导致的温度变化,并采取了降低初始温度的措施。Wang等[27]将初始温度调整在60 ℃,经过400 MPa、80 ℃升压处理后,温度达到95 ℃,后逐渐稳定在80 ℃左右。Shao Yanwen等[28]分别记录了样品温度和腔体温度,腔体温度比样品温度要高10 ℃左右,热压处理条件为700 MPa、80 ℃和800 MPa、100 ℃,因此腔体初始温度分别设置为53 ℃和68 ℃,随着保压时间的延长,样品的温度逐渐达到目标温度。
表 2 两种不同状态的样品在热压结合处理时升压期间绿色魏斯氏菌亡菌数量级
Table 2 Log-reduction of the number of Weissella viridescens in two media during HPTS treatment

热压结合处理时在升压期间会产生压缩加热,因此造成温度急剧升高,导致菌的数量在升压期间急剧减少一定的数量级,从表3可以明显地看出,两种条件下菌的亡菌数量级都有一定程度的升高。绿色魏斯氏菌的菌落的数量级下降1左右,总体上在离体菌液中上升的亡菌数量级比接种于烟熏火腿的多。升压期间接种于肉类基质中由于大分子物质的保护作用,即使500 MPa压力更高,也没有得到比400 MPa产生更好的灭菌效果,这是由于升压期间的压力不稳定、作用力的不均匀导致数据出现误差,超高压的作用力不稳定也是一个有待改正的缺点。在升压期间导致的菌的失活是不容小觑的,热压结合灭菌的相关文献中也有研究:Wang等[27]研究了热压结合处理对芽孢杆菌在离体和接种芦苇牛肉两种条件下的灭活效果,阐述了升压期间的对数减少量,得出离体条件下的升压期间菌株的失活量要大于接种于食品基质,升压期间的压缩加热对暴露在离体条件下的菌是致命的;Ahn等[29]在热处理和与超高压结合的热处理对不需氧型菌的失活动力学研究中发现,升温和升压期间菌的失活量均在失活曲线图中得到了表述,且此期间的失活效果在整个处理时间段内占据了主要的作用。
2.4.1 绿色魏斯氏菌在不同热压结合处理条件下的失活曲线
由图2可以看出,绿色魏斯氏菌在400~500 MPa结合40 ℃的温度处理,其亡菌数量级明显上升,纵坐标是负值,且负值越小,表明微生物亡菌数量级越高。图2中0 min以后是保压时间,0 min以前是升压阶段,图2也描述了升压阶段两种介质培养菌的亡菌数量级,可见菌在升压阶段的死亡也是不容忽视的。两种介质培养的菌随时间延长数量级下降,在离体条件下菌的数量级下降更剧烈,该菌在500 MPa离体条件下处理25 min,能减少8.5 个数量级,而该处理水平接种条件下处理相同时间只能减少2.5 个数量级。且在40 ℃下,随着压力的升高,下降趋势更为急剧,菌的死亡数量更多,很明显500 MPa压力获得了更好的杀菌效果。40 ℃条件下,绿色魏斯氏菌接种火腿中,450 MPa与500 MPa下数量相差甚少,在保压时间15 min以前,500 MPa的灭菌效果更好,而保压时间超过15 min后,450 MPa的效果反而好。

图 2 绿色魏斯氏菌在40 ℃时的失活曲线
Fig. 2 Inactivation curves of Weissella viridescens at 40 ℃

图 3 绿色魏斯氏菌在45 ℃时的失活曲线
Fig. 3 Inactivation curves of Weissella viridescens at 45 ℃

图 4 绿色魏斯氏菌在50 ℃时的失活曲线
Fig. 4 Inactivation curves of Weissella viridescens at 50 ℃
图3为绿色魏斯氏菌在300~400 MPa压力水平结合45 ℃处理温度下的失活曲线,400 MPa条件,随着处理时间的延长,亡菌数量逐渐增加,而且很明显,离体条件两种介质培养菌的亡菌数量更多;但在45 ℃条件下,300 MPa时,离体条件菌的死亡更急剧,而接种火腿中死亡更平稳,而且最终结果相差不及1 个数量级,可能是由于大分子物质如蛋白质、脂肪和碳水化合物等能够为菌提供一种保护机制,能够延缓菌体暴露于危害因素的时间,进而减少相同时间内菌的死亡数量。在400 MPa离体条件下处理25 min后,绿色魏斯氏菌下降的数量级比相同处理下接种低温火腿中要少约6.5 个。与40 ℃不同的是,在45 ℃、接种低温火腿的条件下,对绿色魏斯氏菌而言,压力在400 MPa下的失活效果甚至不及300 MPa。因此又做了50 ℃条件下绿色魏斯氏菌的失活曲线图(图4)。从图3、4中可以明显看出,在接种烟熏火腿的条件下,400 MPa的失活效果甚至不及300 MPa的压力水平。由于高压力水平和较高的温度之间存在相互抑制的作用,因此效果反而减弱,这就需要在热压结合处理时充分考虑压力和温度水平的选择,而高压和高温拮抗反应机制尚待深入研究。
2.4.2 绿色魏斯氏菌在3 种温度下失活曲线的模型拟合

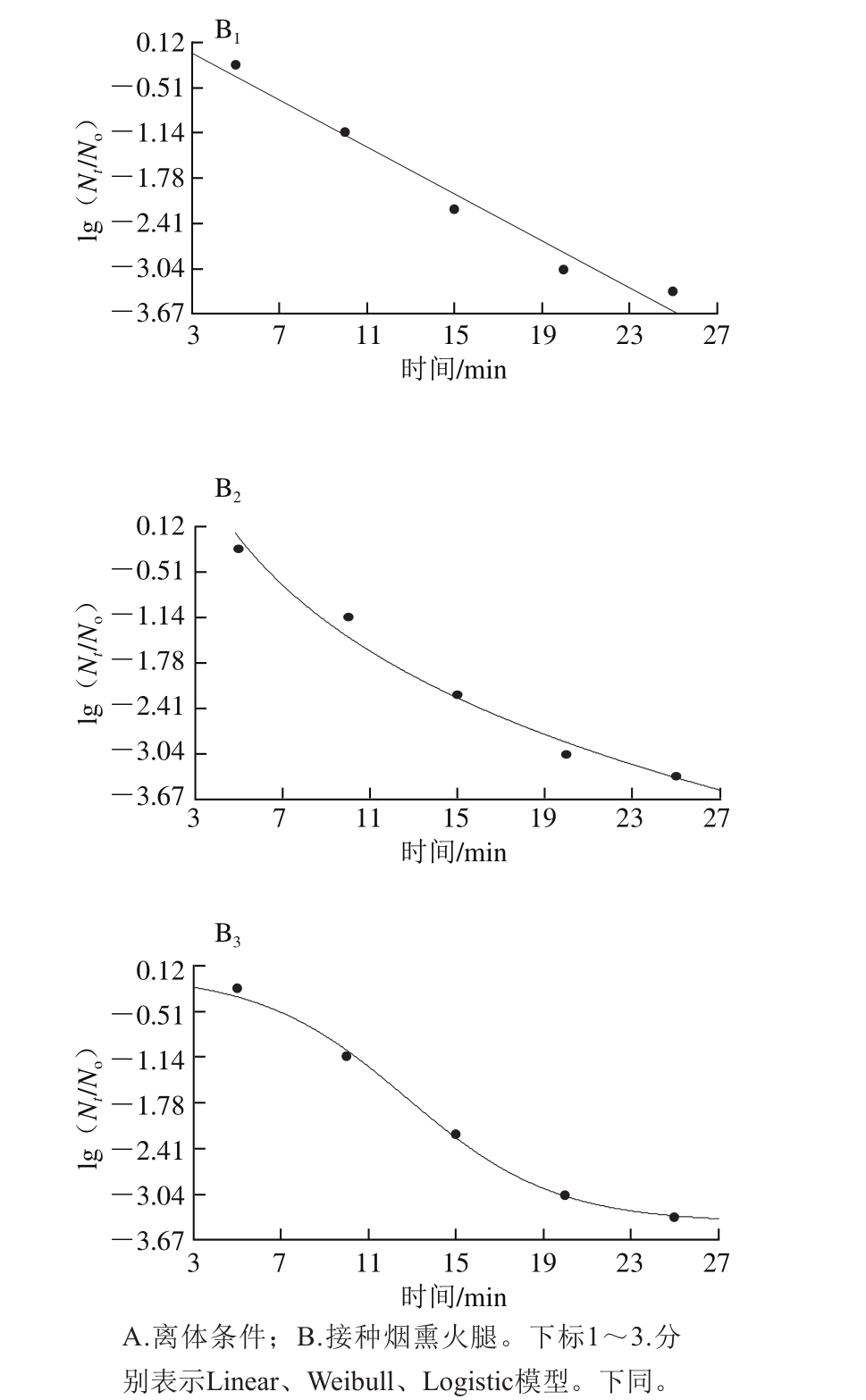
图 5 绿色魏斯氏菌在400 MPa、40 ℃离体和450 MPa、40 ℃接种烟熏火腿的失活曲线拟合模型
Fig. 5 Inactivation curves of Weissella viridescens at 400 MPa and 40 ℃ in vitro and 450 MPa and 40 ℃ in situ
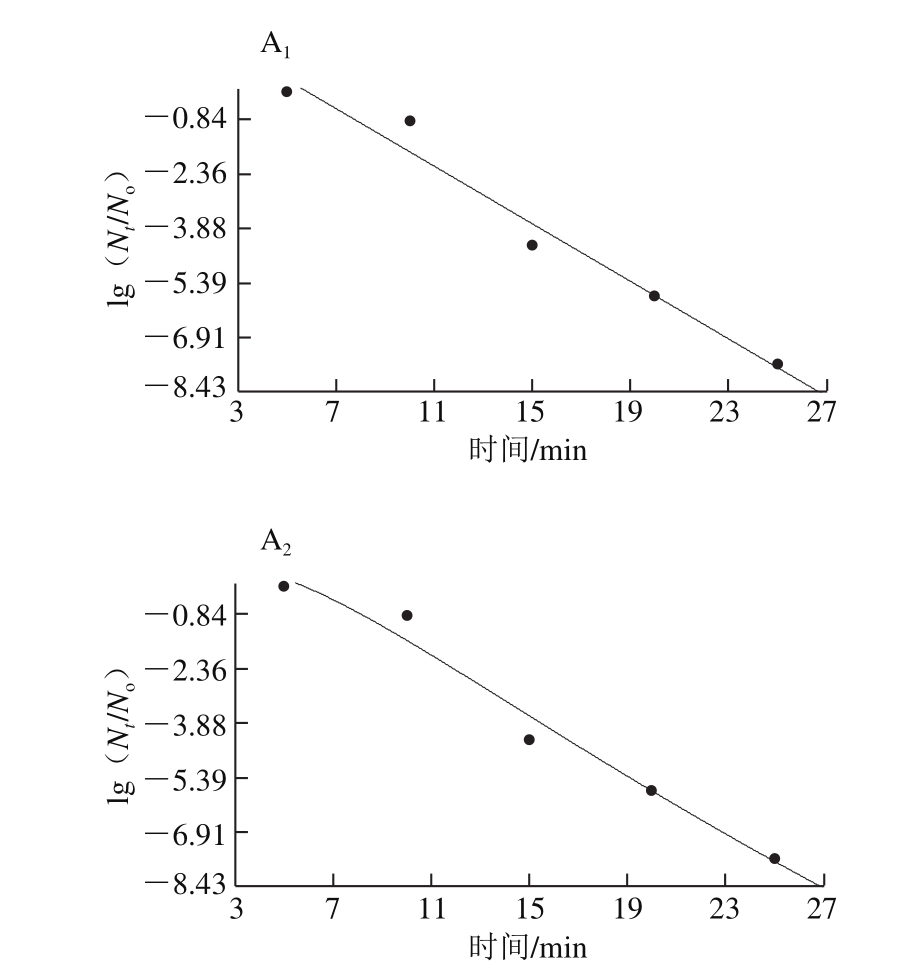

图 6 绿色魏斯氏菌在400 MPa、45 ℃离体条件下的失活曲线拟合模型
Fig. 6 Inactivation curves of Weissella viridescens at 400 MPa and 45 ℃ in vitro

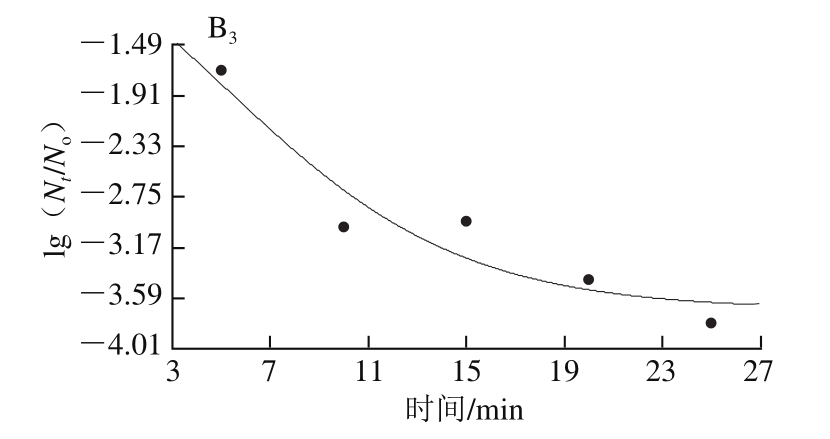
图 7 绿色魏斯氏菌在300 MPa、50 ℃ 离体和接种烟熏火腿的失活曲线拟合模型
Fig. 7 Inactivation curves of Weissella viridescens at 300 MPa and 50 ℃ in vitro and in situ
绿色魏斯氏菌在不同温度和压力接种条件下拟合3 种模型的曲线如图5~7所示,从视觉角度看,一级线性模型并不能很好拟合所有的数据点,而其余两种非线性模型的拟合效果从视觉角度看优于线性模型。Weibull模型和Logistic模型能较好地描述数据点,而且拟合度相差寥寥。因此在模型的选择过程中,排除线性模型用于拟合超高压耐受菌的失活动力学模型。模型的拟合优度最终是根据模型的拟合优度参数值来判断。拟合模型的数据没有完全呈现。
2.4.3 模型评价因子
Af值越大表示平均值准确性越低,而Af值等于1表示预测值与观测值之间完全吻合[30]。相关系数R2和均方差MSE值表示模型的准确性,R2越接近于1,MSE值越小,模型的拟合度越高[1]。结合绿色魏斯氏菌的失活曲线拟合模型以及拟合优度参数的模型评价因子(表3、4),最适拟合模型显示在表5中,除绿色魏斯氏菌在400 MPa、45 ℃和50 ℃接种火腿中无法拟合模型外,其余均能很好地拟合模型,可以看出,Logistic模型在较多的热压结合处理条件下是最适的拟合模型,其次是Weibull模型,不能用两者拟合的选择MMF模型(在拟合参数中只用“-”表示),也获得了较为理想的拟合度。而MMF模型是一种预测微生物失活模型,表明微生物的失活是一种S型曲线。
表 3 绿色魏斯氏菌在离体条件下的拟合优度参数
Table 3 Fitting parameters of Weissella viridescens in vitro

注:—.此模型不适用。表4同。
表 4 绿色魏斯氏菌在接种烟熏火腿条件下的拟合优度参数
Table 4 Fitting parameters of Weissella viridescens in situ
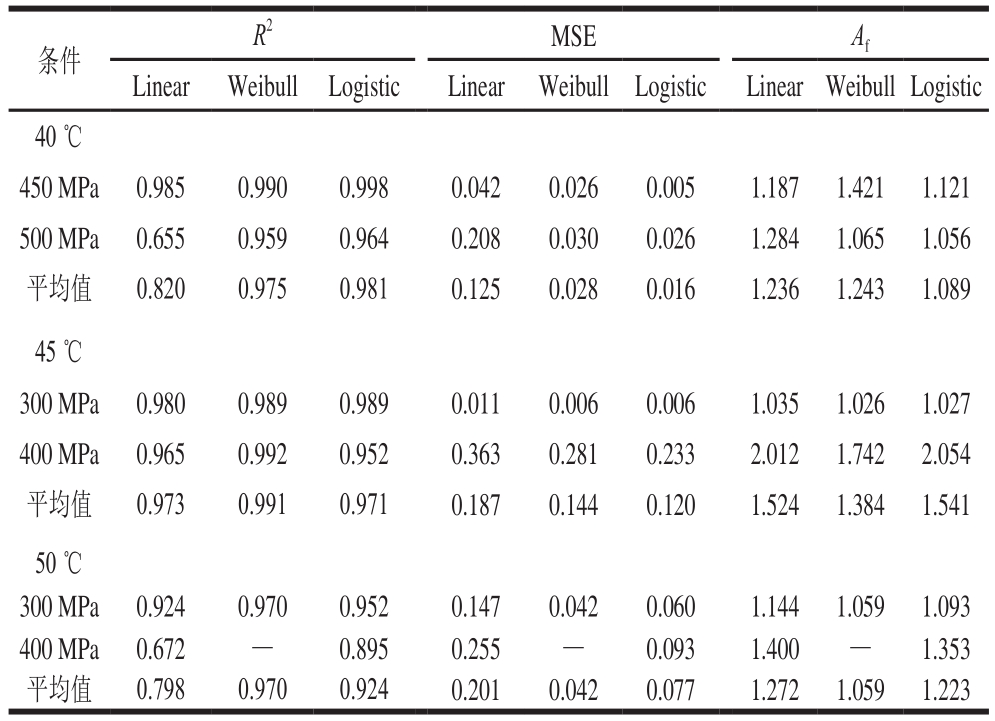
表 5 绿色魏斯氏菌在不同的压力、温度下最适的拟合模型
Table 5 Best models describing Weissella viridescens inactivation at different levels of high pressure coupled with moderate heating

注:-.MMF模型。
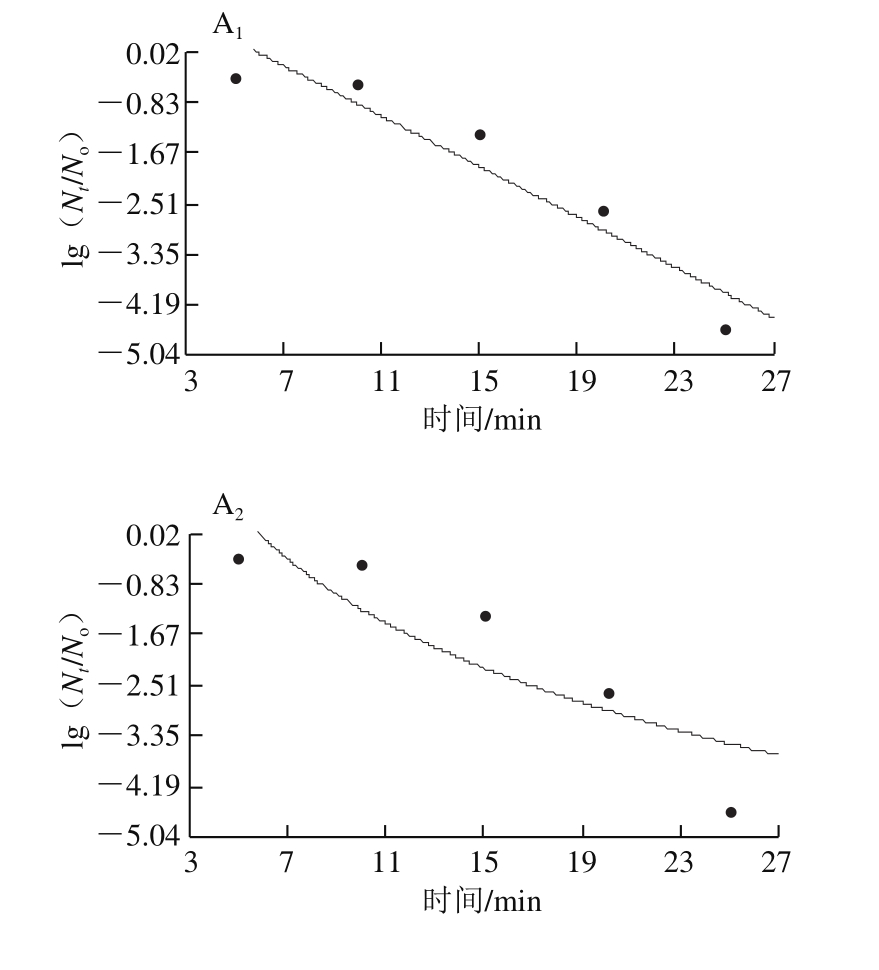
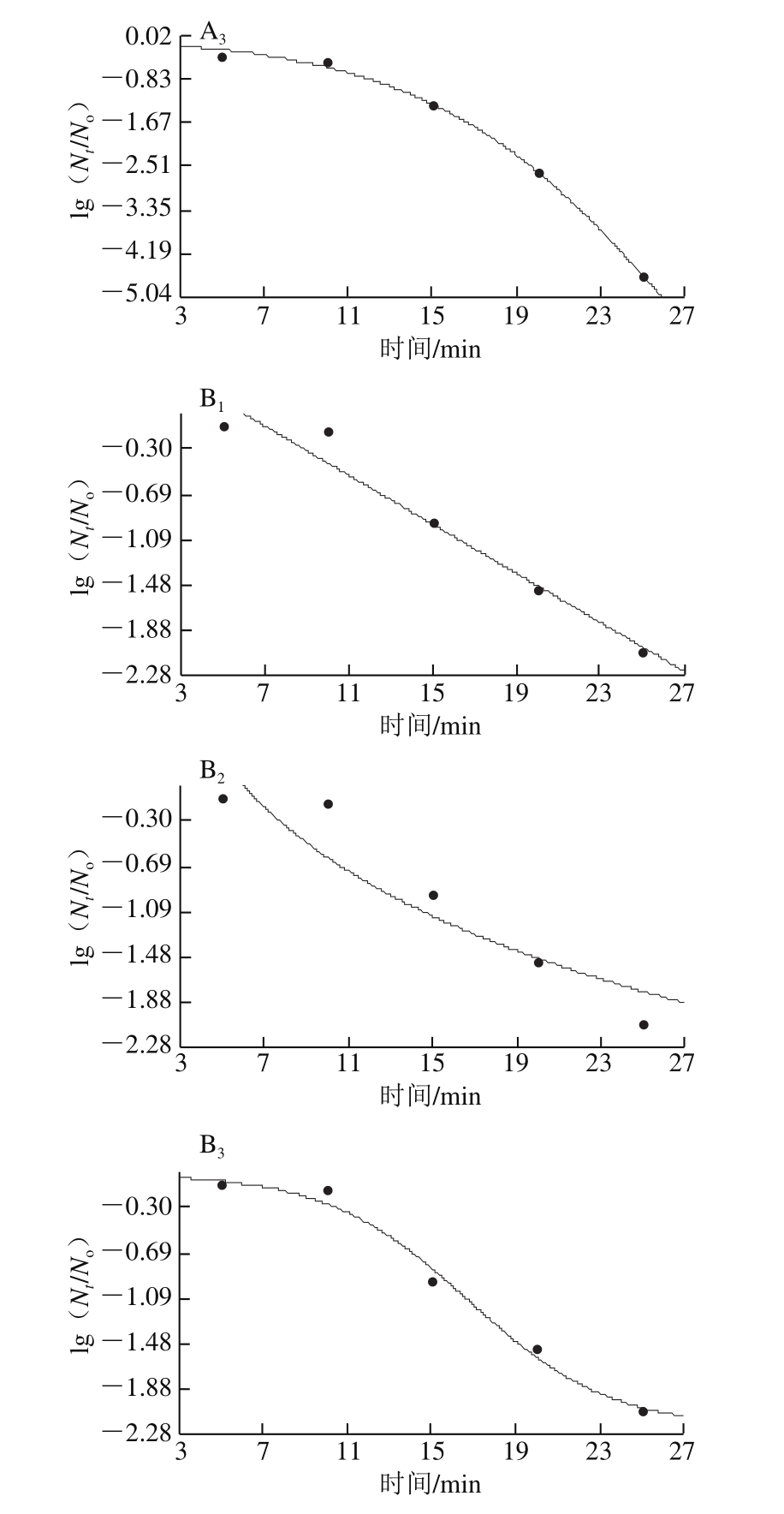
图 8 绿色魏斯氏菌在40 ℃、350 MPa离体条件和接种烟熏火腿条件下的拟合模型
Fig. 8 Comparison of three fitting models for the inactivation curves of Weissella viridescens suspended in vitro and in situ at 40 ℃ and 350 MPa

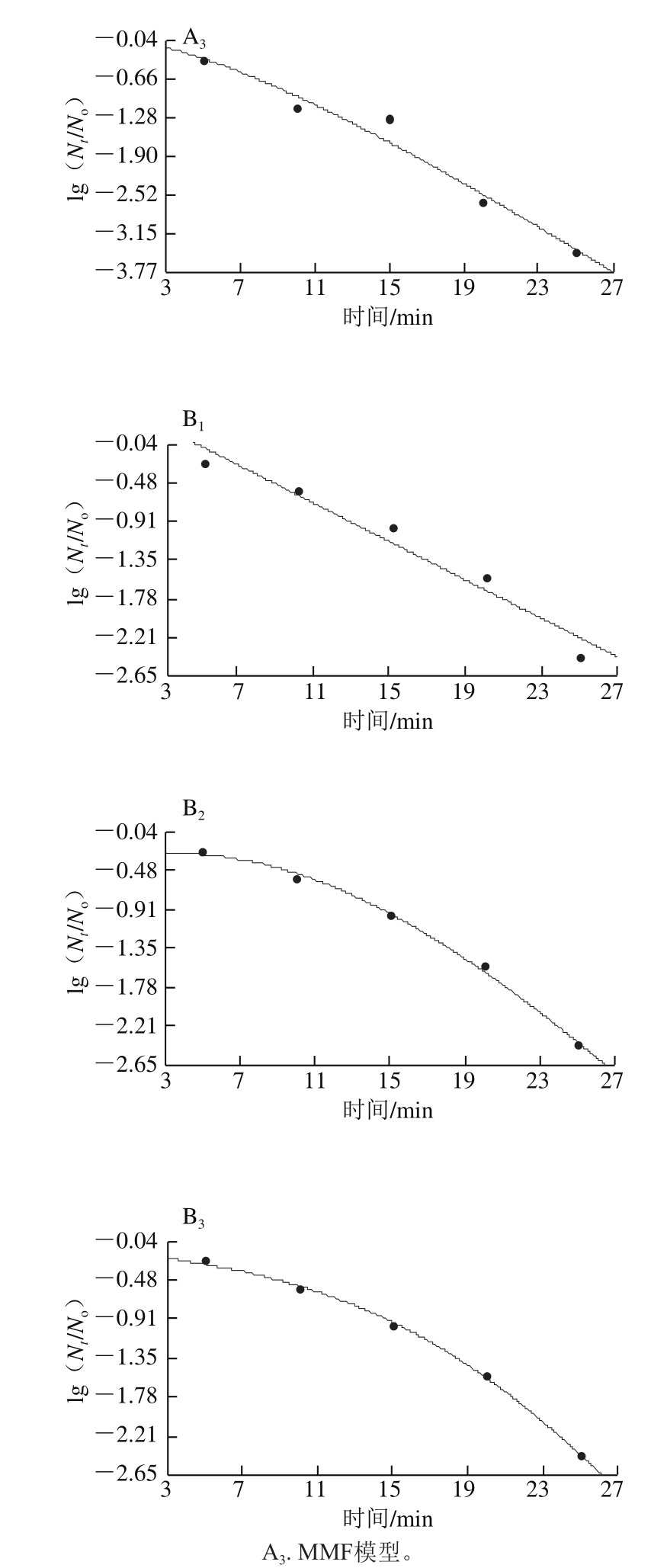
图 9 绿色魏斯氏菌在50 ℃、200 MPa离体条件和接种烟熏火腿条件下的拟合模型
Fig. 9 Comparison of three fitting models for the inactivation curves of Weissella viridescens suspended in vitro and in situ at 50 ℃ and 200 MPa
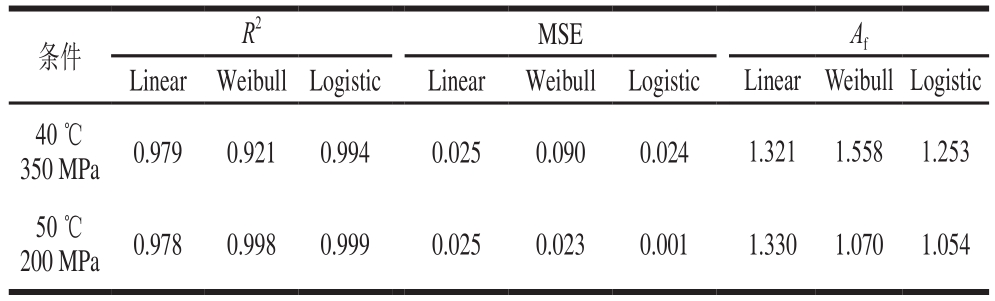
通过模型的拟合参数确定出最适的模型Logistic之后,随机挑选两组条件(40 ℃、350 MPa和50 ℃、200 MPa)对模型进行验证,如图8、9所示,通过对模型拟合参数的分析,评价拟合优度(表6、7)。通过对拟合参数的评价可以看出Logistic模型最适拟合。在温度范围40~50 ℃,压力范围200~500 MPa以及保压时间范围5~30 min的条件下,模型Logistic适合评价耐压腐败菌在低温火腿中的失活趋势。
表 6 两种验证条件下绿色魏斯氏菌在离体条件下的拟合优度参数
Table 6 Fitting parameters of Weissella viridescens inactivation in vitro under validation conditions
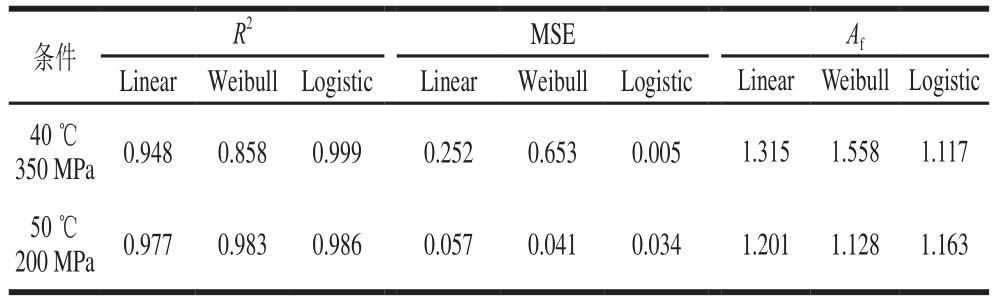
表 7 两种验证条件下绿色魏斯氏菌在接种火腿条件下的拟合优度参数
Table 7 Fitting parameters of Weissella viridescens inactivation in situ under validation conditions
超高压技术作为一项新兴的非热加工技术,应用于食品主要有两方面作用:一是用于食品杀菌以延长食品的货架期;二是生产新的组织结构的食品。超高压在肉类及其制品中的应用主要是肉类杀菌、冻结与解冻和改善肉品品质等方面。肖志华等[31]研究了荠菜制品和生鲜猪肉分别经过(200、400 MPa)10 min、600 MPa(5、10、15、20 min)处理后的灭菌情况,该系列处理对大肠杆菌、金黄色葡萄球菌的杀灭效果很好,相应存活率最大下降了8.45、5.90 个对数值;对生鲜猪肉和芥菜制品中的微生物具有较好的杀灭效果,存活率最大下降了3.45、3.75 个对数值。韩衍青等[32]选择了400 MPa和600 MPa的压力在12 ℃时对烟熏切片火腿进行10 min保压处理,发现该处理能够有效地抑制火腿中的腐败微生物,进一步延长其货架期。
本研究中参数(压力水平、温度范围以及保压时间)的选择都是在前人研究的基础之上通过进一步的摸索而决定,低温肉制品的杀菌温度不能超过加工温度(68~72 ℃),因此在前期实验结果的基础上选择温度水平40、45 ℃和50 ℃。对于绿色魏斯氏菌而言,在40、45 ℃和50℃接种烟熏火腿条件下,压力越高,反而杀菌效果越不好,这是因为较高的压力和温度的拮抗作用导致杀菌效果出现了下降的趋势;因此,在选择热压结合处理时,要充分考虑到压力和温度的协同作用,并考虑超高压处理装置的能耗和成本的节约,选择适当水平的压力。在选择温度和压力时,多进行实验验证,或选择响应曲面优化法优化出最适的热压结合杀菌条件。Carlez等[33]发现较低温度和渐升温度协同超高压处理能够对接种绞碎牛肌肉中的酸杆菌属、荧光假单胞菌和李斯特菌有较好的杀灭效果。Zhu Songming等[34]对牛肉中产梭状芽孢杆菌的孢子进行超高压协同渐升温度的处理,得到了较好的杀菌效果。离体条件下绿色魏斯氏菌暴露于缓冲液中,相比接种烟熏火腿中的菌缺少了大分子物质(脂肪、蛋白质、多糖和核酸等)的保护,经超高压处理之后的菌株数量升高得更迅速。Wang等[27]对接种芽孢杆菌的芦苇牛肉和缓冲液中该种菌株所产的孢子的热压结合处理杀菌效果进行了研究,得到了同样的结论,由于没有大分子物质的保护,缓冲液中的孢子死亡得更快。
李博等[35]提到预测微生物学是建立在计算机基础上的对食品中微生物的生长、残存和死亡进行的数量化预测关系。预测微生物模型可以为微生物在基质中的生长提供一定的参考依据,使企业可以在不进行微生物计数的前提下,快速而便捷地对微生物的生长和产品的货架期以及安全性作出预测,从而确定产品的保质期、储藏条件和杀菌方式,极大地减少了工厂产品研发所需要的测试时间。本研究选择一级线性模型和两种非线性模型(Weibull模型和Logistic模型)对两种菌的失活曲线进行拟合,通过比较各个模型的拟合参数来判断模型的拟合优度,最终建立最适的模型,为企业选择适当的杀菌条件提供更好的理论依据。Chen等[22-23]在温压结合对牛乳中单增李斯特菌的失活动力学研究时选择了Weibull模型、Logistic方程和Gompertz方程对失活曲线进行拟合,最终选择Logistic方程进行描述。Buzrul等[36]研究了离体条件下的单增李斯特菌在热压结合处理条件下的失活动力学研究,经验证和分析,最终也选择了log-Logistic模型拟合失活曲线。应用Logistic模型可以较好地体现不同热压结合处理下绿色魏斯氏菌在不同基质中的死亡情况,很好地预测超高压协同温度处理低温肉制品中绿色魏斯氏菌的死亡动态变化。
参考文献:
[1] 孙新生, 徐幸莲, 韩衍青, 等. 超高压协同温度处理对烟熏火腿中单增李斯特菌生长预测模型的建立[J]. 食品工业科技, 2012, 33(13):118-121; 126. DOI:10.13386/j.issn1002-0306.2012.13.011.
[2] 靳烨, 南庆贤. 高压技术在食品加工中应用的发展[J]. 肉类研究,1997, 11(4): 15-17.
[3] 刘丽莉, 马美湖, 杨协力. 超高压技术在肉制品加工中的应用[J]. 肉类工业, 2008, 37(4): 13-16.
[4] 励建荣, 夏道宗. 食品超高压杀菌技术[J]. 广州食品工业科技,2002(3): 45-47. DOI:10.13982/j.mfst.1673-9078.2002.03.018.
[5] 孙斌, 钱海刚. 超高压技术在食品中的应用[J]. 科技资讯, 2008(3):20-21; 23. DOI:10.16661/j.cnki.1672-3791.2008.03.013.
[6] 韩衍青. 应用超高压技术延长低温火腿的货架期[D]. 南京: 南京农业大学, 2011: 1-2.
[7] RASTOGI N K, RAGHAVARAO K S M S, BALASUBRAMANIAM V M, et al. Opportunities and challenges in high pressure processing of foods[J]. Critical Reviews in Food Science and Nutrition, 2007, 47(1):69-112. DOI:10.1080/10408398.2012.724734.
[8] 韩衍青, 徐宝才, 徐幸莲, 等. 真空包装瘦肉制品中的特定腐败微生物及其控制[J]. 中国食品学报, 2011, 11(7): 148-156.
[9] BORCH E, NERBRINK E, SVENSSON P. Identification of major contamination sources during processing of emulsion sausage[J].International Journal of Food Microbiology, 1988, 7: 317-330.DOI:10.1016/0168-1605(88)90058-X.
[10] DIEZ A M, URSO R, RANTSIOU K, et al. Spoilage of blood sausages morcilla de Burgos treated with high hydrostatic pressure[J].International Journal of Food Microbiology, 2008, 123: 246-253.DOI:10.1016/j.ijfoodmicro.2008.02.017.
[11] PATTERSON M F, MCKAY A M, CONNOLLY M, et al. Effect of high pressure on the microbiological quality of cooked chicken during storage at normal and abuse refrigeration temperatures[J]. Food Microbiology, 2010, 27: 266-273. DOI:10.1016/j.fm.2009.10.007.
[12] DIEZ A M, SANTOS E M, JAIME I. Application of organic acid salts and high-pressure treatments to improve the preservation of blood sausage[J]. Food Microbiology, 2008, 25: 154-161. DOI:10.1016/j.fm.2007.06.004.
[13] HAN Y Q, XU X L, ZHOU G H, et al. Effect of high pressure treatment on microbial population of sliced vacuum-packed cooked ham[J]. Meat Science, 2011, 88(4): 682-688. DOI:10.1016/j.meatsci.2011.02.029.
[14] 王力卫, 雷晓凌, 彭镜林, 等. 冷冻鱼糜制品中大肠杆菌生长动力学模型的构建[J]. 食品工业科技, 2012, 33(10): 113-116.
[15] 冯晓慧, 王庆国, 王仁欢, 等. 牛肉中单增李斯特菌的热失活模型[J]. 微生物学报, 2011, 51(5): 684-691. DOI:10.13343/j.cnki.wsxb.2011.05.008.
[16] 董庆利, 梁娜, 曾静, 等. 猪肉解冻过程中损伤型气单胞菌的检测及失活模型构建[J]. 食品科学, 2012, 33(7): 219-222.
[17] KANG D H, FUNG D Y. Thin agar layer method for recovery of heatinjured Listeria monocytogenes[J]. Journal of Food Protection, 1999,62(11): 1346-1349. DOI:10.4315/0362-028X.JFP-13-374.
[18] WU V C H. A review of microbial injury and recovery methods in food[J]. Food Microbiology, 2008, 25(6): 735-744. DOI:10.1016/j.fm.2008.04.016.
[19] SCHAFFNER D W, LABUZA T P. Predictive microbiology: where are we, and where are we going[J]. Food Technology, 1997, 51(4): 95-99.
[20] PELEG M, COLE M B. Reinterpretation of microbial survival curves[J]. Critical Reviews in Food Science and Nutrition, 1998, 38:353-380. DOI:10.1080/10408699891274246.
[21] COLE M B, DAVIES K W, MUNRO G, et al. A vitalistic model to describe thermal inactivation of Listeria monocytogenes[J]. Journal of Industrial Microbiology, 1993, 12: 232-237.
[22] CHEN H Q, HOOVER D G. Modeling the combined effect of high hydrostatic pressure and mild heat on the inactivation kinetics of Listeria monocytogenes Scott A in whole milk[J]. Innovative Food Science and Emerging Technologies, 2003, 4(1): 25-34. DOI:10.1016/S1466-8564(02)00083-8.
[23] CHEN H Q, HOOVER D G. Use of Weibull model to describe and predict pressure inactivation of Listeria monocytogenes Scott A in whole milk[J]. Innovative Food & Emerging Technologies, 2004, 5(3):269-276. DOI:10.1016/j.ifset.2004.03.002.
[24] YUSTE J, CAPELLAS M, PLA R, et al. High pressure processing for food safety and preservation: a review[J]. Journal of Rapid Methods and Automation in Microbiology, 2001, 9(1): 1-10.
[25] KLOTZ B, MAÑAS P, MACKEY B M. The relationship between membrane damage, release of protein and loss of viability in Escherichia coli exposed to high hydrostatic pressure[J]. International Journal of Food Microbiology, 2010, 137(2/3): 214-220. DOI:10.1016/j.ijfoodmicro.2009.11.020.
[26] DEVLIEGHERE F, VERMEIREN L, DEBEVERE J. New preservation technologies: possibilities and limitations[J].International Dairy Journal, 2004, 14(4): 273-285. DOI:10.1016/j.idairyj.2003.07.002.
[27] WANG B S, LI B S, DU J Z, et al. Combined pressure-thermal inactivation effect on spores in lu-wei beef: a traditional Chinese meat product[J]. Journal of Applied Microbiology, 2015, 119: 446-454.DOI:10.1111/jam.12841.
[28] SHAO Yanwen, RAMASWAMY H S. Clostridium sporogenes-ATCC 7955 spore destruction kinetics in milk under high pressure and elevated temperature treatment conditions[J]. Food Bioprocess Technology, 2011, 4(3): 458-468. DOI:10.1007/s11947-008-0165-8.
[29] AHN J, BALASUBRAMANIAM V M, YOUSEF V M.Inactivation kinetics of selected aerobic and anaerobic bacterial spores by pressure-assisted thermal processing[J]. International Journal of Food Microbiology, 2007, 113: 321-329. DOI:10.1016/j.ijfoodmicro.2006.08.012.
[30] LEBERT I, ROBLES-OLVERA V, LEBERT A. Application of polynomial models to predict growth of mixed cultures of Pseudomonas ssp. and Listeria in meat[J]. International Journal of Food Microbiology, 2000, 61: 27-39.
[31] 肖华志, 吕洪波, 贯恺, 等. 超高压处理对荠菜制品与生鲜猪肉杀茵效果的研究[J] . 食品与机械, 2007, 25(1): 56-57.
[32] 韩衍青, 张秋勤, 徐幸莲, 等. 超高压处理对烟熏切片火腿保质期的影响[J]. 农业工程学报, 2009, 25(8): 305-311. DOI:10.3969/j.issn.1002-6819.2009.08.054.
[33] CARLEZ A, ROSEC, J P, RICHARD N, et al. High pressure inactivation of Citrobacter freundii, Pseudomonas fluorescens and Listeria innocua in inoculated minced beef muscle[J]. Food Science and Technology, 1993, 26: 357-363. DOI:10.1006/fstl.1993.1071.
[34] ZHU Songming, NAIM F, MARCOTTE M, et al. High-pressure destruction kinetics of Clostridium sporogenes spores in ground beef at elevated temperatures[J]. International Journal of Food Microbiology,2008, 126: 86-92. DOI:10.1016/j.jfoodeng.2009.07.019.
[35] 李博, 李里特, 辰巳英三. 预测微生物学的研究进展[J]. 食品与发酵工业, 2001, 27(11): 54-57. DOI:10.13995/j.cnki.11-1802/ts.2001.11.014.
[36] BUZRUL S, ALPAS H. Modeling the synergistic effect of high pressure and heat on inactivation kinetics of Listeria innocua: a preliminary study[J]. FEMS Microbiology Letters, 2004, 238: 29-36.DOI:10.1016/j.femsle.2004.07.011.
Inactivation Kinetics of Weissella viridescens under Ultra-High Pressure Thermal Sterilization Treatment
GAO Fang1,2,3, LI Xingmin2, MA Pengfei4, ZENG Xin4, XU Baocai3,5,*
(1. National Institutes for Food and Drug Control, Beijing 102629, China; 2. College of Food Science and Nutritional Engineering,China Agricultural University, Beijing 100083, China; 3. College of Food Science and Technology, Nanjing Agricultural University,Nanjing 210095, China; 4. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China; 5. State Key Laboratory of Meat Processing and Quality Control, Jiangsu Yurun Meat Group Co. Ltd., Nanjing 210041, China)
Abstract:This work was undertaken to establish a model describing the inactivation of Weissella viridescens on lowtemperature smoked ham with ultra-high pressure thermal sterilization (HPTS). Weissella viridescens suspended in phosphate buffered saline and smoked ham inoculated with 108–109CFU/mL of this strain were subjected to moderate heating (40, 45 and 50 ℃) combined with high pressure (200–500 MPa) held for 5, 10, 15, 20, 25, 30 min. The number of surviving cells was counted by the thin agar layer method. Inactivation curves describing the logarithmic value of the number of inactivated cells as a function of time were fitted with a first-order linear model and the Weibull and Logistic nonlinear models. The goodness of fit of the fitted models was examined by the correlation coefficient (R2), accuracy factor (Af)and mean square error (MSE). It was found that the inactivation of Weissella viridescens in situ was slower than in vitro after HPTS, which was due to the presence of macromolecular substances in the ham matrix including protein and fat, protecting bacteria from damage. Finally, the Logistic equation was the best model to describe bacterial inactivation in vitro and in situ,and could provide the theoretical foundation to predict Weissella viridescens inactivation on smoked hams.
Keywords:ultra-high pressure; Weissella viridescens; smoked ham; in vitro; Logistic model
DOI:10.7506/spkx1002-6630-201815006
收稿日期:2017-03-02
基金项目:国家自然科学基金面上项目(31571909)
第一作者简介:高芳(1993—),女,硕士,研究方向为畜产品科学。E-mail:1057171683@qq.com
*通信作者简介:徐宝才(1973—),男,高级研究员,博士,研究方向为肉品加工技术。E-mail:baocaixu@163.com
中图分类号:TS251.6
文献标志码:A
文章编号:1002-6630(2018)15-0038-10
引文格式:
高芳, 李兴民, 马鹏飞, 等. 超高压协同温度处理对绿色魏斯氏菌的失活动力学[J]. 食品科学, 2018, 39(15): 38-47.DOI:10.7506/spkx1002-6630-201815006. http://www.spkx.net.cn
GAO Fang, LI Xingmin, MA Pengfei, et al. Inactivation kinetics of Weissella viridescens under ultra-high pressure thermal sterilization treatment[J]. Food Science, 2018, 39(15): 38-47. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815006. http://www.spkx.net.cn