张 鹤,张 莹,杨逢建,祖元刚,陈小强*
(东北林业大学 森林植物生态学教育部重点实验室,生物资源生态利用国家地方联合工程实验室(黑龙江),黑龙江 哈尔滨 150040)
摘 要:依次用石油醚、乙酸乙酯、正丁醇对向日葵茎髓乙醇提取物进行萃取,得到不同极性萃取部位,测定石油醚萃取部位(PE)、乙酸乙酯萃取部位(EE)和正丁醇萃取部位(BE)的总酚和总黄酮含量及其体外抗氧化活性,并分析其相关性。结果表明:EE中总酚和总黄酮含量均最高,分别为(1.60±0.10)mg/g和(20.50±1.55)mg/g;且其1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率(半抑制浓度(2.56±0.10)mg/mL)、2,2’-二氮-双(3-乙基苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS)自由基清除率(半抑制浓度(52.00±1.97)μmol/g)和铁离子还原能力(半抑制浓度(120.57±0.74)μmol/g)也最好;总酚、总黄酮含量与抗氧化活性的相关性分析结果表明,各向日葵茎髓萃取部位的DPPH自由基清除率、ABTS+·清除能力及铁离子还原能力与其总酚和总黄酮含量均呈极显著正相关(P<0.01)。
关键词:向日葵茎髓;总酚;总黄酮;抗氧化活性;相关性分析
自由基是机体在生化反应中产生的性质活泼且具有极强氧化功能、可以导致细胞损伤和机体衰老的物质[1]。当机体细胞处于氧化胁迫状态时,摄入外源性抗氧化剂有可能逆转这种胁迫,保护细胞免受自由基的侵害,进而阻止或延缓许多慢性疾病的发生和发展[2-4]。研究表明,许多植物提取物和植物化学成分对维持体内的自由基平衡具有重要作用,或可直接清除自由基,或可直接对抗自由基胁迫造成的组织或细胞损伤,还可增强机体本身的抗氧化酶系统,从多个环节抑制体内自由基过多带来的生理性损伤作用[1],许多植物源提取物[5]和酚类[6]、黄酮类[7]、醌类[8]、皂苷[9]、多糖[10]、生物碱[11]等化学成分均已被证实具有很好的抗氧化活性。
向日葵(Helianthus annuus L.)为菊科向日葵属植物,一年生高大草本,原产于北美洲,世界各国均有栽培[12]。向日葵是仅次于棕榈、大豆和油菜的主要油料作物[13],同时有很高的药用价值,其叶、花、花盘、果壳、根、茎内髓心(向日葵茎髓)均可入药,其中向日葵茎髓具有清热、利尿、止咳的功效,主治淋浊、白带、乳糜尿、百日咳、风疹[14]。研究表明,向日葵的化学成分主要为倍半萜、二萜、倍半萜内酯、三萜类等萜类化合物[15],还含有甾醇、香豆素[15]、酚类[16-17]、黄酮类[18-19]和挥发性化合物[20]。秸秆是向日葵产业的主要副产物之一,多被当作烧柴甚至被废弃[21],其本身所具有的食药用价值和经济价值尚未引起足够的重视,其酚类、黄酮类抗氧化成分含量及活性的相关研究也鲜有开展。为此,本实验中选取向日葵茎髓为实验材料,测定其乙醇提取物的不同极性萃取部位的总酚和总黄酮含量及抗氧化活性的异同,并进行其相关性分析,可为向日葵茎髓的进一步开发利用提供数据参考,对于提高向日葵资源利用率和综合经济效益以及环境保护均具有积极意义。
向日葵茎植物材料于2015年秋季采集于黑龙江省哈尔滨市,由东北林业大学森林植物生态学教育部重点实验室鉴定为菊科植物向日葵(H. annuus L.)的干燥茎。
没食子酸标准品 上海融禾医药科技有限公司;芦丁标准品、福林-酚试剂 上海源叶生物科技有限公司;2,4,6-三(2-吡啶基)三嗪(tripyridyltriazine,TPTZ) 美国Fluka公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-二氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS)、过硫酸钾、乙酸钠 美国Sigma-Aldrich公司;水溶性VE(Trolox) 加拿大TRC公司;所有提取溶剂均为国产分析纯。
超声波清洗机 深圳市洁盟清洗设备有限公司;RE-2000B旋转蒸发器 上海一科仪器有限公司;752N型紫外-可见分光光度计 上海精科实业有限公司;JJ124BC型电子天平 常熟市双杰测试仪器厂。
1.3.1 不同极性萃取部位的制备
剥取向日葵茎髓,风干并粉碎,过40 目筛,精密称取茎髓粉末100 g于锥形瓶中,按料液比1∶30(m/V)加入体积分数为70%的乙醇,在功率为100 W、温度为40 ℃的条件下超声提取3 次,每次30 min,合并3 次提取液,过滤,减压回收溶剂至提取物无醇味。将乙醇提取物用适量去离子水充分混悬后依次用石油醚、乙酸乙酯和正丁醇进行萃取,减压回收溶剂,得到向日葵茎髓石油醚萃取部位(PE)、乙酸乙酯萃取部位(EE)和正丁醇萃取部位(BE),-20 ℃保存备用。
1.3.2 总酚含量的测定
各萃取部位总酚含量通过福林-酚法进行测定[22],稍作改动。依次向试管中加入0.2 mL萃取部位溶液、0.8 mL蒸馏水、0.2 mL福林-酚试剂,混匀并室温静置5 min,依次加入2 mL 0.07 g/mL碳酸钠溶液、1.6 mL蒸馏水,混匀后常温避光反应90 min,于波长765 nm处测定吸光度。各样品的总酚含量参考标准曲线用每克干样品中酚类化合物相当于没食子酸的质量表示(mg/g)。所有样品均测定3 次。
1.3.3 总黄酮含量的测定
各萃取部位总黄酮含量依据文献[23]方法测定,稍作改动。将萃取部位配制成100 mg/mL的待测溶液备用。取2.4 mL待测样品溶液与0.3 mL 0.05 g/mL亚硝酸钠溶液混匀静置;6 min后加入0.3 mL 0.10 g/mL硝酸铝溶液,混匀静置;5 min后加入4 mL 0.04 g/mL氢氧化钠溶液,待反应液充分混匀15 min后,于波长510 nm处测定吸光度。根据芦丁标准曲线计算总黄酮含量。总黄酮含量以每克干样品中黄酮类化合物相当于芦丁的质量表示(mg/g)。所有样品均测定3 次。
1.3.4 DPPH自由基清除能力的测定
DPPH自由基清除能力的测定参考文献[24],稍作改动。用甲醇将DPPH配制成60 μmol/L的溶液,将向日葵茎髓萃取部位配制成50.00、25.00、12.50、6.25、3.13、1.56、0.78 mg/mL的样品液,量取0.1 mL样品溶液与0.9 mL DPPH溶液充分混匀,避光静置30 min后,以甲醇作为空白对照,于波长517 nm处测定吸光度,每个样品平行测定3 次。DPPH自由基清除率按公式(1)计算,VC作为阳性对照。再根据系列质量浓度下的清除率计算出半抑制浓度(half maximal inhibitory concentration,IC50)。
式中:A空白为0.9 mL DPPH溶液与0.1 mL甲醇溶液混合后的吸光度;A样品为0.9 mL DPPH溶液与0.1 mL样品溶液混合后的吸光度。
1.3.5 ABTS+·清除能力的测定
ABTS+·清除能力测定参考文献[5],稍作改动。将7 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾溶液按0.5∶1.0(V/V)混匀,室温避光静置12~16 h,得到ABTS储备液。将此储备液与蒸馏水按照1∶20(V/V)混合,在734 nm波长处调节吸光度为0.80±0.02,得到ABTS工作液。取0.1 mL萃取部位样品溶液分别与3.9 mL的ABTS工作液混匀,避光反应10 min后于波长734 nm处测定吸光度。每个样品平行测定3 次。按公式(2)计算样品对ABTS+·的清除率。
式中:A空白为0.1 mL对应溶剂与3.9 mL ABTS工作液混合后的吸光度;A样品为0.1 mL样品与3.9 mL ABTS工作液反应后的吸光度。
用不同浓度Trolox溶液重复以上操作,以ABTS+·清除率/%为纵坐标,以Trolox溶液浓度/(μmol/L)为横坐标,绘制标准曲线。样品ABTS+·清除能力用每克干样品的Trolox当量表示(μmol/g)。
1.3.6 FRAP测定
铁离子还原能力(ferric reducing antioxidant power,FRAP)的测定参考文献[25],稍作改动。将0.1 mol/L醋酸盐缓冲液(pH 3.6)、l0 mmol/L TPTZ溶液(溶于40 mmol/L盐酸)、20 mmol/L氯化铁溶液按10∶1∶1(V/V)混匀,得到FRAP工作液。取0.1 mL萃取部位样品溶液加入到2.45 mL FRAP工作液中,充分混合,暗反应60 min,于波长593 nm处测定其吸光度。用不同浓度Trolox溶液重复以上操作,绘制标准曲线(以Trolox溶液浓度/(μmol/L)为横坐标,吸光度为纵坐标)。样品FRAP用每克样品的Trolox当量表示(μmol/g)。
每个实验重复3 次取平均值,结果以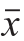 ±s表示。采用SPSS 20.0软件进行数据处理,利用单因素方差分析和Duncan法检验多组数据间差异的显著性,以P<0.05表示差异显著,以P<0.01表示差异极显著。利用Pearson法进行总酚或总黄酮含量与抗氧化活性的相关性分析。
±s表示。采用SPSS 20.0软件进行数据处理,利用单因素方差分析和Duncan法检验多组数据间差异的显著性,以P<0.05表示差异显著,以P<0.01表示差异极显著。利用Pearson法进行总酚或总黄酮含量与抗氧化活性的相关性分析。
表 1 向日葵茎髓各萃取部位总酚、总黄酮的含量
Table 1 Contents of total phenols and total flavonoids in different solvent extracts of sunflower stalk pith

注: 同行肩标字母不同表示差异显著(P<0.05)。
由表1可知,总酚和总黄酮在不同极性萃取部位中的含量差异明显:其中以EE中的总酚、总黄酮含量最高,分别为(1.60±0.10)mg/g和(20.50±1.55)mg/g;其次是PE,分别为(1.00±0.03)mg/g和(5.37±1.54)mg/g。3 种萃取部位的总酚、总黄酮含量的单因素方差分析和多重比较(Duncan法)结果显示:PE与EE、EE与BE及PE与BE总酚含量之间均有显著性差异(P<0.05),总酚含量大小依次为EE>PE>BE;EE与PE、EE与BE总黄酮含量之间均有显著性差异(P<0.05),总黄酮含量大小依次为EE>PE>BE。因此,乙酸乙酯从向日葵茎髓乙醇提取物中富集的酚类和黄酮类成分含量最高,可见其对乙醇提取物中酚类和黄酮类成分的初步分离是有效的。
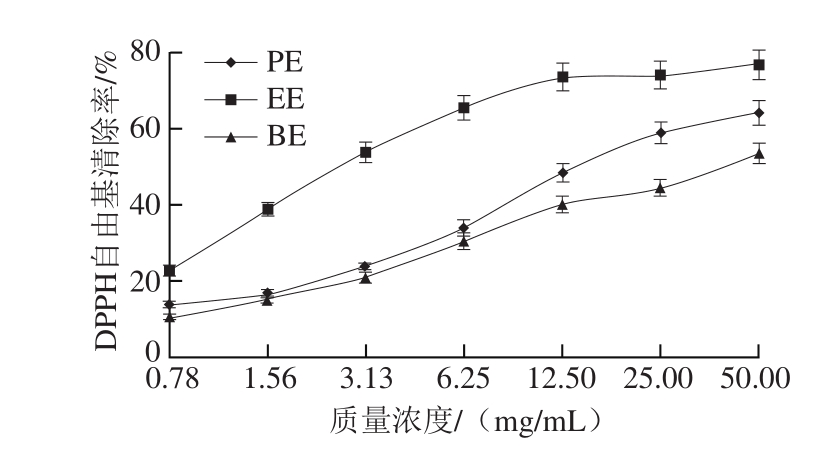
图 1 向日葵茎髓各萃取部位对DPPH自由基清除能力的影响
Fig. 1 Scavenging effects of different solvent extracts from sunflower stalk pith on DPPH radicals
由图1可见,当样品质量浓度在0.78~25.00 mg/mL之间时,不同萃取部位清除DPPH自由基的能力随着样品质量浓度的增大而增强。在样品质量浓度为3.13 mg/mL时,EE对DPPH自由基的清除率为53.76%,高于PE(23.81%)和BE(21.26%)。
3 种萃取部位对DPPH自由基的清除能力由大到小顺序为EE>PE>BE。PE和BE对DPPH自由基清除率的IC50分别为(13.92±0.85)mg/mL和(36.64±1.23)mg/mL,均高于EE((2.56±0.10)mg/mL),且差异显著(P<0.05),表明不同极性溶剂得到的萃取部位有效成分含量之间存在一定差异,中等极性的EE对DPPH自由基清除率最高,而小极性的PE和较大极性的BE对DPPH自由基的清除率较低。但3 种萃取部位中对DPPH自由基清除能力最好的EE其IC50仍显著高于VC(未在图中显示,(0.05±0.00)mg/mL,P<0.05)。
以T r olo x绘制标准曲线,得到回归方程Y=0.523 39X-0.005 36,R2=0.999 5。根据萃取部位样品的ABTS+·清除率和标准曲线计算出各萃取部位样品ABTS+·清除能力。
图 2 向日葵茎髓各萃取部位对ABTS+·清除能力的影响
Fig. 2 Scavenging effects of different solvent extracts from sun flower stalk pith on ABTS+·
由图2可知,向日葵茎髓EE的ABTS+·清除能力最强,为(52.00±1.97)μmol/g;其次为PE((22.63±0.40)μmol/g);BE活性最低,为(11.53±0.25)μmol/g。不同萃取部位ABTS+·清除率的单因素方差分析和多重比较(Duncan法)结果显示,EE对ABTS+·清除能力与其他两种萃取部位之间均存在显著性差异(P<0.05)。
以Trolox绘制标准曲线,得到回归方程Y=0.745 54X+0.099 17,R2=0.999 3。

图 3 向日葵茎髓各萃取部位对FRAP的影响
Fig. 3 FRAP activity of different solvent extracts from sunflower stalk pith
由图3可见,向日葵茎髓EE的FRAP最强,为(120.57±0.74)μmol/g,其次为PE(50.11±1.16)μmol/g和BE(48.00±4.17)μmol/g。不同萃取部位FRAP的单因素方差分析和多重比较(Duncan法)结果显示,EE的FRAP与其他两种萃取部位存在显著性差异(P<0.05)。这一检测结果与2.2、2.3节两种抗氧化活性检测结果是一致的,说明向日葵茎髓中的抗氧化成分主要集中在中等极性的EE中。
表 2 向日葵茎髓各萃取部位总酚、总黄酮含量与抗氧化活性的相关性
Table 2 Correlation between antioxidant activities and total phenols and flavonoids contents of extracts from sunflower stalk pith

注:**.极显著相关(P<0.01)。
由表2可知,向日葵茎髓各萃取部位总酚、总黄酮含量与其DPPH自由基、ABTS+·清除能力及FRAP均呈极显著正相关,表明萃取部位中总酚、总黄酮含量越高,其对DPPH自由基和ABTS+·清除能力以及FRAP越强,该萃取部位的抗氧化活性越强。由相关系数可知,各萃取部位中总酚含量对DPPH自由基和ABTS+·清除能力的影响大于总黄酮,而总黄酮含量对FRAP的影响大于总酚。结果提示向日葵茎髓各萃取部位中的总酚和总黄酮可能是其具有抗氧化活性的物质基础。
从植物中寻找抗氧化活性成分一直是天然产物化学的研究热点之一。研究表明,天然抗氧化剂主要来源于植物酚类及黄酮类化合物[26]。向日葵中研究较多的具有抗氧化活性的酚类成分主要为绿原酸[16-17,27-28],其研究材料多为向日葵种子或籽粕,而关于向日葵茎及茎髓中绿原酸含量的报道较少,文献[29]显示成熟期茎髓中绿原酸含量高于0.5 mg/g,但本课题组之前的研究中通过薄层色谱检测未发现该成分,推测原因为检测方法的灵敏度不够或实验材料中绿原酸含量过低。关于向日葵中黄酮类成分的报道中,杨树平等[30]优化了秋季采摘向日葵盘总黄酮的提取工艺并测定其含量,在优化的工艺条件下(乙醇体积分数50%、提取温度80 ℃、反应时间2 h),向日葵盘中总黄酮得率为33.64 mg/g。高银祥等[29]对不同生长阶段的向日葵植株中黄酮和多酚含量进行了测定,其结果显示黄酮和多酚在向日葵植株中的分布以花、叶和花盘为主,成熟期叶和花盘中黄酮含量分别为8.34 mg/g和9.41 mg/g,而不同生长阶段茎髓中黄酮和多酚含量均较低(低于2 mg/g)。Javed[31]对生长期为40 d的向日葵根、茎、叶中的总酚和总黄酮含量进行了测定,茎中的总酚和总黄酮含量分别为200.0~256.7 mg/g和45.0~65.7 mg/g。本研究结果与上述文献结论表明,酚类和黄酮类成分在向日葵茎髓中均有一定积累,这也可能是茎髓醇提物不同萃取部位具有抗氧化活性的原因。本研究测得茎髓总酚含量约为高银祥等[29]研究结果的1.5 倍,但均远低于Javed[31]以苗期向日葵植株为材料所测得的结果;总黄酮含量约为高银祥等[29]检测结果的15 倍,约为Javed[31]研究结果的1/2。不同研究中总酚和总黄酮检测结果存在一定差异,一方面可能是由于实验材料的原植物生长环境、采集时间等条件不同而导致相关成分的积累有所差异;另一方面由于酚类和黄酮类成分种类较多,不同极性溶剂和处理方法对不同成分的溶解性不同,也可能会使得到的提取物/萃取部位在成分和含量方面存在差异。
植物源酚类和黄酮类成分含量及种类与其抗氧化活性密切相关。本研究结果显示,不同极性溶剂萃取得到的向日葵茎髓萃取部位中酚类和黄酮类含量均存在显著差异。综合DPPH自由基和ABTS+·清除能力以及FRAP的实验结果可以发现,3 种萃取部位的抗氧化活性强弱依次为EE>PE>BE。不同极性向日葵茎髓萃取部位总酚和总黄酮含量与抗氧化活性呈正相关,这与相关研究报道是一致的[32]。由此推断,中等极性的乙酸乙酯更有利于向日葵茎髓中酚类和黄酮类成分的萃取,从而影响萃取部位的抗氧化活性。目前,国内外对植物源抗氧化活性成分的筛选实验较多,而对于抗氧化活性成分的构效关系、作用机制、抗氧化活性成分间的协同或拮抗作用等方面仍缺乏系统性研究,尚未形成规律性的科学依据和结论[33]。因此,向日葵茎髓中酚类和黄酮类成分的种类、结构、抗氧化活性及相互作用等还需要进一步探讨。
向日葵茎髓乙醇提取物PE、EE和BE均含有一定量的酚类和黄酮类成分,且这两类成分都以EE中的含量最高,分别为(1.60±0.10)mg/g和(20.50±1.55)mg/g,与其他两种极性萃取部位相比具有显著差异(P<0.05)。对3 种萃取部位的DPPH自由基、ABTS+·清除能力和FRAP检测发现,其抗氧化能力与总酚和总黄酮含量呈正相关,即EE在3 种检测方法中均具有最优的抗氧化活性。相关性分析结果表明,3 种萃取部位的抗氧化能力与其含有的总酚和总黄酮含量呈极显著正相关(P<0.01),提示酚类和黄酮类成分可能是向日葵茎髓具有抗氧化活性的物质基础。
参考文献:
[1] 李丽, 刘春明. 中药抗氧化成分的现代分离和分析技术[M]. 北京:科学出版社, 2011: 1-2.
[2] TANG W, XING Z, LI C, et al. Molecular mechanisms and in vitro antioxidant effects of Lactobacillus plantarum MA2[J].Food Chemistry, 2017, 221: 1642-1649. DOI:10.1016/j.foodchem.2016.10.124.
[3] 潘瑶, 郑时莲, 邹兴平, 等. 葡萄、芒果、草莓乙醇提取物抗氧化活性组分分析及其抗氧化相互作用[J]. 食品科学, 2017, 38(4): 133-140. DOI:10.7506/spkx1002-6630-201704022.
[4] 刘国安, 常锦春, 乔想金, 等. 多种植物提取物对DMPD自由基清除作用的研究[J]. 华中师范大学学报(自然科学版), 2015, 49(1): 102-107. DOI:10.19603/j.cnki.1000-1190.2015.01.019.
[5] 范智义, 李晓琳, 李巨秀. 桑椹提取物中酚类化合物的抗氧化及抗糖基化活性分析[J]. 食品科学, 2016, 37(17): 19-26. DOI:10.7506/spkx1002-6630-201617004.
[6] AKPANIKA G A, WINTERS A, WILSON T, et al. Polyphenols from Allanblackia floribunda seeds: identification, quantification and antioxidant activity[J]. Food Chemistry, 2017, 222: 35-42.DOI:10.1016/j.foodchem.2016.12.002.
[7] BOEING J S, RIBEIRO D, CHISTE R C, et al. Chemical characterization and protective effect of the Bactris setosa Mart. fruit against oxidative/nitrosative stress[J]. Food Chemistry, 2017, 220:427-437. DOI:10.1016/j.foodchem.2016.09.201.
[8] ASSIMOPOULOU A N, PAPAGEORGIOU V P. Radical scavenging activity of Alkanna tinctoria root extracts and their main constituents,hydroxynaphthoquinones[J]. Phytotherapy Research, 2005, 19(2): 141-147. DOI:10.1002/ptr.1645.
[9] CHOI J H, JIN S W, CHOI C Y, et al. Saponins from the roots of Platycodon grandiflorum ameliorate high fat diet-induced nonalcoholic steatohepatitis[J]. Biomedicine & Pharmacotherapy, 2017,86: 205-212. DOI:10.1016/j.biopha.2016.11.107.
[10] DONG Y R, CHENG S J, QI G H, et al. Antimicrobial and antioxidant activities of Flammulina velutipes polysacchrides and polysacchrideiron (III) complex[J]. Carbohydrate Polymers, 2017, 161: 26-32.DOI:10.1016/j.carbpol.2016.12.069.
[11] KOOLEN H H F, PRAL E M F, ALFIERI S C, et al. Antiprotozoal and antioxidant alkaloids from Alternanthera littoralis[J]. Phytochemistry,2017, 134: 106-113. DOI:10.1016/j.phytochem.2016.11.008.
[12] 中国植物志编委会. 中国植物志[M]. 北京: 中国科学技术出版社,1979: 357.
[13] 李培江, 李碧娟, 南伟, 等. 油用与食用向日葵籽形态及主成分差异辨析[J]. 四川大学学报(自然科学版), 2017, 54(1): 203-208.DOI:103969/j.issn.0490-6756.2017.01.034.
[14] 南京中医药大学. 中药大辞典[M]. 上海: 上海科学技术出版社,2010: 1285.
[15] ZOUHIR E M, ASCENSION T, ROSA M V, et al. Isolation of bioactive compounds from sunflower leaves (Helianthus annuus L.)extracted with supercritical carbon dioxide[J]. Journal of Agricultural and Food Chemistry, 2015, 63(28): 6410-6421. DOI:10.1021/acs.jafc.5b02261.
[16] YE F Y, LIANG Q, LI H, et al. Solvent effects on phenolic content,composition, and antioxidant activity of extracts from florets of sunflower (Helianthus annuus L.)[J]. Industrial Crops and Products,2015, 76: 574-581. DOI:10.1016/j.indcrop.2015.07.063.
[17] 刘振春, 钱月. 响应面优化超声波微波辅助提取葵花籽绿原酸工艺[J]. 西北农林科技大学学报(自然科学版), 2016, 44(10): 157-164.DOI:10.13207/j.cnki.jnwafu.2016.10.022.
[18] KATARÍNA F Š, JANKA N, MAGDA M, et al. Biologically active antimicrobial and antioxidant substances in the Helianthus annuus L.bee pollen[J]. Journal of Environmental Science and Health, Part B,2016, 51(3): 176-181. DOI:10.1080/03601234.2015.1108811.
[19] 许中畅, 卢晓霆. 葵盘总黄酮对油脂抗氧化作用研究[J]. 中国油脂,2016, 41(2): 44-47. DOI:10.3969/j.issn.1003-7969.2016.02.011.
[20] 张玲玲, 汤依娜, 唐思丽, 等. 向日葵花盘挥发油的GC-MS定性分析[J]. 中国现代中药, 2017, 19(2): 188-191. DOI:10.13313/j.issn.1673-4890.2017.2.005.
[21] 周宏, 赵玉英, 王冀敏. 向日葵杆中果胶提取及含量测定[J]. 内蒙古民族大学学报(自然科学版), 2013, 28(1): 28-30.
[22] MEDOUNI-ADRAR S, BOULEKBACHE-MAKHLOUF L, CADOT Y, et al. Optimization of the recovery of phenolic compounds from Algerian grape by-products[J]. Industrial Crops and Products, 2015,77: 123-132. DOI:10.1016/j.indcrop.2015.08.039.
[23] ZHAO P, QI C, WANG G, et al. Enrichment and purification of total flavonoids from Cortex Juglandis Mandshuricae extracts and their suppressive effect on carbon tetrachloride-induced hepatic injury in mice[J]. Journal of Chromatography B, 2015, 1007: 8-17.DOI:10.1016/j.jchromb.2015.10.019.
[24] CHEN X Q, ZHANG Y, ZU Y G, et al. Composition and biological activities of the essential oil from Schisandra chinensis obtained by solvent-free microwave extraction[J]. LWT-Food Science and Technology, 2011, 44(10): 2047-2052. DOI:10.1016/j.lwt.2011.05.013.
[25] SZYDŁOWSKA-CZERNIAK A, ŁASZEWSKA A. Effect of refining process on antioxidant capacity, total phenolics and prooxidants contents in rape seed oils[J]. LWT-Food Science and Technology,2015, 64(2): 853-859. DOI:10.1016/j.foodchem.2011.05.101.
[26] 黄琴, 沈杨霞, 张成静, 等. 铁皮石斛多酚和黄酮含量及与抗氧化活性的相关性[J]. 应用与环境生物学报, 2014, 20(3): 438-442.DOI:10.3724/SP.J.1145.2014.04028.
[27] YOSHIAKI A, MORIO Y, SAORI Y, et al. Isolation of phenolic constituents and characterization of antioxidant markers from sunflower (Helianthus annuus) seed extract[J]. Phytochemistry Letters,2013, 6(2): 302-305. DOI:10.1016/j.phytol.2013.03.013.
[28] LIANG Q, CUI J, LI H, et al. Florets of sunflower (Helianthus annuus L.):potential new sources of dietary fiber and phenolic acids[J]. Journal of Agricultural and Food Chemistry, 2013, 61(14): 3435-3442.DOI:10.1021/jf400569a.
[29] 高银祥, 祖元刚, 杨逢建, 等. 向日葵植株中次生代谢产物分布及积累规律研究[J]. 植物研究, 2014, 34(6): 782-786. DOI:10.7525/j.issn.1673-5102.2014.06.011.
[30] 杨树平, 韩立军, 陈晓云, 等. 向日葵盘总黄酮工艺优化及含量测定[J].食品科学, 2010, 31(24): 66-69. DOI:10.7506/spkx1002-6630-201024013.
[31] JAVED K. Quantification of alkaloids, phenols and flavonoids in sunflower (Helianthus annuus L.)[J]. African Journal of Biotechnology, 2011, 10(16): 3149-3151. DOI:10.5897/AJB09.1270.
[32] 孙丹, 黄士淇, 蔡圣宝. 不同加工方式对苦荞中总酚、总黄酮及抗氧化性的影响[J]. 食品与发酵工业, 2016, 42(1): 141-147.DOI:10.13995/j.cnki.11-1802/ts.201601026.
[33] 旷慧, 王金玲, 姚丽敏, 等. 6 种东北地区红树莓果渣提取物的抗氧化活性差异[J]. 食品科学, 2016, 37(1): 63-68. DOI:10.7506/spkx1002-6630-201601012.
Correlation between Total Phenols and Total Flavonoids Contents and Antioxidant Activity of Different Fractions from Ethanol Extract of Sunflower Stalk Pith
ZHANG He, ZHANG Ying, YANG Fengjian, ZU Yuangang, CHEN Xiaoqiang*
(Key Laboratory of Forest Plant Ecology, Ministry of Education, Provincial Engineering Laboratory of Eco-utilization of Biological Resources (Heilongjiang), Northeast Forestry University, Harbin 150040, China)
Abstract:The total phenols, total flavonoids contents and in vitro antioxidant activities of petroleum ether (PE), ethyl acetate (EE) and n-butanol (BE) soluble fractions from the ethanol extract of sunflower stalk pith were evaluated and correlated with each other. Results showed that EE contained the highest amount of total phenols (1.60 ± 0.10) mg/g calculated as gallic acid equivalent and total flavonoids (20.50 ± 1.55) mg/g calculated as rutin equivalent. EE also had the highest antioxidant activity among three extracts, with half maximal inhibitory concentration of (2.56 ± 0.10) mg/mL,(52.00 ± 1.97) μmol/g and (120.57 ± 0.74) μmol/g for 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity,2,2’-azino-bis (3-ethylbenzthiazoline-6-sulfonic acid) (ABTS) radical scavenging activity and total reducing power (the latter two were calculated as Trolox equivalent), respectively. The correlation analysis showed that for all three extracts,there were significant correlations between the contents of total phenols and total flavonoids and DPPH and ABTS radical scavenging activity and ferric reducing antioxidant power (P < 0.01).
Keywords:sunflower stalk pith; total phenols; total flavonoids; antioxidant activity; correlation analysis
DOI:10.7506/spkx1002-6630-201815008
收稿日期:2017-05-02
基金项目:中央高校基本科研业务费专项资金项目(2572015CB18;2572015CB17);黑龙江省博士后科研启动金项目(LBH-Q15009);黑龙江省博士后资助经费项目(LBH-Z15006);林业公益性行业科研专项经费项目(20140470102)
第一作者简介:张鹤(1992—),女,硕士研究生,研究方向为植物化学与活性评价。E-mail:549755362@qq.com
*通信作者简介:陈小强(1974—),男,副教授,博士,研究方向为植物化学与植物资源学。E-mail:xiaoqiang_chen@nefu.edu.cn
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2018)15-0054-06
引文格式:
张鹤, 张莹, 杨逢建, 等. 向日葵茎髓醇提物中不同溶剂萃取部位总酚、总黄酮含量与抗氧化活性的相关性[J]. 食品科学, 2018, 39(15): 54-59. DOI:10.7506/spkx1002-6630-201815008. http://www.spkx.net.cn
ZHANG He, ZHANG Ying, YANG Fengjian, et al. Correlation between total phenols and total flavonoids contents and antioxidant activity of different fractions from ethanol extract of sunflower stalk pith[J]. Food Science, 2018, 39(15): 54-59.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815008. http://www.spkx.net.cn