苏 平,孙 昕,宋思圆*,魏 丹
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
摘 要:以黄秋葵花为原料,研究热水、酸法、酶法、超声辅助提取工艺对黄秋葵花多糖提取率和样品结构组成等的影响,在此基础上对4 种多糖抗氧化活性进行了比较分析。结果表明:4 种提取方法所得多糖的提取率大小依次为:酶法提取((21.90±0.14)%)>酸法提取((15.15±0.07)%)>热水提取((12.60±0.28)%)>超声辅助提取((12.02±0.37)%)。经酶法和热水提取的多糖样品分子质量较高且特性黏度较大,而超声提取则显著降低了多糖的分子质量和特性黏度,同时使多糖分子质量的分布更加均一。4 种多糖的单糖组成成分相同,主要包括鼠李糖、半乳糖醛酸和半乳糖,但单糖的物质的量之比有所不同。傅里叶变换红外光谱分析结果表明,得到的4 种样品都具有多糖的典型傅里叶变换红外光谱特征。对1,1-二苯基-2-苦基肼自由基清除能力等抗氧化活性的测定结果表明,4 种多糖具有不同程度的抗氧化活性。其中,以超声辅助提取的多糖抗氧化活性最强。
关键词:黄秋葵花;多糖提取;结构组成;抗氧化活性
黄秋葵(Abelmoschus esculentus(L.)Moench)是原产于非洲的锦葵科热带植物,其花中富含多糖、蛋白质、黄酮、脂肪酸、矿物质元素等物质,营养保健价值高,具有很大的开发潜力[1-2]。黄剑波等[3]以成熟的黄秋葵为原料,研究了硫酸铝沉淀法提取果胶的工艺方法,黄秋葵的果胶提取率达到25.96%,证明黄秋葵是一种果胶含量高的植物资源,因此可将其作为一种优质的多糖资源。
多糖的提取有热水提取法、酸提法、酶提法、超声提取法等[4-5]。黄秋葵叶水提多糖存在α-糖苷键构型,原子力显微镜观察结果表明多糖分子间相互缠绕,呈规则团聚状,经进一步的抗氧化性实验研究可知,黄秋葵叶粗多糖对自由基有一定的清除作用[6]。刘晓霞[7]采用酸法提取黄秋葵花中的果胶类多糖,并研究了其理化性质、流变特性和结构等,发现黄秋葵花果胶类多糖是一种主要由半乳糖、鼠李糖以及半乳糖醛酸组成的酸性杂多糖。宋思圆等[8]研究超声辅助提取黄秋葵花果胶多糖的抗氧化活性,结果表明经超声辅助提取得到的黄秋葵花果胶多糖有较好的体外抗氧化活性,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力为(91.31±1.05)mg Trolox/g,2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基清除能力为(50.05±2.50)mg Trolox/g,铁离子还原能力(ferric ion reducing antioxidant power,FRAP)为(65.96±0.14)mg Trolox/g以及氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)为(25.74±1.29)mg Trolox/g。有研究表明提取方法会显著影响多糖的提取率、结构特征以及生物活性[1]。但目前不同提取方法与黄秋葵花多糖的结构及生物活性之间的关系鲜有报道[9]。因此,本实验比较了热水、酸法、酶法、超声辅助提取法对黄秋葵花多糖提取效果的影响,并对所提多糖的结构组成和抗氧化能力进行了研究,以期为黄秋葵多糖的综合开发利用提供技术和理论支持。
黄秋葵花产自浙江嘉善,品种为纤指黄秋葵花,60 ℃烘干,粉碎后过60 目筛备用;氯化钠、三氟乙酸、盐酸、柠檬酸、磷酸二氢钾、氢氧化钠、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazalone,PMP)、纤维素酶(15 000 U/g)、甲醇、VC、过硫酸钾、95%乙醇均为分析纯 国药集团化学试剂有限公司;DPPH、水溶性维生素E(Trolox)均为分析纯、2’,7’-二氯荧光黄双乙酸盐(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA) 美国Sigma公司;2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-methylpropionamidine)dihydrochloride,AAPH)、ABTS、荧光素钠均为分析纯 上海阿拉丁试剂有限公司;DEAE-Q Sepharose Fast Flow纤维素填料 英国Watman公司。
DC-0506低温恒温槽 宁波海曙赛福实验仪器厂;SCIENTZ-ⅡD超声波细胞破碎机 宁波新芝生物科技股份有限公司;PH070A恒温鼓风干燥箱 上海一恒科技有限公司;TGL20M高速冷冻离心机 湖南凯达科学仪器有限公司;JA1003N电子天平 上海菁海仪器有限公司;Multiskan GO全波长酶标仪 美国Thermo公司;DAWN HELEOS Ⅱ多角度激光散射检测器 美国Wyatt公司;1836-A乌氏黏度计 浙江台州椒江玻璃仪器厂;Avatar370傅里叶变换红外光谱仪 美国Nicolet公司。
1.3.1 黄秋葵花多糖的提取及提取率的测定
1.3.1.1 黄秋葵花多糖的超声提取工艺
按照Wang Wenjun等[10]所报道的工艺条件提取,提取温度为60 ℃,按1∶40(m/V)的料液比加入蒸馏水,在95 W的功率下提取30 min,将提取液离心并收集上清液,加入3 倍体积95%乙醇溶液,4 ℃下沉淀过夜,离心;沉淀物依次用体积分数70%乙醇溶液、体积分数95%乙醇溶液、无水乙醇洗涤,复溶,透析48 h,冻干得到样品(CUOFP)备用。
1.3.1.2 黄秋葵花多糖的酶法提取工艺
根据李文德等[11]报道的方法并略作修改,准确称取黄秋葵花粉20 g,使用纤维素酶,加酶量为1%(以黄秋葵花粉质量计),料液比为1∶40(m/V),用pH 4.8的柠檬酸缓冲液作为溶剂,在50 ℃下水浴提取3 h,按1.3.1.1节方法收集上清液,醇沉,离心,复溶,透析,冻干得到样品(CEOFP)备用。
1.3.1.3 黄秋葵花多糖的酸法提取工艺
采用刘晓霞[7]优化的方法,准确称取黄秋葵花粉20 g,料液比1∶30(m/V),加入pH 1.6的盐酸溶液,水浴温度为90 ℃,提取2.5 h,按1.3.1.1节方法收集上清液,经醇沉、离心、复溶、透析、冻干得到样品(CAOFP)备用。
1.3.1.4 黄秋葵花多糖的热水浸提工艺
按Zhu Zhenyuan等[12]报道的方法制备并进行一定的修改,准确称取黄秋葵花粉20 g,按料液比1∶30(m/V)加入蒸馏水,在80 ℃下水浴提取2 h,按1.3.1.1节方法收集上清液,醇沉,离心,复溶,透析,冻干得到样品(CHOFP)备用。
1.3.1.5 黄秋葵花多糖提取率的计算
黄秋葵花多糖提取率的计算参照文献[7],计算公式如式(1)所示。
1.3.2 黄秋葵花多糖的一般理化特性分析
黄秋葵花多糖的一般理化特性分析参照文献[7]进行。半乳糖醛酸质量分数的测定采用咔唑比色法。蛋白质量分数的测定采用考马斯亮蓝法。总酚质量分数采用福林-酚法测定。
1.3.3 黄秋葵花多糖的分子质量分析
黄秋葵花多糖的分子质量分析参照文献[13]。激光光散射法可以精确分析多糖的重均分子质量(mW)及其分布和均方根旋转半径![]() 折光率增量dn/dc为0.138 mL/g,进样量为200~300 μL,数据收集60 min,柱温为室温,流动相为0.1 mol/L NaNO3溶液(含有质量分数0.02% NaN3)。称取3 mg样品溶解于1 μL的0.1 mol/L NaNO3溶液中,磁力搅拌溶解4 h,过0.22 μm滤膜,备用。采用ASTRA软件进行数据收集和计算。
折光率增量dn/dc为0.138 mL/g,进样量为200~300 μL,数据收集60 min,柱温为室温,流动相为0.1 mol/L NaNO3溶液(含有质量分数0.02% NaN3)。称取3 mg样品溶解于1 μL的0.1 mol/L NaNO3溶液中,磁力搅拌溶解4 h,过0.22 μm滤膜,备用。采用ASTRA软件进行数据收集和计算。
1.3.4 黄秋葵花多糖的单糖组成分析
1.3.4.1 多糖组分的完全酸水解
称取2 mg样品于安瓿瓶中,加入2 mol/L三氟乙酸2 mL,封管,置于110 ℃烘箱中酸解8 h,待反应完全后冷却至室温,用氮吹仪吹干,即可得到水解后的单糖混合物。加少量蒸馏水溶解,用0.1 mol/L NaOH溶液调整样品pH值至中性,用蒸馏水定容至1 mL备用。
1.3.4.2 PMP柱前衍生-高效液相色谱法分析单糖组成
衍生物制备:精密称取标准单糖,等物质的量混合配制成浓度为2 mmol/L的标准单糖混合溶液。吸取400 μL标准单糖混合溶液(加乳糖作为内标)和上述水解样品,加入450 μL的0.3 mol/L NaOH溶液和450 μL的0.5 mol/L PMP溶液,混匀,70 ℃水浴反应30 min。加入450 μL的0.3 mol/L HCl溶液,加1 mL氯仿萃取,重复两次,取上层水层过0.45 μm水系膜,进行高效液相色谱分析。
色谱条件:XDB-C18色谱柱(4.6 mm×150 mm,5 μm),检测波长250 nm,柱温为25 ℃,流速1 mL/min,进样量10 μL,流动相:溶剂A为体积分数15%乙腈和0.05 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)(KH2PO4-NaOH,pH 6.8),溶剂B为体积分数40%乙腈和0.05 mol/L PBS(KH2PO4-NaOH,pH 6.8);梯度洗脱模式:时间梯度为0 min→10 min→30 min→35 min→40 min,相应溶剂B体积分数梯度为0→15%→25%→25%→0。
多糖组分的单糖物质的量之比计算:多糖样品中的单糖组成分析和计算方法主要是以乳糖为内标,按公式(2)计算各标准单糖的定量矫正因子fi/Luc。样品中各单糖的物质的量之比为峰面积与内标物的峰面积比乘以fi/Luc所得,样品的单糖相对含量以单糖的物质的量之比来表示。

式中:fi/Luc为该单糖的校正因子;Ai为标准单糖的峰面积;ni为标准单糖的物质的量/mmol;ALuc为内标的峰面积;nLuc为内标的物质的量/mmol。
1.3.5 黄秋葵花多糖的傅里叶变换红外光谱检测
黄秋葵花多糖的傅里叶变换红外光谱检测参照文献[7]进行。取样品约2 mg,置于干燥的玛瑙碾钵中,在红外灯干燥的条件下加入溴化钾约0.5 g,碾匀,压片,用傅里叶变换红外光谱仪扫描,扫描范围400~4 000 cm-1。
1.3.6 黄秋葵花多糖特性黏度分析
黄秋葵花多糖特性黏度分析参照文献[14]进行。用蒸馏水作为溶剂,多糖样品过夜充分溶解,分别配制得到多糖溶液作为待测液。将乌氏黏度计垂直固定于恒温水槽内,温度控制为(25.0±0.1)℃。移取8 mL蒸馏水加入到乌氏黏度计中,恒温15 min。按乌氏黏度计的使用方法,测定溶剂流出时间T0。移取8 mL待测样品溶液加入到乌氏黏度计中,恒温15 min,测定样品溶液流经两刻度线间的时间,重复3 次,取平均值记为T1。依次加入4、4、8 mL的蒸馏水,稀释混匀,使溶液浓度为初始浓度的2/3、1/2、1/3,并恒温15 min,然后测定稀释后溶液流经两刻度线间的时间。每次测定重复至少3 次,最大值与最小值之间相差不得超过0.5 s,最终流出时间取3 次测量值的平均值。分别计算不同样品溶液的相对黏度(ηr)、增比黏度(ηsp)和比浓黏度(ηsp/c)(式(3)~(5))。作图得到Huggins方程和Kraemer方程,外推可得到共同的截距,即为特性黏度[η]。

特性黏度[η]是反映聚合物占据的流体动力学体积的参数,其值的测量在生物大分子表征中具有重要意义[24]。常用Huggins方程(式(6))、Kraemer方程(式(7))来表示聚合物溶液的黏度与浓度的关系。

式中:k是Huggins常数;k’是斜率。
[η]的大小主要取决于聚合物的分子质量和链刚性以及溶剂特性、温度[25]。而当聚合物的溶剂、温度一定时,[η]只与聚合物的分子质量有关,分子质量越大,则表现出的[η]也越大[26]。
1.3.7 多糖的体外抗氧化活性测定
采用离子交换层析纯化,除去黄秋葵花多糖中的小分子杂质。将不同方法提取得到的多糖样品溶于蒸馏水中,离心后上清液用DEAE-Q Sepharose Fast Flow分离,依次用蒸馏水、0.7 mol/L与0.8 mol/L的NaCl洗脱,收集0.7 mol/L NaCl的洗脱组分,经透析、浓缩、冷冻干燥后得到样品备用。
1.3.7.1 FRAP测定
按照黄海智[15]的测定方法,取3.9 mL的Fe3+-TPTR复合物溶液,加入100 μL样品,漩涡混合,在37 ℃下孵育10 min,检测其593 nm波长处的吸光度,吸光度越高表明还原能力越强,同时采用VC作为阳性对照。
1.3.7.2 DPPH自由基清除能力测定
按照Imjongjaira等[16]的方法,取300 μL的DPPH溶液(0.2 mmol/L,溶于体积分数80%乙醇溶液中),加入300 μL样品并漩涡混合,同时用VC作为对照。在避光室温的条件下反应30 min,于517 nm波长处检测其吸光度,记为A样品。DPPH自由基清除率按式(8)计算。
1.3.7.3 ABTS+·清除能力测定
实验根据黄海智[15]的方法进行测定,取25 mL ABTS储备溶液(7 mmol/L)和440 μL过硫酸钾溶液(140 mmol/L)混合室温避光条件下反应12~16 h制备得到ABTS阳离子溶液。ABTS阳离子溶液用PBS(pH 7.4)稀释,直到734 nm波长处的吸光度为0.70±0.02,记为A0。取3.9 mL稀释后的ABTS阳离子溶液,加入100 μL样品并漩涡混合,用VC作为对照。室温下避光反应10 min,734 nm波长处检测其吸光度。ABTS+·清除率以空白与样品吸光度的变化率表示。ABTS+·清除率按式(9)计算。
1.3.7.4 ORAC测定
ORAC测定根据黄海智[15]的方法并略作修改。荧光素的溶液用75 mmol/L的磷酸钾缓冲液(pH 7.4)溶解,配成终浓度100.8 nmol/L。随后在黑底96 孔板加入25 μL的样品或Trolox溶液和75 μL荧光素钠溶液,将其在37 ℃下孵育15 min,再将150 μL AAPH磷酸钾缓冲溶液(38.25 mmol/L)加入到该混合物中。充分振荡5 s后开始检测,发射波长538 nm、激发波长485 nm,每分钟测定一次,在37 ℃下连续测定3 h。结果以每克干物质含Trolox的物质的量(μmol Trolox/g)表示。
1.3.7.5 CAA的测定
细胞抗氧化能力(cellular antioxidant activity,CAA)的测定参照文献[17]。将100 μL的人肝癌细胞(HepG2)以60 000 个/孔的浓度接种到96 孔板中(黑板底透)。37 ℃培养24 h后,移除培养基,PBS洗涤一次。含有不同样品浓度的培养基用25 μmol/L的DCFH-DA处理1 h,移除培养基,PBS洗涤一次,加入100 mL的AAPH溶液。将96 孔板放入荧光酶标仪检测,发射波长538 nm、激发波长485 nm连续检测1 h,每5 min检测一次,以每100 g干物质含槲皮素物质的量(μmol QE/100 g)表示表示细胞抗氧化能力。
实验重复3 次,结果以平均值±标准差表示,采用Excel软件对数据进行整理、Origin Pro 2016软件作图。采用SPSS 22.0软件进行单因素方差分析和Duncan’s分析,以P<0.05表示差异显著。
4 种提取方法的提取率由高到低分别为酶法提取((21.90±0.14)%)、酸法提取((15.15±0.07)%)、热水提取((12.60±0.2 8)%)、超声辅助提取((12.02±0.37)%)。通过提取率的比较可知,采用纤维素酶辅助提取的方法所得粗多糖的得率最高,表明黄秋葵花中的多糖部分与细胞壁的纤维素和半纤维素结合,纤维素酶能够水解和破坏纤维素网络,促进多糖的溶出,这个结果与Zhu Zhenyuan[12]和Yuliarti[18]等的研究结果一致。此外,酶法和酸法所用的提取溶剂为酸性,能够使一部分非水溶性多糖转化为水溶性多糖,提取率升高。热水提取与超声辅助提取法都以去离子水为提取剂,两者的提取率比较接近,但超声提取方法所用的时间比热水提取的短。这可以归因于超声波的空化效应对物料的组织和细胞壁产生破坏,使物料和溶剂之间有更大的接触面积,多糖更易溶出,提高了提取效率[19]。
由表1可见,提取方法对半乳糖醛酸质量分数有一定的影响,4 种不同方法得到多糖CAOFP、CEOFP、CUOFP、CHOFP的半乳糖醛酸质量分数分别为(52.63±2.13)%、(39.51±1.47)%、(31.97±1.30)%、(29.34±1.31)%,其中CAOFP的半乳糖醛酸质量分数最高。在酸性条件下,有更多非水溶性果胶多糖转化为水溶性果胶多糖[7],因此采用酸法和酶法提取得到的CAOFP、CEOFP半乳糖醛酸的质量分数要高于用纯水作为提取剂的CUOFP、CHOFP。
4 种粗多糖中都含有除糖类物质以外的其他成分,而这些成分很可能与糖类基团是紧密相连的,如蛋白质、酚类物质等,会在提取及醇沉的过程中混入样品。而表1中的结果显示CUOFP中所含的蛋白质与总酚质量分数高于其他方法,可能是超声波对黄秋葵花的细胞壁结构造成了更大的破坏,释放出了更多的非多糖成分[18]。
表 1 不同提取方法的黄秋葵花多糖的化学组成
Fig. 1 Chemical composition of polysaccharides obtained using different extraction methods

注:同行肩标小写字母不同表示差异显著(P<0.05)。
表 2 不同提取方法的黄秋葵花多糖分子质量
Fig. 2 Molecular mass of polysaccharides obtained using different extraction methods
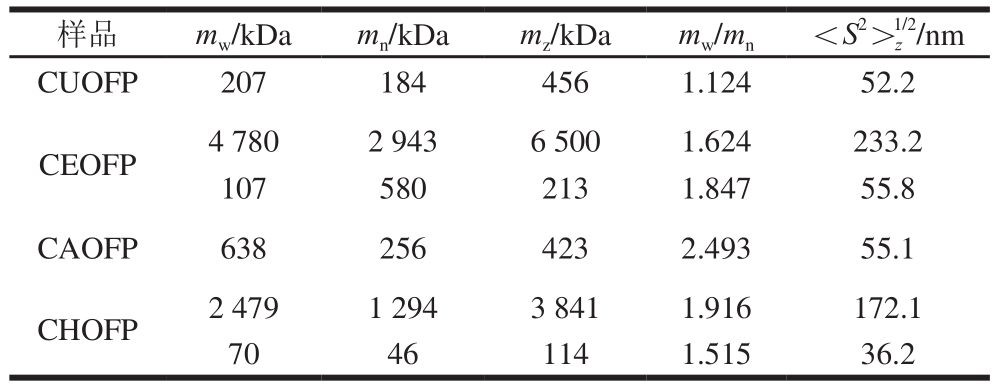
如表2所示,CHOFP和CEOFP都发现了2 个组分,表明黄秋葵花粗多糖中既含有分子质量较大的组分,也有分子质量较小的组分。CEOFP具有最高的![]() (233.2 nm)和mW(4 780 kDa);CAOFP多分散系数大,分布较宽,这与刘晓霞[7]的实验结果一致。与其他3 个样品相比,CUOFP的mW(207 kDa)相对较小,并且多分散系数接近1,说明该样品多糖较为均一。
(233.2 nm)和mW(4 780 kDa);CAOFP多分散系数大,分布较宽,这与刘晓霞[7]的实验结果一致。与其他3 个样品相比,CUOFP的mW(207 kDa)相对较小,并且多分散系数接近1,说明该样品多糖较为均一。
超声波的空化效应不仅促进多糖的溶出,还会导致部分多糖的降解,形成分布更加平均的小分子多糖。研究表明,经一定强度超声处理的大粒车前子多糖分子质量明显下降,分子质量分布会变窄[20]。已有文献报道热水回流提取和酸法提取的黄秋葵花多糖分子质量分别为1 700、1 300 kDa,这种差异主要是由不同的实验方法和计算方法引起的[7,21]。
采用PMP柱前衍生化高效液相色谱法检测黄秋葵花多糖的单糖组成,通过比较标准品和样品衍生物在色谱图中的保留时间进行定性分析,不同提取方法得到的黄秋葵花多糖的单糖组成物质的量之比如表3所示。4 种提取方法所得的黄秋葵花多糖样品具有相同的单糖组成,而相对含量有所不同。4 种样品都由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖和岩藻糖组成,这9 种单糖中主要以鼠李糖、半乳糖醛酸和半乳糖居多,这与刘晓霞[7]的实验结果相近,说明黄秋葵花多糖是一类酸性杂多糖。其中,鼠李糖、阿拉伯糖、半乳糖与半乳糖醛酸一起出现表明多糖链上可能存在分支且分支程度与提取方法有关,CUOFP中性多糖相对含量高,说明多糖结构支化程度更高[18,22]。酸法提取对组织中纤维素、半纤维素等组分有增溶作用,因此产物CAOFP中含有更多的葡萄糖,可能就是来自纤维素的降解[23]。
表 3 不同提取方法的黄秋葵花多糖的单糖相对含量
Fig. 3 Monosaccharide relative content of polysaccharides obtained using different extraction methods

注:同行肩标小写字母不同表示差异显著(P<0.05)。

图 1 不同提取方法的黄秋葵花多糖的傅里叶变换红外光谱
Fig. 1 Fourier transform infrared spectra of polysaccharides obtained using different extraction methods
如图1所示,4 种多糖在3 385 cm-1附近都出现了强而宽的吸收峰,这是O—H伸缩振动的结果,表明多糖的分子内和分子间均存在氢键。2 930 cm-1附近的吸收峰为C—H的振动。1 400~1 200 cm-1处的吸收峰为C—H的变形振动,表明样品为多聚糖组分。1 724 cm-1的吸收峰处为酯键羰基(—COOR)形成的伸缩振动,其中CAOFP在此处的吸收峰比其他样品强,但初步判断所得的多糖为低酯多糖;1 615 cm-1附近为羧基的羰基C=O伸缩振动,可能是羧酸或羧酸盐。1 417 cm-1的峰是C—H变角振动峰。在1 017 cm-1处的吸收峰是糖苷键C—O—C非对称伸缩振动,说明多糖中都存在吡喃环构象。在895 cm-1处的吸收峰表明多糖中存在β-构型糖。
本实验中,[η]CEOFP(10.63 dL/g)>[η]CHOFP(10.55 dL/g)>[η]CAOFP(2.33 dL/g)>[η]CUOFP(1.94 dL/g),这表明不同提取方法影响了多糖的特性黏度,这与分子质量测定的结果相符,CEOFP的分子质量最大而CUOFP分子质量最小。Yan Jingkun等[27]研究发现超声处理能够明显降低桑黄菌丝多糖的特性黏度。Kontogiorgos等[24]测得黄秋葵多糖的特性黏度范围在0.41~2.71 dL/g,Ndjouenkeu等[28]报道黄秋葵多糖的特性黏度为7.6 dL/ g,与本实验结果相近,但同时也反映了提取方法和原材料本身对多糖的结构特征会产生较大的影响。研究发现多糖的黏度过大,则在实际生产和加工的应用中会受到很大的限制[14],Zhu Zhenyuan等[12]也在实验中发现,较小的多糖特性黏度有利于其流动以及附着于肿瘤细胞,因此具有更好的肿瘤抑制活性。而经超声提取得到的黄秋葵花多糖,特性黏度明显下降,这对进一步的加工和利用多糖是有利的。
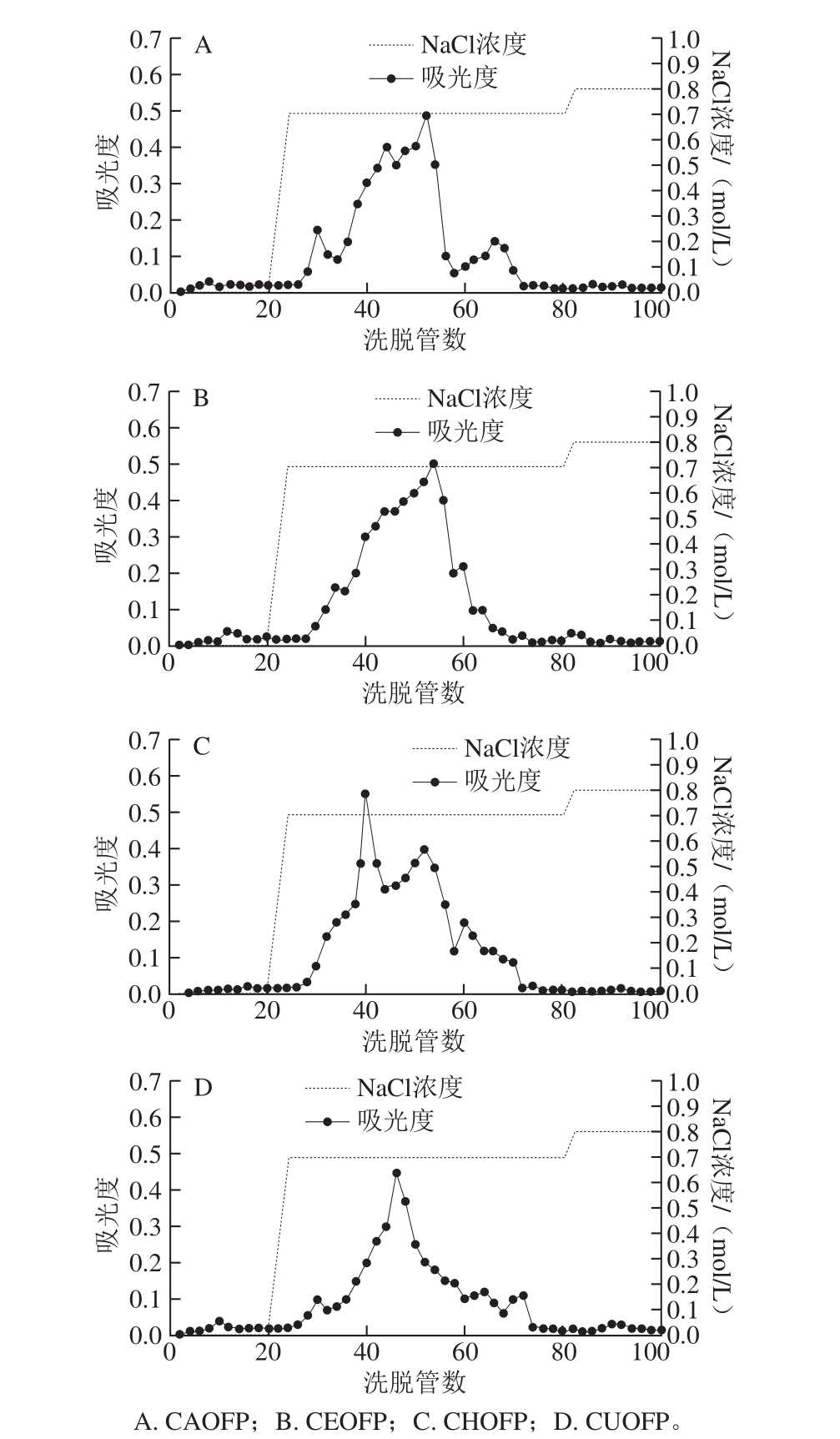
图 2 不同提取方法的黄秋葵花多糖的离子交换层析纯化
Fig. 2 Elution profiles of crude polysaccharides extracted by different methods
为了排除酚类、黄酮等物质对多糖抗氧化活性评价的影响,黄秋葵花多糖样品经离子交换柱脱色,结果见图2。经0.8 mol/L的NaCl洗脱的组分没有多糖出现,观察洗脱组分发现有色素出现,而经0.7 mol/L的NaCl洗脱的组分没有色素且含有全部的多糖。将CEOFP、CAOFP、CHOFP、CUOFP除去小分子杂质后得到的多糖分别命名为EOFP、AOFP、HOFP、UOFP。

图 3 黄秋葵花多糖的FRAP
Fig. 3 FRAP of okra flower polysaccharides
2.7.1 黄秋葵花多糖的FRAP图3显示了VC及4 种不同方法得到的黄秋葵花多糖在1~8 mg/mL下的铁离子还原抗氧化力,多糖样品和
VC的还原能力随质量浓度的增加而增大,但多糖的还原能力与VC具有显著的差距。多糖分子中含有大量的羟基基团,能够作为电子供体,将Fe3+还原成Fe2+,从而使黄秋葵花多糖具有一定的铁离子还原抗氧化活性。由图3可知,UOFP的还原能力明显强于其他3 种多糖。
Shen Shian等[29]在实验中发现超声提取的油茶饼多糖的还原能力明显高于酶法、碱法、热水提取的样品;Li Jinwei
等[23]比较超声提取和热水法提取的骏枣多糖样品,其中超声提取的多糖的Fe3+还原力高于热水法提取的多糖,说明在超声提取过程中可能提取到了更多关键的生物活性物质或者使其发生一些结构或化学变化。
2.7.2 黄秋葵花多糖的DPPH自由基清除能力

图 4 黄秋葵花多糖的DPPH自由基清除能力
Fig. 4 Scavenging effects of okra flower polysaccharides on DPPH free radicals
如图4所示,对于所有样品,清除DPPH自由基的能力都具有剂量依赖关系,清除率在黄秋葵花多糖质量浓度为0.2~2.0 mg/mL的范围内明显上升。其中,VC的半抑制浓度(half maximal inhibitory concentration,IC50)为0.01 mg/mL,UOFP的IC50为(0.83±0.01)mg/mL,HOFP的IC50为(2.45±0.01)mg/mL,EOFP和AOFP的IC50都大于4 mg/mL。4 种多糖对DPPH自由基的清除能力强弱依次为UOFP>HOFP>EOFP>AOFP,UOFP的DPPH自由基清除能力最强。有研究发现采用热水浸提法从黄秋葵中提取的多糖有一定的DPPH自由基清除能力,不同组分的IC50不同,并具有剂量依赖的关系[30]。超声提取过程中可能暴露出了更多的活性基团,其降解效应也能够对多糖的DPPH自由基清除能力产生影响[31-32]。
2.7.3 黄秋葵花多糖的ABTS+·清除能力
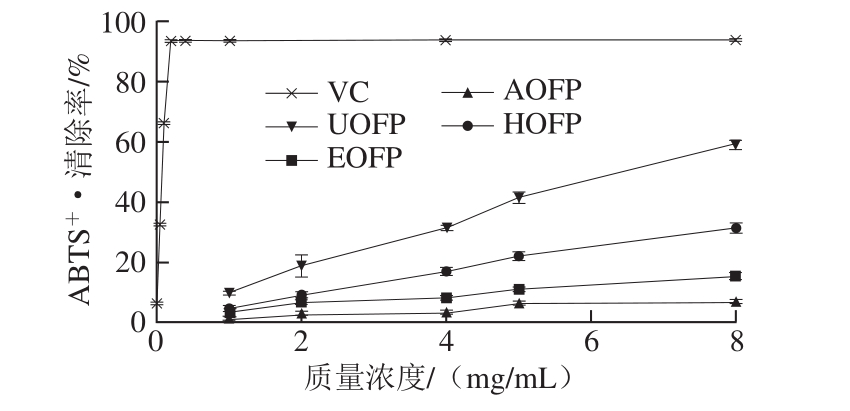
图 5 黄秋葵花多糖的ABTS+·清除能力
Fig. 5 Scavenging effects of okra flower polysaccharides on ABTS+·
由图5可知,所有多糖样品ABTS+·的清除能力与质量浓度呈正相关。通过比较4 种多糖样品的IC50可知,UOFP的ABTS+·清除效果最好,其他多糖样品的IC50均大于8 mg/mL,且与VC相比清除能力相对较弱。与DPPH自由基清除能力实验的结果一致,有研究表明超声对多糖活性有积极的影响,可以有效提高多糖的自由基清除能力和体外抗氧化活性[27]。
2.7.4 黄秋葵花多糖的ORAC
4 种多糖的O R A C由大到小分别为U O F P((151.15±1.23)μmol Trolox/g)、HOFP((144.44±0.27)μmol Trolox/g)、EOFP((6 1.7 5±0.5 5)μ m olT r olo x/g)、A O F P((31.77±0.59)μmol Trolox/g)。结果表明,在适宜的条件下超声提取可以在一定程度上提高多糖的生物活性。多糖中含有的一些极性基团对其抗氧化能力指数具有较大影响,还原能力实验结果也同样具有相近的结果。研究表明多糖的分子质量、糖醛酸含量、单糖组成与其抗氧化能力相关[33]。
2.7.5 黄秋葵花多糖的CAA
虽然化学抗氧化方法能够非常有效地筛选抗氧化物质,但是它们不能准确地评价抗氧化物质在生物体内的活性。细胞抗氧化活性筛选方法涉及细胞吸收、分布和代谢,能提供更可靠的抗氧化活性的生物学评价结果,可以克服化学测定的一些缺点,成为了一种重要的抗氧化活性评价方法[34]。
多糖样品的CAA分别为UOFP((892.85±27.95)μmol QE/100 g)、AOFP((473.86±18.56)μmol QE/100 g)、HOFP((91.11±3.10)μmol QE/100 g),其中UOFP具有最好的CAA,而EOFP在实验中没有检测到CAA。
采用了4 种提取方法:热水提取、酸法提取、酶法提取、超声辅助提取黄秋葵花中的多糖,分别得到CHOFP、CAOFP、CEOFP、CUOFP 4 种多糖。其中酶法提取的得率最高,为(21.90±0.14)%。4 种多糖都富含半乳糖醛酸,且含有少量蛋白质、酚类等。通过分析多糖的分子质量、单糖组成、傅里叶变换红外光谱,结果表明得到的4 种多糖样品都具有多糖的典型傅里叶变换红外光谱特征;它们的单糖组成成分相同,主要由鼠李糖、半乳糖醛酸、半乳糖组成,但不同样品的单糖物质的量之比有所不同;酶法提取和热水提取的多糖样品CEOFP、CHOFP分子质量和特性黏度较大,而超声提取能显著降低多糖的特性黏度和分子质量且使分子质量的分布变窄。
对4 种多糖的DPPH自由基清除能力、ORAC、ABTS+·清除能力、FRAP和CAA进行测定,结果表明4 种多糖具有不同程度的抗氧化活性,且具有剂量依赖性。相对于其他3 种提取方法,超声辅助提取的多糖在实验中均表现出了更强的抗氧化活性,说明超声辅助提取的方法可能对多糖的生物活性产生了有利的影响。
参考文献:
[1] ALBA K, RITZOULIS C, GEORGIADIS N, et al. Okra extracts as emulsifiers for acidic emulsions[J]. Food Research International, 2013,54(2): 1730-1737. DOI:10.1016/j.foodres.2013.09.051.
[2] 任丹丹. 黄秋葵多糖提取纯化及其体外结合胆酸能力和抑制肿瘤活性分析[D]. 广州: 华南理工大学, 2011: 10-14.
[3] 黄剑波, 孙哲浩, 张英慧, 等. 黄秋葵果胶提取工艺的初步研究[J]. 现代食品科技, 2007, 23(2): 51-53. DOI:10.13982/j.mfst.1673-9078.2007.02.017.
[4] NIE S P, XIE M Y. A review on the isolation and structure of tea polysaccharides and their bioactivities[J]. Food Hydrocolloids, 2011,25(2): 144-149. DOI:10.1016/j.foodhyd.2010.04.010.
[5] JIA X, CHEN M, WAN J B, et al. Review on the extraction,characterization and application of soybean polysaccharide[J]. RSC Advances, 2015, 5(90): 73525-73534. DOI:10.1039/c5ra12421b.
[6] 白石琦. 黄秋葵叶多糖的分离纯化、初步表征及其抗氧化活性研究[D]. 镇江: 江苏大学, 2013: 58-62.
[7] 刘晓霞. 黄秋葵花果胶类多糖的提取工艺及其性质的研究[D].杭州: 浙江大学, 2014: 41-68.
[8] 宋思圆, 苏平, 王丽娟, 等. 响应面试验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J]. 食品科学, 2017, 38(2): 283-289.DOI:10.7506/spkx1002-6630-201702044.
[9] 刘杨, 王诗卉, 刘云. 3 种方法提取的雨声红球藻多糖的理化性质及抗氧化活性比较[J]. 食品科学, 2015, 36(6): 161-168. DOI:10.7506/spkx1002-6630-201506030.
[10] WANG Wenjun, MA Xiaobin, XU Yuting, et al. Ultrasound-assisted heating extraction of pectin from grapefruit peel: optimization and comparison with the conventional method[J]. Food Chemistry, 2015,178: 106-114. DOI:10.1016/j.foodchem.2015.01.080.
[11] 李文德, 张礼星, 徐柔, 等. 纤维素酶提取甜菜果胶的工艺条件[J].无锡轻工大学学报, 1999, 18(4): 42-45.
[12] ZHU Zhenyuan, DONG Fengying, LIU Xiaocui, et al. Effects of extraction methods on the yield, chemical structure and anti-tumor activity of polysaccharides from Cordyceps gunnii mycelia[J].Carbohydrate Polymers, 2016, 140: 461-471. DOI:10.1016/j.carbpol.2015.12.053.
[13] 韦朝阳. 蝉拟青霉深层发酵及其胞内多糖的结构研究[D]. 杭州: 浙江大学, 2015: 27-29.
[14] YANG H H, WU Y J, GAN C J, et al. Characterization and antioxidant activity of a novel polysaccharide from Pholidota chinensis Lindl[J].Carbohydrate Polymers, 2016, 138: 327-334. DOI:10.1016/j.carbpol.2015.11.071.
[15] 黄海智. 杨梅酚类化合物抗氧化和抗癌功能及机理研究[D]. 杭州:浙江大学, 2015: 44-46.
[16] IMJONGJAIRAK S, RATANAKHANOKCHAI K, LAOHAKUNJIT N, et al. Biochemical characteristics and antioxidant activity of crude and purified sulfated polysaccharides from Gracilaria fisheri[J].Bioscience Biotechnology & Biochemistry, 2015, 80(3): 524-532. DOI:10.1080/09168451.2015.1101334.
[17] WOLFE K L, LIU R H. Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 8896-8907.DOI:10.1021/jf0715166.
[18] YULIARTI O, MATIA-MERINO L, GOH K K, et al. Characterization of gold kiwifruit pectin from fruit of different maturities and extraction methods[J]. Food Chemistry, 2015, 166: 479-485. DOI:10.1016/j.foodchem.2014.06.055.
[19] EBRINGEROVÁ A, HROMÁDKOVÁ Z. An overview on the application of ultrasound in extraction, separation and purification of plant polysaccharides[J]. Central European Journal of Chemistry,2010, 8(2): 243-257. DOI:10.2478/s11532-010-0006-2.
[20] 夏强, 黄丹菲, 余强, 等. 超声解聚对大粒车前子多糖流变性质、溶液构象及活性的影响[J]. 食品工业科技, 2016, 37(17): 80-85.DOI:10.13386/j.issn1002-0306.2016.17.007.
[21] 郑伟. 黄秋葵花多糖分离纯化、初步表征及生物活性研究[D].镇江: 江苏大学, 2014: 33-36.
[22] PARKAR S G, REDGATE E L, WIBISONO R, et al. Gut health benefits of kiwifruit pectins: comparison with commercial functional polysaccharides[J]. Journal of Functional Foods, 2010, 2(3): 210-218.DOI:10.1016/j.jff.2010.04.009.
[23] LI Jinwei, AI Lianzhong, HANG Feng, et al. Composition and antioxidant activity of polysaccharides from jujuba by classical and ultrasound extraction[J]. International Journal of Biological Macromolecules, 2014, 63: 150-153. DOI:10.1016/j.ijbiomac.2013.10.043.
[24] KONTOGIORGOS V, MARGELOU I, GEORGIADIS N, et al.Rheological characterization of okra pectins[J]. Food Hydrocolloids,2012, 29(2): 356-362. DOI:10.1016/j.foodhyd.2012.04.003.
[25] LIU Y F, ZHANG J S, TANG Q J, et al. Rheological properties of β-D-glucan from the fruiting bodies of Ganoderma lucidum[J].Food Hydrocolloids, 2016, 58: 120-125. DOI:10.1016/j.foodhyd.2016.01.025.
[26] 韩铨. 茶树花多糖的提取、纯化、结构鉴定及生物活性的研究[D].杭州: 浙江大学, 2011: 83-84.
[27] YAN Jingkun, WANG Yaoyao, MA Haile, et al. Ultrasonic effects on the degradation kinetics, preliminary characterization and antioxidant activities of polysaccharides from Phellinus linteus mycelia[J].Ultrasonics Sonochemistry, 2015, 29(23): 251-257. DOI:10.1016/j.ultsonch.2015.10.005.
[28] NDJOUENKEU R, GOYCOOLEA F M, MORRISA E R, et al.Rheology of okra (Hibiscus esculentus L.) and dika nut (Irvingia gabonensis) polysaccharides[J]. Carbohydrate Polymers, 1996, 29(3):263-269. DOI:10.1016/0144-8617(96)00016-1.
[29] SHEN Shian, CHENG Haoran, LI Xu, et al. Effects of extraction methods on antioxidant activities of polysaccharides from camellia seed cake[J]. European Food Research and Technology, 2014, 238(6):1015-1021. DOI:10.1007/s00217-014-2183-2.
[30] 赵焕焕. 黄秋葵多糖提取纯化及体外抗氧化活性的探讨[D]. 郑州:郑州大学, 2012: 38-39.
[31] FU L, CHEN H, DONG P, et al. Effects of ultrasonic treatment on the physicochemical properties and DPPH radical scavenging activity of polysaccharides from mushroom Inonotus obliquus[J]. Journal of Food Science, 2010, 75(4): C322-C327. DOI:10.1111/j.1750-3841.2010.01590.x.
[32] 刘杨, 王诗卉, 刘云. 3 种方法提取的雨声红球藻多糖的理化性质及抗氧化活性比较[J]. 食品科学, 2015, 36(6): 161-168.
[33] WANG J Q, HU S Z, NIE S P, et al. Reviews on mechanisms of in vitro antioxidant activity of polysaccharides[J]. Oxidative Medicine &Cellular Longevity, 2016, 2016: 1-13. DOI:10.1155/2016/5692852.
[34] WU Z, LI H, YANG Y, et al. Ultrasonic extraction optimization of L.macranthoides polysaccharides and its physicochemical properties[J].International Journal of Biological Macromolecules, 2015, 74:224-231. DOI:10.1016/j.ijbiomac.2014.12.010.
Effect of Extraction Method on Structure and Antioxidant Activity of Polysaccharides from Okra Flowers
SU Ping, SUN Xin, SONG Siyuan*, WEI Dan
(College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China)
Abstract:The impacts of four extraction methods (hot water extraction, acid extraction, enzymatic extraction and ultrasonic-assisted extraction) on the yield, structure and antioxidant activities of okra flower polysaccharides were systematically investigated. The results showed that the yield of polysaccharides was in the following decreasing order:enzymatic extraction ((21.90 ± 0.14)%) > acid extraction ((15.15 ± 0.07)%) > hot water extraction ((12.60 ± 0.28)%) >ultrasonic-assistant extraction ((12.02 ± 0.37)%). The polysaccharides extracted by enzyme-assistant extraction and hot water extraction had higher molecular mass and intrinsic viscosity, while ultrasonic-assisted extraction significantly reduced the molecular mass and intrinsic viscosity of polysaccharides and the extracted polysaccharides had a relatively more uniform molecular mass distribution. The polysaccharides obtained by the four extraction methods had identical monosaccharide composition but varied in the molar ratio of monosaccharides, composed mainly of rhamnose, galacturonic acid and galactose. Fourier transform infrared spectroscopy indicated that all four polysaccharides had typical characteristics of polysaccharides. These polysaccharides possessed different antioxidant activities in terms of measurement of 1,1-diphenyl-2-picrylhydrazyl radical scavenging capacity, with the ones extracted by ultrasonic-assisted extraction showing the strongest antioxidant activity.
Keywords:okra flowers; polysaccharide extraction; structure; antioxidant activity
DOI:10.7506/spkx1002-6630-201815014
收稿日期:2017-04-05
第一作者简介:苏平(1962—),男,副教授,博士,研究方向为果蔬加工。E-mail:623801545@qq.com
*通信作者简介:宋思圆(1992-),女,硕士研究生,研究方向为果蔬加工。E-mail:yss4180@163.com
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2018)15-0093-08
引文格式:
苏平, 孙昕, 宋思圆, 等. 提取方法对黄秋葵花多糖的结构组成及抗氧化活性的影响[J]. 食品科学, 2018, 39(15): 93-100.DOI:10.7506/spkx1002-6630-201815014. http://www.spkx.net.cn
SU Ping, SUN Xin, SONG Siyuan, et al. Effect of extraction method on structure and antioxidant activity of polysaccharides from okra flowers[J]. Food Science, 2018, 39(15): 93-100. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815014. http://www.spkx.net.cn