王佳佳,叶 蕾,杨最素*,余方苗,丁国芳
(浙江海洋大学食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022)
摘 要:目的:研究文蛤寡肽(Meretrix meretrix oligopeptides,MMO)对高脂饮食诱导小鼠肾损伤的修护作用。方法:建立高脂饲料致小鼠慢性肾损伤模型,通过MMO灌胃30 d后,测定小鼠肾脏指数,检测小鼠血清甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)浓度,以及小鼠肾组织匀浆中超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力和丙二醛(malondialdehyde,MDA)含量,计算小鼠动脉粥样硬化指数(atherosclerosis index,AI),苏木素-伊红(hematoxylin-eosin,HE)染色观察小鼠肾脏病理学改变,免疫组化法测定肾组织α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、转录生长因子-β1(transforming growth factor-β1,TGF-β1)蛋白表达量。结果:MMO组与模型组比较,小鼠肾脏指数,血清中TG、TC、LDL-C浓度及AI显著下降,HDL-C浓度显著升高,肾组织匀浆中SOD、GSH-Px活力显著升高,MDA含量显著降低,HE染色观察肾组织结构明显好转,免疫组化结果显示MMO可降低肾损伤小鼠α-SMA、TGF-β1蛋白表达水平。结论:MMO对高脂饮食诱导的小鼠肾损伤有较为明显的修护作用。
关键词:文蛤寡肽;高脂饲料;肾损伤;修护作用
文蛤(Meretrix meretrix)俗称蛤蜊,属于软体动物门、真瓣鳃目、帘蛤科、文蛤属,是我国滩涂传统养殖的主要贝类之一[1]。主要产于辽宁、山东、河北、江苏沿海,盛产期为5、6月。文蛤不仅有“天下第一鲜”之称,含有人体必需的氨基酸、蛋白质、矿物质、维生素和其他重要物质[2],而且近年来关于文蛤中多糖、多肽、甾醇化合物、牛磺酸等物质的活性研究较多,发现文蛤在抗癌、抗肿瘤、调节免疫力、降糖、降血脂等方面具有良好的功效,为临床治疗或辅助治疗各种疾病提供了理论依据[3]。研究发现文蛤中含有肿瘤抑制因子和促进因子,经一系列方法得到的肿瘤抑制因子对小鼠S180肉瘤有显著的抑制作用,对正常小鼠没有毒性,遂将该物质命名“蛤素”(mercenene),发现其可能是分子质量小于10 kDa的多肽,且对体外HeLa细胞也具有较强抑制作用[4-5]。范成成[6]从文蛤中提取出两种多肽Mer2和Mer1,Mer2对肝癌HepG2细胞具有很强的抑制作用,Mer1则能降低细胞内黑色素的含量和酪氨酸酶的活性,具有抗氧化活性。王惠[1]从文蛤中提取出一种抗肿瘤多肽Mere15,发现其可以抑制MMPs的分泌和表达,并抑制细胞黏附、迁移、侵袭,对肺癌A549细胞具有良好的抑制作用。张绵松[7]进行了酶法制备文蛤血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽的研究,发现当蛋白含量为1 mg/mL时,ACE抑制率高达65.87%。本实验室前期研究表明,文蛤内脏经酶解获得的分子质量为674.6 Da,氨基酸序列为Gln-Leu-Asn-Trp-Asp的文蛤寡肽(Meretrix meretrix oligopeptides,MMO),能修复经软脂酸诱导的非酒精性脂肪肝细胞模型,显著改善细胞线粒体能量代谢受阻情况,对四氯化碳诱导的小鼠急性肝损伤也具有修复作用[8-9]。高脂饮食不仅可以导致脂肪肝,高血脂引起的脂质代谢异常也是慢性肾损伤的重要影响因素[10-11],而文蛤寡肽是否对高脂血引起的肾损伤也有修复作用,目前鲜见报道。因此本实验以高脂饲料建立小鼠慢性肾损伤模型,探索MMO对高脂饮食诱导的小鼠肾损伤的保护作用。
动物用清洁级雄性ICR小鼠34 只,体质量(20±2)g,购于浙江省实验动物中心(动物生产许可证号:SCXK(浙)2016-0001),饲养于浙江海洋大学动物房。
基础饲料、高脂饲料(胆固醇2.5%、胆酸钠0.5%、猪油10%、基础饲料87%) 浙江省医学科学院。
MMO(氨基酸序列:Gln-Leu-Asn-Trp-Asp,纯度>90%)为本实验室自制;二甲苯、乙醇 国药集团化学试剂有限公司;辛伐他汀 广东彼迪药业有限公司;多聚赖氨酸 美国Sigma公司;低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)试剂盒、苏木素-伊红(hematoxylin-eosin,HE)染液 南京建成生物工程公司;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、转录生长因子-β1(transforming growth factor-β1,TGF-β1)抗体 北京博奥森生物科技有限公司;山羊抗兔IgG/HRP聚合物(二抗) 北京中杉金桥生物技术有限公司;SP Rabbit HRP Kit(DAB)试剂盒 北京康为世纪生物科技有限公司。
ALPHA1-4/Ldplus型冷冻干燥机 德国CHRIST公司;CF16RXⅡ型高速低温离心机 日本日立公司;congent μScale超滤系统 德国默克密理博公司;752FC紫外分光光度计 上海光谱仪器有限公司;切片机RM2135、摊片机HI1210、烤片机H1220 德国Leica公司;光学显微镜、CCD-NC6051显微摄像 日本OLYMPUS公司。
1.3.1 文蛤寡肽的提取方法
参考文献[9]的方法提取文蛤寡肽。
1.3.2 小鼠分组、造模及给药
将34 只成年雄性ICR小鼠在饲养环境中适应性饲养120 h后随机分为2 组,正常组小鼠(8 只)喂基础饲料,其余小鼠(26 只)喂高脂饲料。20 d后,从正常组与高脂饲料模型组各取两只小鼠,处死,取肝脏,包埋后HE染色进行病理学诊断,证实造模成功。造模成功后,将模型组小鼠24 只再随机分为4 组,每组6 只,分别为模型组、辛伐他汀阳性药物组、MMO低剂量组、MMO高剂量组。将各组小鼠灌胃给药,阳性药物组剂量为200 mg/kg mb,MMO低、高剂量组分别为50、250 mg/kg mb,正常组与模型组则给予等量蒸馏水。每天观察动物特征、行为活动等,每周记录体质量3 次。给药30 d,末次灌胃后禁食不禁水24 h,摘眼球取血,4 ℃、4 000 r/min离心10 min取血清,用于生化测定。快速取出肾脏观察形态并称质量;一部分肾脏用4%多聚甲醛固定,用于HE染色;余下肾脏放入液氮中快速冻存,-80 ℃保存备用。
1.3.3 小鼠肾脏指数的计算
根据式(1)计算肾脏指数。
1.3.4 小鼠血清中各项生化指标的测定
摘眼球取血,4 ℃、4 000 r/min离心10 min取血清,按试剂盒说明书步骤进行LDL-C、HDL-C、TC、TG浓度的测定。
1.3.5 小鼠AI的计算
参考文献[12],按式(2)计算小鼠动脉粥样硬化指数(atherosclerosis index,AI)。
式中:cTC、cHDL-C分别为TC、HDL-C的浓度/(mmol/L)。
1.3.6 小鼠肾组织匀浆液中各种生化指标的测定
参考文献[13],准确称取小鼠肾脏组织,按1∶9(m/V)的比例加入0.9%的生理盐水,制成10%的匀浆液,4 000 r/min离心10 min,取上清液进行GSH-Px、SOD活力及MDA含量的测定。
1.3.7 组织病理学HE染色观察
参考文献[14-15],取小鼠肾脏1 cm3左右,立即放入4%多聚甲醛溶液,固定24 h后,常规石蜡包埋后,制备5 µm厚切片,按照HE染色顺序,中性树胶封片且光镜下观察肾组织病理变化。
1.3.8 免疫组化法检测α-SMA、TGF-β1蛋白的表达
参考文献[9],将小鼠肾脏切片常规脱蜡至水;内源性过氧化物酶阻断剂室温作用10 min;微波炉抗原修复,冷却后磷酸盐缓冲液洗涤2 次,每次5 min;滴加封闭用正常山羊血清工作液,室温作用20 min,甩去多余液体;分别滴加适量稀释的一抗(1∶300),4 ℃孵育过夜,磷酸盐缓冲液洗3 次,每次5 min;滴加二抗,室温孵育20 min;滴加适量HRP标记的链霉亲和素,室温孵育20 min;DAB显色,镜下控制时间,自来水冲洗;苏木素复染5 min,乙醇梯度脱水,二甲苯透明后中性树胶封片。显微镜下观察并拍照。
实验数据使用SPSS 18.0统计软件分析处理,实验结果以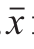 ±s表示,采用单因素方差分析比较差异显著性,且以P<0.05表示差异有显著性。
±s表示,采用单因素方差分析比较差异显著性,且以P<0.05表示差异有显著性。
灌胃给药30 d后,小鼠体质量变化如表1所示。与正常组相比,高脂饲料模型组体质量显著增加,增幅为68.08%(P<0.05),阳性药物组体质量增加与正常组相差不大,增幅为45.99%,MMO剂量组体质量增幅和模型组相比有所下降,且呈现剂量依赖性,其中MMO高剂量组增幅为48.74%(P<0.05),与阳性药物组小鼠体质量增加差别不大。
表 1 MMO对小鼠体质量的影响(n=6)
Table 1 Effect of MMO on body weight of mice (n= 6)

注:#.与正常组比较,差异显著(P<0.05);*.与模型组比较,差异显著(P<0.05)。下同。
表 2 MMO对小鼠肾脏指数的影响(n=6)
Table 2 Effect of MMO on kidney index in mice (n= 6)
如表2所示,与正常组相比,模型组肾脏指数显著升高(P<0.05),各药物组与模型组相比较,肾脏指数有所下降,且以阳性药物组与MMO高剂量组最为明显,并与模型组呈现显著性差异(P<0.05)。说明MMO可降低高脂饮食小鼠肾脏指数。
表 3 MMO对小鼠血清LDL-C、HDL-C浓度的影响(n=6)
Table 3 Effect of MMO on serum LDL-C and HDL-C levels of mice (n= 6)

如表3所示,与正常组比较,模型组小鼠血清LDL-C浓度明显上升,HDL-C浓度明显下降,呈现显著性差异(P<0.05);MMO高剂量组LDL-C浓度与模型组相比,显著降低(P<0.05),阳性药物组与MMO低剂量组LDL-C浓度与模型组相比有下降趋势,无统计学意义;与模型组相比,阳性药物组与MMO高剂量组HDL-C浓度则显著升高(P<0.05);各组药物对血清LDL-C、HDL-C作用大小比较:MMO低剂量组<阳性药物组<MMO高剂量组。说明MMO可降低高脂饮食小鼠血清LDL-C浓度以及升高HDL-C浓度,且有一定的剂量相关性。
如表4所示,模型组小鼠血清TC、TG浓度与正常组相比,显著升高(P<0.05),分别达到正常组的1.84 倍与1.66 倍;与模型组比较,各药物组TC浓度均有所降低,但阳性药物组与MMO高剂量组效果更为显著(P<0.05),其中MMO高剂量组TC浓度降低幅度达到38.19%;各药物组TG浓度与模型组相比,均有下降趋势,且以MMO高剂量组降幅最大,达到25.64%。说明MMO可降低高脂饮食小鼠血清TC、TG浓度,并且呈现一定的剂量相关性。
表 4 MMO对小鼠血清TC、TG浓度的影响(n=6)
Table 4 Effect of MMO on serum TC and TG levels of mice (n= 6)

表 5 MMO对小鼠AI的影响(n=6)
Table 5 Effect of MMO on serum AI of mice (n= 6)
如表5所示,模型组AI与正常组相比,显著升高(P<0.05),是正常组的5.08 倍,各药物组与模型组相比,AI降低,并均呈现显著性差异(P<0.05),且以MMO高剂量组降低幅度最为明显,达到67.27%,阳性药物组次之,为61.82%。说明MMO可降低高脂饮食小鼠AI,且剂量越高效果越好。
表 6 MMO对小鼠肾组织匀浆GSH-Px、SOD活力及MDA含量的影响(n=6)
Table 6 Effect of MMO on GSH-Px and SOD activities and MDA content in kidney of mice (n= 6)

如表6所示,模型组GSH-Px、SOD活力分别为正常组的63%和53%,MDA含量是正常组的2.76 倍,差异显著(P<0.05);各药物组与模型组相比,GSH-Px、SOD活性均有所升高,MDA含量均有所降低,其中以阳性药物组与MMO高剂量组作用较为明显,MMO高剂量组GSH-Px、SOD活性分别为模型组1.49 倍和1.58 倍,MDA含量是模型组的52%。说明MMO可提高高脂饮食小鼠肾组织匀浆GSH-Px、SOD活力以及降低MDA含量,且呈现剂量相关性。

图 1 小鼠肾组织HE染色(×400)
Fig. 1 HE stained kidney sections of mouse (× 400)
A.正常组;B.模型组;C.阳性药物组;D. MMO低剂量组;E. MMO高剂量组。下同。
每组小鼠肾组织切片HE染色后光镜下观察,正常组中,肾小体由肾小囊包绕肾小球组成,形态学表现正常,管腔清晰,肾小管形态规则,无炎症浸润(图1A);模型组肾组织切面苍白,系膜细胞与系膜基质增生,肾小管结构不清晰并有明显空泡变性损伤,周围可见炎症细胞浸润(图1B);MMO低剂量组,系膜细胞与系膜基质增生轻微抑制,肾小管空泡变性情况有所减轻,(图1D);阳性药物组(图1C)与MMO高剂量组(图1E)肾小球形态与正常组差别不大,肾小管结构清晰且肾小管空泡变性抑制效果优于MMO低剂量组,炎症细胞浸润减少。
2.8.1 肾组织α-SMA蛋白表达
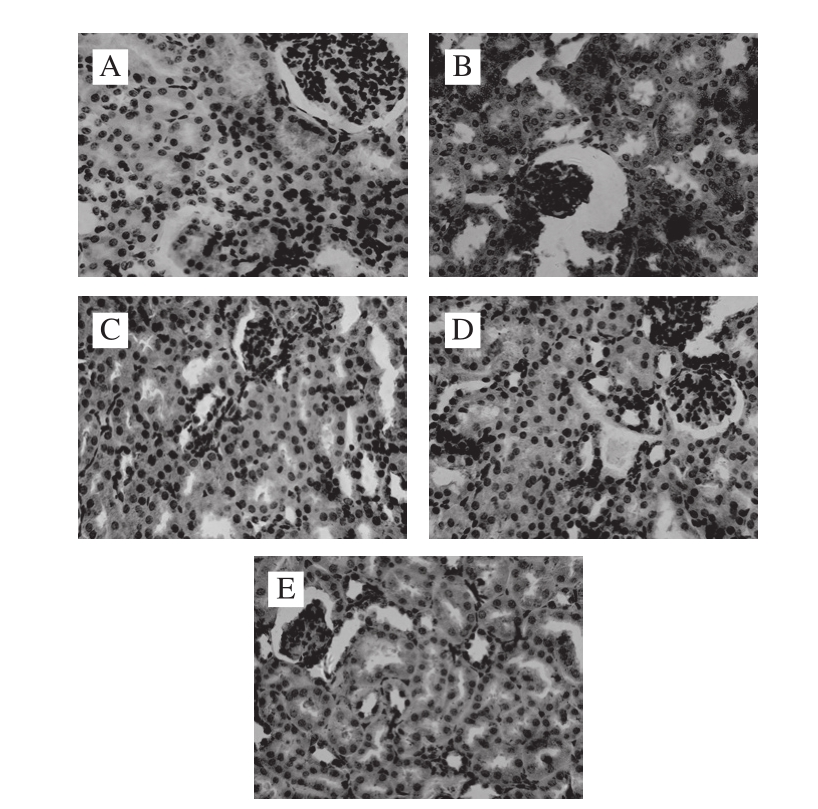
图 2 小鼠肾组织α-SMA表达情况(×400)
Fig. 2 Protein expression of α-SMA in kidney tissue (× 400)
如图2所示,α-SMA蛋白阳性表达为棕褐色,位于细胞质。正常组仅有少量表达(图2A);模型组阳性部位大量表达于肾小管中,棕褐色颜色较深(图2A);MMO低剂量组(图2D)阳性表达与模型组相比大量减少;MMO高剂量组(图2E)α-SMA蛋白阳性表达部位比低剂量组更少,并与阳性药物组(图2C)差别不大。说明MMO可减少α-SMA在肾脏中的表达。
2.8.2 肾组织TGF-β1蛋白表达
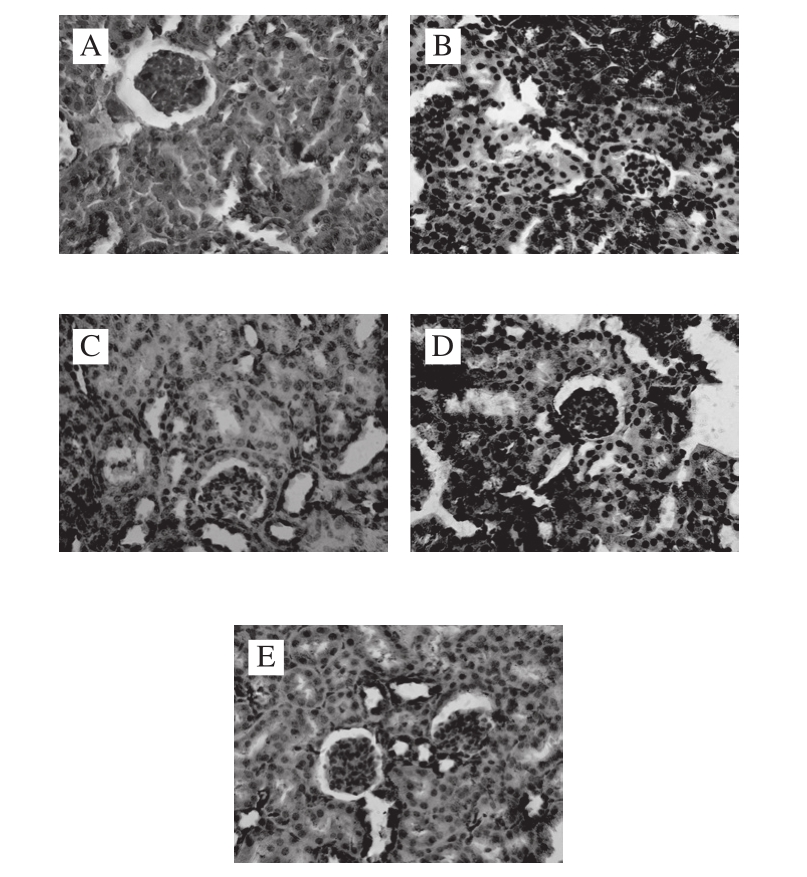
图 3 小鼠肾组织TGF-β1表达情况(×400)
Fig. 3 Protein expression of TGF-β1 in kidney tissue (× 400)
免疫组化法显示MMO对各组小鼠肾组织TGF-β1蛋白表达影响如图3所示,TGF-β1蛋白阳性表达为棕黄色,位于细胞质。正常组仅少量表达于肾小管中(图3A);模型组肾小管中大量表达,颜色较深(图3B);阳性药物组少量表达(图3C);MMO低剂量组表达情况与模型组无太大差异,颜色稍浅(图3D);MMO高剂量组表达量比阳性药物组更少,仅有个别细胞表达(图3E)。
近年来,国内外也有关于活性肽缓解肾毒性的报道。田颖刚等[16]发现丝羽乌骨鸡活性肽能降低治疗组小鼠血清尿素氮、血清肌肝的含量,使肾组织匀浆中MDA含量下降,SOD、GSH-Px活力增高,初步证实适量的羽乌骨鸡活性肽对顺铂所致小鼠肾毒性具有很好的防护作用。孙青[17]以高脂饮食诱导高脂血症大鼠,在整体、蛋白、细胞因子等各个水平上进行探讨,发现大豆肽具有调节血脂代谢及抗动脉粥样硬化的作用。由于海洋肽类药物具有分子质量小、结构简单、副作用小、无免疫原性、活性高等优点。因而,从海洋生物中提取护肾保肾活性物质是开发药源的重要途径之一。Nasri等[18]对虾虎鱼蛋白水解物进行研究,发现其水解物可有效改善高脂饮食导致的大鼠肾损伤。赵海峰等[19]曾对海洋胶原肽对腺嘌呤所致的大鼠慢性肾损伤进行研究,以深海鲑鱼的鱼皮为主要原材料,生物酶法制备混合寡肽,灌胃小鼠。结果发现:海洋胶原肽干预组小鼠不同时间点中血清肌肝、尿素氮较模型组大鼠血清的相应指标明显降低,而肌醉清除率则明显高于模型组,超微结构的改变也较模型组减轻。
本研究按提取条件提取所需量的MMO,将小鼠分组、给药。小鼠体质量指标与肾脏指数指标显示:模型组体质量增幅明显高于正常组与各药物组,小鼠肾脏指数显著升高;而各药物组小鼠体质量增幅下降,肾脏指数均低于模型组。由此说明造模较为成功,MMO可降低小鼠的肾脏指数。
有研究表明长期高脂饮食会使机体脂肪代谢异常,引起高脂血症,其主要是以LDL-C、TC、TG含量的上升,HDL-C含量下降为主要特征[20]。高脂血使脂质在肾脏沉积,直接损伤肾脏。人体中TC、TG主要在肝脏中合成,两者的血清浓度反映出脂代谢的水平。HDL可将周围组织TC运输到肝脏,再转化为胆汁酸或通过胆汁从肠道排出,所以HDL-C浓度与动脉管腔狭窄程度呈负相关。LDL可以将胆固醇从肝脏运输至外周组织细胞,当其含量过高时,它所携的TC便会在动脉壁堆积而引起动脉硬化,故而LDL-C浓度与动脉管腔狭窄程度呈正相关[21]。本实验发现模型组小鼠TC、TG、LDL-C含量显著升高,HDL-C含量下降,AI指数显著升高,说明高脂饮食诱发高脂血症,高血脂继而损害全身动脉产生动脉粥样硬化,而MMO可有效降低小鼠血清TC、TG、LDL-C含量,升高HDL-C含量,并降低AI指数,降幅达到67.27%。说明MMO可减轻高脂血症。
很多研究发现氧化应激在肾损伤中也发挥着重要作用[22-23]。脂质过氧化会产生活性氧,而过量活性氧会损伤细胞、组织,加重动脉粥样硬化和肾病的发生,SOD与GSH-Px活力可以反映出机体抗氧化能力,MDA是脂质过氧化产物,多集中沉积于肾脏、肝脏、睾丸、心肌等组织细胞内,能破坏细胞膜结构使细胞死亡,反应出机体受自由基损伤程度[24]。本实验发现:模型组肾匀浆SOD与GSH-Px活力下降,与MDA含量增多相一致,MMO高剂量组GSH-Px、SOD活力与模型组相比,显著升高(P<0.05),MDA含量则显著降低(P<0.05),因此,MMO可提高小鼠肾脏抗氧化水平,减轻小鼠肾损伤。
脂代谢紊乱导致的脂质沉积、肾脏系膜基质增多、肾小球系膜扩张以及巨噬细胞增殖和聚集等最终可导致肾小球硬化和肾间质纤维化[25]。本实验通过HE染色,观察MMO对肾脏病理学影响,高脂饲料组小鼠肾脏损伤严重,主要体现在肾组织切面苍白,系膜细胞与系膜基质增生,肾小管结构不清晰并有明显空泡变性损伤,周围可见炎症细胞浸润;MMO给药组则明显改善了肾脏受损情况,肾浊肿减轻,系膜细胞与系膜基质增生有所抑制,肾小管空泡变性症状减轻,MMO高剂量组与阳性药物组肾脏形态差别不大。
肾小管间质纤维化是各种病因导致的慢性肾脏疾病的主要特征[26]。肾组织中α-SMA、TGF-β1的大量表达与肾间质纤维化、肾小球硬化、肾功能丧失等有明显的相关性[27]。有研究表明肾小管上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)是肾小管间质纤维化的重要机制之一[28-29]。即是指肾小管上皮细胞转化为肌成纤维细胞(myofibro-blast,MF)、纤维细胞而失去上皮细胞的特性。这一过程涉及4 个关键步骤:1)上皮细胞失去极性和黏附特性;2)重新表达α-SMA。正常情况下上皮细胞表达的是角蛋白(cytokeratin,CK),在EMT过程中,CK表达降低,α-SMA及波形纤维蛋白作为间充质细胞的标志表达量增多,结构蛋白重组成为MF;3)肾小管基底膜破裂;4)细胞迁移、侵袭力增强。MF进入间质,细胞外基质增多,形成肾小管间质纤维化[30-31]。在EMT的调节因子中,TGF-β1被认为是最主要的促纤维化因子[32-33],在肾小管和肾小球足细胞转分化过程中发挥着重要作用[34]。有研究证实,肾小管上皮细胞在不同浓度TGF-β诱导下,逐渐丧失“铺路石样”状态而转变为纤维细胞表型[35]。本实验研究结果表明:高脂饲料组肾组织中α-SMA、TGF-β1表达量明显增加,说明高脂饮食可诱导肾小管上皮细胞-间充质的纤维化而引进慢性肾病变,而应用MMO后,α-SMA、TGF-β1的表达明显下降,结合肾的HE染色结果,认为由于MMO组的肾损伤程度小于模型组,肾小管上皮细胞的间质纤维化减轻,这是导致α-SMA和TGF-β1表达下降的原因。至于MMO通过何种信号途径导致α-SMA和TGF-β1表达下降需要以后的实验来进一步证实。
综上所述,高脂饮食能引起高脂血症,提高小鼠血清AI指数,降低肾脏抗氧化酶活性,使α-SMA、TGF-β1表达量增加,促进肾小管上皮细胞转分化的发生;MMO则可改善小鼠高血脂症状,提高肾脏抗氧化水平,缓解肾小管间质纤维化,从而保护肾脏免受损伤。
参考文献:
[1] 王惠. 文蛤多肽Mere15的抗肿瘤机制研究[D]. 青岛: 中国科学院海洋研究所, 2012: 10-11.
[2] SUPATRA K, SOOTTAWAT B, HIDEKI K,et al. Chemical compositions and nutritional value of Asian hard clam (Meretrix lusoria) from the coast of Andaman Sea[J]. Food Chemistry, 2013,141(4): 4138-4145. DOI:10.1016/j.foodchem.2013.07.001.
[3] 王翠翠. 文蛤多肽的分离纯化及抗肿瘤机制研究[D]. 青岛: 中国科学院海洋研究所, 2011: 13-17.
[4] SCHMEER M R. Growth-inhibiting agents from Mercenaria extracts:chemical and biological properties[J]. Science, 1964, 144: 413-414.DOI:10.1126/science.144.3617.413.
[5] SCHMEER A C. Chemical characterization and biological activity of an anticancer agent of marine origin[J]. Physiological Chemistry and Physics, 1979, 11(5): 415-424.
[6] 范成成. 文蛤多肽的研究与应用[D]. 厦门: 厦门大学, 2009: 1-2.
[7] 张绵松. 酶法制备文蛤ACE抑制肽的研究[D]. 无锡: 江南大学,2008: 44-45.
[8] HUANG F F, ZHAO S S, YU F M, et al. Protective effects and mechanism of Meretrix meretrix oligopeptides against nonalcoholic fatty liver disease[J]. Marine Drugs, 2017, 15(2): 1-13. DOI:10.3390/md15020031.
[9] 王佳佳, 赵莎莎, 杨最素, 等. 文蛤寡肽对小鼠急性肝损伤的保护作用研究[J]. 食品科学, 2017, 38(13): 190-195. DOI:10.7506/spkx1002-6630-201713031.
[10] MOORHEAD J F, CHAN M K, EI-NAHAS M, et al. Lipid nephrotoxicity in chronic progressive glomerular and tubulo-interstitial disease[J]. The Lancet, 1982, 320: 1309-1311. DOI:10.1016/S0140-6736(82)91513-6.
[11] SHUBHA A, GEORGE A K. Treatment of hyperlipidemia changes with level of kidney function-rationale[J]. Advances in Chronic Kidney Disease, 2016, 23(4): 247-254. DOI:10.1053/j.ackd.2015.12.004.
[12] 张建新, 张立佳, 王临宾, 等. 黄粉虫油对高脂血症小鼠血脂水平及抗氧化能力的影响[J]. 食品科学, 2011, 32(5): 263-266.
[13] 纪学芳, 徐怀德, 刘运潮, 等. 光皮木瓜黄酮和多糖降血脂与抗氧化作用研究[J]. 中国食品学报, 2013, 13(9): 1-7. DOI:10.16429/j.1009-7848.2013.09.001.
[14] 李孟婕, 范秀萍, 吴红棉, 等. 翡翠贻贝粗多糖降血脂作用的研究[J].食品科学, 2012, 33(1): 257-261.
[15] 刘合生, 戚向阳, 曹少谦, 等. 杨梅乙醇提取物对小鼠酒精性肝损伤的保护作用[J]. 中国食品学报, 2014, 14 (8): 34-40. DOI:10.16429/j.1009-7848.2014.08.033.
[16] 田颖刚, 黄宇玫, 张丽, 等. 丝羽乌骨鸡活性肽对顺铂所致小鼠肾损伤的防护作用[J]. 中国家禽, 2015, 37(14): 25-29. DOI:10.16372/j.issn.1004-6364.2015.14.006.
[17] 孙青. 大豆肽对大鼠血脂代谢的影响及其抗动脉粥样硬化机理研究[D]. 济南: 山东大学, 2013: 1-3.
[18] NASRI R, ABDELHEDI O, JEMIL I, et al. Ameliorating effects of goby fish protein hydrolysates on high-fat-high-fructose dietinduced hyperglycemia, oxidative stress and deterioration of kidney function in rats[J]. Chemico-Biological Interactions, 2015, 242: 71-80.DOI:10.1016/j.cbi.2015.08.003.
[19] 赵海峰, 张召锋, 李琼, 等. 海洋胶原肽延缓腺嘌呤所致大鼠慢性肾功能损伤[J]. 中华预防医学杂志, 2008, 42(4): 231-234.
[20] 胡文兵, 赵静, 陈婷婷, 等. 青钱柳多糖对高脂血症小鼠的降血脂作用及机制初探[J]. 现代食品科技, 2015, 31(11): 39-44.
[21] 张影. 紫甘薯酒对高脂饮食C57BL/6J小鼠脂代谢的调节及抗氧化活性研究[D]. 成都: 四川农业大学, 2013: 34-35.
[22] FAROOQUI Z, AHMED F, RIZWAN S, et al. Protective effect of Nigella sativa oil on cisplatin induced nephrotoxicity and oxidative damage in rat kidney[J]. Biomedicine and Pharmacotherapy, 2017, 85:7-15. DOI:10.1016/j.biopha.2016.11.110.
[23] LI C Z, JIN H H, SUN H X, et al. Eriodictyol attenuates cisplatin-induced kidney injury by inhibiting oxidative stress and inflammation[J]. European Journal of Pharmacology, 2016, 772(5):124-130. DOI:10.1016/j.ejphar.2015.12.042.
[24] 王林林. 海藻溴酚化合物对糖尿病大鼠肾损伤保护作用的研究[D].青岛: 青岛大学, 2012: 23-25.
[25] MUNOZ-GARCIA B, MORENO J A, LOPEZ-FRANCO O, et al.Tumor necrosis factor-like weak inducer of apoptosis (TWEAK)enhances vascular and renal damage induced by hyperlipidemic diet in ApoE-knockout mice[J]. Arteriosclerosis, Thrombosis and Vascular Biology, 2009, 29(12): 2061-2068. DOI:10.1161/ATVBAHA.109.194852.
[26] 王瑞. 高胆固醇血症肾损害的机制及辛伐他汀的干预作用[D]. 武汉: 武汉大学, 2010: 40-41.
[27] 李晶晶. DPP-4抑制剂西格列汀对高脂饮食诱导的apoE基因敲除小鼠肾损伤的保护作用及其机制研究[D]. 广州: 南方医科大学, 2014:67-71.
[28] LIU Y H. Renal fibrosis: new insights into the pathogenesis and therapeutics[J]. Kidney International, 2006, 69(2): 213-217.DOI:10.1038/sj.ki.5000054.
[29] ZEISBERG M, KALLURI R. The role of epithelial-mesenchymal transition in renal fibrosis[J]. Journal of Molecular Medicine, 2004,82(3): 175-181. DOI:10.1007/s00109-003-0517-9.
[30] 王轩, 袁伟杰. 肾小管上皮细胞转分化类型及其在肾脏疾病进展中的作用[J]. 中国病理生理杂志, 2012, 28(10): 1906-1909.
[31] 姚俊霞, 吴人亮. 肾小管上皮细胞转分化与肾小管间质纤维化[J].中国现代医学杂志, 2008, 18(11): 1561-1564.
[32] 吴睿轩, 胡振奋, 程锦国, 等. 温莪术对TGF-β1诱导的肾小管上皮细胞转分化的影响[J]. 中国中西医结合杂志, 2013, 33(7): 972-977.
[33] 周巧丹. Erbin对TGF-β1诱导肾小管上皮细胞转分化的作用和机制研究[D]. 武汉: 华中科技大学, 2012: 1-5.
[34] YAMAGUCHI Y, IWANO M, SUZUKI D, et al. Epithelialmesenchymal transition as a potential explanation for podocyte depletion in diabetic nephropathy[J]. American Journal of Kidney Diseases, 2009, 54(4): 653-664. DOI:10.1053/j.ajkd.2009.05.009.
[35] HILLS C E, SIAMANTOURAS E, SMITH S W, et al. TGF-β modulates cell-to-cell communication in early epithelial-tomesenchymal transition[J]. Diabetologia, 2012, 55(3): 812-824.DOI:10.1007/s00125-011-2409-9.
Protective Effect of Meretrix meretrix Oligopeptides on Kidney Injury Induced by High Fat Diet in Mice
WANG Jiajia, YE Lei, YANG Zuisu*, YU Fangmiao, DING Guofang
(Zhejiang Provincial Engineering Technology Research Center of Marine Biomedical Products, School of Food Science and Pharmaceutics of Zhejiang Ocean University, Zhoushan 316022, China)
Abstract:The protective effect of Meretrix meretrix oligopeptide (MMO) on high fat diet-induced kidney injury in mice was examined. A chronic kidney injury model was established by feeding a high fat diet to mice, and then the mice were lavaged with MMO for 30 days. Kidney index was measured, and serum triglyceride (TG), total cholesterol (TC), high density lipoprotein cholesterol (HDL-C) and low density lipoprotein cholesterol (LDL-C) contents were determined as well as superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and malondialdehyde (MDA) levels in kidney homogenate.In addition, atherosclerosis index (AI) was calculated and renal pathological changes were examined by hematoxylin-eosin(HE) staining. Immunohistochemical staining was used to detect the protein expression of α-SMA and TGF-β1 in kidney tissue. The results showed that treatment with MMO significantly decreased kidney index, serum TG, TC and LDL-C levels and AI and increased serum HDL-C level as compared to the model group. Treatment with MMO significantly elevated SOD and GSH-Px activities and lowered MDA level in liver homogenate. The immunohistochemical assay showed that MMO markedly down-regulated the protein expression level of α-SMA and TGF-β1 in kidney tissue. Therefore, MMO can effectively protects against chronic kidney injury induced by high fat diet in mice.
Keywords:Meretrix meretrix oligopeptides; high fat diet; kidney injury; protective effect
DOI:10.7506/spkx1002-6630-201815022
收稿日期:2017-02-22
基金项目:浙江省自然科学基金项目(LY15C200016;LQ16H300001);舟山市级公益类科技项目(2015C31012)
第一作者简介:王佳佳(1991—),女,硕士研究生,研究方向为海洋药物、海洋功能食品。E-mail:1354193287@qq.com
*通信作者简介:杨最素(1967—),女,教授,博士,研究方向为海洋药物、海洋功能食品。E-mail:yangzs87@163.com
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2018)15-0145-07
引文格式:
王佳佳, 叶蕾, 杨最素, 等. 文蛤寡肽对高脂饮食诱导小鼠肾损伤的修护作用[J]. 食品科学, 2018, 39(15): 145-151.DOI:10.7506/spkx1002-6630-201815022. http://www.spkx.net.cn
WANG Jiajia, YE Lei, YANG Zuisu, et al. Protective effect of Meretrix meretrix oligopeptides on kidney injury induced by high fat diet in mice[J]. Food Science, 2018, 39(15): 145-151. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815022. http://www.spkx.net.cn