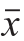 ±s表示,组间差异比较采用单因素方差分析,两两比较方差齐时采用LSD检验法,方差不齐时采用Dunnett’s T3进行比较。
±s表示,组间差异比较采用单因素方差分析,两两比较方差齐时采用LSD检验法,方差不齐时采用Dunnett’s T3进行比较。徐德峰1,2,3,马忠华2,*,赵谋明3,*,张 婷2,苏国万3,赵子健1,聂奇倩1
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研究中心,水产品深加工广东普通高等学校重点实验室,广东 湛江 524088;2.华南理工大学轻工与食品学院,广东 广州 510640;3.无限极(中国)有限公司技术中心,广东 广州 510665)
摘 要:为评价4 种食源性肽口服后对SD大鼠光老化皮肤弹性的改善效果并探讨其力学机制,将健康成年雌性SD大鼠随机分为空白对照组、紫外线(ultraviolet,UV)辐照模型组、4 种活性肽摄取组,空白组不施行UV辐照,模型组及肽组均行UVA+UVB联合辐照,4 种活性肽分别配制成0.3、0.9、1.5 g/L的含肽水溶液口服,脱毛后连续UV辐照18 周至光老化模型建立,测定皮肤弹性后将动物处死,取其背部皮肤制备匀浆,生化法测定羟脯氨酸和透明质酸含量,酶联免疫吸附法检测Ⅰ型胶原蛋白(collagen I,Col I)、III型胶原蛋白(Col III)含量及基质金属蛋白酶-1(matrix metalloproteinase-1,MMP-1)活力,另取部分皮肤组织进行石蜡包埋、切片后进行苏木精-伊红染色观察。结果表明,与空白组相比,模型组大鼠皮肤弹性,Col I、羟脯氨酸、透明质酸含量显著降低(P<0.05),而Col III含量及MMP-1活力显著升高(P<0.05),组织化学显示皮肤表皮增生,真皮层胶原纤维排列紊乱、且断裂呈片段化聚集扭曲,基底膜溶解呈扁平化。与模型组相比,4 种活性肽口服后均能改善皮肤弹性,且样品2效果最显著,其皮肤组织中Col I、羟脯氨酸、透明质酸含量显著升高(P<0.05),而Col III含量及MMP-1活力显著降低(P<0.05)。组织化学显示样品2摄食组大鼠表皮增生明显改善,真皮层增厚、胶原纤维增加,排列趋向均匀化致密分布,不同程度上恢复到空白组波浪状规律排列,提示样品2提高光老化SD大鼠皮肤弹性的机理在于促进了胞外基质(extracellular matrix,ECM)的生物合成,抑制了ECM降解酶MMP-1活力,修复了受损皮肤的力学结构。
关键词:活性肽;口服暴露;SD大鼠;皮肤光老化
皮肤老化所造成的以皱纹为典型代表的各种损美性表现是当今皮肤科学的研究热点,皮肤老化与抗衰老是当今皮肤科学的研究热点,紫外线(ultraviolet,UV)辐射引起的皮肤光老化是皮肤外源性衰老的主要原因[1-3]。光老化导致皮肤过早出现表面粗糙、弹性下降、黑色素沉积等损美性症状,严重影响人们的外表自信心。随着社会进步和审美标准的不断提高,人们对皮肤光老化的防治越来越重视。弹性下降是皮肤老化的重要指标,弹性评估是护肤品抗皱功效评价的重要方面。目前,国内外化妆品市场上抗皱产品种类繁多,但总体来看大多以动植物天然提取物为功效因子[4-6],在使用方法上主要以局部外用为主,功效成分经皮吸收后发挥抗皱作用[5]。鉴于皮肤组织致密的“砖墙结构”,只有小于3 000 Da的分子才能透皮吸收,另外功效成分大多在化学结构上稳定性较差,长时间暴露于紫外线等环境下极易分解,失去本身应有的抗衰功能甚至产生有毒物质[4,7-10]。因此,通过内在途径修复老化细胞弹性结构,调整胞外基质组成,已是新一代功能性化妆品产品开发的必然趋势。
口服VC、VE、黄酮、多糖、肽类物质可改善皮肤皱纹,减轻或修复光老化皮肤损伤[7-9]。自Mellander 1950年首次揭示食源性肽具有生物活性以来,食源性生物活性肽的生物功能就一直引起科学家的兴趣和关注[10]。作为蛋白质特定片段,生物活性肽的多种生物功能已被报道,其中改善人和动物皮肤老化的一些活性肽也有报道[11-14]。Chen等[11]通过生物酶解技术制备了鳕鱼皮胶原蛋白肽,并通过小鼠口服实验评价了平均分子质量在1 200 Da的胶原蛋白肽对光老化小鼠皮肤的修复效果,证明该肽可显著抑制MMPs的表达,降低丝裂原活化蛋白(mitogen-activated protein kinase,MAPK)信号通路关键蛋白的磷酸化水平,通过抑制MMPs的表达和活性而显著改善光诱导的皮肤老化。此外,在人体抗衰老性能评价方面,Proksch等[12]对114 名年龄45~65 岁女性随机接受2.5 g胶原蛋白肽或相应安慰剂连续8 周口服暴露,通过双盲实验评价了胶原蛋白特定生物活性肽VERISOL(R)在控制眼睑部位皮肤皱纹形成,刺激前胶原蛋白、弹性蛋白、原纤蛋白生物合成方面的作用,证实口服特定生物活性肽BCP可减少皮肤皱纹,并对真皮基质合成有良好促进效果。基于食源性活性肽在改善皮肤光老化方面的良好应用前景,本研究对4 种食源性活性肽进行口服暴露,评价各自改善光老化皮肤弹性的效果,并基于皮肤弹性的物质基础和力学结构比较分析各种食源性活性肽的作用机制,为筛选具有显著改善皮肤光老化效应的活性肽及产品开发提供参考。
健康雌性SPF级SD大鼠168 只,购自广州中医药大学实验动物中心提供,体质量180~200 g,实验动物生产许可证号:SCXK(粤)2013-0034,质量合格证号:No.44005800002875。新鲜基础鼠粮及清洁刨花垫料购自广州市花都区实验动物养殖场。
食源性肽样品1:狭鳕皮肤胶原蛋白肽 广州维晟生物科技有限公司;样品2:弹性蛋白肽 无限极(中国)有限公司技术中心;样品3:鲣鱼动脉球弹性蛋白肽 日本Hayashikane Sangyo公司;核桃肽由华南理工大学赵谋明教授惠赠。
硫化钠 济宁宏明化学试剂有限公司;I型胶原蛋白(collagen I,Col I)、III型胶原蛋白(Col III)、羟脯氨酸、透明质酸、苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒 南京建成生物公司。
紫外光辐照箱为本实验室自行设计安装,已获专利授权[15];紫外线灯管(UVA 340-40WT12-G13,波长范围320~400 nm,波峰340 nm;UVB 313-40WT12-G13,波长范围300~320 nm,波峰313 nm) 荷兰Philips公司;UV-A型、UVB297型紫外辐照计 北京师范大学光电仪器厂;1510全波长酶标仪 赛默飞世尔科技有限公司;BS-110S电子天平 北京赛多利斯天平有限公司;5424R台式微量高速离心机 德国Eppendorf公司;cx31倒置荧光显微镜 日本Olympus公司;7002超低温冰箱美国Thermo公司;wi79674型斩鼠器 东西仪(北京)科技有限公司;大鼠实验笼 苏州市苏杭科技器材有限公司;FC1502皮肤分析仪 深圳凯尔电子厂。
1.3.1 动物分组与模型建立
SD大鼠饲养在专用鼠笼中,环境设施符合实验动物清洁级要求,室温20~25 ℃,相对湿度40%~70%,自然昼夜交替。动物实验遵守实验动物伦理学要求,大鼠经适应性喂养一周,随机分为空白组,模型组,样品1、2、3及核桃肽低、中、高剂量摄食组,共14 组,每组12 只,各组大鼠分2 笼饲养,每笼6 只,空白组与模型组以清洁自来水为唯一饮用水,样品低、中、高剂量饲喂组在清洁自来水中分别加入终质量浓度0.3、0.6、0.9 g/L的样品1、2、3及核桃肽,饲料为基础饲料,自由摄食。适应性饲养1 周后开始辐照,适应性饲养1 周后开始辐照,空白组不进行辐照外其余各组进行等量辐照。参照文献[16-17],用记号笔画出背部脊柱两侧约5.0 cm×5.0 cm区域并用电推剪剃除毛发,每次辐照前剃毛并进行Na2S化学脱毛,将脱毛后大鼠放入自制固定器中暴露背部剃毛皮肤,然后连同固定器和大鼠置于紫外线光源(UVA+UVB)正下方40 cm处进行紫外辐照,紫外辐照计测得该处UVA强度为177.9 mW/cm2,UVB强度为59.6 mW/cm2。起始量为10 min/d,隔天1 次,每1 周递增10 min至30 min/d,并以30 min/d 维持18周至皮肤外观呈典型老化状态表示造模结束,累计照射剂量为UVA 150.88 J/cm2,UVB 78.67 J/cm2,紫外辐照结束后将各组大鼠进行观察拍照。
1.3.2 指标检测
1.3.2.1 弹性测定
采用FC1502皮肤分析仪按照说明书进行测定。1.3.2.2 ECM含量检测
参照文献[18],取脱毛后背部中央皮肤组织1 g左右,在预冷的生理盐水中漂洗,去除皮下脂肪和结缔组织,滤纸拭干称质量,量取9 倍质量预冷生理盐水,将组织充分剪碎后在组织匀浆机冰浴下制成10%皮肤匀浆。生化法测定皮肤组织匀浆中羟脯氨酸、透明质酸含量,酶联免疫吸附试验试剂盒测定胶原蛋白含量及MMP-1活力,具体按照试剂盒说明书进行测定。
1.3.2.3 皮肤组织结构分析
参照文献[19-20],取脱毛后背部中央皮肤组织1 g左右,在预冷的生理盐水中漂洗,去除皮下脂肪和结缔组织,多聚甲醛固定,石蜡包埋后常规切片与HE染色观察。
使用SPSS 16.0软件对数据进行统计,实验数据以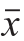 ±s表示,组间差异比较采用单因素方差分析,两两比较方差齐时采用LSD检验法,方差不齐时采用Dunnett’s T3进行比较。
±s表示,组间差异比较采用单因素方差分析,两两比较方差齐时采用LSD检验法,方差不齐时采用Dunnett’s T3进行比较。
皮肤弹性反映了皮肤的力学性能,皮肤弹性与皱纹量呈负相关,而皱纹量又与皮肤老化程度呈正相关,因此皮肤弹性也可间接反映皮肤的衰老状态,光老化对皮肤弹性的影响及4 种食源性活性肽对光老化皮肤弹性的提升效果见图1。与空白对照组相比,模型组大鼠皮肤弹性显著降低,表明皮肤呈严重衰老状态,而4 种食源性活性肽干预组大鼠皮肤弹性得到不同程度提升,在低剂量时弹性开始改善,中、高剂量时达到显著性水平(P<0.05),表明肽对皮肤光老化有不同程度的修复作用,不同活性肽改善光老化皮肤弹性有明显差异,其中以样品2最为显著,样品1和核桃肽其次,样品3效果相对较差。

图 1 4 种食源性肽对SD大鼠皮肤弹性的影响
Fig. 1 Effects of four kinds of food-derived peptides on the elasticity of UV-exposed skin of SD rats
细胞外基质成分与皮肤力学性能密切相关,良好的胞外基质成分构成与排列是维持皮肤良好弹性的物质基础。皮肤蛋白中75%由胶原蛋白组成,胶原蛋白维持着皮肤的弹性和水润状态[21],皮肤中胶原蛋白的含量是皮肤衰老的重要指标。皮肤中胶原蛋白有多种类型,其中与弹性相关的主要为Col I和Col III,在皮肤衰老进程中,Col I含量下降而Col III含量上升,调整二者比例则在一定程度上起到抗衰老效果[22]。由图2a、b可以看出,与空白对照组相比,模型组大鼠皮肤组织中Col I含量显著下降而Col III含量极显著上升(P<0.01),表明造模成功。与模型组相比,4 种食源性活性肽干预后可不同程度调整胶原蛋白类型和含量,尤其是Col I含量差异显著,低剂量时Col I轻微升高,中、高剂量时不同活性肽增加Col I含量差异较大,样品2和核桃肽均可显著提升Col I含量,而样品1和3效果相对较弱。在降低Col III含量方面,虽然不同肽在整体上都呈剂量-效应趋势,但降低幅度均未达到显著性水平,综合比较以样品2效果最好。Hinek等[22]采用蛋白激酶K对牛颈部蛋白进行酶解,制备分子质量在10 kDa以下的蛋白酶解物,命名为Prok-60,并在细胞和动物水平上证实Prok-60肽类物质可显著促进真皮成纤维细胞胞外基质Col I胶原蛋白和弹性蛋白的生物合成,从而增强皮肤弹性对抗皮肤衰老,与本研究结果较为一致。
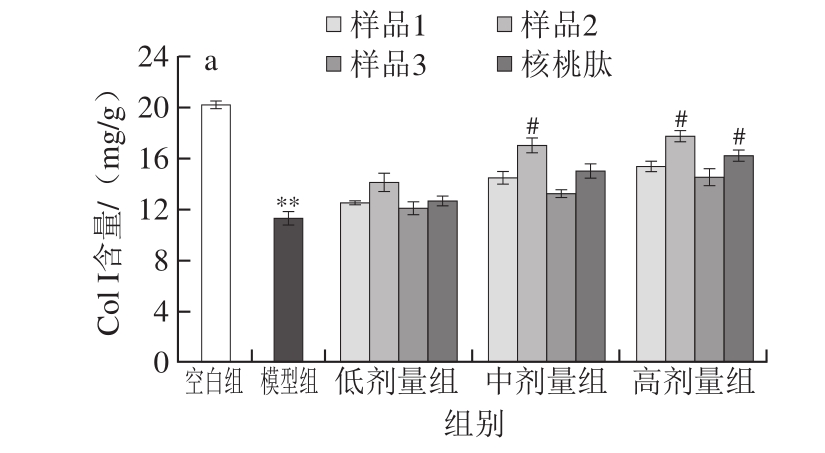

图 2 4 种食源性肽对SD大鼠皮肤ECM主要成分的影响
Fig. 2 Effects of four kinds of food-derived peptides on major components of extracellular matrix in UV-exposed skin of SD rats
a. Col I含量;b. Col III含量;c.羟脯氨酸含量;d.透明质酸含量;**.与空白组相比,差异极显著(P<0.01);##.与模型组相比,差异极显著(P<0.01)。下同。
羟脯氨酸是胶原蛋白特有的一种非必需氨基酸,其含量相对恒定,约占胶原蛋白总量的13%,直接反应真皮内胶原纤维的含量变化,从而能够作为判定皮肤衰老程度的一个敏感指标[23]。由图2c可以看出,与空白组相比,模型组大鼠皮肤组织羟脯氨酸含量显著减少,达到极显著水平(P<0.01),4 种肽口服干预后羟脯氨酸含量呈量-效提高,其中以样品2和核桃肽提升效果优于样品1和样品3,在中、高剂量时提升效果均达到显著性水平(P<0.05)。多项研究表明,透明质酸不仅对保持皮肤水分、维持皮肤结构起重要作用,而且具有促进皮肤再生、增强皮肤弹性、降解皮肤中自由基的功能[24-25]。本研究证实,与空白组相比,模型组大鼠皮肤组织透明质酸含量显著降低(P<0.01),而4 种活性肽可在不同程度上提升透明质酸含量,提高皮肤弹性,在中、高剂量时所有样品均可显著提升透明质酸含量(P<0.05),但以样品2效果最为突出。
MMPs的产生影响胶原纤维合成,使得真皮层内胶原纤维明显减少,排列稀疏紊乱。MMP-1是胶原蛋白降解酶,可将大分子胶原蛋白降解成片段化,然后片段化胶原蛋白进一步浓缩聚集,失去弹性结构,MMP-1活力高低与皮肤衰老状态呈正相关[26-29]。表皮是MMP-1的主要来源,在急性UV辐照下MMP-1快速产生,之后迁移至真皮层降解胶原纤维,MMP-1含量升高是介导胶原纤维结构劣变的关键步骤[30],UVA+UVB联合辐照对SD大鼠皮肤组织MMP-1表达的影响及活性肽干预效应见图3。
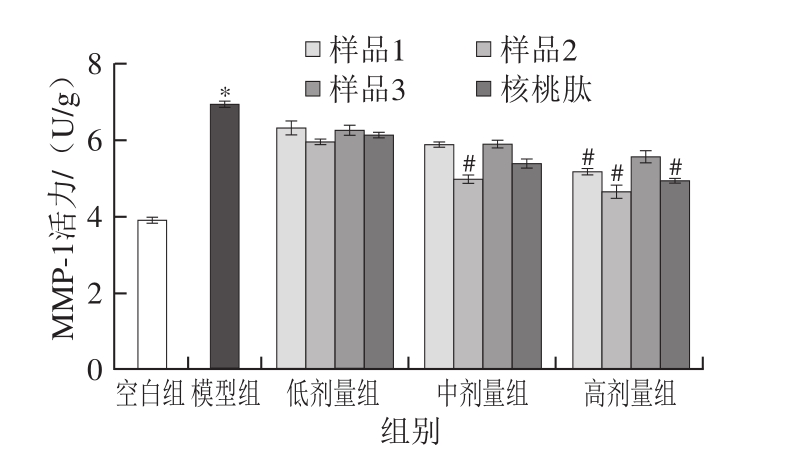
图 3 4 种食源性肽对SD大鼠皮肤MMP-1活力的影响
Fig. 3 Effects of four kinds of food-derived peptides on MMP-1 activity in UV-exposed skin of SD rats
由图3可以看出,模型组MMP-1活力显著高于空白对照组(P<0.05),表明光刺激激活了MMP-1表达,4 种食源性肽口服干预后MMP-1活力呈剂量-效应趋势下调,表明所选活性肽抑制了MMP-1表达,且不同活性肽抑制能力存在显著差异,样品2在中剂量时可显著抑制MMP-1活力(P<0.05),而核桃肽和样品1要在高剂量时才能达到显著性水平,因此样品2修复光老化效果更好。
组织病理学改变是皮肤光老化的重要评价指标之一,弹性良好的皮肤其表皮和真皮层物理屏障结构均维持平衡状态。在皮肤光老化过程中,长期紫外线照射可损伤表皮角质形成细胞,造成表皮细胞分化紊乱,细胞更替和角质剥脱延缓,引起结构紊乱,表皮反应性增生[31-32],表现为表皮增厚、真皮层变薄、基底膜变平、结构不清晰,真皮组织内纤维性成分变性扭曲。皮肤组织病理学实验可进一步解释皮肤光老化进程中的组织学特征及食源性活性肽的干预效应,将抗衰效果最明显的样品2进行组织切片和HE染色观察,结果见图4。
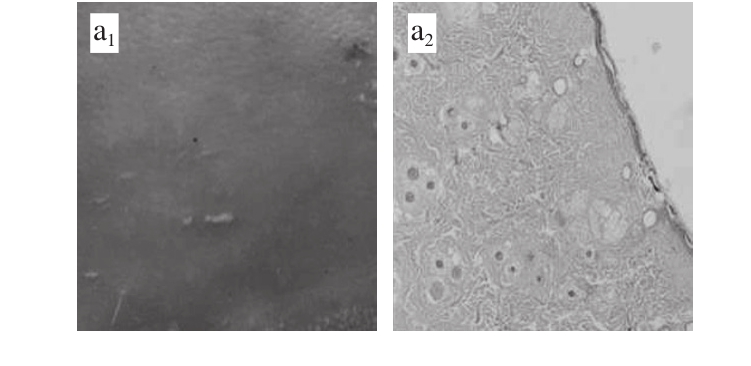
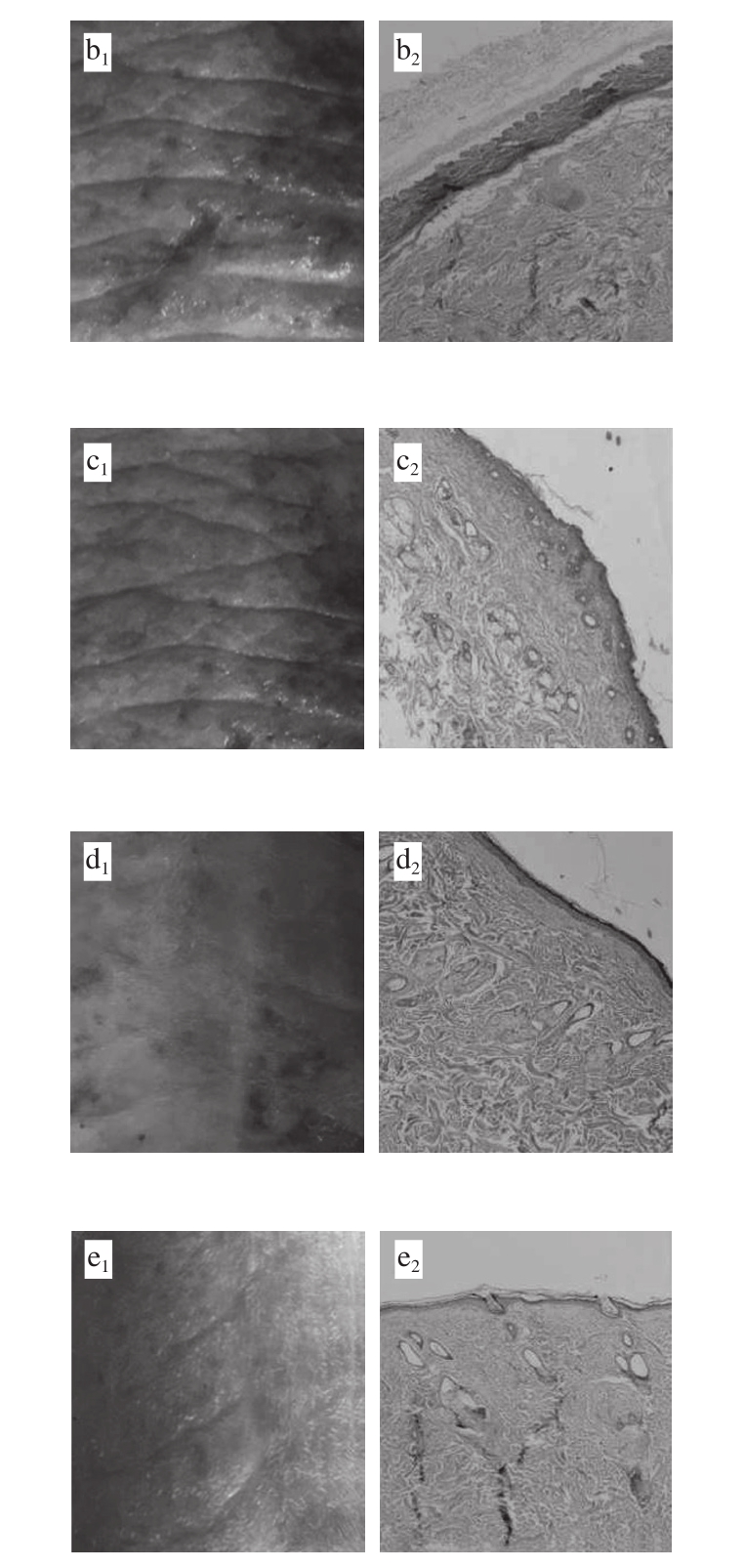
图 4 食源性样品2对SD大鼠皮肤组织结构的影响(200×)
Fig. 4 Effect of elastin-derived peptide 2 on the microstructure of skin in SD rats (200 ×)
a.空白组;b.模型组;c~e.分别为低、中、高剂量组;下标1.组织切片照片;下标2. HE染色光学显微镜照片。
由图4可以看出,空白组皮肤细腻、平坦少皱纹,表皮正常、结构完整,真皮胶原纤维呈波浪状排列,整齐有序,分布均匀,血管正常,细胞成分及数量适中。与空白组相比,模型组皮肤有明显红斑反应,较多深大横向皱纹,表皮不规则增厚,真皮胶原纤维变性、排列紊乱、卷曲、断裂、疏密分布不均、附属器增生。与模型组相比,样品2干预后除了宏观皱纹显著减少外,其微观结构中表皮增生也得到显著抑制,且效果与肽质量浓度呈一定的剂量反应性。Chen等[9]在为期3 个月的实验周期内,将EGb-761肽于UVB辐照前1 h以2 mg/mL涂抹于BALB/c小鼠背部,可显著减少表面粗大皱纹量,HE染色证实在组织化学水平上可降低表皮增生,降低光老化损伤,证明肽可通过改善光老化皮肤组织结构而发挥抗衰老作用,其实验结果与本研究相近。
光老化是当今皮肤科学基础研究和技术开发的热点[1-3],弹性及皱纹状况是衰老评价的重要指标,基于提升弹性从而改善皱纹是目前皮肤抗衰老产品开发的基本思路。鉴于皮肤组织致密的致密性,以及功效成分在结构上稳定性较差,内在途径修复老化细胞弹性结构,调整胞外基质组成,已是新一代功能性化妆品产品开发的必然趋势[32]。已有的多项研究表明口服抗氧化天然成分、多糖或肽类物质可减轻光老化所致皮肤皱纹[5,7-8,11-12],本研究基于已有的衰老理论和活性肽研究开发技术进展,在初步筛选几种食源性活性肽的基础上,通过复制皮肤光老化动物模型,考察各自对光老化皮肤弹性的提升效果,证明样品2在中、高剂量时可显著提升皮肤弹性,具有良好的抗衰功效,是保健食品开发的首先基料。
皮肤弹性等力学性能与ECM成分和排列结构密切相关。在ECM成分中,胶原纤维、羟脯氨酸和透明质酸的质量状况直接影响皮肤的老化程度,胶原纤维结构的改变及胶原蛋白含量的减少是导致皮肤衰老的重要原因,真皮层胶原纤维是皮肤组织的主要结构蛋白,胶原纤维的片段化是人类皮肤衰老的主要特征[23,29]。羟脯氨酸是胶原蛋白特有的一种非必需氨基酸,其含量相对恒定,约占胶原蛋白总量的13%,可直接反应真皮内胶原纤维的含量变化,从而能够作为判定皮肤衰老程度的一个敏感指标。透明质酸不仅对保持皮肤水分、维持皮肤结构起重要作用,而且具有促进皮肤再生、增强皮肤弹性、降解皮肤中自由基的功能[26-27]。因此,促进ECM主要成分胶原纤维、羟脯氨酸和透明质酸的生物合成,抑制ECM结构性降解是维持皮肤弹性的重要途径。本研究发现紫外线辐射后皮肤表皮层增生明显,真皮层厚度显著降低,羟脯氨酸和透明质酸含量显著减少,且MMP-1表达增强,提示紫外线辐射导致皮肤胶原蛋白分解增多,使皮肤胶原蛋白含量减少,真皮层变薄。4 种活性肽口服干预后,可见ECM成分发生响应式表达上调,且胶原纤维片段化聚集得到明显抑制,重现波浪形横纹带,表明光老化受损结构得到不同程度的修复而功能得到相应恢复。
本研究通过组织学和皮肤生化指标的测定,说明口服一定剂量的活性肽能增加光老化大鼠皮肤胶原的厚度,使胶原纤维的排列更为致密,提高皮肤弹性,增加胶原蛋白的含量,初步证实了活性肽可能是通过刺激皮肤胶原蛋白的合成,并减少降解,以达到抗皮肤光老化的作用。因此,基于本实验结果可概括出光诱导皮肤皱纹形成的物质与结构基础及活性肽样品2抗皱机制,具体见图5。
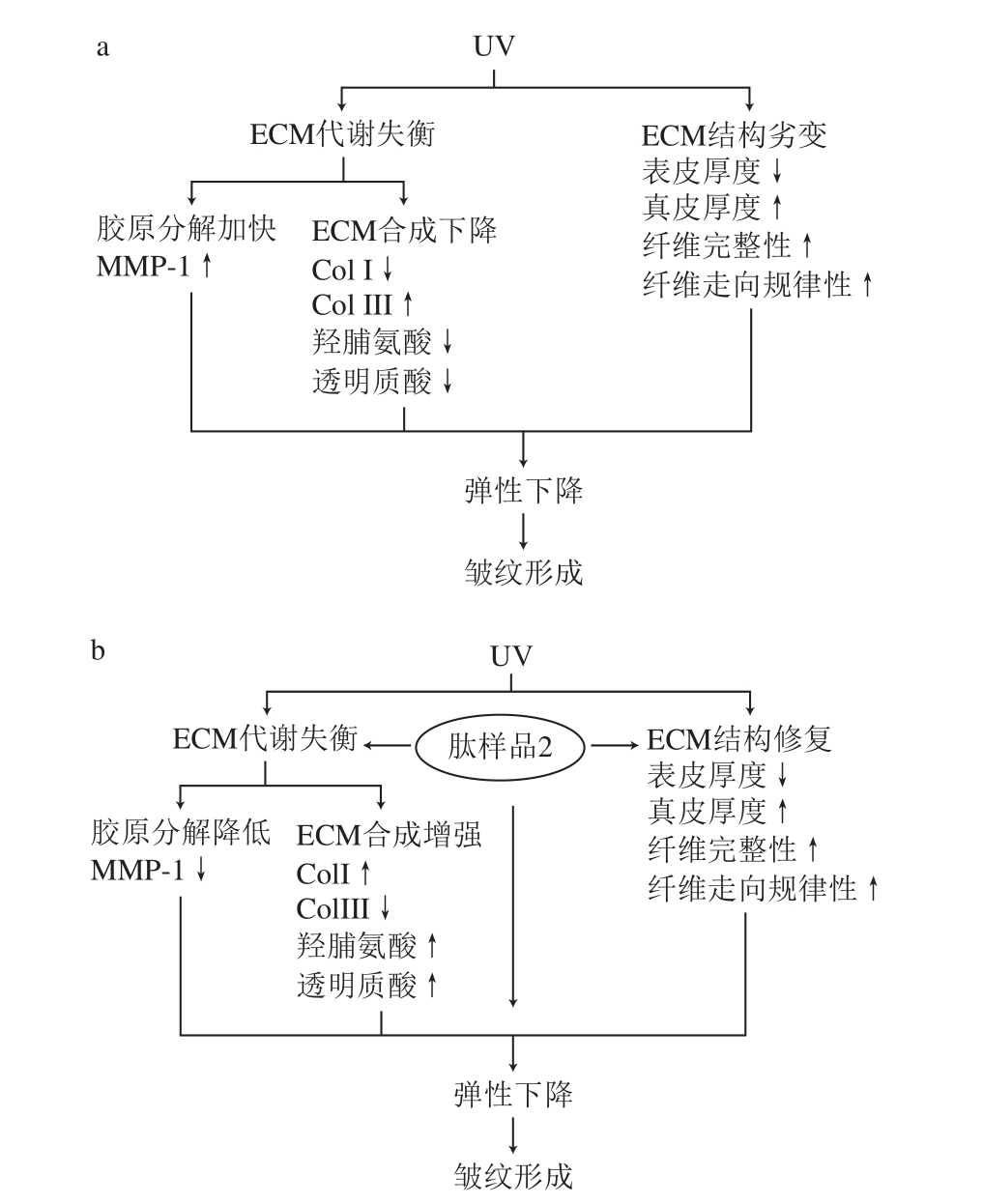
图 5 光诱导皮肤皱纹形成的物质与结构基础(a)及活性肽样品2抗皱机制(b)
Fig. 5 Framework of skin photoaging process mediated by oxidation and immunity stress (a) and its prevention mechanism by food-derived biopeptides (b)
口服摄入一定种类和剂量的食源性肽可提高光老化皮肤弹性,其原因在于增加Col I、羟脯氨酸和透明质酸含量,降低Col III含量和MMP-1活力,修复ECM结构损伤,恢复细胞弹性的物质基础,其中样品2总体效果最好,可明显抑制表皮增生,促进真皮层胶原纤维合成,修复受损细胞活力,是开发抗衰食品的首选原料。
参考文献:
[1] YOUNG A R, CLAVEAU J, ROSSI A B. Ultraviolet radiation and the skin: photobiology and sunscreen photoprotection[J]. Journal of the American Academy of Dermatology, 2017, 76: 100-109. DOI:10.1016/j.jaad.2016.09.038.
[2] TOBIN D J. Introduction to skin aging[J]. Journal of Tissue Viability,2017, 26(1): 37-46. DOI:10.1016/j.jtv.2016.03.002.
[3] SHAH H, MAHAJAN S R. Photoaging: new insights into its stimulators, complications, biochemical changes and therapeutic interventions[J]. Biomedicine & Aging Pathology, 2013, 3(3): 161-169. DOI:10.1016/j.biomag.2013.05.003.
[4] CHEN L, HU J Y, WANG S Q. The role of antioxidants in photoprotection: a critical review[J]. Journal of the American Academy of Dermatology, 2012, 67(5): 1013-1024. DOI:10.1016/j.jaad.2012.02.009.
[5] TSUDA T Y, KIYOTAKA T, HIROYUKI K, et al. Cynaropicrin from Cynara scolymus L. suppresses photoaging of skin by inhibiting the transcription activity of nuclear factor-kappa B[J]. Bioorganic &Medicinal Chemistry Letters, 2013, 23(2): 518-523. DOI:10.1016/j.bmcl.2012.11.034.
[6] PITAK-ARNNOP P, HEMPRICH A, DHANUTHAI K, et al. Gold for facial skin care: fact or fiction?[J]. Aesthetic Plastic Surgery, 2011,35(6):1184-1188. DOI:10.1007/s00266-011-9710-3.
[7] PROKSCH E, SCHUNCK M, ZAGUE V. et al. Oral intake of specific bioactive collagen peptides reduces skin wrinkles and increases dermal matrix synthesis[J]. Skin Pharmacology and Physiology, 2014, 27(3):113-119. DOI:10.1159/000355523.
[8] 周越. 贻贝肽与贻贝多糖对衰老的干预作用及其机制[D]. 镇江: 江苏大学, 2013: 23-28.
[9] CHEN C C, CHIANG A N, LIU H N, et al. EGb-761 prevents ultraviolet B-induced photoaging via inactivation of mitogen-activated protein kinases and proinflammatory cytokine expression[J]. Journal of Dermatological Science, 2014, 75(1): 55-62. DOI:10.1016/j.jdermsci.2014.04.001.
[10] MELLANDER O. The physiological importance of the casein phosphopeptide calcium salts. Ⅱ. peroral calcium dosage of infants[J].Acta Societatis Medicorum Upsaliensis, 1950, 55(5/6): 247-255.
[11] CHEN T J, HOU H, FAN Yan, et al. Protective effect of gelatin peptides from pacific cod skin against photoaging by inhibiting the expression of MMPs via MAPK signaling pathway[J]. Journal of Photochemistry and Photobiology B: Biology, 2016, 165: 34-41.DOI:10.1016/j.jphotobiol.2016.10.015.
[12] PROKSCH E, SCHUNCK M, ZAGUE V, et al. Oral intake of specific bioactive collagen peptides reduces skin wrinkles and increases dermal matrix synthesis[J]. Skin Pharmacology and Physiology, 2014, 27(3):113-119. DOI:10.1159/000355523.
[13] TANAKA M, KOYAMA Y, NOMURA Y. Effects of collagen peptide ingestion on UV-B-induced skin damage[J]. Bioscience, Biotechnology,and Biochemistry, 2009, 73(4): 930-932. DOI:10.1271/bbb.80649.
[14] TAKASHI F, TAKAHIRO O, NAOMI Y, et al. Effects of amla extract and collagen peptide on UVB-induced photoaging in hairless mice[J]. Journal of Functional Foods, 2013, 5(1): 451-459. DOI:10.1016/j.jff.2012.11.018.
[15] 徐德峰, 马忠华, 赵谋明, 等. 一种大鼠皮肤光老化动物模型装置:ZL201520152906.5[P]. 2015-08-12.
[16] 杨汝斌, 万屏, 刘玲, 等. SD大鼠皮肤光老化动物模型建立方法的探索[J]. 中国皮肤性病学杂志,2011, 25(3): 199-202. DOI:10.3969/j.issn.1005- 9202.2012.06.031.
[17] 曹迪, 陈瑾, 黄琨, 等. 皮肤光老化SD大鼠模型的构建及评价标准的探讨[J]. 重庆医科大学学报, 2016, 41(4): 379-383. DOI:10.13406/j.cnki.cyxb.000874.
[18] 殷花, 林忠宁, 朱伟. 皮肤光老化发生机制及预防[J]. 环境与职业医学, 2014, 31(7): 65-69. DOI:10.13213/j.cnki.jeom.2014.0134.
[19] 李勇,眭道顺,李东海, 等. 补肾化瘀中药干预对光老化大鼠模型表皮及真皮结构的影响[J]. 广东医学, 2014, 35(8): 1140-1141.DOI:10.13820/j.cnki.gdyx.2014.08.003.
[20] 楼彩霞, 高擎, 孙侠, 等. 维生素C对紫外线诱导的光老化大鼠皮肤结构的影响[J]. 中国比较医学杂志, 2015, 25(6): 23-27.DOI:10.3969.j. issn.1671.7856.2015.006.005.
[21] BAE J S, HAN M, SHIN H S, et al. Perilla frutescens leaves extract ameliorates ultraviolet radiation-induced extracellular matrix damage in human dermal fibroblasts and hairless mice skin[J]. Journal of Ethnopharmacology, 2017, 195: 334-342. DOI:10.1016/j.jep.2016.11.039.
[22] HINEK A, WANG Y T, LIU K L, et al. Proteolytic digest derived from bovine Ligamentum Nuchae stimulates deposition of new elastin-enriched matrix in cultures and transplants of human dermal fibroblasts[J]. Journal of Dermatological Science, 2005, 39: 155-166.DOI:10.3964/j.issn.1000-0593(2012)02-0383-03.
[23] 胡倩影, 丁艳霞, 田己鑫, 等. 桃叶珊瑚苷抗皮肤光老化作用机制研究[J]. 河南大学学报(医学版), 2016, 35(4): 244-248. DOI:10.15991/j.cnki.41-1361/r.2016.04.005.
[24] WEN L R, GAO Q, MA C W, et al. Effect of polysaccharides from Tremella fuciformis on UV-induced photoaging[J]. Journal of Functional Foods, 2016, 20: 400-410. DOI:10.1016/j.jff.2015.11.014.
[25] KAWADA C, KIMURA M, MASUDA Y, et al. Oral administration of hyaluronan prevents skin dryness and epidermal thickening in ultraviolet irradiated hairless mice[J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 153: 215-221. DOI:10.1016/j.jphotobiol.2015.09.020.
[26] 陈勤, 姚媛媛, 徐柯乐, 等. 乐核桃仁水提物对皮肤老化小鼠皮肤胶原纤维的作用[J]. 中国老年学杂志, 2013, 33(21): 5383-5385.DOI:10.3969/j.issn.1005-9202.2013.21.082.
[27] HONG Y F, LEE H Y, JUNG B J, et al. Lipoteichoic acid isolated from Lactobacillus plantarum down-regulates UV-induced MMP-1 expression and up-regulates type Ⅰ procollagen through the inhibition of reactive oxygen species generation[J]. Molecular Immunology,2015, 67(2): 248-255. DOI:10.1016/j.molimm.2015.05.019.
[28] HA S J, LEE J, KIM H, et al. Preventive effect of Rhus javanica extract on UVB-induced skin inflammation and photoaging[J].Journal of Functional Foods, 2016, 27: 589-599. DOI:10.1016/j.jff.2016.10.011.
[29] SUGANUMA K, NAKAJIMA H, OHTSUKI M, et al.Astaxanthin attenuates the UVA-induced up-regulation of matrixmetalloproteinase-1 and skin fibroblast elastase in human dermal fibroblasts[J]. Journal of Dermatological Science, 2010, 58(2): 136-142. DOI:10.1016/j.jdermsci.2010.02.009.
[30] FISHER G J, QUAN T H, PUROHIT T, et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin[J]. The American Journal of Pathology,2009, 174(1): 101-114. DOI:10.2353/ajpath.2009.080599.
[31] FISHER G J, VARANI J, VOORHEES J J. Looking older: fibroblast collapse and therapeutic implications[J]. Archives of Dermatology,2008, 144(5): 666-672. DOI:10.1001/archderm.144.5.666.
[32] 徐德峰, 赵谋明, 马忠华, 等. 基于胞外基质代谢调控网络的皮肤老化机制的研究进展[J]. 皮肤病与性病, 2016, 38(2): 112-115.DOI:10.3969/j.issn.1002-1310.2016.02.012.
Comparative Analysis of Elasticity Enhancement and Mechanism of Four Kinds of Food-Derived Bioactive Peptides on Photoaged Skin in SD Rats
XU Defeng1,2,3, MA Zhonghua2,*, ZHAO Mouming3,*, ZHANG Ting2, SU Guowan3, ZHAO Zijian1, NIE Qiqian1
(1. Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, Guangdong Provincial Engineering Technology Research Center of Marine Food, Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution, College of Food Science and Technology, Guangdong Ocean University, Zhanjiang 524088, China;2. College of Light Industry and Food Science Technology, South China University of Technology, Guangzhou 510640, China;3. Technique Center of Infinitus (China) Co. Ltd., Guangzhou 510665, China)
Abstract:In order to evaluate the effect of oral supplementation of four kinds of food-derived bioactive peptides on improving the elasticity of photoaged skin in SD rats and to explore the underlying mechanical mechanism, healthy adult female SD rats were randomly divided into normal control group, ultraviolet (UV) exposure group and four bioactive peptide administration groups. All animals except those in the normal control group were exposed to UVA radiation in combination with UVB. Water solutions of each bioactive peptide were prepared in at concentrations of 0.3, 0.9, and 1.5 g/L for the low, middle and high-dose peptide treatment groups, respectively. The model and peptide treatment groups were exposed to UV irradiation thrice weekly for 18 consecutive weeks until the photoaging model was established. The elasticity of dorsal skin in each animal group was detected with a skin analyzer and then the rats were sacrificed. Approximately 1 g of dorsal skin samples were mixed into 10 mL of buffer solution and homogenized, and then the homogenate was prepared for biochemical measurements. The contents of hydroxyproline and hyaluronic acid (HA) were determined by biochemical assays, and the contents of type I and III collagen, and the activity of matrix metalloproteinase-1 (MMP-1) were determined by enzyme-linked immunosorbent assay. Paraffin-embedded sections of skin tissue were prepared and stained with hematoxylin and eosin for histochemical observation. Results showed that skin elasticity and the contents of collagen I,hydroxyproline and HA in rat skin from the model group were significantly decreased when compared with the normal group, while the content of collagen III and the activity of MMP-1 were significantly increased. Histochemical assays showed epidermal hyperplasia and disorderly arrangement of collagen fibers in the dermis which were broken into fragments aggregated and distorted, together with solubilization and flattening of the basement membrane. In comparison with the model group, skin elasticity in all peptide supplementation groups was improved to some different degrees, with elastinderived peptide showing the best effect, which significantly increased the contents of collagen I, hydroxyproline and HA and significantly decreased the content of collagen III and the activity of MMP-1 (P < 0.05). Histochemical assays demonstrated that elastin-derived peptide markedly improved epidermal hyperplasia, increased the thickness of the dermis and the amount of collagen fibers and restored collagen fibers to the uniform compact wave-like arrangement of the blank control, suggesting that the mechanism of action of elastin-derived peptide was enhancing the biosynthesis of extracellular matrix (ECM) and inhibiting the degradation of ECM by MMP-1 as well as restoring the mechanical structure of photodamaged skin.
Keywords:bioactive peptides; oral exposure; SD rat; skin photoaging
DOI:10.7506/spkx1002-6630-201815023
收稿日期:2017-02-23
基金项目:中国博士后科学基金项目(2014M552203);中央高校基本科研业务费专项资金项目(20152M062);国家级大学生创新课题(20161056601)
第一作者简介:徐德峰(1978—),男,副教授,博士,研究方向为食源性活性肽制备与抗衰老机制解析。E-mail:stone_xdf@163.com
*通信作者简介:
马忠华(1965—),男,高级工程师,博士,研究方向为食源性活性肽制备与机理。E-mail:William.Ma@infinitus.com
赵谋明(1965—),男,教授,博士,研究方向为食源性活性肽制备与机理。E-mail:zhaomouming@163.com
中图分类号:R332
文献标志码:A
文章编号:1002-6630(2018)15-0152-07
引文格式:
徐德峰, 马忠华, 赵谋明, 等. 4 种食源性肽改善SD大鼠光老化皮肤弹性及机理的比较分析[J]. 食品科学, 2018, 39(15):152-158. DOI:10.7506/spkx1002-6630-201815023. http://www.spkx.net.cn
XU Defeng, MA Zhonghua, ZHAO Mouming, et al. Comparative analysis of elasticity enhancement and mechanism of four kinds of food-derived bioactive peptides on photoaged skin in SD rats[J]. Food Science, 2018, 39(15): 152-158. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815023. http://www.spkx.net.cn