胡妍芸1,李霁昕1,王 雨1,王 博1,张国祥1,张瑞君2,蒋玉梅1,*
(1.甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄酒产业技术研发中心,甘肃 兰州 730070;2.甘肃省兰州市红古区食品药品检验检测中心,甘肃 兰州 730070)
摘 要:磷脂是细胞膜的重要组分,磷脂代谢直接影响细胞膜的稳定性,进而影响植物的生长、衰老和次生产物代谢。诱抗剂苯并噻重氮(benzothiadiazole,BTH)可提高甜瓜(Cucumis melo L.)采后抗病性、延缓果实衰老、影响果实次生代谢产物香气物质的释放。本研究以‘玉金香’甜瓜为实验材料,于采后贮藏期间分析样品果实中磷脂酰胆碱(phosphatidyl cholines,PC)、磷脂酰肌醇(phosphatidylinositol,PI)和磷脂酸(phosphatidic acid,PA)含量以及磷脂酶A2(phospholipase A2,PLA2)、磷脂酶C(phospholipase C,PLC)和磷脂酶D(phospholipase D,PLD)活力和相关基因表达水平,探讨采后BTH处理调控厚皮甜瓜磷脂代谢的机理。结果表明:BTH处理可抑制厚皮甜瓜采后贮藏期间磷脂酶基因的表达和活力,果皮样磷脂酶活力峰值分别较CK组低7.11%(PLA2)、10.24%(PLC)和7.20%(PLD);BTH处理组膜磷脂组分PC、PI的积累量较CK组增加,贮藏结束时果皮样峰值比CK组高5.24%(PC)和2.08%(PI),BTH处理组磷脂代谢产物PA的含量较CK组、CC组降低,贮藏结束时,BTH处理组比CK组低20.72%(果皮)和8.51%(果肉);BTH对不饱和脂肪酸的抑制率低于饱和脂肪酸。可见,采后BTH处理可通过抑制PLC、PLD基因相对表达降低其活力,进而减少产物脂肪酸生成,改变脂肪酸不饱和度,然后影响细胞膜代谢过程中的信号传导和次生代谢产物生成,降低甜瓜果实的采后病害。
关键词:苯并噻重氮;厚皮甜瓜;磷脂代谢;磷脂酶;基因表达;脂肪酸
呼吸跃变型‘玉金香’甜瓜(Cucumis melo L. cv.Yujinxiang)采后贮藏期间的品质易因病原微生物侵染而劣变,苯并噻重氮(benzothiadiazole,BTH)可通过激活系统获得性抗性通路诱导厚皮甜瓜产生抗性[1]。活性氧自由基代谢[2]、苯丙烷代谢[3]和病程相关蛋白的积累[4]是BTH诱导植物产生抗病性机制研究的热点。
磷脂是生物体细胞膜的主要组分,是细胞质与外界的屏障,也是细胞对外界刺激应答的物质基础[5],在植物生长发育过程中具有结构和信号传导的双功能[6-7]。在磷脂酶的作用下磷脂可水解为甘油、脂肪酸、磷脂等,进而参与次生代谢[8]。逆境胁迫会促进细胞膜不饱和脂肪酸的过氧化,产生活性氧和脂质过氧化物,从而改变细胞膜结构,导致细胞膜流动性下降和通透性增强,影响磷脂代谢的稳定性[9];乙烯处理会提高磷脂酶活力,加速脂质降解[10];冷害使磷脂酶活力升高,进而加速细胞膜磷脂降解,不饱和脂肪酸含量及比例改变[11]。然而,诱抗剂诱抗对甜瓜磷脂代谢的影响机理目前鲜见报道。
本研究以‘玉金香’甜瓜为实验材料,采后BTH浸泡处理,以水处理组为条件对照,未处理组为对照,检测磷脂酶(phospholipase A2,PLA2)、磷脂酶C(phospholipase C,PLC)和磷脂酶D(phospholipase D,PLD)活力的变化及其基因表达特性,分析诱抗剂处理对磷脂代谢底物、产物以及磷脂酶活力的影响,探讨采后BTH处理和条件因子(水因子)对甜瓜果实细胞膜磷脂代谢的影响机理。以期为BTH处理诱导果实抗病性代谢机理研究及其对次生代谢产物的影响分析提供数据参考。
‘玉金香’厚皮甜瓜,2016年6月(花后45 d)采自甘肃省皋兰县什川镇,单果发泡袋包装装箱(35 个/箱),当天运抵实验室。参照李轩[1]的方法,选择成熟度、大小相近且无损伤和虫咬的果实,于100 mg/L的BTH溶液中浸泡10 min,为BTH处理组;蒸馏水浸泡10 min为条件对照(condition control,CC)组,不作处理的空白样为对照(CK)组,室温((22±2)℃)、相对湿度55%~65%贮藏。
BTH(纯度98%)、磷脂酰胆碱(phosphatidyl cholines,PC)、磷脂酰肌醇(phosphatidylinositol,PI)、磷脂酸(phosphatidic acid,PA)(均为标准品)美国Sigma Aldrich公司;PLA2检测试剂盒、PLC检测试剂盒、PLD检测试剂盒 上海酶联生物科技有限公司;UNIQ-10柱式TRIzol总RNA抽提试剂盒 生工生物工程(上海)股份有限公司;EP0733型第一链cDNA合成试剂盒 美国Thermo Scientific公司。
iMar全自动酶标仪 美国Bio-Rad公司;UltiMate 3000系列高效液相色谱(high performance liquid chromatography,HPLC)仪、Genesis 10s紫外-可见分光光度计 美国Thermo Scientific公司;PHS-3C pH计上海雷磁仪器有限公司;HPLC流动相过滤装置 上海陆纳生物科技有限公司。
1.3.1 取样
贮藏期间,在第0、2、4、6、8、10、12天分别于CK、CC和BTH处理组各选取10 个果实,取“赤道”部位果皮(皮下2~5 mm)和果肉组织(皮下5~8 mm),切成小块混匀。用于测定酶活力和磷脂组分的样品,每2.0 g用锡箔纸包裹,共包裹24 组,液氮冷冻,于-80 ℃保存待测;用于测定脂肪酸含量和与酶活力相关的基因表达的样品,每5.0 g用锡箔纸包裹,共包裹18 组,液氮冷冻,于-80 ℃保存待测。
1.3.2 指标测定
1.3.2.1 细胞膜完整率和丙二醛含量的测定
细胞膜完整率的测定参照曹建康等[12]的方法并修改,分别取果实赤道部位果皮和果肉组织5.0 g,去离子水冲洗3 次,40 mL去离子水25 ℃下浸泡3 h,测初始电导率(P0/(S/m)),沸水浴30 min,冷却至25 ℃,测最终电导率(P/(S/m))。细胞膜完整率的计算如下式所示。
丙二醛(malondialdehyde,MDA)含量的测定参照曹建康等[12]的方法,采用硫代巴比妥酸比色法测定。
1.3.2.2 PC、PI、PA含量的测定
参照Yang Wenlong等[13]的方法。2.0 g样品液氮冷冻研磨后置于50 mL三角瓶中,加15 mL Folch试剂(V(氯仿)∶V(甲醇)=2∶1)。超声提取1 h,4 ℃、10 000×g离心20 min。上层清液于4 ℃、10 000×g再离心20 min。弃水相,取氯仿相于10 mL试管中,加入1 mL丙酮,漩涡振荡2 min。氮气吹干后加入2 mL Folch试剂,过0.45 μm膜,HPLC检测。色谱柱ZORBAX SB-C18(250 mm×4.6 mm,5 μm);流动相A:V(乙腈)∶V(甲醇)∶V(85%磷酸)=130∶370∶1,进样量10 μL,柱温30 ℃,流速1.0 mL/min,紫外检测波长205 nm。PC、PI和PA外标定性,HPLC相同仪器条件制标准曲线定量。结果以鲜质量计。
1.3.2.3 脂肪酸含量的测定
参照李岩[14]的方法。甲酯化:取甜瓜样品5.0 g,液氮冷冻充分研磨,加入10 mL石油醚-乙醚(4∶3,V/V)混合液,于0~4 ℃下浸提24 h,加10 mL 0.4 mol/L的氢氧化钾-甲醇溶液,室温下甲酯化2 h,重蒸馏水分离得到有机相,氮气吹干,1 mL氯仿溶解,无水硫酸钠除水,过0.45 μm膜,气相色谱分析。色谱柱TG-WAXMS(60 m×0.25 mm,0.5 µm),进样口温度240 ℃,分流进样,分流比为30∶1,FID检测器,温度250 ℃,载气为高纯度N2,流速1 mL/min。初温150 ℃保持1 min,10 ℃/min升至230 ℃,保持1 min,3 ℃/min至240 ℃,保持10 min。外标定性定量。
1.3.2.4 磷脂酶活力的测定
PLA2活力的测定参照Alferez等[15]的方法。取2.0 g样品液氮冷冻充分研磨,8 mL提取缓冲液(含1 mmol/L EDTA、100 mmol/L Tris-HCl(pH 7.5)、体积分数2%交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone,PVPP)和0.15 mol/L山梨糖醇)浸提,4 ℃、11 000×g离心15 min,悬浮蛋白加硫酸铵过夜沉淀、离心,沉淀洗涤3 次。于2 mL酶反应体系(80 mmol/L pH 7.4 4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES)缓冲液、150 mmol/L NaCl、10 mmol/L CaCl2、4 mmol/L聚乙二醇辛基苯基醚(Triton X-100)、体积分数30%丙三醇和1 mg/mL牛血清白蛋白)中加入1 mL粗酶液。PLA2检测试剂盒检测,酶标仪450 nm波长处读取吸光度,对照标准曲线确定酶活力,单位:μmol/(min·kg)。
PLC活力的测定参照文献[10,16]的方法。取5.0 g样品液氮冷冻充分研磨,加入10 mL HEPES缓冲液(pH 7.0,含0.32 mol/L蔗糖、1 mmol/L二硫苏糖醇、1 mmol/L苯甲基磺酰氟、1 mmol/L EGTA),制成体积分数20%的匀浆,4 ℃、12 000 ×g离心45 min,沉淀为细胞膜的膜性组分,溶于100 mmol/L pH 6.5的二甲基戊二酸(dimethylglutaric acid,DMG),得PLC粗酶提取液。于2 mL酶反应体系(含0.25 mol/L Tris-HCl(pH 7.2)、0.001 mol/L ZnCl2、60 g/100 mL山梨醇、10 nmol/L对硝基苯磷酸胆碱)中加入100 μL粗酶液,37 ℃下反应30 min。PLC试剂盒检测,酶标仪450 nm波长处读取吸光度,对照标准曲线确定酶活力,单位:μmol/(min·kg)。
PLD活力的测定参照王国泽[17]、张红宇[18]等的方法。取5.0 g样品制备粗酶液,方法同PLC粗酶液的制备。200 μL酶反应体系由0.1 mmol/L DMG(pH 6.5)、10 mmol/L MgCl2、10 mmol/L CaCl2、5 mmol/L亚油酸、20 μL粗酶液(对照用DMG替代)组成,加入12 mmol/L PC,封口后30 ℃保温反应30 min,沸水浴10 min终止反应。冷却后加入0.8 mL显色液(含45 mmol/L Tris-HCl(pH 8.0)、0.8单位胆碱氧化酶、2.4单位辣根过氧化物酶、0.24 mg 4-氨基安替比林和0.16 mg重蒸酚),30 ℃反应90 min,色泽稳定后加1 mL Tris-HCl(含2 g/L Triton X-100,pH 8.0),0.22 μm滤膜滤去蛋白质,用酶标仪于450 nm波长处测定吸光度,对照标准曲线确定酶活力,单位:μmol/(min·kg)。
1.3.2.5 磷脂酶基因表达水平的测定
TRIzol总RNA抽提试剂盒提取样品总RNA,第一链cDNA合成试剂盒完成cDNA第一链的合成。实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)测定磷脂酶的表达水平,引物序列设计见表1。qRT-PCR采用20 μL反应体系,包括10.0 μL SYBR Green qPCR Master Mix、0.4 μL上游引物(10 μmol/L)、0.4 μL下游引物(10 μmol/L)、7.2 μL ddH2O、2 μL模板(cDNA)。qRT-PCR程序:95 ℃ 7 s、57 ℃ 10 s、72 ℃ 15 s,45 个循环。数据于LightCycler480 Software Setup中分析。2-∆∆Ct方法计算基因相对表达量,设定各基因在0 d的表达量为1.0。
表 1 所测基因引物设计
Table 1 Primers used for PCR

Excel 2013软件计算平均值和标准偏差并绘制图表。IBM SPSS 19.0软件统计分析,Duncan’s进行多重比较,P<0.05表示差异显著。
细胞膜完整率和MDA含量反映细胞膜的稳定性和完整性,是衡量采后甜瓜果实耐贮性的重要指标。

图 1 采后BTH处理对甜瓜果实细胞膜完整率的影响
Fig. 1 Effect of postharvest BTH treatment on muskmelon membrane integrity

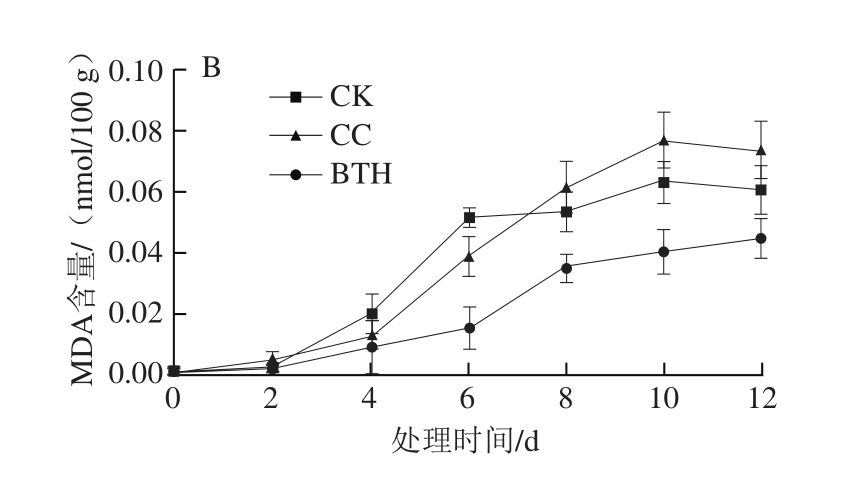
图 2 采后BTH处理对甜瓜果实MDA含量的影响
Fig. 2 Effect of postharvest BTH treatment on MDA content in muskmelon
采后贮藏期间甜瓜果实细胞膜完整率整体呈下降趋势,CC组细胞膜完整率略低于CK组,BTH处理能明显延缓其下降(图1),12 d时BTH处理组果实细胞膜完整率比CK组高8.82%(果皮)和17.13%(果肉)。甜瓜果实贮藏期间,MDA含量开始上升(图2),CC和CK组第10天到达最高积累,随后下降,BTH处理组MDA含量则持续缓慢上升;第6天开始,CC组果皮样MDA含量高于CK组;第8天开始,CC组果肉样MDA含量高于CK组;而BTH处理组MDA含量始终低于CC和CK组(P<0.05)。由此可见,BTH诱抗处理可减少甜瓜样品采后贮藏期间MDA的积累,抑制细胞膜降解;而水因子在采后贮藏期间会导致甜瓜细胞膜完整率降低,在贮藏后期促进MDA的积累。

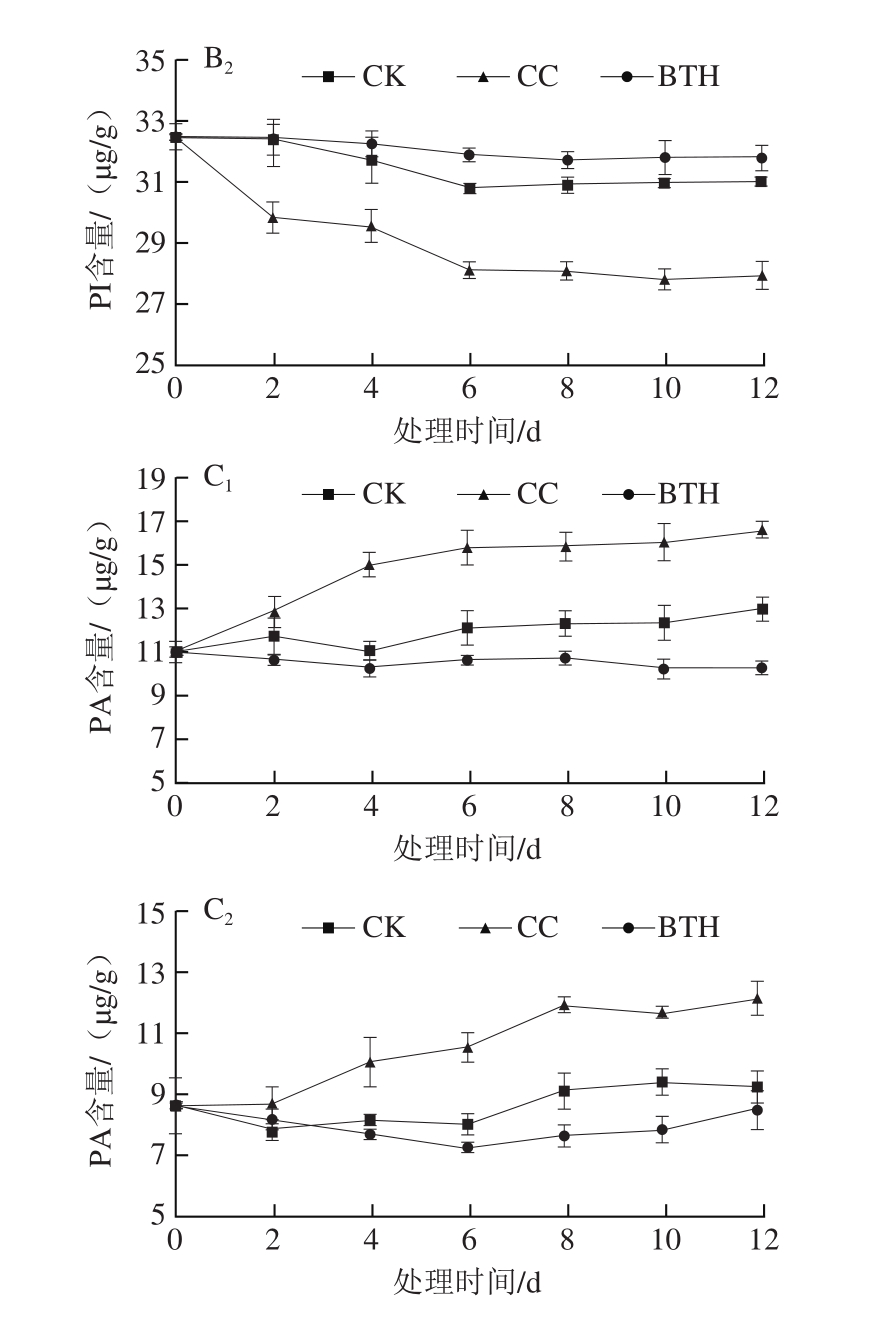
图 3 采后BTH处理对甜瓜果实PC、PI、PA含量的影响
Fig. 3 Effect of postharvest BTH treatment on PC, PI and PA contents in muskmelon
A、B、C.分别为PC、PI、PA含量;下标1.果皮;下标2.果肉。
贮藏期间,样品膜磷脂成分PC含量总体呈不断下降趋势(图3A1、A2)。CC组果皮样PC含量低于CK组,贮藏结束时其含量为(13.66±1.23)μg/g,比CK组低20.97%。BTH处理组果皮样PC含量在贮藏第2天开始就比CK高,贮藏结束时(12 d)较采收当天PC含量下降29.61%,比CK组高5.24%。果肉样与果皮样的PC含量变化趋势一致,贮藏结束时,CK组果肉样PC含量较采收当天下降36.14%,而果皮样中12 d时PC含量较采收当天低33.12%。BTH处理组和CC组的PC含量下降率则比果皮样低5.48%、2.58%。
样品膜磷脂组分PI含量贮藏期间总体呈下降趋势(图3B1、B2)。CC组果皮样贮藏前6 d PI含量下降急剧,之后含量趋于平衡,贮藏结束时比CK组低8.34%。BTH处理组果皮样PI含量在整个贮藏期间无明显变化,且均比CK组高,贮藏结束时(12 d)比CK组高2.08%。果肉样与果皮样PI含量的变化趋势基本一致,贮藏结束时(12 d)CC组则比CK组低9.47%,而BTH处理组果肉样PI含量比CK组高2.90%。
CK和CC组磷脂代谢产物PA含量贮藏期间呈上升趋势(图3C1、C2)。贮藏前6 d,CC组果皮样PA含量迅速增加至(15.79±0.78)μg/g,比CK组高30.01%,贮藏后期PA含量增加速率减慢,第12天时比CK组高27.70%。BTH处理组果皮样PA含量无明显变化,贮藏结束时(12 d)比CK组低20.72%。果肉样与果皮样PA含量变化基本一致,贮藏期间果肉样PA含量的增加率比果皮低11.05%(CK组)、10.01%(CC组);贮藏结束时(12 d)CC组果肉样PA含量比CK组高31.54%;而BTH处理组果肉样在贮藏前6 d PA含量持续下降,至(7.22±0.10)μg/g(6 d),比CK组低9.98%,之后PA含量逐渐增加,第12天时比CK组低8.51%。
总体来看,采后BTH处理可抑制膜磷脂成分PC、PI的降解及磷脂代谢产物PA的生成,而水因子则在一定程度上促进了PC、PI的降解和PA的积累。
磷脂酶水解代谢的多不饱和脂肪酸可作为脂氧合酶(lipoxygenase,LOX)的底物,产生活性氧和脂质过氧化物导致细胞膜的损伤[19],也可代谢生成香气物质。因此,脂肪酸的含量以及不饱和脂肪酸与饱和脂肪酸比例(不饱和度)[20]对细胞膜的稳定性、完整性及果实香气品质均有影响。
表 2 采后BTH处理对甜瓜果实果皮组织脂肪酸含量的影响
Table 2 Effect of postharvest BTH treatment on contents of fatty acids in peel of muskmelon μg/g

注:同行肩标字母不同表示差异显著(P<0.05)。下同。
实验样品中检出的主要脂肪酸为不饱和脂肪酸油酸、亚油酸和亚麻酸,果皮样脂肪酸含量明显高于果肉(表2、3)。随着贮藏时间的延长,CK组不饱和脂肪酸含量显著降低(P<0.05),而饱和脂肪酸(棕榈酸、硬脂酸)含量则显著增加(P<0.05)。BTH处理组各种脂肪酸含量均较CK组明显降低,贮藏结束(12 d)时,果皮样中BTH处理组的棕榈酸较CK组低40.16%,硬脂酸较CK组低31.05%,油酸较CK组低28.43%,亚油酸较CK组低38.47%,亚麻酸较CK组低13.81%;CC组样品各脂肪酸含量显著高于CK组(P<0.05),果肉样较CK组高出18.35%(棕榈酸,10 d)、18.58%(硬脂酸,6 d)、9.15%(油酸,2 d)、25.20%(亚油酸,6 d)、10.34%(亚麻酸,6 d)。
表 3 采后BTH处理对甜瓜果实果肉组织脂肪酸含量的影响
Table 3 Effect of postharvest BTH treatment on contents of fatty acids in pulp of muskmelon
μg/g

表 4 采后BTH处理对甜瓜果实果皮和果肉组织脂肪酸总量的影响
Table 4 Effect of postharvest BTH treatment on contents of total fatty acids in peel and pulp of muskmelon μg/g
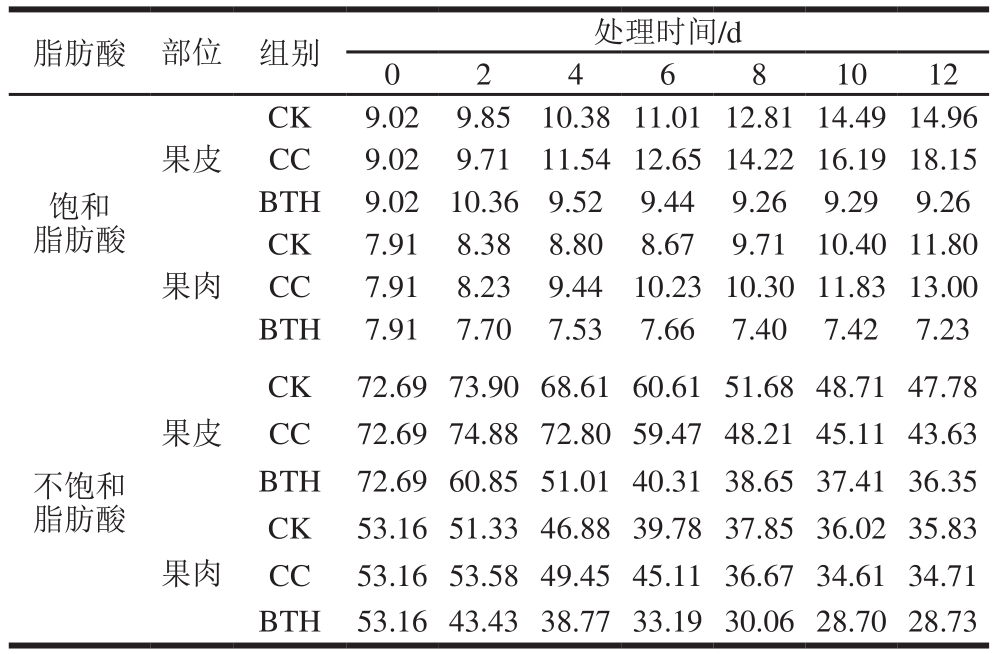
贮藏结束时BTH处理组果皮样不饱和脂肪酸含量较采收当天下降49.99%(表4),而饱和脂肪酸含量则较采收当天上升2.66%;BTH处理对果肉样中脂肪酸含量及比例的影响与果皮样基本一致。由此可见采后BTH处理可减少脂肪酸的生成和积累,水因子则增加脂肪酸含量,进而影响果实香气物质的生成。
采后贮藏期间果皮和果肉试样中PLA2、PLC和PLD活力均呈单峰型变化,基因相对表达量与酶活力变化趋势基本一致(图4)。
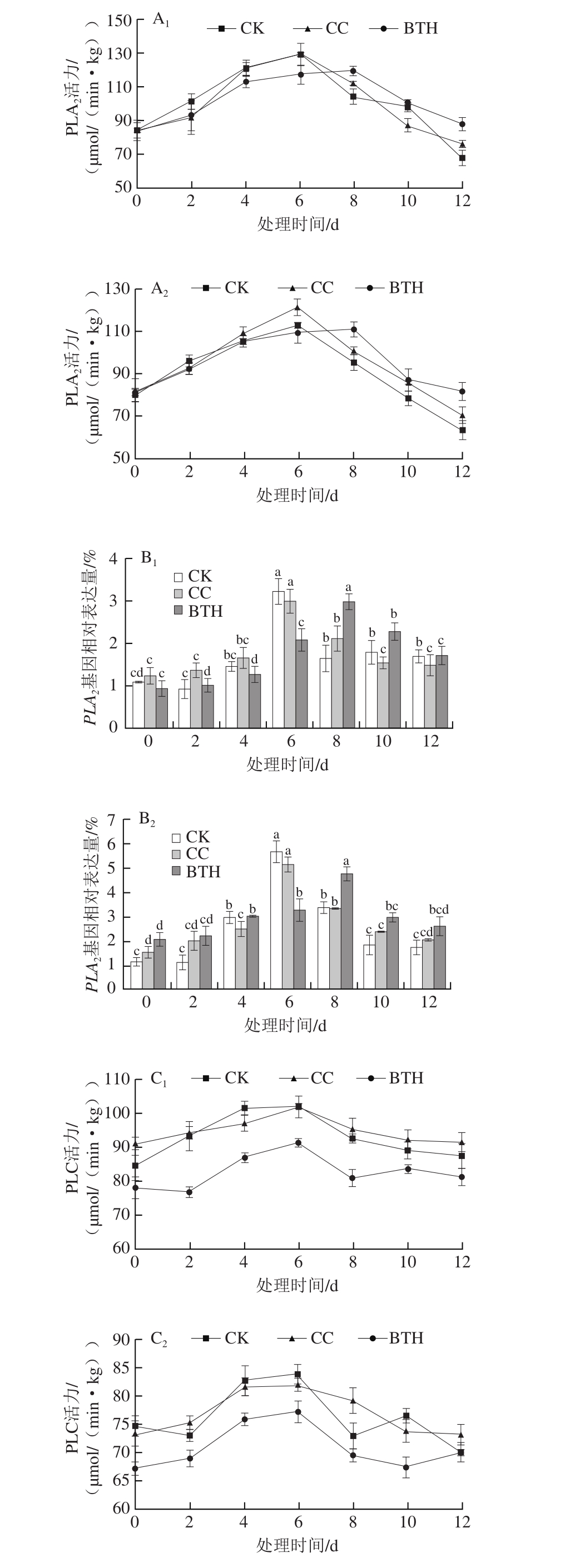

图 4 采后BTH处理对甜瓜果实PLA2、PLC、PLD活力及其基因相对表达量的影响
Fig. 4 Effect of postharvest BTH treatment on relative gene expression levels and activities of PLA2, PLC and PLD in muskmelon
下标1、2.分别为果皮、果肉;A、C、E.分别为PLA2、PLC、PLD活力;B、D、F.分别为PLA2、PLC、PLD基因相对表达量。对于同一处理组,不同处理时间字母不同表示差异显著(P<0.05)。
由图4A1、A2可知,贮藏第2天,BTH处理组PLA2活力比CK组低,但高于CC组;第6天时,CC组和CK组PLA2活力达到高峰,BTH处理组PLA2活力均比CK组和CC组低;第8天时,BTH处理组PLA2活力达到峰值,之后高于CK组和CC组。果皮样CK组和CC组PLA2活力峰值分别为(128.96±6.90)和(129.58±2.12)μmol/(min·kg),差异不显著(P>0.05),而BTH处理组PLA2活力峰值比CK组低7.11%。CK组和CC组果肉组织PLA2活力峰值分别为(112.19±1.11)和(121.04±3.83)μmol/(min·kg),BTH处理组PLA2活力峰值分别比CK组和CC组低1.49%和8.69%。果肉样PLA2活力整体比果皮样低。对于果肉组织,CC组PLA2活力值在处理4 d后高于CK组,峰值比CK组高7.89%。贮藏前6 d果皮样PLA2基因的相对表达量均被BTH处理抑制,第6天时BTH处理组比CK组低35.42%,第8天开始上调(图4B1)。由图4B可知,果肉样品中,BTH组PLA2基因的相对表达量高于CK组,第6天时,较CK组低41.82%。
由图4C1、C2可知,PLC活力第6天达到峰值,BTH处理组贮藏期间PLC活力始终低于CK组和CC组果实,第8天后CC组果实果皮样中的PLC活力高于CK组。CK组果皮样的PLC活力峰值为(102.12±3.40)μmol/(min·kg),BTH处理组峰值较CK组低10.24%;果肉组织BTH处理组峰值为(77.20±1.95)μmol/(min·kg),比CK组低7.95%。果皮样PLC活力整体较果肉样高,CK组和BTH处理组果皮样活力峰值较果肉组织高出21.77%和18.74%。由图4D1、D2可知,BTH处理组PLC基因相对表达量比CK组低,第10天时,果皮样中BTH处理组较CK组高47.66%,果肉样中BTH处理组较CK组高48.50%;CC组的PLC基因相对表达量较CK组上调,峰值较CK组高出26.72%(果皮,10 d)、18.33%(果肉,10 d)。
由图4E1、E2可知,BTH处理组PLD活力比CK组低,而CC组活力则比CK组高。CK组和BTH处理组果皮样于第6天达到峰值,分别为(705.83±14.77)、(655.00±12.75)μmol/(min·kg),BTH处理组峰值较CK组低7.20%;CC组则在第8天达到峰值,比CK组峰值高6.14%。果肉组织CK组峰值为(769.17±27.79)μmol/(min·kg),BTH处理组峰值比CK组峰值低9.43%,CC组峰值则比CK组峰值高14.30%。果肉样PLD活力整体较果皮组织高,CK组和BTH处理组果肉样PLD活力峰值分别比果皮样中CK组和BTH处理组的PLD活力峰值高8.97%、6.36%。
由图4F1、F2可知,CC组PLD基因相对表达量较CK组上调了46.91%(果皮,0 d)、21.02%(果肉,12 d);BTH处理组则较CK组下调了46.29%(果皮,4 d)、36.56%(果肉,6 d)。
由此可见,采后BTH处理延缓了PLA2活力高峰出现时间,抑制了PLC和PLD的活力,基因表达水平和酶活水平基本一致;水因子则局部促进了PLA2、PLC和PLD基因相对表达量,激发了PLA2、PLC和PLD的活力,但水因子的作用规律不明显。
植物的衰老、病害以及外界因子的影响往往伴随着细胞膜的改变和脂质降解,磷脂酶PLA2、PLC和PLD是参与其中的重要酶类[19,21]。细胞膜的改变、脂质降解代谢产物与细胞衰老、程序性死亡密切相关[22]。实验中,甜瓜果实PLA2、PLC和PLD活力和基因表达水平呈单峰型变化趋势,作为底物的膜磷脂成分PC、PI含量下降,而产物PA含量则略有上升,酶活力变化与Mao Linchun等[10]的研究结果一致;Munnik等[23]使用32P标记衣藻细胞分析其磷脂代谢的结果表明,PA来自于PLD代谢;PA作为信号传导信使可调节PLC、PLD、PLA2和二酰基甘油激酶的活力[24-26]。Zhao Yuying等[24]的研究结果表明,黄瓜果实受到机械损伤后磷脂酶活力增加,PC、PI含量减少而PA得到积累。本实验中甜瓜果实经BTH处理后,磷脂酶PLC、PLD活力被抑制,PC、PI因酶活力降低而有所积累;产物PA含量则降低。PA是逆境胁迫、氧化应激等引起植物激素(乙烯、脱落酸等)变化的第二信使[27],BTH处理能够延缓果实成熟衰老、抑制乙烯的释放[28],且影响PA生成。水因子则会在一定程度上促进磷脂酶活力增加,导致PC、PI含量显著降低。由此可推断BTH处理中作为溶剂的水因子可能会抵消BTH的部分作用,影响磷脂酶活力及其底物和产物的变化规律。
细胞衰老及恶化的特征是磷脂含量的减少[29],同时还伴随游离脂肪酸水平的下降[30]。总的来看,BTH处理后脂肪酸的积累被抑制,BTH对不饱和脂肪酸的抑制效果低于对饱和脂肪酸的抑制效果。Cao Shifeng[31]、李辉[32]等的研究结果表明,不饱和脂肪酸的含量及比例影响细胞膜流动性,对植物衰老、冷害等生理反应有着重要意义,本实验BTH处理甜瓜果实后脂肪酸不饱和度有所上升,与BTH处理抑制磷脂组分降解、保持细胞膜完整性相一致。已有报道证明BTH可抑制厚皮甜瓜挥发性物质的释放[33],PLA2活力的变化可影响香气代谢前体物质不饱和脂肪酸的释放,可见,PLA2活力可能也是控制甜瓜果实香气物质代谢的环节之一,BTH不仅可通过影响LOX途径影响甜瓜果实香气物质代谢[34],其通过磷脂代谢的影响同样不容忽视。
BTH诱抗处理可减少厚皮甜瓜‘玉金香’采后贮藏期间MDA的积累,降低磷脂酶PLC和PLD的基因相对表达量和活力,延缓PLA2活力峰值出现时间;促进膜磷脂成分PC、PI的积累,抑制磷脂代谢产物PA的生成,减缓细胞膜降解。而水因子则促进了MDA在贮藏后期积累,局部激发了PLA2、PLC和PLD基因相对表达量和活力,水因子处理促进PC、PI的降解和PA的积累,样品细胞膜完整率降低。作为磷脂代谢产物和香气代谢前体物质之一的不饱和脂肪酸,BTH处理后含量减少,水因子对不饱和脂肪酸含量却有一定的促进作用,进而影响了甜瓜的香气代谢。可见,采后BTH处理可通过抑制磷脂组分降解和PLC基因、PLD基因相对表达量及相关酶活力,从而减少PA和不饱和脂肪酸的生成,进而影响细胞膜完整性及厚皮甜瓜果实的香气代谢。
参考文献:
[1] 李轩. “银帝”甜瓜挥发性物质的分析及BTH或Harpin对其释放的影响[D]. 兰州: 甘肃农业大学, 2005: 20-21. DOI:10.7666/d.y724227.
[2] REN Y L, WANG Y F, BI Y, et al. Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon (Cucumis melo L.) fruit[J]. European Food Research and Technology, 2012, 234(6): 963-971. DOI:10.1007/s00217-012-1715-x.
[3] LIU Y Y, GE Y H, BI Y, et al. Effect of postharvest acibenzolar-S-methyl dipping on phenylpropanoid pathway metabolism in muskmelon (Cucumis melo L.) fruits[J]. Scientia Horticulturae, 2014,168(3): 113-119. DOI:10.1016/j.scienta.2014.01.030.
[4] GE Y H, BI Y, LI X, et al. Induces resistance against Fusarium and pink rots by acibenzolar-S-methyl in harvested muskmelon (cv. Yindi)[J].Agricultural Sciences in China, 2008, 7(1): 58-64. DOI:10.1016/S1671-2927(08)60022-X.
[5] DE BRUXELLES G L, ROBERTS M R. Signals regulating multiple responses to wounding and herbivores[J]. Critical Reviews in Plant Sciences, 2001, 20(5): 487-521. DOI:10.1016/S0010-8545(02)00029-2.
[6] CHAPMAN, KENT D. Phospholipase activity during plant growth and development and in response to environmental stress[J]. Trends in Plant Science, 1998, 3(11): 419-426. DOI:10.1016/S1360-1385(98)01326-0.
[7] LAXALT A M, MUNNIK T. Phospholipid signalling in plant defence[J]. Current Opinion in Plant Biology, 2002, 5(4): 332-338.DOI:10.1016/S1369-5266(02)00268-6.
[8] 林芳, 许智宏, 薛红卫. 植物信号传导中的磷脂酶[J]. 植物学报,2001, 43(10): 991-1002. DOI:10.3321/j.issn:1672-9072.2001.10.001.
[9] PALIYATH G, DROILLARD M J. The mechanisms of membrane deterioration and disassembly during senescence[J]. Plant Physiology& Biochemistry, 1992, 30(6): 789-812.
[10] MAO Linchun, KARAKURT Y, HUBER D J. Incidence of watersoaking and phospholipid catabolism in ripe watermelon (Citrullus lanatus) fruit: induction by ethylene and prophylactic effects of 1-methylcyclopropene[J]. Postharvest Biology and Technology, 2004,33: 1-9. DOI:10.1016/j.postharvbio.2003.12.007.
[11] SIRIKESORN L, KETSA S, VAN DOORN W G. Low temperatureinduced water-soaking of Dendrobium inflorescences: relation with phospholipase D activity, thiobarbaturic-acid-staining membrane degradation products, and membrane fatty acid composition[J].Postharvest Biology and Technology, 2013, 80: 47-55. DOI:10.1016/j.postharvbio.2013.01.007.
[12] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 152-155.
[13] YANG Wenlong, YANG Yuhuan, YAN Xiufeng, et al. Determination of phospholipid content in tree leaves by high performance liquid chromatography[J]. Journal of Northeast Forestry University, 2008,9(1): 11-17. DOI:10.13759/j.cnki.dlxb.2008.09.026.
[14] 李岩. 乙烯在薄皮甜瓜果实香气物质合成中的作用与调控[D]. 沈阳: 沈阳农业大学, 2012: 43-45.
[15] ALFEREZ F, SINGH S, UMBACH A L, et al. Citrus abscission and Arabidopsis plant decline in response to 5-chloro-3-methyl-4-nitro-1H-pyrazole are mediated by lipid signalling[J]. Plant, Cell& Environment, 2005, 28(11): 1436-1449. DOI:10.1111/j.1365-3040.2005.01381.x.
[16] CENZANO A, CANTORO R, RACAGNI G, et al. Phospholipid and phospholipase changes by jasmonic acid during stolon to tuber transition of potato[J]. Plant Growth Regulation, 2008, 56(3): 307-316.DOI:10.1007/s10725-008-9311-6.
[17] 王国泽. 磷脂酶D感应和接受低温胁迫的功能及在黄瓜冷害中的作用[D]. 杭州: 浙江大学, 2006: 48.
[18] 张红宇, 万嗣宝, 尹京苑. 低温贮藏中桃果实磷脂酶D活性的测定[J].食品科技, 2012(5): 22-25. DOI:10.13684/j.cnki.spkj.2012.05.053.
[19] COWAN A K. Phospholipids as plant growth regulators[J]. Plant Growth Regulation, 2006, 48(2): 97-109. DOI:10.1007/s10725-005-5481-7.
[20] 乔勇进, 冯双庆, 李丽萍, 等. 热处理、多胺处理对黄瓜膜脂肪酸变化的影响[J]. 食品科学, 2006, 27(5): 246-249. DOI:10.1007/s10725-005-5481-7.
[21] WANG Xuemei. Plant phospholipases[J]. Annual Review of Plant Biology, 2001, 52(4): 211-231. DOI:10.1146/annurev.arplant.52.1.211.
[22] AVDIUSHKO S A, YE X S, Hildebrand D F, et al. Induction of lipoxygenase activity in immunized cucumber plants[J]. Physiological and Molecular Plant Pathology, 1993, 42: 83-95. DOI:10.1006/pmpp.1993.1007.
[23] MUNNIK T, VAN HIMBERGEN J A J, TER TIET B A, et al.Detailed analysis of the turnover of polyphosphoinositides and phosphatidic acid upon activation of phospholipases C and D in Chlamydomonas cells treated with non-permeabilizing concentrations of mastoparan[J]. Planta, 1998, 207(1): 133-145. DOI:10.1007/s004250050465.
[24] ZHAO Yuying, QIAN Chunlu, CHEN Jicheng, et al. Responses of phospholipase D and lipoxygenase to mechanical wounding in postharvest cucumber fruits[J]. Journal of Zhejiang University:Science B, 2010, 11(6): 443-450. DOI:10.1631/jzus.B0900357.
[25] NARVÁEZ-VÁSQUEZ J, FLORIN-CHRISTENSEN J, RYAN C A. Positional specificity of a phospholipase A activity induced by wounding, systemin, and oligosaccharide elicitors in tomato leaves[J].Plant Cell, 1999, 11(11): 2249-2260. DOI:10.1105/tpc.11.11.2249.
[26] BARGMANN B O, LAXALT A M, TER RIET B, et al. Reassessing the role of phospholipase D in the Arabidopsis wounding response[J].Plant, Cell and Environment, 2009, 32: 837-850. DOI:10.1111/j.1365-3040.2009.01962.x.
[27] MUNNIK T. Phosphatidic acid: an emerging plant lipid second messenger[J]. Trends in Plant Science, 2001, 6(5): 227-233.DOI:10.1016/S1360-1385(01)01918-5.
[28] 徐涛, 蒋玉梅, 李霁昕, 等. 采后BTH处理对“玉金香”厚皮甜瓜生理特性及感官品质的影响[J]. 食品工业科技, 2014, 35(11): 315-318.DOI:10.13386/j.issn1002-0306.2014.11.061.
[29] FAN Lu, ZHENG Suqin, WANG Xuemin. Antisense suppression of phospholipase D alpha retards abscisic acid- and ethylene-promoted senescence of postharvest Arabidopsis leaves[J]. Plant Cell, 1997,9(12): 2183-2196. DOI:10.2307/3870578.
[30] LEVERENTZ M K, WAGSTAFF C, ROGERS H J, et al.Characterization of a novel lipoxygenase-independent senescence mechanism in Alstroemeria peruviana floral tissue[J]. Plant Physiology, 2002, 130(1): 273-283. DOI:10.1104/pp.000919.
[31] CAO Shifeng, YANG Zhenfeng, CAI Yuting, et al. Fatty acid composition and antioxidant system in relation to susceptibility of loquat fruit to chilling injury[J]. Food Chemistry, 2011, 127(4):1777-1783. DOI:10.1016/j.foodchem.2011.02.059.
[32] 李辉, 林毅雄, 林河通, 等. 1-甲基环丙烯延缓采后“油(木奈)”果实衰老及其与膜脂代谢关系[J]. 中国食品学报, 2015, 15(12): 143-151.DOI:10.16429/j.1009-7848.2015.12.020.
[33] 蒋玉梅, 李轩, 毕阳, 等. 采前苯丙噻重氮处理抑制厚皮甜瓜采后挥发性物质的释放[J]. 农业工程学报, 2007, 23(3): 243-247.DOI:10.3321/j.issn:1002-6819.2007.03.048.
[34] 张娜. 采后BTH处理对“玉金香”甜瓜特征香气及LOX酶活性的影响[D]. 兰州: 甘肃农业大学, 2014: 30-35.
Effect of Postharvest Benzothiadiazole Treatment on Membrane Phospholipid Metabolism of Thick-Skinned Muskmelon
HU Yanyun1, LI Jixin1, WANG Yu1, WANG Bo1, ZHANG Guoxiang1, ZHANG Ruijun2, JIANG Yumei1,*
(1. Gansu Key Laboratory of Viticulture and Enology, Research and Development Center of Wine Industry of Gansu Province,College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China;2. Lanzhou Honggu District Food and Drug Inspection Center of Gansu Province, Lanzhou 730070, China)
Abstract:Phospholipids are one of the major constituents of cell membranes. Cell membrane stability is affected by phospholipid metabolism, in turn affecting plant growth, senescence and secondary metabolism. The plant resistance inducer benzothiadiazole (BTH) can improve disease resistance in muskmelon (Cucumis melo L.) after harvest, delay fruit senescence, and affect the production of aroma-active secondary metabolites. In the present work, we studied the changes in the contents of phosphatidyl cholines (PC), phosphatidylinositol (PI) and phosphatidic acid (PA) and the activities and gene expression levels of phospholipase A2(PLA2), phospholipase C (PLC) and phospholipase D (PLD) during the postharvest storage of muskmelon (Cucumis melo L. cv. Yujinxiang), and furthermore, we explored the mechanism of action of BTH in regulating phospholipid metabolism. The results showed that the activity and gene expression of phospholipase in pericarp were inhibited by BTH treatment during postharvest storage, and the activity peaks of PLA2, PLC and PLD in pericarp were reduced by 7.11%, 10.24% and 7.20%, respectively, as compared to the control. BTH treatment augmented the accumulation of PC and PI over the control; the peak values at the end of storage increased by 5.24% and 2.08%, respectively. BTH treatment decreased PA level in comparison to the control and distilled water treatment; PA levels in pericarp and flesh of BTH treated fruits were 20.72% and 8.51% lower than those in the control. BTH treatment inhibited unsaturated fatty acids less than saturated fatty acids. Accordingly, BTH treatment can control postharvest diseases in muskmelon by inhibiting the relative expression levels of PLC and PLD genes and reducing the enzyme activities and therefore decreasing fatty acid production and altering the degree of unsaturation of fatty acids, besides affecting the signal transduction pathways involved in cell membrane metabolism and the generation of secondary metabolites.
Keywords:benzothiadiazole; thick-skinned muskmelon; phospholipid metabolism; phospholipase; gene expression; fatty acid
DOI:10.7506/spkx1002-6630-201815025
收稿日期:2017-03-08
基金项目:国家自然科学基金地区科学基金项目(31160344)
第一作者简介:胡妍芸(1992—),女,硕士研究生,研究方向为果蔬贮藏保鲜及风味物质分析。E-mail:1043410429@qq.com
*通信作者简介:蒋玉梅(1973—),女,副教授,博士,研究方向为果蔬加工和食品挥发性风味物质分析。E-mail:jym316@126.com
中图分类号:S652.9;TS255.36
文献标志码:A
文章编号:1002-6630(2018)15-0165-09
引文格式:
胡妍芸, 李霁昕, 王雨, 等. 采后苯并噻重氮处理对厚皮甜瓜细胞膜磷脂代谢的影响[J]. 食品科学, 2018, 39(15):165-173. DOI:10.7506/spkx1002-6630-201815025. http://www.spkx.net.cn
HU Yanyun, LI Jixin, WANG Yu, et al. Effect of postharvest benzothiadiazole treatment on membrane phospholipid metabolism of thick-skinned muskmelon[J]. Food Science, 2018, 39(15): 165-173. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201815025. http://www.spkx.net.cn