表 1 CO2气调贮藏的实验分组
Table 1 Experimental grouping of CO2controlled atmosphere storage

周沫霖,胡卓炎*,余小林,赵 雷,罗 进
(华南农业大学食品学院,广东 广州 510642)
摘 要:本研究以‘怀枝’荔枝为试材,探究了采后预冷及CO2气调贮藏对果实γ-氨基丁酸(γ-aminobutyric acid,GABA)富集的影响,并比较了贮藏期间荔枝质构、色差、感官品质等指标的变化。结果表明:从荔枝GABA富集和贮藏品质来看,冰水预冷的效果均优于冷库预冷;荔枝CO2气调贮藏的GABA含量呈先上升后下降趋势,且更高体积分数的CO2气调贮藏组具有更高的GABA富集量,最高达19.97 mmol/kg mf,较气调贮藏前提高了40%;GABA含量与谷氨酸脱羧酶(glutamate decarboxylase,GAD)活力变化趋势相同,与γ-氨基丁酸转氨酶(γ-aminobutyric acid transaminase,GABA-T)活力变化趋势无相关性,表明荔枝GABA富集主要是由于GAD活力的增强催化了GABA的生成,而非GABA-T活力的下降抑制了GABA的分解;CO2气调贮藏能够抑制荔枝果肉的软化,延缓荔枝感官品质、果皮果肉色差值的下降;过高的CO2气调体积分数可能会引起荔枝的CO2损伤,使其迅速丧失商品价值。
关键词:荔枝;γ-氨基丁酸;富集;气调贮藏;预冷
荔枝(Litchi chinensis Sonn.)是一种分布于热带及亚热带的无患子科水果,其原产于中国南部及越南北部[1]。荔枝鲜果的货架期非常短,常温下不超过1 周。针对这一问题,研究者做了大量研究工作并发现荔枝鲜果对于高CO2体积分数(3%~5%)和低O2体积分数(4%~6%)的气调贮藏有着良好的耐受性,且该气调条件目前已应用于荔枝产业中,以保持果肉硬度、减少果实腐烂[2]。
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种广泛存在于原核和真核生物中的四碳非蛋白氨基酸,但是其含量往往非常低。在植物中,GABA作为代谢产物参与了三羧酸循环的两个分路[3]。它首先在谷氨酸脱羧酶(glutamate decarboxylase,GAD)的催化下,通过L-谷氨酸或其盐的不可逆的α-脱羧反应合成。之后,GABA在线粒体内的γ-氨基丁酸转氨酶(γ-aminobutyric acid transaminase,GABA-T)催化下,通过不可逆的转氨反应,转化为琥珀酸半醛[4-5]。在哺乳动物中,GABA可以通过超极化和分路抑制来降低神经的活动性,是中枢神经系统中最主要且含量最丰富的抑制性神经递质[6]。此外,GABA还能够抗焦虑、抗抑郁、抗过敏、抗癌、降血压、促进尿钠排泄以及调节激素分泌[7-12]。
GABA富集是植物系统应对非生物逆境(酸中毒、机械损伤、盐胁迫、热激冷激、低氧、干旱)的一种应激反应[13]。有研究证明,某些水果在应对高体积分数CO2环境时,其GABA会迅速富集,比如苹果、西红柿、草莓[14-16],而植物在非生物逆境中的GABA富集可能是通过提高GAD活力、降低GABA-T活力实现的[17]。同时,高体积分数CO2可能引起植物CO2损伤,而CO2损伤是一种在气调贮藏期间能够引起果蔬严重损伤的生理紊乱,这种损伤往往表现为果皮褐变和果肉软化[18-19]。众所周知,采后预冷对于荔枝冷链至关重要,其能够提供有效的温度管控,并且为随后的贮藏或销售移除田间热。对于荔枝等亚热带水果来说,采后预冷带来的瞬时低温相当于一种冷激胁迫,而有研究发现大豆、大麦、小麦在应对冷激胁迫时,GABA含量将会显著提高[20-21]。
关于荔枝在高体积分数CO2气调贮藏条件下的GABA富集研究,以及可能增加CO2诱发型生理损伤发生率的研究国内外鲜见报道。因此,本研究的主要目的是分析GABA富集与鲜果对高体积分数CO2环境的耐受性之间的关系,希望能够阐明在高体积分数CO2、低温的气调贮藏环境下激发GABA富集的机理,为获得富含GABA的荔枝产品提供理论支持,同时提供一种高效的高体积分数CO2气调贮藏方法。本实验以荔枝GABA代谢的相关产物及相关酶活力为指标,分析荔枝GABA富集与荔枝对高体积分数CO2气调贮藏的耐受性之间的关系;研究CO2气调环境对鲜果可溶性蛋白、硬度、色差、感官评定的影响。
荔枝鲜果:品种为‘怀枝’,2016年7月14日采摘于广州从化的商业果园。荔枝于成熟期被采摘,随后在2 h内转移到位于广州的实验室。到达后,荔枝立即按照色泽和大小被分类以保证样品一致,并剔除有任何损伤的荔枝。随后,将荔枝分别置于约4 ℃冰水混合物或4 ℃冷库中预冷2 h,使果温均降至4 ℃左右,立即测定预冷影响的相关指标。
GABA、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)、三羟甲基氨基甲烷盐酸盐(tris(hydroxymethyl)aminomethane-hydrochloride,Tris-HCl)、α-酮戊二酸、二硫苏糖醇(dithiothreitol,DTT)、磷酸吡哆醛(pyridoxal 5’-phosphatemonohydrate,PLP)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、丙酮酸、L-丙氨酸脱氢酶 美国Sigma-Aldrich公司;乙腈、甲醇美国Honeywell公司;Miracloth滤膜 德国Calbiochem公司;CO2、O2、N2混合气体 佛山华特气体有限公司;氯化镧、焦磷酸钾、L-谷氨酸、丙氨酸、邻苯二甲醛、磺基水杨酸、磷酸二氢钾、磷酸氢二钾、氢氧化钠、乙酸钠、乙酸、盐酸、β-巯基乙醇、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、考马斯亮蓝G-250、牛血清白蛋白等均为国产分析纯。
LC-10AT高效液相色谱仪、UV-2550PC紫外-可见分光光度计、AUW120D分析天平 日本Shimadzu公司;ZORBAX SB C18液相色谱柱 美国Agilent公司;Heto PowerDry PL3000冷冻干燥机 美国Thermo Fisher Scientific公司;5430R冷冻离心机 德国Eppendorf公司;Checkmate-9900气体分析仪 丹麦PBI-Dansensor公司;CM-3500d色差仪 日本Minolta公司;TA500质构仪英国Lloyd Instruments公司;FE20 pH计 瑞士Mettler-Toledo公司;HWS24恒温水浴锅 上海一恒科学仪器有限公司。
表 1 CO2气调贮藏的实验分组
Table 1 Experimental grouping of CO2controlled atmosphere storage

1.3.1 实验设计
24 kg经冰水预冷处理的‘怀枝’和24 kg经冷库预冷处理的‘怀枝’各自随机分成4组,每组6 kg,随后每组又被等分成3 个平行组,每个平行组2 kg。为了研究CO2气调贮藏的影响,上述荔枝分别被置于24 个独立的气调贮藏箱中,每个气调贮藏箱的体积大约为8 L,CO2气调贮藏实验的分组情况如表1所示。所有气调贮藏箱均与持续通气的气体控制系统相连接,以100 mL/min的气体流速分别流通不同组分的气体,并且使用气体分析仪每日监测气体成分。所有气调贮藏箱均置于4 ℃的冷库中贮藏20 d,且通过橡胶导管与置于冷库外的气体控制系统相连接。为了避免荔枝本身自发气调对气调贮藏箱内气体成分的影响,在整个贮藏期间,所有的气调贮藏箱均持续流通湿润空气或混合气。每2 d取样一次,每次分别从24 个气调贮藏箱中随机取5 颗荔枝。荔枝鲜果取出后,室温放置约1 h,测定果皮色差,随后去皮核,果肉沿果蒂方向纵切成两半。一半果肉液氮研磨,用于GABA以及相关代谢酶的分析。另一半果肉用于质构分析、果肉色差分析、感官评定。
1.3.2 检测指标
1.3.2.1 GABA含量的测定
GABA含量根据黄敏欣等[22]的方法测定,并做了部分修改。取100 mg邻苯二甲醛溶于5 mL甲醇,加入20 mL 0.4 mol/L硼酸缓冲液(pH 10.2)和300 μL β-巯基乙醇,得邻苯二甲醛衍生剂。取0.2 g荔枝果肉匀浆置于1 mL邻苯二甲醛衍生剂,振荡30 s,4 ℃、10 000×g离心5 min,取上清液,0.45 μm水系滤头过滤,待用。GABA含量的测定采用高效液相色谱仪,色谱柱为ZORBAX SB C18柱(250 mm×4.6 mm,5 μm);流动相A为25 mmol/L乙酸钠(乙酸调pH值至5.90±0.05),流动相B为乙腈;流速为1.0 mL/min,梯度洗脱程序为:0 min,90%流动相A,10%流动相B;30 min,40%流动相A,60%流动相B;35 min,40%流动相A,60%流动相B;40 min,90%流动相A,10%流动相B;45 min,90%流动相A,10%流动相B。柱温40 ℃;进样量10 μL;紫外检测器检测的波长为332 nm。
1.3.2.2 GAD、GABA-T活力的测定
酶提取参考Zhou Molin等[23]的方法,并作部分修改。称取2 g样品置于10 mL经过预冷的0.1 mol/L Tris-HCl缓冲液中(pH 9.1,含体积分数10%丙三醇、1 mmol/L DTT、2 mmol/L EDTA、1 mmol/L PLP、0.5 mmol/L PMSF),振荡10 min,Miracloth滤膜过滤,4 ℃、20 000×g离心20 min,取上清液用于GAD和GABA-T活力的测定。
GAD活力的测定参考Bartyzel等[24]的方法,并作部分修改。GAD活力以每秒每千克GAD催化生成GABA的物质的量表征,单位为mmol/(kg·s)。0.4 mL反应体系(包括0.25 mol/L磷酸钾缓冲液(pH 5.8)、0.04 mmol/L PLP、0.02 mL样品上清液)于30 ℃水浴预孵化10 min,随后添加0.04 mL 30 mmol/L L-谷氨酸启动反应,30 ℃水浴保温60 min后,添加0.1 mL 0.5 mol/L盐酸终止反应。反应终止后4 ℃、12 500×g离心10 min,取上清液以1.3.2.1节的方法测定GABA含量,并计算GAD活力。
GABA-T活力的测定参考Ansari等[25]的方法,并作部分修改。GABA-T活力以每秒每千克过丙氨酸脱氢酶(alanine dehydrogenase,ADH)催化生成丙氨酸(Ala)的物质的量表征,以Ala标准品绘制标准曲线(0~5×10-3mol/L),通过ADH的酶促反应确定Ala产量,单位为mmol/(kg·s)。GABA-T活力的测定由两部分组成:首先,0.5 mL反应体系一(包括50 mmol/L Tris-HCl缓冲液(pH 8.2)、1.5 mmol/L DTT、0.75 mmol/L EDTA、0.1 mmol/L PLP、体积分数10%丙三醇、15 mmol/L GABA、0.02 mL样品上清液)于30 ℃水浴预孵化10 min后,添加0.05 mL 40 mmol/L丙酮酸启动反应,30 ℃水浴60 min后,添加0.05 mL 40 mmol/L磺基水杨酸终止反应,得到已终止反应液。随后,0.5 mL反应体系二(包括70 mmol/L碳酸钠缓冲液(pH 10)、1.5 mmol/L NAD、0.1 unit ADH)于25 ℃水浴条件下预孵化20 min,添加0.02 mL已终止反应液启动反应,并25 ℃水浴20 min。在340 nm波长处测定反应启动时至水浴20 min时吸光度的增加量,并以Ala标准曲线计算Ala产量,进而计算GABA-T活力。
1.3.2.3 可溶性蛋白含量测定
可溶性蛋白含量根据Bradford[26]的方法测定,以牛血清白蛋白标准品绘制标准曲线(0~1 mg/mL)。
1.3.2.4 质构分析
荔枝鲜果置于室温中,平衡1 h。取已称质量的果肉切片(大约20 mm×20 mm×5.0 mm),置于Kramer剪切槽,探头下降速率为100 mm/min,检测果肉硬度。
1.3.2.5 色差分析
采用色差仪测定,每个荔枝测3 次色差(底部及赤道面两侧各1 次)。色差值表示为CIE L*(明度/暗度)、a*(红色/绿色)、b*(黄色/蓝色)。
1.3.2.6 感官评价
荔枝感官评价使用模糊综合评价法,由10 名经过培训的具有食品专业背景的硕士研究生组成感官评价小组,确定果皮色泽、果肉色泽、肉质、风味、汁液、香气为评价因素。
U={u1(果皮色泽),u2(果肉色泽),u3(肉质),u4(风味),u5(汁液),u6(香气)}
5 个水平被确定为评价水平:
V={v1(优),v2(良),v3(中等),v4(较差),v5(差)}
建立模糊矩阵,关联评价因素和评价水平:
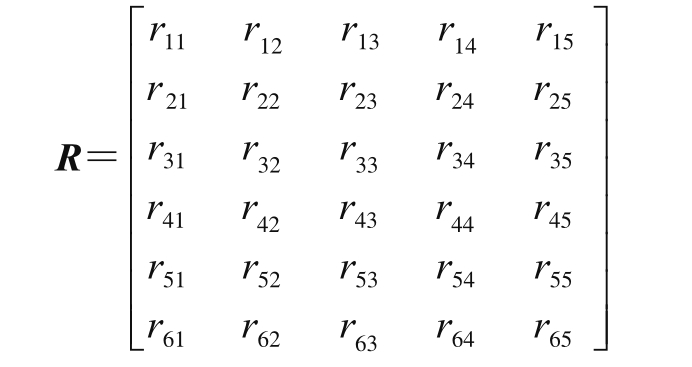
果皮色泽、果肉色泽、肉质、风味、汁液、香气的权重被确定为:
A={a1(果皮色泽),a2(果肉色泽),a3(肉质),a4(风味),a5(汁液),a6(香气)}
={0.1,0.2,0.2,0.2,0.2,0.1}
模糊综合评价的结果集为:

归一化组合索引值:
B’ =(b1’,b2’,b3’,b4’,b5’)
根据感官评价的特殊性,设置优:95 分,良:87.5 分,中等:82.5 分,较差:75 分,差:65 分;建立模糊综合评分矩阵[27]:
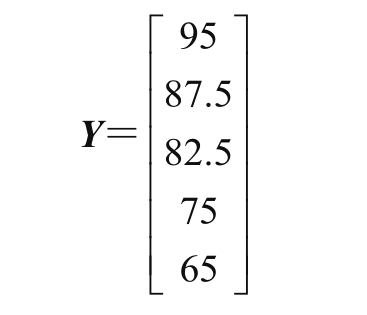
模糊综合评价总分:

实验设计为完全随机设计。采用SPSS 19.0统计软件进行数据分析,组间均值比较使用单因素方差分析(One-way ANOVA),数据表示为平均值±标准差,实验重复3 次。差异性检验使用邓肯氏新复极差法,P<0.05表示差异具有显著性。
表 2 预冷方式对荔枝果肉GABA含量、GAD活力、GABA-T活力、可溶性蛋白含量、硬度的影响
Table 2 Effects of different precooling methods on GABA content,GAD, GABA-T activities and total soluble protein content, pulp firmness of litchi

注:同行肩标字母不同表示差异显著(P<0.05)。
冷激胁迫是一种能引起某些植物GABA富集的非生物胁迫[28]。如表2所示,采后预冷作为冷激胁迫的一种方式,与对照(无预冷处理)相比,冰水预冷、冷库预冷均能显著提高荔枝的GABA含量、GAD活力、GABA-T活力,且冰水预冷处理组的增加量大于冷库预冷。该发现与前人对大豆、大麦、小麦的研究结果一致[20-21],而不同预冷处理组的GABA富集量差异可能是由于冷激胁迫强度的不同。与对照组相比,冰水预冷处理组和冷库预冷处理组的可溶性蛋白含量均显著下降,但两处理组之间没有显著性差异,这可能是由于采后预冷作为一种非生物胁迫,植物在应激胁迫的过程中,需要消耗一定量的可溶性蛋白以维持自身的正常生理活动。冰水预冷处理后的果肉硬度显著增加,而冷库预冷处理后的并没有显著变化。从荔枝果肉GABA富集和食用品质看,冰水预冷处理均有更好的效果。
GABA是荔枝生长过程中一种重要的氨基酸,参与了氧化应激防护、调节渗透平衡、维持细胞质溶质pH值、动态氮贮藏等植物生理生化功能[29]。如图1所示,从CO2气调贮藏的体积分数来看,在整个气调贮藏过程中,不论是经冰水预冷处理还是冷库预冷处理后,CO2气调贮藏后荔枝的GABA含量总体上呈先上升后下降的趋势。其中,经冰水预冷处理的荔枝的GABA含量在体积分数10% CO2气调贮藏的第4天达到峰值(19.97 mmol/kg mf),较第0天增加了0.4 倍;而冷库预冷处理的GABA含量在体积分数10% CO2气调贮藏的第6天达到峰值(17.13 mmol/kg mf),较第0天增加了0.5 倍。更高体积分数的CO2气调处理有着更高的GABA富集量,这个模式归因于高体积分数CO2气调处理将降低细胞质溶质的pH值,进而刺激GAD活力提高,从而导致GABA富集。此外,两种预冷处理的空气对照组的GABA含量均呈平稳下降的趋势。然而,本实验对于荔枝GABA富集的发现与其他园艺产品的研究并不一致。Deyman等[14]研究发现,不论是空气对照处理还是2.5 kPa CO2气调处理,苹果GABA含量均稳步增加;Blanch等[16]发现体积分数40% CO2气调处理的草莓有着最高水平的GABA富集量,而体积分数20% CO2气调处理的GABA富集量与空气对照组并没有显著差别;Merodio等[30]使用体积分数20%CO2+体积分数20% O2处理番荔枝,观察到GABA富集,而后将其转移至环境条件,GABA则迅速代谢分解。这些发现表明,不同园艺产品在应对CO2气调贮藏时的GABA富集模式有着巨大的差异,这可能是由于GABA富集是植物体内一种瞬时调节非生物胁迫的反应,在短暂富集后,会持续降低;而短暂富集的时间可能是几分钟或者几周,这取决于非生物胁迫的种类、强度以及物种对非生物胁迫的耐受性。从预冷方式来看,荔枝GABA富集的总体趋势并不受预冷方式的影响,但是经冰水预冷处理的GABA富集量高于冷库预冷处理。

图 1 气调贮藏对荔枝GABA含量的影响
Fig. 1 Effect of controlled atmosphere storage on GABA content of litchi

图 2 气调贮藏对荔枝GAD活力的影响
Fig. 2 Effect of controlled atmosphere storage on GAD activity of litchi
CO2气调贮藏作为一种非生物胁迫,能够导致细胞质酸化,而在应对细胞质酸化的过程中,植物GAD活力主要取决于细胞质pH值和Ca2+/钙调素(calmodulin,CaM)活性。如图2所示,所有CO2气调组的GAD活力与GABA含量变化趋势相同,均呈先上升后下降趋势,且更高体积分数的CO2气调组处理有着更高的GAD活力,而所有空气空白组均呈平稳下降趋势。对于经冰水预冷处理的荔枝,体积分数10% CO2实验组的GAD活力在气调贮藏的第4天达到峰值(24.81 mmol/(kg·s)),较第0天增加了0.8 倍;而经冷库预冷处理的荔枝,体积分数10% CO2实验组的GAD活力在第6天达到峰值(20.67 mmol/(kg·s)),较第0天增加了1.0 倍。与GABA含量相同的变化趋势可能是因为GAD是植物中最主要的GABA合成酶,它通过催化L-谷氨酸或其盐经不可逆的α-脱羧反应合成GABA。与GABA含量变化趋势相同,荔枝GAD活力的总体变化趋势同样不受预冷方式的影响,但是经冰水预冷处理的GAD活力高于冷库预冷处理。GAD活力的动态变化可以防止细胞溶质pH值的过度增加,同时增强植物对胞质酸化的抗性[31]。Gut[32]和Shelp[33]等研究发现,植物GAD在应对不同细胞质溶质pH值下的不同细胞内胁迫时,表现出两种相对独立的植物GAD调节机制:当pH值环境为中性时,植物通过Ca2+释放来诱导CaM的构象发生变化,引导GAD和CaM结合结构域相结合,从而激活GAD;当处于酸性pH值环境时,虽然GAD活力受主要受pH值调控,但是GAD依然可以通过从活性位点释放出CaM结合结构域来调节,即使此时这种由Ca2+/CaM来刺激提高GAD活力的作用是微不足道的。
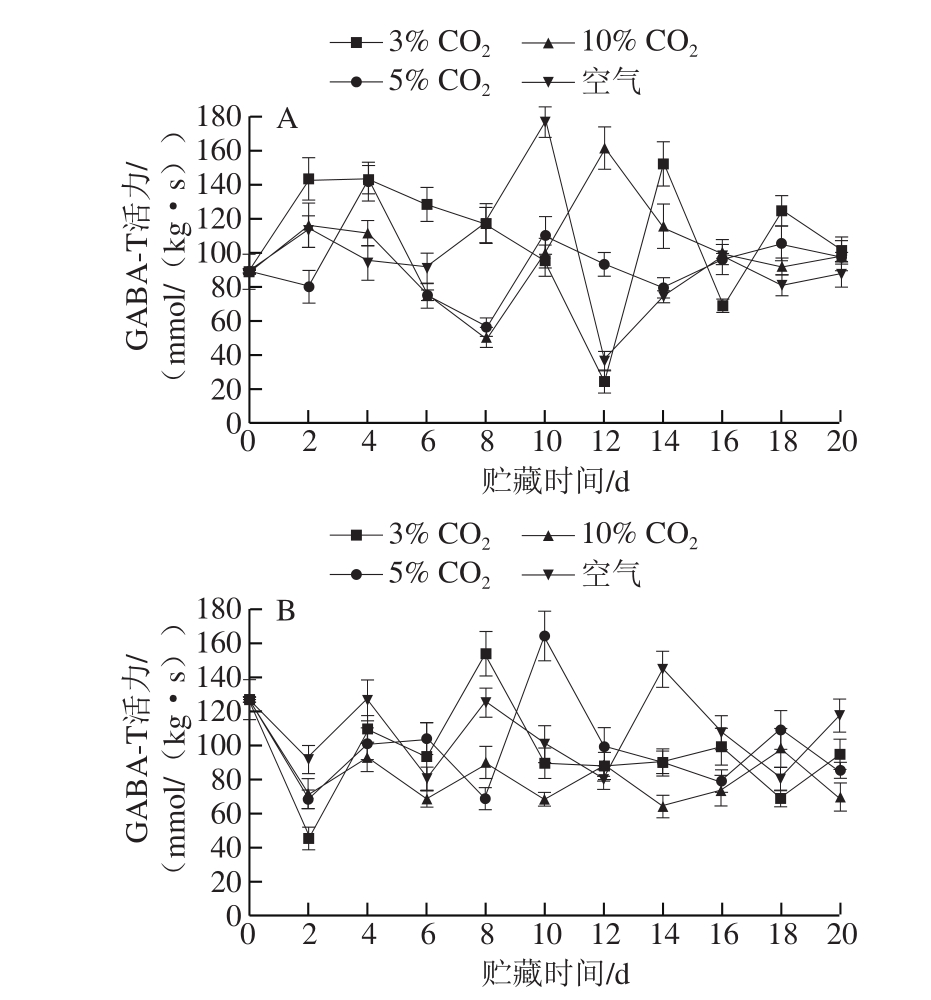
图 3 气调贮藏对荔枝GABA-T活力的影响
Fig. 3 Effect of controlled atmosphere storage on GABA-T activity of litchi
不同来源的GABA-T均属于PLP依赖型酶家族,并对作为氨基供体的GABA具有特异性,且在pH 7.8~9.5时活力最高,并以同源二聚体的自然结构存在[33-34]。如图3所示,所有实验组的GABA-T活力均呈波动状态,且均无显著的规律,表明荔枝GABA-T活力并没有受到预冷方式和CO2气调贮藏的影响,且在目前的研究中,GABA-T活力和GABA分解代谢之间并没有显著的统计学相关性。结合GAD、GABA-T活力的变化趋势,表明荔枝GABA在CO2气调贮藏过程中的富集是由于GAD活力提高而催化生产出更多GABA,而不是依靠降低GABA-T活力来减少GABA的降解。该结论为阐明CO2气调贮藏过程中的植物GABA富集调控机制提供了可能性:首先,高体积分数CO2气调环境导致植物组织的细胞质酸化,这可能是由于植物细胞的细胞质溶质、液泡、质外体腔室的pH值分别为7.2~7.6、5.8~5.9、5.6~6.0[35],而细胞腔室的分解程度不同导致质外体和液泡的质子释放到细胞质中[36],进而使得细胞质酸化。然后,细胞质酸化通过激活GAD活力来富集GABA。此外,随着反应的进行,pH值不断升高,当胞质pH值环境达到中性时,GAD变为Ca2+依赖型,并转而由CaM结合结构域来调控。
目前,可溶性蛋白对GABA富集的影响是有争议性的。Shelp等[37]研究表明,GABA的富集则是通过在胞质Ca2+/CaM依赖型GAD周围提高谷氨酸的浓度来实现的,而这个过程是通过减少可溶性蛋白合成、增加可溶性蛋白降解、抑制谷氨酰胺合成来实现的。而Xu Jiangguo等[38]则认为,在大豆(Glycine max L.)种子发芽过程中,GABA富集主要受GAD调节,而不需要通过蛋白质降解产生足够的谷氨酸。如图4所示,所有实验组的可溶性蛋白含量先上升后趋于相对稳定,大约稳定在80~180 mg/kg mf,究其原因,可能是荔枝持续的失水导致可溶性蛋白含量上升;随后,植物代谢消耗了一部分可溶性蛋白,降低了其含量,同时,不溶性蛋白转换为可溶性蛋白,增加了其含量,最终达到动态平衡,使得可溶性蛋白含量趋于平稳。其中,空气对照组的可溶性蛋白含量最高,体积分数10% CO2实验组含量最低,而不同预冷处理组间明显差异,表明可溶性蛋白含量受CO2气调环境影响,而不受预冷方式影响。这可能是由于可溶性蛋白是一种营养物质,而非应激产物,高强度的胁迫只会使植物消耗更多的营养物质以维持自身的正常生理功能。

图 4 气调贮藏对荔枝可溶性蛋白含量的影响
Fig. 4 Effect of controlled atmosphere storage on soluble protein content of litchi

图 5 气调贮藏对荔枝果肉硬度的影响
Fig. 5 Effect of controlled atmosphere storage on pulp firmness of litchi
机械性断裂时的剪切应力是用于检测果肉硬度的基本的质构分析方法。如图5所示,所有实验组的果肉硬度均呈下降趋势。从气调贮藏的CO2体积分数来看,体积分数3% CO2气调贮藏对于保持荔枝果肉硬度的效果最好,特别是在气调贮藏的后期,这可能是由于该体积分数的CO2气调能够更好地抑制荔枝果肉软化。而高体积分数CO2可能引起荔枝果肉的CO2损伤,进而导致果肉硬度迅速下降,这可能是由于细胞壁结构的分解和细胞壁降解酶活力的增强。从预冷方式来看,冰水预冷处理对保持荔枝果肉硬度的效果优于冷库预冷。
表 3 气调贮藏对荔枝果皮色差的影响
Table 3 Effect of controlled atmosphere storage on pericarp color of litchi

注:同一预冷方式,同行肩标字母不同表示差异显著(P<0.05)。下同。
荔枝果皮果肉的颜色对于其商品价值有着重要意义。由表3可知,所有实验组的L*值、a*值、b*值均随贮藏时间的延长呈下降趋势。从气调贮藏的CO2体积分数来看,体积分数5% CO2实验组的下降趋势慢于其他各气调实验组,特别是在气调贮藏的后期。这可能是由于较高的CO2气调体积分数能够降低控制荔枝果皮褐变的关键酶——多酚氧化酶的活力,进而延缓果皮褐变。同时,更高体积分数的CO2气调贮藏将会引起荔枝的CO2损伤,反而加速了荔枝腐败。从预冷方式来看,冰水预冷处理的色差值下降趋势慢于冷库预冷;这可能是由于在采后预冷过程中,相较冷库预冷,冰水预冷能够通过与冰水混合物直接接触,以热传导的形式降低果温,这种方式能够减少荔枝果皮水分的丧失、延缓果皮褐变。
表 4 气调贮藏对荔枝果肉色差的影响
Table 4 Effect of controlled atmosphere storage on pulp color of litchi

由表4可知,所有实验组的L*值、a*值、b*值随贮藏时间的延长均呈下降趋势,冰水预冷处理组的下降趋势慢于冷库预冷,但是各气调实验组间并没有显著差异
(除了冰水预冷处理组在气调贮藏第20天的L*值)。从气调贮藏的CO2体积分数来看,荔枝果肉色差的结果与果皮色差、果肉硬度变化结果均有所差异,虽然体积分数5% CO2的气调贮藏条件依然表现出最佳贮藏能力,但是各气调组间L*、b*值均没有表现出显著差异,这可能是由于果肉色差变化不同于果皮褐变,其并没有明显的色泽变化,且各样本之间有着较大的个体差异。此外,相比果皮色差较早出现褐斑等负面变化,果肉色差变化具有一定的滞后性。从预冷方式来看,冰水预冷能够更快地降低果温,从而迅速降低果肉的生理活性,有利于维持果肉色泽。
表 5 气调贮藏对荔枝感官品质的影响
Table 5 Effect of controlled atmosphere storage on sensory quality of litchi

荔枝作为一种水果,归根结底其直接受用对象是人,而荔枝的某些性状难以完全依靠仪器检测及化学分析,因此,感官评定在荔枝的综合评价中有着重要意义。如表5所示,所有实验组的感官得分均随贮藏时间的延长呈下降趋势,但是冰水预冷处理组的下降趋势慢于冷库预冷处理组,体积分数5% CO2实验组的下降趋势慢于其他各气调实验组。对于冰水预冷处理的荔枝,体积分数5% CO2实验组在第20天基本丧失了食用价值,而体积分数10% CO2实验组由于CO2损伤,在第16天已完全失去了食用价值,并整果褐变,且在果皮和果肉之间出现了“铁锈水”。这表明控制CO2损伤的发生率是CO2气调贮藏中一个关键点。同时,体积分数5% CO2实验组具有最高的感官得分,而体积分数3% CO2实验组与空气组之间没有明显差异,这表明筛选一个准确有效的CO2体积分数,并能够精准控制,对于提高荔枝CO2气调贮藏的效果至关重要。
在整个气调贮藏过程中,各CO2气调实验组的GABA含量和GAD活力均呈先上升后下降趋势,且更高体积分数的CO2气调贮藏与更高的GABA富集量、更高的GAD活力具有一致性;然而,各CO2气调实验组的GABA-T活力呈剧烈波动状态。该结果表明荔枝GABA富集是由于GAD活力的增强催化了GABA的生成,而不是由于GABA-T活力的下降抑制了GABA的分解。体积分数3% CO2气调贮藏能够抑制荔枝果肉的软化,而体积分数5% CO2气调贮藏能够延缓荔枝感官品质、荔枝果皮果肉色差值的下降,同时,过高的CO2体积分数可能会引起荔枝的CO2损伤。此外,从荔枝GABA富集和贮藏品质来看,冰水预冷的效果优于冷库预冷。
参考文献:
[1] LI J, JIANG Y. Litchi flavonoids: isolation, identification and biological activity[J]. Molecules, 2007, 12(4): 745-758.DOI:10.3390/12040745.
[2] 陈维信, 苏美霞, 李沛文. 荔枝气调贮藏的研究[J]. 华南农学院学报,1982, 3(3): 54-61.
[3] SHELP B J, WALTON C S, SNEDDEN W A, et al. GABA shunt in developing soybean seeds is associated with hypoxia[J]. Physiologia Plantarum, 1995, 94(2): 219-228. DOI:10.1111/j.1399-3054.1995.tb05304.x.
[4] LAMBERTS L, JOYE I J, BELIËN T, et al. Dynamics of γ-aminobutyric acid in wheat flour bread making[J]. Food Chemistry,2012, 130(4): 896-901. DOI:10.1016/j.foodchem.2011.08.004.
[5] TROBACHER C P, CLARK S M, BOZZO G G, et al. Catabolism of GABA in apple fruit: subcellular localization and biochemical characterization of two γ-aminobutyrate transaminases[J]. Postharvest Biology and Technology, 2013, 75: 106-113. DOI:10.1016/j.postharvbio.2012.08.005.
[6] MATSUKI T, TAKASU M, HIROSE Y, et al. GABAAreceptormediated input change on orexin neurons following sleep deprivation in mice[J]. Neuroscience, 2015, 284(22): 217-224. DOI:10.1016/j.neuroscience.2014.09.063.
[7] CHUANG C Y, SHI Y C, YOU H P, et al. Antidepressant effect of GABA-rich monascus-fermented product on forced swimming rat model[J]. Journal of Agricultural and Food Chemistry, 2011, 59(7):3027-3034. DOI:10.1021/jf104239m.
[8] CONSTANTIN S, JASONI C L, WADAS B, et al. γ-Aminobutyric acid and glutamate differentially regulate intracellular calcium concentrations in mouse gonadotropin-releasing hormone neurons[J].Endocrinology, 2009, 151(1): 262-270. DOI:10.1210/en.2009-0817.
[9] OH C H, OH S H. Effects of germinated brown rice extracts with enhanced levels of GABA on cancer cell proliferation and apoptosis[J]. Journal of Medicinal Food, 2004, 7(1): 19-23.DOI:10.1089/109662004322984653.
[10] SHIMADA M, HASEGAWA T, NISHIMURA C, et al.Anti-hypertensive effect of γ-aminobutyric acid (GABA)-rich chlorella on high-normal blood pressure and borderline hypertension in placebo-controlled double blind study[J].Clinical and Experimental Hypertension, 2009, 31(4): 342-354.DOI:10.1080/10641960902977908.
[11] YANG N C, JHOU K Y, TSENG C Y. Antihypertensive effect of mulberry leaf aqueous extract containing γ-aminobutyric acid in spontaneously hypertensive rats[J]. Food Chemistry, 2012, 132(4):1796-1801. DOI:10.1016/j.foodchem.2011.11.143.
[12] YOSHIMURA M, TOYOSHI T, SANO A, et al. Antihypertensive effect of a γ-aminobutyric acid rich tomato cultivar ‘DG03-9’ in spontaneously hypertensive rats[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 615-619. DOI:10.1021/jf903008t.
[13] KINNERSLEY A M, TURANO F J. Gamma aminobutyric acid(GABA) and plant responses to stress[J]. Critical Reviews in Plant Sciences, 2000, 19(6): 479-509. DOI:10.1080/07352680091139277.
[14] DEYMAN K L, BRIKIS C J, BOZZO G G, et al. Impact of 1-methylcyclopropene and controlled atmosphere storage on polyamine and 4-aminobutyrate levels in “Empire” apple fruit[J].Frontiers in Plant Science, 2014, 5: 1-9. DOI:10.3389/fpls.2014.00144.
[15] DEEWATTHANAWONG R, ROWELL P, WATKINS C B, et al.γ-Aminobutyric acid (GABA) metabolism in CO2treated tomatoes[J].Postharvest Biology and Technology, 2012, 57(2): 97-105.DOI:10.1016/j.postharvbio.2010.03.007.
[16] BLANCH M, SANCHEZ-BALLESTA M T, ESCRIBANO M I,et al. Water distribution and ionic balance in response to high CO2treatments in strawberries (Fragaria vesca L. cv. Mara de Bois)[J].Postharvest Biology and Technology, 2012, 73: 63-71. DOI:10.1016/j.postharvbio.2012.06.003.
[17] SHIMAJIRI Y, OZAKI K, KAINOU K, et al. Differential subcellular localization, enzymatic properties and expression patterns of γ-aminobutyric acid transaminases (GABA-Ts) in rice (Oryza sativa)[J].Journal of Plant Physiology, 2013, 170(2): 196-201. DOI:10.1016/j.jplph.2012.09.007.
[18] GAPPER N E, RUDELL D R, GIOVANNONI J J, et al. Biomarker development for external CO2injury prediction in apples through exploration of both transcriptome and DNA methylation changes[J].AoB Plants, 2013, 5: plt021. DOI:10.1093/aobpla/plt021.
[19] TIAN S P, XU Y, JIANG A L, et al. Physiological and quality responses of longan fruit to high O2or high CO2atmospheres in storage[J]. Postharvest Biology and Technology, 2002, 24(3): 335-340. DOI:10.1016/S0925-5214(01)00153-3.
[20] WALLACE W, SECOR J, SCHRADER L E. Rapid accumulation of γ-aminobutyric acid and alanine in soybean leaves in response to an abrupt transfer to lower temperature, darkness, or mechanical manipulation[J].Plant Physiology, 1984, 75(1): 170-175. DOI:10.1104/pp.75.1.170.
[21] MAZZUCOTELLI E, TARTARI A, CATTIVELLI L, et al.Metabolism of γ-aminobutyric acid during cold acclimation and freezing and its relationship to frost tolerance in barley and wheat[J]. Journal of Experimental Botany, 2006, 57(14): 3755-3766.DOI:10.1093/jxb./erl141.
[22] 黄敏欣, 赵文红, 朱豪, 等. 广东客家黄酒酒曲中微生物的初步鉴定及其产γ-氨基丁酸能力的研究[J]. 现代食品科技, 2015, 31(8): 95-102; 116. DOI:10.13982/j.mfst.1673-9078.2015.8.017.
[23] ZHOU Molin, NDEURUMIO K H, ZHAO Lei, et al. Impact of precooling and controlled-atmosphere storage on γ-aminobutyric acid(GABA) accumulation in longan (Dimocarpus longan Lour.) fruit[J].Journal of Agricultural and Food Chemistry, 2016, 64(33): 6443-6450.DOI:10.1021/acs.jafc.6b01738.
[24] BARTYZEL I, PELCZAR K, PASZKOWSKI A. Functioning of the γ-aminobutyrate pathway in wheat seedlings affected by osmotic stress[J]. Biologia Plantarum, 2003, 47(2): 221-225. DOI:10.1023/B:BIOP.0000022255.01125.99.
[25] ANSARI M I, LEE R H, CHEN S C G. A novel senescence-associated gene encoding γ-aminobutyric acid (GABA): pyruvate transaminase is upregulated during rice leaf senescence[J]. Physiologia Plantarum,2005, 123(1): 1-8. DOI:10.1111/j.1399-3054.2004.00430.x.
[26] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.DOI:10.1006/abio.1976.9999.
[27] 陈希, 李汴生, 梅灿辉, 等. 模糊综合评判在催陈黄酒感官分析的应用[J]. 现代食品科技, 2009, 25(4): 394-397. DOI:10.13982/j.mfst.1673-9078.2009.04.019.
[28] BOWN A W, SHELP B J. The metabolism and functions of γ-aminobutyric acid[J]. Plant Physiology, 1997, 115(1): 1-5.DOI:10.1104/pp.115.1.1.
[29] FAIT A, FROMM H, WALTER D, et al. Highway or byway: the metabolic role of the GABA shunt in plants[J]. Trends in Plant Science, 2008, 13(1): 14-19. DOI:10.1016/j.tplants.2007.10.005.
[30] MERODIO C, MUÑOZ M T, DEL CURA B, et al. Effect of high CO2level on the titres of γ-aminobutyric acid, total polyamines and some pathogenesis-related proteins in cherimoya fruit stored at low temperature[J]. Journal of Experimental Botany, 1998, 49: 1339-1347.DOI:10.1093/jxb/49.325.1339.
[31] AL-QURAAN N A, SARTAWE F A, QARYOUTI M M.Characterization of γ-aminobutyric acid metabolism and oxidative damage in wheat (Triticum aestivum L.) seedlings under salt and osmotic stress[J]. Journal of Plant Physiology, 2013, 170(11): 1003-1009. DOI:10.1016/j.jplph.2013.02.010.
[32] GUT H, DOMINICI P, PILATI S, et al. A common structural basis for pH- and calmodulin-mediated regulation in plant glutamate decarboxylase[J]. Journal of Molecular Biology, 2009, 392(2): 334-351. DOI:10.1016/j.jmb.2009.06.080.
[33] SHELP B J, BOZZO G G, TROBACHER C P, et al. Strategies and tools for studying the metabolism and function of γ-aminobutyrate in plants. I. pathway structure[J]. Botany, 2012, 90(8): 651-668.DOI:10.1139/B2012-030.
[34] CLARK S M, DI LEO R, DHANOA P K, et al. Biochemical characterization, mitochondrial localization, expression, and potential functions for an arabidopsis γ-aminobutyrate transaminase that utilizes both pyruvate and glyoxylate[J]. Journal of Experimental Botany,2009, 60(6): 1743-1757. DOI:10.1093/jxb/erp044.
[35] GOUT E, BLIGNY R, DOUCE R. Regulation of intracellular pH values in higher plant cells. carbon-13 and phosphorus-31 nuclear magnetic resonance studies[J]. Journal of Biological Chemistry, 1992,267(20): 13903-13909.
[36] BOWN A W, MACGREGOR K B, SHELP B J. Gammaaminobutyrate: defense against invertebrate pests[J]. Trends in Plant Science, 2006, 11(9): 424-427. DOI:10.1016/j.tplants.2006.07.002.
[37] SHELP B J, BOWN A W, MCLEAN M D. Metabolism and functions of gamma-aminobutyric acid[J]. Trends in Plant Science, 1999, 4(11):446-452. DOI:10.1016/s1360-1385(99)01486-7.
[38] XU Jiangguo, HU Qingping. Changes in γ-aminobutyric acid content and related enzyme activities in Jindou 25 soybean (Glycine max L.)seeds during germination[J]. LWT-Food Science and Technology,2014, 55(1): 341-346. DOI:10.1016/j.lwt.2013.08.008.
Impact of Postharvest Precooling and Controlled Atmosphere Storage on γ-Aminobutyric Acid (GABA)Accumulation and Storage Quality in Litchi (Litchi chinensis Sonn.) Fruits
ZHOU Molin, HU Zhuoyan*, YU Xiaolin, ZHAO Lei, LUO Jin
(College of Food Science, South China Agricultural University, Guangzhou 510642, China)
Abstract:The objective of the present study was to analyze γ-aminobutyric acid (GABA) accumulation associated with postharvest precooling and controlled-atmosphere storage as indicated by GABA metabolism in litchi (Litchi chinensis Sonn. cv. ‘Huaizhi’) fruits. In addition, changes in fruit firmness, color and sensory quality were monitored during storage.The results showed that iced water precooling was better than room precooling for GABA accumulation and storage quality.GABA concentration increased first and then decreased during high-CO2controlled-atmosphere storage, and the peak concentration (19.97 mmol/kg mf) was 1.4 times as high as that at harvest. There was a positive correlation between GABA concentration and glutamate decarboxylase (GAD) activity, while there was no correlation between GABA concentration and GABA transaminase (GABA-T) activity, indicating that GABA accumulation was mainly due to the enhanced GAD activity, promoting the synthesis of GABA, rather than the decreased GABA-T activity, inhibiting the catabolism of GABA.Pulp firmness, pericarp color and sensory quality of the controlled-atmosphere stored litchi fruits were significantly better than those of the fruits stored under normal atmosphere. Litchi fruits showed serious injury and promptly lost commodity value during excessive CO2controlled-atmosphere storage.
Keywords:litchi; γ-aminobutyric acid; accumulation; controlled-atmosphere storage; precooling
DOI:10.7506/spkx1002-6630-201815027
收稿日期:2017-04-28
基金项目:现代农业产业技术体系建设专项(CARS-33);广东省科技计划项目(2015A020209143);广东省扬帆计划创新团队项目(2014YT02H013)
第一作者简介:周沫霖(1988—),男,博士研究生,研究方向为食品加工与保藏。E-mail:tianruojinxi@163.com
*通信作者简介:胡卓炎(1961—),男,教授,博士,研究方向为食品加工与保藏。E-mail:zyhu@scau.edu.cn
中图分类号:TS255.36
文献标志码:A
文章编号:1002-6630(2018)15-0181-09
引文格式:
周沫霖, 胡卓炎, 余小林, 等. 采后预冷及气调贮藏对荔枝γ-氨基丁酸富集及贮藏品质的影响[J]. 食品科学, 2018,39(15): 181-189. DOI:10.7506/spkx1002-6630-201815027. http://www.spkx.net.cn
ZHOU Molin, HU Zhuoyan, YU Xiaolin, et al. Impact of postharvest precooling and controlled atmosphere storage on γ-aminobutyric acid (GABA) accumulation and storage quality in litchi (Litchi chinensis Sonn.) fruits[J]. Food Science, 2018,39(15): 181-189. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815027. http://www.spkx.net.cn