
胡 悦1,2,杜运鹏2,田翠杰3,张秀海2,任建武1,*
(1.北京林业大学生物科学与技术学院,北京 100083;2.北京农业生物技术研究中心,北京市功能花卉工程技术研究中心,北京市农林科学院,北京 100097;3.天津市北大港湿地自然保护区管理中心,天津 300270)
摘 要:百合属植物药食兼用、营养丰富,近年来已成为天然产物化学的研究热点。目前国内外对百合的研究仍较薄弱,一方面已开展研究的种较少,仍有许多种未被研究;另一方面百合研究主要集中于验证生物活性阶段,后续功能成分的分离、功能性食品和药品的开发方面也应继续加强。本文综述了百合属植物化学成分,包括多糖、皂苷、生物碱、酚类和甾类糖苷的研究进展,及其作为食品和药品的传统用途及生物功能,并对未来的研究方向进行展望。
关键词:百合;营养成分;活性物质;生物活性
百合科(Liliaceae)、百合属(Lilium)植物分布于北半球温带地区,约有110~115 个种。我国是百合属植物的主要分布区域之一,约有55 个种。近年来,人工培育的百合品种逐渐增多,目前登录品种超过2万 个。百合素有“云裳仙子”之称,其花朵硕大、花色艳丽、花姿百态、芳香怡人。许多百合属物种包括栽培品种和野生驯化种被人们广泛栽培,皆因为其美学价值。此外,百合鳞茎肉质肥厚、多片、色泽洁白、味甜清香、略有苦味,不仅是高蛋白、高碳水化合物和低脂肪的营养保健食品,而且具有良好的药用价值。百合花可做成百合花茶。百合是我国卫生部首批审批通过的药食同源植物。虽然目前《中华人民共和国药典》只收录了3 种百合:山丹(L. pumilum)、百合和卷丹(L. lancifolium)(其入药部位是干燥的肉质鳞叶,用于阴虚久咳、痰中带血、虚烦惊悸等[1]),但仍有相当多百合的营养物质未被完全探究和利用。本文总结近年来百合化学成分及其活性物质包括多糖、皂苷、生物碱、酚类和甾类糖苷的研究进展,以期对今后百合营养成分的分离鉴定,生物活性分析,功能验证及功能性食品、保健品和相关药品的开发等起到指导意义。
百合鳞茎的主要组成成分为碳水化合物、蛋白质和果胶,且脂肪含量极低。目前对百合的营养成分研究发现其主要的基本营养素包括糖、蛋白质、微量元素、膳食纤维和磷脂。研究种类主要集中于卷丹、兰州百合(L. davidii var. unicolor)、龙牙百合(L. brownii var. viridulum)、川百合(L. davidii)、药百合(L. speciosum Thunb. Var. gloriosoides Baker)、麝香百合(L. longiflorum)和百合(L. brownii)等(图1)。李红娟[2]对干燥后的卷丹和兰州百合鳞茎的基本成分进行比较,除淀粉、果胶、还原糖外,卷丹的蛋白质、脂肪、粗纤维、VC、总磷脂含量均高于兰州百合,且总氨基酸含量比兰州百合高出11.24%。微量元素除K、P外,Ca、Fe、Cu、Mn、Zn、Mg、Se含量均高于兰州百合。


图 1 目前百合属植物化学成分及其生物活性的研究种类
Fig. 1 Lily species previously studied for chemical components and bioactivities
A.卷丹(L. lancifolium);B.百合(L. brownii);C.川百合(L. davidii);D.岷江百合(L. regale);E.药百合(L. speciosum Thunb. Var. gloriosoides Baker);F.竹叶百合(L.hansonii);G.山丹(L. pumilum);H.麝香百合(L. longiflorum);I.兰州百合(L. davidii var. unicolor);J.圣母百合(L. candidum)。
百合中可溶性糖类含量与产地和品种有很大关系。高彦宁[3]对5 种不同产地百合的水溶性糖含量进行比较,发现卷丹>川百合>百合>山丹,其中卷丹以龙山县所产含量最高,为32.81%;百合以桂林所产最高,含量为23.06%。Li Xia等[4]对干燥后的江苏宜兴太湖地区和湖父镇所产卷丹、甘肃兰州和山西平陆所产兰州百合鳞茎的淀粉特性进行比较,研究表明两种产地、两种百合淀粉理化性质、形态和热性能差异显著,而热稳定性和凝胶化焓没有明显差异。其都表现出低肿胀力、高溶解性、呈β型结晶结构和高透明率的特点,且透明率随储存期增加而降低。Yu Xurun等[5]研究发现鳞茎淀粉与球芽淀粉的外部颗粒区域的有序结构相似,但鳞茎淀粉具有较高的结晶度、溶解度、起始温度和糊化焓。当用α-淀粉酶和盐酸水解时,鳞茎淀粉表现出更强的抗酶解作用,但较易被酸解。体外消化实验表明,相较于球芽淀粉,天然糊化的鳞茎淀粉含较低含量的消化淀粉和较高含量的抗性淀粉。
百合属植物的氨基酸含量较高,种类齐全,多种植物均含有17~19 种以上的游离氨基酸,其中6~7 种为人体必需的氨基酸,且精氨酸、脯氨酸和谷氨酸含量较高[6]。不同品种的百合氨基酸含量有较大差异,但氨基酸组分分布类似。
李琪等[7]研究发现兰州百合新鲜鳞片中含18 种水解氨基酸和20 种游离氨基酸,水解氨基酸中精氨酸、谷氨酸、天冬氨酸、亮氨酸、甘氨酸、丝氨酸、赖氨酸、脯氨酸、缬氨酸含量较多,尤其是精氨酸和谷氨酸含量最高;游离氨基酸中精氨酸含量最高。徐瑾等[8]对比兰州百合、龙牙百合和百合鳞茎中的游离氨基酸组成,发现3种百合氨基酸含量有较大差异,总已知游离氨基酸含量为9~14 mg/g,均含17种游离氨基酸,以精氨酸为主体,占总游离氨基酸含量的55%~64%;其次是谷氨酸和脯氨酸,占总游离氨基酸含量的7.7%~15.0%,再次是天冬氨酸、苏氨酸和甘氨酸等。陈立德等[9]研究发现龙牙百合花的氨基酸含量很高,为159.2 mg/g,构成龙牙百合花蛋白质氨基酸的17 种氨基酸中,除半胱氨酸的含量偏低外,其余16 种氨基酸含量均较高。含量最高的是谷氨酸,占氨基酸总量的18.03%,其次是精氨酸,占氨基酸总量的17.30%。孙红梅等[10]研究表明兰州百合鳞茎的游离氨基酸主要集中在顶芽和内部鳞片等幼嫩组织中,含量最高、变化最大的是精氨酸。顶芽的氨基酸总量及精氨酸含量随贮藏温度的升高而增加。贮藏过程中,鳞茎的氨基酸含量下降,顶芽和储备组织中其含量有明显升高的过程。
Wang Hexiang等[11]从百合的干燥鳞茎中分离出一种富集精氨酸和谷氨酸的蛋白质。该蛋白质被命名为lilin,其具有显著的抗真菌活性,能促进有丝分裂和抑制人类免疫缺陷病毒(human immunodeficiency virus,HIV)-1逆转录酶活性。其结构为单链,分子质量14.4 kDa,N-末端序列不同于百合科其他植物的几丁质酶和抗微生物蛋白。
百合属植物含有人体必需的多种微量元素,其中Ca、Mg、Fe、A1、K、P等含量较高。张黄琴等[12]对比两个主产地湖南龙山与安徽霍山的35 批卷丹的干燥鳞茎中微量元素的含量,发现K、P、Mg、Ca、Na、Si、Fe、Al元素含量较高,含量范围为7.200×103~1.955×104μg/g。两产地主要的差异性元素为K、P、Fe、Si、Na,所有样品中均未检测到Hg。
膳食纤维是一种不能被人体消化的碳水化合物,包括粗纤维和果胶等,而百合鳞茎是开发膳食纤维类功能性食品的优良材料。李玉帆等[13]称卷丹、百合和兰州百合的鳞茎都属于粗纤维食物,且粗纤维含量卷丹>百合>兰州百合。李忠海等[14]研究表明百合鳞茎的膳食纤维能改善小鼠总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇含量、动脉硬化指数和体质量,显著降低空腹血糖值,抑制餐后血糖的上升。常银子[15]证实百合膳食纤维能促进小鼠消化吸收,且呈现剂量效应关系。
百合鳞茎含有丰富的磷脂类化合物,磷脂的含量随百合品种而异,但组分变化不大。吴杲[16]、郭戎[17]等发现卷丹和百合鳞茎的总磷脂含量明显高于川百合、药百合及麝香百合。药百合的磷脂酰乙醇胺含量明显高于其他百合。卷丹和百合中磷脂酰胆碱含量最高,分别达70%和83%,其次是双磷脂酰甘油和磷脂酸。药百合、兰州百合和麝香百合中双磷脂酰甘油和磷脂酸的含量最高,两者相加占54%~64%,其次为磷脂酰胆碱、磷脂酰肌醇和溶血磷脂酰胆碱。
百合属植物化学成分最早被研究于1962年,目前研究主要集中于多糖、甾体皂苷、生物碱、酚类和甾类糖苷,其中甾体皂苷类化合物是其主要化学成分。通过研究百合属植物化学成分的生化活性,发现一些活性物质具有抗肿瘤、降血糖、抗氧化、消炎等作用(表1)。百合的种类研究集中于兰州百合、川百合、岷江百合(L. regale)、百合、卷丹、圣母百合(L. candidum)、山丹、竹叶百合(L. hansonii)和麝香百合等。
表 1 百合的功能研究现状
Table 1 Published chemical studies on lily
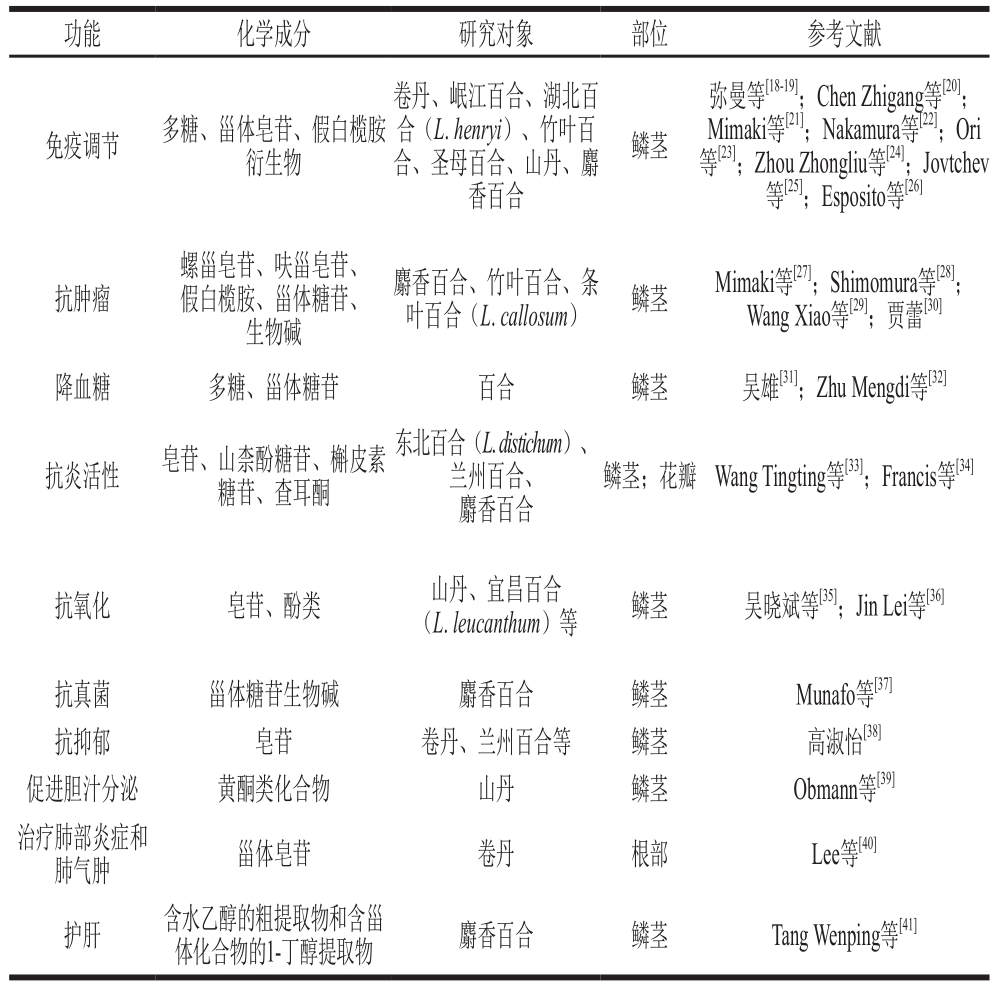
多糖是自然界中含量丰富的生物聚合物,由醛糖或酮糖通过糖苷键连接在一起。百合多糖具有抗氧化、抗肿瘤、免疫调节和降血糖的作用。弥曼等[18-19]发现百合多糖含有β-(1,3)-D-葡聚糖结构,其特异性受体主要分布于巨噬细胞表面,能显著提高免疫功能低下小鼠的单核巨噬细胞的吞噬能力、胸腺和脾脏质量和血清特异性抗体水平。Chen Zhigang等[20]研究发现从卷丹鳞茎中分离出的多糖能刺激巨噬细胞的增殖,25~400 μg/mL的水溶性多糖可增加巨噬细胞的吞噬活性和一氧化氮的产生,且呈剂量依赖性。多糖及其在巨噬细胞表面的受体激活了细胞中的信号转导通路并增加了细胞因子启动子如NO、白细胞介素-1、肿瘤坏死因子-α、干扰素-g等的分泌。这些免疫反应性分子作为内源信号,进一步诱导产生其他细胞因子,从而在身体免疫反应中发挥了调节作用。吴雄[31]研究证明百合多糖能提高机体抗氧化功能,抑制氧自由基对胰岛细胞的损伤和促进胰岛素的分泌,从而减缓糖尿病大鼠体质量的负增长,降低糖尿病大鼠的空腹血糖值。
不同品种、不同产地的百合多糖含量和结构不同,不同的醇沉浓度、分离纯化方法得到糖链结构也相异。李琼[42]称卷丹鳞茎中有3 种多糖,糖醛酸含量10%~15%,以吡喃糖和呋喃糖形式存在。Zhang Ji等[43]研究表明兰州百合鳞茎中的多糖含有3 个单糖分子,分别为D-甘露糖、D-葡萄糖和D-半乳糖,近似物质的量比为10∶19∶1。主链主要由α-1,4-糖苷键连接形式的β-葡萄糖和α-1,3-连接形式的α-甘露糖以2∶1比例组成。You Xuejiao等[44]采用不同于传统的Sevag和三氯乙酸法的酿酒酵母发酵法去除蛋白杂质,从卷丹鳞茎中提取非淀粉多糖。Zhao Baotang等[45]采用微波辅助提取兰州百合鳞茎的多糖,发现其主要由葡萄糖和甘露糖以物质的量比5.17∶4.82组成,重均相对分子质量为1.193×105,而且具有良好的抗氧化活性。Chen Zhigang等[20]用超声波辅助法提取了卷丹鳞茎中的水溶性多糖LLPS-1、LLPS-2和LLPS-3,其分子质量分别为350.5、403.3 kDa和146.2 kDa。LLPS-1和LLPS-2主要由葡萄糖和甘露糖以物质的量比约1∶2和1∶1组成,LLPS-3主要由阿拉伯糖、半乳糖、葡萄糖和甘露糖以物质的量比接近2∶2∶2∶1组成。
皂苷是苷元为三萜或螺旋甾烷类化合物的一类糖苷,按其苷元结构可以划分为甾体皂苷和三萜皂苷两大类。百合中皂苷成分总结如表2所示。不同品种的总皂苷元含量不同,高彦宁[3]对6 种百合的皂苷含量进行比较,称卷丹>川百合>百合>细叶百合(L. pumilum DC)>湖北百合(L. henryi)≈兰州百合。甾类皂苷是百合的特征性成分,目前已被发现具有抗肿瘤、抗抑郁、抗氧化、抑制Na+/K+ATP酶和环AMP磷酸二酯酶活性的功能。研究发现,甾类皂苷在不同组织器官含量是有差别的,花芽中含量最高,茎叶中含量相对偏低[46]。Mimaki等[21]从岷江百合和湖北百合的鳞茎,Nakamura等[22]从美丽×星象家(L. speciosum×L. nobilissimum ‘Star Gazer’)的鳞茎中分离出的甾体皂苷对环AMP磷酸二酯酶活性有抑制作用。Mimaki等[27]从麝香百合的鳞茎中分离出的螺甾皂苷和呋甾皂苷,能抑制HeLa癌细胞活性,具有抗肿瘤促进剂的功效。Mimaki等[47]从圣母百合的鳞茎,Zhou Zhongliu等[24]从山丹的鳞茎中分离出的甾体皂苷和酚苷能显著抑制Na+/K+ATP酶活性,表明在糖苷配基引入羟基能显著降低活性。高淑怡[38]称兰州百合、卷丹和山丹中的皂苷可明显改善大鼠体内血清中血清皮质醇、促肾上腺皮质激素、降钙素基因相关肽、血管活性肠肽的水平,且皂苷含量与抗抑郁作用具有一定的量效关系。吴晓斌等[35]发现百合鳞片皂苷对Co2+与H2O2产生的·OH有较强的清除作用,且强于人参皂苷。质量浓度大于1.0 mg/mL时,清除率高于30%;质量浓度为3.0 mg/mL时,清除率达90%左右。Lee等[40]发现卷丹根系提取物含多种甾体皂苷,对肺部炎症和肺气肿有一定的治疗效果。能显著减少暴露于香烟烟雾的小鼠的支气管肺泡中的巨噬细胞和嗜中性粒细胞的数量,降低肺部组织中的血清肿瘤坏死因子、白细胞介素-6、白细胞介素-1β、单核细胞趋化蛋白-1的蛋白分泌水平RNA表达水平。
Wang Tingting等[33]分析了不同成熟期的6 个食用百合属品种(江西建宁和山西平陆的龙牙百合、湖南龙山和江苏宜兴的卷丹、吉林四平的东北百合和甘肃兰州的兰州百合)的化学成分及其生化活性,研究表明成熟后期的百合鳞茎皂苷含量较高,酚酸和类黄酮含量较低。百合鳞茎通常具有显著的抗氧化、抗炎和镇静催眠能力。抗氧化能力与酚酸和类黄酮含量有关,抗炎和镇静催眠能力与皂苷含量有关。6 个品种中,东北百合与兰州百合的镇静催眠作用和抗炎活性效果更好。
表 2 百合中的皂苷成分
Table 2 Saponins identified in lilies

续表2

续表2
生物碱是指含负氧化态氮原子的碱性环状化合物。百合属植物鳞茎中的生物碱类成分主要为甾体类生物碱。目前其已被发现具有抗肿瘤、抗真菌、抑制环AMP磷酸二酯酶的功能,但同时对肾脏具有一定的毒性。百合中的生物碱成分总结如表3所示。Shimomura等[28]从百合属植物竹叶百合的鳞茎中首次分离出生物碱假白榄胺,发现其具有抗肿瘤的功效。Ori等[23]也从竹叶百合的鳞茎中分离出两种假白榄胺衍生物和3 种甾体皂苷,并证明其能抑制环AMP磷酸二酯酶的活性。Munafo等[48]量化分析麝香百合不同器官的呋甾皂苷和甾体糖苷生物碱,研究发现除根外,所有器官中的甾体糖苷生物碱均比呋甾皂苷浓度更高。甾体糖苷生物碱与呋甾皂苷的比例在光照下较高,且从地上器官到地下器官依次降低。Munafo等[37]发现麝香百合鳞茎中的甾体糖苷生物碱和呋甾皂苷通过抑制灰质B的代谢速率而具有抗真菌活性;生物碱(22R,25R)-螺甾-5-烯-3β-基O-α-L-吡喃鼠李糖基-(1→2)-β-D-吡喃葡萄糖苷首次被认为是一种甾体糖苷生物碱的真菌代谢物和麝香百合的自然产物。Uhlig等[53]称麝香百合花中至少有16种不同的甾体糖苷生物碱类似物。通过猫上皮肾细胞实验,发现这些成分具有一定的细胞毒性。Jovtchev等[25]从圣母百合的鳞茎中分离出山柰酚和假白榄胺,研究表明其可缓解细胞毒性和基因毒性对植物细胞和人体淋巴细胞的影响。贾蕾[30]称百合提取物生物碱能上调胃SGC-7901细胞Caspase-3蛋白的表达,显著抑制其生长,具有剂量和时间依赖性。
表 3 百合中的生物碱成分
Table 3 Alkaloids identified in lilies

百合中的酚类化合物主要分布在花、叶片和鳞茎中,其种类及含量随百合品种而异。目前从百合属植物鳞茎中分离出酚类糖苷、酚甘油类糖苷、酚甘油酯等酚类化合物和槲皮素、山柰酚等黄酮类化合物。百合中的酚类具有抗氧化、抗炎症,刺激胆汁分泌等作用。百合中的酚类成分总结如表4所示。Jin Lei等[36]对比了中国6 种百合鳞茎的抗氧化能力,发现岷江百合总酚含量最高、抗氧化能力最强,兰州百合总酚含量最低、抗氧化能力最弱。抗氧化能力顺序为岷江百合>有斑百合(L. concolor)和山丹>宜昌百合、卷丹和兰州百合。研究表明11 种单体酚中,这6 种百合鳞茎均含有7 种单体酚,包括没食子酸、儿茶素、表儿茶素、杨梅酮、芦丁、对香豆酸和山柰酚。而有斑百合的鳞茎中无槲皮素,山丹的鳞茎中无绿原酸和根皮素,卷丹的鳞茎中无绿原酸和芸香糖苷。岷江百合的鳞茎中儿茶素、杨梅酮、芦丁、槲皮素和根皮素含量最高,山丹的鳞茎中山柰酚和芸香糖苷的含量最高,有斑百合的鳞茎中绿原酸和表儿茶素含量最高,卷丹的鳞茎中对香豆酸和没食子酸含量最高。
表 4 百合中的酚类成分
Table 4 Phenolics in lilies

Shoyama等[58]在对莴苣幼苗的研究中,发现麝香百合鳞茎中的酚苷有抑制生长的作用。大部分的炎症主要归因于环氧合酶的表达和作用,Francis等[34]研究表明麝香百合花瓣中的山柰酚、山柰酚糖苷、槲皮素糖苷和查耳酮对环氧合酶-1和环氧合酶-2在80 mg/L有抑制作用,因而具有消炎作用。Obmann等[39]发现山丹的提取物水溶液富含黄酮类化合物,可以刺激不依赖胆汁盐的胆汁流,从而促进胆汁分泌。提取物中总黄酮含量为1.04%,成分有类黄酮类芦丁,山柰酚-3-O-芦丁和鼠李素-3-O-芦丁。
近年来,百合中甾体糖苷的抗真菌性、降血糖、降胆固醇、抗癌和保护肝脏的功能已被发现。Esposito等[26]研究表明麝香百合鳞茎中的甾体糖苷通过诱导NO产生、转化生长因子-β受体Ⅰ mRNA在成纤维细胞培养物中的表达,从而诱导真皮成纤维细胞迁移。百合中的甾体糖苷成分总结如表5所示。Tang Wenping等[41]在麝香百合鳞茎中发现有两种提取物具有肝保护活性,一种是含水乙醇的粗提取物(CB),另一种是富含甾体化合物的1-丁醇提取物。葡萄糖代谢仅在CB中改善,而且CB中存在的其他成分对低胆固醇血症和低血糖起作用。Zhu Mengdi等[32]从百合鳞茎中分离出29 种甾体糖苷,研究证实这些成分具有抗高血糖活性,能显著提高人体肝癌HepG2细胞和鼠3T3-L1脂肪细胞对葡萄糖的消耗量,并促进3T3-L1前脂肪细胞的分化。Wang Xiao等[29]在条叶百合鳞茎中发现6 种甾体糖苷,研究发现其对3 种人类癌细胞GSC-7901、K562和SPCA-1均显示细胞毒性,半抑制浓度在3.91~311.41 μmol/L之间。
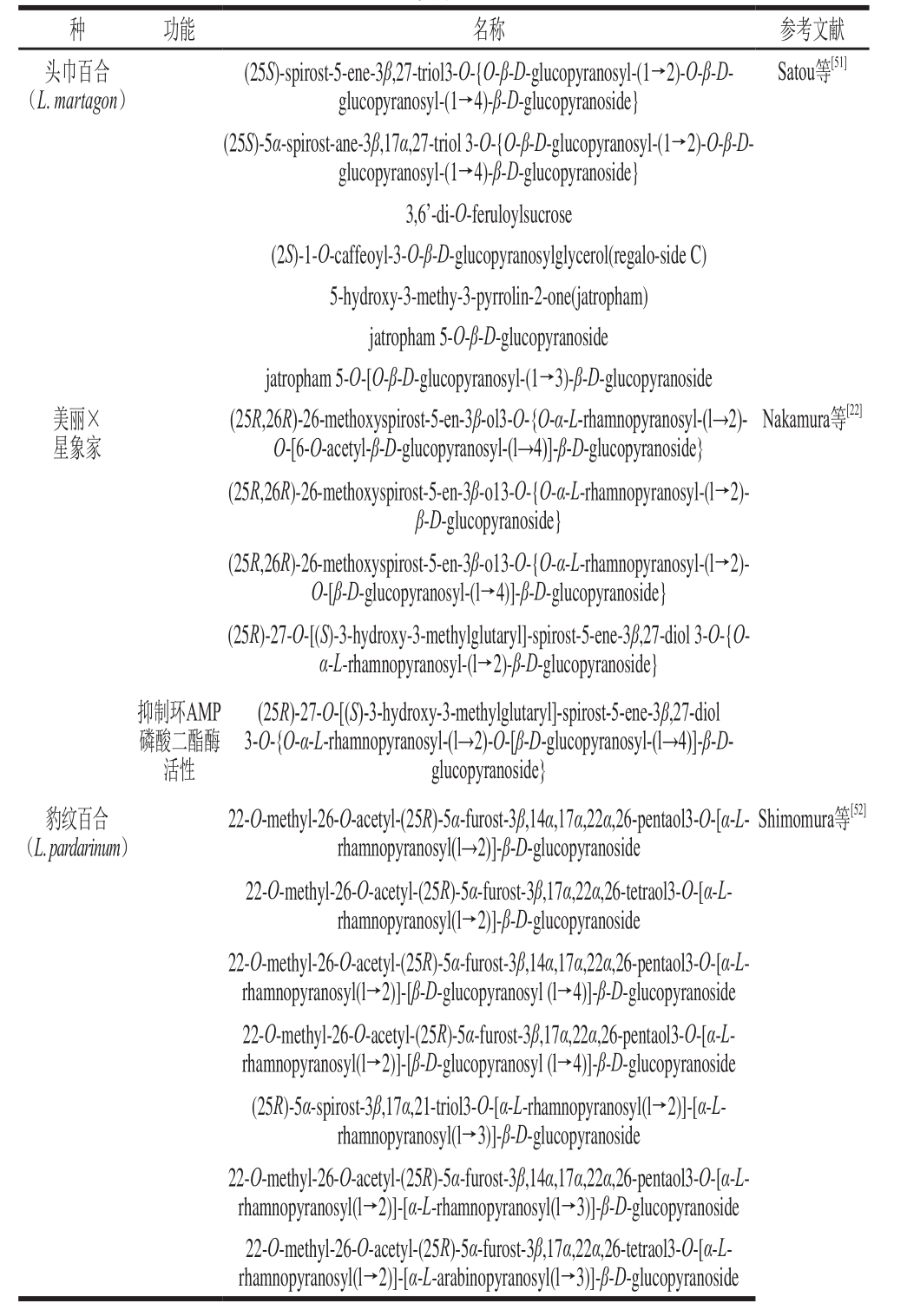
Nakano等[60]从日本大百合的花瓣、Satou等[51]从头巾百合鳞茎中均分离出苯丙素糖苷并鉴定了其结构。Luo Jianguang[64]从卷丹鳞茎中分离出7 种苯丙素糖苷并分析了其抗氧化能力,结果表明这7 种化合物的抗氧化能力具有相似的趋势,且羟基苯结构与二邻苯酚>单甲氧基苯酚或二甲氧基苯酚>单羟基苯或二羟基苯。Munafo等[65]称麝香百合含大量苯丙素甘油糖苷,其能抵御植物病原体和紫外、高强度可见光,具有医药用途,且地面上器官所含苯丙素甘油糖苷含量高于鳞茎和肉质根10~100 倍。
表 5 百合中的甾体糖苷成分
Table 5 Steroidal glycosides identified in lilies

续表5

续表5

百合属植物种类丰富,但综合国内外研究情况,目前开展研究的百合大约只有10余种,其中麝香百合、百合、卷丹,圣母百合和山丹相关研究报道较多,其他野生种和杂交种并未被深入研究。另外,对于珍稀濒危的野生百合资源,如何在保护的基础上合理地开发利用是摆在科研工作者面前亟待解决的问题。
对甾体糖苷和生物碱的研究目前主要集中于麝香百合。在猫肾脏上皮细胞实验中,甾体糖苷生物碱已被证明是主要的细胞毒性成分,但所含具体毒性成分的结构、含量、毒理机制解析以及其他百合是否也具有潜在的毒性并未深入展开研究。大部分炎症主要归因于环氧合酶的表达和作用,因此抑制环氧合酶的作用可以被认为是预防慢性疾病的起点。目前卷丹中的酚苷已被发现对环氧合酶-1、环氧合酶-2有抑制作用。根据上述思路,一方面研究人员可以继续对卷丹中的酚苷的抗炎症作用进行深入研究;另一方面,可以探究其他百合中酚苷含量及抗炎症的效果。目前国内外对百合的研究主要集中于用体外和动物实验验证生物活性阶段,下一步应继续加强研究功能成分的分离以及适当开展临床实验,同时注重功能性食品和药品的开发。
百合中的活性物质含量随不同生长时期、不同产地和不同器官的变化而变化。应进行全程追踪,合理评价,建立一个更规范的标准。目前百合的食用和药用并没有一个严格的标准,市场较为混乱,研究发现有些百合的生物碱含量较高,长期食用对人体会产生毒害作用;因此,食用、药用百合的标准制定应该加以规范。
综上所述,百合是药食兼用、营养丰富的绿色食品,但还存在很多问题需深入系统研究,以保障其食用、药用安全性。因此,应筛选、开发百合属各原种和杂交种,细致地分离和探究百合中的各类营养成分、活性物质,并重视百合下游产品的开发,使其在食品和医药等行业发挥应有的作用。
参考文献:
[1] 卫生部药典委员会. 中华人民共和国药典[M]. 北京: 化学工业出版社, 2005: 88.
[2] 李红娟. 卷丹百合营养成分、活性物质及栽培特性的研究[D]. 杨凌: 西北农林科技大学, 2007: 18-23.
[3] 高彦宁. 百合CAP几项关键技术及有效成分含量的研究[D]. 长沙:湖南中医药大学, 2007: 20-37.
[4] LI Xia, GAO Wenyuan, JIANG Qianqian, et al. Physicochemical,morphological, and thermal properties of starches separated from bulbs of four Chinese lily cultivars[J]. Starch-Stärke, 2012, 64(7): 545-551.DOI:10.1002/star.201100189.
[5] YU Xurun, ZHANG Jing, SHAO Shanshan, et al. Morphological and physicochemical properties of bulb and bulbil starches from Lilium lancifolium[J]. Starch-Stärke, 2015, 67(5/6): 448-458. DOI:10.1002/star.201400209.
[6] 王琦. 兰州百合化学成分的研究[D]. 杨凌: 西北农林科技大学,2007: 7-8.
[7] 李琪, 李广, 张会妮. 兰州百合新鲜鳞片中水解及游离氨基酸分析[J].食品科学, 2012, 33(20): 277-281. DOI:10.14188/j.ajsh.2011.03.003.
[8] 徐瑾, 叶爱英, 丁敬敏. 百合中氨基酸组成测定与营养功能分析[J].氨基酸和生物资源, 2011, 33(3): 18-20. DOI:10.14188/j.ajsh.2011.03.003.
[9] 陈立德, 刘新桃, 蒋盛岩, 等. 龙牙百合花氨基酸含量的柱前衍生OPA-HPLC法测定[J]. 安徽农业科学, 2011, 39(18): 10832-10833;10836. DOI:10.13989/j.cnki.0517-6611.2011.18.183.
[10] 孙红梅, 李天来, 李云飞. 低温贮藏期间百合鳞茎中的游离氨基酸组分和含量变化[J]. 植物生理学通讯, 2004(4): 414-418.DOI:10.13592/j.cnki.ppj.2004.04.003.
[11] WANG Hexiang, NG T B. Isolation of lilin, a novel arginineand glutamate-rich protein with potent antifungal and mitogenic activities from lily bulbs[J]. Life Sciences, 2002, 70(9): 1075-1084.DOI:10.1016/S0024-3205(01)01472-2.
[12] 张黄琴, 严辉, 钱大玮, 等. 不同产地百合药材中无机元素的分析与评价[J]. 中国现代中药, 2016, 18(8): 960-966. DOI:10.13313/j.issn.1673-4890.2016.8.004.
[13] 李玉帆, 明军, 王良桂, 等. 百合基本营养成分和活性物质研究进展[J].中国蔬菜, 2012(24): 7-13.
[14] 李忠海, 常银子, 曹清明, 等. 百合膳食纤维对小白鼠消化吸收功能的影响[J]. 食品科技, 2004, 29(9): 95-97. DOI:10.13684/j.cnki.spkj.2004.09.031.
[15] 常银子. 百合膳食纤维功能评价的研究[D]. 长沙: 中南林学院,2003: 9-24.
[16] 吴杲, 吴汉斌. 五种百合药材磷脂成分的分析[J]. 现代应用药学,1997(2): 16-17; 68. DOI:10.13748/j.cnki.issn1007-7693.1997.02.007.
[17] 郭戎, 周永治, 许益民, 等. 百合磷脂组分的研究及品种鉴定的数学判别[J]. 中药材, 1991(9): 32-35. DOI:10.13863/j.issn1001-4454.1991.09.016.
[18] 弥曼, 任利君, 梅其炳, 等. 百合多糖对小鼠免疫功能的影响[J]. 第四军医大学学报, 2007(22): 2034-2036.
[19] 弥曼, 李汾, 任利君, 等. 百合多糖的分离纯化及抗肿瘤作用[J]. 西安交通大学学报(医学版), 2009, 30(2): 177-180.
[20] CHEN Zhigang, ZHANG Danni, ZHU Qu, et al. Purification,preliminary characterization and in vitro immunomodulatory activity of tiger lily polysaccharide[J]. Carbohydrate Polymers, 2014, 106:217-222. DOI:10.1016/j.carbpol.2014.02.004.
[21] MIMAKI Y, SASHIDA Y, NAKAMURA O, et al. Steroidal saponins from the bulbs of Lilium regale, and L. henryi[J]. Phytochemistry,1993, 33(3): 675-682. DOI:10.1016/0031-9422(93)85472-4.
[22] NAKAMURA O, MIMAKI Y, NISHINO H, et al. Steroidal saponins from the bulbs of Lilium speciosum × L. nobilissimum ‘Star Gazer’and their antitumour-promoter activity[J]. Phytochemistry, 1994, 36(2):463-497. DOI:10.1016/S0031-9422(00)97096-1.
[23] ORI K, MIMAKI Y, MITO K, et al. Jatropham derivatives and steroidal saponins from the bulbs of Lilium hansonii[J]. Phytochemistry, 1992,31(8): 2767-2775. DOI:10.1016/0031-9422(92)83627-B.
[24] ZHOU Zhongliu, FENG Zongcai, FU Chunyan, et al. Steroidal and phenolic glycosides from the bulbs of Lilium pumilum DC and their potential Na+/K+ATPase inhibitory activity[J]. Molecules, 2012, 17(9):10494-10502. DOI:10.3390/molecules170910494.
[25] JOVTCHEV G, GATEVA S, STANKOV A. Lilium compounds kaempferol and jatropham can modulate cytotoxic and genotoxic effects of radiomimetic zeocin in plants and human lymphocytes in vitro[J]. Environmental Toxicology, 2014, 31(6): 751-764.DOI:10.1002/tox.22088.
[26] ESPOSITO D, MUNAFO J P, LUCIBELLO T, et al. Steroidal glycosides from the bulbs of Easter lily (Lilium longiflorum Thunb.) promote dermal fibroblast migration in vitro[J]. Journal of Ethnopharmacology, 2013, 148(2): 433-440. DOI:10.1016/j.jep.2013.04.032.
[27] MIMAKI Y, NAKAMURA O, SASHIDA Y, et al. Steroidal saponins from the bulbs of Lilium longiflorum and their antitumour-promoter activity[J]. Phytochemistry, 1994, 37(1): 227-232.DOI:10.1016/0031-9422(94)85030-5.
[28] SHIMOMURA H, SASHIDA Y, MIMAKI Y, et al. Jatropham glucoside from the bulbs of Lilium hansonii[J]. Phytochemistry, 1987,26(2): 582-583. DOI:10.1016/S0031-9422(00)81463-6.
[29] WANG Xiao, WU Guoqing. A new steroidal glycoside and potential anticancer cytotoxic activity of compounds isolated from the bulbs of Lilium callosum[J]. Journal of Chemical Research, 2014, 38(10):577-579. DOI:10.3184/174751914X14109503283663.
[30] 贾蕾. 百合对人胃癌SGC-7901细胞的增殖抑制作用及其机制的探讨[D]. 延安: 延安大学, 2015: 25-37.
[31] 吴雄. 百合多糖对I型糖尿病大鼠的降血糖作用研究[D]. 长沙: 湖南师范大学, 2013: 17-28.
[32] ZHU Mengdi, LUO Jianguang, LÜ Huawei, et al. Determination of anti-hyperglycaemic activity in steroidal glycoside rich fraction of lily bulbs and characterization of the chemical profiles by LC-QTOF-MS/MS[J]. Journal of Functional Foods, 2014, 6(1): 585-597.DOI:10.1016/j.jff.2013.12.002.
[33] WANG Tingting, HUANG Hanhan, ZHANG Yao, et al. Role of effective composition on antioxidant, anti-inflammatory, sedativehypnotic capacities of 6 common edible Lilium varieties[J]. Journal of Food Science, 2015, 80(4): H857-H868. DOI:10.1111/1750-3841.12787.
[34] FRANCIS J A, RUMBEIHA W, NAIR M G. Constituents in Easter lily flowers with medicinal activity[J]. Life Sciences, 2004, 76(6): 671-683. DOI:10.1016/j.lfs.2004.10.001.
[35] 吴晓斌, 任凤莲, 邱昌桂, 等. 百合皂苷的提取、纯化及其对自由基的清除作用[J]. 天然产物研究与开发, 2005(6): 777-780.DOI:10.16333/j.1001-6880.2005.06.028.
[36] JIN Lei, ZHANG Yanlong, YAN Linmao, et al. Phenolic compounds and antioxidant activity of bulb extracts of six Lilium species native to China[J]. Molecules, 2012, 17(8): 9361-9378. DOI:10.3390/molecules17089361.
[37] MUNAFO J P, GIANFAGNA T J. Antifungal activity and fungal metabolism of steroidal glycosides of Easter lily (Lilium longiflorum Thunb.) by the plant pathogenic fungus, Botrytis cinerea[J]. Journal of Agricultural and Food Chemistry, 2011, 59(11): 5945-5954.DOI:10.1021/jf200093q.
[38] 高淑怡. 百合总皂苷质量标准研究及抗抑郁伴肠易激综合征的作用初探[D]. 广州: 广州中医药大学, 2013: 66-81.
[39] OBMANN A, TSENDAYUSH D T, ZEHL M, et al. Extracts from the Mongolian traditional medicinal plants Dianthus versicolor Fisch. and Lilium pumilum Delile stimulate bile flow in an isolated perfused rat liver model[J]. Journal of Ethnopharmacology, 2010, 131(3): 555-561.DOI:10.1016/j.jep.2010.07.029.
[40] LEE E J, YUN N Y, JANG Y P, et al. Lilium lancifolium Thunb.extract attenuates pulmonary inflammation and air space enlargement in a cigarette smoke-exposed mouse model[J]. Journal of Ethnopharmacology, 2013, 149(1): 148-156. DOI:10.1016/j.jep.2013.06.014.
[41] TANG Wenping, MUNAFO J P, PALATINI K, et al. Hepatoprotective activity of Easter lily (Lilium longiflorum Thunb.) bulb extracts[J].Journal of Agricultural and Food Chemistry, 2015, 63(44): 9722-9728.DOI:10.1021/acs.jafc.5b04078.
[42] 李琼. 百合多糖提取纯化及结构鉴定[D]. 长沙: 湖南农业大学,2010: 38-48.
[43] ZHANG Ji, GAO Yixia, ZHOU Xiangjun, et al. Chemical characterisation of polysaccharides from Lilium davidii[J]. Natural Product Research,2010, 24(4): 357-369. DOI:10.1080/14786410903182212.
[44] YOU Xuejiao, XIE Chunyan, LIU Kunlun, et al. Isolation of nonstarch polysaccharides from bulb of tiger lily (Lilium lancifolium Thunb.) with fermentation of Saccharomyces cerevisiae[J].Carbohydrate Polymers, 2010, 81(1): 35-40. DOI:10.1016/j.carbpol.2010.01.051.
[45] ZHAO Baotang, ZHANG Ji, Guo Xiao, et al. Microwave-assisted extraction, chemical characterization of polysaccharides from Lilium davidii var. unicolor Salisb and its antioxidant activities evaluation[J].Food Hydrocolloids, 2013, 31(2): 346-356. DOI:10.1016/j.foodhyd.2012.11.021.
[46] MUNAFO J P, GIANFAGNA T J. Quantitative analysis of steroidal glycosides in different organs of Easter lily (Lilium longiflorum Thunb.) by LC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2011, 59(3): 995-1004. DOI:10.1021/jf1036454.
[47] MIMAKI Y, SATOU T, KURODA M, et al. Steroidal saponins from the bulbs of Lilium candidum[J]. Phytochemistry, 1999, 51(4): 567-573. DOI:10.1016/S0031-9422(99)00022-9.
[48] MUNAFO J P, RAMANATHANA, JIMENEZ L S, et al. Isolation and structural determination of steroidal glycosides from the bulbs of Easter lily (Lilium longiflorum Thunb.)[J]. Journal of Agricultural and Food Chemistry, 2010, 58(15): 8806-8813. DOI:10.1021/jf101410d.
[49] MIMAKI Y, SASHIDA Y. Sterodial saponins and alkaloids from the Bulbs of Lilium brownii var. colchesteri[J]. Chemical and Pharmaceutical Bulletin, 1990, 38(11): 3055-3059. DOI:10.1248/cpb.38.3055.
[50] HONG Xiaoxiao, LUO Jianguang, GUO Chao, et al. New steroidal saponins from the bulbs of Lilium brownii var. viridulum[J].Carbohydrate Research, 2012, 361: 19-26. DOI:10.1016/j.carres.2012.07.027.
[51] SATOU T, MIMAKI Y, KURODA M, et al. A pyrroline glucoside ester and steroidal saponins from Lilium martagon[J]. Phytochemistry,1996, 41(4): 1225-1230. DOI:10.1016/0031-9422(95)00723-7.
[52] SHIMOMURA H, SASHIDA Y, MIMAKI Y. Steroidal saponins,pardarinoside A–G from the bulbs of Lilium pardarinum[J].Phytochemistry, 1989, 28(11): 3163-3170. DOI:10.1016/0031-9422(89)80299-7.
[53] UHLIG S, HUSSAIN F, WISLOFF H. Bioassay-guided fractionation of extracts from Easter lily (Lilium longiflorum) flowers reveals unprecedented structural variability of steroidal glycoalkaloids[J].Toxicon, 2014, 92: 42-49. DOI:10.1016/j.toxicon.2014.09.004.
[54] MAŠTEROVÁ I, UHRIN D, TOMKO J. Lilaline: a flavonoid alkaloid from Lilium candidum[J]. Phytochemistry, 1987, 26(6): 1844-1845.DOI:10.1016/S0031-9422(00)82304-3.
[55] EISENREICHOVÁ E, HALADOVÁ M, BUČHOVÁ A, et al.A pyrroline-pyrrolidine alkaloid from Lilium candidum bulbs[J].Phytochemistry, 1992, 31(3): 1084-1085. DOI:10.1016/0031-9422(92)80088-V.
[56] NAKANO K, NISHIZAWA K, MURAKAMI K, et al. Steroidal alkaloid glycosides from Lilium cordatum[J]. Phytochemistry, 1986,26(1): 301-303. DOI:10.1016/S0031-9422(00)81532-0.
[57] TAI C S, UEMOTO S, SHOYAMA Y, et al. Biologically active phenolics from Lilium longiflorum[J]. Phytochemistry, 1981, 20(11):2565-2568. DOI:10.1016/0031-9422(81)83095-6.
[58] SHOYAMA Y, HATANO K, NISHIOKA I, et al. Phenolic glycosides from Lilium longiflorum[J]. Phytochemistry, 1987, 26(11): 2965-2968.DOI:10.1016/S0031-9422(00)84572-0.
[59] SHIMOMURA H, SASHIDA Y, MIMAKI Y, et al. Studies on the chemical constituents of Lilium henryi Baker[J]. Chemical and Pharmaceutical Bulletin, 1988, 36(7): 2430-2446. DOI:10.1016/0031-9422(81)83095-6.
[60] NAKANO K, NISHIZAWAK, TAKEMOTO I, et al. Flavonol and phenylpropanoid glycosides from Lilium cordatum[J]. Phytochemistry,1989, 28(1): 301-303. DOI:10.1016/0031-9422(89)85070-8.
[61] SHIMOMURA H, SASHIDA Y, MIMAKI Y. Phenolic glycerides from Lilium auratum[J]. Phytochemistry, 1987, 26(3): 844-845.DOI:10.1016/S0031-9422(00)84801-3.
[62] CHEN Guanlin, CHEN Songgen, XIE Yingqing, et al. Total phenolic,flavonoid and antioxidant activity of 23 edible flowers subjected to in vitro digestion[J]. Journal of Functional Foods, 2015, 17: 243-259.DOI:10.1016/j.jff.2015.05.028.
[63] ZHELEVA-DIMITROVA D, GEVRENOVA R, NIKOLOVA M.HPLC-UV phenolic profiles and radical scavenging potential of Aurinia uechtritziana, Centaurea aren aria and Lilium jankae[J].Multidisciplinary Sciences, 2015, 68(9):1009-1106.
[64] LUO Jianguang, LI Lu, KONG Lingyi. Preparative separation of phenylpropenoid glycerides from the bulbs of Lilium lancifolium by high-speed counter-current chromatography and evaluation of their antioxidant activities[J]. Food Chemistry, 2012, 131(3): 1056-1062.DOI:10.1016/j.foodchem.2011.09.112.
[65] MUNAFO J P, GIANFAGNAT J. Quantitativeanalysis of phenylpropanoid glycerol glucosides in different organs of Easter lily (Lilium longiflorum Thunb.)[J]. Journal of Agricultural and Food Chemistry, 2015, 63(19): 4836-4842. DOI:10.1021/acs.jafc.5b00893.
[66] KANEDA M, MIZUTANI K, TAKAHASHI Y, et al. Lilioside A and B, two new glycerol glucosides isolated from Lilium longiflorum thunb[J]. Tetrahedron Letters, 1974, 15(45): 3937-3940. DOI:10.1016/S0040-4039(01)92050-7.
[67] MIMAKI Y, SASHIDA Y, SHIMOMURA H. Lipid and steroidal constituents of Lilium auratum var. platyphyllum and L. tenuifolium[J].Phytochemistry, 1989, 28(12): 3453-3458. DOI:10.1016/0031-9422(89)80363-2.
[68] MATSUO Y, TAKAKU R, MIMAKI Y. Novel steroidal glycosides from the bulbs of Lilium pumilum[J]. Molecules, 2015, 20(9): 16255-16265. DOI:10.3390/molecules200916255.
[69] KANEDA M, MIZUTANI K, TANAKA K. Lilioside C, a glycerol glucoside from Lilium lancifolium[J]. Phytochemistry, 1982, 21(4):891-893. DOI:10.1016/0031-9422(82)80087-3.
[70] NAKANO K, NISHIZAWAK, TAKEMOTO I, et al. Furostanol glycosides from Lilium cordatum[J]. Phytochemistry, 1988, 27(6):1897-1898. DOI:10.1016/0031-9422(88)83118-2.
[71] SHIMOMURA H, SASHIDA Y, MIMAKI Y, et al. Regaloside A and B, acylated glycerol glucosides from Lilium regale[J]. Phytochemistry,1988, 27(2): 451-454. DOI:10.1016/0031-9422(88)83118-2.
[72] SHIMOMURA H, SASHIDA Y, MIMAKI Y. Bitter phenylpropanoid glycosides from Lilium speciosum var. rubrum[J]. Phytochemistry,1986, 25(12): 2897-2899. DOI:10.1016/S0031-9422(00)83765-6.
[73] KANEDA M, KOBAYASHI K, NISHIDA K, et al. Liliosides D and E, two glycerol glucosides from Lilium japonicum[J]. Phytochemistry,1984, 23(4): 795-798. DOI:10.1016/S0031-9422(00)85029-3.
[74] MIMAKI Y, ISHIBASHI N, ORI K, et al. Steroidal glycosides from the bulbs of Lilium dauricum[J]. Phytochemistry, 1992, 31(5): 1753-1758. DOI:10.1016/0031-9422(92)83141-K.
A Review of Chemical Components and Their Bioactivities from the Genus Lilium
HU Yue1,2, DU Yunpeng2, TIAN Cuijie3, ZHANG Xiuhai2, REN Jianwu1,*
(1. College of Biological Sciences and Technology, Beijing Forestry University, Beijing 100083, China;2. Beijing Agro-biotechnology Research Center, Beijing Functional Flower Engineering Technology Research Center,Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097, China;3. Tianjin Beidagang Wetland Nature Reserve Management Center, Tianjin 300270, China)
Abstract:Plants from the genus Lilium are used for both medicinal and culinary purposes as a rich source of nutrients.In recent years, they have aroused tremendous research interest in the field of natural product chemistry. However, to date, limited research efforts have been dedicated to the study of Lilium. Only a few Lilium species have been studied.Furthermore, most of the current studies concentrate on the validation of bioactivities, and thus more efforts are needed to study the separation of functional constituents and to develop functional foods and pharmaceuticals from Lilium. This paper summarizes recent progress in the study of nutrients and bioactive components including polysaccharides, saponins,alkaloids, phenols and steroidal glycosides in Lilium as well as its traditional medicinal and culinary applications and bioactive functions. Moreover, future research directions are also proposed.
Keywords:Lilium; nutrient; bioactive substance; bioactivity
DOI:10.7506/spkx1002-6630-201815047
收稿日期:2017-04-29
基金项目:北京市科委项目(Z161100000916004);北京市农林科学院青年基金项目(201619);国家自然科学基金青年科学基金项目(31601781);北京市农业科技项目(20160109)
第一作者简介:胡悦(1994—),女,硕士研究生,研究方向为天然产物研究开发。E-mail:1506360692@qq.com
*通信作者简介:任建武(1967—),男,教授,博士,研究方向为天然产物研究开发。E-mail:jianwur@sina.com
中图分类号:S567.23
文献标志码:A
文章编号:1002-6630(2018)15-0323-10
引文格式:
胡悦, 杜运鹏, 田翠杰, 等. 百合属植物化学成分及其生物活性的研究进展[J]. 食品科学, 2018, 39(15): 323-332.DOI:10.7506/spkx1002-6630-201815047. http://www.spkx.net.cn
HU Yue, DU Yunpeng, TIAN Cuijie, et al. A review of chemical components and their bioactivities from the genus Lilium[J]. Food Science, 2018, 39(15): 323-332. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815047. http://www.spkx.net.cn