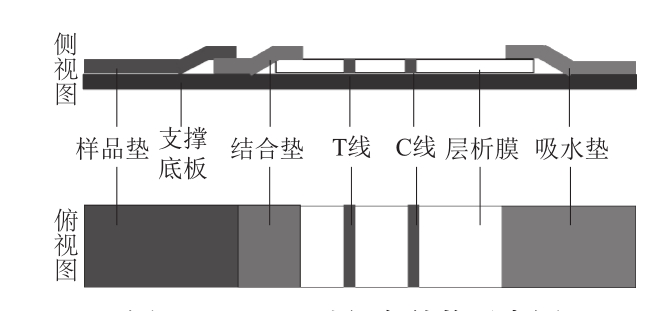
图 1 LFCA试纸条结构示意图
Fig. 1 Structural diagram of LFCA test strip
马 兰,王淑娟,曾海娟,谢曼曼,丁承超,翟绪昭,郭 亮,孙静娟,李 杰,胡 谦,刘 箐*
(上海理工大学医疗器械与食品学院,上海 200093)
摘 要:在毛细管层析作用下,基于抗原抗体特异性结合或核酸探针和靶向核酸杂交反应来检测样品中的目标物质的侧流层析技术与传统检测方法相比,以其成本低、特异性强、稳定性高、节省时间、不需专业人员、可现场检验、结果肉眼可见等优势,广泛运用在人体临床医学、动植物医学、食品安全、环境监测等领域。本文重点介绍了侧流层析技术的背景、原理、设计以及国内外应用现状、发展前景等,以期为侧流层析技术的发展提供参考。
关键词:侧流层析技术;临床医学;食品安全;环境监测
近年来,快速检测需求的增加刺激了新技术在临床诊断、环境监测和食品安全分析等领域的发展。目前已有很多技术可用于检测小分子和生物大分子,包括气相色谱-质谱联用技术、高效液相色谱-质谱联用技术、高效液相色谱技术、酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)技术和生物传感器技术等。这些技术大都特异性强、灵敏度高,但耗时长且需要昂贵的仪器以及专业的操作人员。和传统方法相比,侧流层析技术(lateral flow chromatographic assay,LFCA)有很多优势,如成本低、易操作、快速、可实现现场检测及结果肉眼可见等[1-3]。基于上述优势,自LFCA出现以来,其在基础及应用研究领域取得了快速的发展。
1980年首次研制出检测人绒毛膜促性腺激素的LFCA试纸被用以诊断早孕。自此以后,LFCA被广泛的运用于检测各种分子,包括肿瘤标志物、微生物、霉菌毒素、重金属和农药等。本文主要从LFCA的原理、技术结构、研究动态等方面予以阐述。
LFCA主要是基于免疫识别或者核酸杂交以及抗体标记技术,使待检测物中各组分(抗原、抗体、蛋白质、核酸等)通过毛细管作用力的移动速度差异,在反应基质上实现分离的色谱系统[4-6]。
LFCA由4 个部分组成,即样品垫、结合垫、层析膜和吸水垫,将这4 个部分叠加于支撑底板上就构成了一个简易的LFCA试纸条(图1)。样品垫为经过处理的纤维膜或玻璃棉,用于快速吸收待检样品,使其利用毛细管作用向结合垫方向侧向流动。结合垫为纤维膜或玻璃棉,吸附有标记的生物活性材料(如金标抗体),它可与待检样品溶液里的检测靶标结合形成肉眼可见的免疫复合物。层析膜大都为硝酸纤维素(nitrocellulose,NC)膜,它是LFCA的关键材料,为分析物之间的反应提供了平台,其上固定有两条或多条不同生物活性物质(如抗原或抗体)喷印的“检测(test,T)线”和“质控(control,C)线”,用于拦截带标记的免疫复合物,并可直观地显示检测结果。吸水垫为吸水纸板,用于吸收流过层析膜的待检样品,以平衡层析膜两边的压差,促使更多待检样品在层析膜上侧向流动[7]。

图 1 LFCA试纸条结构示意图
Fig. 1 Structural diagram of LFCA test strip
LFCA是一项基于抗原抗体特异性结合或核酸探针和靶向核酸杂交反应来检测样品中目标物质的有效技术。其中,当抗体被用作生物识别因素时,LFCA又叫免疫层析试纸快速检测技术。它是一种20世纪80年代发展起来的将标记免疫技术和色谱层析技术结合起来的固相膜免疫分析方法,依据其免疫层析反应时抗原与抗体结合方式的不同,主要分为两类,即双抗体夹心免疫层析法和竞争免疫层析法[8]。
1.2.1 双抗体夹心免疫层析技术原理
由于含有较多的抗原位点,双抗体夹心法适用于检测大分子物质。该模式中使用了3 种抗体:第一种是被标记材料标记在结合垫上的将与样品中抗原特异性结合的单克隆抗体1(monoclonal antibody 1,mAb1);第二种是喷印在T线上的与不同抗原决定簇结合的捕获单克隆抗体2(monoclonal antibody 2,mAb2)或多克隆抗体(polyclonal antibody,pAb);第三种是被喷印在C线上的抗种属特异性免疫球蛋白G(immunoglobulin G,IgG)的“抗抗体”(俗称二抗)。
以胶体金标记法为例,其检测原理如下:利用待测抗原上的两个抗原决定簇A和B分别与结合垫上的金标抗体和T线上的捕获抗体结合,形成“金标抗体(mAb1)-待测抗原-捕获抗体(mAb2或pAb)”复合物;该复合物因为有胶体金的缘故而显红色,复合物的形成量与待测抗原含量成正比[9],C线将未被T线拦截的金标抗体mAb1及部分抗原-金标抗体复合物拦截并反应显色。于是,当滴加到样品垫上的待测样品通过毛细管作用向前层析到结合垫上时,会溶解其上的金标抗体并一同向前涌动:如果样品中含有抗原,T线和C线均会显现红色;反之,T线无条带,C线显红色(图2);C线不显色则结果不能判断。

图 2 双抗体夹心LFCA原理图[10]
Fig. 2 Schematic diagram for the principle of sandwich LFCA[10]
1.2.2 竞争免疫层析法原理
小分子不能同时结合两种及两种以上的抗体,而竞争法检测模式为竞争抑制性的免疫学结合反应,所以竞争法适用于抗原位点较少或仅有单个抗原位点的小分子化合物的检测。该方法中使用了两种抗体,一种是与样品中抗原特异性结合的抗体,另一种是喷印在C线上的二抗。与双抗体夹心法不同的是,竞争免疫层析法试纸条结果表现为:若样品中无靶标抗原,则T线和C线处均显现条带;反之,若样品中有靶标抗原,则C线处显现条带,T线处无条带,T线条带颜色深度与靶标抗原含量成反比;C线不显条带则结果不能判断。
竞争法分两种模式,一种用于检测抗原,另一种是当抗原材料中的干扰物质不易除去或不易得到足够的纯化抗原时,用来检测特异性抗体。以胶体金标记为例,在第一种检测抗原的模式中,用胶体金标记一定量的靶标抗原并固定在结合垫上,T线与C线分别喷涂与靶标抗原特异性结合的抗体(一抗)以及抗种属特异性IgG的“抗抗体”(俗称二抗):对于阴性样品,金标抗原随样品侧向流动,在T线处与一抗结合,在C线处与二抗结合,结果T线和C线均显现红色;对于阳性样品,样品中未被标记的靶标抗原和结合垫上金标的靶标抗原通过竞争与T线处的一抗结合,样品中的靶标抗原越多,结合在T线上的金标抗原越少,显色也就越浅,而过量的金标抗原与C线处的二抗结合,故只有C线显现红色(图3)。
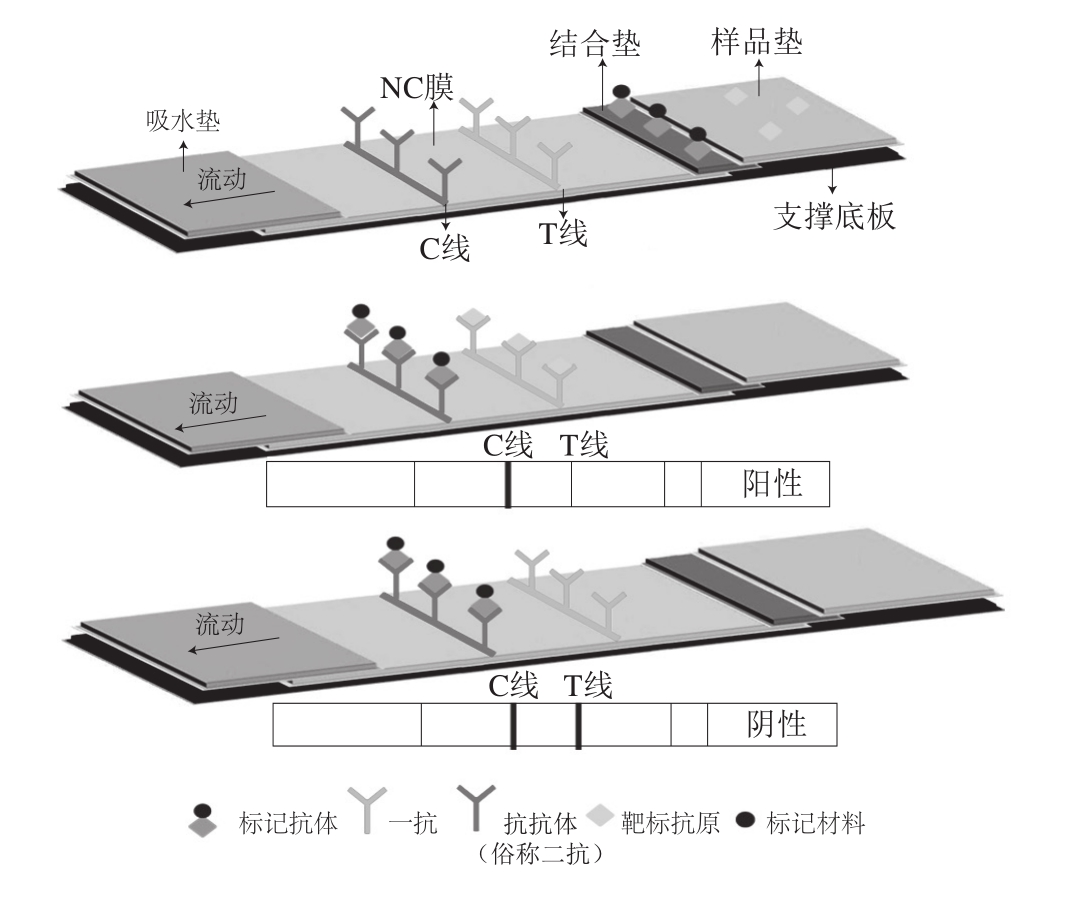
图 3 竞争法LFCA原理图(模式一)
Fig. 3 Schematic diagram for the principle of competitive LFCA (mode 1)

图 4 竞争法LFCA原理图(模式二)
Fig. 4 Schematic diagram for the principle of competitive LFCA (mode 2)
在第二种检测抗体的模式中,将抗体用胶体金标记在结合垫上,T线和C线分别包含抗原与载体分子(通常为牛血清白蛋白(bovine serum albumin,BSA))的结合物以及抗种属特异性IgG的“抗抗体”(俗称二抗)。样品中的靶标抗体和结合垫上的金标抗体共同竞争T线上的抗原与载体分子的结合物:对于阴性样品,结合垫上的金标抗体分别与T线和C线上的固定物反应结合,使T线和C线均显现红色;对于阳性样品,样品中的靶标抗体会优先和T线上的抗原与载体分子的结合物特异性结合,样品中的靶标抗体越多,结合在T线上的金标抗体就越少,显色也越浅,而过量的金标抗体与C线处的二抗结合,故只有在C线处显现红色(图4)[6,11-12]。
由于亲和素和生物素间特异性强、亲和力大、可分别结合各种大小分子而构成亲和素-生物素系统(avidinbiotin system,ABS),将核酸和LFCA结合起来。类似ABS,生物素-生物素抗体、生物素-链霉亲和素、荧光素-荧光素抗体、地高辛-地高辛抗体等系统也具有这种桥梁连接作用。基于此,互补的核苷酸序列(DNA与DNA、DNA与RNA、RNA与RNA等)通过Watson-Crick碱基配对形成非共价键,从而形成稳定的同源或异源双链分子的核酸杂交过程,核酸也可被用作LFCA的生物识别元件。检测结果及分析如下:T线和C线均显条带者为阳性样品;C线显色而T线不显色者为阴性样品;C线不显色则结果不能判断。依据方法过程中是否需要抗体,基于核酸的LFCA中分为两种类型,一种是抗体依赖型(又称“核酸侧流免疫(nucleic acid lateral flow immunoassay,NALFIA)”),另一种是抗体非依赖型(又称“核酸侧流检测试纸条(nucleic acid lateral test strips,NALTS)”)。
1.3.1 NALFIA技术
抗体依赖型LFCA中运用了核酸-抗体相互作用以及双链DNA的特异性标记,因此又被称为NALFIA。NALFIA其实是聚合酶链式反应(polymerase chain reaction,PCR)技术与ELISA技术的结合应用。
以胶体金NALFIA为例:首先针对检测靶标特异性基因片段设计一对相应的PCR引物,并对其进行两种不同标记物标记(如用生物素标记一条引物,而用荧光素标记另一条引物),通过PCR扩增产生双标记的双链扩增产物;制作试纸条,在结合垫上固定一定量能与扩增子标记物之一特异性结合的物质(如链霉亲和素或亲和素)和胶体金的复合物,T线喷涂特异性抗扩增子另一标记物的抗体的标记物(如荧光素抗体),C线喷涂能与结合垫上复合物特异性结合的物质(如生物素);用制作的胶体金试纸条对PCR产生的扩增产物进行检测。
对于阳性样品,双标扩增子由于毛细管作用力从样品垫侧流至结合垫,其上的生物素与结合垫上的链霉亲和素或亲和素特异性结合,复合物又侧流至T线后,双标扩增子上的荧光素与T线上的荧光素抗体特异性结合,结合垫上过量的链霉亲和素或亲和素又与C线上的生物素特异性结合,又因结合垫上链霉亲和素或亲和素被胶体金标记,所以T线与C线同时显红色;对于阴性样品,结合垫上的链霉亲和素或亲和素与C线上的生物素特异性结合,所以只有C线显红色;C线不显色则结果不能判断。
1.3.2 NALTS技术
抗体非依赖型LFCA因不依赖抗体而被称作NALTS。与NALFIA不同的是,NALTS的被检样品是单链核苷酸而非双链核苷酸,它的关键步骤是核酸杂交。核酸适配体是一小段经体外筛选得到的人造短链单链寡核苷酸(RNA或DNA),它们能特异性识别并结合靶向核酸且易于合成,并且在标记过程中不会失去活性,因此,核酸适配体常被用在NALTS中代替抗体发挥作用[13]。以胶体金NALTS为例,结合垫上固定一定量被胶体金标记的捕获探针与标记物(如生物素)的结合物,T线喷涂结合探针或其与BSA的结合物,C线喷涂与结合垫标记物特异性结合的标记物(如链霉亲和素)。
对于阳性样品,单链扩增子与结合垫上的捕获核酸探针杂交,复合物又与T线上的结合探针杂交,C线上的链霉亲和素与结合垫上过量的生物素特异性结合,又因结合垫上捕获探针与生物素被胶体金标记,所以T线和C线同时显红色条带;对于阴性样品,C线上的链霉亲和素与结合垫上的亲和素特异性结合,所以只有C线显红色条带;C线不显色则结果不能判断。
NALFIA和NALTS因检测原理不同,检测灵敏度和时间也有所不同。因为杂交过程比标记物之间的亲和反应更耗费时间,所以NALTS需要的检测时间比NALFIA长;而灵敏度则与更多条件有关,无法给出统一结论。例如,赭曲霉毒素A是曲霉和青霉家族的次级代谢产物,它是一种小分子,适用于竞争性LFCA。基于适配子[14]和抗体[15]的LFCA可用于赭曲霉毒素A的检测。基于NALTS的检测限可达0.18 ng/mL[14],基于NALFIA的检测限为0.5 ng/mL[15]。
LFCA的灵敏度和特异性是基于免疫反应物的选择。综上所述,LFCA对抗体种类和质量都要求极高,所选抗体必须具有高亲和力、敏感性和特异性,且在LFCA中往往需要一组配对的抗体(标记抗体和T线抗体),提高了对抗体的要求及开发LFCA的难度。针对此问题,2016年Song Chunmei等[16]首次发明了只用一种抗体对食源性致病菌进行半定量免疫荧光试纸检测技术,实际样品中大肠杆菌O157∶H7的检测时间为5~10 min。
影响LFCA检测限的另一个关键因素是NC膜的选择,不同孔径的膜对检测限和检测时间影响不同。Laura[17]和Majdinasab[18]等使用Hi-Flow 180和Millipore NC膜,检测限分别是1.5 ng/mL和0.25 ng/mL,检测时间分别是20 min和15 min。
标记材料同时承担LFCA检测结果的“可视化”和“抗体标记”两大功能,对该方法的灵敏度、检测限等性能至关重要。纳米金颗粒具有稳定性高、抗体相容性好、显色清晰等优点,是LFCA最常用的抗体标记材料。近年来,碳纳米材料、量子点、上转换荧光材料、超顺磁性纳米颗粒等新型标记材料的研究取得了突破性的进展,使检测性能大幅度提升。2015年Wang Chunying等[19]利用多色量子点标记抗体,同时对甲胎蛋白和癌胚蛋白进行双靶标检测,检测限分别可达3 ng/mL和2 ng/mL,并可在15 min内得到检测结果,其灵敏度高于ELISA方法。
LFCA中,标记物是影响其灵敏度的关键因素之一。对抗体或抗原进行标记,通过标记物的增强放大效应显示反应系统对应的抗原或抗体的相对含量。
根据标记原理可分为两大类:一类是以酶促反应为基础的酶标记法;另一类是自显色标记法。对于不需要仪器辅助的免疫层析试纸,主要是自显色标记[7]。为增加试纸的灵敏性,人们一直在不断寻找新型的标记物,包括纳米颗粒(金纳米颗粒、碳纳米颗粒)、发光纳米颗粒(量子点、荧光猝灭材料、上转换荧光材料)、超顺磁纳米颗粒、脂质体和酶等标记物,目前应用最广泛的是胶体金标记[20]。
3.1.1 纳米颗粒
纳米颗粒因其特有的光学性质(包括由组件和聚集产生的荧光或颜色变化)而被用作LFCA的示踪剂[21]。目前,胶体金、银和碳纳米颗粒、碳纳米管已被广泛应用于开发LFCA[22]。
3.1.1.1 胶体金
胶体金易于制备、成本低,可视化颜色形成较快,在液态或是干燥状态下非常稳定,不易褪色,广泛应用于许多领域。但是,胶体金的形状、大小、均一性和稳定性是影响胶体金试纸条成功与否的关键因素。胶体金的颜色、大小与还原金的柠檬酸三钠数量密切相关[23]。同时,胶体金的标记还受多种因素的影响,如配体和胶体金的酸碱度以及胶体金和配体蛋白的比例等[24]。
3.1.1.2 碳纳米管和碳纳米颗粒
碳纳米颗粒因其表面积大、光电特性良好而被应用于侧流免疫层析技术(lateral flow immunochromatographic assay,LFICA)分析中,其颜色比胶体金深,非常适合做标记材料,而且成本低、易制备、缀合稳定[25]。然而,碳纳米颗粒的标记效果会受反应时间和反应温度等条件影响[26],碳纳米颗粒的广泛应用还会给环境和人类健康带来不利影响[27]。
3.1.1.3 其他纳米材料
其他用于LFCA的纳米材料有Fe3O4@Si纳米颗粒[28]、硅原子纳米颗粒[29]、乳胶微球[30]、铂纳米颗粒[31]等。其中,乳胶微球因其来源广泛且价格低被广泛应用,其可通过氨基、羰基和巯基产生的简单吸附和共价连接与很多物质偶联,其操作简便、稳定可靠、灵敏度高,但是需加碳二亚胺/N-羟基丁二酰亚胺活化乳胶微球中的反应基团才能有效标记结合抗体或抗原。
3.1.2 荧光纳米颗粒
最近许多研究表明,使用荧光纳米颗粒比使用比色标记材料获得的检测限更低[32]。荧光纳米颗粒背景信号低、干扰少、灵敏度高、荧光素价格低廉,表面不需要修饰即可直接偶联生物特异性抗体。然而其荧光信号不稳定、容易猝灭,而且半定量分析的精确度欠佳。
3.1.2.1 量子点
拥有窄发射光谱、宽激发范围和高荧光量子产率的量子点[33],具有优异的亮度、尺寸可调的荧光发射、较大的吸收系数、良好的稳定性和高信噪比,已广泛用于提高LFCA检测灵敏度。然而,量子点标记能诱导氧自由基的产生,因此对生物活性物质具有一定毒性,不过这些毒性可以通过偶联到蛋白质分子上或者是覆盖一层低毒物质来降低。量子点和某些蛋白质结合后可能导致量子点的荧光减弱或猝灭,如铜/锌-超氧化物歧化酶对CdSe量子点的荧光有明显的猝灭作用。另外,如果量子点标记用于试纸的制备,其使用过程中需要紫外光源用于色泽变化的观察,与肉眼观察即可判断检测结果的其他类型试纸相比操作程序稍显复杂。
3.1.2.2 荧光猝灭材料
荧光猝灭材料(有机荧光染料、荧光蛋白、胶体金和量子点等)已经被用来检测小的分析物,并且有研究发现信号强度和分析物的浓度呈正相关[32]。这些材料具有背景信号低、灵敏度高、可以标记多个生物识别元件的优点。
3.1.2.3 镧系元素
已经用于标记LFCA以提高其检测限的镧系元素螯合物有Eu3+、Tb3+、Sm3+和Dy3+,它们作为标记材料的原理是荧光反应,因其纳米颗粒与胶体金的尺寸相当接近并且消除了背景荧光而被选为LFCA的标记材料。与常规的荧光标记和量子点相比,它们具有独特且有应用优势的荧光特性,例如荧光寿命长、发射光谱窄、斯托克斯位移大、光稳定性突出等。
3.1.2.4 上转换荧光体
上转换荧光体是一种含镧系元素的亚微米尺寸的陶瓷颗粒,其特殊的组成和结构具备了优良的光学特性,当被红外光激发时,它可以发射可见光。与其他荧光标记相比,它的主要优点有灵敏度高、保质期长、永久记录(无褪色)、基质干扰低、成本低等。
3.1.2.5 其他荧光材料
研究者常用荧光信号来增强检测信号以提高LFCA的灵敏度。荧光微球(fluorescent microspheres,FM)具有稳定的构型和高荧光强度,是多彩和安全的标记材料。由于胶体金应用时缺乏灵敏度,FM主要用于检测几种化合物,如黄曲霉毒素M1[34]、肿瘤坏死因子α[35]等。
3.1.3 超顺磁纳米颗粒
超顺磁纳米颗粒因其稳定的磁信号而被装置完全捕获,可使检测的灵敏度提高10~100 倍,使检测时间缩短。然而它会产生背景噪声,由于利用磁微粒标记建立的快速检测技术需要使用外界磁场,因此与胶体金标记相比较为麻烦。另外,磁微粒具有较大的表面自由能和强磁偶极矩相互作用,彼此间易聚集,如果包被不良也会影响试纸的检测结果。
3.1.4 酶
酶与底物反应形成的颜色可以通过肉眼和标准的颜色图表比色,直观反应检测物的有无。但其分析灵敏度不高,且比色时可能会带来由于人为错误判断引起的不精确性。另外,酶是一种生物活性物质,如果保存不当,催化性能就会丧失。
3.1.5 脂质体
脂质体是由一个或多个磷脂双层组成的球形人工小泡,因其具有捕获高浓度信号分子的能力,脂质体诊断装置可以把可视免疫层析的灵敏度提高2~3 个数量级。但其稳定性低、操作复杂,因此应用较少。
基于核酸LFCA的标记原理是碱基配对,将带有标记物的已知序列的核酸片段和与其互补的核酸序列杂交形成双链,用以检测未知样品中是否具有与其相同的序列,并能进一步判定其与已知序列的同源程度。根据标记材料是否具有放射性可分为放射性标记材料和非放射性标记材料。
3.2.1 放射性标记材料
放射性同位素被用作标记物,常用的有32P、3H、35S。放射性标记材料的优点是灵敏度高,缺点是易造成放射性污染,同位素半衰期短、对人体有伤害。
3.2.2 非放射性标记材料
生物素和地高辛被用作非放射性标记材料,二者都是半抗原。生物素一亲和素系统是一种具有亲和力高、灵敏度高、特异性强和稳定性好等优点的信号放大标记技术[36]。生物素标记对身体无害,但受到紫外线的照射后易发生分解。地高辛标记与放射性同位素标记探针的灵敏度相当,并且特异性优于生物素标记[37]。
20世纪90年代开始,层析试纸技术以其价格低廉、方便携带使用、不需要专业人员、支持现场快速检验以及结果肉眼可见等优势,在人类、动物、植物医学临床检测以及环境监测、食品安全检测等领域被广泛应用。
3.3.1 LFCA在人类医学及动、植物医学检测领域的应用
在LFCA建立并发展的早期,人们就将研究的目的放在了其在人类疾病诊断、预警、生理生化指标的分析上。后来,随着畜牧养殖业和种植业的不断发展,动植物疫病对其危害也不断加剧。迄今为止,有大量试纸已经成功应用于人类肿瘤性疾病、病毒性感染、细菌性传染、动、植物性病毒病、细菌病、寄生虫病等的快速检测上。
表 1 LFCA在人类医学及动、植物医学检测领域的应用
Table 1 Application of LFCA in the fields of clinical medicine, and animal and plant medicine

由表1可见,目前LFCA在医学领域应用甚广,涉及人类、动物和植物,且以胶体金标记双抗夹心法为主,其检测灵敏度可达ng/mL级,分析时间均在1 h之内。由于胶体金易于制备、成本低、颜色形成较快、不易褪色,加上医学领域检测靶标抗原大都是大分子物质,含有较多的抗原位点,使胶体金标记双抗夹心法被高度的应用在人类医学及动、植物医学检测领域,为医学发展作出了巨大贡献。胶体金作为层析试纸标记材料由来已久、应用甚多,更多更高效的标记材料及方法值得研究者继续并深入研究以取得更大成就。
3.3.2 LFCA在食品安全领域的应用
目前,“从农田到餐桌”的食品安全问题日益复杂化,食品安全问题频发。病原微生物造成人体食物中毒,农兽药滥用处于无序状态,重金属超标构成粮食产品安全隐患,违法添加、掺杂掺假现象报道此起彼伏,食品安全已经成为困扰人民健康生活的大问题。为响应人民的需求,方便快速、低成本、节省时间、结果肉眼可见的LFCA已在包括食源性致病菌、农兽药残留、违禁添加剂、生物毒素、重金属离子检测等领域被越来越多的应用[47]。
表 2 LFCA在食品安全领域的应用
Table 2 Application of LFCA in the field of food safety

由表2可见,现阶段LFCA在食品安全领域应用甚广,主要应用于食源性致病菌和农兽药残留检测两大方面。对微生物检测主要以双抗夹心法为主,而在农兽药残留检测领域大都采用竞争法。这些方法中胶体金作为标记材料的应用非常广泛,为了提高灵敏度,近年来对一些新型标记材料的应用也有很多研究,比如量子点、磁性纳米颗粒、上转换荧光材料等。LFCA法对微生物的检测限高达10~108CFU/mL,农兽药残留的检测限高达30 ng/mL~0.1 mg/L,检测时间缩短至1~20 min。
3.3.3 LFCA在环境监测领域的应用
伴随社会生产力发展而来的环境污染和破坏问题已经成为威胁人类生存和发展的重大世界性问题,对此各国环保委员会发起环保联合声明,表示环境污染物的监测为环保的首要环节。LFCA以其快速、可现场检测等优点被广泛应用在环境监测中。
表 3 LFCA在环境监测领域的应用
Table 3 Application of LFCA in the field of environmental monitoring

由表3可见,现阶段LFCA在环境监测领域应用范围广但不全面,原因可能有二:其一,环境问题在以前并不严重,后来也并未得到真正重视;其二,环境监测层析试纸开发困难较大、环境样品不易收集处理等。目前应用于环境监测的LFCA试纸条灵敏度可达ng/mL数量级,检测时间短至10 min左右。LFCA可被应用在环境监测领域,为环境中水、空气、土壤等污染的监督管理工作提供便利。但对其他环境污染物的检测开发还需进一步研究和探索,以完善对其的监督和管理。
LFCA不需要专业操作人员和昂贵的仪器设备即可实现对抗原、抗体和半抗原等各种分析物的定性和半定量检测,在劳动力稀缺的地区起着重要作用,还可在短时间内对几种化合物进行同时检测。图5对LFCA试纸检测技术的优缺点进行了总结。

图 5 LFCA试纸条的优缺点[24]
Fig. 5 Advantages and disadvantages of LFCA test strip[24]
传统微生物学检测方法中样品需要经增菌、分离培养和生化鉴定等步骤,完成一次检测一般需要5~8 d。相比之下,LFCA除增菌外仅需几十分钟甚至几分钟的检测时间,检测快捷、灵敏度更高[68]。
目前,在检测农、兽药以及重金属残留方面应用较广的是色谱法和质谱法等相关检测方法,其中色谱法又包括气相色谱法、高效液相色谱法,高效液相色谱技术更为先进。同时,气相色谱-质谱联用技术将气相色谱仪与质谱仪通过适当的接口相结合,借助计算机技术进行联用分析,发展成熟,成为复杂组分分离和鉴定的有效方法。表4从样品前处理、灵敏度、检测周期、成本和检测要求5 方面以质谱法和高效液相色谱法作为代表与LFCA作比较分析。分析表明,LFCA相较仪器分析化学技术,虽然检测灵敏度低且不能进行定量分析,但其所需成本低、对技术人员要求不高、检测时间短。因此,可以用LFCA法作为一种初筛手段,对阳性结果进一步使用仪器分析法得到准确数值。也可通过借助一些数据读取设备对LFCA法进行半定量分析。
表 4 LFCA、质谱法、高效液相色谱法对比
Table 4 Comparison of mass spectrometry, high performance liquid chromatography and LFCA
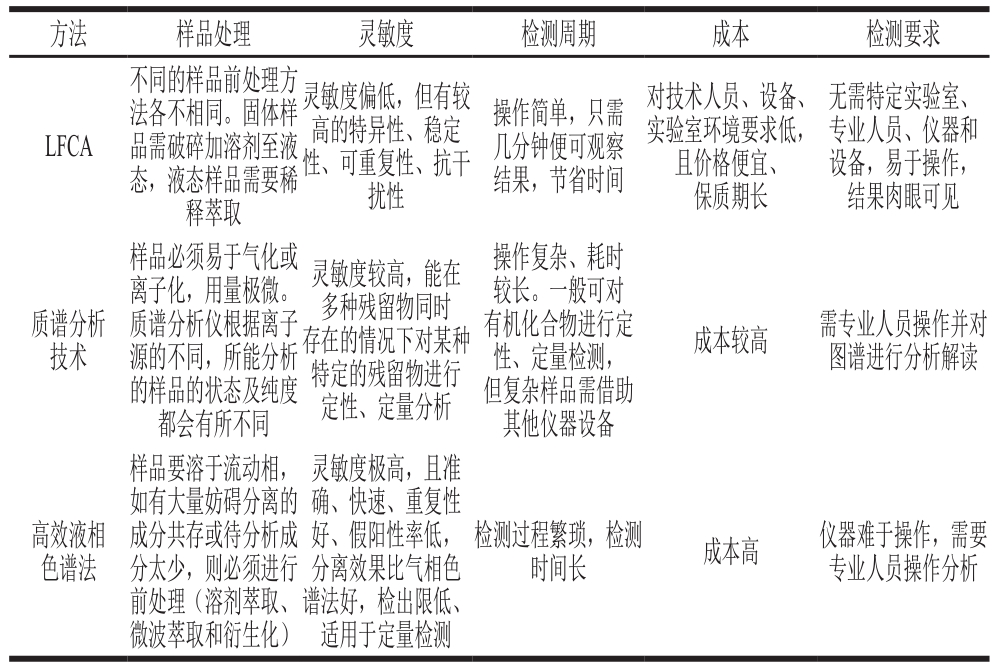
表 5 LFICA与其他免疫学检测技术的对比
Table 5 Comparison of LFCIA and other immunoassays

免疫学检测技术是以抗原与抗体的特异性反应为基础建立的,不同的检测物质有其特异的抗原,并能激发机体产生相应的特异性抗体。基于免疫技术的检测方法以目标菌的表面抗原或分泌毒素等为检测靶点,因此是一种可用于检测细菌或芽孢的方法。这种方法已广泛应用于食品中致病菌的检测,包括ELISA、免疫磁性分离技术、放射免疫分析技术、免疫荧光技术等。表5以这几种方法为代表与LFICA作比较分析。分析表明,LFICA相较其他免疫学检测手段,不需特定仪器或复杂技术手段辅助,节省成本,且对检测环境要求不高,适合现场快速检测。
分子生物学检验技术是以核酸或蛋白质为分析材料,通过分析基因的结构、表达的变化和由此而导致的基因功能的改变,为疾病的研究和诊断提供更准确、更科学的信息和依据的一门技术。分子生物学检测技术包括PCR技术、环介导恒温扩增(loop-mediated isothermal amplification,LAMP)技术、生物发光检测法等。表6以这几种方法为代表与LFCA作比较分析[68]。分析表明,LFCA与分子生物学检测技术相比,不需特定仪器及专业操作人员,检测时间短,不易出现假阳性和假阴性。但该方法灵敏度偏低且不能实现定量检测,是LFCA法的瓶颈问题,需要进行优化和改进。
表 6 LFCA与分子生物学检测技术的对比
Table 6 Comparison of molecular biology techniques and LFCA

本文不仅研究总结了LFCA的背景、组成、原理、标记材料及其在人类医学、动、植物医学、环境监测和食品检测几方面的应用现状,还将LFCA与传统检测方法、仪器分析化学技术、免疫学检测方法、分子生物学分析方法进行对比,总结其优劣势。
LFCA虽然不如仪器分析化学技术、免疫学检测方法、分子生物学分析方法等的灵敏度高,而且不能定量检测,但因其成本低、易操作、快速、便携、干扰少、稳定、结果肉眼可见、无需专业人员,适于现场检测,仍被广泛应用于医学、食品、环境各领域。
LFCA目前已成熟应用在各领域的物质检测中,但其灵敏度偏低、结果不能定量以及对标记材料和抗体的依赖性依然是该技术的瓶颈问题。如何解决以上问题,开发出一种基于LFCA基本原理,又无需纳米颗粒等标记材料的高灵敏度、高准确性、高稳定性的新型LFCA技术或许会成为未来LFCA研究的新突破。
2012年,Rohrman等[69]将LFCA与扩增和样品制备技术相结合,达到对人类免疫缺陷病毒病毒的定量检测,弥补了LFCA只可定性或半定量的不足。2015年,Jung等[39]将新的基因检测技术-LAMP技术和LFIAC试纸检测技术相结合,对流感病毒进行了检测,结果显示该技术可在40 min内完成基因扩增和LFICA检测,且灵敏度达到10 拷贝,同时可实现现场检测。随着材料科学、电化学、广电科学、基因扩增技术等的不断发展及各学科的交叉融合,将会有更多的新型标记材料、抗体、检测模式以及新型便携化、微型化、自动化的定性、定量检测仪器出现,可用于弥补现有LFCA的缺陷,使其在医学、食品、环境各领域中发挥作用,为人类工作生活做出更大的贡献。
综上所述,LFCA的优势众多,但灵敏度和定量问题亟待解决,随着科技发展,LFCA还有很大的发展空间,值得广大研究者们去努力探索挖掘。
参考文献:
[1] TARANOVA N A, BERLINA A N, ZHERDEV A V, et al. ‘Traffic light’ immunochromatographic test based on multicolor quantum dots for the simultaneous detection of several antibiotics in milk[J].Biosensors & Bioelectronics, 2015, 63: 255-261. DOI:10.1016/j.bios.2014.07.049.
[2] FU Q, LIANG J, LAN C, et al. Development of a novel dualfunctional lateral-flow sensor for on-site detection of small molecule analytes[J]. Sensors & Actuators B Chemical, 2014, 203: 683-689.DOI:10.1016/j.snb.2014.06.043.
[3] YU C Y, ANG G Y, CHUA A L, et al. Dry-reagent gold nanoparticlebased lateral flow biosensor for the simultaneous detection of Vibrio cholerae serogroups O1 and O139[J]. Journal of Microbiological Methods, 2011, 86: 277-282. DOI:10.1016/j.mimet.2011.04.020.
[4] MAO X, WANG W, DU T E. Rapid quantitative immunochromatographic strip for multiple proteins test[J]. Sensors & Actuators B Chemical, 2013,186: 315-320. DOI:10.1016/j.snb.2013.05.083.
[5] DZANTIEV B B, BYZOVA N A, URUSOV A E, et al.Immunochromatographic methods in food analysis[J]. Trends in Analytical Chemistry, 2014, 55: 81-93. DOI:10.1016/j.trac.2013.11.007.
[6] SINGH J, SHARMA S, NARA S. Evaluation of gold nanoparticle based lateral flow assays for diagnosis of enterobacteriaceae members in food and water[J]. Food Chemistry, 2015, 170: 470-483.DOI:10.1016/j.foodchem.2014.08.092.
[7] 张改平. 免疫层析试纸快速检测技术[M]. 郑州: 河南科学技术出版社, 2015: 6-7.
[8] 李怀明, 许恒毅, 熊勇华. 免疫层析试纸条技术及其在食源性致病菌检测中应用的研究进展[J]. 食品科学, 2011, 32(17): 380-383.
[9] 王硕, 张鸿雁, 王俊平. 酶联免疫吸附分析方法[M]. 北京: 科学出版社, 2011: 3.
[10] ZENG H, GUO W, LIANG B, et al. Self-paired monoclonal antibody lateral flow immunoassay strip for rapid detection of Acidovorax avenae subsp. citrulli[J]. Analytical and Bioanalytical Chemistry,2016, 408(22): 6071-6078. DOI:10.1007/s00216-016-9715-5.
[11] BANGS L. Lateral flow tests[N]. TechNote 303, 2013-03-20(1).
[12] SAJID M, KAWDE A N, DAUD M. Designs, formats and applications of lateral flow assay: a literature review[J]. Journal of Saudi Chemical Society, 2015, 19(6): 689-705. DOI:10.1016/j.jscs.2014.09.001.
[13] CHEN A, YANG S. Replacing antibodies with aptamers in lateral flow immunoassay[J]. Biosensors and Bioelectronics, 2015, 71: 230-242.DOI:10.1016/j.bios.2015.04.041.
[14] WANG L, MA W, CHEN W, et al. An aptamer-based chromatographic strip assay for sensitive toxin semi-quantitative detection[J].Biosensors and Bioelectronics, 2011, 26(6): 3059-3062. DOI:10.1016/j.bios.2010.11.040.
[15] LI X, LI P, ZHANG Q, et al. Multi-component immunochromatographic assay for simultaneous detection of aflatoxin B1, ochratoxin A and zearalenone in agro-food[J]. Biosensors and Bioelectronics, 2013,49(22): 426-432. DOI:10.1016/j.bios.2013.05.039.
[16] SONG Chunmei, LI Jianwu, LIU Jinxin, et al. Simple sensitive rapid detection of Escherichia coli O157:H7 in food samples by label-free immunofluorescence strip sensor[J]. Talanta, 2016, 156/157: 42-47.DOI:10.1016/j.talanta.2016.04.054.
[17] LAURA A, GILDA D A, CLAUDIO B, et al. A lateral flow immunoassay for measuring ochratoxin A: development of a single system for maize, wheat and durum wheat[J]. Food Control, 2011,22(12): 1965-1970. DOI:10.1016/j.foodcont.2011.05.012.
[18] MAJDINASAB M, SHEIKH-ZEINODDIN M, SOLEIMANIANZAD S, et al. Ultrasensitive and quantitative gold nanoparticle-based immunochromatographic assay for detection of ochratoxin A in agroproducts[J]. Journal of Chromatography B, 2015, 974: 147-154.DOI:10.1016/j.jchromb.2014.10.034.
[19] WANG Chunying, HOU Fei, MA Yicai. Simultaneous quantitative detection of multiple tumor markers with a rapid and sensitive multicolor quantum dots based immunochromatographic test strip[J].Biosensors and Bioelectronics, 2015, 68: 156-162. DOI:10.1016/j.bios.2014.12.051.
[20] WONG R, TSE H. Lateral flow immunoassay[J]. Methods in Molecular Biology, 2017, 1318: 127. DOI:10.1007/978-1-59745-240-3.
[21] LIU Q, ZHANG Y, ZHENG L, et al. A novel test strip fororganophosphorus detection[J]. Sensors and Actuators B Chemical,2015, 210: 803-810. DOI:handle/00001903-5/210858.
[22] PAROLO C, ESCOSURA-MUNIZ A D L, MERKOCI A. Enhanced lateral flow immunoassay using gold nanoparticles loaded with enzymes[J]. Biosensors and Bioelectronics, 2013, 40: 412-416.DOI:10.1016/j.bios.2012.06.049.
[23] ZHOU P, LU Y, ZHU J, et al. Nanocolloidal gold-based immunoassay for the detection of the N-methylcarbamate pesticide carbofuran[J].Journal of Agricultural and Food Chemistry, 2004, 52(14): 4355-4359.DOI:10.1021/jf0499121.
[24] BAHADIR E B, SEZGINTÜRK M K. Lateral flow assays: principles,designs and labels[J]. Trends in Analytical Chemistry, 2016, 82: 286-306. DOI:10.1016/j.trac.2016.06.006.
[25] QIU W, XU H, TAKALKAR S, et al. Carbon nanotube-based lateral flow biosensor for sensitive and rapid detection of DNA sequence[J].Biosensors and Bioelectronics, 2015, 64: 367-372. DOI:10.1016/j.bios.2014.09.028.
[26] 诸颖, 李玉峰, 张小勇, 等. 碳纳米颗粒的放射性99mTc标记[J]. 原子核物理评论, 2008, 25(3): 305-310.
[27] 诸颖, 李文新. 碳纳米管的细胞毒性[J]. 中国科学(B辑: 化学),2008(8): 677-684. DOI:10.1360/zb2008-38-8-677.
[28] YAN J, LIU Y, WANG Y, et al. Effect of physiochemical property of Fe3O4particle on magnetic lateral flow immunochromatographic assay[J]. Sensors and Actuators B Chemical, 2014, 197: 129-136.DOI:10.1016/j.snb.2014.02.067.
[29] BAI Y, TIAN C, WEI X, et al. A sensitive lateral flow test strip based on silica nanoparticle/CdTe quantum dot composite reporter probes[J].RSC Advances, 2012, 2(5): 1778-1781. DOI:10.1039/c2ra00976e.
[30] PARK J M, JUNG H W, CHANG Y W, et al. Chemiluminescence lateral flow immunoassay based on Pt nanoparticle with peroxidase activity[J]. Analytica Chimica Acta, 2015, 853: 360-367. DOI:10.1016/j.aca.2014.10.011.
[31] JIANG T, SONG Y, WEI T, et al. Sensitive detection of Escherichia coli O157:H7 using Pt-Au bimetal nanoparticles with peroxidase-like amplification[J]. Biosensors and Bioelectronics, 2015, 77: 687-694.DOI:10.1016/j.bios.2015.10.017.
[32] 宋春美. 基于荧光纳米颗粒标记的盐酸克伦特罗荧光免疫层析试纸的研究[D]. 无锡: 江南大学, 2013: 20-22.
[33] BELOGLAZOVA N V, SPERANSKAYA E S, WU A, et al. Novel multiplex fluorescent immunoassays based on quantum dot nanolabels for mycotoxins determination[J]. Biosensors and Bioelectronics, 2014,62(6): 59-65. DOI:10.1016/j.bios.2014.06.021.
[34] LIU X, XIANG J J, TANG Y, et al. Colloidal gold nanoparticle probe-based immunochromatographic assay for the rapid detection of chromium ions in water and serum samples[J]. Analytica Chimica Acta, 2012, 745: 99-105. DOI:10.1016/j.aca.2012.06.029.
[35] WORSLEY G J, ATTREE S L, NOBLE J E, et al. Rapid duplex immunoassay for wound biomarkers at the point-of-care[J].Biosensors and Bioelectronics, 2012, 34(1): 215-220. DOI:10.1016/j.bios.2012.02.005.
[36] 孔令青, 李勇, 高洪, 等. 生物素-亲和素标记技术[J]. 动物医学进展,2008(4): 100-102. DOI:10.16437/j.cnki.1007-5038.2008.04.002.
[37] 刘洋, 李苗苗. 核酸探针和PCR技术在食品致病菌检验中的应用[J].食品安全导刊, 2016(21): 14. DOI:10.16043/j.cnki.cfs.2016.21.005.
[38] CHOI D H, LEE S K, OH Y K, et al. A dual gold nanoparticle conjugate-based lateral flow assay (LFA) method for the analysis of troponin I[J]. Biosensors and Bioelectronics, 2010, 25(8): 1999-2002.DOI:10.1016/j.bios.2010.01.019.
[39] JUNG J H, OH S J, YONG T K, et al. Combination of multiplex reverse-transcription loop-mediated isothermal amplification with an immunochromatographic strip for subtyping influenza A virus[J].Analytica Chimica Acta, 2015, 853(1): 541-547. DOI:10.1016/j.aca.2014.10.020.
[40] MDLULI P, TETYANA P, SOSIBO N, et al. Gold nanoparticle based Tuberculosis immunochromatographic assay: the quantitative ESE Quanti analysis of the intensity of test and control lines[J]. Biosensors and Bioelectronics, 2014, 54: 1-6. DOI:10.1016/j.bios.2013.10.019.
[41] LEE J H, SEO H S, KWON J H, et al. Multiplex diagnosis of viral infectious diseases (AIDS, hepatitis C, and hepatitis A) based on point of care lateral flow assay using engineered proteinticles[J].Biosensors and Bioelectronics, 2015, 69C: 213-225. DOI:10.1016/j.bios.2015.02.033.
[42] SHEN J, ZHOU Y, FU F, et al. Immunochromatographic assay for quantitative and sensitive detection of hepatitis B virus surface antigen using highly luminescent quantum dot-beads[J]. Talanta, 2015, 142:145-149. DOI:10.1016/j.talanta.2015.04.058.
[43] SALMINEN T, JUNTUNEN E, KHANNA N, et al. Anti-HCV immunoassays based on a multiepitope antigen and fluorescent lanthanide chelate reporters[J]. Journal of Virological Methods, 2015,228: 67-73. DOI:10.1016/j.jviromet.2015.11.015.
[44] DUAN D, FAN K, ZHANG D, et al. Nanozyme-strip for rapid local diagnosis of Ebola[J]. Biosensors and Bioelectronics, 2015, 74: 134-141. DOI:10.1016/j.bios.2015.05.025.
[45] WANG H, FENG N, YANG S, et al. A rapid immunochromatographic test strip for detecting rabies virus antibody[J]. Journal of Virological Methods, 2010, 170(1/2): 80-85. DOI:10.1016/j.jviromet.2010.09.002.
[46] WATANABE Y, ITO T, IBRAHIM M S, et al. A novel immunochromatographic system for easy-to-use detection of group 1 avian influenza viruses with acquired human-type receptor binding specificity[J]. Biosensors and Bioelectronics, 2014, 65C: 211-219.DOI:10.1016/j.bios.2014.10.036.
[47] 李建武, 宋春美, 刘芳, 等. 免疫层析试纸技术及其在食品安全检测中的应用[J]. 食品科学, 2014, 35(8): 36-41. DOI:10.7506/spkx1002-6630-201408007.
[48] LIU J W, LU C C, LIU B H, et al. Development of novel monoclonal antibodies-based ultrasensitive enzyme-linked immunosorbent assay and rapid immunochromatographic strip for aflatoxin B1detection[J]. Food Control, 2016, 59: 700-707. DOI:10.1016/j.foodcont.2015.06.038.
[49] CHEN F, MING X, CHEN X, et al. Immunochromatographic strip for rapid detection of Cronobacter in powdered infant formula in combination with silica-coated magnetic nanoparticles separation and 16S rRNA probe[J]. Biosensors and Bioelectronics, 2014, 61(6): 306-313. DOI:61:306-13.10.1016/j.bios.2014.05.033.
[50] FANG Z, WU W, LU X, et al. Lateral flow biosensor for DNA extraction-free detection of Salmonella based on aptamer mediated strand displacement amplification[J]. Biosensors and Bioelectronics,2014, 56: 192-197. DOI:10.1016/j.bios.2014.01.015.
[51] CHEN X, GAN M, XU H, et al. Development of a rapid and sensitive quantum dot-based immunochromatographic strip by double labeling PCR products for detection of Staphylococcus aureus in food[J]. Food Control, 2014, 46: 225-232. DOI:10.1016/j.foodcont.2014.04.044.
[52] LIU H, ZHAN F, LIU F, et al. Visual and sensitive detection of viable pathogenic bacteria by sensing of RNA markers in gold nanoparticles based paper platform[J]. Biosensors and Bioelectronics, 2014, 62: 38-46. DOI:10.1016/j.bios.2014.06.020.
[53] MOONGKARNDI P, RODPAI E, KANARAT S, et al. Evaluation of an immunochromatographic assay for rapid detection of Salmonella enterica serovars Typhimurium and Enteritidis[J].Journal of Veterinary Diagnostic Investigation, 2011, 23: 797-801.DOI:10.1177/1040638711408063.
[54] COX C R, JENSEN K R, MONDESIRE R R, et al. Rapid detection of Bacillus anthracis by γ phage amplification and lateral flow immunochromatography[J]. Journal of Microbiological Methods,2015, 118: 51-56. DOI:10.1016/j.mimet.2015.08.011.
[55] WANG D B, TIAN B, ZHANG Z P, et al. Detection of Bacillus anthracis spores by super-paramagnetic lateral-flow immunoassays based on “Road Closure”[J]. Biosensors and Bioelectronics, 2015, 67:608-614. DOI:10.1016/j.bios.2014.09.067.
[56] LEE J Y, KIM Y A, KIM M Y, et al. Importance of membrane selection in the development of immunochromatographic assays for lowmolecular weight compounds[J]. Analytica Chimica Acta, 2012, 757:69-74. DOI:10.1016/j.aca.2012.10.052.
[57] BYZOVA N A, SMIRNOVA N I, ZHERDEV A V, et al. Rapid immunochromatographic assay for ofloxacin in animal original foodstuffs using native antisera labeled by colloidal gold[J]. Talanta,2014, 119: 125-132. DOI:10.1016/j.talanta.2013.10.054.
[58] 山珊, 彭涛, 杨万春, 等. 胶体金免疫层析法定量检测孔雀石绿[J].食品科学, 2013, 34(16): 160-163. DOI:10.7506/spkx1002-6630-201316032.
[59] WANG P, WANG R, ZHANG W, et al. Novel fabrication of immunochromatographic assay based on up conversion phosphors for sensitive detection of clenbuterol[J]. Biosensors and Bioelectronics,2015, 77: 866-870. DOI:10.1016/j.bios.2015.10.053.
[60] WANG J, WANG Z, LIU J, et al. Nanocolloidal gold-based immunodip strip assay for rapid detection of Sudan red I in food samples[J].Food Chemistry, 2013, 136(3/4): 1478-1483. DOI:10.1016/j.foodchem.2012.09.047.
[61] ZHU M, WANG Y, DENG Y, et al. Ultrasensitive detection of mercury with a novel one-step signal amplified lateral flow strip based on gold nanoparticle-labeled ssDNA recognition and enhancement probes[J].Biosensors and Bioelectronics, 2014, 61: 14-20. DOI:10.1016/j.bios.2014.04.049.
[62] MARZO A M, LOPEZ, JOSEFINA P, et al. High sensitive goldnanoparticle based lateral flow immunodevice for Cd2+detection in drinking waters[J]. Biosensors and Bioelectronics, 2013, 47: 190-198.DOI:10.1016/j.bios.2013.02.031.
[63] XING C, LIU L, SONG S, et al. Ultrasensitive immunochromatographic assay for the simultaneous detection of five chemicals in drinking water[J]. Biosensors and Bioelectronics, 2015, 66: 445-453.DOI:10.1016/j.bios.2014.12.004.
[64] FU Q, TANG Y, SHI C, et al. A novel fluorescence-quenching immunochromatographic sensor for detection of the heavy metal chromium[J]. Biosensors and Bioelectronics, 2013, 49: 399-402.DOI:10.1016/j.bios.2013.04.048.
[65] YOU D J, PARK T S, YOON J Y. Cell-phone-based measurement of TSH using Mie scatter optimized lateral flow assays[J]. Biosensors and Bioelectronics, 2013, 40(1): 180-185. DOI:10.1016/j.bios.2012.07.014.
[66] BLAZKOVA M, MICKOVA-HOLUBOVA B, RAUCH P, et al.Immunochromatographic colloidal carbon-based assay for detection of methiocarb in surface water[J]. Biosensors and Bioelectronics, 2009,25(4): 753-758. DOI:10.1016/j.bios.2009.08.023.
[67] MIRASOLI M, BURAGINA A, DOLCI L S, et al. Development of a chemiluminescence-based quantitative lateral flow immunoassay for on-field detection of 2,4,6-trinitrotoluene[J]. Analytica Chimica Acta,2012, 721: 167-172. DOI:10.1016/j.aca.2012.01.036.
[68] 栗建永, 赵琢, 贾晓川, 等. 食源性致病菌检测分析技术的研究进展[J]. 食品研究与开发, 2013, 34(18): 110-115. DOI:10.3969/j.issn.1005-6521.2013.18.028.
[69] ROHRMAN B A, LEAUTAUD V, MOLYNEUX E, et al. A lateral flow assay for quantitative detection of amplified HIV-1 RNA[J]. PLoS ONE, 2012, 7(9): e45611. DOI:10.1371/journal.pone.0045611.
Progress in Lateral Flow Chromatography
MA Lan, WANG Shujuan, ZENG Haijuan, XIE Manman, DING Chengchao, ZHAI Xuzhao, GUO Liang, SUN Jingjuan,LI Jie, HU Qian, LIU Qing*
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:Lateral flow chromatography is capillary column separation based on antigen-antibody interaction or hybridization between DNA probe and target DNA. Compared with traditional analytical methods, it has the advantages of low cost, short assay time, strong specificity, high stability, non-professional personnel, field test and naked eye visualization. Therefore, it is widely used in clinical medicine, animal and plant medicine, food safety detection, environmental monitoring and other fields. This paper focuses on the background, principle, design, application and prospects of lateral flow chromatography.We hope that this review will provide valuable information for the development of lateral flow chromatography.
Keywords:lateral flow chromatography; clinical medicine; food safety; environmental monitoring
DOI:10.7506/spkx1002-6630-201815048
收稿日期:2017-04-24
基金项目:上海市科委科技创新行动计划长三角科技联合攻关领域项目(15395810900);徐州绿健乳品饮料有限公司乳制品生产体系致病菌快速检测项目(3A15308006)
第一作者简介:马兰(1992—),女,硕士研究生,研究方向为食品安全保障监控关键技术。E-mail:18717758696@163.com
*通信作者简介:刘箐(1970—),男,教授,博士,研究方向为食源性致病菌致病机理、疫苗及快速检测技术。E-mail:liuq@usst.edu.cn
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2018)15-0333-10
引文格式:
马兰, 王淑娟, 曾海娟, 等. 侧流层析技术研究进展[J]. 食品科学, 2018, 39(15): 333-342. DOI:10.7506/spkx1002-6630-201815048. http://www.spkx.net.cn
MA Lan, WANG Shujuan, ZENG Haijuan, et al. Progress in lateral flow chromatography[J]. Food Science, 2018, 39(15):333-342. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201815048. http://www.spkx.net.cn