袁江兰,陈晓敏,钟文秀,康 旭
关键词: 鲁氏酵母;米曲霉;黑曲霉;米渣;氨基酸态氮;风味;抗氧化活性
传统酱油是以大豆、小麦和麸皮为原料酿造而成的调味品,其滋味鲜美,深受消费者欢迎。长期以来,大豆是生产酱油的不可或缺的主要原料,但是随着蛋白质资源和酱油新产品的开发,一些高蛋白植物性原料,如玉米渣、核桃饼、面筋、米渣等成为酿造酱油的潜在资源 [1-3] 。
米渣是大米淀粉糖企业的主要副产品,其蛋白质量分数达60%左右,是浓缩的大米蛋白,具有氨基酸组成及比例合理、低抗原性等优点 [4-5] ,大米蛋白经适度降解后还具有一定的保健功能,如抗高血压、降低胆固醇等 [6] 。米渣溶解性很差,因此应用非常有限,目前主要作为饲料,价值未得到充分体现。这一问题也引起了研究者的关注,近年来对其应用研究较多,主要集中在蛋白粉、活性肽、可食用膜及食品添加剂等方面 [7-9] 。米渣是酿造酱油的优质原料 [10] ,但仍然存在蛋白质利用率相对较低、风味不及大豆酱油等问题;多菌种耦合发酵是解决这些问题的有效方法,如鲁氏酵母(Zygosaccharomyces rouxii)耦合发酵能赋予酱油良好滋味和香气,细胞自溶后也可进一步增加酱油鲜味,鲁氏酵母还可能对酱油的抗氧化活性产生贡献。关于大豆酱油的抗氧化活性已有较多报道 [11-15] ,前期研究表明米渣酱油也具有明显的抗氧化活性 [10] ,但其与菌种的相关性尚不清楚。本实验系统探究鲁氏酵母对米渣生酱油风味和抗氧化活性的影响,以期为提高米渣的应用价值提供参考。
米曲霉HN3.042、黑曲霉AS3.350 上海佳民酿造食品有限公司酿造一厂;鲁氏酵母 安琪酵母股份有限公司。
米渣 湖北德安府糖业有限责任公司;仲辛醇(色谱纯)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、罗丹明6G(高级纯) Aladdin试剂(上海)有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海源叶生物科技有限公司;其他试剂均为国产分析纯。
L-8900氨基酸自动分析仪、F-7000荧光分光光度计日本日立公司;2100可见分光光度计 上海尤尼柯仪器有限公司;78-1 pH计 瑞士梅特勒-托利多公司;气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪 美国Agilent公司。
1.3.1 米渣生酱油样品的制备
将米渣、麸皮、面粉、水以质量比6∶2∶2∶7.8的配比混合,经蒸料、冷却、接种后,在32~35 ℃、相对湿度85%~90%的恒温恒湿曲室中制曲36 h。制曲结束后,称取成曲,装入1 L密封罐中,添加2.5 倍质量盐水混合制成盐质量分数10.86%的稀醪,35 ℃恒温发酵45 d,经过滤得生酱油。根据菌种及接种比例差异,实验分组如下。
S1:接种0.2%米曲霉制曲;S2:接种0.16%米曲霉和0.04%黑曲霉,混菌制曲;S3:接种0.2%米曲霉制曲,发酵初始添加0.05%鲁氏酵母混菌发酵;S4:接种0.16%米曲霉和0.04%黑曲霉混菌制曲,并在发酵初始添加0.05%鲁氏酵母混菌发酵。
采用米曲霉(0.16%)和黑曲霉(0.04%)混菌制曲,制曲完成后,将成曲均分为3 份。C1:不添加鲁氏酵母的对照组;C2:发酵初始时添加0.05%鲁氏酵母;C3:酱醪发酵至pH 5.0时添加0.05%鲁氏酵母。
采用米曲霉(0.16%)和黑曲霉(0.04%)混菌制曲,制曲完成后,将成曲均分6 份,酱醪发酵至pH 5.0左右时分别添加0.00%、0.01%、0.025%、0.05%、0.075%和0.100%鲁氏酵母继续发酵,记为Ⅰ~Ⅵ组。
1.3.2 基本理化指标测定
氨基酸态氮含量采用甲醛滴定法测定,参考GB/T 5009.39—2003《酱油卫生标准的分析方法》,还原糖含量测定参考GB/T 5009.7—2008《食品中还原糖的测定》。
1.3.3 游离氨基酸含量测定
采用L-8900氨基酸自动分析仪测定生酱油中游离氨基酸含量。取适量生酱油样品与等体积的10%磺基水杨酸溶液,混合均匀后于4 ℃下放置15 min,15 000 r/min离心15 min。取上清液用0.02 mol/L盐酸稀释200 倍,0.22 μm微孔滤膜过滤后上氨基酸自动分析仪检测。衍生化试剂为茚三酮,反应柱柱温135 ℃,柱压0.982 MPa。
1.3.4 总酚含量测定
参考文献[16]方法,略作修改。取1 mL样品稀释液加6 mL蒸馏水和1 mL福林-酚试剂混匀后,在5~8 min内加1.5 mL质量分数20% Na 2 CO 3 溶液,混匀后,75 ℃水浴保持2 h后在765 nm波长处测定吸光度。以0.1 mg/mL没食子酸标准品绘制标准曲线,样品中总酚含量以没食子酸含量表示。
1.3.5 挥发性成分分析
5-甲基-2-乙基-4-羟基-3(2H)-呋喃酮(2-ethyl-4-hydroxy-5-methyl-3(2H)-furanone,EHMF)、4-乙烯基愈创木酚(4-vinylguaiacol,4-VG)质量浓度采用顶空固相微萃取和GC-MS测定。
固相微萃取方法:取3 mL酱油样品与2 mL蒸馏水于20 mL样品瓶中,加入2 g NaCl,置于磁力搅拌器50 ℃水浴平衡15 min后,用固相微萃取头萃取,顶空吸附35 min,解吸5 min,每个样品重复3 次。
GC条件:19091S-433UI HP-5MS Ultra Inert型毛细管柱(30 m×250 μm,0.25 μm),载气为氦气,流速1.0mL/min,进样口温度250 ℃,不分流;升温程序为初温40 ℃保持2 min,以5 ℃/min的速率升温到120 ℃保持2 min,再以7 ℃/min的速率升温到220 ℃保持5 min。
MS条件:采集方式为扫描;溶剂延迟7 min;质量范围35~395 amu;离子源温度230 ℃;四极杆温度150 ℃;电离方式EI;离子源能量70 eV;接口温度250 ℃。
对匹配度大于70(最大值100)的挥发性成分根据NIST 11和NIST EPA数据库定性,采用面积归一化法进行定量计算。
1.3.6 体外抗氧化活性测定方法
1.3.6.1 还原力
采用普鲁士蓝法 [17] ,以VC溶液的还原力作标准曲线对还原力进行定量,表示为每毫升样品的还原力与VC溶液浓度的等同量,即μg VC/mL。
1.3.6.2 DPPH自由基清除能力
参考文献[18]的方法。样品稀释200 倍进行测定并以VC溶液为阳性对照。DPPH自由基清除率按式(1)计算。
式中:A 样品 为等体积样品稀释液和DPPH乙醇溶液的吸光度;A 对照 为等体积样品稀释液和无水乙醇的吸光度;A 空白 为等体积水和DPPH乙醇溶液的吸光度。
测定5 个浓度梯度的样品对DPPH自由基清除能力,经线性回归后计算出DPPH自由基清除能力为50%时的酱油浓度,即半最大效应浓度(concentration for 50% of maximal effect,EC 50 )(μL酱油/mL溶液)。
1.3.6.3 总抗氧化能力
采用ABTS法 [19] ,取2 mmol/L ABTS溶液50 mL与70 mmol/L K 2 S 2 O 8 溶液200 mL混合均匀,室温避光放置12~16 h,得ABTS储备液。用磷酸盐缓冲液(10 mmol/L,pH 7.4)将ABTS储备液稀释,使其A 734 nm =0.700±0.020。取0.2 mL样品稀释液与3.8 mL ABTS工作液混合均匀反应4 min后检测其A 734 nm ,ABTS + ·清除能力与A 734 nm 呈反比。以Trolox为阳性对照,并绘制标准曲线,样品的总抗氧化能力用Trolox当量(Trolox equivalent antioxidant capacity,TEAC)表示。
1.3.6.4 •OH清除能力
采用罗丹明6G-Fenton体系荧光法 [17] ,在10 mL具塞比色管中,依次加入pH 4.8的磷酸盐缓冲液0.5 mL 0.1 mg/L罗丹明6G溶液0.5 mL、1.0 mmol/L FeSO 4 溶液1.0 mL、0.03% H 2 O 2 溶液0.6 mL,加水至刻度,混匀,反应15 min。激发波长348 nm,发射波长550 nm,激发和发射狭缝宽度为5 nm,以不加Fenton试剂的体系为空白,其荧光强度为F 0 ,0.3 mL样品稀释液与罗丹明6G-Fenton溶液体系的荧光强度记为F 样品 ,未加清除剂体系的荧光强度记为F,并以0.53 mg/mL VC溶液作阳性对照。•OH清除能力按式(2)计算。
式中:F 样品 -F为样品清除6G-Fenton体系•OH的量;F 0 -F为罗丹明6G-Fenton体系所产生的•OH的量。
1.3.7 生酱油组分的抗氧化活性测定
提取酱油色素 [20] ,生酱油与无水乙醇最佳体积比为1∶2.16,按1.3.6.2节方法测定DPPH自由基清除活性。
采用蒸馏萃取法提取生酱油挥发油,按1.3.6.2节方法测定DPPH自由基清除活性。
采用超滤膜分离技术截留分子质量小于10 kDa组分制成冻干粉,按1.3.6.2节方法测定DPPH自由基清除活性。
应用Origin 9.3软件对数据进行作图和统计分析,显著性分析采用SPSS 19.0软件的Duncan test进行,以P<0.05表示差异显著。
表1 米渣生酱油关键质指标和抗氧化活性成分
Table 1 Quality indicators and antioxidant components of raw soy sauces
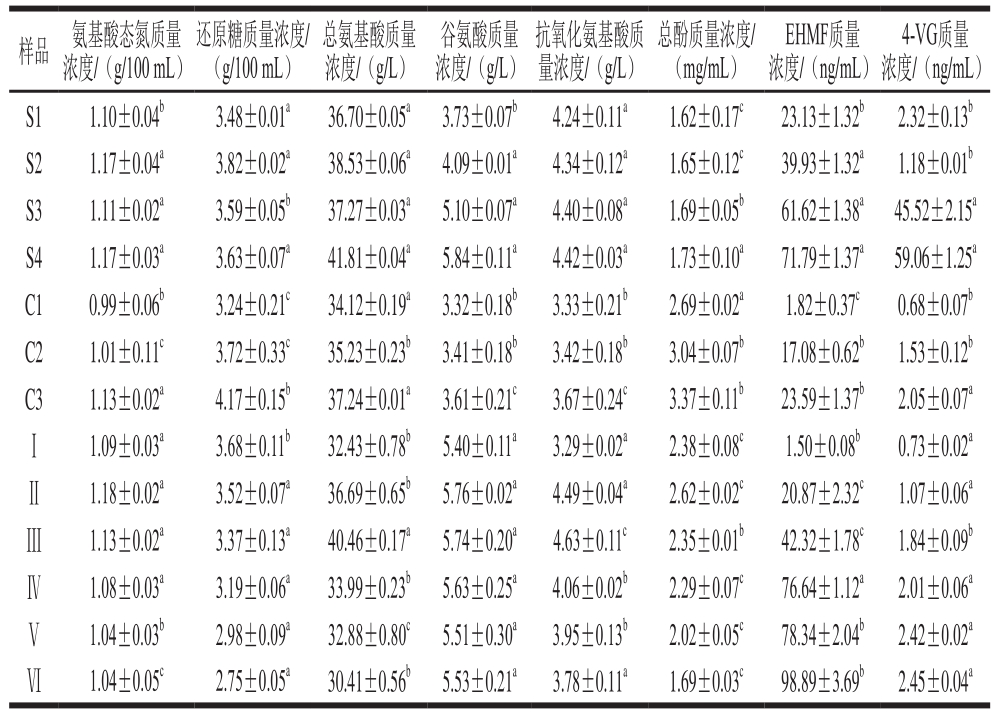
注:抗氧化氨基酸的选择参考文献[21];同一批次实验中,肩标小写字母不同表示不同组间差异显著性(P<0.05)。
由表1可知,S1~S4氨基酸态氮质量浓度均明显高于GB/T 18186—2000《酿造酱油》中特级酱油(0.8 g/100 mL),以添加黑曲霉发酵的S2和S4酱油中的氨基酸态氮质量浓度最高,黑曲霉和米曲霉的协同作用提高了米渣蛋白的降解与转化率。除还原糖外,其他各项指标均以S4最高。黑曲霉产酸性蛋白酶和淀粉酶的能力较强,有利于提高酱油中氨基酸态氮、总氨基酸含量、谷氨酸及还原糖的含量 [22] 。EHMF、4-VG是酱油中重要的特征香气成分,其中,EHMF被认为是日式酱油中最芳香的成分之一 [23-25] 。4-VG可赋予酱油典型的酱香味,EHMF具有焦糖香味,同时还具有抑制肿瘤和抗氧化功能。EHMF由鲁氏酵母、假丝酵母等经戊糖磷酸途径或基于戊糖的美拉德反应而生物合成 [26-27] 。S3、S4的总氨基酸、谷氨酸、EHMF和4-VG质量浓度总体显著高于S1、S2,表明鲁氏酵母不仅与EHMF和4-VG的生物合成具有相关性,而且有利于提高发酵产品氨基酸质量浓度。
C2、C3的各项指标总体明显高于C1(P<0.05),尤以C3增加最为明显,其中C3的EHMF和4-VG分别比C2约提高38.15%和33.98%。鲁氏酵母最适pH值为4.5~5.0,米渣酱醪发酵初始pH值为5.83±0.05,对酵母生长繁殖和代谢有一定抑制作用,酵母易因高浓度盐水而失活或自溶,酱醪中活酵母数量下降。
酵母接种量对氨基酸态氮质量浓度影响不明显,总氨基酸、谷氨酸、抗氧化氨基酸和总酚质量浓度随酵母添加量的增加呈现先增后减的趋势,总氨基酸以Ⅲ为最高,Ⅱ和Ⅲ的谷氨酸、抗氧化氨基酸、总酚质量浓度均较高,表明鲁氏酵母添加0.01%~0.025%较为适宜。EHMF和4-VG质量浓度均随酵母添加量增加而增加,均明显高于未添加组。
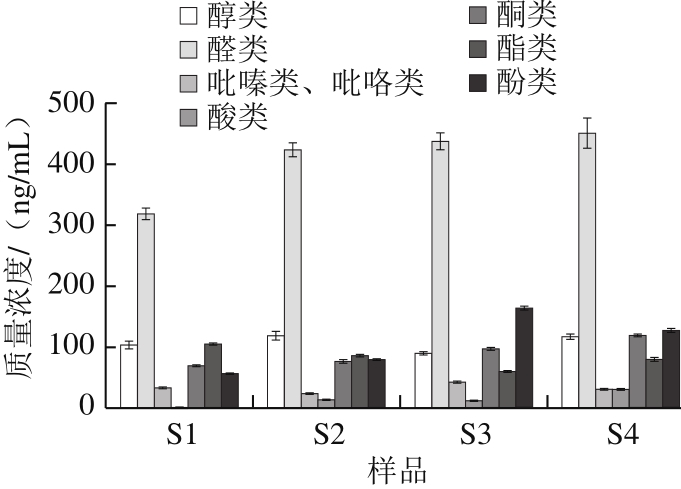
图1 米渣生酱油主要挥发性成分
Fig. 1 Major volatile components in raw soy sauces
由图1可知,S1~S4的挥发性成分种类和质量浓度均有一定的差异,以S3的挥发性成分种类为最多,达57 种,其次是S4,但S4挥发性成分总质量浓度最高,约1 074.79 ng/mL,表明鲁氏酵母耦合发酵显著增加了风味物质的种类和含量。各样品均以醛类物质质量浓度最高,S4的醛类物质质量浓度较S1提高了41.4%,其中对酱油风味有着关键作用的苯甲醛和苯乙醛质量浓度提高最为显著,S4苯甲醛和苯乙醛较S1分别提高了72.47%和44.13%。苯乙醛及其相应的醇2-苯基乙醇来源于苯丙氨酸,事实上,蛋白质的新陈代谢和游离氨基酸的变化在酱油香气的形成中扮演着重要的角色 [28] ,这可能也意味着鲁氏酵母在氨基酸代谢方面的特点。S3、S4酸类物质质量浓度均显著高于相应未添加鲁氏酵母组,表明鲁氏酵母明显提高了酱油中的酸类物质质量浓度。
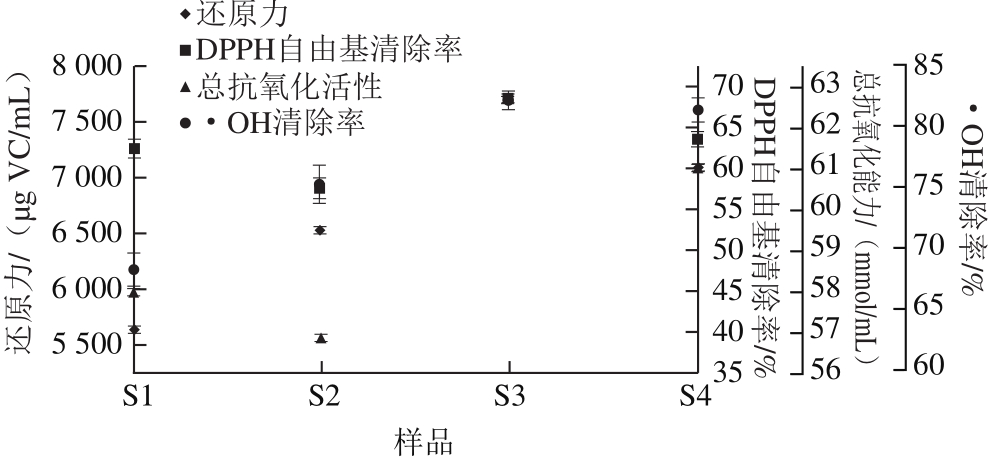
图2 米渣生酱油的体外抗氧化活性
Fig. 2 Antioxidant activity of raw soy sauces
由图2可知,S3、S4的4 种体外抗氧化活性均明显高于相应的对照S1、S2,表明鲁氏酵母在抗氧化活性方面具有一定作用。在其他发酵产品中酵母菌也表现出对抗氧化活性有突出贡献 [29] 。鲁氏酵母除了产生高浓度的多元醇外,还具有较强抗氧化活性,可作为天然抗氧化剂的来源 [30] 。可见鲁氏酵母在耦合发酵酱油的过程中具有多方面的有益作用。
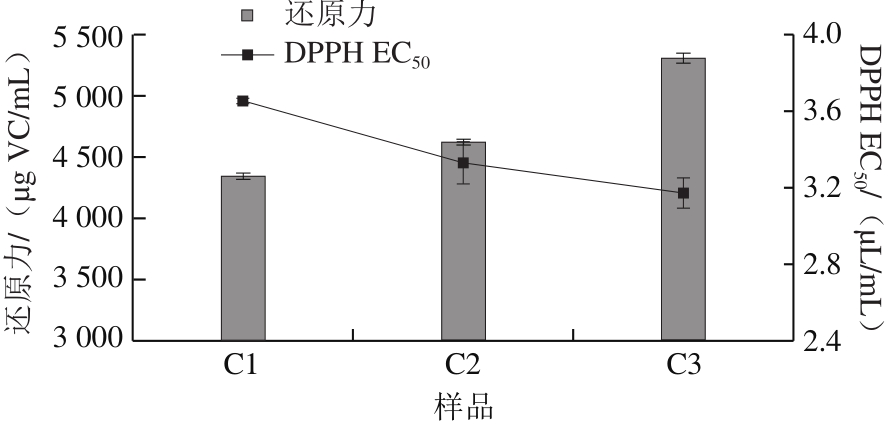
图3 酵母接种时期对米渣生酱油抗氧化活性的影响
Fig. 3 Effect of Z. rouxii inoculation time on antioxidant activity of raw soy sauce
由图3可知,鲁氏酵母接种时期对米渣酱油的抗氧化活性也有影响。C2和C3的抗氧化活性均明显高于C1,特别是C3显著增加,还原力较C2酱油提高了约14.49%,DPPH EC 50 为3.17 μL/mL。因此当酱醪发酵至pH 5.0左右时添加鲁氏酵母有利于提高米渣酱油的抗氧化活性。
由图4A可知,与Ⅰ组相比,发酵初始7 d内各实验组还原力迅速增加,且与鲁氏酵母添加量存在明显的量效关系。发酵1 周后,Ⅳ、Ⅴ、Ⅵ的还原力增加明显变缓,而Ⅰ和Ⅱ还原力依然平稳增加。还原力明显受鲁氏酵母添加量影响。由图4B可知,鲁氏酵母对DPPH自由基清除能力影响规律相似,发酵初始15 d,DPPH自由基清除率与鲁氏酵母添加量呈正相关。表明抗氧化能力的增加与鲁氏酵母的增殖和代谢有关,鲁氏酵母的细胞数量和代谢产物对抗氧化有重要贡献。

图4 发酵期间米渣生酱油抗氧化活性的变化
Fig. 4 Change in antioxidant activity of raw soy sauce during fermentation
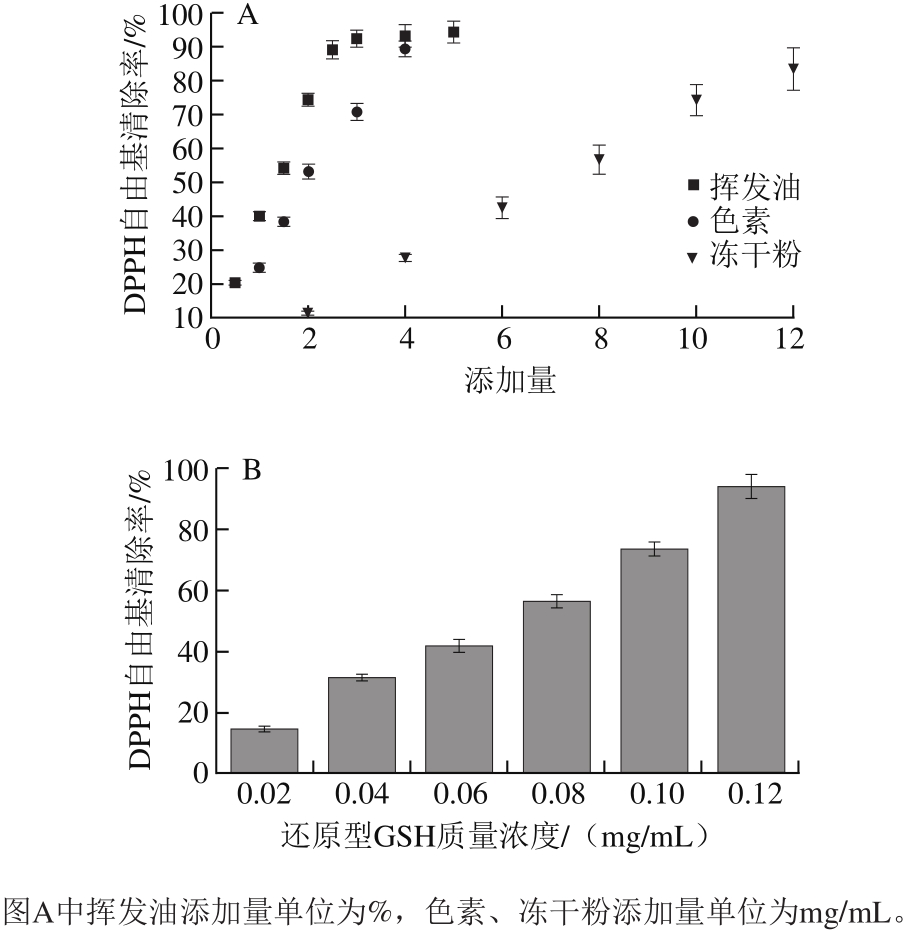
图5 米渣生酱油组分(A)及还原型GSH(B)的DPPH自由基清除活性
Fig. 5 DPPH radical scavenging effect of volatile oil, pigment and retenate with molecular mass less than 10 kDa from raw soy sauce (A)and reduced GSH (B)
如图5A所示,在实验添加量范围内,挥发油与DPPH自由基清除率在明显的量效关系,体积分数低于2.5%时,呈现良好的线性关系,体积分数2.5%时DPPH自由基清除率可达(89.13±0.73)%。米渣酱油色素主要通过褐变反应产生,在实验添加量范围内酱油色素与DPPH自由基清除能力存在线性关系,当色素质量浓度为4 mg/mL时,DPPH自由基清除率达(89.42±0.49)%。随着酱油色素质量浓度增加,电子供体浓度增大,可结合更多的自由基形成稳定物质,从而中断了自由基链式反应 [31] 。截留分子质量小于10 kDa的酱油组分冻干粉和DPPH自由基清除能力呈现明显的线性关系,但是相同质量浓度下,还原型GSH清除DPPH自由基的能力明显强于冻干粉。综合分析表明米渣酱油挥发油、色素和较小的分子中均存在抗氧化活性成分,对米渣酱油抗氧化能力有重要贡献。
鲁氏酵母联合曲霉发酵对增强米渣酱油风味和抗氧化活性有利,总氨基酸和挥发性成分质量浓度均明显增加,特别是谷氨酸、EHMF和4-VG质量浓度增加显著,同时各种体外抗氧化能力也得到明显增强,有效改善了米渣酱油的品质。
利用鲁氏酵母发酵米渣酱油,需掌握适宜的接种量和接种时间,在发酵至酱醪pH 5.0左右时添加约0.025%的鲁氏酵母为宜。
米渣酱油抗氧化的化学本质并未探明,但初步的研究表明其挥发性成分、色素和截留分子质量小于10 kDa的组分具有较强的抗氧化活性。
参考文献:
[1] 郑喜群, 刘晓兰, 苏凌. 玉米渣酿造酱油的新工艺研究[J]. 中国调味品, 2001, 26(5): 16-19; 5. DOI:10.3969/j.issn.1000-9973.2001.05.005.
[2] 曹海丽, 孙欣, 卢晓蕊. 核桃黑米香菇酱油的研制[J]. 食品工业科技,2005, 26(1): 132-134. DOI:10.3969/j.issn.1002-0306.2005.01.048.
[3] QUILES A, LLORCA E, HERNÁNDEZ-CARRIÓN M, et al. Effect of different cornstarch types in new formulations of gluten- and lactosefree white sauces with high protein content[J]. Journal of Food Quality,2012, 35(5): 341-352. DOI:10.1111/j.1745-4557.2012.00461.x.
[4] 易翠平, 姚惠源. 大米蛋白的研究进展[J]. 粮油加工与食品机械,2003(8): 53-54.
[5] 王章存, 申瑞玲, 姚惠源. 大米蛋白开发利用[J]. 粮食与油脂,2004(1): 12-14. DOI:10.3969/j.issn.1008-9578.2004.01.003.
[6] NAGARAJAN S, STEWART B W, FERGUSON M E, et al. Rice protein isolates (RPI) inhibit the onset of atherogenesis in a genetically pre-disposed hypercholesterolemic mouse model[J]. The FASEB Journal, 2006, 20(5): A1000.
[7] 顿新鹏, 陈正望. 酶法水解米渣蛋白制备大米小分子肽[J]. 食品科学, 2004, 25(6): 113-116. DOI:10.3321/j.issn:1002-6630.2004.06.025.
[8] SHIH F F. Edible films from rice protein concentrate and pullulan[J].Cereal Chemistry, 1996, 73(3): 406-409.
[9] 张燕平. 利用下脚料米渣生产全营养蛋白粉的研究[J]. 西部粮油科技, 1999, 24(3): 37; 40. DOI:10.3969/j.issn.1007-6395.1999.03.014.
[10] 林灿, 袁江兰, 邓冲, 等. 米渣蛋白酱油发酵中氮素演变规律与过程调控相关性[J]. 现代食品科技, 2015, 31(6): 116-121. DOI:10.13982/j.mfst.1673-9078.2015.6.019.
[11] KATAOKA S. Functional effects of Japanese style fermented soy sauce (shoyu) and its components[J]. Journal of Bioscience and Bioengineering, 2005, 100(3): 227-234. DOI:10.1263/jbb.100.227.
[12] KOGA T, MORO K, MATSUDO T. Antioxidative behaviors of 4-hydorxy-2,5-dimethyl-3(2H)-furanone and 4-hydorxy-2(or 5)-ethyl-5(or 2)-methyl-3(2H)-furanone against lipid peroxidation[J]. Journal of Agricultural and Food Chemistry, 1998, 46: 946-951. DOI:10.1021/jf9709109.
[13] LONG L H, KWEE D C T, HALLIWELL B. The antioxidant activities of seasonings used in Asian cooking. powerful antioxidant activity of dark soy sauce revealed using the ABTS assay[J]. Free Radical Research, 2000, 32(2): 181-186. DOI:10.1080/10715760000300181.
[14] ESAKI H, KAWAKISHI S, INOUE T, et al. Potent antioxidative o-dihydroxyis-oflavones in soybean pastes and their antioxidative activities[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2001, 48(1):51-57.
[15] MASHILIPA C, WANG Q Y, SLEVIN M, et al. Antiglycation and antioxidant properties of soy sauces[J]. Journal of Medicinal Food,2011, 14(12): 1647-1653. DOI:10.1089/jmf.2011.0054.
[16] MINUSSI R C, ROSSI M, BOLOGNA L, et al. Phenolic compounds and total antioxidant potential of commercial wines[J].Food Chemistry, 2003, 82(3): 409-416. DOI:10.1016/S0308-8146(02)00590-3.
[17] 张爱梅, 臧运波. 罗丹明6G-Co 2+ -H 2 O 2 体系荧光法测定常见蔬菜的抗氧化活性[J]. 食品科学, 2004, 25(1): 149-152. DOI:10.3321/j.issn:1002-6630.2004.01.038.
[18] CHAMPAGNE C P, TOMPKINS T A, BUCKLEY N D, et al.Effect of fermentation by pure and mixed cultures of Streptococcus thermophilus and Lactobacillus helveticus on isoflavone and B-vitamin content of a fermented soy beverage[J]. Food Microbiology, 2010,27(7): 968-972. DOI:10.1016/j.fm.2010.06.003.
[19] 李培源, 卢汝梅, 苏炜 等. ABTS法测定福州薯蓣的抗氧化活性研究[J]. 湖北农业科学, 2016, 55(12): 3173-3175. DOI:10.14088/j.cnki.issn0439-8114.2016.12.043.
[20] 郭彩华, 陈昭华, 孙莉萍 等. 发酵酱油色素的提取及性质研究[J]. 食品工业科技, 2012, 33(10): 157-161. DOI:10.13386/j.issn1002-0306.2012.10.061.
[21] MATSUI R, HONDA R, KANOME M, et al. Designing antioxidant peptides based on the antioxidant properties of the amino acid sidechains[J]. Food Chemistry, 2018, 245: 750-755. DOI:10.1016/j.foodchem.2017.11.119.
[22] 王宪斌, 冯霞, 刘义, 等. 多菌种制曲在酱油发酵中的研究进展[J].食品与发酵科技, 2016, 52(3): 60-64.
[23] KANEKO S, KUMAZAWA K, NISHIMURA O. Comparison of key aroma compounds in five different types of Japanese soy sauces by aroma extract dilution analysis (AEDA)[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 3831-3836. DOI:10.1021/jf300150d.
[24] KANEKO S, KUMAZAWA K, NISHIMURA O. Studies on the key aroma compounds in raw (unheated) and heated Japanese soy sauce[J].Journal of Agricultural and Food Chemistry, 2013, 61: 3396-3402.DOI:10.1021/jf400353h.
[25] FENG Y Z, SU G W, ZHAO H F, et al. Characterisation of aroma profiles of commercial soy sauce by odour activity value and omission test[J]. Food Chemistry, 2015, 167: 220-228. DOI:10.1016/j.foodchem.2014.06.057.
[26] BLANK I, FAY L B. Formation of 4-hydroxy-2,5-dimethyl-3(2H)-furanone and 4-hydroxy-2(or 5)-ethyl-5(or 2)-methyl-3(2H)-furanone through maillard reaction based on pentose sugars[J]. Journal of Agricultural and Food Chemistry, 1996, 44: 531-536. DOI:10.1021/jf950439.
[27] OHATA M, KOHAMA K, MORIMITSU Y, et al. The formation mechanism by yeast of 4-hydroxy-2(or 5)-ethyl-5(or 2)-methyl-3(2H)-furanone in miso[J]. Bioscience Biotechnology Biochemistry, 2007,71: 407-413. DOI:10.1271/bbb.60466.
[28] ZHANG Y, TAO W. Flavor and taste compounds analysis in Chinese solid fermented soy sauce[J]. African Journal of Biotechnology, 2010,8: 673-681. DOI:10.4314/ajb.v8i4.59911.
[29] MALBAŠA R V, LONČAR E S, VITAS J S, et al. Influence of starter cultures on the antioxidant activity of kombucha beverage[J].Food Chemistry, 2011, 127(4): 1727-1731. DOI:10.1016/j.foodchem.2011.02.048.
[30] NAYLIN N, TAING O K, HASHINAGA F, et al. Antioxidant activity of sugar-tolerant yeast Zygosaccharomyces rouxii[J]. Food Biotechnology, 2005, 19(2): 107-120. DOI:10.1081/FBT-200063435.
[31] YEN G C, CHEN H Y. Antioxidant activity of various tea extracts in relation to their antimutagenicity[J]. Journal of Agricultural and Food Chemistry, 1995, 43(1): 27-32. DOI:10.1021/jf00049a007.
YUAN Jianglan, CHEN Xiaomin, ZHONG Wenxiu, KANG Xu
(School of Food and Biological Engineering, Hubei University of Technology, Wuhan 430068, China)
Abstract: The application of Zygosaccharomyces rouxii in conjunction with Aspergillus spp. was proposed to ferment soy sauce with rice dreg protein as a substrate. The effect of Z. rouxii on the flavor and antioxidant activity of soy sauce was evaluated. Results revealed that co-fermentation with Z. rouxii significantly improved the contents of glutamic acid,2-ethyl-4-hydroxy-5-methyl-3(2H)-furanone and 4-vinylguaiacol, and antioxidant activities in vitro such as reducing power,1,1-diphenyl-2-picrylhydrazyl (DPPH) and hydroxyl free radical scavenging capacity and total antioxidant capacity (trolox equivalent antioxidant capacity, TEAC) in soy sauce. The best quality of soy sauce was obtained by inoculating 0.025% of Z. rouxii when Aspergillus spp. fermentation reached pH 5.0. After 45 days of fermentation, the contents of total amino acids and antioxidant amino acid increased by 24.76% and 40.73%, respectively compared with the soy sauce without Z. rouxii fermentation, and the reducing power was 5 830.43 μg VC/mL. Furthermore, obvious DPPH radical scavenging activity was detected in volatile oils, pigments and retenate with molecular mass less than 10 kDa from the soy sauce produced by co-fermentation, which was concentration dependent.
Keywords: Zygosaccharomyces rouxii; Aspergillus oryzae; Aspergillus niger; rice dreg; amino acid nitrogen; flavor; antioxidant activity DOI:10.7506/spkx1002-6630-201817004
Effect of Zygosaccharomyces rouxii on Improving the Flavor and Antioxidant Activity of Raw Soy Sauce Made with Rice Dreg Protein
YUAN Jianglan, CHEN Xiaomin, ZHONG Wenxiu, et al. Effect of Zygosaccharomyces rouxii on improving the flavor and antioxidant activity of raw soy sauce made with rice dreg protein[J]. Food Science, 2018, 39(17): 19-24. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201817004. http://www.spkx.net.cn
引文格式: 袁江兰, 陈晓敏, 钟文秀, 等. 鲁氏酵母对米渣生酱油风味和抗氧化活性的增强效应[J]. 食品科学, 2018, 39(17): 19-24.DOI:10.7506/spkx1002-6630-201817004. http://www.spkx.net.cn
文献标志码: A
文章编号: 1002-6630(2018)17-0019-06
第一作者简介: 袁江兰(1970—),女,教授,博士,研究方向为蛋白质化学。E-mail:jlyuan1229@163.com
中图分类号: TS264.2
基金项目: 国家自然科学基金面上项目(31371741)
(湖北工业大学生物工程与食品学院,湖北 武汉 430068)
收稿日期: 2017-04-14
摘 要: 利用鲁氏酵母和曲霉联合发酵米渣制作生酱油,评价其对产品风味和抗氧化活性的影响。结果表明鲁氏酵母可以提高米渣生酱油谷氨酸、5-甲基-2-乙基-4-羟基-3(2H)-呋喃酮、4-乙烯基愈创木酚含量,增强还原力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、总抗氧化能力和·OH清除率等体外抗氧化活性。米渣酱醪发酵至pH 5.0时接种0.025%鲁氏酵母发酵的生酱油品质最好,发酵45 d时,总氨基酸和抗氧化氨基酸质量浓度较未接种组分别提高了24.76%和40.73%,还原力达到5 830.43 μg VC/mL。米渣生酱油的挥发油、色素和截留分子质量小于10 kDa的组分均具有明显的DPPH自由基清除活性,并且呈现一定的量效关系。