表1 美拉德反应条件正交试验因素水平表
Table 1 Code and level of independent variables used in orthogonal array design for Maillard reaction conditions

刘海梅,陈 静,郝良文,于 慧
关键词: 美拉德反应;抗氧化活性;1,1-二苯基-2-三硝基苯肼自由基清除能力;金属离子螯合能力;还原能力
牡蛎又名生蚝,是我国主要的经济贝类之一,也是我国四大养殖贝类之一 [1] ,营养价值高,富含蛋白质,是一种高蛋白的食品 [2-4] 。已有研究学者利用其富含的蛋白质制备酶解液,发现牡蛎酶解液具有一定的抗氧化活性 [5-6] 。美拉德反应是广泛存在于食品加工与贮藏过程中的一种非酶褐变反应,其利用食品中存在的羰基(主要来源于糖或油脂氧化酸败所产生的醛和酮)和氨基化合物(主要来源于胺、氨基酸、肽和蛋白质)发生羰氨反应,生成美拉德反应产物(Maillard reaction products,MRPs)。MRPs不仅能提供给食品芳香风味和色泽,而且具有抗氧化、抗诱变、抗病毒、抑菌、抗过敏、保护心血管疾病和预防肠道炎症等生理功能 [7-14] 。已有研究表明,美拉德反应能显著增强肽和蛋白质的抗氧化活性,木糖-草鱼肽反应的MRPs [15] 、大豆分离蛋白和金带细鲹鱼肉蛋白酶解物与葡萄糖反应生成的MRPs [16-17] 等的抗氧化活性均高于相应的肽和蛋白质。因此,利用蛋白质、肽、氨基酸和还原糖制备具有抗氧化活性的MRPs [18-21] 已成为国内外研究的热点。
研究发现,MRPs的抗氧化强度可以与食品中常用的抗氧化剂媲美 [22] ,一些MRPs可以替代酚类食用抗氧化剂 [23-24] 。MRPs是食品加工和贮藏过程中自身产生的一类物质,被认为是天然物质,利用美拉德反应产生的抗氧化剂属于天然抗氧化剂,寻找具有高活性的天然抗氧化剂代替商业抗氧化剂如叔丁基对羟基茴香醚、2,6-二叔丁基-4-甲基苯酚,将极大地保障食品质量与安全。MRPs的抗氧化活性会因美拉德反应的反应底物和反应条件的不同而产生较大差异,本研究拟以牡蛎酶解液为原料,与葡萄糖建立美拉德反应体系,优化美拉德反应体系的反应条件,提高MRPs的抗氧化活性,从而为天然抗氧化剂的开发和牡蛎深加工提供理论依据。
太平洋牡蛎(Crassostrea gigas) 烟台振华量贩超市鲁东大学店;Protemax复合蛋白酶(酶活力1.5 AU/g)诺维信忆诺联创生物科技(北京)有限公司;葡萄糖上海市蓝季生物有限公司;二甲基硅油 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 梯希爱(上海)化成工业发展有限公司。所用试剂均为分析纯。
721G紫外-可见分光光度计 上海精密科学仪器有限公司;AR224cn数显电子天平 奥豪斯仪器(上海)有限公司;DF-2集热式恒温磁力搅拌器(油浴锅)金坛市白塔金昌实验仪器厂;TDL-5-A离心机 上海安亭科学仪器厂;JJ-2B组织匀浆捣碎机 金坛市荣华仪器制造有限公司;PB-10普及型pH计 赛多利斯科学仪器(北京)有限公司。
1.3.1 牡蛎酶解液的制备流程
新鲜牡蛎肉→加水调整料液比为1∶5(m/m)→高速组织捣碎机捣碎→自然pH值→加入复合蛋白酶(30 AU/kg)→50 ℃恒温酶解4 h→100 ℃灭酶15 min→冷却→离心(5 000 r/min、15 min)→取上清液→酶解液 [25] 。
1.3.2 葡萄糖质量分数对MRPs抗氧化活性的影响
牡蛎酶解液中加入不同质量的葡萄糖,使葡萄糖的质量分数分别为0%、2%、4%、6%、8%、10%,在自然pH值下100 ℃加热反应90 min,冷却,4 000 r/min离心20 min,取上清液,测定不同葡萄糖质量分数下MRPs的DPPH自由基清除率、金属离子螯合能力以及还原能力。
1.3.3 反应温度对MRPs抗氧化活性的影响
牡蛎酶解液中添加质量分数为5%的葡萄糖,在自然pH值下,分别在90、100、110、120、130、140 ℃条件下加热反应90 min,冷却,4 000 r/min离心20 min,取上清液,测定不同反应温度MRPs的DPPH自由基清除率、金属离子螯合能力以及还原能力。
1.3.4 反应时间对MRPs抗氧化活性的影响
牡蛎酶解液中添加质量分数为5%的葡萄糖,在100 ℃、自然pH值下,分别加热反应30、60、90、120、150、180 min,冷却,4 000 r/min离心20 min,取上清液,测定不同反应时间下MRPs的DPPH自由基清除率、金属离子螯合能力以及还原能力。
1.3.5 pH值对MRPs抗氧化活性的影响
牡蛎酶解液中添加质量分数为5%的葡萄糖,分别调节pH值为5.5、6.0、6.5、7.0、7.5、8.0,在100 ℃下加热90 min,冷却至室温,4 000 r/min离心20 min。取上清液,测定不同pH值下MRPs的DPPH自由基清除率、金属离子螯合能力以及还原能力。
1.3.6 MRPs抗氧化活性为指标的美拉德反应条件正交试验设计
根据单因素试验结果,设计L 9 (3 4 )正交试验对美拉德反应条件进行优化。正交试验的因素水平如表1所示。
表1 美拉德反应条件正交试验因素水平表
Table 1 Code and level of independent variables used in orthogonal array design for Maillard reaction conditions

1.3.7 DPPH自由基清除率的测定
移取2 mL样液,加入2 mL 0.2 mmol/L的DPPH乙醇溶液,混匀后于室温下避光反应30 min,测定在517 nm波长处的吸光度。将2 mL DPPH乙醇溶液与2 mL磷酸盐缓冲液混合液作为对照组;2 mL样品与2 mL乙醇混合液作为空白组 [26] 。DPPH自由基清除率按式(1)计算。
式中:A 1 为实验组的吸光度;A 2 为空白组的吸光度;A 3 为对照组的吸光度。
1.3.8 金属离子螯合能力的测定
移取2 mL样液,加入2.7 mL蒸馏水和0.1 mL 0.02 mmol/L FeCl 2 溶液,再加入0.2 mL、5 mmol/L菲洛嗪溶液,在漩涡混合仪上混匀后室温下反应10 min,于562 nm波长处测定吸光度。用蒸馏水代替样品溶液作为对照组,用蒸馏水代替菲洛嗪溶液作为空白组 [27] 。金属离子螯合能力的计算如式(2)。
式中:A 1 为实验组的吸光度;A 2 为空白组的吸光度;A 3 为对照组的吸光度。
1.3.9 还原能力的测定
取样液1 mL(体积分数95%乙醇作为空白),加入2.5 mL 0.2 mol/L的pH 6.6磷酸盐缓冲液与2.5 mL质量分数1%铁氰化钾的混合溶液,于50 ℃恒温水浴30 min,再加入2.5 mL质量分数10%的三氯乙酸,于3 000 r/min离心分离10 min,取上层清液2.5 mL,加入蒸馏水2.5 mL和0.5 mL质量分数0.1% FeCl 3 ,混合均匀,静置10 min后,测定700 nm波长处吸光度,即为还原能力 [27] 。
采用Excel、SAS 8.1统计软件对数据进行分析处理及图表的制作,采用最小显著性差异法进行方差分析,以P<0.05表示差异显著,以P<0.01表示差异极显著。

图1 葡萄糖质量分数对DPPH自由基清除率及金属离子螯合能力的影响
Fig. 1 Effect of glucose addition on DPPH free radical scavenging capacity and metal chelating ability

图2 葡萄糖质量分数对还原能力的影响
Fig. 2 Effect of glucose addition on reducing power
如图1、2所示,葡萄糖质量分数对MRPs抗氧化活性的影响呈现先增加后降低的趋势。葡萄糖质量分数为2%时,MRPs的DPPH自由基清除率、金属离子螯合能力和还原能力均为最低,分别是53.38%、10.54%、0.893。葡萄糖质量分数增加至4%时,3 种抗氧化活性指标急剧增高,分别为63.50%、13.90%、1.229,继续增加葡萄糖质量分数至10%,3 种抗氧化活性指标均逐渐减弱。经过方差分析,葡萄糖质量分数为4%时,MRPs的DPPH自由基清除率、金属离子螯合能力和还原能力显著高于其他质量分数(P<0.05),且不同葡萄糖质量分数下的MRPs抗氧化活性指标均存在明显差异。经美拉德反应后,MRPs的DPPH自由基清除率明显高于韦海胜等 [5] 报道的牡蛎酶解液的26%,说明经美拉德反应后,产物的抗氧化活性明显增加。
综合分析,葡萄糖质量分数为4%时,MRPs的DPPH自由基清除能力、金属离子螯合能力以及还原能力均达到最大值,因此,适宜的葡萄糖质量分数为4%。

图3 反应温度对DPPH自由基清除率及金属离子螯合能力的影响
Fig. 3 Effect of reaction temperature on DPPH free radical scavenging capacity and metal chelating ability

图4 反应温度对还原能力的影响
Fig. 4 Effect of reaction temperature on reducing power
温度直接影响MRPs的抗氧化活性 [26-28] 。如图3、4所示,温度由90 ℃升至120 ℃时,MRPs的DPPH自由基清除率、金属离子螯合能力和还原能力逐渐增加至最高值,分别达到81.8%、13.0%、1.250;继续增加温度至130、140 ℃时,3 种抗氧化活性指标水平先降低再上升,但数值均低于120 ℃时。经过方差分析,温度为120 ℃时的MRPs的DPPH自由基清除率、金属离子螯合能力和还原能力显著高于其他温度(P<0.05),且不同温度下的MRPs抗氧化活性指标均存在明显差异。章银良等 [29] 发现,随着温度的升高,酪蛋白-木糖模式MRPs的DPPH自由基清除率增加。赵晶等 [30] 研究酪蛋白-葡萄糖MRPs、酪蛋白-乳糖MRPs产物抗氧化活性时也发现,随着温度的升高,MRPs的DPPH自由基清除率增加。本研究结果与报道基本一致。
综合分析,在温度为120 ℃时,MRPs的DPPH自由基清除率、金属离子螯合能力以及还原能力均达到最大值,因此,适宜的反应温度为120 ℃。

图5 反应时间对DPPH自由基清除率及金属离子螯合能力的影响
Fig. 5 Effect of reaction time on DPPH free radical scavenging capacity and metal chelating ability

图6 反应时间对还原能力的影响
Fig. 6 Effect of reaction time on reducing power
如图5、6所示,反应时间从30 min延长至120 min时,MRPs的DPPH自由基清除率、金属离子螯合能力和还原能力整体呈增加趋势,在120 min时达到最大值,分别为84.09%、8.68%、1.216。但随着反应时间延长至150、180 min,DPPH自由基清除率、金属离子螯合能力和还原能力均不同程度下降。经过方差分析,反应时间为120 min时,MRPs的DPPH自由基清除率、金属离子螯合能力、还原能力显著高于其他时间的(P<0.05),不同反应时间下的DPPH自由基清除率均存在显著差异(P<0.05),反应时间为30、180 min下的金属离子螯合能力和还原能力没有显著差异(P>0.05),其他不同反应时间下均存在明显差异。赵谋明等 [15] 研究木糖-草鱼肽美拉德反应体系时发现,具有强还原性的物质易在美拉德反应中产生,但随着美拉德反应的进行,长时间加热可能会使此类物质产生分解,从而导致MRPs还原能力增强趋势变缓。本研究发现,长时间加热会引起强还原性物质分解,从而导致MRPs还原能力有一定程度的降低。
综合分析,在反应时间为120 min时,MRPs的自由基清除率、金属离子螯合能力以及还原能力达到最大值,因此,适宜的反应时间为120 min。

图7 pH值对DPPH自由基清除率及金属离子螯合能力的影响
Fig. 7 Effect of reaction pH on DPPH free radical scavenging capacity and metal chelating ability
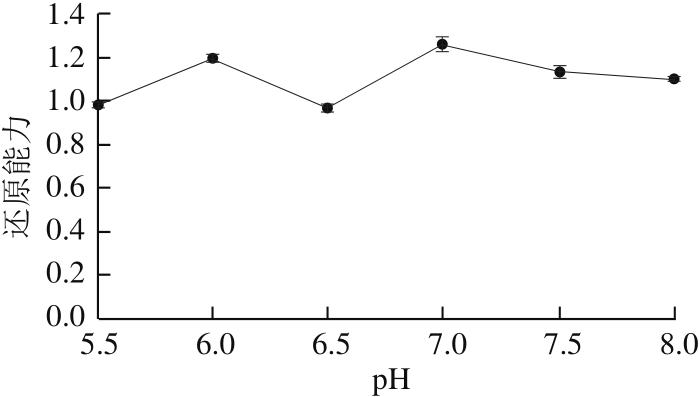
图8 pH值对还原能力的影响
Fig. 8 Effect of reaction pH on reducing power
pH值是美拉德反应的重要影响因素,能够直接影响美拉德反应的进程 [27,29] ,从而影响抗氧化活性物质的生成。如图7、8所示,美拉德反应体系的pH值由5.5上升至7.0,MRPs的DPPH自由基清除率、金属离子螯合能力和还原能力随pH值的增加整体呈现升高趋势,pH 7.0时达到最高,分别为76.54%、25.82%、1.259,pH值上升至8.0的过程中则不断下降。经过方差分析,pH 7.0时,MRPs的DPPH自由基清除率、金属离子螯合能力、还原能力显著高于其他pH值(P<0.05),pH 7.5、8.0下的DPPH自由基清除率不存在显著差异(P>0.05),除此之外,其他不同pH值下的DPPH自由基清除率均存在显著差异(P<0.05);pH 5.5、6.5及pH 6.0、7.5下的金属离子螯合能力不存在显著差异(P>0.05),但pH 6.0、7.5下的金属离子螯合能力显著高于pH 5.5、6.5;pH 5.5、6.5下的还原能力不存在显著差异(P>0.05),其他不同pH值下的还原能力均存在显著差异(P<0.05)。综合分析,在pH 7.0时,MRPs的DPPH自由基清除率、金属离子螯合能力以及还原能力达到最大值,因此,适宜的反应pH值为7.0。
表2 以MRPs抗氧化活性为指标的美拉德反应条件正交试验优化结果
Table 2 Orthogonal array design with experimental values of antioxidant activity
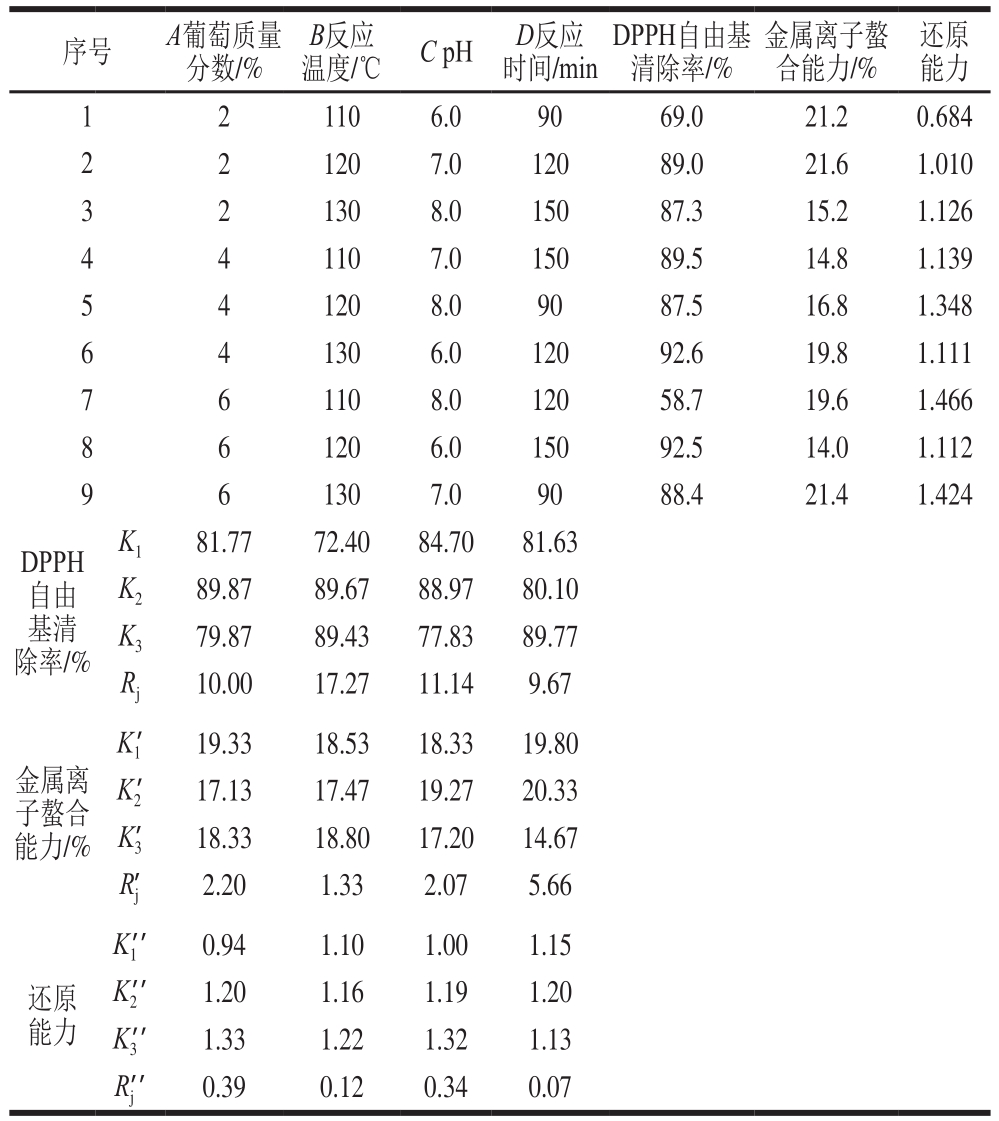
对葡萄糖质量分数、反应温度、反应时间以及pH值进行4 因素3 水平的正交试验优化,经极差分析得到各因素对MRPs抗氧化活性的影响。由表2可知,对DPPH自由基清除率而言,各因素对抗氧化活性影响的大小顺序为B>C>A>D,最优条件为A 2 B 2 C 2 D 3 ,即葡萄糖质量分数4%、反应温度120 ℃、pH 7.0、反应时间150 min;对于金属离子螯合能力而言,各因素对抗氧化活性影响的大小顺序为D>A>C>B,最优条件为A 1 B 3 C 2 D 2 ,即葡萄糖质量分数2%、反应温度130 ℃、pH 7.0、反应时间120 min;对于还原能力而言,各因素对抗氧化活性影响的大小顺序为A>C>B>D,最优反应条件为A 3 B 3 C 3 D 2 ,即葡萄糖质量分数6%、反应温度130 ℃、pH 8.0、反应时间120 min。综合分析葡萄糖质量分数、反应温度、反应时间以及pH值4 个因素对MRPs的DPPH自由基清除率、金属离子螯合能力、还原能力3 个抗氧化活性指标的影响,确定抗氧化活性最强的反应条件为A 2 B 2 C 2 D 2 ,即葡萄糖质量分数4%、反应温度120 ℃、pH 7.0、反应时间120 min。
在牡蛎酶解液中添加4%的葡萄糖,调整pH值为7.0,于120 ℃下进行美拉德反应120 min后,得到MRPs,测定其DPPH自由基清除率为93.2%,金属离子螯合能力为22.5%,还原能力为1.436,优于正交试验结果,证明选择优化的结果可靠。
牡蛎酶解液与葡萄糖建立美拉德反应体系,通过单因素试验和正交试验设计,研究葡萄糖质量分数、反应温度、pH值、反应时间4 个因素对MRPs的DPPH自由基清除率、金属离子螯合能力以及还原能力的影响,优化了MRPs产生较强抗氧化活性的条件,反应条件为葡萄糖质量分数4%、反应温度120 ℃、pH 7.0、反应时间120 min。在此条件下进行美拉德反应,得到的MRPs的DPPH自由基清除率为93.2%、金属离子螯合能力为22.5%、还原能力为1.436。
参考文献:
[1] 李超柱, 潘珍凤, 陈艳辉, 等. 牡蛎软体活性物质的研究进展[J].食品工业与科技, 2012, 33(8): 412-415. DOI:10.13386/j.issn1002-0306.2012.08.105.
[2] 刘慧, 秦小明, 林华娟, 等. 牡蛎蛋白酶解液脱腥技术的研究[J].中国食品学报, 2012, 12(9): 78-86. DOI:10.16429/j.1009-7848.2012.09.026.
[3] 叶盛权, 吴晖, 赖富饶, 等. 牡蛎酶解过程的成分变化及脱腥初步研究[J]. 现代食品科技, 2009, 25(3): 262-265. DOI:10.13982/j.mfst.1673-9078.2009.03.007.
[4] 刘海梅, 陈静, 安孝宇, 等. 牡蛎酶解工艺参数优化及其产物分析与评价[J]. 食品科学, 2017, 38(14): 240-244. DOI:10.7506/spkx1002-6630-201714037.
[5] 韦海胜, 常虹, 段振华, 等. 牡蛎肉酶解液的抗氧化工艺研究[J]. 食品科技, 2012, 37(6): 150-153. DOI:10.13684/j.cnki.spkj.2012.06.053.
[6] 李园, 刘艳, 段振华. 双酶法制备牡蛎抗氧化酶解液的工艺优化[J]. 食品研究与开发, 2016, 37(15): 118-121. DOI:10.3969/j.issn.1005-6521.2016.15.028.
[7] 胡燕, 陈忠杰, 李斌. 美拉德反应产物的功能特性和安全性研究进展[J]. 食品工业, 2016, 37(10): 258-262.
[8] 张君慧, 张晖, 王兴国, 等. 抗氧化活性肽的研究进展[J]. 中国粮油学报, 2008, 23(6): 227-233.
[9] BORRELLI R C, MENNELL A C, BARBA F, et al. Characterization of coloured compounds obtained by enzymatic extraction of backery products[J]. Food and Chemical Toxicology, 2003, 41(10): 1367-1374.DOI:10.1016/S0278-6915(03):00140-6.
[10] WAGNER K H, DERKITS S, HERR M, et al. Antioxidative potential of melanoidins isolated from a roasted glucose-glycine model[J].Food Chemistry, 2002, 78(3): 375-382. DOI:10.1016/S0308-8146(02)00200-5.
[11] 龚平, 阚建全. 美拉德反应产物性质的研究进展[J]. 食品与发酵工业, 2009, 35(4): 141-146. DOI:10.13995/j.cnki.11-1802/ts.2009.04.023.
[12] HWANG I G, KIM H Y, WOO K S, et al. Biological activities of Maillard reaction products (MRPs) in a sugar-amino acid model system[J]. Food Chemistry, 2011, 126(1): 221-227. DOI:10.1016/j.foodchem.2010.10.103.
[13] 倪孔巍, 张萌, 徐大伦, 等. 花蟹肉酶解物美拉德反应产物的抗氧化性[J]. 食品与生物技术学报, 2015, 34(3): 239-245. DOI:10.13386/j.issn1002-0306.2017.05.008.
[14] 杨荣华, 林家莲, 周凌霄. 酱油、豆酱中褐色色素的生理功能[J]. 中国调味品, 2000, 5(5): 21-25. DOI:10.3969/j.issn.1000-9973.2000.05.005.
[15] 赵谋明, 刘洋, 张佳男, 等. 木糖-草鱼肽美拉德反应产物的抗氧化性[J]. 农业工程学报, 2014, 30(9): 279-286. DOI:10.3969/j.issn.1002-6819.2014.09.035.
[16] 杨健, 李芳菲, 武淑影, 等. 大豆蛋白美拉德反应产物的抗氧化特性及其机理[J]. 中国食品学报, 2017, 17(2): 44-51. DOI:10.16429/j.1009-7848.2017.02.007.
[17] 王军, 王忠合, 傅力, 等. 美拉德反应对金带细鲹鱼肉蛋白酶解物体内抗氧化性的影响[J]. 现代食品科技, 2017, 33(4): 38-45.DOI:10.13982/j.mfst.1673-9078.2017.4.007.
[18] 项惠丹, 许时婴, 王璋. 蛋白质与还原糖美拉德反应产物的抗氧化活性[J]. 食品科学, 2008, 29(7): 52-57. DOI:10.3321/j.issn:1002-6630.2008.07.005.
[19] 唐宏刚, 肖朝耿, 叶梦迪, 等. 猪骨蛋白酶解液美拉德反应产物的抗氧化活性研究[J]. 浙江农业学报, 2016, 28(8): 1396-1400.DOI:10.3969/j.issn.1004-1524.2016.08.18.
[20] 李鑫, 刘骞, 韩建春, 等. 大豆浓缩蛋白与还原糖美拉德反应产物的理化及抗氧化活性的研究[J]. 大豆科技, 2013, 32(2): 30-36.
[21] 章银良, 卢慢慢, 张陆燕, 等. 均匀试验优化鲢鱼蛋白-D-木糖美拉德反应产物的抗氧化活性[J]. 河南工业大学学报(自然科学版), 2015,36(2): 28-31; 36. DOI:10.16433/j.cnki.issn1673-2383.2015.02.028.
[22] PAPETTI A, DAGLIA M, ACETI C, et al. Isolation of an in vitro and ex vivo antiradical melanoidin from roasted barley[J]. Journal of Agricultural and Food Chemistry, 2006, 54(4): 1209-1216. DOI:10.1021/jf058133x.
[23] EISSA H A, FADEL H H M, IBRAHIM G E, et al. Thiol containing compounds as controlling agents of enzymatic browning in some apple products[J]. Food Research International, 2006, 39(8): 855-863.DOI:10.1016/j.foodres.2006.04.004.
[24] 张汆, 骆会婷. 食品类黑精的研究进展[J]. 中国食品添加剂,2005(3): 11-13; 29. DOI:10.3969/j.issn.1006-2513.2005.03.004.
[25] 刘海梅, 安孝宇, 陈静, 等. 牡蛎酶解液美拉德反应体系优化及产物营养评价[J]. 食品科学, 2017, 38(16): 178-182. DOI:10.7506/spkx1002-6630-201716028.
[26] 周春娣, 王晓春, 刘平. 美拉德反应对核桃蛋白肽抗氧化特性的影响[J]. 食品与发酵科技, 2014, 50(6): 43-46; 81.
[27] SAMPATH KUMAR N S, NAZEER R A, JAIGANESH R.Purification and identification of antioxidant peptides from the skin protein hydrolysate of two marine fishes, horse mackerel (Magalaspis cordyla) and croaker (Otolithes ruber)[J]. Amino Acids, 2012, 42(12):1641-1649. DOI:10.1007/s00726-011-0858-6.
[28] 王军, 王忠合, 傅力, 等. 美拉德反应对金带细鲹鱼肉蛋白酶解物体内抗氧化性的影响[J]. 现代食品科技, 2017, 33(4): 38-45.DOI:10.13982/j.mfst.1673-9078.2017.4.007.
[29] 章银良, 张陆燕, 周文权, 等. 不同温度对酪蛋白-木糖模式美拉德反应产物抗氧化性的影响[J]. 现代食品科技, 2014, 30(4): 211-219.DOI:10.13982/j.mfst.1673-9078.2014.04.038.
[30] 赵晶, 马丹雅, 张筠, 等. 酪蛋白与还原糖美拉德反应产物抗氧化性的研究[J]. 食品工业科技, 2011, 32(12): 187-189; 293.DOI:10.13386/j.issn1002-0306.2011.12.070.
LIU Haimei, CHEN Jing, HAO Liangwen, YU Hui
(School of Food Engineering, Ludong University, Yantai 264025, China)
Abstract: Maillard reaction products (MRPs) were prepared from oyster enzymatic hydrolysate and glucose. To optimize reaction conditions for the production of MRPs with strong antioxidant activity, the effects of glucose addition, temperature,pH and reaction time on the 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity, metal chelating ability and reducing power of MRPs were studied by one-factor-at-a-time and orthogonal array design methods. The results showed that the best reaction conditions were determined as addition of 4% glucose, reaction temperature of 120 ℃, pH 7.0, and reaction time of 120 min. The antioxidant activity of MRPs prepared under the optimized conditions was 93.2%, 22.5% and 1.436 in DPPH radical scavenging capacity, metal chelating ability and reducing power assays, respectively.
Keywords: Maillard reaction; antioxidant activity; 1,1-diphenyl-2-picrylhydrazyl radical scavenging capacity; metal chelating ability; reducing power
Antioxidant Activity of Maillard Reaction Products from Glucose and Oyster Enzymatic Hydrolysate
LIU Haimei, CHEN Jing, HAO Liangwen, et al. Antioxidant activity of Maillard reaction products from glucose and oyster enzymatic hydrolysate[J]. Food Science, 2018, 39(17): 47-52. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201817008. http://www.spkx.net.cn
文章编号: 1002-6630(2018)17-0047-06
引文格式: 刘海梅, 陈静, 郝良文, 等. 葡萄糖-牡蛎酶解液美拉德反应体系的抗氧化活性[J]. 食品科学, 2018, 39(17): 47-52.DOI:10.7506/spkx1002-6630-201817008. http://www.spkx.net.cn
中图分类号: TS254.1
文献标志码: A
第一作者简介: 刘海梅(1979—),女,教授,博士,研究方向为水产品加工与高值化利用。E-mail:hellen_79@aliyun.com
DOI: 10.7506/spkx1002-6630-201817008
基金项目: 山东省自然科学基金项目(ZR2015PC002);山东省科技发展计划项目(2012YD07013)
(鲁东大学食品工程学院,山东 烟台 264025)
收稿日期: 2017-07-07
摘 要: 以牡蛎酶解液与葡萄糖建立美拉德反应体系,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、金属离子螯合能力和还原能力为指标,通过葡萄糖质量分数、反应温度、pH值以及反应时间4 个因素的单因素试验和正交试验优化得到具有强抗氧化活性的美拉德反应产物适宜反应条件。结果表明,葡萄糖-牡蛎酶解液美拉德反应产物具有较强抗氧化活性的反应条件为葡萄糖质量分数4%、反应温度120 ℃、pH 7.0、反应时间120 min。在此组合条件下,牡蛎酶解液美拉德反应得到的反应液的DPPH自由基清除率为93.2%,金属离子螯合能力为22.5%,还原能力为1.436。