熊政委 1,2 ,谢跃杰 1,2 ,黄梅桂 2,3 ,赵富昌 4 ,王仲明 1,2 ,任贵礼 4 ,王 强 1,2, *
(1.重庆第二师范学院生物与化学工程学院,重庆 400067;2.重庆第二师范学院,脂质资源与儿童日化品协同创新中心,重庆 400067;3.南京林业大学轻工与食品学院,江苏 南京 210037;4.重庆江源油橄榄开发有限公司,重庆 404100)
摘 要: 油橄榄鲜果被广泛用作加工药材或作为蔬菜食用,不同品种及成熟度对其药用和食用价值具有重要影响。本实验研究了10 个具有代表性的油橄榄品种(白橄榄、豆果、鄂植、佛奥、卡林、科拉蒂、克罗莱卡、皮瓜尔、云台和配多灵)及3 个成熟度(早、中、晚)对其功效成分(总酚、总类黄酮、总黄烷-3-醇、橄榄苦苷和羟基酪醇)和抗氧化能力(铁离子还原能力、清除1,1-二苯基-2-苦基苯肼自由基、羟自由基和超氧阴离子自由基能力)的影响,并通过相关性和主成分分析研究了油橄榄鲜果不同品种及成熟度与所分析指标之间的关联性。研究发现:不同油橄榄品种及成熟度对其功效成分影响程度不同,并且品种对所分析指标的影响大于成熟度;随着成熟度的增加,油橄榄鲜果提取物的抗氧化能力(除清除超氧阴离子自由基能力)呈现增强趋势。通过对不同品种及成熟度的油橄榄鲜果功效成分和抗氧化能力进行分析,为油橄榄品种的选育、采收、加工和应用提供理论依据。
关键词: 油橄榄鲜果;品种;成熟度;理化特性;功效成分;抗氧化能力
油橄榄属木犀科木犀榄属常绿乔木,又名洋橄榄、齐墩果,是世界四大木本油料植物之一,主要分布于甘肃、重庆、云南、四川等地区 [1] 。油橄榄是一种高经济效益的树种,其综合利用价值较高,主产品为橄榄油,具有抗氧化、抗菌、抗癌等功效,享有“食用植物油皇后”的美誉;油橄榄鲜果还可加工成药用或餐用油橄榄,作为药材或蔬菜食用 [2] ;其榨油后的果渣可作提取载体、饲料、肥料或燃料 [1,3] 。近年来,研究发现油橄榄叶提取物具有抗氧化、降血糖、降血压、抗动脉粥样硬化作用 [4-5] 。自古以来,由油橄榄果制作的产品就被作为食物和传统药物使用 [6] 。油橄榄鲜果皮肉细嫩、清香适口,含有较丰富的营养成分,可以作为餐用蔬菜;同时,《滇南本草》中提到橄榄“治一切喉火上炎,大头瘟症,能解湿热,生津止渴,利痰,解鱼毒、酒、积滞” [7] 。现代营养学研究发现,油橄榄鲜果含有丰富的酚酸类、黄酮类、裂环烯醚萜类(包括橄榄苦苷(oleuropein,OL))、维生素及色素类等生物活性成分 [8] 。
目前,关于油橄榄鲜果的研究主要集中于鲜果中黄酮类和多酚类化合物的提取和分析。邓俊琳等 [9] 建立了测定油橄榄鲜果中没食子酸、羟基酪醇(hydroxytyrosol,HT)、对香豆酸、芦丁、OL和槲皮素6 种多酚化合物含量的高效液相色谱方法;并研究了不同成熟度对蛋白质、还原糖、粗脂肪、总多酚含量的影响 [10-11] 。Salvador等 [12] 的研究发现,收获时间对橄榄油产量、品质、稳定性、感官特性有重要影响。影响橄榄油鲜果中化合物的组成及含量的因素很多,如遗传因子、气候因子、土壤因子、加工手段、采收时间等 [13-19] 。但迄今为止关于多个不同油橄榄鲜果品种及成熟度对其主要功效成分(总酚(total phenol,TP)、总类黄酮(total flavonoid,TF)、总黄烷-3-醇(total flavanols,TFL)、OL、HT)的报道还很少。因此,为评价油橄榄鲜果药用和食用价值,本研究对具有代表性的10 个品种进行功效成分分析;通过比较分析不同品种及成熟度(早、中、晚,分别记为I、II、III)油橄榄鲜果的功效成分和抗氧化能力,评价不同品种及成熟度间的品质差异性,对橄榄品种的选育及采后加工具有指导意义。
供试油橄榄鲜果采集于重庆、甘肃陇南油橄榄种植示范基地。实验采用完全随机设计,选取不同株生长健壮、长势一致的果树为试材,共选取长势良好、产量较稳定的10 个品种:白橄榄、豆果、鄂植、佛奥、卡林、科拉蒂、克罗莱卡、皮瓜尔、云台、配多灵,分别在早、中、晚(即I、II、III)成熟期采摘于油橄榄种植基地,每个品种选取3 株生长健壮、长势一致的5 年生树为试材。
儿茶素、焦性没食子酸、1,1-二苯基-2-苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、L-抗坏血酸、福林-酚、水溶性VE(Trolox)、p-二甲氨基肉桂醛(p-dimethylaminocinnamaldehyde,p-DMACA)、乙腈(色谱纯) 美国Spectrum公司;其他化学试剂均为国产分析纯;所用水为双蒸水,所用溶液均自行配制。
AR2140电子天平 梅特勒-托利多仪器(上海)有限公司;JYL-C012料理机 九阳股份有限公司;高压均质机 上海申鹿均质机有限公司;DHG-9240A电热恒温鼓风干燥箱、DK-8D三孔电热恒温水槽 上海齐欣科学仪器有限公司;UV-2450紫外-可见分光光度计、LC-20A高效液相色谱仪 日本岛津公司。
1.3.1 油橄榄鲜果原料预处理与提取
油橄榄鲜果的取样根据GB/T 8855—2008《新鲜水果和蔬菜 取样方法》 [20] 。将油橄榄果实去核,加液氮研成粉末,-80 ℃贮存备用。准确称取200 g粉末,加入体积分数80%甲醇溶液,超声提取25 min后,于4 ℃条件下5 000 r/min冷冻离心20 min,上清液即为油橄榄鲜果提取物,低温保存备用。
1.3.2 不同品种及成熟度油橄榄鲜果TP、TF、TFL、OL、HT含量的测定
TP含量的测定采用福林-酚法 [21] ,以焦性没食子酸-乙醇溶液(10~150 mg/L)作标准曲线,以每克鲜果粉末含有没食子酸质量表示(μg/g)。TF含量采用三氯化铝比色法测定 [22] ,以每克鲜果粉末含有儿茶素质量表示(μg/g)。TFL含量采用p-DMACA法测定 [23] ,以每克新鲜样品含有儿茶素质量表示(μg/g)。OL和HT含量均采用色谱法测定 [24-25] ,均以每克鲜果粉末含有测试物质量表示(μg/g)。
OL含量测定的超高效液相色谱(ultra performance liquid chromatography,UPLC)条件 [24] :UPLC BEH C 18 色谱柱(50 mm×1.0 mm,1.7 μm),柱温30 ℃;流动相:乙腈-水(21∶79,V/V);检测波长230 nm;紫外检测器;流速1 mL/min。准确称取OL标准品7.88 mg,以甲醇定容至5 mL,混匀,配成质量浓度为1.576 mg/mL的溶液;分别移取80、155、235、315、395 μL溶液用甲醇定容至5 mL。以峰面积对质量浓度绘制标准曲线,计算OL含量,回归方程为y=6.217×10 -8 x(R 2 =0.999 1)。
HT含量测定的UPLC条件:UPLC BEH C 18 色谱柱(50 mm×1.0 mm,1.7 μm);流动相:A为体积分数0.2%甲酸-乙腈溶液,B为体积分数0.2%甲酸-水溶液;流速0.15 mL/min;进样量2.0 μL;柱温35 ℃;激发波长为300 nm,发射波长为350 nm;洗脱梯度:0~5.0 min,5%~8% A;5.0~8.0 min,8%~80% A;8.0~9.0 min,80%~5% A;平衡2.0 min。准确称取HT标准品1.20 mg,加体积分数12%甲醇-磷酸溶液定容,混匀,配成质量浓度为120 μg/mL溶液;按对半稀释法分别配制3.75、7.50、15.00、30.00、60.00 μg/mL溶液,以峰面积对质量浓度绘制标准曲线,计算HT含量,回归方程为y=2.462×10 –5 x-1.302×10 -5 (R 2 =0.998 9)。
1.3.3 不同品种及成熟度油橄榄鲜果提取物抗氧化能力的测定
1.3.3.1 FRAP的测定
铁离子还原能力(ferric reducing/antioxidant power,FRAP)参考Benzie等 [26] 的方法。取500 μg油橄榄鲜果提取物,加入1.8 mL 2,3,5-氯化三苯基四氮(2,3,5-triphenyltetrazolium chloride,TPTZ)工作液(由25 mL 0.3 mol/L醋酸盐缓冲液(pH 3.6)、2.5 mL 10 mmol/L TPTZ溶液、2.5 mL 20 mmol/L FeCl 3 溶液组成),混匀后37 ℃反应15 min,测定吸光度A 593 nm ,以1.0 mmol/L FeSO 4 为标准溶液,样品FRAP以每100 g鲜果粉末达到同样吸光度所需FeSO 4 的物质的量表示(mmol/100 g)。
1.3.3.2 清除DPPH自由基能力的测定
清除DPPH自由基能力参考Liu Lixiang等 [27] 的方法进行测定,将4 mL 95% DPPH-乙醇溶液(10 -4 mol/L)与油橄榄鲜果提取物500 μg混匀后测定吸光度A 517 nm ,以Trolox为标样做标准曲线计算,DPPH自由基清除能力,回归方程为y=3.526x-1.423(R 2 =0.999 1),结果以每100 g鲜果粉末含有Trolox物质的量表示(mmol/100 g)。
1.3.3.3 清除·OH能力的测定
清除羟自由基(·OH)能力的测定参照孙瑾等 [28] 的方法并略有修改。在比色管中依次加入1 mL 10 mmol/L FeSO 4 、1 mL 10 mmol/L水杨酸、油橄榄鲜果提取物500 μg,最后加入1 mL 8.8 mmol/L H 2 O 2 ,37 ℃反应0.5 h,以蒸馏水作参比,在510 nm波长处测吸光度,并同时做不加FeSO 4 的空白样品;以Trolox为标准品作标准曲线,计算·OH清除能力,回归方程为y=2.566x-1.602(R 2 =0.999 0),结果以每100 g鲜果粉末含有Trolox物质的量表示(mmol/100 g)。
1.3.3.4 清除O 2 - ·能力的测定
清除超氧阴离子自由基(O 2 - ·)能力的测定参照孙瑾等 [28] 的方法并略有修改。取油橄榄鲜果提取物0.1 mg,加入0.1 mol/L Tris-HCl缓冲液(pH 8.2)2.8 mL混匀,25 ℃水浴10 min后加入3 mmol/L的邻苯三酚溶液(25 ℃水浴预热)0.1 mL,混匀后迅速在420 nm波长处测定吸光度,每隔30 s读取A 420 nm ,5 min后结束。以去离子水0.1 mL和0.1 mol/L Tris-HC1缓冲液(pH 8.2)2.8 mL调零;空白对照管以去离子水代替油橄榄鲜果提取物。作吸光度随时间变化的回归方程,其斜率为邻苯三酚自氧化速率v,按下式计算O 2 - ·清除率。
实验数据以 ±s表示,用Duncan法进行差异显著性检验,以P<0.05表示差异显著,使用Origin 8.0软件作图。采用SPSS 16.0软件进行各元素间相关性分析(correlation analysis,CA),因多数变量不服从正态分布,故采用Spearman等级相关系数法。采用SAS 8.2软件中PRINCOMP过程对数据进行主成分分析(principal component analysis,PCA)。

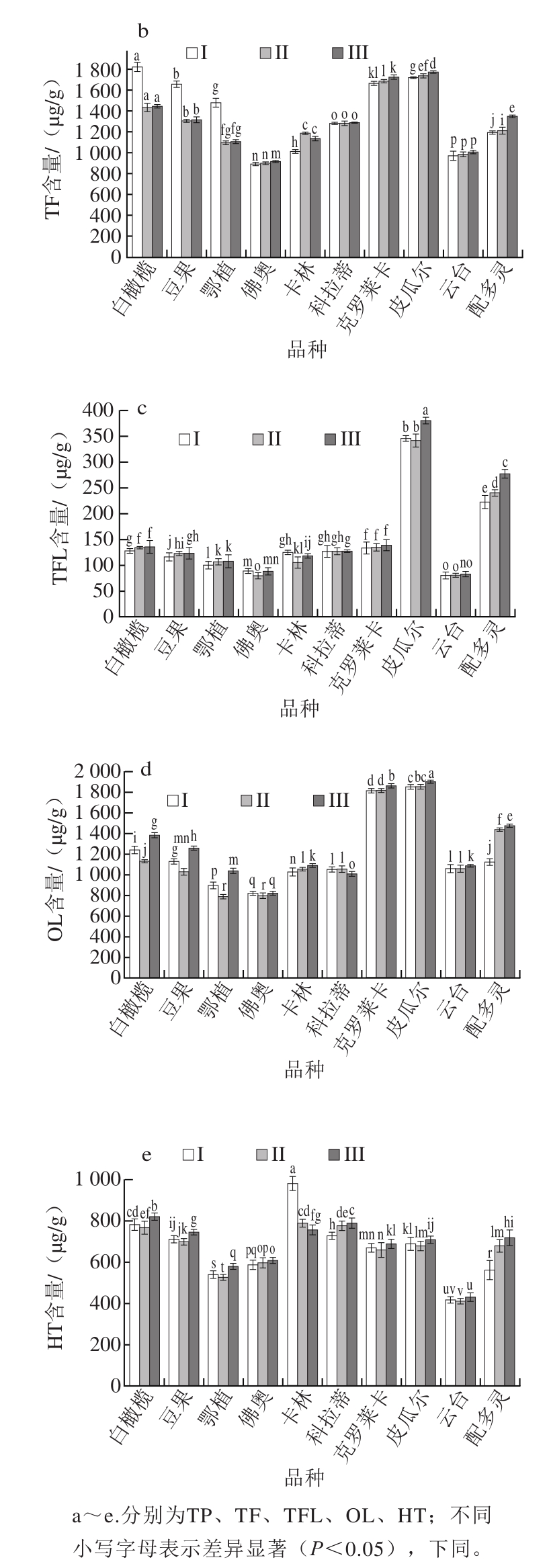
图1 品种及成熟度对油橄榄鲜果功效成分的影响
Fig. 1 Effects of cultivar and maturity on functional composition content in fresh olive fruits
由图1可知,在整个成熟过程中,对于同一个品种的鲜果而言,不同成熟度时TP和OL含量相对稳定,分别介于(1 080.63±24.33)~(2 434.75±11.89)μg/g之间和(790.47±21.89)~(1 867.62±19.67)μg/g之间,不同成熟度之间其差异较小;TP含量最高的为第II成熟阶段白橄榄品种,含量最低的为第II成熟阶段云台品种;OL含量最高的为第III成熟阶段皮瓜尔品种,含量最低的为第II成熟阶段佛奥品种。
在整个成熟过程中,仅白橄榄、豆果、鄂植和配多灵4 个品种的TF含量变化较大,其中第I成熟阶段白橄榄品种TF含量最高,达到(1 824.7±42.37)μg/g;仅皮瓜尔和配多灵2 个品种的TFL含量变化较大,其中第III成熟阶段皮瓜尔品种TFL含量最高,达到(380.86±6.21)μg/g。不同品种及成熟度对油橄榄鲜果HT含量的整体影响与TP、TF、TFL和OL含量不同,各品种和不同成熟阶段鲜果中HT含量波动较大,介于(413.30±12.34)~(983.96±32.15)μg/g之间。
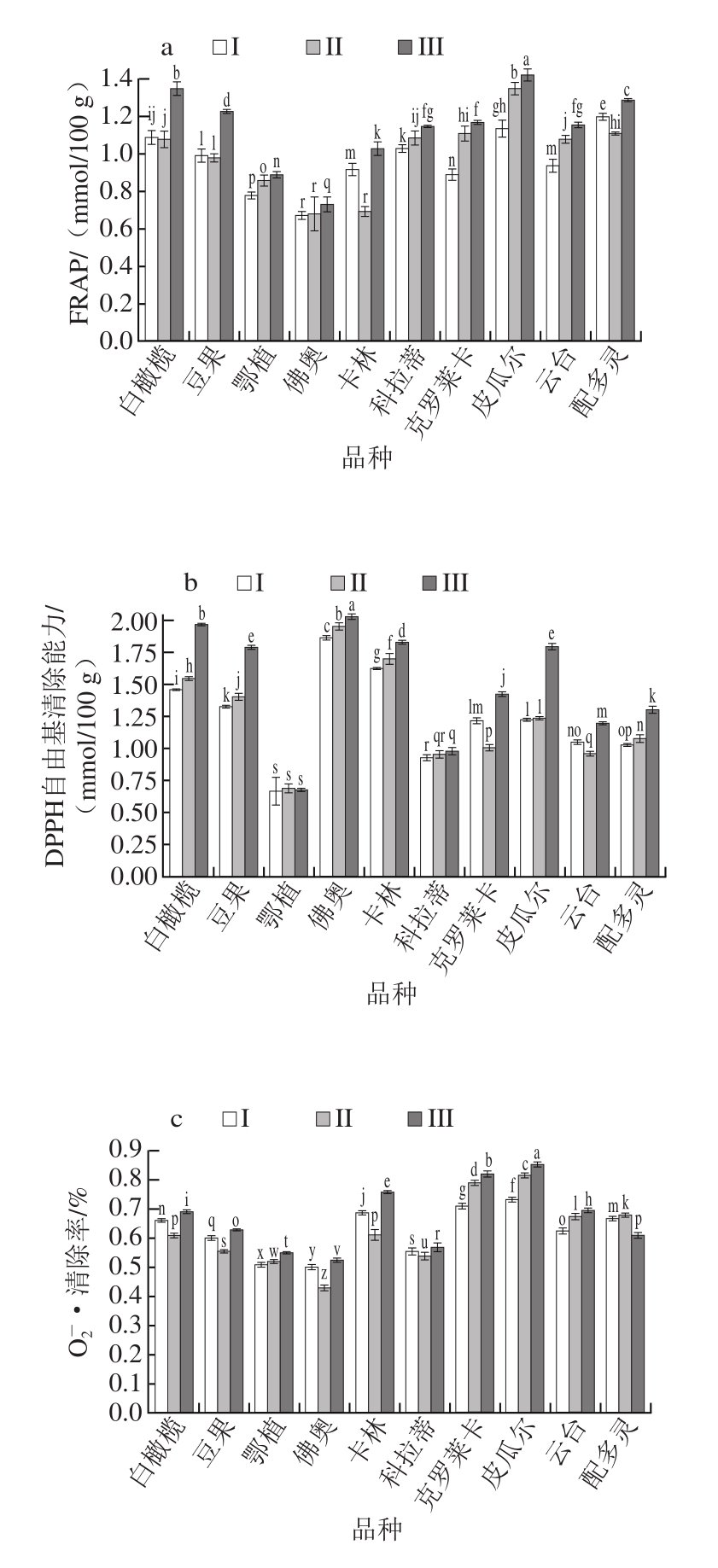
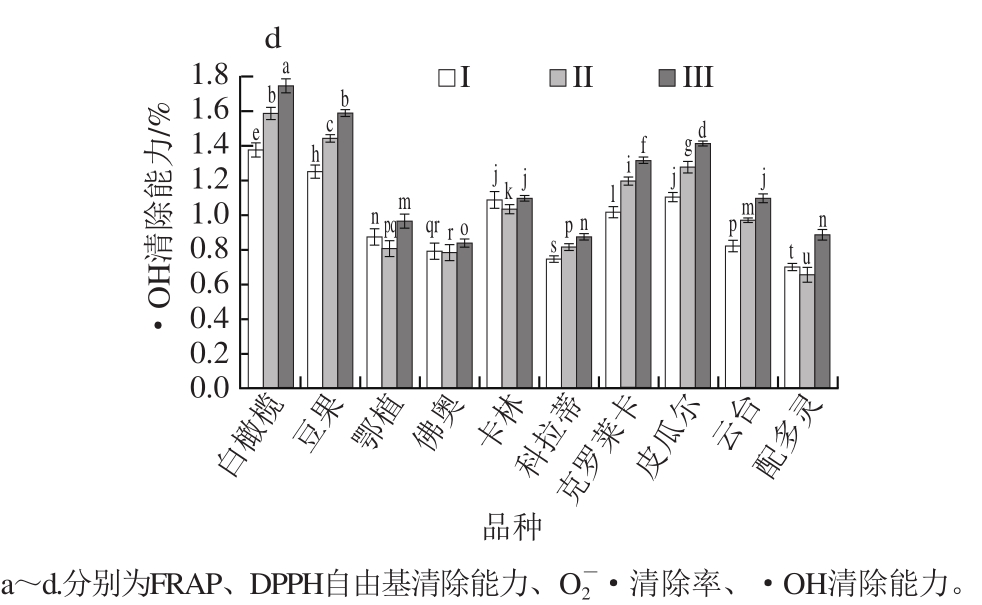
图2 不同品种及成熟度对油橄榄鲜果提取物的抗氧化能力的影响
Fig. 2 Effects of cultivar and maturity on antioxidant capacity of fresh olive fruit extracts
由图2可知,随着成熟度的增加,油橄榄鲜果提取物的抗氧化能力呈现增强趋势,但是O 2 - ·清除率无此规律。第III成熟阶段的白橄榄、豆果、皮瓜尔和配多灵品种FRAP较强(均大于1.2 mmol/100 g);第III成熟阶段的白橄榄、豆果、佛奥、卡林、皮瓜尔品种DPPH自由基清除能力较强(均大于1.75 mmol/100 g);第III成熟阶段的白橄榄、豆果品种•OH清除能力较强(均大于1.6 mmol/100 g);除了配多灵品种,油橄榄鲜果提取物清除O 2 - ·的能力均随着成熟度增加而总体呈现增强的趋势(第II成熟阶段略有波动),其中卡林、克罗莱卡、皮瓜尔清除O 2 - ·的能力较强。
表1 不同品种及成熟度油橄榄鲜果提取物中功效成分含量与抗氧化能力的相关性
Table 1 Correlation between functional composition and antioxidant capacity of fresh olive fruit extracts from different cultivars at different harvest dates

注:*.相关性显著(P<0.05)。
表1相关矩阵分析显示,油橄榄鲜果提取物FRAP与TF、TFL和OL含量呈显著正相关(P<0.05);其DPPH自由基清除能力与HT含量呈显著正相关(P<0.05);其•OH清除能力与各功效成分含量均呈显著正相关(P<0.05)(除TFL含量);其O 2 - ·清除率与TF、TFL和OL含量均呈显著正相关(P<0.05)。
PCA可以用于解释和分析多维样品之间的差异,从而进一步分析“相似多维变量”之间的差异 [29-31] 。本实验通过对不同品种及成熟度油橄榄鲜果提取物的功效成分与抗氧化能力的数据进行分析,根据特征值大于1的原则提取了3 个主成分(PCs),其方差贡献率分别为43.42%、25.62%和9.52%,前2 个PCs数据反映了原始数据提供信息总量的78.56%。因此,将这2 个PCs作为评价所采集的样品质量的综合变量,通过PC1-PC2散点图即可直观了解各个品种及其成熟度的聚类程度及分布(图3)。
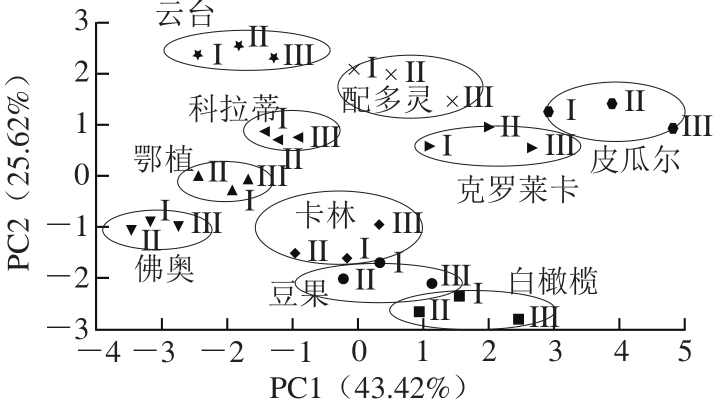
图3 不同品种及成熟度油橄榄鲜果的PC1/PC2主成分散点图
Fig. 3 PCA scatter plot of PC1 vs. PC2 for fresh olive fruits from different cultivars at three harvest dates
油橄榄果作为一种综合利用价值较高的木本油料,有着巨大的开发利用空间。邓俊琳等 [11] 的研究发现,8 个油橄榄品种(皮瓜尔、佛奥、克罗莱卡、卡林、鄂植、云台、配多灵、科拉蒂)的总黄酮含量随成熟度增加呈现先下降后略有上升的变化趋势;随着成熟度的增加,皮瓜尔品种TP含量先降低后趋于平稳,这与本研究结果差异较大。究其原因在于,油橄榄果中黄酮类和多酚类化合物的积累、转化、降解是一个复杂的过程,其结果受品种、成熟度、产地、采样时间等诸多因素的影响,因此产地识别对橄榄果实具有重要研究价值。
朱庆平 [29] 、龙伟 [32] 、张东 [33] 等研究了我国8 个品种(鄂植8、城固32、皮削利、莱星、佛奥、阿贝奎纳、皮瓜尔和奇迹)油橄榄果及初榨橄榄油的品质,主要包括果实成熟度、大小、鲜果率、含水率、含油率以及橄榄油中脂肪酸组成、甘油三酯组成、生育酚、角鲨烯及甾醇等含量,结果发现,油橄榄果实中的金属元素及角鲨烯等成分含量在不同品种之间存在着遗传差异,这种差异也可作为油橄榄品种鉴定和分类的重要参考依据。功效成分的含量是评价油橄榄果品质及其特性的重要指标,笔者认为,皮瓜尔、克罗莱卡的OL含量总体较高,可作为特殊用途油橄榄品种。对于油橄榄果实的研究今后还需要建立品种及成熟度对油橄榄鲜果金属元素、全成分、功能、品质等指标影响的指纹图谱及谱库,从而为油橄榄副产物利用及品种培育提供参考。
参考文献:
[1] 刘娜, 白万明, 韩锐, 等. 橄榄油加工废弃物中的活性成分及其综合利用技术研究进展[J]. 中国油脂, 2016, 41(5): 84-88. DOI:10.13995/j.cnki.11-1802/ts.2014.04.011.
[2] SIFAOUI I, LOPEZ-ARENCIBIA A, MARTÍN-NAVARRO C M,et al. Activity assessment of Tunisian olive leaf extracts against the trophozoite stage of Acanthamoeba[J]. Parasitology Research, 2013,112(8): 2825-2829. DOI:10.1007/s00436-013-3453-9.
[3] 孔维宝, 李阳, 白万明, 等. 微波辅助提取油橄榄果渣多酚[J]. 食品与发酵工业, 2011, 37(4): 233-237. DOI:10.13995/j.cnki.11-1802/ts.2011.04.015.
[4] 郑洁, 魏鉴腾, 刘建飞, 等. 油橄榄叶提取物生物活性研究进展[J].中国中药杂志, 2016, 41(4): 613-618. DOI:10.4268/cjcmm20160411.
[5] 吴遵秋, 姜友军, 苏光灿, 等. 油橄榄叶中橄榄苦苷的体外抗氧化和抑菌活性[J]. 食品科学, 2014, 35(21): 94-99. DOI:10.7506/spkx1002-6630-201421019.
[6] 贺瑞坤, 罗海吉. 橄榄果提取物抗氧化活性及在皮肤健康中的作用[J]. 食品研究与开发, 2015, 36(6): 49-52. DOI:10.3969/j.issn.1005-6521.2015.06.013.
[7] 王强, 王锴, 黄梅桂, 等. LLE-UPLC-FLD法测定橄榄油中羟基酪醇和酪醇的含量[J]. 食品工业科技, 2018, 39(9): 233-238.DOI:10.13386/j.issn1002-0306.2018.09.041.
[8] GUINDA A, RADA M, DELGADO T, et al. Pentacyclic triterpenoids from olive fruit and leaf[J]. Journal of Agricultural and Food Chemistry, 2010, 58(17): 9685-9691. DOI:10.1021/jf102039t.
[9] 邓俊琳, 李旭, 王寒冬, 等. 油橄榄鲜果中多酚化合物含量测定的HPLC法研究[J]. 西北农林科技大学学报(自然科学版), 2017, 45(1):185-189. DOI:10.13207/j.cnki.jnwafu.2017.01.025.
[10] 邓俊琳, 刘露, 刘泉, 等. 油橄榄鲜果中主要化合物随成熟度的变化[J]. 中国粮油学报, 2016, 31(10): 73-77. DOI:10.13386/j.issn1002-0306.2014.22.047.
[11] 邓俊琳, 王寒冬, 刘露, 等. 油橄榄鲜果中总黄酮提取工艺优化及其含量随不同成熟度的变化[J]. 食品工业科技, 2014, 35(22): 254-258.DOI:10.13386/j.issn1002-0306.2014.22.047.
[12] SALVADOR M D, ARANDA F, FREGAPANE G. Influence of fruit ripening on ‘Cornicabra’ virgin olive oil quality: a study of four successive crop seasons[J]. Food Chemistry, 2001, 73(1): 45-53.DOI:10.1016/S0308-8146(00)00276-4.
[13] 刘露, 邓俊琳, 王寒冬, 等. 油橄榄鲜果中多酚提取工艺优化及不同成熟度含量变化分析[J]. 天然产物研究与开发, 2015, 27(8): 1453-1458. DOI:10.16333/j.1001-6880.2015.08.026.
[14] GEORGIADOU E C, GOULAS V, NTOUROU T, et al. Regulation of on-tree vitamin E biosynthesis in olive fruit during successive growing years: the impact of fruit development and environmental cues[J].Front Plant Science, 2016, 16(7): 1-12. DOI:10.3389/fpls.2016.01656.
[15] TALHAOUI N, GOMEZ-CARAVACA A M, LEON L, et al. Pattern of variation of fruit traits and phenol content in olive fruits from six different cultivars[J]. Journal of Agricultural and Food Chemistry,2015, 63(48): 10466-10476. DOI:10.1021/acs.jafc.5b04315.
[16] HBAIEB R H, KOTTI F, GARCÍA-RODRÍGUEZ R, et al. Monitoring endogenous enzymes during olive fruit ripening and storage:correlation with virgin olive oil phenolic profiles[J]. Food Chemistry,2015, 174(1): 240-247. DOI:10.1016/j.foodchem.2014.11.033.
[17] MORELLÓ J R, VUORELA S, ROMERO M P, et al. Antioxidant activity of olive pulp and olive oil phenolic compounds of the Arbequina cultivar[J]. Journal of Agricultural and Food Chemistry,2005, 53(6): 2002-2008. DOI:10.1021/jf048386a.
[18] HERNÁNDEZ M L, PADILLA M N, SICARDO M D, et al. Effect of different environmental stresses on the expression of oleate desaturase genes and fatty acid composition in olive fruit[J]. Phytochemistry,2011, 72(2/3): 178-187. DOI:10.1016/j.phytochem.2010.11.026.
[19] GUO X, YANG L, HU H, et al. Cloning and expression analysis of carotenogenic genes during ripening of autumn olive fruit (Elaeagnus umbellata)[J]. Journal of Agricultural and Food Chemistry, 2009,57(12): 5334-5339. DOI:10.1021/jf900547e.
[20] 国家质量监督检验检疫总局. 新鲜水果和蔬菜 取样方法: GB/T 8855—2008[S]. 北京: 中国标准出版社, 2008: 1-8.
[21] SINGLETON V L, ROSSI J A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal of Enology and Viticulture, 1965(16): 144-158. DOI:10.12691/ijebb-2-1-5.
[22] ZHISHEN J, MENGCHENG T, JIANMING W. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry, 1999, 64(4): 555-559.DOI:10.1016/S0308-8146(98)00102-2.
[23] LI H, WANG X Y, LI Y, et al. Polyphenolic compounds and antioxidant properties of selected China wines[J]. Food Chemistry,2009, 112(2): 454-460. DOI:10.1016/j.foodchem.2008.05.111.
[24] 闫树军, 王远, 苏艳红, 等. 响应面法优化油橄榄叶中橄榄苦苷超声辅助提取工艺[J]. 食品科学, 2012, 33(18): 73-76. DOI:10.16333/j.1001-6880.2012.07.026.
[25] 李春燕, 颜军, 陈封政, 等. 油橄榄叶中羟基酪醇的提取及分离纯化[J]. 食品与发酵工业, 2014, 40(4): 227-232. DOI:10.13995/j.cnki.11-1802/ts.2014.04.011.
[26] BENZIE F F I, STRAIN J J. The ferric reducing ability of plasmaasa measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/abio.1996.0292.
[27] LIU Lixiang, SUN Yi, LAURA T, et al. Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C.J. Tseng[J]. Food Chemistry, 2009, 112(1): 35-41.DOI:10.1016/j.foodchem.2008.05.038.
[28] 孙瑾, 王宗举, 陈岗, 等. 橄榄中多酚类物质体外抗氧化活性研究[J]. 中国食品添加剂, 2010(3): 69-73. DOI:10.3969/j.issn.1006-2513.2010.03.011.
[29] 朱庆平, 周力, 李开, 等. 西昌引种栽培油橄榄果中5 种金属元素主成分及聚类分析[J]. 基因组学与应用生物学, 2017, 36(1): 362-369.DOI:10.13417/j.gab.036.000362.
[30] 钟扬, 陈卓良. 湖北省油橄榄适生气候的主成分分析[J]. 湖北农业科学, 1986(7): 21-23. DOI:10.14088/j.cnki.issn0439-8114.1986.07.012.
[31] 陈海云, 陈少瑜, 宁德鲁, 等. 48 个油橄榄品种的遗传多样性及聚类分析[J]. 生物技术通报, 2013(3): 96-101. DOI:10.13560/j.cnki.biotech.bull.1985.2013.03.011.
[32] 龙伟, 王裕斌, 姚小华, 等. 油橄榄品种间叶片性状及总黄酮含量分析[J]. 热带亚热带植物学报, 2017, 25(4): 379-386. DOI:10.11926/jtsb.3708.
[33] 张东, 薛雅琳, 朱琳, 等. 我国油橄榄果及初榨橄榄油品质研究[J]. 中国粮油学报, 2017, 32(2): 88-93. DOI:10.3969/j.issn.1003-0174.2017.02.015.
Effects of Cultivar and Maturity on Bioactive Components and Antioxidant Activity of Fresh Olive Fruits
XIONG Zhengwei 1,2 , XIE Yuejie 1,2 , HUANG Meigui 2,3 , ZHAO Fuchang 4 , WANG Zhongming 1,2 , REN Guili 4 , WANG Qiang 1,2, *
(1. School of Biological and Chemical Engineering, Chongqing University of Education, Chongqing 400067, China;2. Cooperative Innovation Center of Lipid Resources and Children’s Daily Chemicals, Chongqing University of Education,Chongqing 400067, China; 3. College of Light Industry and Food Science, Nanjing Forestry University, Nanjing 210037, China;4. Chongqing Jiangyuan Olive Co. Ltd., Chongqing 404100, China)
Abstract: Olive fruits are widely used as medicinal herbs and vegetables. The varieties and maturity of olive fruits have significant impacts on its medicinal and edible value. The functional composition (total phenols, total flavonoids, total flavan-3-ol, oleuropein and hydroxytyrosol) and antioxidant capacity (Fe 3+ reducing power, 1,1-diphenyl-2-picrylquinone,hydroxyl and superoxide anion free radical scavenging capacity) of ten different cultivars (Baiganlan, Douguo, Europaea,Frantoio, Kalinjot, Coratina, Koroneiki, Picnal, Yuntai, and Pendollin) with different maturities (I, II and III) were determined in the present study. The correlations of the investigated parameters with cultivar and maturity were investigated by principal component analysis. Results indicated that cultivar and maturity level had different effects the bioactive components of olive fruits with the effect of the former being greater. The antioxidant capacity except for superoxide anion free radical scavenging capacity of olive fruit extracts increased with the increase of maturity. The analysis of bioactive components and antioxidant capacity of different varieties of olive fruits with different maturities can provide an important theoretical basis for the breeding, harvesting, processing and application of olive fruits.
Keywords: fresh olive fruits; cultivars; maturity; physicochemical properties; functional composition; antioxidant activity
XIONG Zhengwei, XIE Yuejie, HUANG Meigui, et al. Effects of cultivar and maturity on bioactive components and antioxidant activity of fresh olive fruits[J]. Food Science, 2018, 39(17): 61-66. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201817010. http://www.spkx.net.cn
文章编号: 1002-6630(2018)17-0061-06
引文格式: 熊政委, 谢跃杰, 黄梅桂, 等. 品种和成熟度对油橄榄鲜果功效成分及抗氧化能力的影响[J]. 食品科学, 2018, 39(17):61-66. DOI:10.7506/spkx1002-6630-201817010. http://www.spkx.net.cn
中图分类号: TS255.3
文献标志码: A
*通信作者简介: 王强(1982—),男,副教授,博士研究生,研究方向为抗氧化自然资源利用与生理生化。E-mail:gogo1443@sina.com
DOI: 10.7506/spkx1002-6630-201817010
基金项目: 重庆市社会事业与民生保障科技创新专项(cstc2017shms-xdny80081);北京食品营养与人类健康高精尖创新中心开放基金项目(20171044);重庆市创新创业示范团队支持计划项目(201618793);重庆第二师范学院科技协同创新平台建设项目(2017XJPT01);重庆市教委科学技术研究项目(KJ1601404)
第一作者简介: 熊政委(1989—),男,讲师,硕士,研究方向为功能性食品。E-mail:842406970@qq.com
收稿日期: 2017-10-11