马 晶,康美玲,田忠景,张营霞,丁诚实*,张立华*
关键词: 鞣花酸微球;制备;鉴定;前脂肪细胞生长;成脂分化
石榴为石榴科石榴属植物,含有多酚、黄酮、生物碱、甾体类以及三萜类化合物等次生代谢物,其中多酚类含量最高 [1-3] 。鞣花酸是石榴中的一种多酚类物质,是没食子酸的二聚衍生物,呈反式没食子酸单宁结构,具有抗氧化、抑菌、抗肿瘤等多种生物活性 [4-7] 。最新研究表明,鞣花酸还可以抑制3T3-L1脂肪细胞内脂肪酸合成酶活性,减少脂肪生成,预防和治疗肥胖 [8-9] 。鞣花酸作为多酚类物质,溶解性差、不稳定、受热易氧化、不易吸收,难以稳定、长期地发挥作用 [10] 。若能够制备成鞣花酸微球则可能解决以上问题。
海藻酸钠是从褐藻类的海带或马尾藻中提取的一种多糖类碳水化合物,是一种带负电荷的多糖类高分子材料;由β-D-甘露糖醛酸和α-L-古罗糖醛酸经糖苷键连接,从而形成的一类线性链状阴离子聚合物 [11-12] 。以海藻酸钠/壳聚糖作为药物载体是近年来在药物研究方面出现的一种应用于给药研究的新技术,海藻酸钠具有较低的细胞毒性、可被生物降解、良好的生物相容性和成膜性等特点,被广泛应用于药物载体的制备,特别是对控释和缓释制剂的研究 [13-15] 。海藻酸钠微球综合了生物可降解高分子材料海藻酸钠的多糖性、微尺度材料的抗菌和多微孔等特性,其在生物医药、工业及食品等方面的应用研究已经越来越多地受到人们的关注 [16-18] 。
本研究采用海藻酸钠和壳聚糖包裹石榴皮鞣花酸,制备鞣花酸微球,以扫描电子显微镜(scanning electron microscope,SEM)、傅里叶变换红外光谱仪和释放率检测仪鉴定制备的鞣花酸微球。用不同质量浓度的鞣花酸微球体外培养前脂肪细胞,噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法检测细胞在不同时间的生长情况,苏木精-伊红(hematoxylin-eosin,HE)染色观察细胞形态、数目的变化;对诱导成功出现脂滴的细胞进行油红O染色,观察细胞内脂滴的数量和大小,并采用异丙醇萃取法定量检测脂肪生成量。本研究为石榴皮鞣花酸在食品保健方面的应用提供了一定的理论依据。
石榴皮鞣花酸由实验室自制并纯化(纯度>98%) [2] ;鼠源性前脂肪细胞系3T3-F442A 美国模式培养物集存库;鞣花酸标准品(纯度>98%) 上海源叶生物科技有限公司;DMEM F12高糖培养基 美国Hyclone公司;胎牛血清、青霉素、链霉素、胰蛋白酶 美国Gibco公司;3-异丁基-1-甲基黄嘌呤、胰岛素、地塞米松、吲哚镁锌 美国Sigma公司;油红O(苏丹红) 上海生工公司;HE染色试剂盒 北京Solarbio公司;其他试剂均为国产分析纯。
TM-1000台式SEM 日本Hitachi公司;FTIR-7600傅里叶变换红外光谱仪 澳大利亚Lambda公司;DF-4压片机 天津港东科技发展股份有限公司;UV-2000紫外分光光度计 上海尤尼柯公司;Multiskan智能酶标仪、371型CO 2 培养箱 美国Thermo Fisher公司;倒置显微镜 日本Olympus公司;台式真空冷冻干燥机 上海京孚仪器有限公司。
1.3.1 鞣花酸微球的制备
移取20 mL 0.1 mol/L盐酸羟胺溶液注入一干燥洁净的250 mL烧杯中,加入80 mL 0.5 g/L海藻酸钠溶液后摇匀,加入0.2 g鞣花酸粉末,快速摇匀后置于50 ℃恒温水浴锅中加热1 h,经微孔滤膜过滤得到滤液。向滤液中加入5 g壳聚糖作为缓释剂,用磁力搅拌器搅拌1 h后形成均一稳定的悬浊液,再加入5 mL体积分数2%戊二醛溶液,-80 ℃下冷冻2 h后,-50 ℃下真空干燥12 h,获得海绵状复合物,经研磨粉碎得到最终产物 [19-20] 。
1.3.2 鞣花酸微球的鉴定
1.3.2.1 SEM观察
打开SEM,排气泵工作至Air灯为Ready状态。样品台上贴上导电双面胶,将少量鞣花酸、海藻酸钠、壳聚糖、鞣花酸微球依次平铺在双面胶上,然后放入SEM暗箱中,关闭舱门,排气至Air灯为Ready状态。加速电压15.0 kV,扫描范围6.5 mm,扫描速率为慢3。拍照并保存图片。
1.3.2.2 傅里叶变换红外光谱扫描
充分研磨一定量的溴化钾及鞣花酸、海藻酸钠、壳聚糖、鞣花酸微球。将研磨好的待测样品和溴化钾以1∶100的质量比混匀并进行压片,依次放入傅里叶变换红外光谱仪进行扫描,保存图谱并分析。波数范围4 000~400 cm -1 ,波数精度1 cm -1 。
1.3.2.3 鞣花酸微球中鞣花酸的包封率及释放率的测定
称取鞣花酸微球200 mg,研磨粉碎,用5 mL无水乙醇溶解,超声处理2 h,置于37 ℃恒温振荡仪中振荡,弃去沉淀后用体积分数50%乙醇溶液稀释,利用紫外分光光度法在254 nm波长处测定其吸光度A,以标准曲线法计算溶液中游离鞣花酸质量,包封率按式(1)计算 [21] 。
式中:200为鞣花酸微球质量(mg)。
称取20 mg的鞣花酸微球,置于500 mL锥形瓶中,加入磷酸盐缓冲液(0.2 mol/L、pH 7.4)200 mL,室温孵育,分别在3、6、12、24、36 h时吸取样品,于254 nm波长处测定吸光度A,以标准曲线法计算溶液中游离鞣花酸含量,按式(2)计算累计释放率。
式中:20为鞣花酸微球质量(mg)。
1.3.3 鞣花酸微球对前脂肪细胞生长影响的测定
当3T3-F442A前脂肪细胞生长到铺满培养瓶80%时,用胰蛋白酶消化细胞,调整细胞浓度为1×10 5 个/mL,接种100 μL于96 孔板各孔中,在二氧化碳培养箱中培养24 h后,分别加入0.1、0.3、0.5 g/L的鞣花酸微球悬液,每个质量浓度设置3 个重复,并设置对照组(未添加鞣花酸微球)。将药物处理后的前脂肪细胞分别培养6、12、24、36 h后,向各孔中加入0.5 mg/mL MTT溶液10 μL,继续培养4 h,吸去培养液,加入100 μL二甲基亚砜。选择570 nm波长使用酶标仪检测各孔的OD值,记录结果 [22-23] ,OD值与细胞存活率呈正相关。药物作用细胞6 h后进行HE染色,观察细胞形态。
1.3.4 鞣花酸微球对前脂肪细胞成脂分化影响的测定
待脂肪细胞在12 孔板内长满、接触抑制2 d后,加入成脂诱导培养基(含质量分数5%胎牛血清,17 nmol/L胰岛素、250 μmol/L 3-异丁基-1-甲基黄嘌呤、60 μmol/L吲哚美辛和100 nmol/L 地塞米松),诱导培养22 d [24-25] 。在成脂诱导的同时药物组分别加入0.1、0.3 g/L和0.5 g/L的鞣花酸微球,每个质量浓度设置3 个重复,并设置对照组(未添加鞣花酸微球)。
弃去细胞培养基,磷酸盐缓冲液冲洗细胞3 次。4%(体积分数,下同)甲醛溶液固定细胞30 min,超纯水冲洗细胞3 次。0.3%油红O染色液染色15 min,60%乙醇溶液分化数秒。超纯水清洗,倒置显微镜下观察细胞,拍照记录。用异丙醇对染色的细胞萃取油红O,测定590 nm波长处吸光度A [26-27] ,按式(3)计算脂肪形成的抑制率。
采用SPSS统计学软件进行成组数据T检验,以P<0.05为统计学有显著性差异。
2.1.1 SEM观察结果

图1 海藻酸钠-壳聚糖-鞣花酸复合物SEM图
Fig. 1 SEM images of sodium alginate-chitosan-ellagic acid complex
石榴皮鞣花酸呈针状晶体结构(图1A中箭头所示),形状规则,长度为(3.20±0.78)μm;海藻酸钠-壳聚糖-鞣花酸复合物(图1B)呈多面球形结构,直径为(13.82±3.29)μm,且看不到鞣花酸的针状结构,推测鞣花酸已经与海藻酸钠/壳聚糖形成复合物。
2.1.2 傅里叶变换红外光谱分析结果
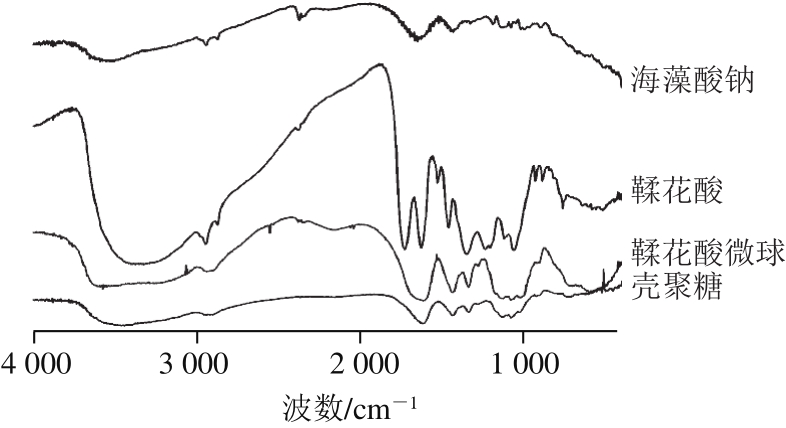
图2 海藻酸钠-壳聚糖-鞣花酸复合物傅里叶变换红外光谱图
Fig. 2 Fourier transform infrared spectra of sodium alginate-chitosanellagic acid complex
如图2所示,海藻酸钠傅里叶变换红外光谱曲线中:3 496~3 548 cm -1 处的宽峰是O—H键的伸缩振动峰;2 946 cm -1 处是C—H键的伸缩振动峰;1 646 cm -1 处是吡喃环化合物C—O—C的伸缩振动峰;1 076 cm -1 处是环醇结构上的—OH的振动峰;1 427 cm -1 附近的吸收峰是羧酸根离子的对称伸缩振动峰。壳聚糖红外曲线中:2 940 cm -1 处是C—H的伸缩振动吸收峰;1 687 cm -1 处是酰胺I键(C=O)的特征吸收峰;1 614 cm -1 处是酰胺II键(N—H面内弯曲)的特征吸收峰;—CH 2 弯曲和—CH 3 变形振动吸收峰在1 430 cm -1 处显示;—CH 3 对称变形振动和—CH弯曲振动吸收峰在1 336 cm -1 处显示;酰胺III键谱带和—CH 2 摇摆吸收峰在1 278 cm -1 处显示;C—O伸缩振动吸收峰则在1 076、1 029 cm -1 处显示。鞣花酸红外曲线中:1 525、1 458 cm -1 处是苯环骨架的伸缩振动吸收峰;3 374 cm -1 处是O—H伸缩振动吸收峰;1 726、1 625 cm -1 处是羧基的吸收峰。海藻酸钠-壳聚糖-鞣花酸复合物在3 444 cm -1 处有和海藻酸钠相同的O—H吸收峰,在1 434 cm -1 处有和海藻酸钠相同的羧基吸收峰,在1 334 cm -1 处有和壳聚糖相同的—CH弯曲和—CH 3 变形振动吸收峰,在1 620 cm -1 处有和鞣花酸相同的羧基伸缩振动峰,在1 518 cm -1 处有和鞣花酸相同的苯环结构特征伸缩振动吸收峰。多种相同之处说明海藻酸钠、壳聚糖、鞣花酸形成了复合物。
2.1.3 鞣花酸微球中鞣花酸释放率的分析
鞣花酸微球中的鞣花酸的包封率为28.9%。鞣花酸在不同时间从微球中释放出来,0~6 h为缓慢释放阶段,仅释放9%的鞣花酸;6~24 h为快速释放阶段,释放率达到63%;24~36 h再次进入缓慢释放阶段,释放21%的鞣花酸(图3)。鞣花酸微球中鞣花酸能够缓慢释放,也说明海藻酸钠-壳聚糖-鞣花酸微球制备成功。
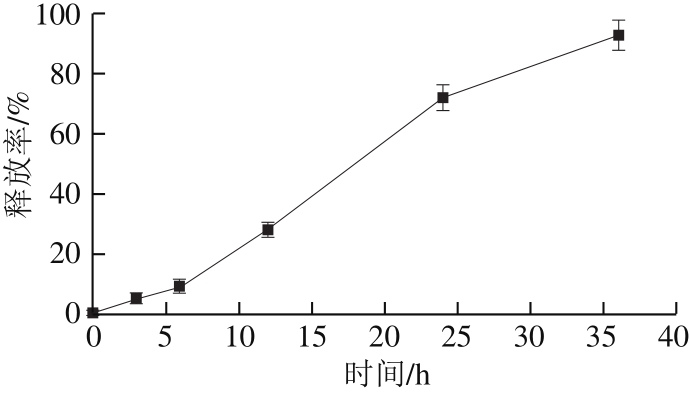
图3 海藻酸钠-壳聚糖-鞣花酸微球中鞣花酸的释放率
Fig. 3 Release rates of ellagic acid from sodium alginate-chitosanellagic acid microspheres
2.2.1 MTT法检测鞣花酸微球对前脂肪细胞生长的影响
表1 鞣花酸微球对前脂肪细胞存活率的影响
Table 1 Effect of ellagic acid microspheres on preadipocyte survival rate

注:与对照组相比,*.差异显著(P<0.05),**.差异极显著(P<0.01)。
如表1所示,与对照组相比,0.1 g/L鞣花酸微球处理前脂肪细胞12 h后,细胞存活率显著降低,24 h后细胞存活率极显著降低;0.3 g/L和0.5 g/L鞣花酸微球处理细胞6 h后,细胞存活率显著降低,12 h后细胞存活率极显著降低。推测鞣花酸微球质量浓度越大、处理细胞时间越长,对前脂肪细胞存活率的抑制就越大。
2.2.2 HE染色观察鞣花酸微球对前脂肪细胞生长的影响
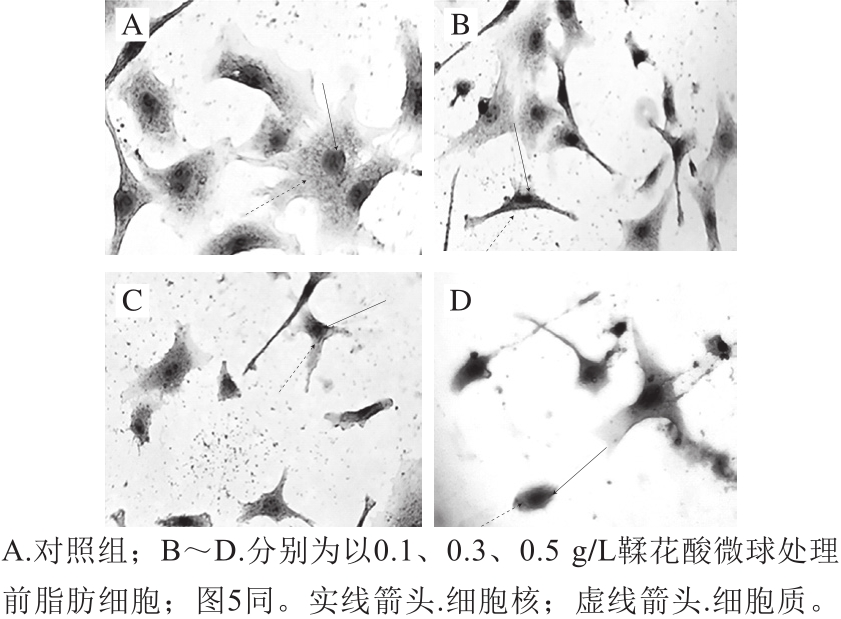
图4 HE染色观察不同质量浓度鞣花酸微球对前脂肪细胞存活的影响(400×)
Fig. 4 HE staining for evaluating the effect of different concentrations of ellagic acid microspheres on the survival of preadipocytes (400 ×)
由图4A可知,正常前脂肪细胞形态较好、较大,数目较多;细胞核染色紫色明显;细胞质充盈,颜色为红色(图中未显示)。加入鞣花酸微球后细胞质出现明显的固缩,细胞数量减少;随着加入鞣花酸微球质量浓度的增大,细胞固缩的程度增加,细胞数量明显减少,说明鞣花酸微球对前脂肪细胞的生长有一定的抑制作用(图4B~D)。
2.3.1 油红O染色成脂分化的3T3-F442A细胞观察
前脂肪细胞在成脂诱导22 d后进行油红O染色,几乎所有细胞内都有较大脂滴,脂滴指环结构明显。加入鞣花酸微球后细胞脂滴变小,脂滴数量减少;随着加入鞣花酸微球质量浓度的增大,细胞脂滴减小的程度增大,脂滴数量显著减少,说明鞣花酸微球对前脂肪细胞的成脂有较强的抑制作用,且具有量效关系(图5)。
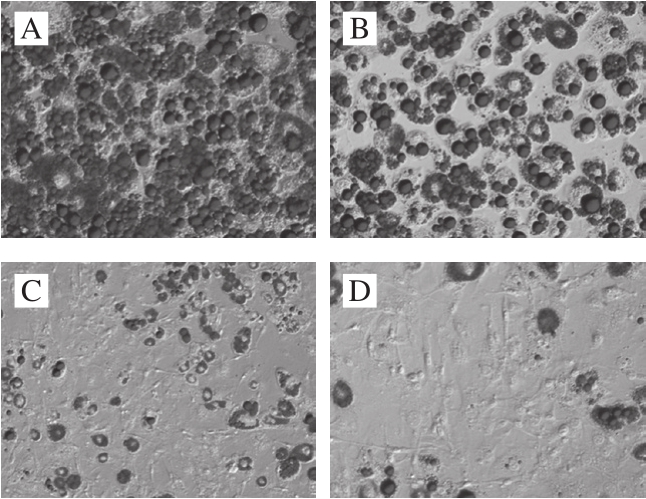
图5 不同质量浓度鞣花酸微球对前脂肪细胞成脂分化的影响(400×)
Fig. 5 Effects of different concentrations of ellagic acid microspheres on adipogenic differentiation of preadipocytes (400 ×)
2.3.2 鞣花酸微球对前脂肪细胞成脂分化的抑制
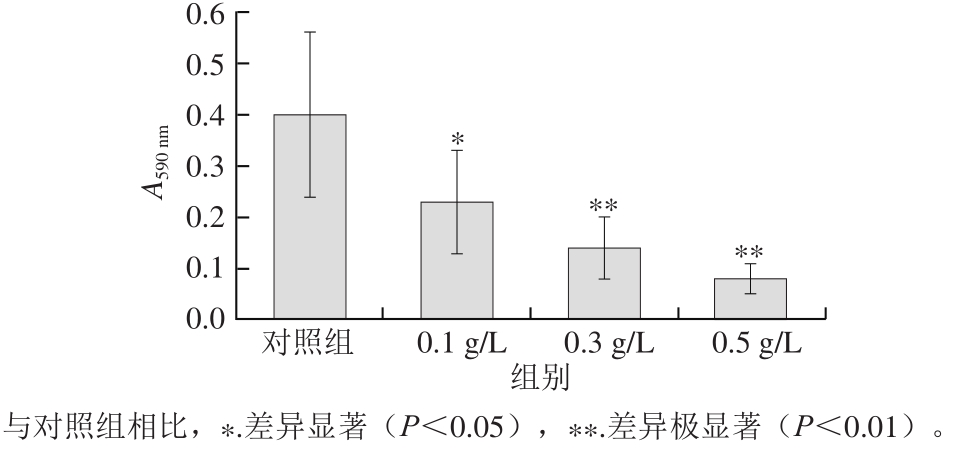
图6 不同质量浓度鞣花酸微球对异丙醇萃取细胞内油红O的影响
Fig. 6 Effect of ellagic acid microspheres on adipogenic differentiation of preadipocytes as evaluated by isopropyl alcohol extraction of intracellular oil red O
如图6所示,0.1 g/L鞣花酸微球能够显著降低前脂肪细胞内的脂滴形成,抑制率为42.5%;0.3 g/L和0.5 g/L鞣花酸微球能够极显著降低前脂肪细胞的成脂分化,抑制率分别为65.0%和80.0%。
石榴皮鞣花酸、海藻酸钠和壳聚糖都是功能性食品的天然活性成分,本研究以海藻酸钠和壳聚糖作为包裹材料,有效地包裹石榴皮鞣花酸,制备成鞣花酸复合微球。通过SEM和傅里叶变换红外光谱鉴定,显示鞣花酸微球制备成功,且微球中的鞣花酸能够缓慢释放。鞣花酸微球增强了鞣花酸的稳定性,还使被包裹的鞣花酸具有抗热、耐光、容易贮存和运输等更多重功能和良好的特性 [17-18] 。SEM观察结果显示制备出的海藻酸钠-壳聚糖-鞣花酸复合物颗粒偏大,平均直径为13.82 μm,没有达到更微观的尺寸。可能的原因是石榴皮鞣花酸晶体结构尺寸已达到微米级,制备的包合物只能更大。但与张华等 [28] 的结果相比,微球尺寸已经缩小近100 倍。
细胞实验中,鞣花酸微球能抑制前脂肪细胞的生长以及成脂分化。鞣花酸质量浓度越大、处理时间越长,细胞的存活率越低,呈现出剂量-效应关系。在低质量浓度条件下,在鞣花酸缓慢释放阶段,鞣花酸微球对细胞存活率的影响较小;而在的鞣花酸快速释放阶段,鞣花酸微球对细胞存活率的影响较大,故鞣花酸微球的活性是与鞣花酸释放情况相关的。在中、高质量浓度条件下,即使处于缓慢释放阶段,但由于微球质量浓度较高,释放的鞣花酸总量较大,也能够显著抑制前脂肪细胞的成活率及成脂分化。
鞣花酸作为石榴皮中的有效成分,提取得率可达15.56% [29] 。把石榴皮鞣花酸做成海藻酸钠/壳聚糖微球,可以控制鞣花酸缓慢释放,保证微球具有更好的生物相容性,进入细胞的可能性更大,而且渗入的速度缓慢,使加入的鞣花酸更长久、有效地作用于细胞。把鞣花酸做成微球后还具有靶向作用,使鞣花酸作用目标更加准确 [30] 。随着石榴皮鞣花酸微球的研制及其在食品保健方面应用的深入研究,石榴的综合利用将得到进一步的发展。
参考文献:
[1] LANSKY E P, NEWMAN R A. Punica granatum (pomegranate)and its potential for prevention and treatment of inflammation and cancer[J]. Journal of Ethnopharmacology, 2007, 109(2): 177-206.DOI:10.1016/j.jep.2006.09.006.
[2] OSWA T, IDE A, SU J D, et al. Inhibition of in vitro lipid peroxidation by ellagic acid[J]. Journal of Agricultural and Food Chemistry, 1987,35(5): 808-812. DOI:10.1021/jf00077a042.
[3] 李云峰, 郭长江, 杨继军, 等. 石榴皮抗氧化物质提取及其体外抗氧化作用研究[J]. 营养学报, 2004, 26(2): 144-147. DOI:10.3321/j.issn:0512-7955.2004.02.016.
[4] 冯立娟, 陶吉寒, 尹燕雷, 等. 石榴功能物质鞣花酸研究进展[J].食品科学, 2014, 35(23): 325-330. DOI:10.7506/spkx1002-6630-201423063.
[5] 张立华, 张元湖, 孙蕾, 等. 鞣花酸和三萜类物质在石榴不同器官中的分布[J]. 食品科学, 2015, 36(6): 136-139. DOI:10.7506/spkx1002-6630-201506025.
[6] SHARMA M, LI L, CELVER J, et al. Effects of fruit ellagitannin extracts, ellagic acid, and their colonic metabolite, urolithin A, on Wnt signaling[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7):3965-3969. DOI:10.1021/jf902857v.
[7] GONZÁLEZ-SARRÍAS A, AZORÍN-ORTUÑO M, YÁÑEZGASCÓN M J, et al. Dissimilar in vitro and in vivo effects of ellagic acid and its microbiota-derived metabolites, urolithins, on the cytochrome P450 1A1[J]. Journal of Agricultural and Food Chemistry,2009, 57(12): 5623-5632. DOI:10.1021/jf900725e.
[8] WU D, MA X F, TIAN W X, et al. Pomegranate husk extract,punicalagin and ellagic acid inhibit fatty acid synthase and adipogenesis of 3T3-L1 adipocyte[J]. Journal of Functional Foods,2013, 5(2): 633-641. DOI:10.1016/j.jff.2013.01.005.
[9] 王丽凤, 蒙克嘎勒, 李琳琳, 等. 鞣花酸对3T3-L1前体脂肪细胞增殖与分化的影响[J]. 中华高血压杂志, 2014, 22(9): 852-854.DOI:10.16439/j.cnki.1673-7245.2014.09.003.
[10] 陈亮, 李医明, 陈凯先, 等. 植物多酚类成分提取分离研究进展[J]. 中草药, 2013, 44(11): 1501-1507. DOI:10.7501/j.issn.0253-2670.2013.11.027.
[11] MOTWANI S K, CHOPRA S, TALEGAONKAR S, et al. Chitosansodium alginate nanoparticles as submicroscopic reservoirs for ocular delivery: formulation, optimisation and in vitro characterisation[J].European Journal of Pharmaceutics and Biopharmaceutics, 2008,68(3): 513-525. DOI:10.1016/j.ejpb.2007.09.009.
[12] 吴秋惠, 吴皓, 王令充, 等. 海藻酸钠微球的制备及其在药物载体中的应用进展[J]. 中华中医药杂志, 2011, 26(8): 1791-1794.
[13] KAFSHGARI M H, KHORRAM M, MANSOURI M. Preparation of alginate and chitosan nanoparticles using a new reverse micellar system[J]. Iranian Polymer Journal, 2012, 21(2): 99-107. DOI:10.1007/s13726-011-0010-1.
[14] MUKHOPADHYAYA P, CHAKRABORTYA S, BHATTACHARYAB S,et al. pH sensitive chitosan/alginate core shell nanoparticles for efficient and safe oral insulin delivery[J]. International Journal of Biological Macromolecules, 2015, 72(1): 640-648. DOI:10.1016/j.ijbiomac.2014.08.040.
[15] 汪程, 汪令伟, 史晓宇, 等. 海藻酸钠壳聚糖微球作为药物载体的研究进展[J]. 现代生物医学进展, 2014, 14(16): 3174-3176.DOI:10.13241/j.cnki.pmb.2014.16.046.
[16] BEHERA T, SWAIN P. Antigen encapsulated alginate-coated chitosan microspheres stimulate both innate and adaptive immune responses in fish through oral immunization[J]. Aquaculture International, 2014,22(2): 673-688. DOI:10.1007/s10499-013-9696-8.
[17] 张琳琳, 涂姜磊, 徐静, 等. 壳聚糖-海藻酸钠载药微球的缓释性能研究[J]. 材料导报, 2010, 24(24): 48-52.
[18] ZHANG X Z, TIAN F J, HOU Y M, et al. Preparation and in vitro in vivo characterization of polyelectrolyte alginate-chitosan complex based microspheres loaded with verapamil hydrochloride for improved oral drug delivery[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2015, 81(3): 429-440. DOI:10.1007/s10847-014-0471-x.
[19] 董学猛, 刘晨光. 疏水修饰海藻酸钠纳米粒的制备及鉴定[J]. 海洋科学集刊, 2009, 3(1): 125-132.
[20] 徐晖, 胡富强, 应晓英, 等. 胰岛素海藻酸钠纳米粒的制备及体内外评价[J]. 中国药学杂志, 2006, 41(6): 434-437. DOI:10.3321/j.issn:1001-2494.2006.06.011.
[21] 李梦颖, 李建科, 于振, 等. 石榴多酚的提取、检测和成分分析研究进展[J]. 食品工业科技, 2013, 34(17): 384-388. DOI:10.13386/j.issn1002-0306.2013.17.054.
[22] 杜宏, 张娜, 高霞, 等. 莲房原花青素对人肝癌细胞HepG2生长及凋亡的作用[J]. 实用医学杂志, 2008, 24(6): 891-893. DOI:10.3969/j.issn.1006-5725.2008.06.003.
[23] 吴窈画, 谈书华, 范超超, 等. MTT法检测细菌细胞数的主要影响因素分析[J]. 微生物学杂志, 2011, 31(3): 67-72. DOI:10.3969/j.issn.1005-7021.2011.03.014.
[24] 李亚红, 潘杰. 肥胖与非肥胖小鼠间充质干细胞成脂分化[J]. 济南大学学报(自然科学版), 2013, 27(3): 264-269. DOI:10.7632/j.issn:1671-3559.2013.03.011.
[25] 杨蕾, 李晓帆, 张雅鸥, 等. 番石榴叶天然成分抑制3T3-L1细胞成脂分化的研究[J]. 中国药理学通报, 2011, 27(5): 705-708. DOI:10.3969/j.issn.1001-1978.2011.05.025.
[26] 范正伟. 探讨TNF-α与Wnt/β-catenin信号通路在小鼠原代前脂肪分化过程中相互作用机制[D]. 济南: 山东师范大学, 2013: 32-39.
[27] 乔海琦, 巫冠中. 新型格列酮类化合物ANY-2对原代大鼠前体脂肪细胞糖脂代谢的影响[J]. 宁夏医科大学学报, 2010, 32(2): 179-182.DOI:10.16050/j.cnki.issn1674-6309.2010.02.066.
[28] 张华, 杨丹, 靳诗英, 等. 鞣花酸壳聚糖-海藻酸钠微球的制备工艺[J].中国医院药学杂志, 2015, 35(17): 1605-1609. DOI:10.13286/j.cnki.chinhosppharmacyj.2015.17.20.
[29] 李海霞, 王彩芳, 张红岭, 等. 石榴皮中鞣花酸的提取工艺研究[J]. 中国医药导报, 2008(24): 50; 52. DOI:10.3969/j.issn.1673-7210.2008.24.030.
[30] 李凤红, 张欣蕊, 相丽英, 等. 海藻酸钠/壳聚糖载药纳米微球的研究进展[J]. 化工新型材料, 2016, 44(1): 31-33.
MA Jing, KANG Meiling, TIAN Zhongjing, ZHANG Yingxia, DING Chengshi*, ZHANG Lihua*
(College of Life Sciences, Zaozhuang University, Zaozhuang 277160, China)
Abstract: Objective: In this study, sodium alginate and chitosan as a coating were chosen for the preparation of ellagic acid microspheres, and the effect of the microspheres on the growth and adipogenic differentiation of preadipocytes was evaluated. Methods: Scanning electron microscopy, Fourier transform infrared spectra and release rate analysis were used to identify the formation of ellagic acid microspheres. Methylthiazolyldiphenyl-tetrazolium bromide method was used to detect the effect of different concentrations of ellagic acid microspheres on preadipocyte growth at 6, 12, 24 and 36 h, and the cell morphology and quantity were observed by hematoxylin-eosin staining. Oil red O staining was used to observe the effect of ellagic acid microspheres on adipogenic differentiation of preadipocyte cells, and lipogenesis was detected by isopropanol extraction. Results: Ellagic acid microspheres were successfully prepared. Ellagic acid microspheres at 0.1, 0.3 and 0.5 g/L could inhibit the growth and adipogenic differentiation of preadipocytes in a dose-dependent manner, and showed 80%inhibition on lipid droplet formation. Conclusion: It is feasible to prepare ellagic acid microspheres with sodium alginate and chitosan, and ellagic acid microspheres have potential therapeutic value for obesity.
Keywords: ellagic acid microspheres; preparation; identification; preadipocyte growth; adipogenic differentiation
Preparation of Ellagic Acid Microspheres and Their Effects on Preadipocyte Growth and Adipogenic Differentiation
MA Jing, KANG Meiling, TIAN Zhongjing, et al. Preparation of ellagic acid microspheres and their effects on preadipocyte growth and adipogenic differentiation[J]. Food Science, 2018, 39(17): 104-108. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201817017. http://www.spkx.net.cn
文章编号: 1002-6630(2018)17-0104-05
引文格式: 马晶, 康美玲, 田忠景, 等. 鞣花酸微球的制备及其对前脂肪细胞生长和成脂分化的影响[J]. 食品科学, 2018, 39(17):104-108. DOI:10.7506/spkx1002-6630-201817017. http://www.spkx.net.cn
中图分类号: TS202.3
文献标志码: A
张立华(1969—),男,教授,博士,研究方向为植物资源开发利用。E-mail:chinazhanglh@163.com
DOI: 10.7506/spkx1002-6630-201817017
*通信作者简介: 丁诚实(1982—),男,副教授,博士,研究方向为纳米材料医药学应用。E-mail:dingchengshi123@126.com
基金项目: 国家自然科学基金青年科学基金项目(81703190);山东省重点研发项目(GG201703210015);山东省自然科学基金项目(ZR2017LH058);枣庄学院博士基金项目(2016BS01)
第一作者简介: 马晶(1982—),女,讲师,硕士,研究方向为纳米材料医药学应用。E-mail:ma_haiming@163.com
(枣庄学院生命科学学院,山东 枣庄 277160)
收稿日期: 2017-06-19
摘 要: 目的:采用海藻酸钠/壳聚糖对石榴皮鞣花酸进行包裹,制备成鞣花酸微球,并观察其对前脂肪细胞的生长及成脂分化的影响。方法:利用扫描电子显微镜、傅里叶变换红外光谱仪和释放率分析仪鉴定制备的鞣花酸微球;噻唑蓝法检测不同质量浓度的鞣花酸微球在6、12、24 h和36 h时对前脂肪细胞生长的影响,苏木精-伊红染色观察细胞形态及数量的变化;油红O染色观察鞣花酸微球对前脂肪细胞成脂分化的影响,异丙醇萃取测定脂肪生成量。结果:成功制备了海藻酸钠/壳聚糖包裹的鞣花酸微球,0.1、0.3 g/L和0.5 g/L的鞣花酸微球能够抑制前脂肪细胞的生长及成脂分化,且具有剂量-效应关系,对脂滴生成的抑制率可达80%。结论:以海藻酸钠/壳聚糖作为石榴皮鞣花酸的包裹材料制备鞣花酸微球是可行的,鞣花酸微球具备潜在的保健价值。