田 笑,金梅花,刘莉园,何 鑫,全吉淑*
关键词: 大豆异黄酮;H22肝癌移植瘤细胞;凋亡;p53;信号传导子及转录激活子
大豆异黄酮是大豆中分离的重要活性成分,具有典型异黄酮结构。自从Walz [1] 首次从大豆分离出染料木苷以来,目前已经发现12 种不同结构的大豆异黄酮,分别为游离型大豆异黄酮3 种(7,4’-二羟异黄酮——大豆苷元、7,4’-二羟-6-甲氧异黄酮——大豆黄素、5,7,4’-三羟异黄酮——染料木素)和对应的葡萄糖苷及其衍生物9 种 [2] 。研究表明,大豆异黄酮具有抗氧化、抗肿瘤、保护心血管等多种药理活性 [2-6] 。流行病学调查显示,大豆异黄酮的摄取与乳腺癌、结肠癌、直肠癌及前列腺癌等多种癌症的发病率呈负相关性 [7-10] 。动物及细胞实验也显示,大豆异黄酮具有明显的抗肿瘤作用,特别是对激素相关性肿瘤,如乳腺癌、结肠癌和前列腺癌 [11-13] 。其抗癌机制可能包括类雌激素作用及抗激素作用、抑制肿瘤血管生成的作用、阻滞细胞周期等多个方面 [14-16] 。尽管流行病学和动物、细胞模型的研究结果明确了其抗肿瘤作用,但其对肿瘤细胞凋亡的作用机理和靶点尚不清楚。本课题组近年来的研究表明,大豆异黄酮对家兔鳞癌移植瘤和小鼠肝癌移植瘤均具有促细胞凋亡作用 [5-6] 。众所周知,细胞凋亡存在复杂的调节网络,有许多蛋白参与其调控过程,如死亡受体、胞浆信号转导蛋白、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)家族和含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)家族等 [7] 。本实验拟通过小鼠H22肝癌皮下移植瘤模型,探讨大豆异黄酮对H22移植瘤细胞的促凋亡作用机制,旨在为大豆异黄酮抑制肿瘤研究提供科学依据。
昆明小鼠,体质量(20±2)g,由延边大学实验动物中心提供。
小鼠H22肝癌细胞株由延边大学医学院韩春姬教授惠赠。
大豆异黄酮(纯度≥80%)购自华北制药集团有限责任公司,含大豆苷45.9%(质量分数,下同)、黄豆苷21.0%、染料木苷13.4%、大豆苷元0.96%、黄豆苷元0.05%和染料木素0.02%。
5-氟尿嘧啶(5-fuorouracil,5-Fu) 上海旭东海普药业有限公司;细胞凋亡-DNA ladder抽提试剂盒 碧云天生物技术公司;小鼠Caspase-3(Casp-3)单克隆抗体、兔Caspase-8(Casp-8)单克隆抗体、小鼠Caspase-9(Casp-9)单克隆抗体、兔Bcl-2多克隆抗体、兔细胞色素c(cytochrome c,Cyt c)单克隆抗体、兔细胞凋亡诱导因子(apoptosis inducing factor,AIF)单克隆抗体、小鼠p53单克隆抗体、兔Survivin单克隆抗体、兔信号传导子及转录激活子(signal transducer and activator of transcription,STAT)3单克隆抗体、兔p-STAT3单克隆抗体 美国赛信通公司;小鼠Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)多克隆抗体 美国艾博抗公司;小鼠β-肌动蛋白单克隆抗体、辣根过氧化物酶标记的兔抗小鼠免疫球蛋白G、羊抗兔免疫球蛋白G美国西格玛奥德里奇公司。
台式高速冷冻离心机 德国艾本德公司;平板电泳槽北京六一生物科技有限公司;小型垂直电泳槽、小型转印槽 美国伯乐公司;化学发光成像仪 上海培清科技有限公司。
1.3.1 建立H22小鼠肝癌移植瘤模型及分组处理
常规进行细胞复苏、培养和腹腔传代。取第2代腹水,将细胞密度调至1×10 7 个/mL,接种到小鼠腋下 [5] 。第2天,将30 只小鼠分为模型组(阴性对照组)、大豆异黄酮组和5-Fu组(阳性对照组)。大豆异黄酮组小鼠每日灌胃100 mg/kg大豆异黄酮(含质量分数0.5%羧甲基纤维素钠的生理盐水溶解),共10 次;5-Fu组小鼠隔日腹腔注射25 mg/kg 5-Fu,共5 次;模型组小鼠灌胃等体积含0.5%羧甲基纤维素钠的生理盐水。16 h后处死动物,迅速取出肿瘤组织,称瘤质量,并根据下式计算抑瘤率。
1.3.2 DNA ladder法检测肿瘤细胞凋亡
提取移植瘤细胞DNA,进行琼脂糖凝胶电泳,检测肿瘤细胞凋亡特征性DNA ladder [6] 。
1.3.3 蛋白印迹法检测移植瘤组织蛋白的表达
裂解细胞并提取蛋白,加热变性。进行电泳、转膜,封闭,用相应一抗孵育,洗膜,二抗孵育。化学发光显色法显色,并进行灰度分析。
数据以 ±s表示,应用SPSS 19.0统计软件进行单因素方差分析和t检验,P<0.05为差异有统计学意义。
模型组、大豆异黄酮组和5-Fu组小鼠瘤质量分别为2.00、1.30、0.83 g;抑瘤率计算结果显示,大豆异黄酮和5-Fu对荷瘤小鼠的抑瘤率分别为36%和59%。与模型组比较,大豆异黄酮组和5-Fu组小鼠瘤质量减轻(P<0.05);与5-Fu组比较,大豆异黄酮组瘤质量增加(P<0.05)。提示大豆异黄酮和5-Fu明显抑制荷瘤小鼠肝癌移植瘤的生长,但大豆异黄酮的抑瘤作用低于5-Fu。
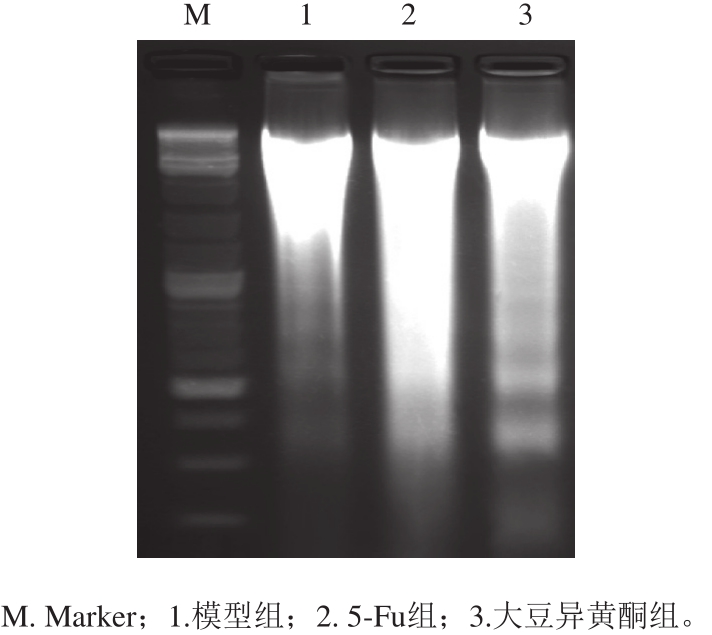
图1 移植瘤组织DNA ladder检测结果
Fig. 1 DNA ladder observation of transplanted tumor tissue
细胞凋亡时DNA在核小体间断裂形成一些DNA ladder,其形成是判断细胞凋亡的重要标准 [6] 。如图1所示,模型组小鼠移植瘤细胞有少量凋亡特征性DNA ladder存在。与模型组比较,大豆异黄酮组小鼠移植瘤细胞凋亡特征性DNA ladder增多(P<0.05)。5-Fu组小鼠移植瘤细胞DNA损伤较为严重,DNA ladder少量存在,更多的是细胞坏死引起的DNA无规则断裂。
Caspase是一组胞浆蛋白水解酶,与真核细胞凋亡密切相关,在正常细胞内以无活性的酶原状态存在,可将部分肽段切除后激活成有活性的片段,其中Casp-3为凋亡执行者,可直接水解靶蛋白从而导致细胞凋亡 [17-18] 。
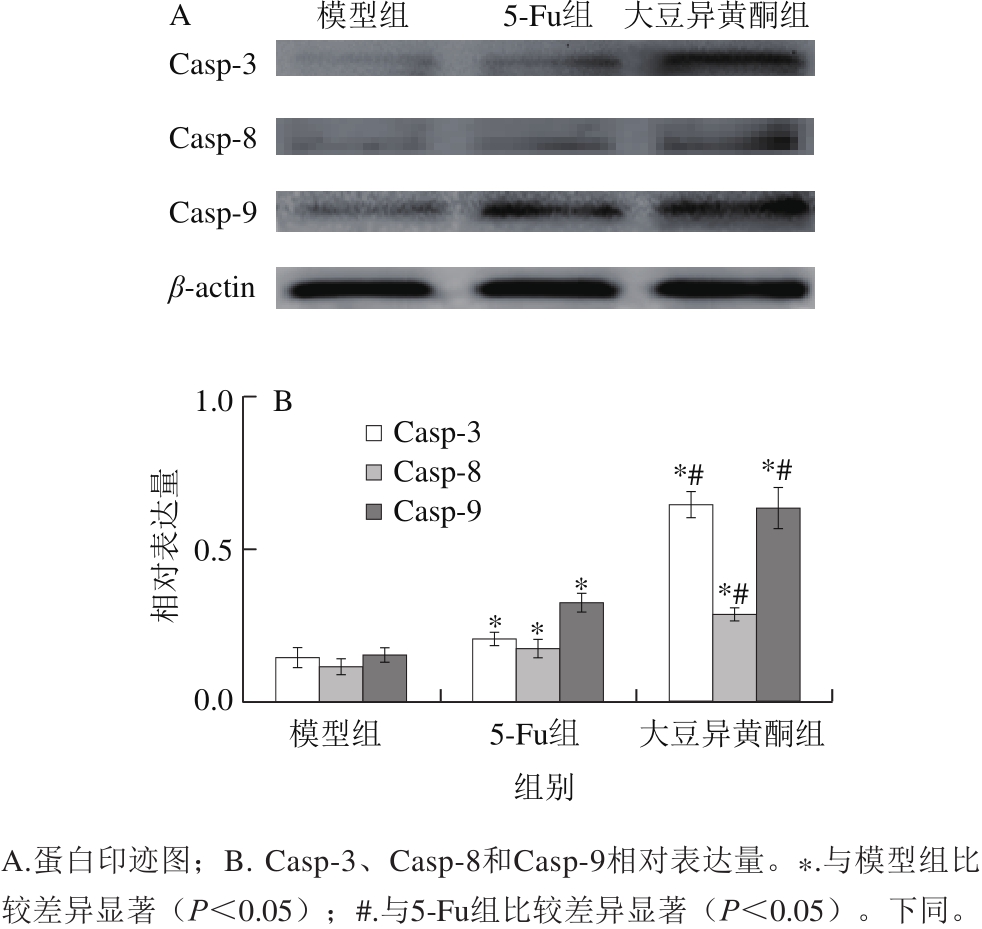
图2 移植瘤组织Casp-3、Casp-8和Casp-9活性片段表达
Fig. 2 Expression of active caspase-3, caspase-8 and caspase-9 fragments in transplanted tumor tissue
由图2可知,与模型组比较,大豆异黄酮组和5-Fu组小鼠移植瘤组织Casp-3、Casp-8和Casp-9活性片段增多(P<0.05);与5-Fu组比较,大豆异黄酮组小鼠移植瘤组织Casp-3、Casp-8和Casp-9活性片段增多(P<0.05)。
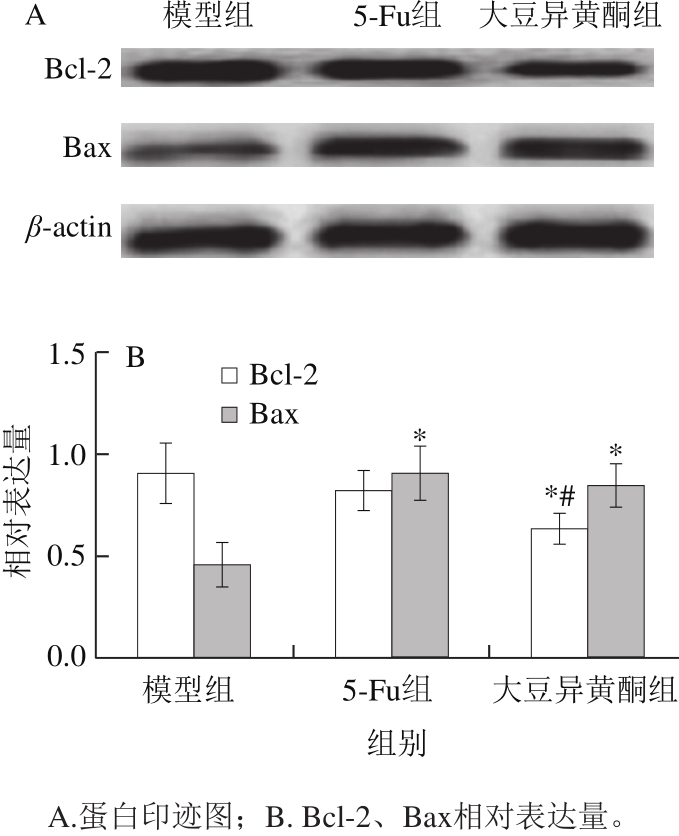
图3 移植瘤组织Bcl-2、Bax蛋白表达
Fig. 3 Expression of Bcl-2 and Bax proteins in transplanted tumor tissue
许多蛋白参与细胞凋亡的调控过程,其中Bcl-2蛋白家族是细胞凋亡研究中最受重视的癌蛋白之一,其中,Bax促进细胞凋亡,而Bcl-2抑制细胞凋亡 [19-21] 。由图3可知,与模型组比较,大豆异黄酮组小鼠移植瘤细胞Bcl-2蛋白表达显著降低(P<0.05),5-Fu组小鼠移植瘤细胞Bcl-2蛋白表达有降低趋势,但差异无显著性(P>0.05);与5-Fu组比较,大豆异黄酮组小鼠移植瘤组织Bcl-2蛋白表达显著降低(P<0.05)。与模型组比较,大豆异黄酮组和5-Fu组小鼠移植瘤细胞Bax蛋白表达均升高(P<0.05),且两组小鼠移植瘤组织Bax/Bcl-2比值均显著升高(P<0.05)。
细胞凋亡时,线粒体内Cyt c可释放到胞浆后导致依赖Caspase的凋亡途径,AIF则为不依赖Caspase的凋亡效应分子;而Bcl-2能够阻止Cyt c和AIF从线粒体释放到细胞质,从而抑制细胞凋亡的发生 [19-21] 。
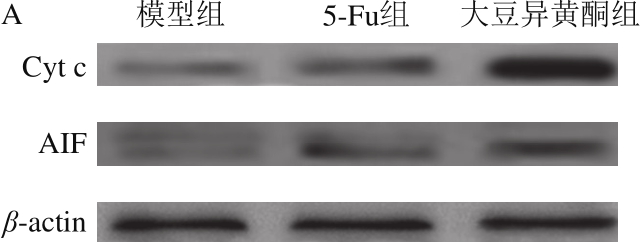
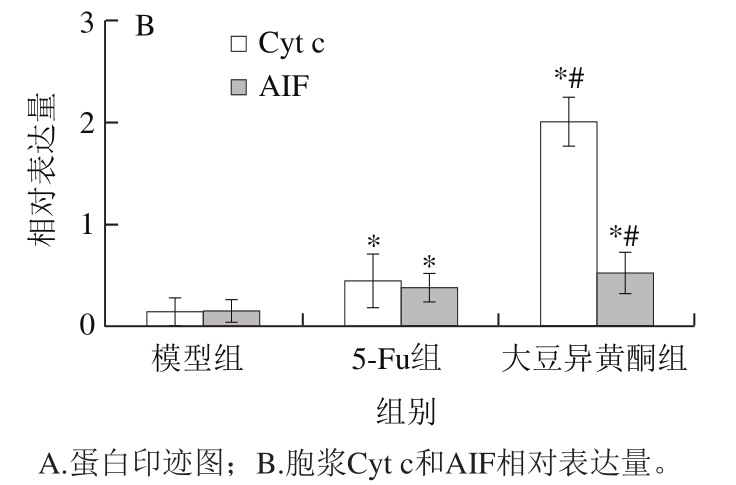
图4 移植瘤组织胞浆Cyt c和AIF蛋白表达
Fig. 4 Expression of cytoplasmic Cyt c and AIF proteins in transplanted tumor tissue
由图4可知,与模型组比较,大豆异黄酮组和5-Fu组小鼠移植瘤组织胞浆Cyt c和AIF蛋白表达均升高(P<0.05);与5-Fu组比较,大豆异黄酮组小鼠移植瘤组织胞浆Cyt c和AIF蛋白表达显著升高(P<0.05)。
Bcl-2家族也受多种信号途径的调控,其中p53和Survivin是研究广泛的途径之一,STAT3也是近年来研究较多的一条胞内信号通路 [22-23] 。
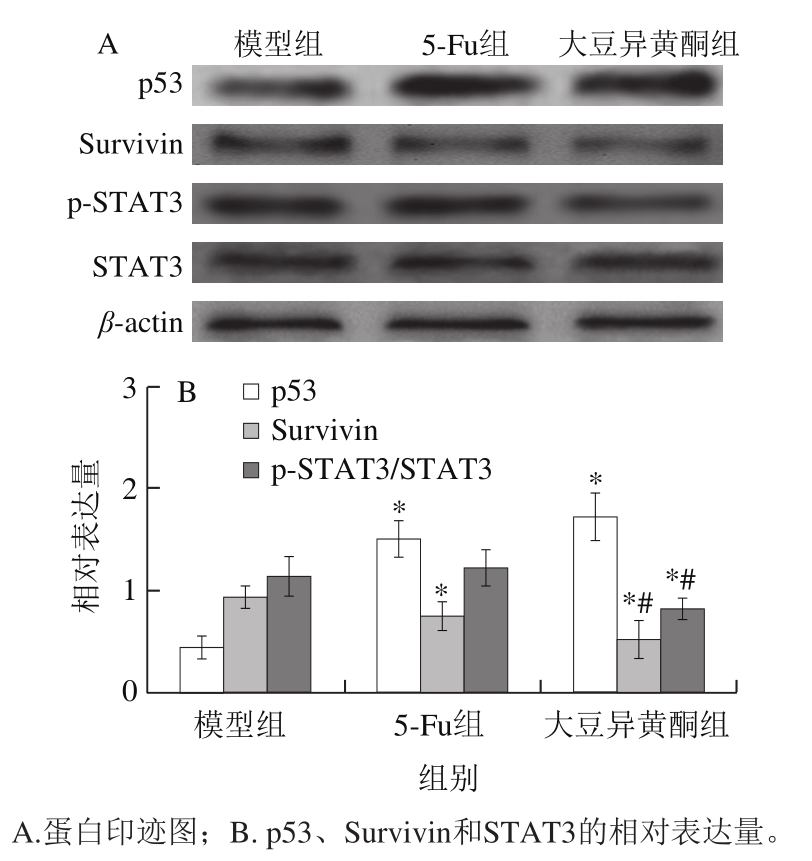
图5 移植瘤组织p53、Survivin蛋白表达和STAT3活化
Fig. 5 Expression of p53 and survivin proteins, and STAT3 activation in transplanted tumor tissue
由图5可知,与模型组比较,大豆异黄酮组小鼠移植瘤组织p53蛋白表达升高(P<0.05),STAT3活化和Survivin蛋白表达降低(P<0.05);与5-Fu组比较,大豆异黄酮组小鼠移植瘤组织STAT3活化和Survivin蛋白表达降低(P<0.05)。
小鼠H22肝癌移植瘤模型是筛选抗癌化疗药物常用的肿瘤模型 [24] 。该小鼠移植瘤成瘤率高,肿瘤生长缓慢、稳定,肺转移少,是理想的肿瘤模型 [25] 。本实验结果表明,大豆异黄酮抑制小鼠H22移植瘤生长,抑瘤率大于30%,虽然其抑癌作用低于5-Fu,但符合抗肿瘤药物的要求 [26] 。
细胞核染色质DNA断裂成180~200 bp或者其多聚体片段是细胞凋亡的生化特征 [6] 。本研究发现,大豆异黄酮增加小鼠移植瘤细胞凋亡特征性结构——DNA ladder的形成,同时上调小鼠移植瘤组织Casp-3、Casp-38和Casp-39活性片段的形成,提示大豆异黄酮可促进H22小鼠肝癌移植瘤细胞凋亡。这与本课题组前期研究 [5] 相一致。
众所周知,细胞凋亡可通过线粒体途径、死亡受体途径及内质网途径实现 [18] 。其中,线粒体途径是凋亡的主要途径,又分为依赖Caspase和不依赖Caspase的凋亡途径 [18] 。Caspase依赖性凋亡主要为线粒体受损,促使Cyt c释放到胞浆中,启动Caspase激活,引起细胞凋亡 [18] 。而AIF是一种不依赖Caspase的凋亡效应分子,细胞受到凋亡刺激后,AIF成熟并从线粒体释放到胞浆,继而转位到核内作用于DNA,使其发生片段化,引起不依赖Caspase的凋亡途径 [19-21] 。线粒体凋亡途径激活中,Bcl-2家族成员起重要调节作用。其中,Bcl-2为抗凋亡因子,Bax为促凋亡因子,可拮抗Bcl-2的抗凋亡作用,两者的比值决定细胞的存活或死亡 [19-21] 。本实验结果显示,大豆异黄酮上调小鼠移植瘤组织胞浆Cyt c和AIF蛋白表达,下调Bcl-2蛋白表达,上调Bax蛋白表达,升高Bax/Bcl-2比值。提示大豆异黄酮促细胞凋亡作用至少部分是与Bcl-2家族成员有关。
Bcl-2家族蛋白表达受多种信号途径的调控,其中p53是研究较广泛的途径之一,而Bax是第一个被鉴定为受其调控的Bcl-2家族成员 [22] 。JAK2/STAT3途径也是近年来研究较多的一条胞内信号通路,涉及细胞增殖、凋亡、分化及炎症发生等过程,在肿瘤的发生发展过程中起重要作用 [22-23] 。研究表明,STAT3可通过上调抗凋亡因子Bcl-2、Bcl-xl以及凋亡抑制因子Survivin的表达抑制细胞凋亡 [27-28] 。也有报道称Survivin可受p53调控,二者可能共属于相同信号转导通路中 [29-30] 。本研究结果表明,大豆异黄酮上调p53蛋白表达,下调STAT3活化和Survivin蛋白表达,提示其促凋亡机制可能与STAT3和p53有关。
综上所述,大豆异黄酮可诱导小鼠H22移植瘤细胞凋亡,其促细胞凋亡作用可能与p53和STAT3介导的凋亡途径有关。
参考文献:
[1] WALZ E. Isoflavon- und saponin-glucoside in soja hispida[J].European Journal of Organic Chemistry, 1931, 489: 118-155.DOI:10.1002/jlac.19314890110.
[2] 尹学哲, 赵文玺, 金爱花, 等. 大豆异黄酮对四氯化碳致小鼠肝脏氧化应激和DNA损伤的干预作用[J]. 食品科学, 2014, 35(1): 214-218.DOI:10.7506/spkx1002-6630-201401042.
[3] 邢扬帆, 刘旭杰, 王智彪, 等. 染料木黄酮对MKN45胃癌细胞及其皮下移植瘤抗血管生成作用的研究[J]. 重庆医科大学学报, 2014,39(12): 1686-1691. DOI:10.13406/j.cnki.cyxb.000435.
[4] 张婷. 抗氧化基因在大豆异黄酮抑制内皮细胞氧化应激损伤中的作用及机制研究[D]. 重庆: 第三军医大学, 2012: 104.
[5] 郑峰, 金延华, 何鑫, 等. 大豆异黄酮和皂甙对H22小鼠肝癌移植瘤的生长抑制及促细胞凋亡作用[J]. 大豆科学, 2016, 35(3): 494-497.DOI:10.11861/j.issn.1000-9841.2016.03.0494.
[6] 尹学哲, 赵文玺, 金爱花, 等. 大豆异黄酮对长春瑞滨化疗兔鳞癌的干预作用[J]. 食品科学, 2013, 34(15): 236-239. DOI:10.7506/spkx1002-6630-201315049.
[7] TOI M, HIROTA S, TOMOTAKI A, et al. Probiotic beverage with soy isoflavone consumption for breast cancer prevention: a casecontrol study[J]. Current Nutrition and Food Science, 2013, 9(3):194-200. DOI:10.2174/15734013113099990001.
[8] MESSINA M J. Emerging evidence on the role of soy in reducing prostate cancer risk[J]. Nutrition Reviews, 2003, 61(4): 117-131.DOI:10.1301/nr.2003.apr.117-131.
[9] PARK O J, SURH Y J. Chemopreventive potential of epigallocatechin gallate and genistein: evidence from epidemiological and laboratory studies[J]. Toxicology Letters, 2004, 150(1): 43-56. DOI:10.1016/j.toxlet.2003.06.001.
[10] BANERJEE S, LI Y, WANG Z, et al. Multi-targeted therapy of cancer by genistein[J]. Cancer Letters, 2008, 269(2): 226-242. DOI:10.1016/j.canlet.2008.03.052.
[11] ULLAH M F, AHMAD A, ZUBAIR H, et al. Soy isoflavone genistein induces cell death in breast cancer cells through mobilization of endogenous copper ions and generation of reactive oxygen species[J].Molecular Nutrition & Food Research, 2011, 55(4): 553-559.DOI:10.1002/mnfr.201000329.
[12] PHILLIP C J, GIARDINA C K, BILIR B, et al. Genistein cooperates with the histone deacetylase inhibitor vorinostat to induce cell death in prostate cancer cells[J]. BMC Cancer, 2012, 12: 145.DOI:10.1186/1471-2407-12-145.
[13] BIELECKI A, ROBERTS J, MEHTA R, et al. Estrogen receptor-β mediates the inhibition of DLD-1 human colon adenocarcinoma cells by soy isoflavones[J]. Nutrition and Cancer, 2011, 63(1): 139-150.DOI:10.1080/01635581.2010.516867.
[14] YU X P, ZHU J D, MI M T, et al. Anti-angiogenic genistein inhibits VEGF-induced endothelial cell activation by decreasing PTK activity and MAPK activation[J]. Medical Oncology, 2012, 29(1): 349-357.DOI:10.1007/s12032-010-9770-2.
[15] FANG Y, ZHANG Q, WANG X, et al. Quantitative phosphoproteomics reveals genistein as a modulator of cell cycle and DNA damage response pathways in triple-negative breast cancer cells[J]. International Journal of Oncology, 2016, 48(3): 1016-1028.DOI:10.3892/ijo.2016.3327.
[16] BAECHLER S A, SCHROETER A, WALKER J, et al. Oxidative metabolism enhances the cytotoxic and genotoxic properties of the soy isoflavone daidzein[J]. Molecular Nutrition & Food Research, 2014,58(6): 1269-1281. DOI:10.1002/mnfr.201300531.
[17] 魏思忱. 三羟异黄酮诱导人肝癌细胞SMMC-7721凋亡的分子机制研究[D]. 石家庄: 河北医科大学, 2005: 40.
[18] 楼烨亮, 陈梦静, 王可, 等. 哈巴苷对急性脑缺血及线粒体介导的caspase依赖性细胞凋亡信号通路的影响[J]. 中国药理学通报, 2017,33(4): 563-567. DOI:10.3969/j.issn.1001-1978.2017.04.022.
[19] 张道宫, 樊兆民, 韩月臣, 等. AIF和PARP-1在庆大霉素致前庭毛细胞凋亡中的作用[J]. 山东大学学报(医学版), 2013, 51(8): 49-52; 57.DOI:10.6040/j.issn.1671-7554.2013.08.010.
[20] 张树森, 徐瑞荣, 王兆华, 等. 益气养阴方及其拆方对急性髓系白血病细胞细胞凋亡及Cyt-C, Apaf-1, Smac/Diablo, AIF表达的影响[J]. 中国实验方剂学杂志, 2017, 23(5): 95-100. DOI:10.13422/j.cnki.syfjx.2017050095.
[21] 王佳, 张炯. 蛇床子素通过抑制线粒体介导的凋亡信号途径减轻脑缺血再灌注损伤[J]. 西安交通大学学报(医学版), 2017, 38(1): 131-135. DOI:10.7652/jdyxb201701028.
[22] 郭彬, 郭佳培, 李雷雷, 等. IL-17-JAK2/STAT3信号通路通过调控p53降低肝癌细胞化疗凋亡敏感性的研究[J]. 重庆医科大学学报,2017(7): 845-849. DOI:10.13406/j.cnki.cyxb.001166.
[23] 郭佳培, 郭彬, 李雷雷, 等. 青蒿素通过抑制JAK2/STAT3信号通路诱导肝癌细胞凋亡[J]. 山西医科大学学报, 2017, 48(2): 97-100.DOI:10.13753/j.issn.1007-6611.2017.02.001.
[24] 孙维凯, 朱伟宏. 大鼠Walker-256、小鼠H22肿瘤模型建立及应用[J].同济大学学报(医学版), 2009, 30(5): 15-18.
[25] 潘志强, 方肇勤, 卢文丽. H22肝癌与Lewis肺癌荷瘤小鼠证候特征比较研究[J]. 北京中医药大学学报, 2008, 31(3): 184-188; 217.DOI:10.3321/j.issn: 1006-2157.2008.03.010.
[26] 卫生部. 新药(西药)临床前研究指导原则汇编[M]. 北京: 卫生部药政局, 1993: 137-138.
[27] ZHANG Y, LI Q, WANG J F, et al. Polysaccharide from Lentinus edodes combined with oxaliplatin possesses the synergy and attenuation effect in hepatocellular carcinoma[J]. Cancer Letters, 2016,377(2): 117-125. DOI:10.1016/j.canlet.2016.04.037.
[28] GRITSKO T, WILLIAMS A, TURKSON J, et al. Persistent activation of Stat3 signaling induces survivin gene expression and confers resistance to apoptosis in human breast cancer cells[J]. Clinical Cancer Research, 2006, 12(1): 11-19. DOI:10.1158/1078-0432.CCR-04-1752.
[29] LU M J, WANG C, WANG J. Tanshinone I induces human colorectal cancer cell apoptosis: the potential roles of Aurora A-p53 and survivinmediated signaling pathways[J]. International Journal of Oncology,2016, 49(2): 603-610. DOI:10.3892/ijo.2016.3565.
[30] LI X, LI B, NI Z, et al. Metformin synergizes with BCL-XL/BCL-2 inhibitor ABT-263 to induce apoptosis specifically in p53-defective cancer cells[J]. Molecular Cancer Therapeutics, 2017, 16(9): 1806-1818. DOI:10.1158/1535-7163.MCT-16-0763.
Pro-apoptotic Mechanism of Soy Isoflavones on Transplanted Hepatoma Cells in Mice
TIAN Xiao, JIN Meihua, LIU Liyuan, HE Xin, QUAN Jishu*
(Medical College, Yanbian University, Yanji 133002, China)
Abstract: Objective: To investigate the pro-apoptotic mechanism of soy isoflavones on transplanted H22 hepatoma cells in mice. Methods: Kunming mice were subcutaneously inoculated with mouse hepatoma H22 cells and then divided into model, soy isoflavone-treated and 5-fuorouracil-treated groups. The apoptosis of transplanted tumor tissue was detected by DNA ladder assay, and the expressions of cysteinyl aspartate specific proteinase (caspase)-3, caspase-8, caspase-9,B cell lymphoma/lewkmia-2 (Bcl-2), Bcl-2-associated X protein (Bax), cytochrome c (Cyt c), apoptosis-inducing factor(AIF), p53, survivin and signal transducer and activator of transcription (STAT)3 proteins were detected by Western blotting. Results: Compared with the model group, the growth of transplanted tumor was suppressed, and the intensity of DNA ladder was increased; the active fragments of caspase-3, caspase-8 and caspase-9 were increased; the expression of Bcl-2 protein was decreased, while the expression of Bax was increased; and the cytoplasmic levels of Cyt c and AIF in transplanted tumor tissue were elevated in the soy isoflavone group. In addition, soy isoflavone treatment elevated p53 protein expression, and reduced STAT3 activation and survivin protein expression in transplanted tumor tissue. Conclusion:Soy isoflavones can induce the apoptosis of H22 transplanted tumor cells, and the pro-apoptotic mechanism may be related to the regulation of p53 and STAT3.
Keywords: soy isoflavone; transplanted hepatoma H22 cells; apoptosis; p53; signal transducer and activator of transcription DOI:10.7506/spkx1002-6630-201817020
TIAN Xiao, JIN Meihua, LIU Liyuan, et al. Pro-apoptotic mechanism of soy isoflavones on transplanted hepatoma cells in mice[J]. Food Science, 2018, 39(17): 122-126. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201817020.http://www.spkx.net.cn
引文格式: 田笑, 金梅花, 刘莉园, 等. 大豆异黄酮诱导小鼠肝癌移植瘤细胞凋亡的机制[J]. 食品科学, 2018, 39(17): 122-126.DOI:10.7506/spkx1002-6630-201817020. http://www.spkx.net.cn
文献标志码: A
文章编号: 1002-6630(2018)17-0122-05
*通信作者简介: 全吉淑(1968—),女,教授,博士,研究方向为中药药理学。E-mail:quanjs@ybu.edu.cn
中图分类号: TS201.4
基金项目: 国家自然科学基金地区科学基金项目(81160539)
第一作者简介: 田笑(1992—),女,硕士研究生,研究方向为分子肿瘤学。E-mail:879866691@qq.com
(延边大学医学院,吉林 延吉 133002)
收稿日期: 2017-04-26
摘 要: 目的:探讨大豆异黄酮对小鼠肝癌移植瘤细胞凋亡的诱导机制。方法:建立小鼠H22肝癌皮下移植瘤模型,分为模型组、大豆异黄酮组和5-氟尿嘧啶组。采用DNA ladder法检测移植瘤细胞凋亡情况,蛋白印迹法检测移植瘤组织含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)-3、Caspase-8、Caspase-9、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、细胞色素c(cytochrome c,Cyt c)、细胞凋亡诱导因子(apoptosis inducing factor,AIF)、p53、Survivin和信号传导子及转录激活子(signal transducer and activator of transcription,STAT)3表达情况。结果:与模型组比较,大豆异黄酮组移植瘤质量减轻;肿瘤细胞凋亡特征性DNA片段增多;移植瘤细胞Caspase-3、Caspase-8和Caspase-9的活性片段增多;Bcl-2蛋白相对表达量降低,Bax蛋白相对表达量升高;胞浆Cyt c和AIF水平升高。同时,大豆异黄酮上调移植瘤组织p53蛋白表达,下调STAT3活化和Survivin蛋白表达。结论:大豆异黄酮诱导H22移植瘤细胞凋亡,其促凋亡机制可能与p53和STAT3有关。