表1 原花青素B 2 对小鼠旷场迷宫实验的影响
Table 1 Effect of procyanidin B 2 on open test field of aging mice

注:同列肩标小写字母不同代表差异显著(P<0.05),下同。
肖 瀛,吴其国,尹志婷,周一鸣,周小理,胡中志
关键词: 原花青素B 2 ;抗衰老;抗氧化;代谢组学
衰老是机体组织器官发生退行性变化、导致机体功能下降和功能紊乱不断加重的过程,易出现如记忆力下降,糖、脂代谢紊乱,肝、肾功能异常等症状 [1-2] 。随着年龄的增长,体内抗氧化防御系统机能减退,造成自由基堆积,是导致衰老的主要原因之一。过多的自由基可攻击核酸、蛋白质及酶类等生物大分子,造成DNA变异及酶活性下降 [3] 。氧化性损伤会造成细胞损伤和凋亡,导致多种与年龄相关的慢性疾病恶化,如阿尔茨海默症、帕金森病、糖尿病 [4-6] 等。原花青素是一种由儿茶素或表儿茶素单体聚合而成的化合物,在植物界分布广泛,且常见于日常食品中,如葡萄、松树皮、红酒 [7-8] 等。众多研究证实原花青素具有较强的生物活性,在清除自由基、抗氧化、抗癌、治疗糖尿病和心血管保护等方面 [9-11] 有显著效果,其中原花青素B 2 在各类食物原花青素中分布最广,且抗氧化活性强,但目前的研究主要以原花青素提取物作为研究对象,鲜有单一成分原花青素对抗衰老功能评价的报道,且其机理并不明确。
代谢组学是一种快速对生物体内所有内源性代谢产物进行定性、定量分析,并寻找代谢物与生理变化相对关系的研究方式,其通过鉴别潜在生物标志物来评价机体反映的细微生理应激,为探索整个机体功能提供重要信息 [12-15] 。目前尚鲜有从代谢组学角度探究原花青素B 2 抗衰老的机理研究。因此,本研究采用D-半乳糖诱导的衰老小鼠为模型,考察其学习记忆力,评价原花青素B 2 的抗衰老作用,基于液相色谱-四极杆-飞行时间质谱(liquid chromatography quadrupole-time-of-flight mass spectrometer,LC-Q-TOF-MS)代谢组学技术,解析原花青素B 2 改善衰老的可能机制。
4 周龄雄性C57BL/6小鼠(SPF级,体质量(15±1)g)购于上海灵畅生物科技公司,许可证号:SCXK(沪)2013-0018。
原花青素B 2 (纯度≥90%) 上海同田生物技术有限公司;D-半乳糖、肝素钠(分析纯) 上海阿拉丁生化科技公司;无水乙醇、乙醚(分析纯) 国药集团上海化学试剂公司;总抗氧化力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)检测试剂盒 南京建成生物研究所。
DF-1156型低温冰箱 日本三洋电机公司;3k-18型离心机 德国Sigma公司;旷场实验、Y型食物诱导型迷宫(简称Y型迷宫)、Morris水迷宫及动物行为学视频分析软件 上海欣软信息科技公司;LC-Q-TOF-MS(配备1290 Infinity LC系统、6530 UHD Q-TOF-MS)美国Agilent公司;PURELAB Classic型超纯水机 英国ELGA公司。
1.3.1 动物分组与给药
小鼠饲养在室温为(22±2)℃、12 h昼夜交替的动物房内,自由摄食和饮水。动物购买后适应性喂养1 周,随机分为3 组:对照组(A组)、模型组(B组)、原花青素B 2 组(C组),每组9 只,每笼4~5 只。对照组喂以标准饲料AIN93G,并每天皮下注射0.86%(质量分数,下同)生理盐水10 mL/kg;模型组给予标准饲料,每天皮下注射10% D-半乳糖10 mL/kg;原花青素B 2 组喂以原花青素干预饲料(AIN93G+0.2%原花青素B 2 ),同时注射10% D-半乳糖10 mL/kg,持续6 周。实验期间每周一称体质量一次,并根据小鼠体质量的变化调整注射剂量。
1.3.2 行为学实验
1.3.2.1 旷场实验
实验第5周进行行为学实验。旷场迷宫底部设为4×4方格,中央4 格为中心区域,其他为边周区域。将小鼠放入旷场迷宫的中心位置,视频记录5 min内小鼠的活动情况。观察小鼠的总活动量、中心区域的活动时间及路程。
1.3.2.2 Y型迷宫实验
Y型迷宫由3 个夹角120°且相同的臂组成,随机设为起始臂、食物臂、新异臂。实验包含两个阶段,间隔1 h。第1阶段为训练期,新异臂用隔板挡住,食物臂中放入一小块巧克力,小鼠由起始臂放入,在起始臂和食物臂中自由活动10 min。训练结束后,小鼠放回饲养笼。1 h后进入第二阶段。第2阶段为检测期,抽开新异臂隔板,小鼠由起始臂放入,在3 个臂中自由活动5 min。统计小鼠进入食物臂的次数及停留时间。
1.3.2.3 Morris水迷宫实验
Morris水迷宫主要由圆形水池(直径1.2 m、高50.0 cm)和逃生平台(直径9.0 cm)组成。实验时将水池内的水用钛白粉染成乳白色,以隐藏平台,水面高于逃生平台1 cm,将水池平均分成4 个象限,将不同形状的参照物挂于各个象限的池壁内侧并高于水面,作为小鼠寻找平台的标记物,在实验期间保持固定。实验室挂窗帘严密避光,且整个水池周围挂遮光窗帘,保证内部无灯光直射,水温控制在(22±1)℃。
实验历时6 d,每天每只小鼠训练4 次,每次以随机方式从第一、二、三、四象限选择一个入水点,将小鼠面向池壁放入水中。让小鼠在60 s内找到逃生平台并停留10 s,记录寻找平台所需的时间,即为潜伏期(即小鼠进入泳池后第一次找到平台所需的时间)。若未能寻找到平台,则由实验者用手引导至平台停留30 s。每次训练后用取暖器烘干小鼠,以免低温造成的应激。第6天撤除平台,将小鼠从平台的对角象限置于水中,游泳60 s,记录平台潜伏期、穿越平台次数、平台象限活动时间及路程。
1.3.3 样品采集
小鼠饲养7 周后称质量,乙醚麻醉后眼球取血,置于肝素钠抗凝管中,颈椎脱臼处死小鼠后立即解剖,取出肝、脑、肾组织,分别在冰浴条件下用生理盐水匀浆,制成质量分数10%的组织匀浆液。血液在4 ℃、3 000 r/min条件下离心15 min,取上清获得血浆,组织匀浆液于4 ℃、6 000 r/min条件下离心15 min取上清液,样品保存在-80 ℃的冰箱中待测。
1.3.4 抗氧化指标的测定
取组织匀浆上清液,按照试剂盒说明书方法测定SOD活力、MDA含量、GSH-PX活力以及T-AOC。
1.3.5 LC-MS代谢组学分析
血浆样本置于室温解冻,用移液枪吸取100 μL血浆样本于1.5 mL EP管中。加入300 μL甲醇及10 μL内标(2.9 mg/mL 2-氯苯丙氨酸),漩涡振荡混匀30 s,而后置于4 ℃离心机中,12 000 r/min离心15 min,取200 μL上清液待检测。
色谱条件:分离色谱柱为C 18 (100 mm×2.1 mm,1.8 μm);柱温40 ℃;流速0.35 mL/min;流动相组成A:水+0.1%(体积分数,下同)甲酸溶液;B:乙腈+0.1%甲酸溶液;梯度洗脱条件:0~6 min,0~5% B,6~9 min,5%~50% B,9~13 min,50%~95% B,13~15 min,95% B;进样量4 μL;自动进样器温度4 ℃。
质谱条件:正离子模式:以氮气作为雾化、锥孔气;飞行管检测模式V型;毛细管电压4 kV,锥孔电压35 kV,离子源温度100 ℃;脱溶剂气温度350 ℃,反向锥孔气流速50 L/h,脱溶剂气流速600 L/h,萃取锥孔电压4 V。负离子模式:毛细管电压3.5 kV,锥孔电压50 kV,离子源温度100 ℃;脱溶剂气温度300 ℃,反向锥孔气流速50 L/h,脱溶剂气流速700 L/h,萃取锥孔电压4 V。离子扫描时间0.03 s,扫描时间间隔0.02 s,数据采集范围m/z 50~1 000。
抗氧化与行为学表征数据的结果用 ±s表示,并采用SPSS 11.5软件中的ANOVA方法对数据进行显著性差异分析,以P<0.05为差异显著。代谢组学数据利用Mass Profiler软件对采集到的谱图进行预处理,并在Excel软件中进行后期编辑,将最终结果组织为二维数据矩阵,导入SIMCA-P 13.0软件进行多元统计分析。
2.1.1 对旷场行为学实验的影响
表1 原花青素B 2 对小鼠旷场迷宫实验的影响
Table 1 Effect of procyanidin B 2 on open test field of aging mice

注:同列肩标小写字母不同代表差异显著(P<0.05),下同。
如表1所示,与对照组(A)比较,模型组(B)小鼠的总路程和进入中心区域时间、次数、路程显著减少(P<0.05),表明D-半乳糖已经引起小鼠的运动能力和探索能力下降,降低了小鼠的活动量。与模型组相比,原花青素B 2 组(C)小鼠中心区域时间延长、次数与路程显著增加,表明原花青素B 2 可以改善衰老小鼠的运动能力和学习记忆能力。
2.1.2 对Y型迷宫行为学实验的影响
表2 原花青素B 2 对小鼠Y型迷宫行为学实验的影响
Table 2 Effect of procyanidin B 2 on Y-maze behavior of aging mice

如表2所示,与模型组(B)相比,原花青素B 2 能显著提高小鼠进入食物臂的次数并延长在食物臂停留的时间,降低衰老小鼠的错误次数,并且与对照组(A)处于同水平。这表明原花青素B 2 能抵御D-半乳糖导致的小鼠学习记忆能力的损伤。
2.1.3 对Morris水迷宫行为学实验的影响
表3 原花青素B 2 对小鼠Morris水迷宫行为学实验的影响
Table 3 Effect of procyanidin B 2 on water maze behavior of aging mice

对小鼠在Morris水迷宫探索平台实验中穿越逃生平台的次数、逃生平台所在象限的停留时间和路程进行了分析。由表3可知,与对照组(A)相比,模型组(B)穿越平台的次数和路程显著下降;相对于模型组,原花青素B 2 组(C)在次数和路程上显著增加,且与对照组小鼠在穿越平台的次数、逃生平台所在象限的停留时间和路程无显著差异(P>0.05),这表明原花青素B 2 能够增强衰老小鼠探索空间及空间定位的能力,提高其记忆力,延缓衰老。
表4 原花青素B 2 对小鼠抗氧化指标的影响
Table 4 Effect of procyanidin B 2 on antioxidant indices in aging mice U/mg pro

由表4可见,与对照组(A)相比,模型组(B)肝、脑、肾3 个组织中的T-AOC、SOD活力和GSH-Px活力显著降低(P<0.05)(肝组织GSH-Px活力除外)。与模型组相比,原花青素B 2 组(C)小鼠组织中的T-AOC、SOD活力、GSH-Px活力显著升高。表明原花青素B 2 可以提高衰老小鼠肝、脑、肾组织的抗氧化能力,清除体内过多的自由基。如表5所示,模型组(B)小鼠组织中MDA含量与对照组(A)相比显著增加(P<0.05),表明衰老小鼠肝、脑、肾组织中有大量脂质过氧化产物积累。与模型组相比,原花青素B 2 组(C)小鼠MDA含量显著低于模型组,原花青素B 2 能显著抑制衰老小鼠肝、脑、肾等组织中MDA的产生,表明原花青素B 2 能够抑制衰老小鼠体内脂质过氧化的发生,干预氧化损伤的产生。
表5 原花青素B 2 对小鼠MDA含量的影响
Table 5 Effects of procyanidin B 2 on MDA content in aging mice nmol/mg pro

2.3.1 血浆样本PLS-DA及模型验证
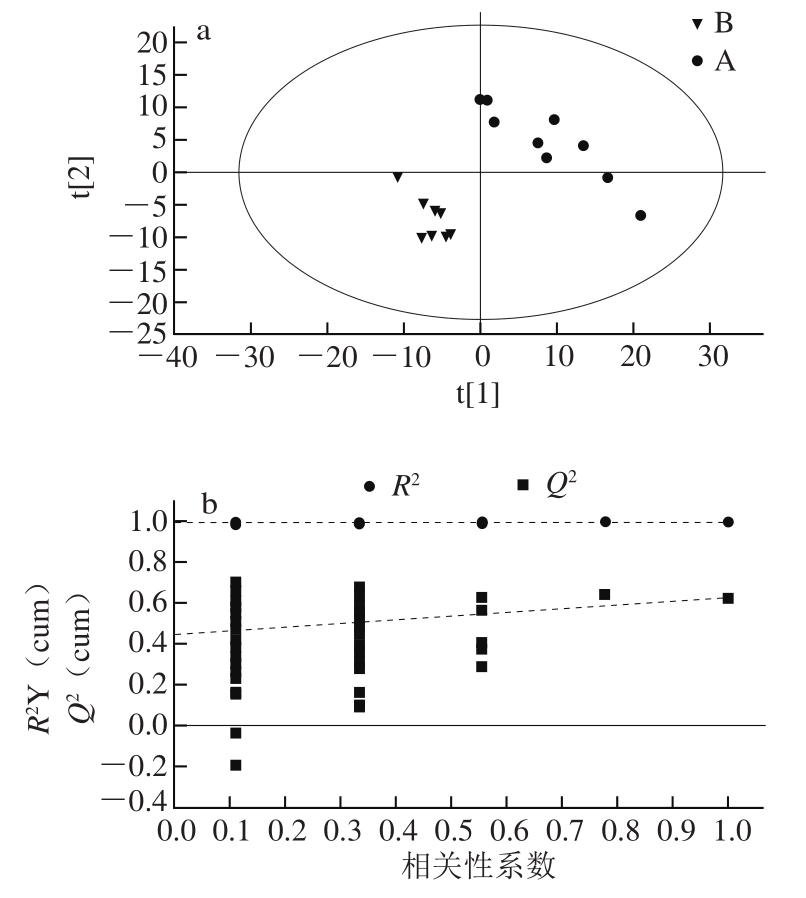
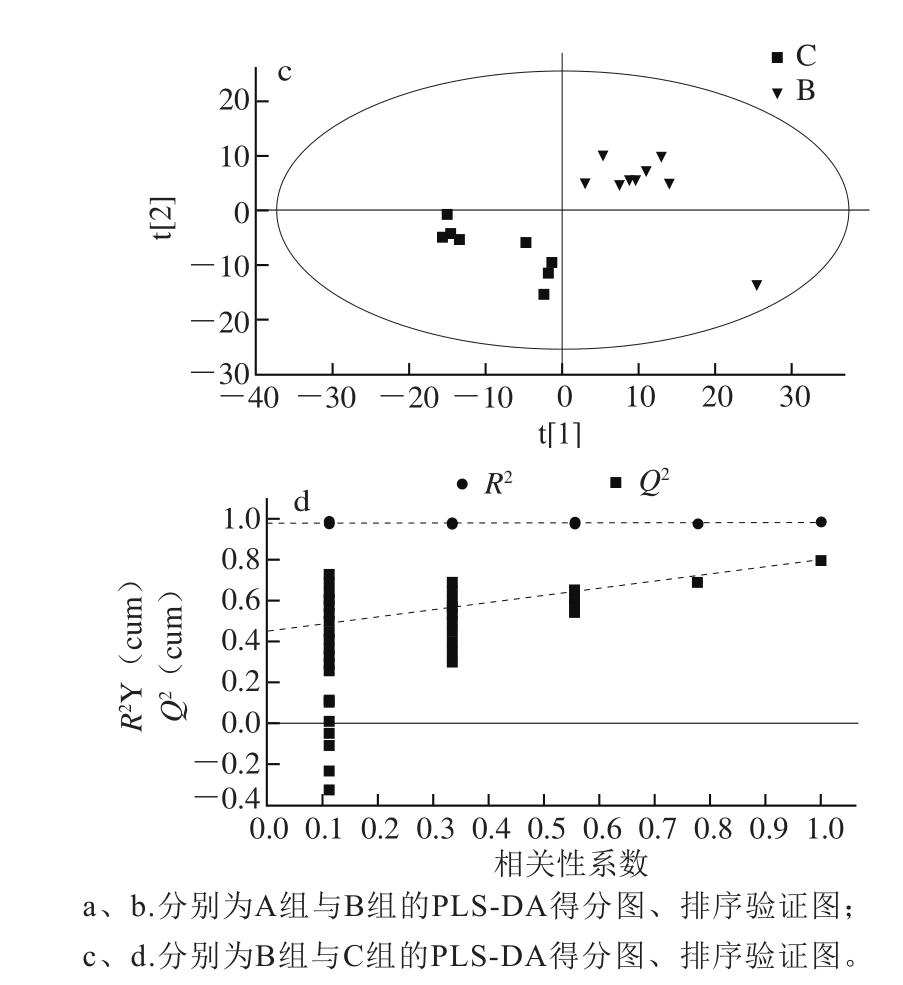
图1 血浆样本的PLS-DA得分图及排序验证图(负离子扫描模式)
Fig. 1 PLS-DA score plot and permutation test of plasma samples(in negative ion mode)
如图1所示,采用偏最小二乘法判别分析(partial least squares-discriminant,PLS-DA),以模型的拟合度(R 2 Y)和预测度(Q 2 )结合排序验证图共同提示对照组(A)与模型组(B)比较有显著差异,且没有过度拟合(R 2 Y=0.997,Q 2 =0.626)。模型组与原花青素B 2 组(C)显著区分,存在显著差异(R 2 Y=0.992,Q 2 =0.808),表明原花青素B 2 对D-半乳糖致衰老小鼠代谢轮廓有着显著的影响。
2.3.2 差异代谢物的筛选及相关代谢通路研究结果
表6 主要差异性代谢物及其代谢通路
Table 6 Major differential metabolites and their metabolic pathways

注:VIP.正交偏最小二乘法-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)模型构建时不同物质对模型的贡献率;变化倍数为两组平均值之比的对数值(以2为底数);+.表示含量上升;-.表示含量下降(P<0.05);NC.含量无显著性改变(P>0.05)。
采用OPLS-PA模型的VIP值(阈值>1)并结合t-检验的P值,寻找差异性表达代谢物,得到具有显著性差异的潜在生物标志物(表6)。与对照组(A)相比,模型组(B)小鼠血浆中泛酸、肉碱、肌酸、柠檬酸、α-酮戊二酸含量降低,而溶血磷脂酰乙醇胺(0∶0/16∶0)、癸酸、马尿酸含量上升。相比于模型组,原花青素B 2 组(C)小鼠血浆中存在12 种潜在生物标志物,其中磷脂酰胆碱((O-18∶1(1E)/0∶0)、(P-18∶1(9Z)/0∶0)、(20∶5(5Z,8Z,11Z,14Z,17Z)/0∶0)、(O-12∶0/O-1∶0))、油酸、亚油酸、肉碱、牛黄胆酸、泛酸含量显著升高,β-羟基丁酸、马尿酸、丙酮酸这3 种物质含量显著降低。潜在的17 种生物标志物涉及了甘油磷脂代谢、不饱和脂肪酸合成、三羧酸循环、糖酵解、牛磺酸和亚牛磺酸代谢、泛酸盐和辅酶A合成等途径,表明原花青素B 2 延缓衰老的作用机制可能与多种代谢通路相关,并且可能与代谢途径相互联系、相互影响。
本研究通过动物行为学表征与抗氧化表征评价了原花青素B 2 对D-半乳糖诱导衰老模型小鼠的干预作用,结果表明原花青素B 2 具有显著干预D-半乳糖模型小鼠记忆减退与氧化损伤的作用。大脑的学习与记忆功能极易在衰老过程中受损 [16] ,D-半乳糖衰老模型引发小鼠学习与记忆损伤的机制可能是激活了体内的醛糖还原酶和半乳糖氧化酶等途径,产生大量活性氧,引起脑内与学习记忆密切相关的胆碱乙酰化转移酶等蛋白质氧化损伤,使乙酰胆碱合成减少,同时对神经细胞核进行攻击,上调半胱氨酸蛋白酶等凋亡基因表达,导致神经元细胞凋亡,尤其是与学习记忆有关的胆碱能和谷氨酸能神经纤维发生退变 [17] 。本研究中衰老小鼠的空间学习及记忆能力在原花青素B 2 干预后得到显著改善,可能是由于原花青素B 2 具有多个酚羟基,能够有效地清除活性氧,提高小鼠体内的抗氧化能力,抑制凋亡基因的表达,抵御蛋白与脂质氧化损伤,从而延缓衰老。
本研究进一步通过LC-Q-TOF-MS技术探究了原花青素B 2 对衰老小鼠内源代谢物的影响,解析了其生物标志物,发现模型小鼠中三羧酸循环代谢通路发生显著变化。三羧酸循环为组织细胞提供ATP,在此过程中的ATP是经呼吸链产生的 [18-21] ,本研究结果显示衰老模型小鼠血浆代谢产物中与三羧酸循环有关的柠檬酸与α-酮戊二酸含量均显著降低;说明随着机体的衰老,三羧酸循环中间代谢物含量降低,能量代谢水平也会受到影响。线粒体是机体进行氧化代谢的部位,是糖类、脂肪、氨基酸代谢释放能量的场所 [22] 。线粒体的氧化损伤是细胞衰老和凋亡的基础,可加速细胞老化,导致核DNA的氧化损伤,并影响基因转录。丙酮酸在线粒体中氧化脱羧生成乙酰辅酶A,是连接糖酵解和三羧酸循环的重要环节。原花青素B 2 干预使小鼠的T-AOC、SOD和GSH-Px活力明显提高,血浆中泛酸含量显著增加,丙酮酸含量降低,表明原花青素B 2 可能通过保护线粒体氧化损伤,促进丙酮酸转化为乙酰辅酶A,调节糖酵解、三羧酸循环趋于正常,从而延缓了衰老。
磷脂酰胆碱、不饱和脂肪酸不仅是脂代谢重要的相关物质,而且与机体自由基的产生、氧化损伤等衰老和老化进程密切相关 [23-25] 。脂肪酸在脂酰辅酶A合成酶的催化下生成脂酰辅酶A,长链脂酰辅酶A通过肉碱进入线粒体才能代谢 [24] 。本实验衰老模型小鼠血浆中肉碱的含量降低,从而抑制长链脂肪酸的氧化;而原花青素B 2 可清除体内过多自由基,抑制活性氧与不饱和脂肪酸、磷脂等大分子反应,降低小鼠组织中MDA的含量,保护细胞膜的流动性和通透性,有利于脂酰辅酶A顺利进入线粒体发生氧化反应,使肉碱含量升高、β-羟基丁酸含量降低,从而促进脂肪酸的β-氧化,并可能调节脂质代谢紊乱。原花青素B 2 干预后亚油酸、油酸含量显著上升,抑制了脂质过氧化,提示原花青素B 2 能够通过抑制脂质过氧化程度改善衰老小鼠的能量代谢异常。
磷脂酰胆碱也是构成生物细胞膜的主要成分 [26-28] ,脑神经细胞中卵磷脂约占脑神经细胞质量的17%~20% [29] 。大脑能直接从血液中摄取卵磷脂及胆碱,并很快转化为乙酰胆碱,提高脑细胞的活性,从而减缓记忆力衰退的进程,改善脑功能 [30-31] 。有研究发现多烯磷脂酰胆碱从一定程度上可以减轻阿尔茨海默症模型大鼠的行为学及形态学改变,减弱胶质细胞活化的程度,并且对于突触结构的完整性具有一定的保护作用 [32-34] 。模型小鼠在行为学中表现出记忆力减退、盲目寻找逃生途径及对空间定位的记忆能力衰退的现象,原花青素B 2 干预组的小鼠血浆中磷脂酰胆碱((O-18∶1(1E)/0∶0)、(P-18∶1(9Z)/0∶0)、(20∶5(5Z,8Z,11Z,14Z,17Z)/0∶0)、(O-12∶0/O-1∶0))含量显著提高,磷脂合成的增加可促进神经突起的生长,增加突触和树突触的数量,促进大脑的学习记忆功能 [35] 。本研究发现原花青素B 2 干预组小鼠学习记忆能力和空间探索能力较模型组显著提高,推测原花青素B 2 有显著改善认知功能减退的作用。此外,苯丙氨酸浓度过高会造成神经系统的损害,导致发育迟缓、学习记忆能力下降 [31] ,原花青素B 2 可能通过调节马尿酸的水平,改善苯丙氨酸代谢,从而保护大脑功能,延缓其衰老。
本研究结果表明,原花青素B 2 的干预可显著改善小鼠学习记忆减退与氧化损伤,且血浆代谢物与模型组差异显著,表明其在一定程度上干预了机体代谢异常,从而延缓衰老进程。
参考文献:
[1] 刘春杰, 董立珉, 康红钰. 丝瓜提取物对衰老小鼠学习记忆能力、脑组织形态学及免疫功能的影响[J]. 中药药理与临床, 2016, 32(1):106-110. DOI:10.13412/j.cnki.zyyl.2016.01.030.
[2] MORETTO J, GUGLIELMETTI A S, TOURNIER-NAPPEY M, et al.Effects of a chronic L-arginine supplementation on the arginase pathway in aged rats[J]. Experimental Gerontology, 2017, 90: 52-60.DOI:10.1016/j.exger.2017.01.023.
[3] FORMAN H J. Redox signaling: an evolution from free radicals to aging[J]. Free Radical Biology and Medicine, 2016, 97: 398-407.DOI:10.1016/j.freeradbiomed.2016.07.003.
[4] TENG D, FANG Y, SONG X, et al. Optimization of enzymatic hydrolysis parameters for antioxidant capacity of peptide from goat placenta[J]. Food and Bioproducts Processing, 2011, 89(3): 202-208.DOI:10.1016/j.fbp.2010.05.001.
[5] ZAVALZA-GÓMEZ A B. Obesity and oxidative stress: a direct link to preeclampsia?[J]. Archives of Gynecology and Obstetrics, 2011,283(3): 415-422. DOI:10.1007/s00404-010-1753-1.
[6] MATEOS L R, MADRIGAL K, FLORES C, et al. The effects of differential outcomes on learning and memory in young and aged rats[J]. Learning and Motivation, 2016, 53: 1-6. DOI:10.1016/j.lmot.2015.10.004.
[7] 高璐, 王滢, 饶胜其, 等. 葡萄籽原花青素提取物对衰老模型小鼠抗氧化作用[J]. 食品科学, 2014, 35(23): 253-256. DOI:10.7506/spkx1002-6630-201423049.
[8] TERRA X, PALLARÉS V, ARDÈVOL A, et al. Modulatory effect of grape-seed procyanidins on local and systemic inflammation in dietinduced obesity rats[J]. Journal of Nutritional Biochemistry, 2011,22(4): 380-387. DOI:10.1016/j.jnutbio.2010.03.006.
[9] MARGALEF M, IGLESIASCARRES L, PONS Z, et al. Age related differences in the plasma kinetics of flavanols in rats[J].Journal of Nutritional Biochemistry, 2016, 29: 90-96. DOI:10.1016/j.jnutbio.2015.11.007.
[10] 张慧文, 张玉, 马超美. 原花青素的研究进展[J]. 食品科学, 2015,36(5): 296-304. DOI:10.7506/spkx1002-6630-201505052.
[11] MELO P S, ARRIVETTI L D O R, ALENCAR S M D, et al.Antioxidative and prooxidative effects in food lipids and synergism with α-tocopherol of acai seed extracts and grape rachis extracts[J]. Food Chemistry, 2016, 213: 440-449. DOI:10.1016/j.foodchem.2016.06.101.
[12] CHEDEA V S, BRAICU C, CHIRILĂ F, et al. Antioxidant/prooxidant and antibacterial/probacterial effects of a grape seed extract in complex with lipoxygenase[J]. BioMed Research International, 2014, 2014:313684. DOI:10.1155/2014/313684.
[13] 雷荣辉, 王青秀, 颜贤忠, 等. 利用 1 H-NMR技术研究大黄素染毒后大鼠内源性代谢物的改变[J]. 药物评价研究, 2015, 38(1): 29-35.DOI:10.7501/j.issn.1674-6376.2015.01.005.
[14] 武雪玲, 常平, 黄汉昌, 等. 原花青素防治阿尔茨海默病机理研究进展及最新治疗策略[J]. 生命科学研究, 2016, 20(2): 158-161; 177.DOI:10.16605/j.cnki.1007-7847.2016.02.012.
[15] 宣琪, 张育先, 刘殿刚, 等. 原花青素对高脂饮食诱导大鼠脂肪肝的防治研究[J]. 中华实用诊断与治疗杂志, 2016, 30(9): 848-850.DOI:10.13507/j.issn.1674-3474.2016.09.006.
[16] SU H M. Mechanisms of n-3 fatty acid-mediated development and maintenance of learning memory performance[J]. Journal of Nutritional Biochemistry, 2010, 21(5): 364-373. DOI:10.1016/j.jnutbio.2009.11.003.
[17] RUAN Q, HU X, AO H, et al. The neurovascular protective effects of huperzine A on D-galactose-induced inflammatory damage in the rat hippocampus[J]. Gerontology, 2014, 60(5): 424-439.DOI:10.1159/000358235.
[18] LIU X J, ZHOU Y Z, LI Z F, et al. Anti-depressant effects of Xiaoyaosan on rat model of chronic unpredictable mild stress: a plasma metabonomics study based on NMR spectroscopy[J]. Journal of Pharmacy & Pharmacology, 2012, 64(4): 578-588. DOI:10.1111/j.2042-7158.2011.01412.x.Epub 2011 Dec 29.
[19] ŠOŠIĆJURJEVIĆ B, LÜTJOHANN D, JARIĆ I, et al. Effects of age and soybean isoflavones on hepatic cholesterol metabolism and thyroid hormone availability in acyclic female rats[J]. Experimental Gerontology, 2017, 92: 74-81. DOI:10.1016/j.exger.2017.03.016.
[20] 牛强, 谢馨瑶, 刘雪娇, 等. 葡萄籽原花青素对NaF致雄性小鼠肝脏氧化损伤的拮抗作用[J]. 环境与职业医学, 2015, 32(4): 311-314.DOI:10.13213/j.cnki.jeom.2015.14462.
[21] 邓伟. 中等强度耐力运动与葡萄籽原花青素对高脂饮食大鼠动脉粥样硬化形成干预作用及其机制探讨[J]. 安徽师范大学学报(自然科学版), 2015, 38(2): 192-198. DOI:10.14182/j.cnki.1001-2443.2015.02.017.
[22] BOCZONADI V, HORVATH R. Mitochondria: impaired mitochondrial translation in human disease[J]. International Journal of Biochemistry and Cell Biology, 2014, 48: 77-84. DOI:10.1016/j.biocel.2013.12.011.
[23] OAKMAN C, TENORI L, BIGANZOLI L, et al. Uncovering the metabolomic fingerprint of breast cancer[J]. International Journal of Biochemistry and Cell Biology, 2011, 43(7): 1010-1020. DOI:10.1016/j.biocel.2010.05.001.
[24] KUSHNIR V A, LUDAWAY T, RUSS R B, et al. Reproductive aging is associated with decreased mitochondrial abundance and altered structure in murine oocytes[J]. Journal of Assisted Reproduction and Genetics, 2012, 29(7): 637-642. DOI:10.1007/s10815-012-9771-5.
[25] KIN WONG M W, BRAIDY N, POLJAK A, et al. Dysregulation of lipids in Alzheimer’s disease and their role as potential biomarkers[J].Alzheimer’s & Dementia, 2017, 13(7): 810-827. DOI:10.1016/j.jalz.2017.01.008.
[26] KIM S T, CHUNG Y H, LEE H S, et al. Protective effects of phosphatidylcholine on oxaliplatin-induced neuropathy in rats[J]. Life Sciences, 2015, 130: 81-87. DOI:10.1016/j.lfs.2015.03.013.
[27] NAJDEKR L, GARDLO A, MÁDROVÁ L, et al. Oxidized phosphatidylcholines suggest oxidative stress in patients with mediumchain acyl-CoA dehydrogenase deficiency[J]. Talanta, 2015, 139: 62-66. DOI:10.1016/j.talanta.2015.02.041.
[28] SI X, STRAPPE P, BLANCHARD C, et al. Enhanced anti-obesity effects of complex of resistant starch and chitosan in high fat diet fed rats[J]. Carbohydrate Polymers, 2017, 157: 834-841. DOI:10.1016/j.carbpol.2016.10.042.
[29] ZHANG J, WEI S Y, LI Y, et al. Davunetide improves spatial learning and memory in Alzheimer’s disease-associated rats[J]. Physiology &Behavior, 2017, 174: 67-73. DOI:10.1016/j.physbeh.2017.02.038.
[30] 吕雪幼, 叶国良. 多烯磷脂酰胆碱治疗老年中重度脂肪肝的临床研究[J]. 中国临床药理学杂志, 2016, 32(15): 1370-1373.DOI:10.13699/j.cnki.1001-6821.2016.15.008.
[31] 周玲, 刘颖, 贡盈歌, 等. 阿尔茨海默病模型小鼠脑组织生物标记物代谢组学分析[J]. 沈阳药科大学学报, 2016, 33(6): 459-465.DOI:10.14066/j.cnki.cn21-1349/r.2016.06.008.
[32] VASILEVA L V, GETOVA D P, DONCHEVA N D, et al.Beneficial effect of commercial Rhodiola extract in rats with scopolamine-induced memory impairment on active avoidance[J].Journal of Ethnopharmacology, 2016, 193: 586-591. DOI:10.1016/j.jep.2016.10.011.
[33] YU P N, OR T C T, IP N Y. Plant alkaloids as drug leads for Alzheimer’s disease[J]. Neurochemistry International, 2015, 89: 260-270. DOI:10.1016/j.neuint.2015.07.018.
[34] SCHLEGEL G, SCHOLZ R, ULLRICH K, et al. Phenylketonuria:direct and indirect effects of phenylalanine[J]. Experimental Neurology, 2016, 281: 28-36. DOI:10.1016/j.expneurol.2016.04.013.
[35] RAVETTI M G, ROSSO O A, BERRETTA R, et al. Uncovering molecular biomarkers that correlate cognitive decline with the changes of hippocampus’ gene expression profiles in Alzheimer’s disease[J].PLoS ONE, 2010, 5(4): e10153. DOI:10.1371/journal.pone.0010153.
XIAO Ying, WU Qiguo, YIN Zhiting, ZHOU Yiming, ZHOU Xiaoli, HU Zhongzhi
(School of Perfume and Aroma Technology, Shanghai Institute of Technology, Shanghai 201418, China)
Abstract: In the present study, we investigated the anti-aging effect of procyanidin B 2 in D-galactose-induced aging in mice and explored the changes of characteristic metabolites. Four week-old mice were used in this study and randomly divided into normal control group, D-galactose-induced aging group, and procyanidin B 2 group. After six weeks of administration,learning and memory capacity in each group were tested by open field maze, Y-maize and Morris water maze and total antioxidant capacity (T-AOC), superoxide dismutase (SOD) activity, glutathione peroxidase (GSH-Px) activity and malondialdehyde (MDA) content in the brain, liver and kidney of mice were evaluated. The metabolites were analyzed by liquid chromatography quadrupole-time-of-flight mass spectrometry (LC-Q-TOF-MS). The results showed that procyanidin B 2 improved learning capacity and it increased significantly T-AOC, SOD and GSH-Px activity, and decreased significantly the content of MDA in liver, brain and kidney tissues when compared with the aging model mice (P < 0.05). Moreover,procyanidin B 2 changed the levels of 17 characteristic metabolites, including pantothenic acid, pyruvic acid, linoleic acid,and alpha ketoglutarate, as detected by LC-Q-TOF-MS combined with multivariate statistical analysis. These results indicated that procyanidin B 2 was a potential nutrition supplement with anti-aging effect and its underlying mechanism may be associated with a series of metabolism pathways, such as glucose metabolism and lipid metabolism.
Keywords: procyanidin B 2 ; anti-aging; antioxidant; metabolomics
Metabonomics Study on Anti-aging Effect of Procyanidin B 2 in D-Galactose-Induced Aging in Mice
XIAO Ying, WU Qiguo, YIN Zhiting, et al. Metabonomics study on anti-aging effect of procyanidin B 2 in D-galactoseinduced aging in mice[J]. Food Science, 2018, 39(17): 134-139. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201817022. http://www.spkx.net.cn
文章编号: 1002-6630(2018)17-0134-06
引文格式: 肖瀛, 吴其国, 尹志婷, 等. 原花青素B 2 对D-半乳糖模型小鼠的代谢组学研究[J]. 食品科学, 2018, 39(17): 134-139.DOI:10.7506/spkx1002-6630-201817022. http://www.spkx.net.cn
中图分类号: TS201.4
文献标志码: A
第一作者简介: 肖瀛(1981—),男,副教授,博士,研究方向为分子与应用营养学、食品生物化学。E-mail:y-xiaomn@163.com
DOI: 10.7506/spkx1002-6630-201817022
基金项目: 国家自然科学基金青年科学基金项目(31401504)
(上海应用技术大学香料香精技术与工程学院,上海 201418)
收稿日期: 2017-07-27
摘 要: 为探究原花青素B 2 对D-半乳糖诱导的亚急性衰老模型小鼠的抗衰老作用及特征代谢产物的变化差异,将C57BL/6小鼠随机分为3组:对照组、模型组、原花青素B 2 组。采用旷场迷宫、Y型食物诱导型迷宫和Morris水迷宫检测各组小鼠的学习记忆能力,并测定小鼠肝、脑、肾中丙二醛(malondialdehyde,MDA)含量、总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)活力、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力,通过液相色谱-质谱联用技术寻找各组间代谢产物的差异。结果显示:原花青素B 2 能改善衰老小鼠的学习行为能力,在肝、脑、肾组织中,原花青素B 2 提高了T-AOC、SOD和GSH-Px活力,而显著降低了MDA的含量(P<0.05)。小鼠血浆代谢组学数据显示泛酸、丙酮酸、亚油酸、α-酮戊二酸、马尿酸等17 种标志性代谢产物含量发生变化,其抗衰老机制可能涉及糖代谢、脂类代谢等多条代谢通路。