王 璐,郜玉钢*,郭 阳,刘 杨,陈 思,臧 埔*,何忠梅,赵 岩,张连学
关键词: 人参发根;抗氧化;黑色素瘤;细胞凋亡;细胞周期
癌症严重威胁人类健康,每3 例确诊癌症病例中就有1 例是皮肤癌,全世界每年发生200多万例皮肤癌病例,其中恶性黑色素瘤的致死率极高 [1-2] 。紫外线的辐射是皮肤癌发生的重要因素之一 [3] 。随着臭氧层的破坏,越来越多的紫外线到达地面,研究表明人体长期暴露在紫外光,尤其是中波紫外线下,会引起皮肤衰老、DNA损伤、光老化甚至癌变 [4] 。人参皂苷可通过抑制自由基的生成,减少氧化损伤 [5] ,达到抗氧化、抗紫外线、抗肿瘤等作用 [6] 。但人参及其提取物中的重金属、农药和溶剂残留等会带来安全风险 [7] ,人参生长过程缓慢且大面积占用森林土地,为解决伐林栽参、老参地问题,科研人员以人参茎叶为外植体诱导出人参发根,工厂化生产人参皂苷 [8] 。目前人参发根研究多集中于发根诱导、培养条件优化、生产次生代谢产物 [9] ,鲜见人参发根对黑色素瘤的作用研究。本实验选择富含人参皂苷成分、而无农药、无重金属、质量稳定的生物反应器人参发状根及其培养液为原料 [10] ,对其进行抗氧化、抗黑色素瘤功效评价,以期为黑色素瘤的预防和治疗提供理论依据。
人参发根及其培养液由本实验室采用1/2 MS液体培养基,在25 ℃、110 r/min的恒温摇床中继代培养30 d所得。人参(Panax ginseng C. A. Mey.),为吉林抚松4 年生人参。
CuSO 4 、乙醇 北京化工厂;邻苯二酚紫 上海源叶生物科技有限公司;抗坏血酸、焦儿茶酚 国药集团化学试剂有限公司;总抗氧化能力检测试剂盒、细胞周期试剂盒 碧云天生物技术公司;人黑色素瘤细胞A375 北纳创联生物技术有限公司;DMEM培养基、胰蛋白酶 美国GE公司;胎牛血清 杭州四季青生物工程材料有限公司;细胞凋亡试剂盒 美国BD公司;其他试剂均为国产分析纯。
LC-2010A高效液相色谱仪(配有LC-2010A型液相色谱泵、LC-2010A型自动进样器、CLASS-VP色谱工作站) 日本岛津公司;Infinite Pro 200全波长酶标仪瑞士TECAN公司;HHS-6s电子恒温水浴锅 余姚市上通温控仪表厂;101A-2E烘箱 上海实验仪器厂有限公司;GXZ智光照培养箱 宁波江南仪器厂;Guava ® easyCyte流式细胞仪 德国默克密理博公司;E000327 CO 2 培养箱 青岛Haier公司。
1.3.1 细胞培养及样品溶液的制备
于150 mL发根培养瓶中加入50 mL pH 6.0的1/2 MS液体培养基,每瓶接种1 g鲜人参发根,30 d继代培养1 次,第30天取鲜人参发根10 g与培养液以1∶6(m/V)匀浆,于烘箱中60 ℃烘至质量恒定,待降至室温,置于-20 ℃储存备用,培养液匀浆人参发根用FG表示。
精确称取FG粉、人参粉0.5 g于10 mL离心管中,加入5 mL体积分数70%乙醇溶液超声108 min,离心取上清液,稀释至系列梯度质量浓度,做抗氧化能力测定,其余挥干乙醇,干燥至质量恒定,密封冷藏以备后续实验用。
人黑色素瘤细胞A375用含10%胎牛血清的DMEM培养基,于37 ℃、5% CO 2 培养箱中培养,液氮中冻存。
醇提的FG、人参(用RS表示)及达卡巴嗪(用DK表示)分别用DMEM培养基溶解后稀释成100、200、400、600、800 µg/mL的含药培养液。
1.3.2 人参皂苷含量的测定
取FG粉0.5 g加入5.0 mL色谱甲醇溶液,室温下超声提取30 min,4 000 r/min离心20 min,取上清液过0.45 µm滤膜备用 [11] 。每个样品设3 个平行。色谱条件参照本实验室建立的同时测定20 种人参皂苷的方法 [12] 。
1.3.3 Cu 2+ 螯合能力的测定
取160 μL 0.1 mg/mL CuSO 4 溶液,加入40 μL 4 mmol/L的邻苯二酚紫溶液,再加入80 μL不同质量浓度的样品溶液后混匀,室温反应20 min后于632 nm波长处测吸光度。以同质量浓度VC作为阳性对照,实验重复3 次 [13-14] 。螯合率根据下式计算。
式中:A i 为加入样品的反应液吸光度;A 0 为用醇替代样品的反应液吸光度;A 1 为样品对照组的吸光度。
1.3.4 PPO活力的测定
准确量取100 µL pH 7.4磷酸盐缓冲液,向其中缓慢加入50 µL 2 mol/L的焦儿茶酚溶液,混匀后,置于37 ℃恒温培养箱预热15 min后加入50 µL各个质量浓度的样品、对照品溶液,于525 nm波长处分别测定第0、0.5、1.0分钟时的吸光度。定义1 min内1 g人参发根样品使A 525 nm 改变0.01为1 个多酚氧化酶(polyphenol oxidase,PPO)活力单位 [15] 。
1.3.5 总抗氧化能力的测定
根据总抗氧化能力检测试剂盒建立FeSO 4 ·7H 2 O标准曲线,求出线性回归方程。用试剂盒对人参发根的总抗氧化能力在593 nm波长处进行测定,OD值代入回归方程求出FG的抗氧化能力 [16-17] 。
1.3.6 流式细胞术检测黑色素瘤细胞A375凋亡
根据细胞凋亡检测试剂盒说明书,将对数期的A375细胞以1×10 6 个/mL,接种于6 孔板内加药孵育24 h收集细胞,加V-FITC孵育15 min取1×10 4 个细胞用配有GuavaSoft 3.1系统的流式细胞仪对每个样品进行分析。
1.3.7 流式细胞术检测细胞周期分布
根据细胞周期试剂盒说明书,将对数期的A375细胞以1×10 6 个/mL,接种于6 孔板内加药孵育24 h收集细胞,于预冷体积分数70%乙醇溶液中4 ℃固定过夜。PI染色后,重悬细胞,37 ℃避光温浴30 min。用配有GuavaSoft 3.1系统的流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况。对细胞DNA含量和光散射进行分析。
用SPSS 17.0软件进行ANOVA单因素方差分析,数据用 ±s表示,并进行Duncans’差异显著性分析,以P<0.05表示差异显著。
表1 FG中20 种人参皂苷单体含量
Table 1 Contents of 20 ginsenosides in ginseng hairy root culture


图1 FG高效液相色谱图
Fig. 1 High performance liquid chromatogram of ginsenosides in ginseng hairy root culture
如表1、图1所示,采用20 种皂苷含量测定方法对FG进行测定,共检测出13 种人参皂苷。Rg1、Re含量较高,皂苷含量加和值为(0.160 7±0.011 0)%。

图2 FG及VC对Cu 2+ 螯合率
Fig. 2 Cu 2+ -chelating rates of VC and ginseng hairy root culture
如图2所示,VC的Cu 2+ 螯合率先增加后缓慢降低,FG对Cu 2+ 的螯合率随着质量浓度的增大显著增加(P<0.05),其中40 mg/mL时螯合率已达到50.73%,100 mg/mL时螯合率为66.51%,显著高于FG的其他组(P<0.05),虽低于同质量浓度的VC,但差异不显著(P>0.05)。

图3 多酚氧化酶活力
Fig. 3 Polyphenol oxidase activity in the presence of VC or ginseng hairy root culture
如图3所示,在PPO活力测定中VC与FG呈现相同趋势,酶活力随着质量浓度的增加逐步提高,呈现较好的量效关系。在5、10、20 mg/mL时FG活力均显著低于同质量浓度VC(P<0.05),40、60、80、100 mg/mL时FG的PPO活力分别为2.19、3.36、4.66、5.16 U/g,低于同质量浓度VC,但差异不显著(P>0.05)。

图4 FG总抗氧化能力
Fig. 4 Total antioxidant capacity of ginseng hairy root culture
参照总抗氧化能力试剂盒说明书建立FeSO 4 ·7H 2 O标准曲线,线性回归方程:y=3.169 8x-0.284 97,吸光度在0.13~0.55范围内线性关系良好R 2 =0.997 2。如图4所示,在发根的总抗氧化能力测定中,随着质量浓度的增大抗氧化能力逐渐增加,除10 mg/mL与20 mg/mL总抗氧化能力差异不显著外,其余各组间均差异显著(P<0.05),当质量浓度升高到100 mg/mL时,FG的总抗氧化能力高达0.877 4 mmol FeSO 4 /g,显著高于其他组(P<0.05)。



图5 FG对黑色素瘤细胞A375凋亡图
Fig. 5 Flow cytometric analysis of apoptosis in A375 cells exposed to ginseng hairy root culture
表2 FG对黑色素瘤细胞A375凋亡的影响
Table 2 Effect of ginseng hairy root culture on apoptosis in A375 cells

注:同列相同质量浓度不同处理组肩标小写字母不同表示差异显著(P<0.05)。
由图5、表2可知,不同质量浓度(200、400、600 µg/mL)的FG、RS、DK对A375细胞的增殖具有明显的抑制作用,且随药物质量浓度的增加,细胞的抑制率明显增加,呈剂量依赖性。200 µg/mL时FG组的早期凋亡率显著高于RS组、DK组(P<0.05);400 µg/mL时FG组早期凋亡与DK组差异不显著,晚期凋亡与RS差异不显著(P>0.05);600 µg/mL FG组晚期凋亡率显著高于RS组、DK组(P<0.05),RS组与DK组早期凋亡显著高于FG(P<0.05)。
表3 FG对A375细胞周期的影响
Table 3 Effect of ginseng hairy root culture on cell cycle in A375 cells

注:*.与对照组相比差异显著(P<0.05);同列相同质量浓度肩标小写字母不同表示差异显著(P<0.05)。
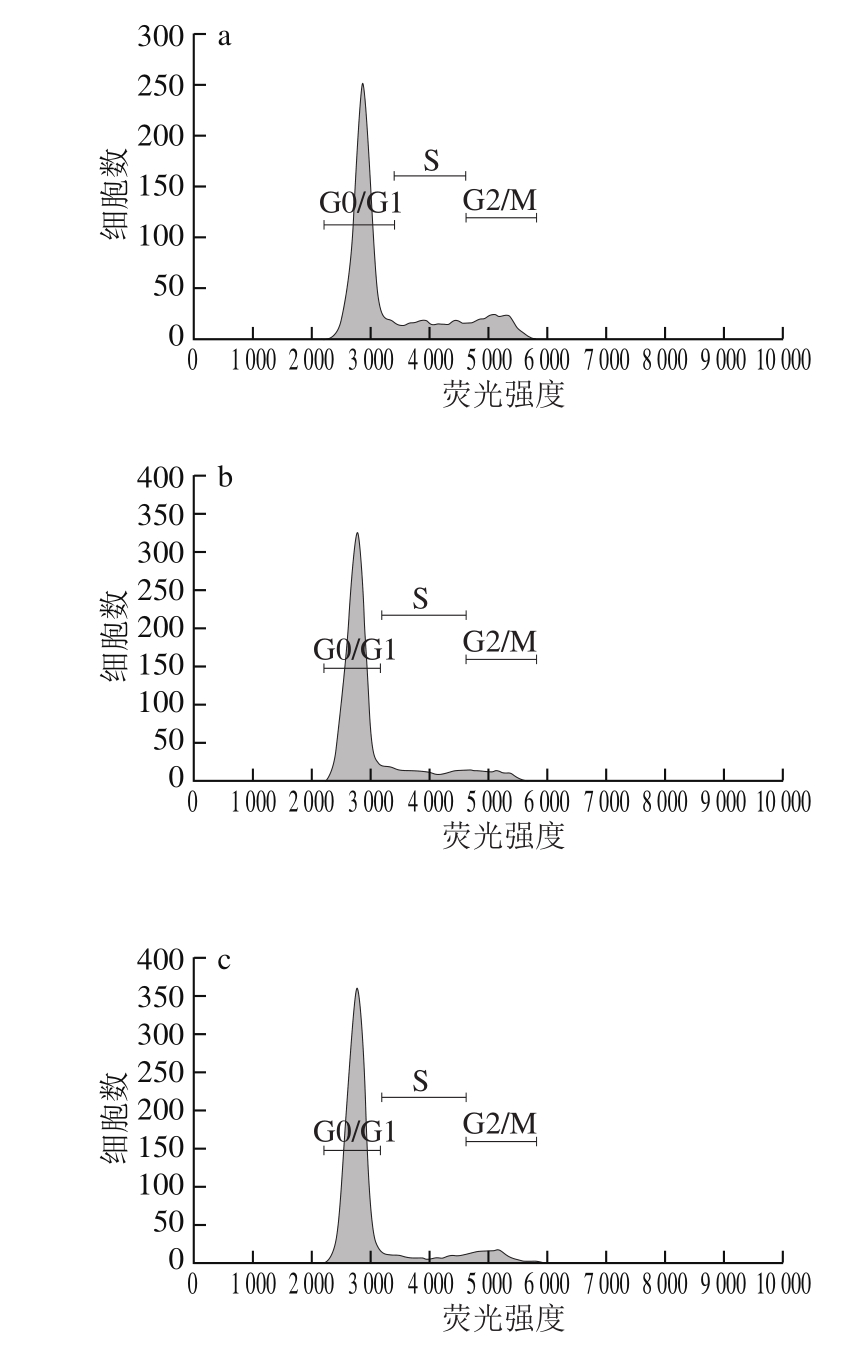
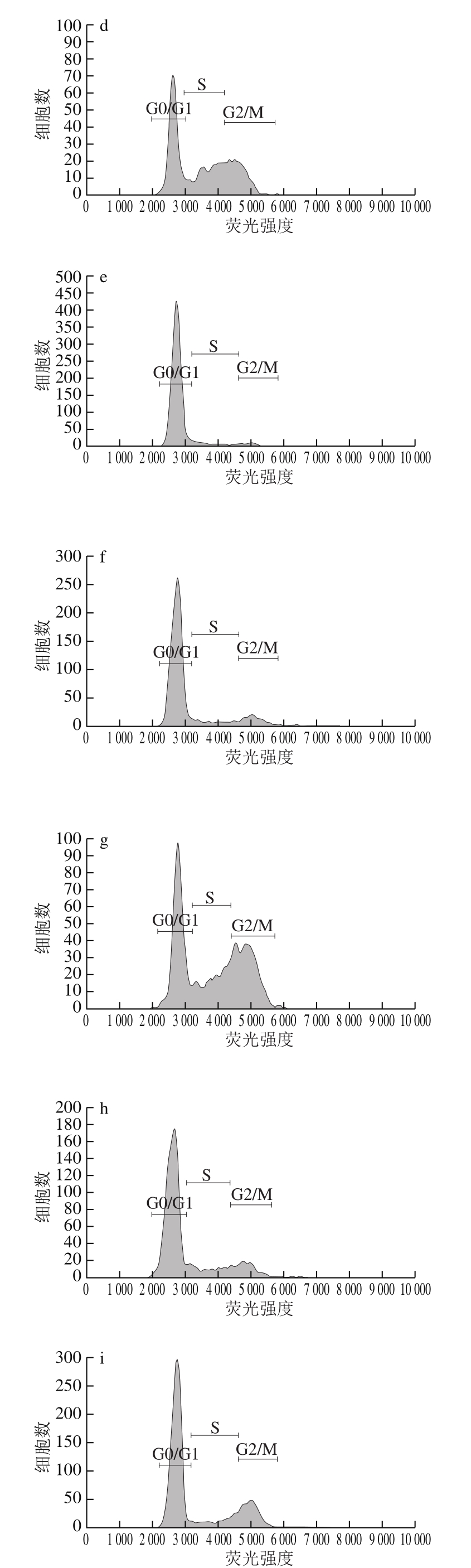

图6 FG对A375细胞周期图
Fig. 6 Flow cytometric analysis of cell cycle in A375 cells
如表3、图6所示,200 µg/mL时FG组、DK组与对照组相比G0/G1期细胞比例降低,G2/M期细胞比例增加,说明200 µg/mL时FG、DK可将细胞阻滞在G2/M期。400 µg/mL时与对照组相比,FG组S期细胞比例显著增加,FG、RS、DK组G2/M期细胞比例显著增加,说明400 µg/mL时FG可将细胞阻滞于S、G2/M期,RS、DK可将细胞阻滞于G2/M。600 µg/mL时FG、RS、DK组与对照组相比G0/G1期细胞比例显著降低,S、G2/M期细胞比例显著增加,S期DK细胞比例最高,G2/M期RS细胞比例最高,FG的S、G2/M期细胞比例为29.82%、28.70%,显著高于对照组。说明600 µg/mL时FG、RS、DK可将A375细胞阻滞于S期、G2/M期,进而诱导细胞凋亡。
人体长期暴露在紫外光下,尤其是中波紫外线,会引起皮肤过敏、衰老、DNA损伤、光老化甚至癌变。黑色素瘤是一种侵袭性皮肤癌,传统疗法对其无效 [18] 。主要由紫外线辐射使皮肤层产生黑色素,黑色素在合成过程中产生的亲氧化状态使其易受到氧化应激,氧化应激水平升高导致细胞的生长、分裂失控,入侵临近的机体组织而成癌 [19] 。氧化应激能诱导DNA、蛋白质、线粒体等细胞成分损伤并影响细胞内信号转导途径 [20-21] 。线粒体为细胞中水平最高的抗氧化剂,在维护细胞的氧化还原状态中起着重要的作用 [22] 。研究报道黑色素瘤的发生都伴有抗氧化酶活性降低或其表达下调、氧化与抗氧化作用失衡 [23-24] 。抗氧化酶可保护细胞免受氧化应激损伤,抗氧化酶活性和表达的失调与黑色素瘤发生密切相关,是黑色素瘤发生发展的重要影响因素 [25-26] 。人参 [27-28] 、人参发根 [29] 抗氧化活性显著。而关于FG的抗氧化能力未知,因此选用Cu 2+ 、PPO、总抗氧化能力3 种方法对FG的抗氧化能力进行测定。由实验结果可知随着质量浓度的增大,FG的Cu 2+ 螯合率逐渐接近VC,在100 mg/mL时FG的Cu 2+ 螯合率达到66.5%与VC差异不显著;FG与VC有相同的酶活力清除趋势,大于40 mg/mL时两者差异不显著;FG的总抗氧化能力在100 mg/mL时达到0.877 4 mmol FeSO 4 /g。
研究发现,中草药提取物产生抗肿瘤作用的主要机制是阻滞细胞周期、诱导细胞凋亡,在肿瘤细胞中细胞周期阻滞能够抑制细胞增殖和诱导细胞凋亡 [30] 。主要抑制细胞周期蛋白、细胞周期蛋白依赖性蛋白激酶及其抑制因子等3大类与细胞周期有关的分子的表达对细胞进行调控,从而诱导细胞周期阻滞并抑制肿瘤细胞增殖 [31] 。主要表现为药物作用于细胞干预DNA复制或者造成DNA损伤及有丝分裂所必需的蛋白质合成,细胞周期进程就会发生停滞,若不能及时进行修复,就会抑制细胞增殖,甚至诱导细胞产生凋亡 [32] 。与对照组相比,FG组、RS组、DK组均出现明显的凋亡细胞,FG组较RS组、DK组晚期凋亡率高,这种作用可能是将皮肤癌细胞周期阻滞在S、G2/M期实现的。人参发根与人参具有相似的化学成分 [33-34] ,可通过减少氧化损伤、阻滞细胞周期进程、诱导黑色素瘤细胞凋亡产生抗皮肤癌作用,其具体促凋亡机制有待进一步研究。综上,人参发根具有抗氧化、抗黑色素瘤作用。本研究为人参发根产品开发提供了理论依据。
参考文献:
[1] 王雪, 黄文华, 张晶, 等. 抗黑色素瘤天然药物的研究进展[J]. 现代药物与临床, 2013, 28(1): 83-89. DOI:10.7501/j.issn.1674-5515.2013.01.023.
[2] 张苹, 袁凤. 紫外线辐射的危害: 欧盟有关日光浴床安全的标准与法规[J]. 中国个体防护装备, 2010(3): 39-42. DOI:10.16102/j.cnki.cppe.2010.03.007.
[3] BORG M, BRINCAT S, CAMILLEIRI G, et al. The role of cytokines in skin aging[J]. Climacteric, 2013, 16: 514-521. DOI:10.3109/13697137.2013.802303.
[4] JENKINS G. Molecular mechanisms of skin ageing[J]. Mechanisms of Ageing and Development, 2002, 123(7): 801-810. DOI:10.1016/S0047-6374(01)00425-0.
[5] 王涵, 赵雨, 刘海龙, 等. 不同生长时期人参叶中多酚氧化酶等几种氧化还原酶活力变化研究[J]. 辽宁中医杂志, 2013, 40(8): 1676-1678. DOI:10.13192/j.ljtcm.2013.08.178.wangh.080.
[6] 罗敏, 舒磊, 李映莹, 等. 人参总皂苷在实验性肺纤维化小鼠中的抗氧化损伤作用[J]. 中国药理学与毒理学杂志, 2016, 30(5): 511-516.DOI:10.3867/j.issn.1000 -3002.2016.05.005.
[7] 陈静. 人参提取物中残留农药和重金属的测定方法研究[D]. 沈阳:沈阳药科大学, 2008: 5-12.
[8] 李昌禹. 人参发根诱导及高产发根无性系的筛选研究[D]. 北京: 中国农业科学院, 2003: 38-39.
[9] 赵寿经, 蒋磊, 李军华, 等. 高产人参发根系的建立及发根中皂苷Rb1的分离纯化[J]. 吉林大学学报, 2006, 36(4): 622-627.DOI:10.13229/j.cnki.jdxbgxb2006.04.038.
[10] 王璐, 郜玉钢, 王佳宁, 等. 人参属药用植物鉴定技术研究进展[J]. 时珍国医国药杂志, 2017, 28(3): 694-696. DOI:10.3969/j.issn.1008-0805.2017.03.068.
[11] 董妍, 郜玉钢, 赵岩, 等. 糖水煎煮对人参化学成分的影响[J]. 食品科学, 2016, 37(12): 110-116. DOI:10.7506/spkx1002-6630-201612019.
[12] 杨艳文, 孟凡双, 郜玉钢, 等. 高效液相色谱法同时测定人参制剂中20 种人参皂苷方法的建立[J]. 食品科学, 2016, 37(22): 131-135.DOI:10.7506/spkx1002-6630-201622019.
[13] WU W, HUA Y F, LIN Q L. Effects of oxidative modification on thermal aggregation and gel properties of soy protein by malondialdehyde[J]. Journal of Food Science and Technology, 2014,51(3): 485-493. DOI:10.1007/s13197-011-0533-7.
[14] 刘红开, 李放, 张亚宏, 等. 不同品种蚕豆种皮中膳食纤维的提取工艺优化及其理化特性[J]. 食品科学, 2016, 37(16): 22-28.DOI:10.7506/spkx1002-6630-201616004.
[15] 邢楠楠. 人参10 种氧化还原酶的活力研究[D]. 长春: 长春中医药大学, 2011: 24-26.
[16] 周瑞. 4 种滋阴类中药对人参质效的影响及其产品的研制[D]. 长春:吉林农业大学, 2016: 31-33.
[17] CHUNG I M, SIDDIQUI N A, KIM S H, et al. New constituents triterpene ester and sugar derivatives from Panax ginseng Meyer and their evaluation of antioxidant activities[J]. Saudi Pharmaceutical Journal, 2017, 25(5): 801-812. DOI:10.1016/j.jsps.2016.12.002.
[18] OLIVEIRA S, COELHO P, PRUDENCIO C, et al. Melanoma and obesity: should antioxidant vitamins be addressed?[J]. Life Sciences,2016, 165: 83-90. DOI:10.1016/j.lfs.2016.09.015.
[19] BURGEIRO A, BENTO A C, GAJATE C, et al. Rapid human melanoma cell death induced by sanguinarine through oxidative stress[J]. European Journal of Pharmacology, 2013, 705(1/2/3): 109-118. DOI:10.1016/j.ejphar.2013.02.035.
[20] VAN VELZEN L S, WIJDEVELD M, BLACK C N, et al. Oxidative stress and brain morphology in individuals with depression, anxiety and healthy controls[J]. Progress in Neuro-Psychopharmacology &Biological Psychiatry, 2017, 76(2): 140-144. DOI:10.1016/j.pnpbp.2017.02.017.
[21] ZHAO W W, FENG H T, SUN W, et al. Tert-butyl hydroperoxide(t-BHP) induced apoptosis and necroptosis in endothelial cells: roles of NOX4 and mitochondrion[J]. Redox Biology, 2017, 11: 524-534.DOI:10.1016/j.redox.2016.12.036.
[22] DIKALOV S. Cross talk between mitochondria and NADPH oxidases[J]. Free Radical Biology & Medicine, 2011, 51(7): 1289-1301. DOI:10.1016/j.freeradbiomed.2011.06.033.
[23] LIU G S, WU J C, TSAI H E, et al. Proopiomelanocortin gene delivery induces apoptosis in melanoma through NADPH oxidase 4-mediated ROS generation[J]. Free Radical Biology and Medicine, 2014, 70(5):14-22. DOI:10.1016/j.freeradbiomed.2013.12.024.
[24] BALDEA I, OLTEANU D E, BOLFA P, et al. Efficiency of photodynamic therapy on WM35 melanoma with synthetic porphyrins:role of chemical structure, intracellular targeting and antioxidant defense[J]. Journal of Photochemistry & Photobiology B Biology,2015, 151: 142-152. DOI:10.1016/j.jphotobiol.2015.07.019.
[25] 阿萨. 白藜芦醇通过调节抗氧化酶活性而呈现抗肿瘤效应[D].长沙: 中南大学, 2013: 4-5.
[26] TONG L Y, CHUANG C C, WU S Y, et al. Reactive oxygen species in redox cancer therapy[J]. Cancer Letters, 2015, 367(1): 18-25.DOI:10.1016/j.canlet.2015.07.008.
[27] BAEK K S, YI Y S, SON Y J, et al. Comparison of the anti-cancer activities of Korean Red Ginseng-derived fractions[J]. Journal of Ginseng Research, 2017, 41 (3): 386-391. DOI:10.1016/j.jgr.2016.11.001.
[28] OH M J, KIM H J, PARK E Y, et al. The effect of Korean Red Ginseng extract on rosiglitazone-induced improvement of glucose regulation in diet-induced obese mice[J]. Journal of Ginseng Research, 2017, 41(1):52-59. DOI:10.1016/j.jgr.2015.12.011.
[29] 刘峻, 丁家宜, 周倩耘. 人参毛状根培养过程中对活性氧清除能力的动态变化[J]. 植物资源与环境学报, 2002, 11(4): 22-24.DOI:10.3969/j.issn.1674-7895.2002.04.005.
[30] 杨志杰, 李秀丽. 中医药诱导细胞凋亡治疗恶性肿瘤的研究进展[J]. 中医学报, 2013, 28(1): 18-20. DOI:10.16368/j.issn.1674-8999.2013.01.027.
[31] 杨历辉, 李东霞, 苏依拉, 等. 小檗碱对人皮肤黑素瘤A375细胞周期相关miRNA的影响[J]. 中国皮肤性病学杂志, 2016, 30(11): 1123-1126; 1134. DOI:10.13735/j.cjdv.1001-7089.201605119.
[32] KARAMITOPOULOU E, RENTSCH C A, MARKWALDER R,et al. Prognostic significance of apoptotic cell death in bladder cancer: a tissue microarray study on 179 urothelial carcinomas from cystectomy specimens[J]. Pathology, 2010, 42(1): 37-42.DOI:10.3109/00313020903434397.
[33] WOO S S, SONG J S, LEE J Y, et al. Selection of high ginsenoside producing ginseng hairy root lines using targeted metabolic analysis[J]. Phytochemistry, 2004, 65(20): 2751-2761. DOI:10.1016/j.phytochem.2004.08.039.
[34] LI J X, LIU S J, WANG J, et al. Fungal elicitors enhance ginsenosides biosynthesis, expression of functional genes as well as signal molecules accumulation in adventitious roots of Panax ginseng C. A.Mey[J]. Journal of Biotechnology, 2016, 239: 106-114. DOI:10.1016/j.jbiotec. 2016.10.011.
WANG Lu, GAO Yugang*, GUO Yang, LIU Yang, CHEN Si, ZANG Pu*, HE Zhongmei, ZHAO Yan, ZHANG Lianxue
(College of Traditional Chinese Medicine, Jilin Agricultural University, Changchun 130118, China)
Abstract: The antioxidant capacity of Panax ginseng hairy root culture homogenate was measured by Cu 2+ chelating ability, polyphenol oxidase activity and total antioxidant capacity assays, and its antimelanoma activity was evaluated by determining the cell apoptosis and cycle in melanoma cells A375 using flow cytometry. The results showed that the ginseng hairy root culture had Cu 2+ chelating ability in a concentration-dependent manner, which was not significantly different from that of VC at a concentration of 100 mg/mL (P > 0.05). No significant difference in polyphenol oxidase activity was found between the presence of the homogenate and VC at 40, 60, 80 and 100 mg/mL (P > 0.05). The total antioxidant capacity of the homogenate was concentration dependent, 0.877 4 mmol FeSO 4 /g at 100 mg/mL. Compared with the control group, the ginseng hairy root culture significantly increased the cell apoptosis rate (P < 0.05), improved the percentage of cells in the S and G2/M phases and decreased the percentage of cells in the G0/G1 phase. These findings led to the conclusion that Panax ginseng hairy root has antioxidant and antimelanoma effects.
Keywords: ginseng hairy root; antioxidant activity; melanoma; cell apoptosis; cell cycle
Antioxidant and Antimelanoma Capability of Ginseng Hairy Root Culture
WANG Lu, GAO Yugang, GUO Yang, et al. Antioxidant and antimelanoma capability of ginseng hairy root culture[J]. Food Science,2018, 39(17): 152-158. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201817025. http://www.spkx.net.cn
文章编号: 1002-6630(2018)17-0152-07
引文格式: 王璐, 郜玉钢, 郭阳, 等. 培养液匀浆人参发根抗氧化、抗黑色素瘤作用[J]. 食品科学, 2018, 39(17): 152-158.DOI:10.7506/spkx1002-6630-201817025. http://www.spkx.net.cn
中图分类号: R285.5
文献标志码: A
臧埔(1970—),女,副教授,硕士,研究方向为中药生物技术。E-mail:zangpu@163.com
DOI: 10.7506/spkx1002-6630-201817025
*通信作者简介: 郜玉钢(1969—),男,教授,博士,研究方向为生药学。E-mail:gaoyugang_2006@163.com
基金项目: “十三五”国家重点研发计划重点专项(2016YFC0500300);吉林省科技厅科技发展计划项目(20160307005YY;20170204017YY);公益性行业(农业)科研专项(201303111);国家级大学生创新创业项目(201610193027)
第一作者简介: 王璐(1992—),女,硕士研究生,研究方向为药理学。E-mail:wl19921913@163.com
(吉林农业大学中药材学院,吉林 长春 130118)
收稿日期: 2017-04-25
摘 要: 以培养液匀浆人参发根为实验材料,选用Cu 2+ 螯合能力、多酚氧化酶活力、总抗氧化能力3 种方法对其抗氧化能力进行测定;采用流式细胞术对黑色素瘤细胞A375凋亡、细胞周期进行测定。结果表明:随着质量浓度的增大,培养液匀浆人参发根的Cu 2+ 螯合率逐渐提高,在100 mg/mL时与VC差异不显著(P>0.05);40、60、80、100 mg/mL时培养液匀浆人参发根与VC的多酚氧化酶活力差异不显著(P>0.05);培养液匀浆人参发根的总抗氧化能力具有质量浓度依赖性,在100 mg/mL时达到0.877 4 mmol FeSO 4 /g。与对照组相比培养液匀浆人参发根组细胞凋亡显著(P<0.05);S、G2/M期比例升高,G0/G1期比例下降。结论:人参发根具有抗氧化、抗黑色素瘤作用。