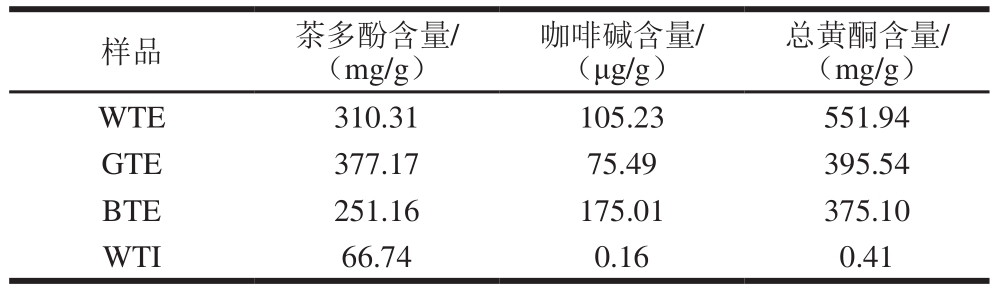
表1 WTE、GTE、BTE和WTI主要功效成分
Table 1 Major bioactive components in WTE, GTE, BTE and WTI
郑 丽 1 ,侯彩云 1,2, *,任发政 2
关键词: 白茶;红茶;绿茶;高脂饮食;预防肥胖;安全性
近年,静态生活方式和高脂饮食模式使得肥胖症发生率在世界范围内不断增加。肥胖可引起的糖脂代谢异常,与心脑血管疾病、Ⅱ型糖尿病、骨关节炎、多种癌症和哮喘等的发生密切相关 [1-2] ,严重威胁人类的身体健康。自然界存在多种具有减肥功效的天然植物 [3-4] ,其中,茶叶含有丰富的活性物质,具有减肥、改善脂代谢的生理活性 [5-7] 。有关绿茶、红茶、黑茶和乌龙茶的减肥功效研究较多 [8-9] 。民间也盛传白茶具有降压减脂、解油腻过多和缓解消化功能障碍等保健功能,但没有足够科学文献的支持。基于对白茶是否能预防高脂饮食诱导的肥胖发生,以及如果白茶具有预防肥胖功效,其与绿茶和红茶的效果又有何区别的疑问,本研究选取安吉白茶、白琳工夫和寿眉分别作为白茶、红茶和绿茶的代表,通过动物实验,对此3 种茶叶提取物和白茶茶汤的预防肥胖功效及其安全性进行评价和对比。
SPF级雄性C57BL/6J小鼠(许可证号SCXK(京)2012-0001) 北京维通利华实验动物技术有限公司;小鼠维持饲料、小鼠60 kcal%高脂营养饲料(许可证号SCXK(京)2014-0008) 北京华富康生物科技股份有限公司。
选取市售安吉白茶、寿眉和白琳工夫茶作为白茶、绿茶和红茶代表,制备茶叶提取物。
异丙醇、氯仿、无水乙醇(分析纯) 北京化工厂;DEPC水 北京索莱宝科技有限公司;TRIzol试剂 碧云天生物技术研究所;5×All-In-One RT MasterMix试剂盒、EvaGreen 2×qPCR MasterMix-No Dye试剂盒 美国ABM公司;小鼠GAPDH内参引物 生工生物工程(上海)股份有限公司。
FA2004分析天平 上海精密科学仪器有限公司;中药超细粉碎机 温岭市迈邦机械设备有限公司;DHG-9070A型电热恒温鼓风干燥箱 上海一恒科技有限公司;SHZ-III循环水真空泵、RE-52AA真空旋转蒸发仪上海振捷实验设备有限公司;Nanodrop 2000核酸蛋白检测仪 美国Thermo Fisher公司;T-personal梯度聚合酶链式反应(polymerase chain reaction,PCR)仪德国Biometra公司;LightCycler 96荧光定量PCR仪瑞士Roche公司;54180R低温超速离心机 德国Eppendorf公司;LX-200掌式离心机 海门市其林贝尔仪器;制冰机 北京天林恒泰科技有限公司;双人单面超净工作台 北京东联哈尔仪器制造有限公司。
1.3.1 提取物与茶汤制备
将茶叶用中药粉碎机磨碎并过40 目筛备用,精确称取粉碎茶样。参考保健食品功能学评价程序与检验方法规范中对动物实验受试物的制备方法 [10] ,按照1∶15(V/V)茶水比,95 ℃水浴浸提30 min,过滤,浸提两次,合并茶汤冷却至约50~60 ℃后,58 ℃旋转蒸发浓缩,真空冷冻干燥36 h得到绿茶提取物(green tea extract,GTE)、红茶提取物(black tea extract,BTE)和白茶提取物(white tea extract,WTE),密封包装,-20 ℃保存备用。精确称取茶样,按照3 g/400 mL加入沸水,冲泡10 min,过滤,冷却至室温得到白茶茶汤(white tea infusion,WTI)。WTE、GTE、BTE和WTI主要功效成分见表1。
表1 WTE、GTE、BTE和WTI主要功效成分
Table 1 Major bioactive components in WTE, GTE, BTE and WTI

1.3.2 实验动物分组与饲养
小鼠于标准条件动物房(温度(23±2)℃、相对湿度(50±5)%、压差20~50 Pa、12/12 h光暗循环)适应性喂养7 d后,按照体质量随机分为6 组:正常对照组(NC)、模型对照组(HC)、GTE干预组(GTE)、BTE干预组(BTE)、WTE干预组(WTE)和WTI干预组(WTI)。NC组给予繁殖饲料,HC组给予60%高脂饲料构建肥胖模型,以最终体质量均值比NC组小鼠高20%为造模成功,其余各组小鼠均给予60%高脂饲料。按照0.2 mL/10 g的灌胃量 [11] ,HC组和WTI组以蒸馏水灌胃,GTE、BTE和WTE组以相当茶叶剂量的GTE、BTE和WTE灌胃,WTI组以茶汤代替饮水。茶汤每日一换,灌胃时间固定为晚上8:00。
剂量设置:茶叶人体推荐剂量为60 kg标准体质量成人每日9.0 g,即0.15 g/kg [12] 。参照保健食品功能学评价程序与检验方法规范,设置人体推荐量的10 倍为小鼠摄入剂量,查黄继汉等 [13] 的剂量折算表,得小鼠和人的剂量换算系数为0.081,按照小鼠日饮水量4~7 mL [14] ,得小鼠茶汤摄入质量浓度为3 g/400 mL。
表2 实验动物分组
Table 2 Grouping of experimental animals

1.3.3 样品采集和检测
1.3.3.1 常规指标检测
每周测量体质量和摄食量,实验结束后,按照繁殖饲料14.57 kJ/g和高脂饲料21.93 kJ/g计算各组的总能量摄入量。准确称量附睾脂肪、肾周脂肪及皮下脂肪组织湿质量。
1.3.3.2 组织病理学观察
切取肝脏同叶组织、皮下脂肪组织各约0.5 cm 3 ,迅速置于组织固定液,固定48 h,常规石蜡包埋,切片,苏木精-伊红染色,显微镜观察肝脏组织的脂肪沉积情况,观察脂肪细胞形态及其脂肪积累情况,应用Image-Pro Plus 6.0软件于200 倍视野下统计皮下脂肪细胞直径。
1.3.3.3 生化指标检测
血样经4 ℃、5 000 r/min离心15 min,分离血清样本,全自动生化分析仪测定血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白-胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白-胆固醇(low-density lipoprotein cholesterol,LDL-C)水平,谷丙转氨酶(alanine transferase,ALT)、谷草转氨酶(aspartate transaminase,AST)活力,按试剂盒说明书要求进行测定。
1.3.3.4 实时荧光定量PCR检测
TRIzol试剂抽提小鼠肝脏总RNA,检测RNA浓度及质量,反转录制备cDNA第一链。PCR体系(20 μL):EvaGreen 2× qPCR MasterMix-No Dye10 μL、cDNA模板1 μL、上游引物(10 nmol/L)0.6 μL、下游引物(10 nmol/L)0.6 μL、ddH 2 O补充至20 μL。按照梯度程序:95 ℃ 10 min;95 ℃ 15 s;60 ℃ 60 s,循环35 次。以GAPDH为内参基因,采用delta delta Ct法 [15] 对各脂代谢相关基因的表达水平进行分析。
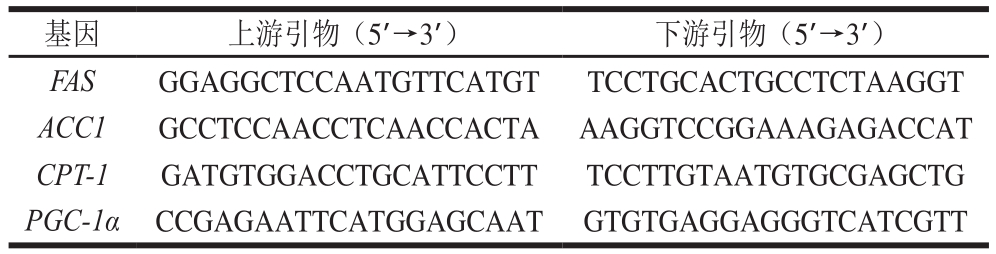
脂肪酸合成酶(fatty acid synthase,FAS)、乙酰辅酶-A羧化酶1(acetyl-coenzyme A carboxylase 1,ACC1)、肝脏肉毒碱棕榈酰基转移酶-1(carnitine palmitoyl transferase 1,CPT-1)和过氧化物酶体增殖物激活受体γ辅激活因子-1α(peroxisome proliferative activated receptor γ coactivator-1α,PGC-1α)基因引物由Primer premier 5.0软件设计,引物序列如表3所示,由生工生物工程(上海)股份有限公司合成。
表3 引物序列
Table 3 Primer sequences
实验数据均采用SPSS 18.0统计软件进行统计学处理,以 ±s表示;方差分析采用LSD或Tamhane’s T2(M)方法检测,P<0.05定义为差异显著。图像采用Origin 8.0软件进行处理。
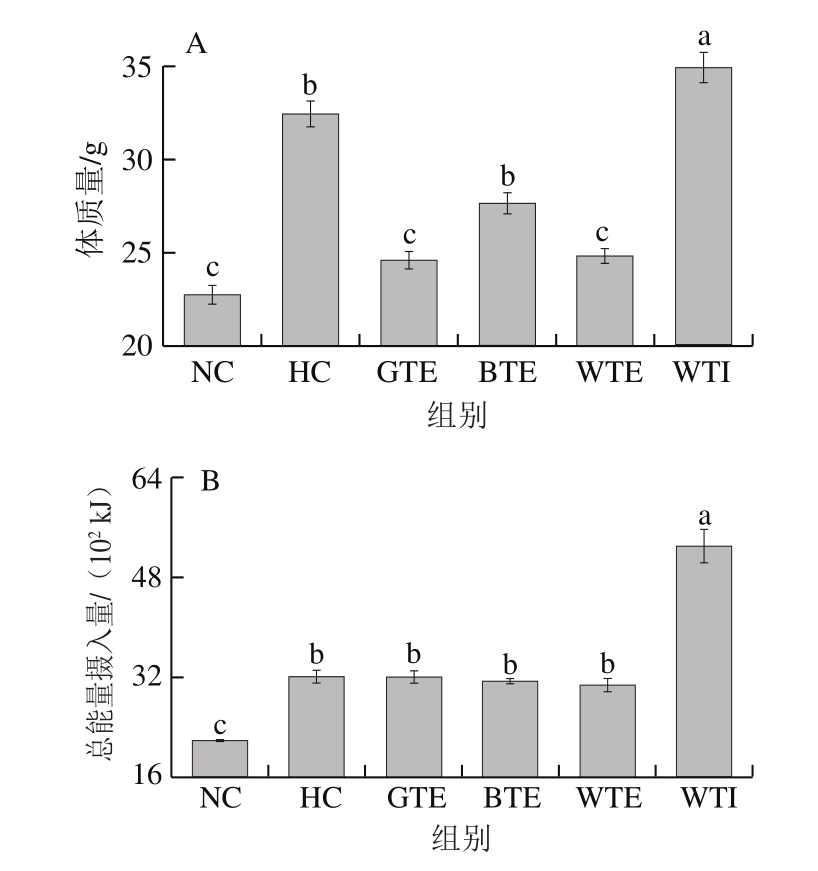
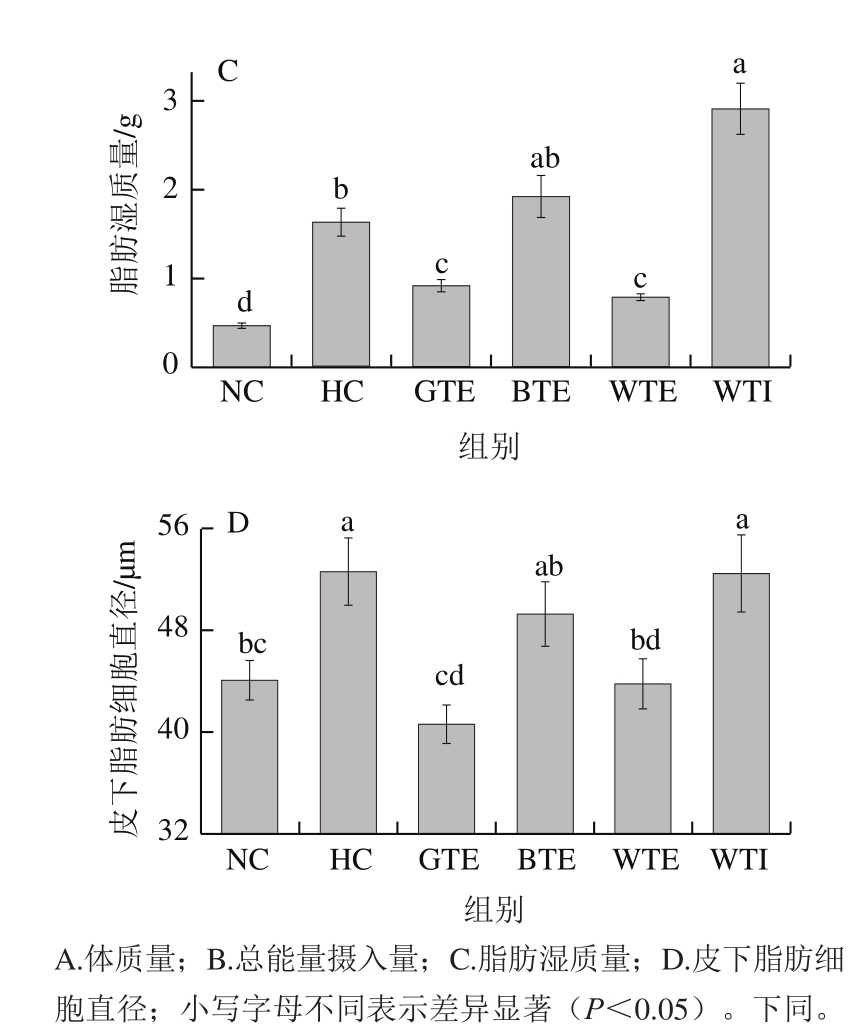
图1 GTE、BTE、WTE与WTI对小鼠体质量和脂肪组织的影响
Fig. 1 Effects of GTE, BTE, WTE and WTI on body mass, total energy intake, wet mass of adipose tissue and subcutaneous adipocyte diameter of mice in each experimental group
如图1A所示,实验初始,各组小鼠体质量无显著性差异(P>0.05)。8 周实验结束时,HC组小鼠体质量平均值(32.4 g)高出NC组(22.7 g)42.72%,并显著高于GTE、BTE和WTE干预组小鼠体质量平均值(分别为24.59、27.63、24.85 g),成功建立预肥胖模型。
对小鼠摄食量进行分析发现,除WTI组外,其余各组小鼠食欲均无显著性差别(图未列出),这导致高脂饮食的HC、GTE、BTE和WTE组小鼠的总能量摄入量均显著高于正常饮食的NC组(P<0.05)。其中,GTE、BTE和WTE组与HC组无显著性差异(图1B)。但由图1A可知,GTE和WTE组小鼠体质量均显著低于HC组,与NC组无显著性差异。BTE组小鼠体质量也低于HC组(P>0.05)。三者可将高脂饮食引起的体质量增长分别降低22.49%、21.23%和9.03%,GTE和WTE甚至可将高脂饮食小鼠体质量维持在正常水平,BTE虽能抑制高脂饮食小鼠的体质量增长,但效果不显著。由此可见,GTE、WTE和BTE可能通过抑制机体对高脂饮食中能量的消化吸收,或增加机体能耗、抑制脂肪生成,从而有效预防肥胖的发生。另外,WTI可显著提高小鼠的食欲,故该组小鼠总能量摄入量极显著高于NC组,甚至极显著高于HC组(P<0.01)。这也可能是WTI未能有效预防高脂饮食引起的肥胖发生的根本原因。
为进一步验证GTE、BTE、WTE和WTI对脂肪组织作用,计算了小鼠皮下脂肪、附睾脂肪和肾周脂肪组织湿质量,并对小鼠皮下脂肪组织进行病理学切片观察。脂肪湿质量统计结果如图1C所示,高脂饮食可显著升高小鼠的脂肪湿质量(P<0.05),HC组小鼠脂肪湿质量是NC组6.28 倍,GET和WTE可将高脂饮食引起的脂肪湿质量升高分别降低44.01%和51.45%,而BTE组脂肪湿质量不降反升,虽未表现出显著性差异,但由此可见,BTE不能抑制高脂饮食引起的脂肪组织增长作用。WTI组脂肪湿质量与体质量统计结果一致,小鼠脂肪湿质量显著高于NC组和HC组(P<0.05)。
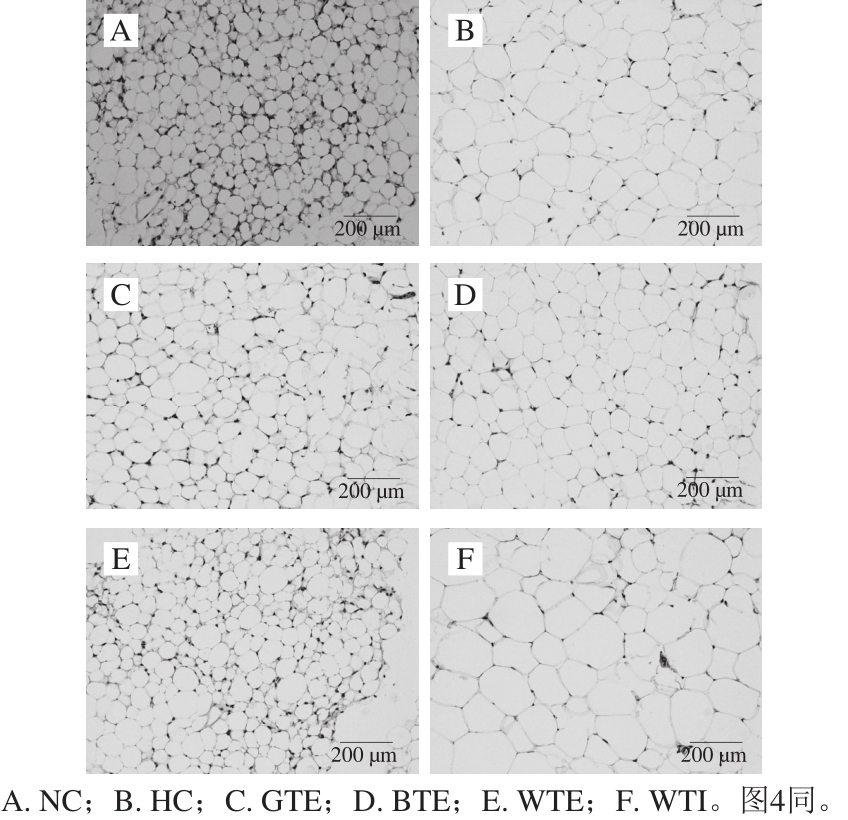
图2 小鼠皮下脂肪组织病理学变化
Fig. 2 Histopathological change of subcutaneous fatty tissues in mice
如图2所示,NC组脂肪细胞大小均一、形态规则、边界清晰、排列整齐致密。HC组和WTI组脂肪细胞大小不一,绝大多数细胞出现充脂,体积增大,出现不同程度的分化。GTE和WTE组脂肪细胞与正常对照组相似,BTE组部分脂肪细胞出现充脂和体积增大。皮下脂肪细胞直径统计结果显示(图1D),GTE和WTE组皮下脂肪细胞直径均极显著低于HC组(P<0.01),与NC组无显著性差异。BTE组脂肪细胞直径介于NC组和HC组之间(P>0.05)。WTI组小鼠脂肪细胞直径与HC无显著性差异。由此可见,GTE和WTE均能有效抑制脂肪组织中的脂肪积累和脂肪细胞分化,从而有效预防高脂饮食小鼠肥胖的发生,而在本研究所设剂量条件下,BTE对脂肪细胞分化无显著的抑制作用,WTI反而能促进脂肪细胞分化。
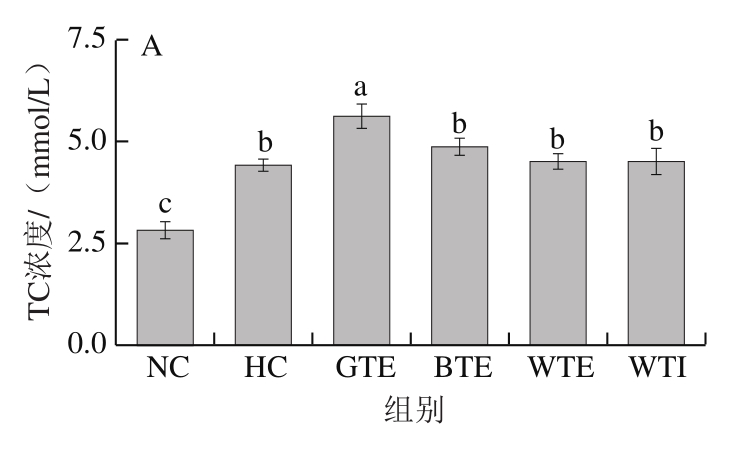
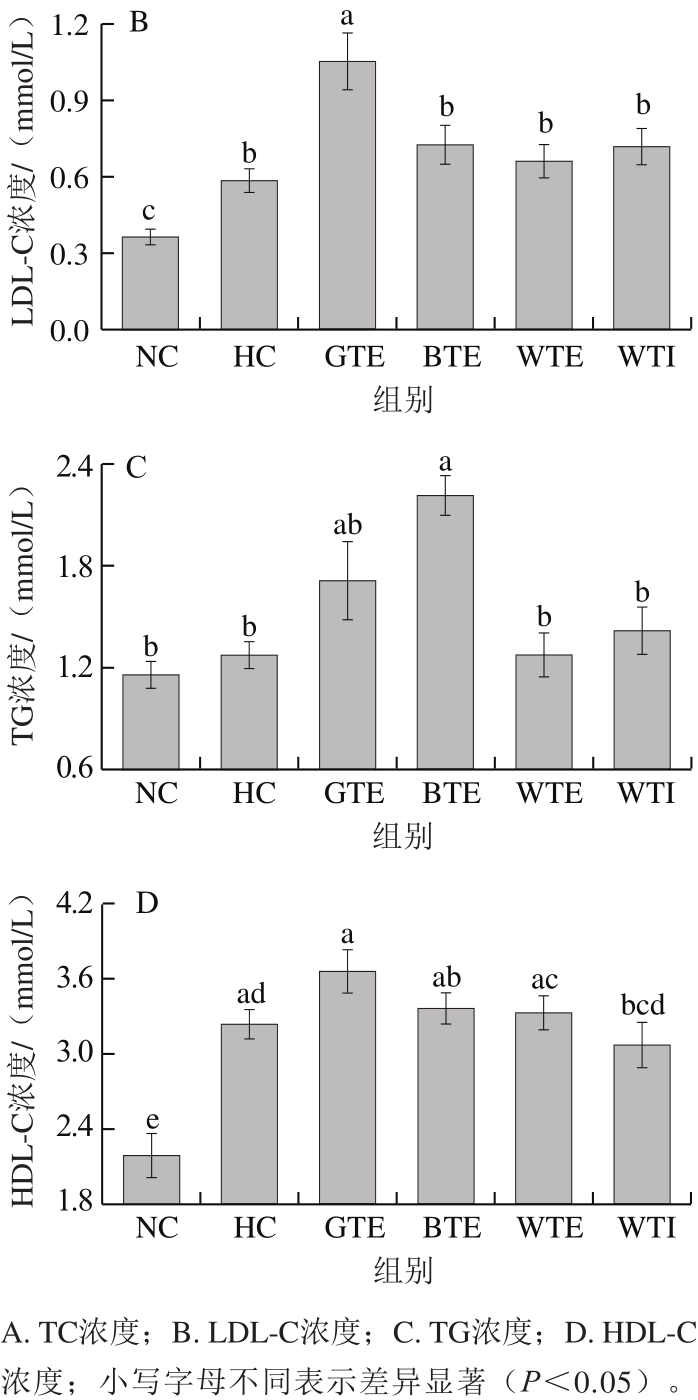
图3 GTE、BTE、WTE与WTI对小鼠血脂的影响
Fig. 3 Effects of GTE, BTE, WTE and WTI on serum lipid profiles of mice in each experimental group
如图3所示,与NC组相比,各高脂饮食组小鼠血清TC和LDL-C水平显著升高,而GTE、BTE、WTE和WTI未对其升高产生显著抑制作用。另外,除BTE组小鼠血清TG水平显著高于HC组外,其余各组血清TG水平均无显著性差异(P>0.05)。
解剖过程中观察肝脏形态和颜色,发现NC组小鼠肝脏呈有光泽的暗红色,无油腻感,形态规则,边缘锐利,切面有颗粒感;HC和WTI组小鼠肝脏颜色为黄褐色,切面有油腻感。GTE和WTE组小鼠肝脏与NC组相似。
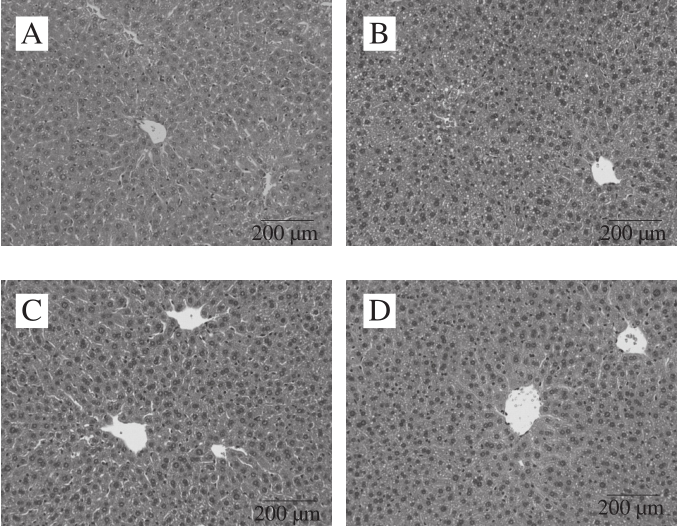

图4 小鼠肝脏组织病理学变化
Fig. 4 Histopathological change of liver in mice
肝脏病理学切片的苏木精-伊红染色结果显示,NC组肝窦清晰可见,切面肝索排列整齐有序、肝细胞排列整齐、胞浆均匀,细胞核清晰可见,未见脂滴,且无变性坏死。HC组肝窦明显缩小,甚至消失不见,切面肝索排列混乱无序,部分肝细胞出现肿胀,排列混乱,细胞之间界限模糊,细胞内出现大量脂滴空泡。GTE和WTE组小鼠肝细胞与NC组相似,均处于良好状态,而BTE组小鼠肝脏细胞中出现明显小型脂滴空泡,WTI组小鼠的肝细胞与HC组相似,出现大量的脂滴空泡(图4)。
可见,高脂饮食可引起小鼠肝细胞脂肪变性。GTE和WTE能有效预防高脂饮食诱导的脂肪肝的发生。BTE可缓解高脂饮食引起的肝细胞脂肪变性,而WTI不能预防高脂饮食诱导的脂肪肝的发生。
为探究GTE、BTE和WTE预防肥胖及脂肪肝发生的机制,本实验对小鼠肝脏脂代谢相关基因的相对表达进行定量分析。
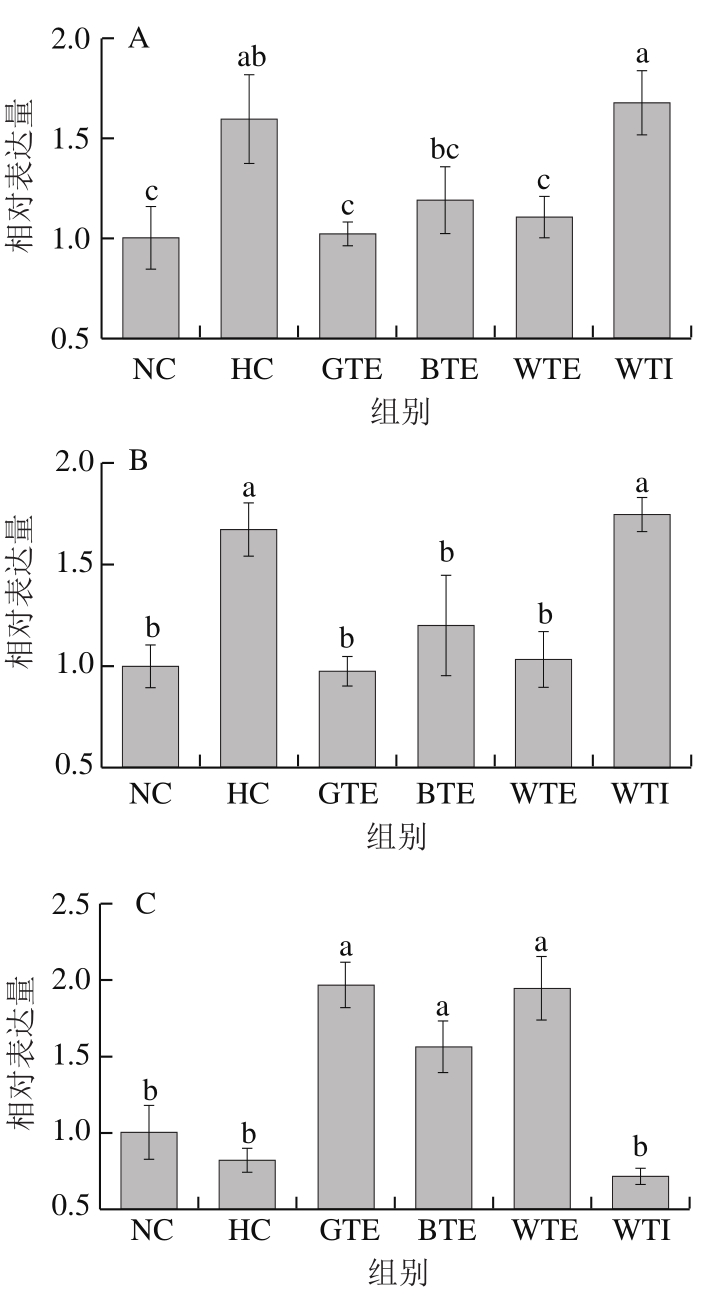
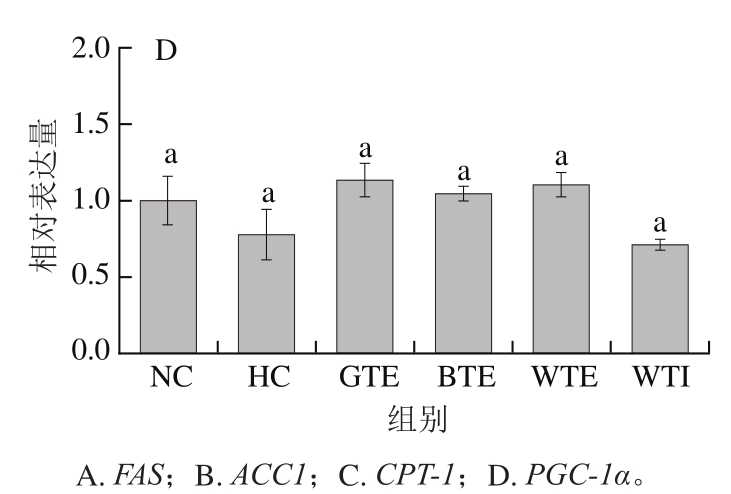
图5 GTE、BTE、WTE与WTI对小鼠肝脏脂代谢相关基因表达的影响
Fig. 5 Effects of GTE, BTE, WTE and WTI on the expression levels of lipid metabolism-related genes
由图5A、B可知,高脂饮食导致小鼠肝脏FAS和ACC1表达水平显著升高,分别是NC组的1.60 倍和1.67 倍,GTE和WTE干预使FAS和ACC1基因表达水平显著降低(P<0.05)。与HC组相比,GTE使两基因表达水平分别降低36.03%和30.89%,WTE使两基因表达水平分别降低41.43%和38.05%。BTE也能使FAS和ACC1基因表达水平下降(P>0.05),分别降低25.73%和28.21%。WTI对FAS和ACC1表达水平无显著影响。
由图5C、D可知,高脂饮食可抑制肝脏CPT-1的表达(P>0.05),其表达水平下降18.51%。GTE、BTE和WTE均可显著提高CPT-1的表达水平(P<0.05),分别提高242.73%、192.45%和240.21%。高脂饮食可抑制PGC-1α在肝脏中的表达,GTE、BTE和WTE均能提高PGC-1α的表达水平,但均未达到显著性水平。WTI对CPT-1和PGC-1α表达水平也无显著影响。
由图1可知,GTE、BTE和WTE组小鼠体质量均未显著低于NC组,故本实验所设剂量的GTE、BTE和WTE对小鼠生长无抑制作用。
表4 小鼠血清AST和ALT水平
Table 4 Serum AST and ALT levels of mice in each experimental group U/L
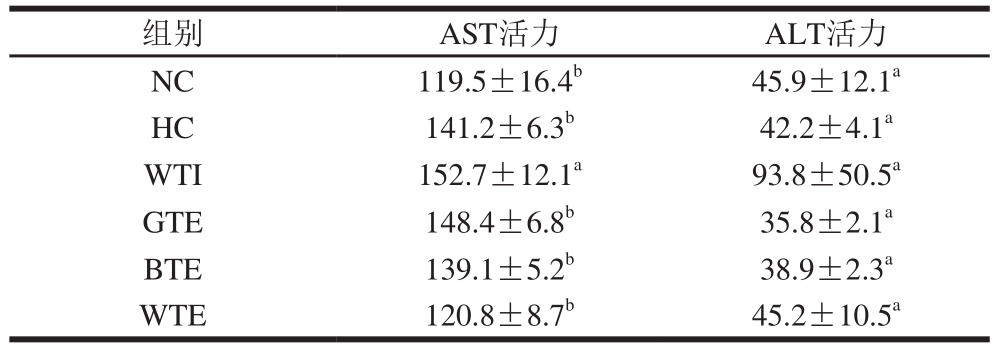
注:同列肩标字母不同表示差异显著,P<0.05。
另外,由表4可知,GTE、BTE和WTE组小鼠血清AST和ALT水平与NC组小鼠无显著性差异(P>0.05),结合图4可知,3 组小鼠肝脏均处于良好状态。故GTE、BTE和WTE组小鼠肝脏未产生毒性反应。综上所述,在本实验所设剂量条件下,GTE、BTE和WTE并无生长抑制作用和肝毒性。
肥胖是机体摄入能量超过所需,多余能量以脂肪形式贮存于体内,尤其是下腹部与臀部,达到损害身体健康的程度的疾病 [16] 。体质量超过标准体质量的10%~19%者为超重,超过20%者则为肥胖。《中国成人超重与肥胖症预防与控制指南》建议,对肥胖症的干预应坚持以预防为主 [17] 。本研究模拟高脂饮食结构,以60%高脂饲料饲喂C57BL/6J小鼠,最终诱导HC组小鼠体质量高出NC组42.72%,成功建立预肥胖模型。
高脂饮食可促进脂肪组织中脂肪积累和脂肪细胞分化,GTE和WTE均能有效抑制脂肪组织中的脂肪积累和脂肪细胞分化,从而防止脂肪组织增长,进而有效预防高脂饮食小鼠肥胖的发生,而BTE对脂肪细胞分化无显著的抑制作用,这可能也是BTE对小鼠体质量增长无显著抑制作用的主要原因,而WTI反而能促进脂肪细胞分化。另外,高脂饮食能上调肝脏中FAS和ACC1转录水平,FAS和ACC1是脂肪酸从头合成的关键酶,肝脏超表达FAS和ACC1则促进脂肪酸合成和脂肪积累,从而引起脂肪肝变性 [18] 。高脂饮食还能使CPT-1转录水平降低,CPT-1是脂肪酸氧化的限速酶,催化长链脂肪酸进入线粒体内部进行β氧化。肝脏CPT-1表达水平下降可导致长链脂肪酸β氧化发生障碍,最终导致大量脂质堆积 [19-20] ;与之相反,肝脏CPT-1表达量上升可促使脂肪堆积及分泌显著降低 [21] 。GTE、BTE和WTE能通过抑制FAS和ACC1表达,促进CPT-1的表达,抑制肝脏脂肪酸合成和脂肪积累,促进脂肪酸氧化,进而有效预防高脂饮食结构下小鼠肥胖和脂肪肝的发生。BTE也具有预防肥胖发生的趋势,但其效果短周期内未表现出显著性。除CPT-1外,PGC-1α是肝脏中调控脂肪酸氧化的关键调节因子,PGC-1α表达水平下降会导致肝细胞脂肪酸氧化率降低和线粒体呼吸率下降 [22] 。另外,PGC-1α还可通过PPARα调节PPAR介导编码的脂肪代谢相关基因如CPT-1、FAS等的表达 [23] 。本实验结果显示,GTE、BTE和WTE可促进肝脏中PGC-1α转录水平升高,但未达到显著性水平。
值得注意的是,GTE、WTE和BTE预防肥胖作用机制存在差异,BTE主要是通过改善肝脏脂代谢相关基因的表达,而非通过抑制脂肪组织增长来实现的,并且BTE从转录水平上对上述基因的调节作用较小,这也可能是BTE组体质量、脂肪湿质量等指标显著高于WTE和GTE组,并且小鼠出现轻度脂肪肝趋势的根本原因。另外,与WTE完全不同,本研究所设浓度条件下,WTI未能预防高脂饮食诱导的肥胖的发生,反而有一定程度的促进作用。究其原因,WTI显著增加小鼠食欲,导致其总能量摄入量极显著高HC组,过剩能量以脂肪形式储存在脂肪组织,并最终导致小鼠肥胖和脂肪肝的发生。由此可见,茶叶预防肥胖效果的发挥,与茶叶种类和摄入方式等都密切相关。
除茶叶种类和摄入方式外,摄入剂量与茶叶预防肥胖效果的发挥也息息相关。本实验选取3 g/400 mL的WTI与WTE进行对比,评价茶汤预防肥胖功效。发现此剂量WTI对高脂饮食诱导的体质量增长、脂肪增长和脂肪肝等均无改善作用。其实,小鼠每日摄入3 g/400 mL的茶汤量相当于标准体质量60 kg的成人每天摄入7.29~12.76 g茶叶。事实上,绝大多数成人茶叶日摄入量为5~10 g/d,少数人饮茶量较大,可达20 g/d [24] 。初步确定,高脂饮食结构下,按日常饮用量摄入低浓度WTI,短期内不能达到预防肥胖的效果。因此,茶叶摄入量过低不能预防肥胖的发生。而且,茶叶摄入剂量过高还可能产生毒副作用 [25] ,最新研究显示,高剂量的绿茶多酚可造成果蝇发育迟缓和生殖功能损伤 [26] ,持续6 个月摄取800 mg/d茶多酚使受试者产生肝中毒 [27] 。本实验小鼠的茶叶摄入剂量为1.5 g/kg,按提取率折算得茶多酚摄入剂量为116~158 mg/kg,相当于标准体质量60 kg的成人每日摄入562~768 mg茶多酚,并且安全性评价也显示,GTE、BTE和WTE组小鼠体质量增长并未受到抑制,且血转氨酶水平正常,故本实验所设GTE、BTE和WTE的剂量为安全剂量,无生长抑制作用和肝毒性。
另外,本研究中GTE、BTE和WTE未能有效控制高脂饮食诱导的血清TC和LDL-C浓度升高。其实C57BL/6J小鼠对高脂饲料极为敏感,容易形成高脂血症。C57BL/6J小鼠血清TC和LDL-C水平在高脂饮食第3~11周内,稳定为正常小鼠的2.4 倍和6.2 倍,停止高脂饮食5 周后,在无任何干预条件下恢复正常水平 [28] 。另有研究显示,7 周绿茶干预不能预防高脂饮食诱导的血脂水平升高,而14 周甚至更长周期的绿茶干预可显著抑制血脂水平升高 [29-31] 。故本实验周期较短可能是导致茶叶提取物未能发挥预防血脂升高作用的原因。另外,高脂饮食导致HDL-C水平显著升高,初步确认为高脂饮食导致小鼠血胆固醇水平升高,从而引起HDL-C水平代偿性升高,以清除血胆固醇,保持循环系统胆固醇平衡。
参考文献:
[1] KOPELMAN P. Obesity as a medical problem[J]. Nature, 2000, 404:635-643. DOI:10.1038/35007508.
[2] POULAIN M, DOUCET M, MAJOR G C, et al. The effect of obesity on chronic respiratory diseases: pathophysiology and therapeutic strategies[J]. Canadian Medical Association Journal, 2006, 174(9):1293-1299. DOI:10.1503/cmaj.051299.
[3] BAHMANI M, EFTEKHARI Z, SAKI K, et al. Obesity phytotherapy:review of native herbs used in traditional medicine for obesity[J].Journal of Evidence-Based Complementary and Alternative Medicine,2015, 21(3): 228-234. DOI:10.1177/2156587215599105.
[4] ASGARY S, RAFIEIANKOPAEI M, SHAMSI F, et al. Biochemical and histopathological study of the anti-hyperglycemic and antihyperlipidemic effects of cornelian cherry (Cornus mas L.) in alloxaninduced diabetic rats[J]. Journal of Complementary & Interative Medicine, 2014, 11(2): 63-69. DOI:10.1515/jcim-2013-0022.
[5] WANG S, MOUSTAID-MOUSSA N, CHEN L, et al. Novel insights of dietary polyphenols and obesity[J]. Journal of Nutritional Biochemistry, 2014, 25(1): 1-18. DOI:10.1016/j.jnutbio.2013.09.001.
[6] YANG C S, ZHANG J, ZHANG L, et al. Mechanisms of body weight reduction and metabolic syndrome alleviation by tea[J]. Molecular Nutrition & Food Research, 2015, 60(1): 160-174. DOI:10.1002/mnfr.201500428.
[7] YANG C S, HONG J. Prevention of chronic diseases by tea: possible mechanisms and human relevance[J]. Annual Review of Nutrition,2013, 33(1): 161-181. DOI:10.1146/annurev-nutr-071811-150717.
[8] CHEN Y K, CHEUNG C, REUHL K R, et al. Effects of green tea polyphenol (-)-epigallocatechin-3-gallate on a newly developed highfat/Western-style diet-induced obesity and metabolic syndrome in mice[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21):11862-11871. DOI:10.1021/jf2029016.
[9] ALSHATWI A A, AL OBAAID M A, AL SEDAIRY S A, et al. Black and green tea improves lipid profile and lipid peroxidation parameters in Wistar rats fed a high-cholesterol diet[J]. Journal of Physiology and Biochemistry, 2011, 67(1): 95-104. DOI:10.1007/s13105-010-0053-3.
[10] 卫生部. 保健食品检验与评价技术规范(2003年版)[S]. 北京: 卫生部卫生法制与监督司编印, 2003: 115-117.
[11] 章金涛. 医学实验动物学[M]. 郑州: 郑州大学出版社, 2014: 200-301.
[12] 王蝶. 茶叶对肥胖大鼠的减肥作用及机制研究[D]. 长沙: 湖南农业大学, 2012: 19-32.
[13] 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072.DOI:10.3969/j.issn.1009-2501.2004.09.026.
[14] 刘恩岐, 尹海林, 顾为望. 医学实验动物学[M]. 北京: 科学出版社,2008: 68-150.
[15] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-timequantitative PCR and the 2(-delta delta C(T)) method[J].Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262.
[16] KAUTZKY-WILLER A, LEMMENS-GRUBER. Obesity and diabetes[M]//VON VERA REGITZ-ZAGROSEK. Sex and gender differences in pharmacology. Berlin: Springer, 2013: 307-340.
[17] 卫生部疾病控制司. 中国成人超重和肥胖症预防控制指南[M]. 北京: 人民卫生出版社, 2006: 1-4.
[18] 杨永青. 脂肪细胞分化及其调控机制[M]. 北京: 中国农业科学技术出版社, 2014: 12-14.
[19] MCGARRY J D. The mitochondrial carnitine palmitoyltransferase system: its broadening role in fuel homoeostasis and new insights into its molecular features[J]. Biochemical Society Transactions, 1995,23(2): 321-324. DOI:10.1042/bst0230321.
[20] ZANG Y, WANG T, XIE W, et al. Regulation of acetyl CoA carboxylase and carnitine palmitoyl transferase-1 in rat adipocytes[J]. Obesity Research, 2005, 13(9): 1530-1539. DOI:10.1038/oby.2005.188.
[21] STEFANOVIC-RACIC M, PERDOMO G, MANTELL B S, et al.A moderate increase in carnitine palmitoyltransferase 1a activity is sufficient to substantially reduce hepatic triglyceride levels[J].American Journal of Physiology, 2008, 294(1): 969-977. DOI:10.1152/ajpendo.00497.2007.
[22] WAN Z, ROOT-MCCAIG J, CASTELLANI L, et al. Evidence for the role of AMPK in regulating PGC-1 alpha expression and mitochondrial proteins in mouse epididymal adipose tissue[J]. Obesity, 2014, 22(3):730-738. DOI:10.1002/oby.20605.
[23] 施军平, 陈芝芸, 包剑锋, 等. 高脂饮食诱导的非酒精性脂肪性肝病大鼠肝组织PPARα和CPT-I mRNA的表达[J]. 浙江中医药大学学报,2007, 31(1): 52-55. DOI:10.16466/j.issn1005-5509.2007.01.020.
[24] HAN M, ZHAO G, WANG Y, et al. Safety and anti-hyperglycemic efficacy of various tea types in mice[J]. Scientific Reports, 2016, 6:1-11. DOI:10.1038/srep31703.
[25] MURAKAMI A. Dose-dependent functionality and toxicity of green tea polyphenols in experimental rodents[J]. Archives of Biochemistry& Biophysics, 2014, 557(5): 3-10. DOI:10.1016/j.abb.2014.04.018.
[26] LOPEZ T E, PHAM H M, BARBOUR J, et al. The impact of green tea polyphenols on development and reproduction in Drosophila melanogaster[J]. Journal of Functional Foods, 2016, 20: 556-566.DOI:10.1016/j.jff.2015.11.002.
[27] LOVERA J, RAMOS A, DEVIER D, et al. Polyphenon E, non-futile at neuroprotection in multiple sclerosis but unpredictably hepatotoxic:phase I single group and phase II randomized placebo-controlled studies[J]. Journal of the Neurological Sciences, 2015, 358(1/2):46-52. DOI:10.1016/j.jns.2015.08.006.
[28] 王丽娟, 李晓蓉, 李宇航, 等. 高脂饲料对C57BL/6J小鼠血脂与转氨酶的动态影响[J]. 中国比较医学杂志, 2007, 17(10): 572-576.
[29] NISHIUMI S, BESSYO H, KUBO M, et al. Green and black tea suppress hyperglycemia and insulin resistance by retaining the expression of glucose transporter 4 in muscle of high-fat diet-fed C57BL/6J mice[J]. Journal of Agricultural and Food Chemistry, 2010,58(24): 12916-12923. DOI:10.1021/jf102840w.
[30] BYUN J K, YOON B Y, JHUN J Y, et al. Epigallocatechin-3-gallate ameliorates both obesity and autoinflammatory arthritis aggravated by obesity by altering the balance among CD4 + T-cell subsets[J]. Immunology Letters, 2014, 157(1/2): 51-59. DOI:10.1016/j.imlet.2013.11.006.
[31] PARK B, LEE S, LEE B, et al. New ethanol extraction improves the anti-obesity effects of black tea[J]. Archives of Pharmacal Research,2016, 39(3): 1-11. DOI:10.1007/s12272-015-0674-8.
Anti-obesity Efficacy of Extracts from Several Kinds of Tea in High-Fat Diet-Induced Obese Mice
ZHENG Li 1 , HOU Caiyun 1,2, *, REN Fazheng 2
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, College of Food Science and Nutritional Engineering,China Agricultural University, Beijing 100083, China; 2. Beijing Laboratory for Food Quality and Safety,College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract: Objective: To evaluate and compare the anti-obesity efficacy of white, green and black tea extract (GTE, BTE and WTE) and white tea infusion (WTI) in mice with high-fat diet-induced obesity and to investigate their mechanisms of action.Methods: For this study, GTE, BTE and WTE were prepared from Shoumei green tea, Bailin Gongfu black tea and Anji Bai white tea, respectively. C57BL/6J mice were fed on a high-fat diet or a normal diet supplemented with WTE, GTE, BTE,WTI or distilled water. After 8 weeks of feeding, body mass, wet mass of adipose tissue, subcutaneous adipocyte diameter and serum lipid levels of mice were determined. The pathological changes of liver and adipose tissues were observed. The differential expression profiles of lipid metabolism-related genes in liver tissues of mice were also determined by real-time fluorescence quantitative polymerase chain reaction. Results: GTE and WTE reduced body mass gain in high-fat diet-fed rats by 22.49% and 21.23%, respectively, and they also significantly decreased the wet mass of adipose tissue and subcutaneous adipocyte diameter (P < 0.05). BTE reduced body mass gain by 9.03%, but had no significant effect on the wet mass of adipose tissue or subcutaneous adipocyte diameter (P > 0.05). The BTE, WTI and model control groups showed hepatic steatosis, whereas the liver of mice in the GTE and WTE groups was kept in good condition. GTE and WTE could improve lipid metabolism disorder induced by high-fat diet at the transcription level. Conclusion: At the dosages used in this study,hepatotoxicity and growth inhibition have not been found in the WTE, GTE and BTE groups. GTE and WTE can regulate the transcription and expression of lipid metabolism-related genes, inhibit fatty acid synthesis and enhance liver fatty acid oxidation, thus effectively preventing the occurrence of obesity and fatty liver in high-fat diet-fed mice. The effect of GTE is slightly better than that of WTE (P > 0.05). However, BTE has little anti-obesity efficacy and no protective effect on the liver. In addition, WTI can not prevent the occurrence of obesity and fatty liver in high-fat diet-fed mice.
Keywords: white tea; black tea; green tea; high-fat diet; anti-obesity; safety
ZHENG Li, HOU Caiyun, REN Fazheng. Anti-obesity efficacy of extracts from several kinds of tea in high-fat diet-induced obese mice[J]. Food Science, 2018, 39(17): 192-199. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201817032. http://www.spkx.net.cn
文章编号: 1002-6630(2018)17-0192-08
引文格式: 郑丽, 侯彩云, 任发政. 几种茶叶提取物对高脂饮食小鼠肥胖的预防作用[J]. 食品科学, 2018, 39(17): 192-199.DOI:10.7506/spkx1002-6630-201817032. http://www.spkx.net.cn
中图分类号: TS272;R151.3
文献标志码: A
*通信作者简介: 侯彩云(1963—),女,教授,博士,研究方向为食品营养与安全。E-mail:food319@139.com
DOI: 10.7506/spkx1002-6630-201817032
基金项目: 北京食品营养与人类健康高精尖创新中心开放基金项目
第一作者简介: 郑丽(1991—),女,硕士研究生,研究方向为白茶功能性评价。E-mail:18810889738@163.com
(1.中国农业大学食品科学与营养工程学院,北京食品营养与人类健康高精尖创新中心,北京 100083;2.中国农业大学食品科学与营养工程学院,食品质量与安全北京实验室,北京 100083)
收稿日期: 2017-03-03
摘 要: 目的:对绿茶提取物(green tea extract,GTE)、红茶提取物(black tea extract,BTE)、白茶提取物(white tea extract,WTE)和白茶茶汤(white tea infusion,WTI)预防肥胖功效进行评价和对比,并对其作用机制进行研究。方法:分别以寿眉、白琳工夫茶和安吉白茶作为绿茶、红茶和白茶的代表,制备GTE、BTE、WTE和WTI并喂养C57BL/6J小鼠,同时给予高脂饲料。实验结束后统计体质量、脂肪湿质量,制作肝脏和脂肪组织病理切片,测定血脂及血清转氨酶水平,实时荧光定量聚合酶链式反应测定小鼠肝脏中脂代谢相关基因表达水平。结果:GTE和WTE可将高脂饮食引起的体质量增长分别降低22.49%和21.23%,且可显著降低脂肪湿质量和皮下脂肪细胞直径(P<0.05)。BTE可将体质量增长降低9.03%,但对小鼠脂肪湿质量和皮下脂肪细胞直径无显著影响(P>0.05)。BTE组、WTI组和模型对照组小鼠出现不同程度肝细胞脂肪变性,而GTE和WTE组小鼠肝脏状态良好。GTE和WTE可在转录水平上改善高脂饮食引起的脂代谢紊乱。结论:本实验所选剂量条件下,GTE、BTE和WTE对小鼠均无肝毒性和生长抑制作用。GTE和WTE可调节脂代谢相关基因的转录表达水平,增强脂肪酸氧化能力,抑制脂肪酸合成,从而有效预防小鼠肥胖和脂肪肝的发生。GTE预防肥胖效果略优于WTE(P>0.05)。BTE也可预防肥胖发生,但效果不显著。另外,未发现WTI有预防高脂饮食引起的肥胖和脂肪肝发生的效果。