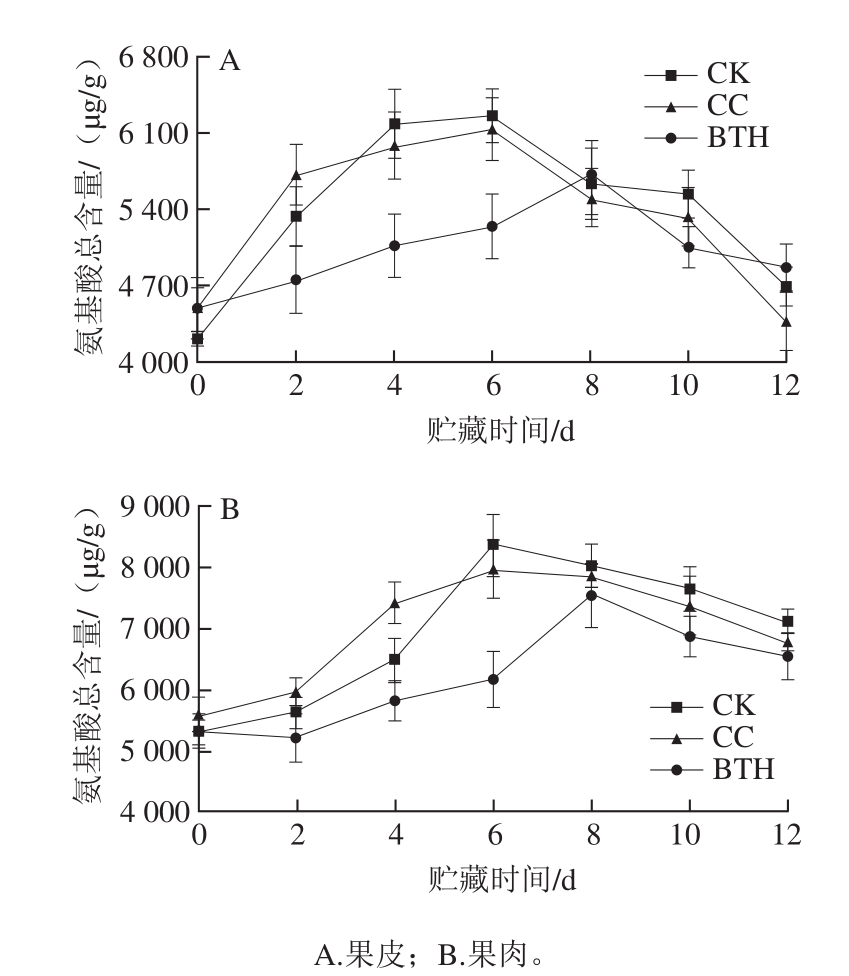
图1 BTH处理对甜瓜氨基酸总含量的影响
Fig. 1 Effect of BTH treatment on amino acid contents in melon
王 博 1 ,李霁昕 1 ,李经纬 2 ,王 雨 1 ,胡妍芸 1 ,蒋玉梅 1, *
关键词: 苯并噻重氮;酯类香气物质;氨基酸;转氨酶;丙酮酸脱羧酶;丙酮酸脱氢酶
‘玉金香’甜瓜是甘肃省特色经济作物之一,属呼吸跃变型水果,贮藏运输过程中因后熟快、易受病原菌浸染而易失去商品价值 [1-2] 。化学诱抗剂苯丙噻重氮(benzothiadiazole,BTH)可诱导甜瓜果实产生抗病性,降低病原菌侵染率,延长果实货架期 [3-4] 。果实香气可反映商品风味、成熟度及品质 [5] ,其构成是评价果实品质的重要指标 [6-7] 。酯类、醛类、醇类及含硫化合物是甜瓜香气的主要构成 [8-9] ,分别来自于以脂肪酸为前体的脂氧合酶(lipoxygenase,LOX)代谢和以氨基酸、单糖、糖苷为前体的代谢 [10-11] 。采后BTH诱抗处理可提高甜瓜果肉和果皮组织的LOX活力,影响以脂肪酸为前体的LOX代谢,抑制甜瓜香气物质释放 [12] 。关于采后BTH处理对以氨基酸为前体的香气代谢影响机理研究目前鲜见报道。
酯类香气物质的氨基酸代谢包括转氨基和脱羧基过程,氨基酸通过转氨基过程形成支链酮酸,脱羧或脱氢后生成支链醛和酰基-CoA,进而在醇脱氢酶和醇酰基转移酶的催化下形成支链酯类香气物质 [13-14] ;由支链氨基酸、芳香族氨基酸和含硫氨基酸代谢衍生形成的醛、醇和酯类是构成植物香气的重要组分 [15] 。转氨酶和丙酮酸脱氢酶是转氨基和脱羧基过程的关键酶 [16] 。
以‘玉金香’厚皮甜瓜为实验原料,在采后常温贮藏期间,监测样品氨基酸含量、谷丙转氨酶(glutamate pyruvic transaminase,GPT)、谷草转氨酶(glutamic oxaloacetic transaminase,GOT)、丙酮酸脱羧酶(pyruvate decarboxylase,PDC)和丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)活力及其代谢产物酯类香气物质含量的变化,探讨采后BTH诱抗处理对氨基酸代谢酯类香气物质的影响及其代谢机理,以期为甜瓜采后病害控制机理及其对果实香气代谢影响机理的研究提供数据参考。
‘玉金香’甜瓜于花后45 d采摘于甘肃省皋兰县什川镇露天栽培大田,单果发泡网袋包装(40 个/箱),当天运达甘肃省葡萄与葡萄酒工程学重点实验室。
BTH(纯度98%)、2-辛醇(色谱纯) 美国Sigma Aldrich公司;GPT、GOT试剂盒 苏州科铭生物公司;PDC和PDH酶联免疫吸附剂测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 上海酶联生物公司。
TRACE1300GC-ISQ300气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪、TG-WAX色谱柱(60 m×0.25 mm,0.5 µm)、Multiskan GO全波长酶标仪 美国Thermo Scientific公司;DVB/CAR/PDMS(50/30 μm)固相微萃取头 美国SUPELCO公司;L-8900氨基酸分析仪 日本日立公司。
1.3.1 前处理
参照李轩 [17] 的方法,选择成熟度和大小相近、无损伤和虫咬的果实,分别用100 mg/L BTH溶液(BTH处理组)、蒸馏水(条件对照组,CC组)浸泡10 min,以未处理果实为对照组(CK组)。在(22±2)℃、相对湿度55%~65%条件下贮藏待测。
贮藏第0、2、4、6、8、10、12天在各组随机抽取外观相近、无损伤的‘玉金香’果实各10 个,取果实“赤道”部位果肉、果皮组织(皮下5 mm),切小块混匀。用于测定氨基酸含量和酶活力的样品(约5.0 g)用锡箔纸包裹液氮冷冻,于-80 ℃保存;用于测定香气物质含量的样品(5.0 g)置于20 mL顶空瓶,加1.0 g NaCl、50 μL 1.64 g/L内标2-辛醇,混匀密封,-20 ℃保存待测。
1.3.2 氨基酸含量的测定
参考王颉等 [18] 的方法,取5.0 g样品冰浴研磨,加10 mL体积分数5%的磺基水杨酸溶液,12 000 r/min 4 ℃离心20 min,取上清液,过膜,L-8900氨基酸分析仪测定氨基酸含量。采用外标法定性定量分析。
1.3.3 香气物质含量的测定
参照蒋玉梅等 [19] 的方法并进行修改。样品室温解冻后40 ℃水浴平衡30 min,用250 ℃活化的固相微萃取头40 ℃顶空吸附30 min。GC进样口解析10 min后进样分析。
GC条件:进样口温度240 ℃,不分流进样,20 min后开分流阀,分流比30∶1;高纯度He,流速1.0 mL/min;初温50 ℃保持3 min,3 ℃/min升至170 ℃(保持10 min);检测器温度250 ℃。
MS条件:传输线温度180 ℃,电子轰击电离,70 eV,离子源温度240 ℃,质量扫描范围m/z 40~250。
定性定量:计算机检索NIST Library(11)、Wiley Library,结合人工图谱解析;内标法半定量分析。
1.3.4 酶活力的测定
GPT和GOT活力的测定:参照王美英 [20] 的方法并进行修改,取2.0 g样品于预冷研钵,加0.05 mol/L Tris-HCl缓冲液(pH 7.2)8 mL,冰浴研磨匀浆,12 000 r/min 4 ℃离心20 min,上清液为粗酶液,分别滴入GPT和GOT试剂盒试剂,用酶标仪测定505 nm波长处吸光度,对照标准曲线确定酶活力。单位为μmol/(kg·min)。
PDC活力的测定:参照李岩 [21] 的方法并进行修改,取2.0 g样品于预冷研钵,冰浴研磨匀浆,加入8 mL 4 ℃ 预冷提取液(85 mmol/L 2-吗啉乙磺酸缓冲液(pH 6.0)、5 mL二硫苏糖醇、体积分数1%聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone,PVP)溶液),12 000 r/min 4 ℃离心15 min,上清液为粗酶液,采用PDC试剂盒检测,用酶标仪于450 nm波长处测定吸光度,对照标准曲线确定酶活力。单位为μmol/(kg·min)。
PDH活力的测定:参照李岩 [21] 的方法并进行修改,取2.0 g样品于预冷研钵,冰浴研磨匀浆,加8 mL的分离提取液(50 mmol/L磷酸钾缓冲液(pH 7.2)、0.25 mol/L蔗糖、5 mmol/L乙二胺四乙酸、4.5 mmol/L β-巯基乙醇、体积分数0.2% PVP溶液、体积分数0.1%牛血清白蛋白(albumin from bovine serum,BSA)溶液)。2 000 r/min 4 ℃离心10 min,过滤,于上清液中加入8 mL的清洗介质(含50 mmol/L磷酸钾缓冲液(pH 7.2)、0.25 mol/L蔗糖、体积分数0.1% BSA溶液),悬浮浸提沉淀5 min,取上清液10 000 r/min 4 ℃离心5 min,过滤;沉淀用5 mL的清洗介质二次悬浮浸提5 min,2 000 r/min 4 ℃离心5 min,采用PDH试剂盒分析上清液,用酶标仪于450 nm波长处测定吸光度,对照标准曲线确定酶活力。单位为μmol/(kg·min)。
采用Excel 2010软件计算平均值、标准差和绘制图表。采用SPSS 19.0软件进行显著性(Duncan’s多重比较)和相关性分析(相关系数法),以P<0.05表示差异显著。
样品中共检测到15 种游离氨基酸。苏氨酸和谷氨酸含量较高,其次是丙氨酸、甘氨酸、组氨酸和赖氨酸;半胱氨酸、蛋氨酸、异亮氨酸和精氨酸含量较低(表1)。氨基酸总含量随贮藏时间延长呈单峰型变化(图1)。CK和CC组样品氨基酸总含量在第6天达到最大值,BTH处理组的峰值则延迟2 d,其果皮和果肉样品氨基酸总含量峰值分别为5 690、7 525 μg/g,分别是CK组的91.22%和90.08%,是CC组的92.57%和94.37%,BTH处理显著抑制了氨基酸的积累(P<0.05);水处理对样品氨基酸总含量有影响,但CC组与CK组氨基酸总含量差异不显著(P>0.05)。CK组果实(果皮+果肉)氨基酸总含量峰值出现在第6天,峰值为14 597 μg/g;BTH处理组果实氨基酸总含量峰值则延迟2 d,比CK组氨基酸总含量峰值降低了9.47%。果肉中氨基酸含量整体高于果皮,CK组果肉的峰值是果皮的1.34 倍。

图1 BTH处理对甜瓜氨基酸总含量的影响
Fig. 1 Effect of BTH treatment on amino acid contents in melon
已报道的参与果实香气代谢的单体氨基酸前体主要包括缬氨酸、亮氨酸、异亮氨酸、丙氨酸、半胱氨酸和苯丙氨酸 [11] 。由表1可知,贮藏期间CK组果实中异亮氨酸、半胱氨酸、亮氨酸、丙氨酸、缬氨酸和苯丙氨酸的含量峰值分别为74、57、176、1 205、166 μg/g和134 μg/g。BTH处理组果实中异亮氨酸的含量峰值比CK组低39.19%,其次是半胱氨酸、亮氨酸和丙氨酸,分别比CK组果实低24.56%、16.48%和5.15%。BTH处理组果实中缬氨酸和苯丙氨酸含量与CK组无明显差异。
表1 BTH处理对果实(果皮+果肉)中氨基酸含量的影响
Table 1 Effect of BTH treatment on amino acid contents in fruit (peel + pulp)μg/g
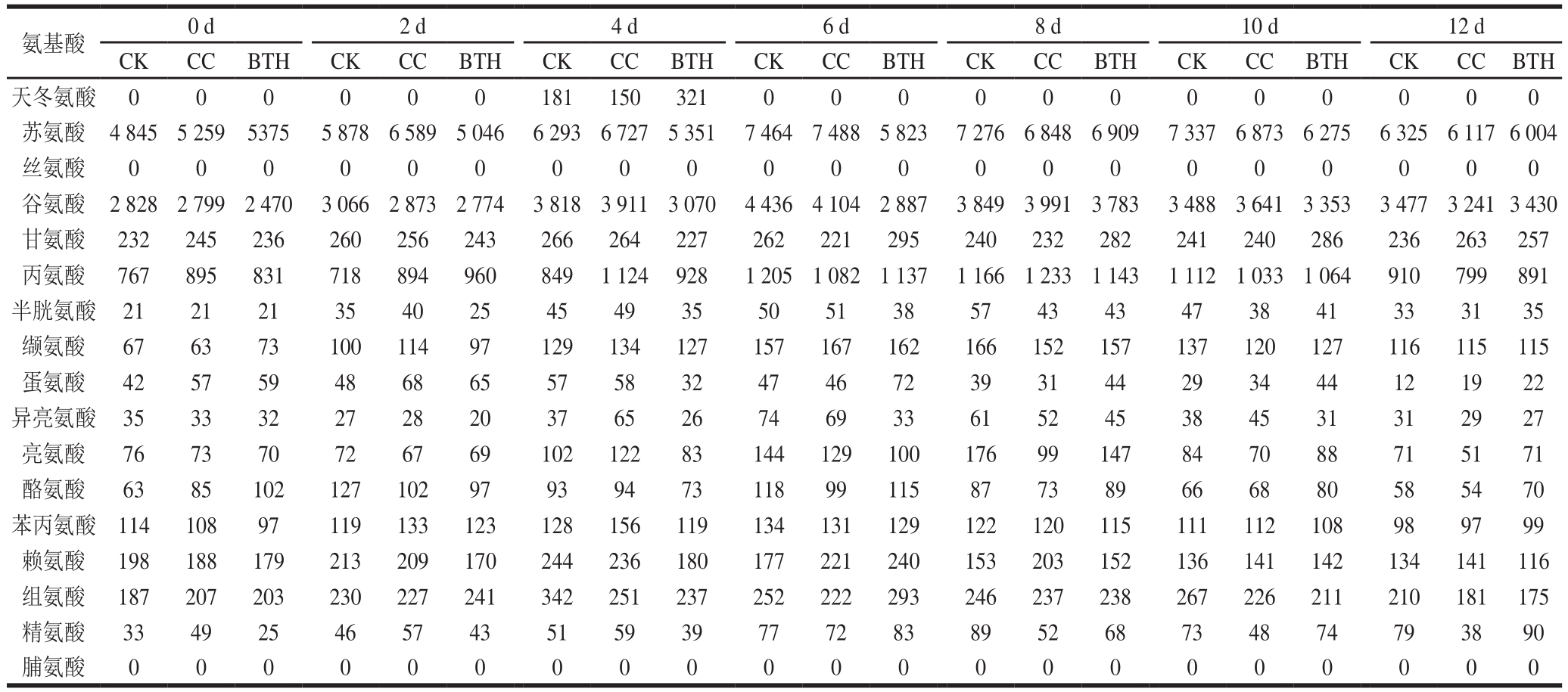
表2 BTH处理对果实(果皮+果肉)中支链、芳香族和含硫酯类香气物质含量的影响
Table 2 Effect of BTH treatment on the contents of branched-chain, aromatic and sulfur-containing aroma substances in fruit (peel + pulp)μg/g
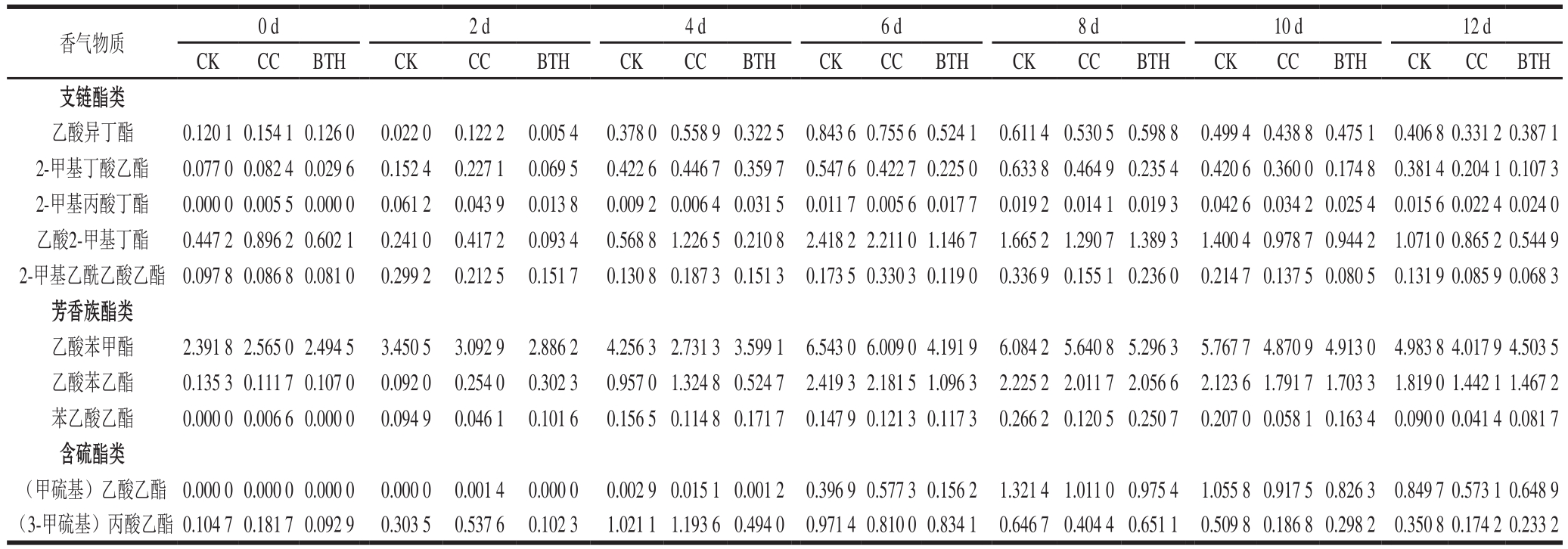
‘玉金香’甜瓜样品中,检测到的氨基酸代谢酯类香气物质包括支链酯类、芳香族酯类和含硫酯类物质,共10 种(表2)。贮藏期间,其酯类香气物质含量(图2)及各类酯类香气物质含量(图3)均呈单峰型变化。

图2 BTH处理对甜瓜果实(果皮+果肉)酯类香气物质含量的影响
Fig. 2 Effects of BTH treatment on the contents of aroma esters in melon fruit (peel + pulp)
由图2可知,BTH处理组氨基酸代谢酯类香气物质含量在贮藏第2~8天较CK和CC组果实低,释放高峰较CK和CC组推迟2d。CK和CC组样品释放峰值分别为(14.473 3±1.311 9)μg/g和(13.424 3±1.362 0)μg/g,BTH处理组果实峰值为(11.708 8±1.083 4)μg/g,BTH处理组果实峰值分别比CK和CC组低19.10%、12.78%。释放高峰后CK组释放量高于CC组和BTH处理组,8 d后,CC组和BTH处理组释放总量相近。
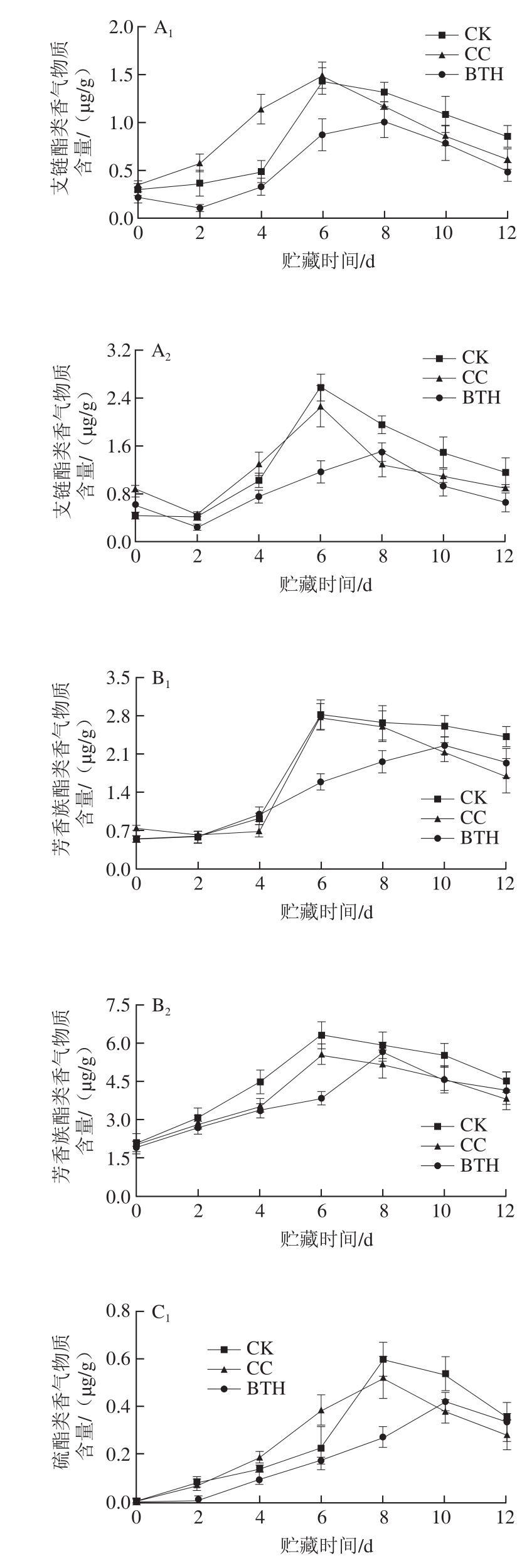

图3 BTH处理对甜瓜支链、芳香族和硫酯类香气物质含量的影响
Fig. 3 Effect of BTH treatment on the contents of branched-chain,aromatic and thioester aroma substances in melon
由图3A 1 、A 2 可知,BTH处理组果皮及果肉样的支链酯类香气物质含量采后2 d内下降,随后上升,到达释放高峰后再次下降。CK和CC组样品的释放高峰出现于第6天,BTH处理组的释放高峰则推迟2 d。CK和CC组果皮样释放峰值分别为(1.433 7±0.137 7)μg/g和(1.493 4±0.139 3)μg/g,是BTH处理组释放峰值的1.47 倍和1.51 倍;BTH处理组果肉样释放峰值为(1.487 4±0.155 4)μg/g,分别是CK和CC组峰值的58.08%和66.65%。
由图3B 1 、B 2 可知,CK和CC组芳香族酯类香气的释放高峰出现于第6天。贮藏前8 d CK和CC组果皮样品芳香族酯类香气物质含量差异不明显,随后CC组低于CK组。BTH处理组果皮和果肉芳香族酯类香气物质释放高峰则分别被推迟至第10天和第8天。CK和CC组果皮样释放峰值分别为(2.808 5±0.283 5)μg/g和(2.770 9±0.244 9)μg/g,是BTH处理组的1.26 倍和1.24 倍;BTH处理组果肉样释放峰值为(5.657 0±0.398 9)μg/g,分别是CK和CC组释放峰值的89.77%和102.10%。
由图3C 1 、C 2 可知,果皮样第0天未检测到硫酯类香气物质,CK和CC组样品的释放高峰出现于第8天,BTH处理组释放高峰则推迟2 d,CK和CC组果皮硫酯类香气物质释放峰值分别为(0.607 6±0.095 6)μg/g和(0.517 7±0.084 6)μg/g,是BTH处理组释放峰值的1.45 倍和1.24 倍。CK组和BTH处理组果肉硫酯类香气物质释放高峰出现在第8天,CC组释放高峰在第4天,BTH处理组果肉样品释放峰值为(1.355 2±0.130 1)μg/g,分别是CK和CC组的99.61%和135.06%。
由此可见,BTH处理可抑制氨基酸代谢酯类香气物质的释放,延迟释放高峰出现,释放高峰前水处理对氨基酸代谢酯类香气物质的释放影响不显著,之后有一定的抑制作用,第8天后,水处理的作用与BTH接近(图2)。水处理会促进果皮样品香气释放高峰前的支链酯类香气物质和果肉样品的含硫酯类香气物质释放(图3A 1 、C 2 ),释放高峰之后水处理则一定程度上减少了各类酯类香气物质的释放,但无明显作用规律。支链酯类香气物质可赋予甜瓜果香和甜香感 [22-23] ,硫酯类主要赋予果实清香味 [24] ,而含量最多的芳香族酯类主要赋予果实花香味和生青味 [22] 。CK组果实支链酯类、芳香族酯类和硫酯类香气物质的释放峰值分别为(3.994 6±0.359 4)、(9.110 3±0.807 1)μg/g和(1.968 1±0.239 3)μg/g,与CK组相比,BTH处理组分别降低了37.95%、16.54%和17.36%,可见BTH处理对支链酯类香气物质的释放影响最明显,由此可推断BTH处理会显著减弱甜瓜果香味和甜香感,而在一定程度上维持样品的生青味,从而从香气释放的角度证明了BTH处理可延缓甜瓜的后熟进程。
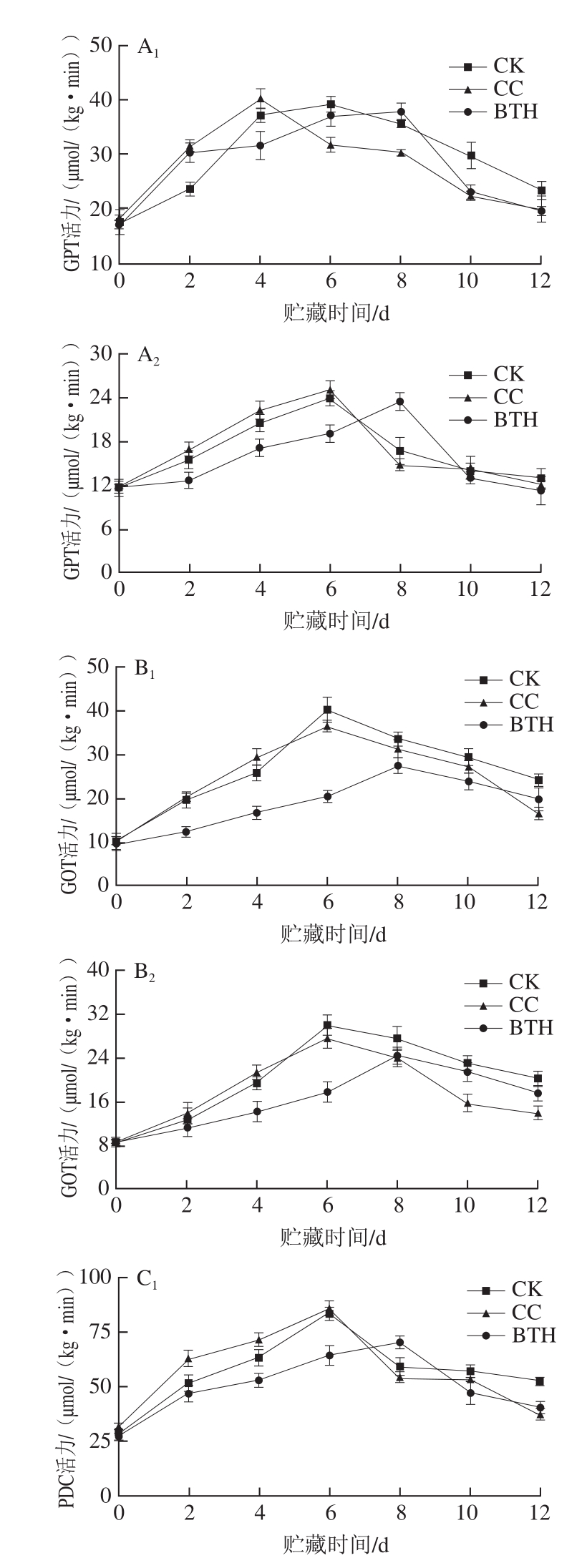

图4 BTH处理对甜瓜GPT、GOT、PDC和PDH活力的影响
Fig. 4 Effect of BTH treatment on GPT, GOT, PDC and PDH activities in melon
氨基酸代谢酶GPT、GOT、PDC和PDH活力随贮藏时间延长总体均呈单峰型变化趋势(图4)。由图4A 1 、A 2 可知,BTH处理组GPT活力高峰出现在第8天,果皮样品峰值为(37.77±1.60)μmol/(kg·min),分别比CK和CC组GPT活力峰值低3.60%和5.92%;CK组GPT活力高峰出现于第6天,CC组果皮样品较其提前了2 d。CK和CC组果肉样品GPT活力高峰均出现在第6天,分别为(23.84±0.99)μmol/(kg·min)和(25.03±1.23)μmol/(kg·min),BTH处理组为(23.42±1.23)μmol/(kg·min),各组样品活力峰值差异不显著。CK、CC组和BTH处理组果皮GPT活力峰值是果肉的1.64 倍、1.60 倍和1.61 倍。
由图4B 1 、B 2 可知,BTH处理组的GOT活力高峰亦出现于第8天,果皮样品GOT活力峰值为(27.48±1.80)μmol/(kg·min),分别比CK和CC组样品低31.80%和24.80%。CK和CC组GOT活力高峰出现于第6天,果肉样GOT活力峰值分别为(30.01±1.89)μmol/(kg·min)和(27.61±1.88)μmol/(kg·min),BTH处理组果肉GOT活力峰值比CK和CC组低19.10%和12.06%。CK、CC组和BTH处理组果皮的GOT活力峰值比果肉分别高出25.48%、24.44%和11.64%。
由图4C 1 、C 2 可知,CK和CC组PDC活力高峰出现在第6天,BTH处理组PDC活力高峰被延迟2 d。BTH处理组果皮峰值为(70.08±3.07)μmol/(kg·min),分别比CK和CC组低16.86%和18.21%。CK和CC组果肉PDC活力峰值分别为(103.33±3.06)μmol/(kg·min)和(100.39±2.94)μmol/(kg·min),BTH处理组PDC活力峰值分别比CK和CC组低14.70%和12.21%。CK、CC组和BTH处理组果肉的PDC活力峰值是果皮的1.23、1.17 倍和1.26 倍。
由图4D 1 、D 2 可知,BTH处理组PDH活力第8天最高,果皮峰值为(111.06±10.26)μmol/(kg·min),分别比CK和CC组低24.30%和26.95%,CK组活力高峰出现于第6天,CC组较其提前了2 d。CK和CC组果肉PDH活力高峰均出现于第6天,峰值分别为(188.32±10.99)μmol/(kg·min)和(180.22±11.23)μmol/(kg·min),BTH处理组较其分别低25.56%和22.21%。CK、CC组和BTH处理组果肉PDH活力较果皮样分别高28.34%、18.56%和26.23%。
采后BTH处理可延迟GPT、GOT、PDC和PDH活力高峰出现,并抑制其活力,果皮GOT活力峰值被抑制最明显,活力峰值比CK组样品低31.80%,其次是PDH和PDC;果肉PDH活力峰值被抑制最明显,活力峰值比CK组样品低25.56%,其次是GOT、PDC。GPT和GOT果皮活力高于果肉,PDC和PDH果肉活力高于果皮。水处理可使果皮GPT和PDH活力高峰提前2 d出现,但与CK组相比,其对氨基酸代谢酶GPT、GOT、PDC、PDH活力峰值的影响不显著。
CK组和BTH处理组氨基酸代谢酯类香气物质含量与氨基酸总含量、酶活力相关性见表3,氨基酸总含量和GPT、GOT、PDC、PDH活力均与酯类香气释放量呈正相关。对于CK组,样品氨基酸总含量、GOT活力与酯类香气物质含量呈极显著正相关(P<0.01);PDC活力与酯类香气物质含量呈显著正相关(P<0.05);GPT、PDH活力与酯类香气物质含量相关性不显著;氨基酸总含量与GPT、GOT和PDC活力呈极显著正相关(P<0.01),与PDH呈显著正相关(P<0.05)。BTH处理对氨基酸总含量、GOT活力与酯类香气物质含量的相关性无影响,但会提高PDH活力与酯类香气物质含量相关性(P<0.05),而PDC活力与酯类香气物质含量的相关性则被减弱;氨基酸总含量与GPT和PDC活力的相关性同样被减弱。可见BTH可通过影响酯类香气物质氨基酸代谢中各指标间的相关性改变氨基酸代谢酯类香气物质的释放。
表3 甜瓜果实(果皮+果肉)氨基酸总含量、相关酶活力与酯类香气物质含量的相关性分析
Table 3 Correlation analysis of amino acid content, related enzyme activities and aroma ester content in melon fruit (peel + pulp)

注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
香气物质2-甲基丁基酯类代谢前体异亮氨酸 [25] 含量在贮藏期间呈单峰型变化。采后BTH处理可抑制异亮氨酸在贮藏期间含量的变化,贮藏期间产物乙酸2-甲基丁酯含量变化及BTH对其的影响与异亮氨酸趋势一致(图5)。草莓的离体实验显示,加入异亮氨酸可促使2-甲基丁基酯含量增加2 倍 [26] ;对氘化的L-异亮氨酸追踪分析可知L-异亮氨酸在苹果中可转化为相应的2-甲基丁基挥发性衍生物 [27-28] ;异亮氨酸对乙酸2-甲基丁酯的生物合成起重要作用 [29] 。同时,贮藏期间硫酯类香气物质含量的变化及BTH对其的影响与半胱氨酸变化趋势一致(图6)。

图5 BTH处理对异亮氨酸(A)及乙酸2-甲基丁酯(B)含量的影响
Fig. 5 Effect of BTH treatment on the contents of isoleucine (A) and 2-methyl butyl acetate (B)
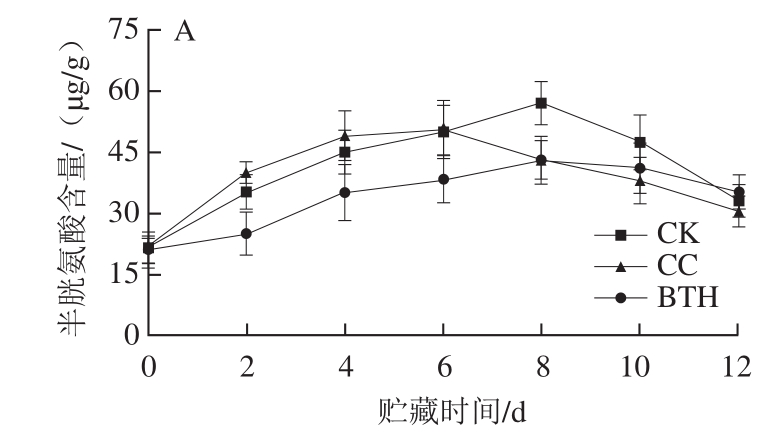

图6 BTH处理对半胱氨酸(A)及硫酯类(B)含量的影响
Fig. 6 Effect of BTH treatment on the contents of cysteine (A) and thioesters (B)
果实成熟过程中,游离氨基酸的变化与其生理代谢联系紧密 [18] 。本实验在‘玉金香’甜瓜中检测到的15 种游离氨基酸贮藏期间变化趋势与其代谢酯类香气物质总体相同。唐贵敏 [31] 研究发现‘山农金黄一号’甜瓜香气的形成随氨基酸含量的增加而降低,‘Sweet Delight’甜瓜香气物质含量形成随着氨基酸含量的增加而升高。可见作为甜瓜香气代谢前体物质之一的氨基酸对香气物质代谢的影响因品种而异。本实验所用‘玉金香’甜瓜氨基酸总量与酯类香气物质含量呈极显著正相关(P<0.01)。BTH处理对实验果实氨基酸总量及各类酯类香气的释放均有抑制作用,说明BTH可通过抑制氨基酸含量的降低从而抑制其代谢产物酯类香气物质的释放。贮藏期间,产物乙酸2-甲基丁酯含量变化与代谢前体异亮氨酸变化趋势一致,产物含硫酯类香气物质含量的变化与代谢前体半胱氨酸变化趋势一致,进一步说明了采后BTH处理可通过影响代谢前体氨基酸的含量改变‘玉金香’甜瓜酯类香气物质的释放。
氨基酸通过转氨酶作用形成支链酮酸,进而经过PDC或PDH形成支链醛和酰基-CoA。样品采后BTH处理对GPT、GOT、PDC和PDH活力均有一定的抑制作用,其影响度依次为:GOT>PDH>PDC>GPT。GOT活力与酯类香气物质含量呈极显著正相关(P<0.01),贮藏期间酯类香气物质含量变化与GOT活力变化趋势相同,可见GOT活力对氨基酸酯类香气代谢影响最大,是氨基酸代谢途径的关键环节之一。程焕等 [16] 的研究结果也表明转氨酶是氨基酸代谢的关键酶。
‘玉金香’甜瓜果皮和果肉中共检测到15 种游离氨基酸和10 种氨基酸代谢酯类香气物质,采后BTH处理可降低样品氨基酸含量,抑制氨基酸代谢酯类香气物质释放,推迟其释放高峰;抑制GPT、GOT、PDC和PDH活力,按酶活力峰值高低,被抑制程度排序为:GOT>PDH>PDC>GPT;氨基酸总含量、GOT活力与酯类香气物质含量呈极显著正相关(P<0.01),BTH处理会提高PDH活力与酯类香气物质含量相关性,减弱PDC活力与酯类香气物质含量的相关性以及氨基酸总含量与GPT、PDC活力的相关性。可见采后BTH处理可通过降低‘玉金香’果实氨基酸总含量,抑制相关酶GOT、PDC和PDH的活力,改变酯类香气物质氨基酸代谢各因子间的相关性,从而影响以氨基酸为前体的酯类香气物质代谢,水处理对氨基酸含量、相关代谢酶活力及其产物酯类香气物质释放均有影响,但其作用规律和机理还有待进一步研究。
参考文献:
[1] BI Y, LI Y C, GE Y H. Induced resistance in postharvest fruits and vegetables by chemicals and its mechanism[J]. Stewart Postharvest Review, 2007, 3(6): 1-7.
[2] GUO Y R, LIU L, ZHAO J, et al. Use of silicon oxide and sodium silicate for controlling Trichothecium roseum postharvest rot in Chinese cantaloupe (Cucumis melo L.)[J]. International Journal of Food Science and Technology, 2007, 42(8): 1012-1018. DOI:10.1111/j.1365-2621.2006.01464.x.
[3] GE Y H, BI Y, LI X, et al. Induces resistance against Fusarium and pink rots by acibenzolar-S-methyl in harvested muskmelon (cv. Yindi)[J].Agricultural Sciences in China, 2008, 7(1): 58-64.
[4] 任亚琳, 毕阳, 葛永红, 等. BTH浸泡处理对厚皮甜瓜采后病害的控制及贮藏品质的影响[J]. 食品科学, 2013, 34(2): 267-272.
[5] KULKARNI R S, CHIDLEY H G, PUJARI K H, et al.Geographic variation in the flavour volatiles of Alphonso mango[J]. Food Chemistry, 2012, 130(1): 58-66. DOI:10.1016/j.foodchem.2011.06.053.
[6] SCHWAB W, DAVIDOVICH-RIKANATI R, LEWINSOHN E.Biosynthesis of plant-derived flavor compounds[J]. Plant Journal for Cell & Molecular Biology, 2008, 54(4): 712-732.
[7] 邬子燕, 韩育梅. 甜瓜风味物质的研究进展[J]. 保鲜与加工, 2010,10(6): 51-53. DOI:10.3969/j.issn.1009-6221.2010.06.014.
[8] PANG X L, GUO X, QIN Z, et al. Identification of aroma-active compounds in Jiashi muskmelon juice by GC-O-MS and OAV calculation[J]. Journal of Agricultural and Food Chemistry, 2012,60(17): 4179-4185. DOI:10.1021/jf300149m..
[9] 陈小央, 胡晋. 甜瓜芳香物质研究进展[J]. 中国蔬菜, 2010(2): 7-14.DOI:10.3969/j.issn.1673-2871.2008.01.010.
[10] ARAGÜEZ I, FERNÁNDEZ V V. Metabolic engineering of aroma components in fruits[J]. Biotechnology Journal, 2013, 8(10): 1144-1158. DOI:10.1002/biot.201300113.
[11] EL HADI M A, ZHANG F J, WU F F, et al. Advances in fruit aroma volatile research[J]. Molecules, 2013, 18(7): 8200-8229. DOI:10.3390/molecules18078200.
[12] 张娜. 采后BTH处理对“玉金香”甜瓜特征香气及LOX酶活性的影响[D]. 兰州: 甘肃农业大学, 2014: 35.
[13] 乜兰春, 孙建设, 黄瑞虹. 果实香气形成及其影响因素[J]. 植物学通报, 2004, 21(5): 631-637. DOI:10.3969/j.issn.1674-3466.2004.05.015.
[14] 关小川. 嫁接对薄皮甜瓜果实酯类形成过程氨基酸途径的影响[D].沈阳: 沈阳农业大学, 2010: 8-9.
[15] 秦改花. 梨果实挥发性芳香物质组成及其形成特性分析[D]. 南京:南京农业大学, 2012: 5.
[16] 程焕, 陈健乐, 周晓舟, 等. 水果香气物质分析及合成途径研究进展[J]. 中国食品学报, 2016, 16(1): 211-218. DOI:10.16429/j.1009-7848.2016.01.029.
[17] 李轩. “银帝”甜瓜挥发性物质的分析及BTH或Harpin对其释放的影响[D]. 兰州: 甘肃农业大学, 2005: 16.
[18] 王颉, 徐继忠, 陈海江, 等. 鸭梨果实挥发性物质和氨基酸含量测定[J]. 食品科技, 2002, 27(9): 71-73. DOI:10.3969/j.issn.1005-9989.2002.09.029.
[19] 蒋玉梅, 李轩, 毕阳, 等. 采前苯丙噻重氮处理抑制厚皮甜瓜采后挥发性物质的释放[J]. 农业工程学报, 2007, 23(3): 243-247.DOI:10.3321/j.issn:1002-6819.2007.03.048.
[20] 王美英. 不同LED光质对山豆根幼苗生长及药用活性成分含量的影响[D]. 南宁: 广西大学, 2013: 16-17.
[21] 李岩. 乙烯在薄皮甜瓜果实香气物质合成中的作用与调控[D].沈阳: 沈阳农业大学, 2012: 75-77.
[22] 张东晓. 日本关于厚皮甜瓜若干品种香气成分的研究[J]. 中国西瓜甜瓜, 2002(2): 45-46. DOI:10.3969/j.issn.1673-2871.2002.02.022.
[23] SAFTNER R, ABBOTT J A, LESTER G, et al. Sensory and analytical comparison of orange-fleshed honeydew to cantaloupe and green-fleshed honeydew for fresh-cut chunks[J]. Postharvest Biology and Technology, 2006, 42(2): 150-160. DOI:10.1016/j.postharvbio.2006.02.011.
[24] HAYATA Y, SAKAMOTO T, MANEERAT C, et al. Evaluation of aroma compounds contributing to muskmelon flavor in Porapak Q extracts by aroma extract dilution analysis[J]. Journal of Agricultural and Food Chemistry, 2003, 51(11): 3415-3418. DOI:10.1021/jf0209950.
[25] 李秋棉, 罗均, 李雪萍, 等. 果实香气物质的合成与代谢研究进展[J].广东农业科学, 2012, 39(19): 104-107. DOI:10.3969/j.issn.1004-874X.2012.19.035.
[26] PÉREZ A G, OLÍAS R, LUACES P, et al. Biosynthesis of strawberry aroma compounds through amino acid metabolism[J]. Journal of Agricultural and Food Chemistry, 2002, 50(14): 4037-4042.DOI:10.1021/jf011465r.
[27] ROWAN D D, LANE H P, ALLEN J M, et al. Biosynthesis of 2-methylbutyl, 2-methyl-2-butenyl, and 2-methylbutanoate esters in red delicious and Granny Smith apples using deuterium-labeled substrates[J]. Journal of Agricultural and Food Chemistry, 1996,44(10): 3276-3285. DOI:10.1021/jf9508209.
[28] MATICH A, ROWAN D. Pathway analysis of branched-chain ester biosynthesis in apple using deuterium labeling and enantioselective gas chromatography-mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2007, 55(7): 2727-2735. DOI:10.1021/jf063018n.
[29] 齐红岩, 关小川, 李岩, 等. 嫁接对薄皮甜瓜果皮和果肉中主要酯类、游离氨基酸及酯类合成相关酶活性的影响[J]. 中国农业科学,2010, 43(9): 1895-1903. DOI:10.3864/j.issn.0578-1752.2010.09.016.
[30] WANG Y M, WYLLIE S G, LEACH D N. Chemical changes during the development and ripening of the fruit of Cucumis melo (cv.Makdimon)[J]. Journal of Agricultural and Food Chemistry, 1996,44(1): 210-216. DOI:10.1021/jf9503568.
[31] 唐贵敏. 厚皮甜瓜果实挥发性物质含量及代谢途径研究[D]. 泰安:山东农业大学, 2008: 27-28.
Effect of Postharvest Benzothiadiazole Treatment on Aroma Esters Derived from Amino Acid Metabolism and Metabolic Mechanism in ‘Yujinxiang’ Melon
WANG Bo 1 , LI Jixin 1 , LI Jingwei 2 , WANG Yu 1 , HU Yanyun 1 , JIANG Yumei 1, *
(1. Gansu Key Laboratory of Viticulture and Enology, Gansu Research and Development Center of Wine Industry,College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China;2. Comprehensive Technical Center of Gansu Entry Exit Inspection and Quarantine Bureau, Lanzhou 730070, China)
Abstract: Muskmelon (Cucumis melo L. cv. Yujinxiang ) was analyzed for changes in the contents of amino acids and aroma esters derived from amino acid metabolism and the activities of glutamate pyruvic transaminase (GPT), glutamic oxaloacetic transaminase (GOT), pyruvate decarboxylase (PDC) and pyruvate dehydrogenase (PDH) during postharvest storage at room temperature. This study examined the influence of postharvest benzothiadiazole (BTH) treatment on the amino acid mechanic pathways for the production of aroma esters, and it also elucidated the underlying mechanism. The results showed that the peak time of aroma esters was delayed and the release amount was inhibited by 19.10% by BTH treatment as compared to the untreated control. A total of 15 free amino acids were separated and identified; total free amino acid content in the control group reached its peak (14 597 μg/g) on the 6 th day of storage, whereas the peak for the BTH treatment group appeared on the 8 th day, 9.47% lower than that of the control (P < 0.05). BTH treatment inhibited the activities of GOT, PDC and PDH during storage and reduced these enzyme activities by 31.80%, 16.86% and 24.30% for peel and by 19.10%, 14.70% and 25.56% for pulp, respectively and it significantly inhibited GOT activity in peel (P < 0.05).On the other hand, no significant difference in GPT activity existed between the groups (P > 0.05). Total amino acid content and GOT activity were highly significantly positively correlated with the content of aroma esters (P < 0.01). Water treatment affected amino acid contents, metabolic enzyme activities and the release of aroma esters as metabolites, but this effect was irregular. Therefore, BTH treatment can reduce amino acid contents, and inhibit the activities of related metabolic enzymes,thereby affecting the release of aroma esters.
Keywords: benzothiadiazole; aroma ester; amino acids; transaminase; pyruvate decarboxylase; pyruvate dehydrogenase
WANG Bo, LI Jixin, LI Jingwei, et al. Effect of postharvest benzothiadiazole treatment on aroma esters derived from amino acid metabolism and metabolic mechanism in ‘Yujinxiang’ melon[J]. Food Science, 2018, 39(17): 212-220. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201817035. http://www.spkx.net.cn
文章编号: 1002-6630(2018)17-0212-09
引文格式: 王博, 李霁昕, 李经纬, 等. 采后苯并噻重氮处理对‘玉金香’甜瓜氨基酸代谢酯类香气物质及其代谢机理的影响[J]. 食品科学, 2018, 39(17): 212-220. DOI:10.7506/spkx1002-6630-201817035. http://www.spkx.net.cn
中图分类号: S652.9;TS255.3
文献标志码: A
*通信作者简介: 蒋玉梅(1973—),女,副教授,博士,研究方向为果蔬加工和食品挥发性风味物质分析。E-mail:jym316@126.com
DOI: 10.7506/spkx1002-6630-201817035
基金项目: 国家自然科学基金地区科学基金项目(31160344)
第一作者简介: 王博(1993—),男,硕士研究生,研究方向为果蔬贮藏保鲜及风味物质分析。E-mail:291512586@qq.com
(1.甘肃农业大学食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃省葡萄酒产业技术研发中心,甘肃 兰州 730070;2.甘肃出入境检验检疫局检验检疫综合技术中心,甘肃 兰州 730070)
收稿日期: 2017-03-15
摘 要: 以‘玉金香’甜瓜为材料,采后常温贮藏期间分析其氨基酸含量、谷丙转氨酶(glutamate pyruvic transaminase,GPT)、谷草转氨酶(glutamic oxaloacetic transaminase,GOT)、丙酮酸脱羧酶(pyruvate decarboxylase,PDC)、丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)活力及其代谢产物酯类香气物质含量的变化,探讨采后苯并噻重氮(benzothiadiazole,BTH)诱抗处理对酯类香气物质氨基酸代谢途径影响的机理。结果表明:BTH诱抗处理可延迟样品酯类香气物质释放高峰出现,抑制其释放,总含量比CK组(未经任何处理)低19.10%。15 种游离氨基酸被分离确定,CK组氨基酸总含量峰值(14 597 μg/g)出现在第6天,BTH组峰值出现在第8天,低于CK组9.47%(P<0.05)。BTH处理抑制了贮藏期间GOT、PDC和PDH活力,与CK组相比,BTH处理组果皮GOT、PDC和PDH活力峰值分别降低31.80%、16.86%和24.30%,果肉峰值分别降低19.10%、14.70%和25.56%,果皮GOT活力被显著抑制(P<0.05);不同处理组间GPT活力差异不显著(P>0.05)。氨基酸总含量、GOT活力与酯类香气物质含量呈极显著正相关(P<0.01)。水处理对氨基酸含量、代谢酶活力及其产物酯类香气物质释放均有影响,但无明显作用规律。由此可见,BTH处理会减少氨基酸含量,抑制相关代谢酶活力,进而改变其产物酯类香气物质的释放。